Cushing症候群とは
Cushing症候群とは慢性的なコルチゾール過剰状態が引き起こす病態の総称である。
Cushing症候群の所見
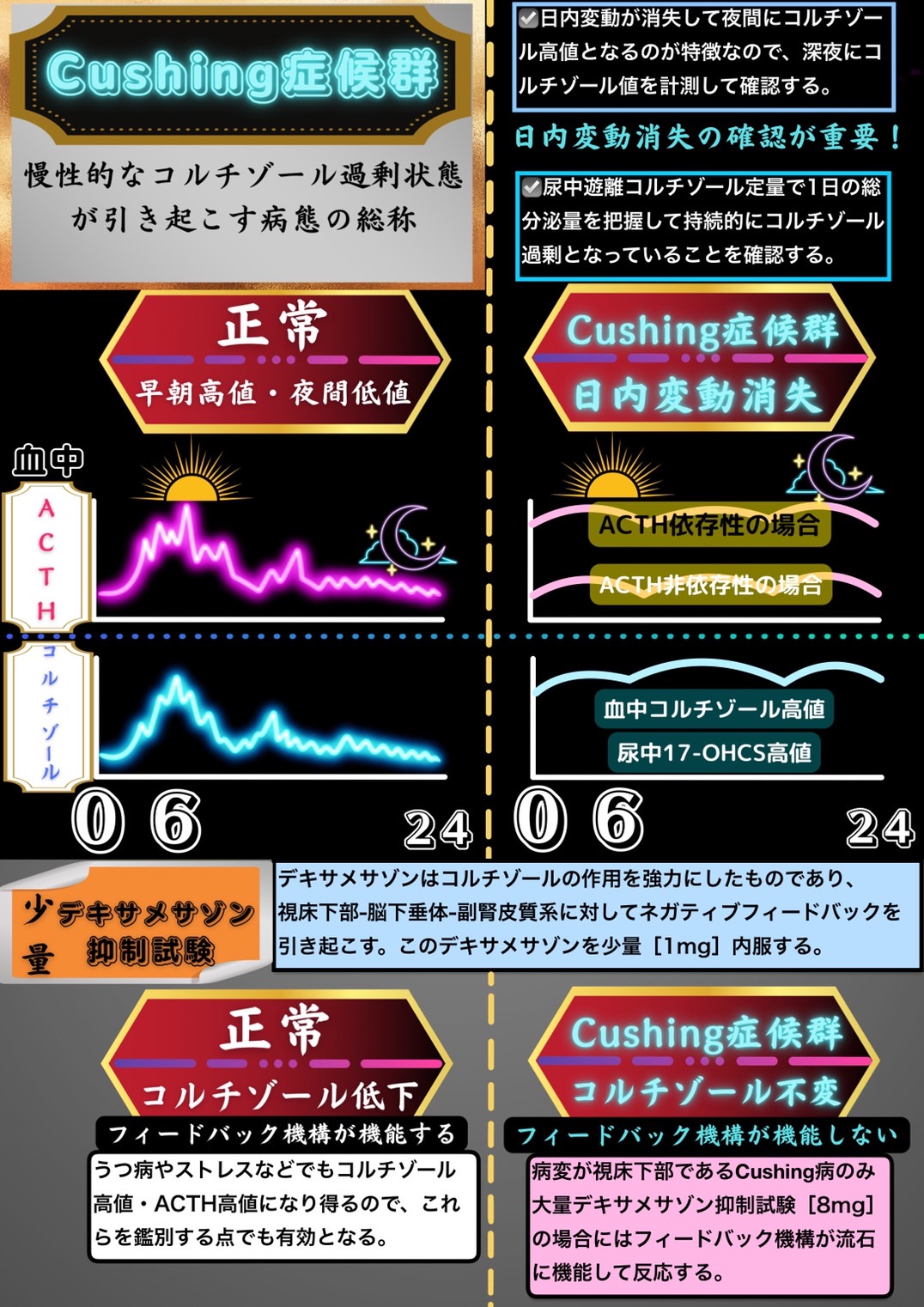
正常の場合、血中ACTH値と血中コルチゾール値は早朝高値・夜間低値という日内変動をとる。
Cushing症候群を診断する際にはこの日内変動の消失を確認することが重要となる。
ある時点で一度だけ採血をして、その時点でコルチゾール高値・ACTH高値だったとしてもCushing症候群だと確定することはできない。
なぜなら、うつ病やストレスなどでもある一時点においてはコルチゾール高値・ACTH高値となり得るからである。しかし、うつ病やストレスでは一過性にコルチゾール高値・ACTH高値となり得るものの、慢性的に分泌されているわけではないため日内変動は消失しない。
そこで、慢性的なコルチゾール過剰状態を引き起こすCushing症候群であることを確定するためにはCushing症候群に特異的な所見である日内変動消失を確認する必要がある。
また、Cushing症候群では慢性的なコルチゾール過剰状態によってHPA系(視床下部-下垂体-副腎系)のフィードバック機構が機能不全を起こすことも重要な所見となる。
日内変動消失を確認するための検査
尿中遊離コルチゾール定量
尿中遊離コルチゾール定量では24時間蓄尿を行って測定するため、コルチゾールの1日の分泌量を評価できる利点がある。
これによって一過性ではなく持続的なコルチゾール過剰状態が生じていることを証明する。
深夜睡眠中コルチゾール値
Cushing症候群では日内変動が消失して夜間にコルチゾール高値となるのが特徴的なので、深夜にコルチゾール値を計測して確認する。
フィードバック機構の機能不全の確認
少量デキサメサゾン抑制試験
Cushing症候群におけるフィードバック機構の機能不全の確認にはデキサメサゾンを用いて少量デキサメサゾン抑制試験を行う。
デキサメサゾンはコルチゾールの作用を強力にしたものであり、コルチゾールのようにHPA系(視床下部-下垂体-副腎系)に対してネガティブフィードバックを引き起こす。
このデキサメサゾンを少量[1mg]内服するものを少量デキサメサゾン抑制試験という。
正常下垂体では正常なフィードバック機構が働いて最終的にコルチゾール値が低下するのに対して、Cushing病(下垂体腺腫)・異所性ACTH産生腫瘍・副腎腺腫・副腎癌といったCushing症候群においてはフィードバック機構は機能不全となっているためコルチゾール値が低下しない。
大量デキサメサゾン抑制試験とは異なる
大量デキサメサゾン抑制試験とはデキサメサゾンを大量[8mg]内服するものである。
大量にデキサメサゾンを投与するとCushing症候群のうち唯一下垂体に病変があるCushing病(下垂体腺腫)の場合にのみ流石に反応してコルチゾール値が低下する。
つまり、大量デキサメサゾン抑制試験とは少量デキサメサゾン抑制試験によってCushing症候群と確定したものをさらにCushing症候群のうちCushing病(下垂体腺腫)かそれ以外(異所性ACTH産生腫瘍・副腎腺腫・副腎癌)かを判別するための試験である。
つまり、「少量デキサメサゾン抑制試験では反応しなかったが大量デキサメサゾン抑制試験では反応した」というCushing症候群はCushing病(下垂体腺腫)だと分かるということである。
Cushing症候群の鑑別
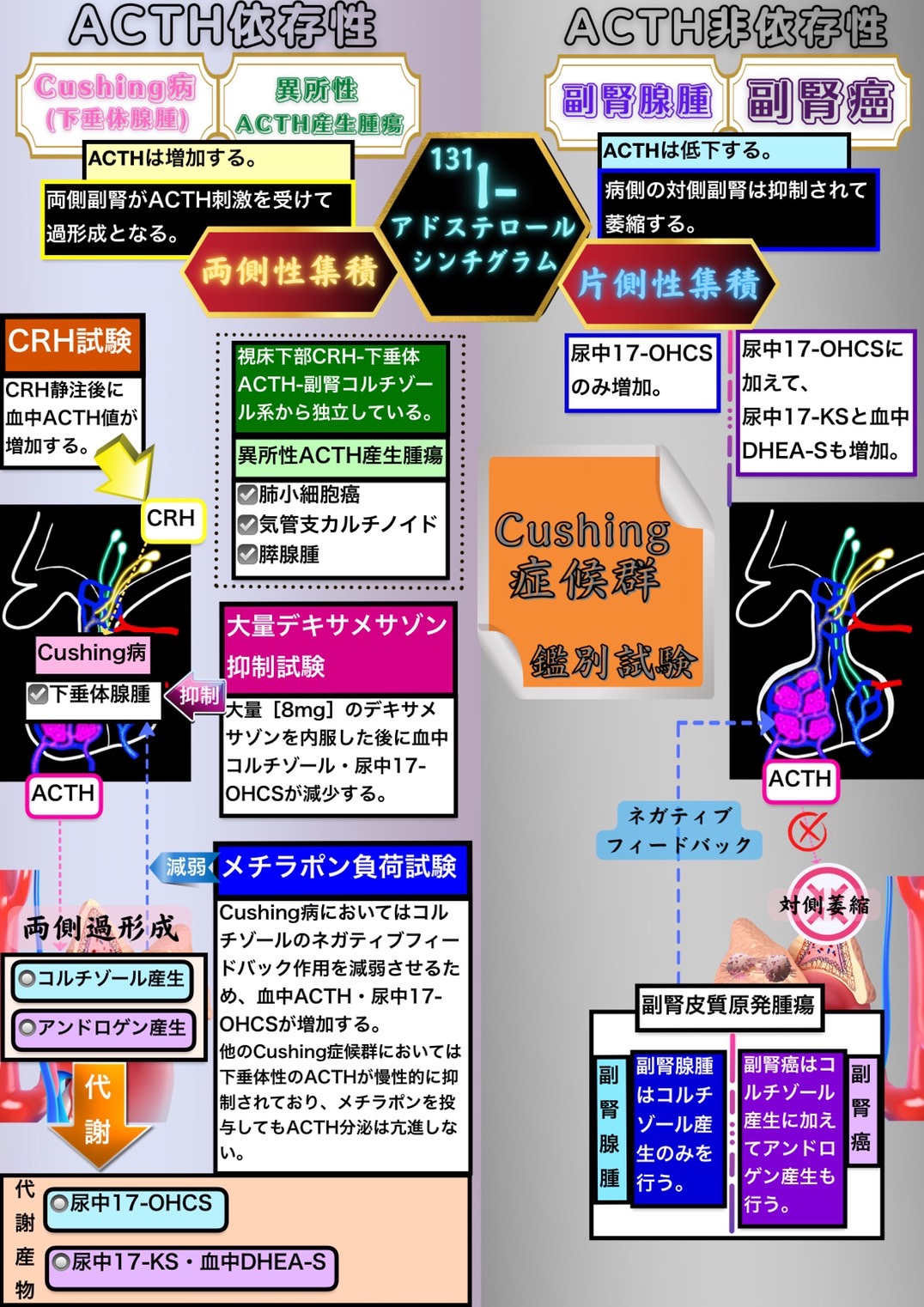
Cushing症候群はCushing病(下垂体腺腫)・異所性ACTH産生腫瘍・副腎腺腫・副腎癌に分類できる。
ACTH依存性とACTH非依存性
まず、Cushing病はACTH依存性とACTH非依存性に分けられる。
ACTH分泌が過剰となった結果として二次的にコルチゾール分泌が増加する場合をACTH依存性Cushing症候群と呼び、副腎から自律的にコルチゾールが過剰産生される場合をACTH非依存性Cushing症候群と呼ぶ。
ACTH依存性Cushing症候群にはCushing病(下垂体腺腫)と異所性ACTH産生腫瘍が属する。
ACTH非依存性Cushing症候群には副腎皮質原発腫瘍である副腎腺腫と副腎癌が属する。
ACTH値で判別する
ACTH依存性の場合はACTHが増加するため、両側副腎がACTH刺激を受けて過形成となる。
ACTH非依存性の場合は過剰なコルチゾールによってフィードバック機構が働いてACTHは低下する。また、病側の対側副腎は抑制されて萎縮する。
131-Iアドステロールシンチグラム
副腎皮質に集積する性質のある131-Iアドステロールを用いてシンチグラムを行う。
ACTH依存性の場合、両側性に集積する。
ACTH非依存性の場合は病側の対側副腎は抑制されて萎縮するため、片側性に集積する。
ACTH依存性Cushing症候群の鑑別
ACTH依存性Cushing症候群はACTHが過剰となる病態であるので、コルチゾール産生とともにアンドロゲン産生も過剰となる。
このため、コルチゾールの代謝産物である尿中17-OHCSが増加するのに加えて、アンドロゲンの代謝産物である尿中17-KSと血中DHEA-Sも増加する。
ACTH依存性Cushing症候群の鑑別のための検査はHPA系を利用して行われるため、基本的には下垂体に病変があってHPA系に深く関与するCushing病(下垂体腺腫)が反応するのを確認するために行われるというイメージを持つことが重要である。
異所性ACTH産生腫瘍とは肺小細胞癌・気管支カルチノイド・膵腺腫などが異所性にACTHを産生する病態であり、視床下部CRH-下垂体ACTH-副腎コルチゾール系から独立していることに注目すると分かりやすい。
CRH試験
Cushing症候群が下垂体性(Cushing病)なのかそれ以外なのかを鑑別できる検査である。
副腎性のCushing症候群の場合はコルチゾールのネガティブフィードバックの働きにより、CRHを投与してもACTHが投与前と比べて変化せず低値のままであり反応しない。一方で、下垂体性(Cushing病)の場合はCRHを投与するとACTHの値が投与前に比べて上昇する。
また、異所性ACTH症候群の場合には、CRH試験前のACTHは高値であり、CRH試験後のACTHはその高値のまま変化しない。コルチゾールのネガティブフィードバックが下垂体にかかっているのでCRHを投与しても下垂体からさらにACTHが分泌されるということはないのである。
つまり、CRH試験とは下垂体に病変があるCushing病(下垂体腺腫)の場合にのみ反応して、それ以外のCushing症候群では反応しない検査だといえる。
大量デキサメサゾン抑制試験
Cushing病(下垂体腺腫)の場合にのみ、大量[8mg]のデキサメサゾンを内服するとフィードバック機構が流石に働いて血中コルチゾール・尿中17-OHCSが減少する。
それ以外のCushing症候群においてはフィードバック機構が作動することがないため反応しない。
メチラポン負荷試験
メチラポンとはHPA系においてコルチゾールのネガティブフィードバック作用を減弱する役割を果たす物質である。
Cushing病(下垂体腺腫)の場合にのみ、コルチゾールのネガティブフィードバック作用を減弱させるため投与後に血中ACTH・尿中17-OHCSが増加する。
他のCushing症候群においては下垂体性のACTH分泌が慢性的に抑制されており、メチラポンを投与してもACTH分泌は亢進しない。
ACTH非依存性Cushing症候群の鑑別
ACTH非依存性Cushing症候群は副腎皮質原発腫瘍である副腎腺腫と副腎癌が属するのだが、副腎腺腫はコルチゾール産生のみを行うのに対して、副腎癌はコルチゾール産生に加えてアンドロゲン産生も行うという違いがある。
つまり、ACTH非依存性Cushing症候群の鑑別にはアンドロゲン産生とアンドロゲンの代謝産物である尿中17-KSと血中DHEA-Sに注目することが重要となる。
Cushing症候群の症状
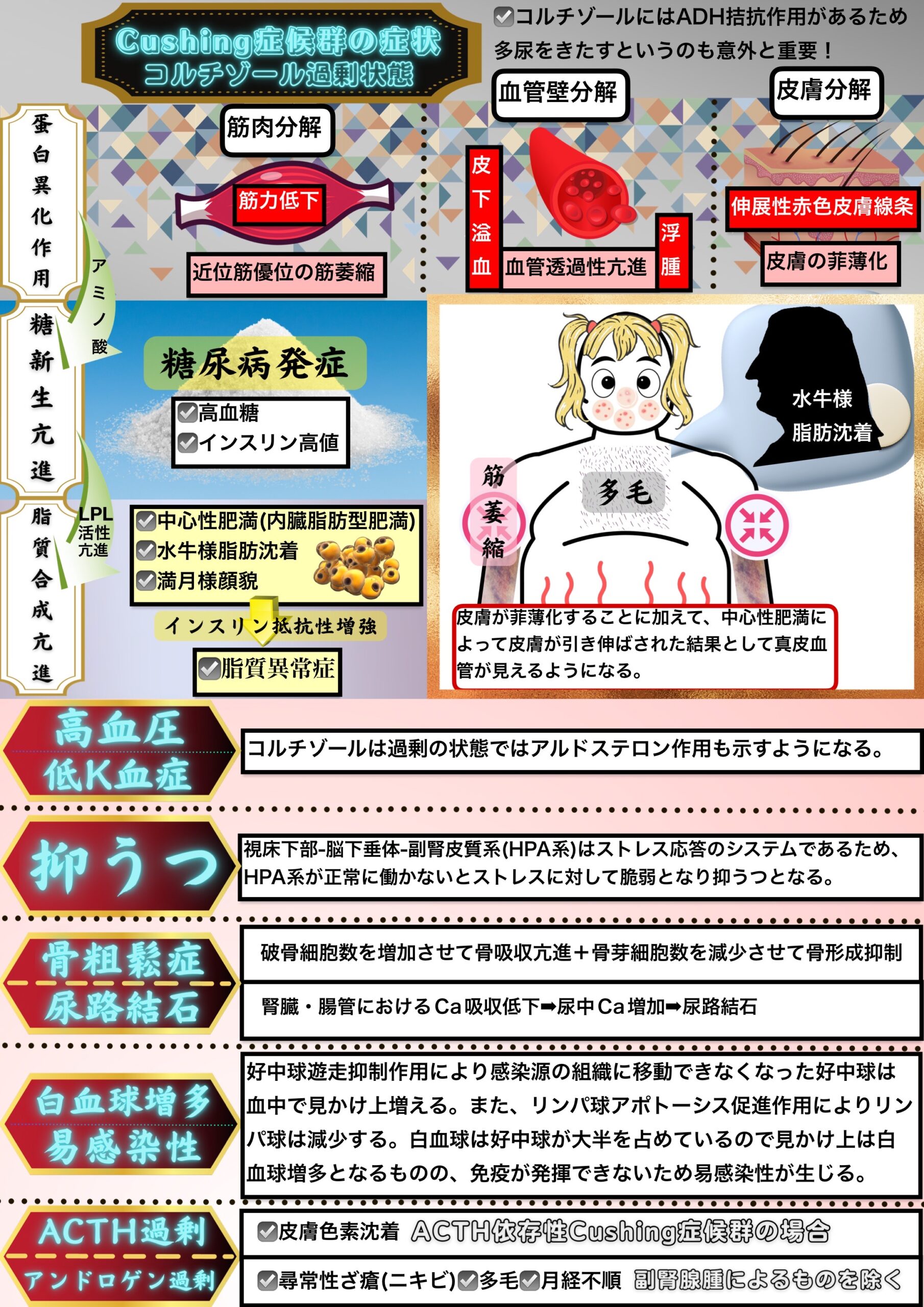
Cushing症候群の症状はコルチゾール過剰が引き起こすものであり、これは副腎皮質ステロイドの副作用にも当てはまる。
蛋白異化作用によるもの
筋力低下
筋肉が分解されてしまうことで近位筋優位の筋委縮を呈して筋力が低下する。
皮下溢血・浮腫
血管壁が分解されてしまうことで血管透過性が亢進して皮下溢血・浮腫が引き起こされる。
伸展性赤色皮膚線条
皮膚が分解されて皮膚が菲薄化することに加えて、中心性肥満によって皮膚が引き伸ばされた結果として真皮血管がみえるようになったものを指す。
糖新生作用によるもの
コルチゾールの糖新生作用が過剰となってしまい耐糖能が低下して高血糖となりインスリン高値を呈する。
脂質合成作用によるもの
脂質合成が亢進して体幹に脂肪が沈着する中心性肥満や野牛肩(buffalo hump)と呼ばれる背中上部の過剰な脂肪沈着や丸く膨らんだ顔になる満月様顔貌(ムーンフェイス)が引き起こされる。
また、内臓脂肪が増加することでインスリン抵抗性が増強して脂質異常症や糖尿病を発症する。
高血圧・低K血症
過剰なコルチゾールはアルドステロン様作用を示して高血圧・低カリウム血症を引き起こす。
本来鉱質コルチコイド受容体は鉱質コルチコイドとコルチゾールに同等の親和性を持つのだが、通常腎臓ではコルチゾールは11β-HSDによって鉱質コルチコイド受容体に結合できないコルチゾンに変換されるのでコルチゾールがアルドステロン様作用を示すことはない。
しかし、コルチゾール過剰の場合はコルチゾンに変換しきれなくなるのでコルチゾールが鉱質コルチコイド受容体に結合するようになってアルドステロン様作用を示すこととなる。
抑うつ
視床下部-脳下垂体-副腎皮質系(HPA系)はストレス応答のシステムであるため、HPA系が正常に働かないとストレスに対して脆弱となり抑うつとなる。
抑うつ以外にも不眠や多幸感といった精神症状が生じることもある。
骨粗鬆症・尿路結石
コルチゾール過剰状態では破骨細胞数が増加して骨吸収が亢進するのに加えて、骨芽細胞数が減少して骨形成が抑制されるため骨粗鬆症が引き起こされる。
また、腎臓・腸管におけるCa再吸収を低下させる役割もあるため尿中Caが増加して尿路結石が引き起こされる。
白血球増多・易感染性
コルチゾールの好中球遊走抑制作用により感染源の組織に移動できなくなった好中球は血中で見かけ上増える。
また、リンパ球アポトーシス促進作用によりリンパ球は減少する。
白血球は好中球が大半を占めているので見かけ上は白血球増多となるものの、免疫が発揮できないため易感染性が生じる。
ACTH過剰(ACTH依存性Cushing症候群の場合)
ACTH過剰によって皮膚色素沈着が起こる。
アンドロゲン過剰(副腎腺腫によるものを除く)
アンドロゲン過剰状態は尋常性ざ瘡(にきび)や多毛や月経不順を引き起こす。
参考文献
2.Cushing症候群:https://www.jstage.jst.go.jp/article/naika/103/4/103_832/_pdf
3.コルチゾールと脂質代謝:https://www.ryudai2nai.com/doc/Lipid201201_01.pdf
Cushing症候群・副腎性subclinical Cushing症候群の診断と治療:https://www.jstage.jst.go.jp/article/naika/107/4/107_674/_pdf
クッシング病の診断の手引き:https://square.umin.ac.jp/kasuitai/doctor/guidance/cushing.pdf
一般診断医のための核医学ー内分泌ー:https://dl.ndl.go.jp/view/download/digidepo_8286347_po_JJRS-60-12-691-698.pdf?contentNo=1&alternativeNo=
6.副腎偶発腫瘍の鑑別診断と治療:https://www.jstage.jst.go.jp/article/naika/103/3/103_650/_pdf/-char/ja
内分泌疾患に続発する肥満症:https://www.jstage.jst.go.jp/article/naika/104/4/104_690/_pdf
ステロイド治療における白血球数の動態:https://www.kyorin-pharm.co.jp/prodinfo/useful/doctorsalon/upload_docs/200864-1-28.pdf



コメント
Dear customer,
My name is Alessandro and I am responsible for X Best World Ou and I would like to introduce you to Marketsy, an e-commerce platform based on artificial intelligence that revolutionizes online sales. As promoters of effective business software, we believe that Marketsy can significantly contribute to the success of your company. Ideal for companies that have multiple brands to market and diversify in their promotions.
The big advantage is purchasing lifetime software.
Explore Marketsy here: http://www.bestqtf.org/applandingmarket89803
For any questions or clarifications,
our team is here to help you.
Best regards,
Alessandro Molari
Opt out of future messages by replying to this email, indicating your desire to unsubscribe and including your website domain.
I really enjoy studying on this web site, it holds fantastic content.
I like this website it’s a master piece! Glad I discovered this ohttps://69v.topn google.Raise blog range
You could definitely see your enthusiasm in the work you write. The world hopes for more passionate writers like you who are not afraid to mention how they believe. All the time go after your heart.