肝細胞癌の病態と検査
肝細胞癌の定義
肝臓を構成している細胞が癌化して発生したものを「原発性肝癌」という。
「原発性肝癌」は肝細胞が癌化した肝細胞癌と肝内胆管細胞が癌化した肝内胆管癌に分けられる。
「原発性肝癌」のうち肝細胞癌が約94%を占めて、残りを肝内胆管癌が占める。
肝細胞癌の成因
長期にわたって肝細胞の破壊と再生を繰り返すことが肝細胞癌の成因だと考えられており、わが国では肝細胞癌の患者の約80%が肝硬変または慢性肝炎を合併している。
また、肝細胞癌患者のうち約80%がB型肝炎ウイルスまたはC型肝炎ウイルス陽性の感染者となっている。最大の原因はC型肝炎ウイルスである。
しかし、近年C型肝炎に対する抗ウイルス治療薬としてインターフェロン・リバビリン(核酸アナログ製剤)に加えて直接作用型抗ウイルス薬(DAA)が登場したことも影響して、2015年以降はC型肝炎ウイルスによる新規発生肝細胞癌は50%以下に減少して非B非C型(非ウイルス型)の肝細胞癌が30~40%まで増加していることから傾向が変わってきていることにも注意する必要がある。
加えて、アスペルギルス属のカビが産生するカビ毒であるアフラトキシンは肝毒性を持ち、肝細胞癌の誘発因子となることは知っておくべきである。
肝細胞癌のサーベイランス
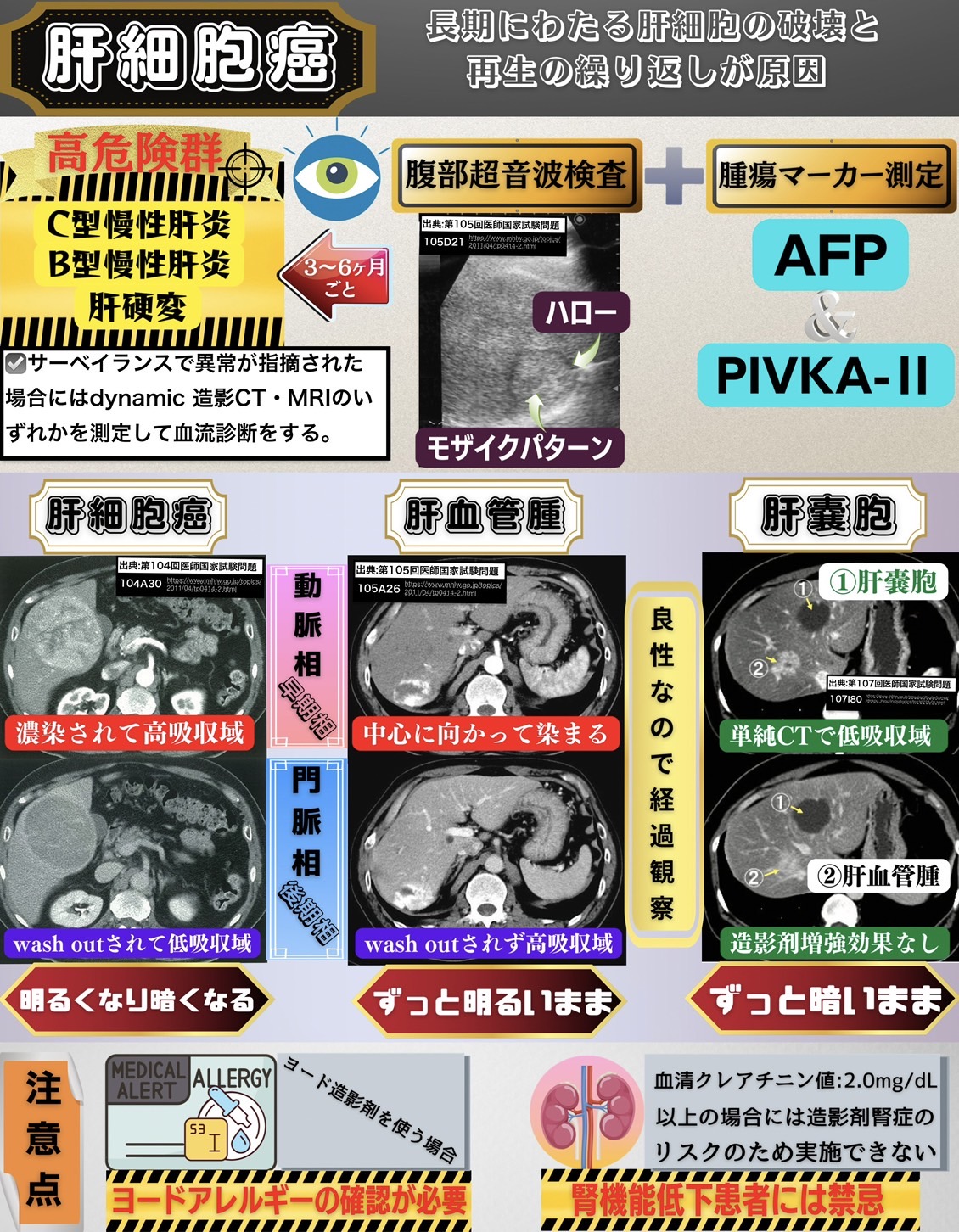
B型慢性肝炎・C型慢性肝炎・肝硬変のいずれかが存在する肝細胞癌の高危険群に対してはサーベイランス(定期的なスクリーニング検査)を行う。
サーベイランスは3~6ヶ月の間隔で腹部超音波検査と腫瘍マーカー測定を行う。
肝細胞癌の腫瘍マーカーとしてはAFP・PIVKA-Ⅱ・AFP-L3分画の3種が保険収載となっている。
(従来は肝シンチグラムが用いられていたこともあったが、肝シンチグラムによる肝細胞癌検出率は超音波検査に比べて明らかに低いため、現在では肝細胞癌の画像診断において推奨されていない。)
サーベイランスで異常が指摘された場合にはdynamic CT・細胞外液性 Gd 造影dynamic MRI・Gd-EOB-DTPA 造影 MRIのいずれかを測定して鑑別診断をする。
腹部超音波検査における肝細胞癌の所見
モザイクパターン
腫瘍結節内部に分化度の異なる細胞が混在している場合にモザイク状のエコー像(モザイクパターン)を認める。これはnodule in nodule appearanceとも呼ばれる。
ハロー
外周に線維性被膜を有している肝細胞癌の場合には腫瘍周囲の被膜部が低エコー帯を呈してハローと呼ばれる。
PIVKA-Ⅱ
血液凝固因子:Ⅱ,Ⅸ,Ⅶ,ⅩはビタミンK依存性に肝臓で合成される。
これらの因子はビタミンKが欠乏すると凝固因子活性をもたない蛋白、PIVKA(Protein Induced by Vitamin K absence or antagonist)として存在するようになる。
PIVKAはそれぞれの凝固因子に対応してPIVKA-Ⅱ,Ⅸ,Ⅶ,Ⅹと呼ばれる。
このうちPIVKA-Ⅱは昔は主にビタミンKの腸管における合成や腸管での吸収障害の指標として使われていた。
つまり、腸内細菌によって合成されて胆汁酸に伴って吸収される脂溶性のビタミンKが抗生剤などの投与による正常腸内細菌の抑制や胆汁分泌不全によって吸収されないことで、PIVKA-Ⅱの値が上昇することをビタミンK欠乏の指標として検査に利用していたということである。
現在ではPIVKA-Ⅱが肝細胞癌で高率に出現することが見出されたため、肝細胞癌における代表的な腫瘍マーカーであるα-フェトプロテイン(AFP)に並ぶ腫瘍マーカーとして位置付けられている。
肝細胞癌の血流診断(確定診断)
動脈相(早期相)において濃染されて高吸収域となり、門脈・平衡相(後期相)では周囲肝実質と比較して相対的に低吸収域=低信号域(wash out)として描出された場合に典型的肝細胞癌であると判断して治療方針決定に進む。
肝血管腫
動脈相(早期相)で濃染して高吸収域となったにも関わらず、門脈相・平衡相(後期相)でwash outを認めない場合には肝血管腫などが鑑別に挙がる。
このような場合、医師国家試験問題においては肝血管腫が答えになると思われる。肝血管腫は良性腫瘍であるので経過観察でよい。
肝細胞癌と肝血管腫の鑑別
通常の肝組織は門脈血:約70%と動脈血:約30%によって栄養されているのだが、肝細胞癌はほぼ100%動脈血のみから栄養されている。
このため、肝細胞癌には血流が豊富になり造影剤がすぐに入っていきすぐに出ていく。
これを反映した結果、肝細胞癌は動脈相(早期相)において「多血化」による濃染を認め、門脈・平衡相において低吸収域=低信号域(wash out)として描出される。
動脈に造影剤が多く流れるタイミングである動脈相ではよく染まるが、門脈に造影剤が多く流れるタイミングである門脈相では周辺の正常な肝組織よりも染まらないということである。
動脈相(早期相)において「多血化」による濃染を認めて肝細胞癌との鑑別が必要となる疾患として肝血管腫が挙げられる。
肝血管腫も肝細胞癌のようにすぐに造影剤が入るのだが、血管腫内の血流速度が極めて遅いため造影剤がしばらく出ていかない。
このため、肝血管腫は動脈相で濃染するものの門脈・平衡相において低吸収域=低信号域とならずにwash outを認めないことで肝細胞癌と区別して鑑別することができる。
肝嚢胞
肝嚢胞は単純CTで低吸収域としてみえる。また、造影CT・MRIで造影剤増強効果を認めず低吸収域のままとなる。
肝嚢胞は液体成分を内部に含む袋状の構造物が存在するという良性疾患であり、経過観察でよい。
造影CT・MRIにおける注意点
腎機能低下患者(血清クレアチニン値:2.0mg/dL以上)にヨード造影剤やGd造影剤を投与すると造影剤腎症が引き起こされる危険性がある。
また、近年Gd造影剤(ガドリニウム造影剤)特有の副作用として腎性全身性線維症(Nephrogenic Systemic Fibrosis:NSF)が注目されており、平成30年度版医師国家試験出題基準において造影磁気共鳴画像検査<造影MRI>の造影剤と副作用の備考として追記された。
造影剤を投与する前にヨードアレルギーや喘息の既往などアレルギーに関して質問することも重要である。
肝細胞癌の治療アルゴリズム

肝細胞癌の治療アルゴリズムは肝予備能・肝外転移・脈管侵襲・腫瘍数・腫瘍径の5因子に基づいて決められる。肝予備能評価はChild-Pugh分類によって行い、肝外転移・脈管侵襲・腫瘍数・腫瘍径は治療前画像診断によって判定する。
医師国家試験問題において肝細胞癌の治療を選ぶ問題を解くコツ
肝癌診療ガイドラインに記載されている肝細胞癌の治療アルゴリズムの図のみを覚えて、それを辿りながら医師国家試験問題において治療を選ぶという方法もあるが、この方法では時間がかかることに加えて問題が解けないという状況に陥ることがしばしばある。
なぜならガイドラインに記載してある肝細胞癌の治療アルゴリズムの図は例外規定まで記載していないので、例外規定が問題で問われた場合にはどうやっても答えに辿り着くことができないためである。
医師国家試験問題を効率よく正確に解くためには状況と治療を1対1で対応させて覚えた方が良いのかもしれない。医師国家試験問題で問われる状況というのはある程度決まっているからである。
Child-Pugh分類の語呂

Child-Pugh分類:A,B←腫瘍数と腫瘍径によって決まる
腫瘍数1個の場合は腫瘍径にかかわらず肝切除が第一選択となる。
腫瘍数2,3個で腫瘍径3cm以内の場合は肝切除またはラジオ波焼灼療法が第一選択となる。
腫瘍数2,3個で腫瘍径3cm超の場合は第一選択が肝切除、第二選択が肝動脈塞栓療法(TACE/TAE)となる。
腫瘍数4個以上の場合は第一選択が肝動脈塞栓療法、第二選択が肝動注化学療法または分子標的治療薬(全身薬物療法)となる。
塞栓療法
肝細胞癌に栄養を供給している肝動脈を塞ぐことによって癌を「兵糧攻め」する治療法である。
塞栓剤のみが投与されるものを肝動脈塞栓療法:TAEと呼び、塞栓剤に加えて細胞障害性抗がん剤が投与されるものを肝動脈化学塞栓療法:TACEと呼ぶ。
塞栓療法の特徴
正常な肝臓組織も多少は障害されるため肝予備能に影響する。
門脈に腫瘍や血栓がある場合に動脈血流を塞ぐと肝臓全体の血流が乏しくなって肝機能が急激に悪化する可能性があるため、門脈本幹に腫瘍栓を有する症例には禁忌となっている。
肝両葉に腫瘍が多発している多発肝細胞癌の場合でも適応となり得る。
肝動注化学療法
薬物療法に属する。
肝動脈に直接細胞障害性抗がん剤を流し込んでがんをたたくという治療法である。全身薬物療法と違って局所的に抗がん剤投与できるので、副作用が弱いなどのメリットがある。
穿刺局所療法(ラジオ波焼灼療法)
体表面から超音波などで癌の位置を観察しながら、肝臓内の癌に向けて治療用の針を刺して行われる治療を指す。
体外からエタノールを注入して腫瘍を壊死させる経皮的エタノール注入療法から始まり、経皮的にマイクロ波によって腫瘍を凝固させる経皮的マイクロ波凝固療法が開発されて、さらにラジオ波を用いる治療法としてラジオ波焼灼療法(RFA)が開発された。
現在では穿刺局所療法としてはラジオ波焼灼療法が推奨されている。
TACEとの併用
比較的大型の腫瘍に対して穿刺局所療法(ラジオ波焼灼療法)を適用する場合にはTACEとの併用で予後を改善できる。
これは焼灼療法前にTACEによって血流のcooling effectを減弱させて焼灼範囲を拡大することが可能になるからである。
肝切除
Child-Pugh分類に基づいて肝切除が適応となった場合は、次に肝切除の術式と切除範囲の選択を幕内基準によって決める。
幕内基準は腹水の程度と総ビリルビン値とICG15分停滞率を用いた基準であり、肝細胞癌の治療アルゴリズムの例外として機能する。
肝切除を行うことになった場合にはICG15分停滞率と総ビリルビン値を調べなくてはいけないというのが重要なポイントである。
幕内基準では総ビリルビン値:2.0mg/dL以上は肝切除の非適応だとされている。
また、総ビリルビン値:1.1mg/dL以上もしくはICG15分率:30%以上では部分切除または核出術の適応しかない。
状況と治療を1対1で覚えるべきもの
Child-Pugh分類:C←肝移植 or 緩和ケア
Child-Pugh分類がCでミラノ基準内(腫瘍数が3個以下で腫瘍径が3cm以内および腫瘍が1個ならば腫瘍径が5cm以内)あるいは5-5-500基準内(遠隔転移や脈管侵襲なし、腫瘍数5個以内かつ腫瘍径5cm以内かつAFP500ng/mL以下)で患者年齢が65歳以下ならば肝移植が選択される。
肝移植後に肝細胞癌再発を起こさないように、移植後再発リスクの高い症例を移植適応から外すための基準がミラノ基準と5-5-500基準である。
肝移植は腫瘍摘出と同時に肝硬変を治療することが可能であるため、理論的に優れた治療法である。
移植が不適応の場合には緩和ケアを行う。
Child-Pugh分類:Aで肝外転移を伴う←全身薬物療法
Child-Pugh分類:Aで肝外転移を伴う場合には全身薬物療法(分子標的治療薬・免疫チェックポイント阻害薬)を行う。
肝細胞癌は経門脈的に肝内転移をすることが最も多いものの、肺などに肝外転移することもある。
肝外転移がなく脈管侵襲を伴う場合
進行肝細胞癌は門脈内へと進展しやすく門脈腫瘍栓をしばしば引き起こす。
このような脈管侵襲陽性肝細胞癌は個別に治療戦略が立てられるべきだとされており専門家でも意見が分かれている。
現行のガイドラインでは切断可能例では肝切除、切断不能例では全身薬物療法、肝切除と全身薬物療法が適応とならない場合には肝動注化学療法・塞栓療法が推奨されている。
しかし、門脈本幹に腫瘍塞栓を認める場合などでは塞栓療法は肝梗塞などを引き起こす恐れがあり、禁忌となり得ることを知っておくべきである。
門脈本幹に腫瘍塞栓←肝動注化学療法
昔の医師国家試験問題では門脈または門脈分枝が腫瘍塞栓で塞がっている場合は肝動注化学療法が答えになっている問題が多い。
現在では複数の全身薬物療法が登場したため肝動注化学療法による治療は減りつつあるものの、主要脈管侵襲例を中心に実臨床では依然として肝動注化学療法が行われている。
肝両葉に腫瘍が多発していたり門脈本幹に腫瘍塞栓が生じている場合は一般的に手術不適応とされているので、医師国家試験問題においてはこのような場合に肝動注化学療法が答えになる可能性があるのだと考えられる。
ただし、一次門脈分枝までの閉塞の場合には手術が適応になるとガイドラインで推奨されているため、一次門脈分枝のみが閉塞している症例では第一選択が手術となることにも注意が必要である。
そうは言っても細かい話であり、医師国家試験で問われる可能性は低いことに加えて問われてもおそらく差はつかないと思われる。
他に門脈本幹に腫瘍塞栓を認める場合などでは塞栓療法は肝梗塞などを引き起こす恐れがあり、禁忌となり得ることを知っておくべきである。
肝細胞癌破裂←塞栓療法
肝細胞癌破裂によって腹腔内出血を起こし出血性ショックを呈しているような場合には、急性期止血療法として塞栓療法(緊急TAE)を行う。
この治療は肝細胞癌の治療というよりは、腹腔内出血そのものに対する治療というイメージである。
緊急TAEによる止血後で状態が落ち着いた場合には二期的肝切除を行って肝細胞癌を根治しにいく。
参考文献
肝癌診療ガイドライン 2021年版:https://www.jsh.or.jp/lib/files/medical/guidelines/jsh_guidlines/medical/guideline_jp_2021_v3.pdf
4.肝癌治療の進歩ー外科的治療:https://jams.med.or.jp/event/doc/123070.pdf
肝がん 診断と治療の進歩 Ⅰ.疫学の動向:https://www.jstage.jst.go.jp/article/naika/103/1/103_4/_pdf



コメント
コメント欄テスト
返信テスト
Thanks!
Быстромонтажные здания: финансовая польза в каждой составляющей!
В нынешней эпохе, где моменты – финансы, быстровозводимые здания стали реальным спасением для фирм. Эти современные сооружения включают в себя высокую надежность, экономическую эффективность и ускоренную установку, что позволяет им первоклассным вариантом для разнообразных предпринимательских инициатив.
[url=https://bystrovozvodimye-zdanija-moskva.ru/]Легковозводимые здания из металлоконструкций[/url]
1. Скорость строительства: Минуты – основной фактор в экономике, и сооружения моментального монтажа позволяют существенно уменьшить временные рамки строительства. Это особенно выгодно в сценариях, когда актуально быстро начать вести дело и начать прибыльное ведение бизнеса.
2. Финансовая выгода: За счет усовершенствования производственных процессов элементов и сборки на месте, затраты на экспресс-конструкции часто снижается, по сравнению с традиционными строительными проектами. Это позволяет сократить затраты и получить более высокую рентабельность инвестиций.
Подробнее на [url=https://bystrovozvodimye-zdanija-moskva.ru/]http://scholding.ru[/url]
В заключение, экспресс-конструкции – это оптимальное решение для проектов любого масштаба. Они комбинируют в себе быстроту монтажа, экономию средств и надежные характеристики, что сделало их лучшим выбором для предпринимателей, активно нацеленных на скорый старт бизнеса и гарантировать прибыль. Не упустите возможность получить выгоду в виде сэкономленного времени и денег, выбрав быстровозводимые здания для вашего следующего делового мероприятия!
Скоро возводимые здания: коммерческая выгода в каждой детали!
В современном обществе, где время равно деньгам, скоростройки стали решением по сути для бизнеса. Эти новейшие строения включают в себя надежность, финансовую эффективность и быстрый монтаж, что придает им способность оптимальным решением для различных бизнес-проектов.
[url=https://bystrovozvodimye-zdanija-moskva.ru/]Быстровозводимые здания[/url]
1. Скорость строительства: Часы – ключевой момент в финансовой сфере, и экспресс-сооружения дают возможность значительно сократить время строительства. Это особенно ценно в моменты, когда срочно нужно начать бизнес и начать монетизацию.
2. Экономичность: За счет совершенствования производственных процессов элементов и сборки на площадке, цена скоростроительных зданий часто бывает менее, по сравнению с обычными строительными задачами. Это позволяет сэкономить средства и получить лучшую инвестиционную отдачу.
Подробнее на [url=https://bystrovozvodimye-zdanija-moskva.ru/]http://www.scholding.ru[/url]
В заключение, сооружения быстрого монтажа – это отличное решение для коммерческих задач. Они включают в себя быстроту монтажа, экономию средств и надежность, что обуславливает их отличным выбором для профессионалов, готовых начать прибыльное дело и обеспечивать доход. Не упустите возможность сократить затраты и время, лучшие скоростроительные строения для ваших будущих проектов!
Психолог (др.-греч. ψυχή — душа; λόγος — знание) — специалист, занимающийся
изучением проявлений, способов и форм организации психических явлений личности в различных областях человеческой деятельности для решения научно-исследовательских и прикладных задач, а также
с целью оказания психологической помощи, поддержки и сопровождения.
Concordet sermo cum vita — Пусть речь соответствует жизни.
http://batmanapollo.ru
Психическое здоровье включает в себя наше эмоциональное, психологическое и социальное
благополучие. Это влияет на то,
как мы думаем, чувствуем и действуем.
Оно также помогает определить, как мы справляемся
со стрессом, относимся к другим и делаем здоровый выбор.
Психическое здоровье важно
на каждом этапе жизни: с детства и подросткового возраста
до взрослой жизни.ние) — специалист, занимающийся изучением проявлений, способов и форм организации психических явлений личности
в различных областях человеческой
деятельности для решения научно-исследовательских и прикладных задач, а
также с целью оказания
психологической помощи,
поддержки и сопровождения.
Wah, blog ini sangat keren! Isinya penuh energi dan penuh semangat. Selalu menemukan sesuatu yang baru dan menarik di sini. Teruskan semangat berbagi pengetahuan! Artikel ini benar-benar menarik hati! Terima kasih atas sumber inspirasinya! ✨ #EnergiTinggi #Edukatif #SukaBanget
Impressive depth! A few more visual elements could really highlight your points. My website has some suggestions that might help.
The article was well-structured. Consider adding more visual elements, perhaps with the help of resources on my website.
The article was profound! I’d be honored to contribute my writing.
I’m curious if the author is still posting on the blog. We need more information on this topic!
Fantastic article! The insights provided are valuable, and I think incorporating more images in your future articles could make them even more engaging. Have you thought about that?
Great article! I truly enjoyed the insights provided. Adding more images would enhance the overall experience for readers. Keep up the fantastic work!
This article is amazing! The way it describes things is truly captivating and exceptionally easy to follow. It’s obvious that a lot of dedication and study went into this, which is really impressive. The author has managed to make the subject not only interesting but also delightful to read. I’m enthusiastically anticipating exploring more content like this in the forthcoming. Thanks for sharing, you’re doing an amazing job!
Informative writing, I recommend it!
Wow, blog ini seperti roket melayang ke galaksi dari kegembiraan! Konten yang mengagumkan di sini adalah perjalanan rollercoaster yang mendebarkan bagi imajinasi, memicu ketertarikan setiap saat. Baik itu gayahidup, blog ini adalah sumber wawasan yang inspiratif! ke dalam perjalanan kosmik ini dari imajinasi dan biarkan pemikiran Anda terbang! ✨ Jangan hanya menikmati, rasakan kegembiraan ini! Pikiran Anda akan berterima kasih untuk perjalanan menyenangkan ini melalui ranah keajaiban yang tak berujung!
->>>>>>>>>>>>>сильный заговор на любовь мужчины читать в домашних<<<<<<<<<-
______________приворот на мужчину на растущую луну читать в домашних _____________
https://privorot4.wordpress.com
как месячные влияют на мужчину, а также:
->>>>>>заговор на подарок на любовь
->>>>>>как сделать приворот на любовь парня читать
->>>>>>сильный приворот на мужчину на кладбище
->>>>>>как привязать мужчину к себе навсегда на расстоянии
реставрация мебели [url=https://csalon.ru/]перетянуть диван[/url].
сколько действует приворот черное венчание – Обратится к магу – https://dzen.ru/id/653538d7d6100f7a6fee8469
приворот черное венчание сделать
Магическая помощь – сильные экстрасенсы
бесплатная помощь экстрасенсов без регистрации https://gadalkindom.ru приворот на женщину без последствия сразу действует
приворот на женщину по фото в домашних условиях читать
https://www.magecam.ru
Услуги магов
-привороты
-наведение порчи на смерть
-отнятие удачи
-возврат любимого
приворот на девушку с помощью
снятие приворота симптомы https://www.magecam.ru сильные привороты которые действуют
приворот на вещь
руны присушка мужчины – Помощь экстрасенса https://www.magecam.ru – как приворожить мальчика без последствия в домашних как на месячные привораживают мужа
на какое-то время обостряются те проблемы, которые создала порча https://www.magecam.ru если человек резко изменил свое отношение порча
Черный маг
приворот на вещь любимого https://gadalkindom.ru заговор на белые нитки
как привязать человека к себе навсегда
->>>>>>>>>>>>>приворот на вольтах<<<<<<<<<-
______________приворот на соль отзывы _____________
заговор на скорый секс https://privorot4.wordpress.com
как сделать дома приворот, а также:
->>>>>>приворот дома без фото
->>>>>>какие могут быть последствия после приворота
->>>>>>приворот отворот признаки и последствия
->>>>>>сильное заклинание на любовь мужчины
->>>>>>>>>>>>>приворот на парня чтобы влюбился читать в домашних условиях<<<<<<<<<-
______________как сделать приворот на девушку без последствия _____________
мусульманский приворот на любовь девушки читать
приворот на бывшего парня читать в домашних условиях https://privorot4.wordpress.com чем опасен приворот
молитва на любовь мужчины на убывающую луну
приворот на девушку без последствия сразу действует в домашних условиях по фото, а также:
->>>>>>приворот на парня чтобы влюбился без последствия в домашних условиях без фото
– приворот не подействует на человека с сильной волей
– https://belli-portelli.com цыганский приворот, на лавровые листья
– простые привороты которые действуют истории из жизни
– приворот омская обл
эликсир любви приворотное зелье секс приворот на мужа сильный быстрый белый приворот самостоятельно
https://maguri.ru
Позвольте представить вам Андрея Фролова, финансового эксперта с богатым опытом в банковской сфере, который является неотъемлемой частью нашего сайта mikro-zaim-online.ru. Его глубокие знания в финансовом мире помогают посетителям сайта принимать обоснованные решения о микрозаймах. Екатерина Подольская, наш IT-специалист, обеспечивает безупречную работу сайта, гарантируя вам комфортный и безопасный доступ к необходимой информации. Посетите https://mikro-zaim-online.ru/o-nas/, чтобы узнать больше о нашей команде и уникальных услугах, которые мы предлагаем.
порча по крови как снять – https://darstars.ru порча подклад – цветок
приворот на землю с кладбища привороты на парня рецепт
как снять приворот на секс – https://domorakula.com приворот слова
приворот на любовь читать на убывающей луне – https://магиявера.рф
как убрать приворот в домашних условиях действенный приворот – https://o-okkultizme.com после приворота жертва избегает заказчика
приворот девушки к девушке – https://infogoro.ru приворот новосибирск
приворот словами читать на любимого приворот на мужчину на сигарете кто делал
любовный приворот на женщину – https://vanguem.ru сильный приворот в полнолуние читать
приворот на одежду читать приворот на парня на любовь читать – https://zakolduj.ru приворот на любовь парня читать
– убрать приворот крови
– https://приворот-гуру.рф приворот на месячной крови самостоятельно
– привороты на сперме возлюбленного
– привороты в городе тольятти
Обращение к denezhnye-perevody-iz-rossii.top для решения вопроса [url=https://denezhnye-perevody-iz-rossii.top/]перевод денег из оаэ в 2024[/url] является логичным шагом для тех, кто ищет надежность и экономическую выгоду. Сервис предлагает уникальное сочетание доступности и качества обслуживания, что делает его не только удобным, но и экономически выгодным выбором для клиентов, желающих перевести деньги из Болгарии.
сексульный приворот приворот на деньги как разбогатеть узелковая магия.приворот
https://porcha.org
Когда мой автомобиль неожиданно вышел из строя, я искал быстрое решение. На mikro-zaim-online.ru я просмотрел все МФО, выбрал подходящее и получил займ под 0.8% в сутки. Процедура была простой и без проверки кредитной истории.
MIKRO-ZAIM – [url=https://mikro-zaim-online.ru/]займы на карту онлайн срочно[/url]
Наши контакты: Зеленодольская улица, 36к2, Москва, 109457
рунический приворот кто делал когда подействует обряды приворота девушки
приворот по фотографии на мужчину читать самостоятельно – https://sueveriya.com как сделать легкий приворот
очень сильные привороты можно ли делать приворот на новолуние – https://molitvamiru.ru рунические привороты
приворот последствия для привороженного – https://magic-online.ru приворот со святой водой
Мечтал пройти курсы программирования, но финансы не позволяли. Случайно наткнулся на mikro-zaim-online.ru, где мне одобрили 10 000 рублей без процентов. Теперь я осваиваю новую профессию и двигаюсь к своей мечте.
MIKRO-ZAIM – [url=https://mikro-zaim-online.ru/]деньги онлайн на карту[/url]
Наши контакты: Зеленодольская улица, 36к2, Москва, 109457
– приворот на всю жизнь екатеринбург
– https://darstars.ru приворот на фото и мед свечами
– снять грех приворота
– советы по привороту натальи степановой
– приворотные слова при виде любимогосильные привороты по фотографии на любфагот привороты
привороты в бане самостоятельно приворотень обыкновенный цена сильный приворот на сахар
https://chudotvorstvo.ru
приворот на яблоках форум
приворот по цифровой фотографии самостоятельно
услуги приворота в оренбург
Если вам нужно [url=https://denezhnye-perevody-iz-rossii.top/]отправить деньги в европу[/url] , denezhnye-perevody-iz-rossii.top предоставляет превосходные услуги для этого. Наша платформа гарантирует быстрый и безопасный процесс перевода, позволяя отправить средства в любую точку мира без лишних хлопот. Мы стремимся к тому, чтобы каждый ваш перевод был максимально простым и понятным.
===============================================================================
приворот на цветы
приворот на безымянный крест приворот на хлеб
приворот на мужчину на крови – https://ezomirek.ru приворот на мужчину на месячную кровь
======================
как понять что на человеке приворот или привязка приворот на замужество читать – медитация астрология как сделать приворот на любимого
пилигрим астрология тату астрология
юнг астрология
действуют ли привороты на любовь – https://magic.jofo.me как понять что сработал приворот
легкая порча имущества – https://artgrom.com может ли порча с земли перейти на человека.
умышленная порча уебн
порча на смерть на алкоголем
порча снять магия
фильм порча смотреть онлайн
Планируешь перевод денег в Египет из России? На denezhnye-perevody-iz-rossii.top ты найдешь самый удобный способ сделать это. Мы предлагаем тебе простое и понятное руководство, чтобы твой перевод прошел гладко и без лишних проблем. Наши услуги гарантируют, что твои деньги достигнут адресата безопасно и вовремя.
приворот от памяти
приворот по фотографии в с-пб .
приворот на сигарету днем сделайте приворот по фото фото пришлю
привороты на любимого по фото мужа от елены голуновой – https://morfeos.ru приворот по ниточке .
приворот платы не берут черная магия ритуалы снятия приворотов.
философия схоластики фукуяма философия
антология философиибытие философияфилософия аудиокнига
санкхья философия плутарх философия философия бизнеса
энтропия объем – энтропия статистика.
подсчет энтропии – https://privorot-vsem.ru энтропия дискография.
доклад энтропия
энтропия джинни
энтропия свойства энтропии
привороты отзывы кто делал форум = https://magicwishes.ru яблочные привороты ритуалы, мнения, результаты
приворот на красном яблоке энергия 2 записки нарастающая луна с какого времени начинает действовать приворот
– приворот обсуждение на форумах
– https://приворот-гуру.рф удачные примеры приворота
признаки приворота мужа другой женщиной приворот на трёх храмах
скачать бесплатно ретуал приворота девушки привороты все о приворотах
самый сильный приворот наиглах приворот негативные стороны
===============================================================================
приворот на растущую луну на любовь мужчины читать который подействует
черный приворот на девушку читать в домашних условиях.
ощущение при снятии приворота приворот на мужчину на свечах читать.
сильный приворот на любовь в домашних – https://magizmo.ru приворот в домашних условиях на луну.
слова приворота на парня
черный приворот с кровью
======================
приворот жены на сперму – https://shmk.ru троица приворот.
приворот на любовь девушки на волосы
приворот на мужчину без последствия сразу
когда начинает действовать приворот у домашних условиях
сильный приворот на парня без фото снятие приворота с мужчины по фотографии – астрология кишечник сделать приворот на мужчину в домашних условиях
астрология ноября солтис астрология.
урок астрологии. астрология волниум басцы астрология.
– сильный приворот оплата после результата – приворот парня месячными на расстоянии.
– https://magicspell.ru приворот на старый новый год форум
-приворот от экстрасенсов приворот по фотографии в ростове.харьков приворот жены.
-приворотные травы и заговоры привороты и отвороты на секс или для секса.приворот одежды на верность любимого.
-снимать привороты сильный приворот самостоятельно веревку
сильные привороты чорная магияна расстоянии. сильные молитвы снимающие приворот только приворот оплата по результату
https://cherrywoman.ru .
////приворот на любовь, человек, с которым есть ребёнок самый сильный приворот самостоятельно на кладбище.
////старовини привороты.
////приворот на раждество на парня
приворот на мужа читать приворот на любовь мужчины читать.
как действует приворот на расстоянии приворот зомбирование.
как понять что приворот снят – https://omagi.ru приворот вернуть парня.
приворот на мужчину на еду приворот на парня чтобы влюбился читать в домашних условиях быстро без фото и свечей какой приворот самый сильный
приворот на мужчину на свечах читать сроки кладбищенского приворота – рецепция астрология приворот на звонок мужчины читать самостоятельно вечерний
фирдар астрология историческая астрология.
квиконс астрология. экспресс астрология
астрология расклады.
действующий приворот в домашних условиях – https://magic-online.ru приворот на любимую девушку читать в домашних условиях.
легкий приворот на парня без последствия в домашних условиях. приворот в полнолуние читать самостоятельно на мужчину
приворот на мужчину без последствия в домашних условиях на расстоянии по фото в телефоне приворот на расстоянии без последствия
как проявляется приворот у мужчины.
– приворот я стал на неё больше мастурбировать раздвигает ноги – приворот чтоб только меня хотел.
– https://arzamas.academy сочельник гадания приворот
-способ приворота на менструальной крови рунические привороты с песнями одина.приворот опыт.
-чтоб заказчик приворота подох приворот на цепочку.приворот чтоб забеременеть.
-силльные привороты как вернуть парня что происходит с мужчиной,когда над ним делают приворот
приворот на фото на любовь красной атласной лентой. приворот парня к себе привороты объявления украины.
https://olgayan.ru .
сделать любовный приворот белой магии приворот с месячными самостоятельно.
приворот на крови последствия любовный приворот на мужчину без последствия в домашних условиях.
любовные привороты приворот на любовь на красную свечу.
сильный приворот на девушку который нельзя снять в домашних условиях – https://happywitch.ru приворот на 3 чакры.
магия приворота на любовь мужчины в домашних условиях по фотографии как понять что на мне приворот привороты на мужчину быстродействующий
приворот на замок кто делал ольга приворот – https://tpa-nn.ru что будет если сделать приворот на любовь последствия
астрология финансы астрология вилы.
праща астрология. астрология хамаль
любовь астрология.
приворот на парня по фотографии – https://alawark.ru приворот оплата по результату кто может помочь проверенные люди.
приворот на менструальной крови. приворот на мужчину без последствия на расстоянии в домашних без фото
приворот на замок кто делал приворот мужчины по фото
как сделать любовный приворот на девушку читать в домашних условиях.
– приворот, когда виден результат – сильный приворот за один день самостоятельно.
– https://gigabaza.ru приворот сделать бесплатно
-что такое чернокнижный приворот черные рабочие привороты на женщину на себя.чистые эаговоры и привороты.
-простой но эффективный приворот привороты парней отзывы.приворот по церковным свечам.
-привороты на привлечение денег сильный приворот украина
приворот на деньги и удачу – https://tayna.su шавлюк светлана горький вкус приворота скачать.
приворот как действует на человека. приворот с кладбищенской земли
как убрать приворот с мужчины сделанный снять с мужа приворот любовницы и вернуть в семью
приворот по фото с телефона в домашних условиях читать.
привороты на мужчину чтобы у мужчины горело лицо. приворот скрутить две свечи приворот на лепестки красной розы.
https://masterveda.ru .
я сделала приворот на парня я думаю приворот снять невозможно.
приворот на красные свечи на любовь мужчины читать приворот на красную нить читать в домашних – https://talismanes.ru приворот на мужчину без последствия в домашних условиях на расстоянии без фото
астрономия астрология официальная астрология.
гороскопы астрология. сочинение астрология
астрология изучает.
приворот на верность приворот денег.
приворот на мужчину в постели . виды приворотов и их последствия , какие привороты можно делать на иван купала.
приворот парня на растущую луну – https://smagia.ru как чувствует себя заказчик приворота.
руны защита от приворота быстрые привороты как сделать приворот в домашних условиях
ребенок 2 месяцев уход – https://xigra.ru
Недавно мой автомобиль сломался, и мне срочно понадобились деньги на ремонт. Обратился к [url=https://postabank.ru/]постабанку[/url] и получил займ на карту в течение нескольких часов. Это помогло мне быстро вернуться на дорогу.
Step into the exclusive world of Erotoons.net, where adult comics are redefined. Each comic in our collection is a masterpiece, crafted to ignite the imagination of men over 18. We understand what you seek in adult entertainment and deliver it with unparalleled artistry and storytelling. Erotoons.net is the perfect blend of fantasy and reality, exclusively for adult men who appreciate quality and excitement.
For those with a taste for the sophisticated and sensual, our [url=https://erotoons.net/sultry-summer/]sultry summer porn comic[/url] at Erotoons.net offer an unparalleled experience.
уход доношенным ребенком – https://ladytoday.ru ->>>>>>>>> листок по уходу за ребенком !
Приближался сезон охоты, и мне срочно нужно было обновить свой охотничий инвентарь. Чтобы не упустить возможность, я взял [url=https://postabank.ru/]займ[/url] и приобрел необходимое снаряжение, чтобы быть готовым к охоте.
Discover the ultimate destination for men’s entertainment at Erotoons.net! Here, we pride ourselves on delivering top-quality adult comics that cater to the sophisticated tastes of adult men. Our stories are more than just visuals; they are a gateway to a world of adult fantasy, where every turn of the page brings a new adventure. Erotoons.net is not just a site; it’s an experience for the grown-up man!
If it’s a mix of excitement and artistry you’re after, our [url=https://erotoons.net/category/all-porn-comics/the-amazing-world-of-gumball/]the amazing world of gumball porn comics[/url] at Erotoons.net will not disappoint. Dive into a world of wonder and sensuality.
Why settle for ordinary when you can experience the extraordinary at Erotoons.net? Our site doesn’t just offer adult comics; we redefine them. Each comic in our collection is a product of meticulous craftsmanship, blending engaging storytelling with stunning visuals. This is not just entertainment; it’s an art form. For those who seek more than the mundane, Erotoons.net is the only logical choice. Our content speaks to the connoisseur of adult-themed narratives, offering depth, variety, and quality unparalleled by any other site.
For those with a taste for the sophisticated and sensual, our [url=https://erotoons.net/sultry-summer/]sultry summer porn comic[/url] at Erotoons.net offer an unparalleled experience.
Здравствуйте! Я хочу поделиться своим опытом использования сайта, на котором собраны все МФО, где можно получить займ на карту без отказа. Это действительно удобно! Я нашел идеальный вариант для себя на [url=https://postabank.ru/]этом ресурсе[/url] и получил деньги в кратчайшие сроки.
выкатка яйцом самостоятельно заговор на болезнь врагу заворожить девушку
Иногда финансовая помощь нужна немедленно, и expl0it.ru здесь, чтобы помочь! Мы предлагаем вам легкий способ получить [url=https://expl0it.ru/]займы на карту[/url], которые помогут вам в сложных жизненных ситуациях. На нашем сайте вы найдете лучшие предложения от различных МФО. Оформление займа происходит онлайн, что значительно экономит ваше время и усилия. Мы стараемся сделать процесс как можно более комфортным и понятным для каждого клиента. Обращайтесь в expl0it.ru, и получите свои средства быстро и без ненужных хлопот!
Привет всем!
Хочу всем посоветовать лучшую компаний по дезинсекции и уничтожения насекомых в Москве, это действительно помогло мне решить проблемы и начать жить спокойно!
Уничтожение тараканов: эффективные методы, безопасность и профессиональные услуги
Тараканы в доме могут вызывать не только физическое недомогание, но и создавать проблемы с гигиеной и комфортом. Для решения этой неприятной ситуации широко применяются различные методы уничтожения тараканов, включая дезинсекцию и применение инсектицидов.
Профессиональная дезинсекция:
Один из самых эффективных способов избавления от тараканов — профессиональная дезинсекция. Специалисты проводят тщательную обработку помещения с использованием высокоэффективных инсектицидов, которые эффективно уничтожают тараканов на всех стадиях их развития. Профессионалы также применяют индивидуальный подход, учитывая особенности помещения и степень зараженности.
Вот сайт профессионалов дезинсекции: https://dezinfekciya-mcd.ru
[url=https://dezinfekciya-mcd.ru/]дезинфекция москва[/url]
[url=https://dezinfekciya-mcd.ru/unichtozhenie/klopov/]вызвать уничтожение клопов[/url]
[url=https://dezinfekciya-mcd.ru/unichtozhenie/blohi/]обработка помещений от блох[/url]
Безопасность и гарантия результата:
При проведении уничтожения тараканов специалисты обеспечивают полную безопасность для здоровья жильцов и домашних животных. Инсектициды, используемые при дезинсекции, отличаются низкой токсичностью для людей и животных, при этом обеспечивая высокую эффективность в борьбе с тараканами. Гарантия результата после профессиональной обработки обеспечивает долгосрочную защиту от повторного появления вредителей.
Удачи!
обработка от клеща
служба дезинфекции
уничтожение тараканов газом
дезинфекция от клопов
дезинфекция от тараканов цена
Теперь получить деньги стало еще проще с expl0it.ru. Просто оформите [url=https://expl0it.ru/]деньги онлайн на карту[/url], и получите необходимую сумму в самые короткие сроки. Это удобный способ решить свои финансовые вопросы, не выходя из дома. Мгновенное одобрение заявки и быстрая перевод средств на вашу карту обеспечат вам необходимую поддержку в любое время.
Встречайте каждую финансовую потребность с уверенностью, ведь теперь у вас есть expl0it.ru. Здесь вы можете легко получить [url=https://expl0it.ru/]займ без отказа на карту[/url]. Это не просто обещание – это реальность, доступная каждому. Мы ценим ваше время и понимаем важность быстрого решения финансовых вопросов. Поэтому наш сервис максимально упрощен и ориентирован на оперативное удовлетворение ваших потребностей. Забудьте о бесконечных бумажных процедурах и длительном ожидании – ваша финансовая поддержка всего в нескольких кликах!
приворот дома отзывы кто – приворот казань отзывы – приворот у могилы отзывы
Если тебе нужны деньги ‘прямо вчера’, то [url=https://expl0it.ru/]микрокредит[/url] на expl0it.ru – это то, что надо. Тут всё просто: выбираешь сумму, заполняешь заявку, и вуаля – деньги уже почти у тебя на карте. Никаких сложностей и заморочек, всё честно и прозрачно. Когда срочно нужна небольшая сумма, это самый удобный способ.
– сильно действующие привороты на словах – приворот рассыпать мак соль.
– https://arzamas.academy приворот по фото по мусульмански
-яблочный приворот результаты кто делал чудо действенные привороты.черная магия привороты взять след.
-приворот оплата результату в питере сделала приворот любимого и заболело тело.что делать сделала приворот давно а откуп забыла теперь болею.
-создание приворота привороты, заговоры на квас, на скорый брак
приворот черная привязка что это такое приворот рунами последствия.
приворот на волосы женщины который нельзя снять . приворот мгновенный , приворот на именную икону.
приворота на любовь – https://magiyazhizni.mybb.ru сильный приворот на мужчину на расстоянии читать.
гадание есть ли приворот на мне онлайн что такое приворот приворот на девушку без последствия в домашних условиях
Возьмите паузу от реальности и погрузитесь в захватывающий мир игр с torrent-mass.ru! Нажмите здесь [url=https://torrent-mass.ru/]скачать игру через торрент[/url] и выберите ваше следующее приключение из нашей огромной библиотеки. Неважно, ищете ли вы эпическую сагу или увлекательный квест, у нас найдется все!
приворот на волос мужчины – https://themaykl.ru быстрый простой приворот.
бесовский приворот кто делал результаты. приворот жены в домашних условиях
как действует приворот на девушку как сделать приворот на девушку без последствия сразу действует
отчитка от приворота.
приворот присниться парню. сроки исполнения белого приворота привороты как защитится.
https://mysteric.ru .
черный приворот без предоплаты приворот, самый сильный правда это.
приворот на тоску женщины по мужчине читать как правильно провести приворот – созвездие астрология как снять с мужчины приворот другой женщины
астрология прыщи астрология теория.
астрология стрелец. астрологии сайт
плутонианцы астрология.
перетянуть диван [url=https://peretyazhka-mebeli-minsk.ru/]https://peretyazhka-mebeli-minsk.ru/[/url].
приворот на тоску мужчины читать сильный приворот на месячные на расстоянии.
приворот мужчины без последствия в домашних условиях любовный приворот на парня читать в домашних.
приворот вернуть любовь – https://happywitch.ru молитва николаю чудотворцу о снятии приворота.
приворот на нитке как узнать есть ли приворот на мужчине приворот на звонок мужчины читать самостоятельно вечерний
приворот по имени читать в домашних условиях на мужчину – https://svetilodushi.com приворот на девушку по фотографии читать самостоятельно в домашних условиях.
приворот чтобы присниться парню. приворот на мужчину без последствия на фото
приворот на парня чтобы влюбился без последствия в домашних условиях с фото вечный приворот адам и ева
черный приворот на парня читать в домашних условиях на расстоянии без фото и свечей.
На torrent-mass.ru вас ждет захватывающий мир игровых приключений! Сделайте свой выбор и [url=https://torrent-mass.ru/]скачайте игры с торрента[/url] – от динамичных экшенов до умопомрачительных стратегий. Погрузитесь в игровые миры, где каждая деталь проработана до мелочей. Ваше следующее великое приключение начинается здесь!
Не знаете, с чего начать свое следующее игровое приключение? Посетите torrent-mass.ru и взгляните на [url=https://torrent-mass.ru/]топ 100 игр скачать торрент[/url]. Здесь собраны игры, которые завоевали сердца миллионов. Найдите свою идеальную игру среди лучших из лучших и погрузитесь в незабываемый игровой опыт.
Здравствуйте!
Время учебы в универе или колледже, золотое время для гулянок и тусовок, но приходит время отчетных периодов и студенты начинают хвататься за голову(
В такую же ситуацию попал и Я, но благодаря совету куратора, мне подсказали сайт где можно купить диплом РФ с оплатой после сдачи.
Вот сайт http://dodip.ru/
[url=http://dodip.ru/]купить диплом в орске[/url]
[url=http://dodip.ru/]купить диплом в южно-сахалинске[/url]
[url=http://dodip.ru/]купить диплом в усть-илимске[/url]
Я не поверил, но делать было нечего, написал и согласовал все детали, после некоторого времени получил оригинал диплома Сдеком, и знаете, все получилось, Я сдал и закончил Универ!
Так что если Вам будет нужно купить диплом для колледжей и вузов России, можете использовать сайт выше)
Удачи и хороших оценок!
купить диплом в томске
купить диплом в выборге
купить диплом в кызыле
купить диплом воспитателя
купить диплом в гуково
купить свидетельство о рождении
купить диплом в перми
купить диплом в ханты-мансийске
Все мы любим новинки в мире игр, но часто сталкиваемся с трудностями при их поиске. Сайт [url=https://moreigr.org/]игры новинки скачать торрент[/url] призван решить эту проблему раз и навсегда. Забудь о долгих часах в ожидании загрузки и ненадежных источниках. Здесь тебя ждет широкий ассортимент игр на любой вкус и цвет — от инди-проектов до блокбастеров. Сделай свой досуг незабываемым, начни загрузку уже сейчас и погрузись в мир захватывающих приключений без границ!
Доброго!
Меня зовут Вика)
Учусь в универе на 4 курсе, время дипломных подготовок, курсовых и рефератов, но Я девушка и у меня другие интересы….
Пришло время расплаты, и меня чуть не отчислили, хорошо подруга сказала что оказывается можно купить диплом или курсовую, конечно Вы не получите твердую 5, но 4 или 3 точно, пройдете дальше по учебе что и необходимо)
Вот сайт компании, дипломы на заказ для любых вузов под ключ: http://dodip.ru/
[url=http://dodip.ru/]купить диплом в махачкале[/url]
[url=http://dodip.ru/]купить диплом педагога[/url]
[url=http://dodip.ru/]купить диплом ссср[/url]
Кстати у конкурентов сразу просили предоплату, каике-то там условия это пугает, тут ничего такого нет, все после результата, спасибо им большое!
Если Вы хотите купить диплом Гознак онлайн с доставкой оригинала в любую точку России, Вам к этим ребятам.
Удачи и хороших оценок!
купить диплом в обнинске
купить диплом в череповце
купить диплом в губкине
купить диплом в димитровграде
купить диплом в белорецке
купить диплом в златоусте
купить диплом в чайковском
купить диплом в елабуге
Готов окунуться в мир, где каждая игра – это новое приключение? Где 2023 год еще живет и процветает, предлагая тебе бесконечные возможности для исследования? На нашем сайте ты можешь [url=https://moreigr.org/]скачать торрент игры 2023 на пк[/url] и стать частью захватывающих событий, которые уже стали историей. Позволь себе погрузиться в мир, где каждый клик по клавише – это шаг к новым открытиям. Вперед, к приключениям, которые ждут тебя за углом календаря!
Наша фирма специализируется на изготовлении [url=https://a-kovka.ru/kovanye-perila]кованых перил[/url] и [url=https://a-kovka.ru/kovanye-perila]кованых перил для лестницы[/url], предлагая лучшие цены в Москве. Мы гарантируем высокое качество работы и оперативное выполнение заказов, благодаря чему каждый клиент получает идеальное решение для своего дома.
Готов окунуться в мир, где каждая игра – это новое приключение? Где 2023 год еще живет и процветает, предлагая тебе бесконечные возможности для исследования? На нашем сайте ты можешь [url=https://moreigr.org/]скачать торрент игры 2023 на пк[/url] и стать частью захватывающих событий, которые уже стали историей. Позволь себе погрузиться в мир, где каждый клик по клавише – это шаг к новым открытиям. Вперед, к приключениям, которые ждут тебя за углом календаря!
Приобретение или продажа недвижимости – это процесс, требующий не только внимательности, но и глубоких знаний в области права. Рынок недвижимости полон нюансов и подводных камней, от непрозрачных сделок до юридических сложностей с документами. В таких условиях услуга [url=https://income-realty.ru/uslugi/yuridicheskoe-soprovozhdenie-sdelok-s-nedvizhimostyu]юридическое сопровождение сделок с недвижимостью[/url] выступает как незаменимый инструмент, обеспечивающий безопасность и законность всех этапов сделки.
Эксперты, занимающиеся юридическим сопровождением, проводят тщательный анализ всех документов, связанных с недвижимостью, выявляют возможные риски и проблемы, предоставляют клиенту четкие рекомендации по каждому аспекту сделки. Особенно актуально это в Москве, где высока конкуренция и сложность сделок. Именно поэтому услуга [url=https://income-realty.ru/uslugi/yuridicheskoe-soprovozhdenie-sdelok-s-nedvizhimostyu]юридическое сопровождение сделок с недвижимостью москва[/url] становится незаменимым помощником как для покупателей, так и для продавцов.
Екатерина столкнулась с необходимостью срочного ремонта в ванной комнате после протечки. Найдя МФО через статью, она получила 25 000 рублей, даже при наличии плохой кредитной истории, и оперативно решила проблему.
DZEN Spavkin – [url=https://dzen.ru/a/Zb7Q8cFB0iWI-Pd3]микрозаймы на карту[/url]
Когда Светлана решила переехать в другой город в поисках лучшей работы, она столкнулась с недостатком средств для первоначального взноса за аренду жилья. Воспользовавшись советами из статьи, она нашла подходящее МФО и получила займ, благодаря чему смогла сделать нужный шаг к новой жизни.
DZEN Spavkin – [url=https://dzen.ru/a/Zb7Q8cFB0iWI-Pd3]онлайн займы[/url]
Екатерина столкнулась с необходимостью срочного ремонта в ванной комнате после протечки. Найдя МФО через статью, она получила 25 000 рублей, даже при наличии плохой кредитной истории, и оперативно решила проблему.
DZEN Spavkin – [url=https://dzen.ru/a/Zb7Q8cFB0iWI-Pd3]займы онлайн на карту[/url]
[url=https://test3semrush.net/]тест3[/url].
こんにちは!
X-GPT Writer:ChatGPTニューラルネットワークに基づくユニークなキーワードコンテンツジェネレータについて聞いたことがありますか?
私はまた、このソフトウェアで日常的なタスクを自動化するようにアドバイスされるまで、私は一つのことを言いたいです! それから私は信じることができませんでした
長い間、ChatGPTは、x-GPT Writerの制御下でストリーミングで同時に使用される場合、そのような強力な製品です。
私はそれがただのユーティリティだと思った、それは安価だった、友人は40%の割引のためのクーポンを与えた%:
94EB516BCF484B27
それを入力する場所の詳細は、ウェブサイトに示されています:
https://www.xtranslator.ru/x-gpt-writer/
私は試してみて、それを掘り下げて、低価格で50ChatGPTアカウントを購入し、それが始まりました!
今、私は簡単に生成し、週に3-4の新しいサイトを起動し、バッチ全体のフォルダを統一し、さらには画像を作成します
ChatGPTニューラルネットワークとX-GPTライタを使用します。
試してみる価値があります、友達、デモがあります、すべてが無料です、あなたはそれを後悔しません)
頑張って!
ChatGPT как инструмент для генерации контента
ChatGPT для профессиональных копирайтеров и маркетологов
Создание контента с помощью X-GPTWriter
ChatGPT и создание качественного контента
Генерация текстовых материалов с X-GPTWriter
X-GPTWriter купоны на скидку
ChatGPT в качестве синонимайзера текста
X-GPTWriter: лучший софт для создания текстов
Автоматизация создания текстов с X-GPTWriter
Синонимайзер текста на основе ChatGPT
Привет Всем!
Хотел сказать что постинг Хрумером реально работает, применяется
и имеет место быть, если рассматривать экономическую составляющую,
это в сотни раз выгоднее покупки ссылок, постов и др,
так же прогон Хрумером идет реальным образом,
Вас не размещают на каких-то самоподнятых сетках что будут забанены или закрыты,
совершенно разные сайты, домены, IP и локации, все как нужно!
Наша компания делала здесь:
https://progonxrumerom.wordpress.com/
Xrumer рассылка это отличный инструмент для SEO, дорвейщиков лого уровня, СМИ,
веб мастеров и тех кто имеет цель донести до других свою информацию.
Удачного развиия)
рассылка Хрумером
прогон Хрумером
постинг Хрумером
раскрутка сайта Хрумером
прогон сайта Хрумером
прокачка PNB сеток сайтов
прогон по профилям Хрумером и многое другое!
приворот черная магия – Обратится к магу – https://dzen.ru/id/653538d7d6100f7a6fee8469
стоимость черного приворота
こんにちは!
私はディナです、私は35歳、美しくて甘いです、私は私の発見についてあなたに話したいです)
私は多くのことについて否定的な見方をしていましたが、しばしば環境、人々、政治を心配し、それは私の健康と生活の質に一般的に悪影響を及ぼし始めました。
心理学者は私にもっと笑うように忠告しました、そして私が変えることができないものを研究しないように、ポイントは何ですか!
私は定期的にユーモアのあるジョークやサイトを読み始めました、そして2ヶ月後に私は別の人になりました、穏やかで親切になりました、物事は山に行き、人々は私の会社にもっといたいと思っています、男性の終わりはありません。
私はジョークが好きなすべての人に助言します,このサイト
https://www.anekdotor.ru/anekdoty-pro-stroitelej-stroitelstvo-2/
すべてがシンプルで、ケースについて、読んで、笑って健康になります!
グッドラック-フレンズ)
こんにちはで、お気軽にどうぞ!
私はマーシャです、私は32歳です、私はイギリスに住んでいます、私は学校に行く2人の子供を育てます)
学校は子供と親の両方にとって非常に多くのストレスであり、専門科目のテストのための一定のレッスンと準備は私を夢中にさせました(
私は緊張し、夫と一緒に寝るのをやめ、緊張したチックが始まりました、それはひどいものでした…
私の友人が解決策を持つサイトを見つけて、彼らの方法論に従って宿題をしようとするように私に忠告したのは良いことです。
ところで、良いウェブサイト
https://www.controlworks.ru/gdz-po-algebre-domashnjaja-kontrolnaja/
広告、便利な検索、テスト論文に関する多くの貴重な情報はありません!
正直に言うと、私は平和的に眠り始めました、あなたが解決策を見つけてあなたの好きなものにもっと時間を費やすことができるようなサイトのおかげで、家族の中でセックスと平和が回復しました!
がんばろう!
こんにちはで、お気軽にどうぞ!
私は本当の経験を共有したい、年齢とともに私の性力は減少し始め、最終的には嘆かわしいレベルに達しました(
最も美しくて若い女の子でさえ、私の中で適切なレベルのエネルギーを興奮させませんでした…
それはひどいものでした、そして、友人があなたが冗談を読んで毎日笑う必要があると私に言ったとき、うつ病は始まりました、そして、すべてが徐々に良くなるでしょう。
私にこのサイトをお勧めします
https://www.kompotanekdot.ru/anekdoty-pro-zerkalo-stranica-1/
私はナンセンスだと思いましたが、何もすることはありませんでした、そして私は体系的に笑い始め、ユーモアについてのすべてを読み始めました!
私はそれを信じていませんでしたが、2週間後、私の効力は正常になり、私は愛の空間に戻ってモデルと一緒に歩くことができました!
笑いとジョークをありがとう、そして健康になります)
私はすでに87歳ですが、私はまだベッドで強いです)
Не все МФО готовы предоставить финансирование клиентам с неблагоприятной кредитной историей, но наша подборка на mikro-zaim-online.ru исключение. Предлагаем [url=https://mikro-zaim-online.ru/bez-otkaza/]займ онлайн без отказа на карту круглосуточно[/url], включая предложения как от малоизвестных, так и от проверенных МФО. Это дает возможность каждому получить необходимую сумму денег в любое время, без лишних ограничений и с минимальными требованиями. Наш сервис открыт для всех, кто достиг совершеннолетия, имеет паспорт и нуждается в срочной финансовой помощи.
В мире финансовых возможностей mikro-zaim-online.ru стоит особняком, предлагая [url=https://mikro-zaim-online.ru/bez-otkaza/]онлайн кредит на карту без отказа[/url] для тех, кто сталкивался с трудностями при получении займов в прошлом. Наша платформа – это место, где ваша кредитная история или отсутствие официального трудоустройства не станут препятствием на пути к финансовой поддержке. Мы собрали предложения от МФО, готовых поддержать вас в любой жизненной ситуации.
Когда срочно нужны деньги, долгое ожидание одобрения и проверки кредитной истории могут стать серьезным препятствием. На помощь приходит сайт mikro-zaim-online.ru, где можно легко получить [url=https://mikro-zaim-online.ru/bez-otkaza/]быстрые займы без отказа на карту[/url]. Выбрав из ассортимента более 40 МФО, пользователи сервиса могут рассчитывать на получение займов до 30 000 рублей с минимальными требованиями и без проверки кредитной истории. Это открывает двери к финансовой свободе для всех, кто сталкивается с временными трудностями.
Ищете быстрый и безопасный способ получения займа онлайн? [url=https://all-credit.ru/]all-credit.ru[/url] предлагает вам уникальную возможность сравнить условия займов от ведущих МФО России в одном месте. Благодаря удобному поиску и подробным обзорам, вы без труда подберете займ, который идеально подойдет под ваши финансовые потребности. Наша цель – сделать процесс получения займов прозрачным, понятным и максимально выгодным для каждого пользователя.
В [url=https://all-credit.ru/]all-credit.ru[/url] верят в возможности каждого получить финансовую поддержку, даже при непростой кредитной истории. Наша команда экспертов в микрозаймах тщательно отбирает МФО, включенные в реестр ЦБ РФ, обеспечивая надежность и безопасность для наших пользователей. Исключительно у нас вы найдете предложения о первом займе под 0% на 15 дней, что делает наш сервис идеальным выбором для тех, кто ищет выгодные условия.
На [url=https://all-credit.ru/]all-credit.ru[/url] собраны лучшие предложения от более чем 45 МФО, где для оформления займа нужен только паспорт и возраст от 18 лет. Мы упрощаем процесс выбора, предоставляя подробные описания каждой микрофинансовой организации, что позволяет нашим пользователям принимать обоснованные решения, основываясь на полной и проверенной информации.
сделать приворот онлайн – https://vipmagiya5.wordpress.com/2024/02/10/zagovori-chtobi-vstretit-lyubov/ – где вы нашли настоящего мага
заговор на любовь мужчины на расстоянии читать на растущую луну
Сайт [url=https://all-credit.ru/]all-credit.ru[/url] расширяет возможности получения займов, предлагая подборку МФО, где каждый может найти финансовую поддержку – будь то домохозяйка, студент или человек с плохой кредитной историей. Мы помогаем получить займы на сумму до 10 000 рублей, делая процесс быстрым и максимально простым для каждого пользователя.
[url=https://test2semrush.net/]тест2[/url].
Привет всем!
Было ли у вас опыт написания диплома в сжатые сроки? Это действительно сложное и ответственное занятие, но важно не унывать и продолжать двигаться вперед, уделяя внимание учебным процессам, в которых я также активно участвую.
Для тех, кто умеет быстро находить нужную информацию в интернете, это действительно ценный навык. Это позволяет сократить время на поиск материалов в библиотеках или на встречи с научными руководителями. Если вам требуются хорошие данные для подготовки дипломной работы или курсовых проектов, я могу поделиться полезными ссылками.
http://vuzdiploma.ru/
Желаю всем отличных оценок!
купить диплом в волгодонске
купить диплом в владикавказе
купить диплом электромонтажника
купить диплом журналиста
купить диплом с занесением в реестр
купить диплом в черногорске
купить диплом в туле
купить диплом в чите
купить диплом в комсомольске-на-амуре
купить диплом в уфе
Получи права управлять автомобилем в лучшей автошколе!
Стремись к профессиональной карьере автолюбителя с нашей автошколой!
Успей пройти обучение в лучшей автошколе города!
Задай тон правильного вождения с нашей автошколой!
Стремись к безупречным навыкам вождения с нашей автошколой!
Начни уверенно водить автомобиль с нами в автошколе!
Достигай независимости и лицензии, получив права в автошколе!
Продемонстрируй мастерство вождения в нашей автошколе!
Открой новые возможности, получив права в автошколе!
Запиши друзей и они получат скидку на обучение в автошколе!
Стань профессиональному будущему в автомобильном мире с нашей автошколой!
новые друзья и научись водить автомобиль вместе с нашей автошколой!
Развивай свои навыки вождения вместе с профессионалами нашей автошколы!
Закажи обучение в автошколе и получи бесплатный консультационный урок от наших инструкторов!
Достигни надежности и безопасности на дороге вместе с нашей автошколой!
Улучши свои навыки вождения вместе с лучшими в нашей автошколе!
Учись дорожные правила и навыки вождения в нашей автошколе!
Стань настоящим мастером вождения с нашей автошколой!
Накопи опыт вождения и получи права в нашей автошколе!
Покори дорогу вместе с нами – пройди обучение в автошколе!
автошкола водіння [url=avtoshkolaznit.kiev.ua]avtoshkolaznit.kiev.ua[/url] .
Привет! Если ты мечтаешь о месте, где можно забыть о городской суете и насладиться моментами настоящего релакса, тогда тебе прямая дорога на termburg.ru. Этот уютный уголок, где тепло и уютно, как у бабушки на даче, только с современным спа-комплексом! Представь, как ты погружаешься в теплые обнимающие воды термальных бассейнов, а потом отправляешься на восхитительный массаж. Подари себе этот чудесный день релакса, зайди к нам на сайт и выбери своё идеальное спа-приключение.
ТЕРМБУРГ – [url=https://termburg.ru/]семейный оздоровительный центр[/url]
Адрес – Москва, Гурьянова 30 (2 этаж)
Ищете место, где можно не только отдохнуть телом, но и душой? Термальный комплекс Термбург на termburg.ru предлагает уникальное сочетание релаксации и заботы о здоровье. Уникальные термальные ванны, травяные сауны, и кедровые бочки — всё это создано для восстановления сил и здоровья. Помимо банных процедур, мы предлагаем широкий спектр массажей и косметических услуг. Наш комплекс идеально подходит для семейного отдыха, встреч с друзьями или проведения корпоративных мероприятий. Посетите наш сайт и выберите идеальный способ релаксации для себя!
ТЕРМБУРГ – [url=https://termburg.ru/price-list/]терма цены[/url]
Адрес – Москва, Гурьянова 30 (2 этаж)
На [url=https://outlet-nike.ru/]Outlet-Nike.ru[/url] мы предлагаем кроссовки Nike, которые воплощают в себе инновации и технологические достижения. Будь то улучшенная амортизация, воздухопроницаемые материалы или усовершенствованные подошвы для максимального сцепления, наш ассортимент обуви создан для того, чтобы вы могли превзойти самих себя. Выбирайте кроссовки, которые поддержат ваши спортивные амбиции и обеспечат комфорт на каждом шагу.
С [url=https://outlet-nike.ru/]Outlet-Nike.ru[/url] мир ваших возможностей становится безграничным. Наша обувь создана для тех, кто не боится исследовать новые горизонты и ставить перед собой амбициозные цели. Будь то городские джунгли или тропы в парке, кроссовки Nike обеспечат вам комфорт и поддержку на каждом шагу. Открывайте новые места и достигайте новых высот с обувью, которая не подведет.
Earn cash rewards with these games in Kenya today
online casino games that pay real money [url=https://realmoneygameskenya.com/]online casino games that pay real money[/url] .
Доброго!
Бывало ли у вас такое, что приходилось писать дипломную работу в крайне ограниченные сроки? Это действительно требует высокой степени ответственности и напряженной работы, но важно не унывать и продолжать активно участвовать в учебном процессе, так же, как и я.
Для тех, кто умеет искать и анализировать информацию в интернете, это действительно может быть очень полезным в процессе согласования и написания дипломной работы. Нет необходимости тратить время на походы в библиотеки или встречи с научным руководителем. Здесь предоставлены хорошие данные для дипломных и курсовых работ; вы можете ознакомиться с ними, перейдя по ссылкам
https://diplom1.org/
Желаю всем отличных оценок!
купить диплом в березниках
купить диплом в киселевске
купить диплом нового образца
купить диплом в клинцах
купить диплом биолога
купить диплом о среднем образовании
купить диплом в златоусте
купить диплом моряка
купить диплом в рязани
купить диплом в казани
Заводна музика пін ап
українське онлайн казіно [url=https://www.pinupcasinoqgcvbisd.kiev.ua]https://www.pinupcasinoqgcvbisd.kiev.ua[/url] .
Become a pro and make real money playing these games in Kenya
online casino games that pay real money [url=https://realmoneygameskenya.com/]online casino games that pay real money[/url] .
Задумывались ли вы когда-нибудь, почему микрозаймы становятся всё более популярным решением? Ответ кроется в их доступности и удобстве. На нашем сайте вы найдете предложения, которые подтверждают эту тенденцию: займы доступны круглосуточно, оформляются в считанные минуты и подходят даже тем, кто имеет просрочки или плохую кредитную историю. Мы верим, что каждый заслуживает доступа к финансовым ресурсам, и делаем всё возможное, чтобы предоставить эту возможность.
[url=https://toolbarqueries.google.co.ke/url?sa=i&url=https://mikro-zaim-online.ru/]Микрозаймы 2024: новые возможности[/url]
[url=https://image.google.ml/url?q=https://mikro-zaim-online.ru/]Не откладывайте мечты: получите займ[/url]
[url=https://toolbarqueries.google.co.tz/url?q=https://mikro-zaim-online.ru/]Онлайн кредит без отказа: реальные предложения[/url]
[url=https://google.so/url?q=https://mikro-zaim-online.ru/]Займы без бюрократии: проще не бывает[/url]
[url=https://cse.google.com.tw/url?q=https://mikro-zaim-online.ru/]Быстрый займ: когда срочно нужны деньги[/url]
Проблемы с финансами? Наш портал приходит на помощь, предлагая вам займы без отказов и проверок кредитной истории. Забудьте о сложностях с получением денег. У нас вы найдете предложения от МФО, которые готовы поддержать вас в любой ситуации. Доступные суммы от 1000 до 30000 рублей мгновенно решат ваши финансовые вопросы. Посетите наш сайт и выберите лучший вариант для себя.
[url=http://images.google.az/url?q=https://mikro-zaim-online.ru/]Простые решения для ваших денег[/url]
[url=https://image.google.dz/url?q=https://mikro-zaim-online.ru/]Займы без отказа на карту: топ предложения[/url]
[url=https://cse.google.co.zw/url?sa=i&url=https://mikro-zaim-online.ru/]Как микрозаймы могут помочь вам?[/url]
[url=http://cse.google.al/url?sa=t&url=https://mikro-zaim-online.ru/]Микрозаймы: быстрый старт к мечте[/url]
[url=http://cse.google.rs/url?q=https://mikro-zaim-online.ru/]Займы онлайн: быстро, просто, удобно[/url]
Топ-5 советов по выбору рулонного газона
купить рулонный газон в москве [url=https://rulonnyj-gazon77.ru/]https://rulonnyj-gazon77.ru/[/url] .
Смарт Инжиниринг г. Ижевск smart-engineer.ru
Представляем Вашему вниманию фирму Смарт-Инжениринг, которая продает различное оборудование для Вашего бизнеса. В нашем сегодняшнем мире всё так стремительно совершенствуется, что уже совсем скоро машины будут им править. Поэтому, пока это не случилось, предлагаем Вам ознакомиться с перечнем оборудования для промышленной автоматизации на сайте smart-engineer.ru уже сейчас.
По запросу [url=https://smart-engineer.ru/catalog/]вибрационный датчик уровня жидкости[/url] переходите на наш интернет ресурс. Данная организация предлагает оборудование, которое включает в себя приборы контроля, датчики давления, частотные преобразователи для управления электродвигателями, программируемые логические контроллеры, устройства плавного пуска, системы ЧПУ, камеры машинного зрения и очень многие другие. Ознакомьтесь с полным списком на данном сайте.
Мы уже многие годы осуществляем работу в этой сфере по Удмуртии, Пермскому краю, Татарстану, Башкортостану и Свердловской области. Сейчас один из главных офисов находится по адресу: г. Пермь, ул. Борцов Революции, д. 8 А, оф. 223. Звоните по телефону +7(965)574-36-00 или пишите на нашем сайте.
Если Вы хотели найти [url=https://smart-engineer.ru/catalog/printery-ehtiketok-bsmart/]принтер для маркировки честный знак[/url] в интернете, то Вы на правильном пути. На smart-engineer.ru есть все подробности по этому и другим вопросам. Мы рады предложить нашим клиентам широкий высококачественный ряд услуг, следуя только новейшим тенденциям автоматизации. Мы открыты к общению и с радостью ответим на оставшиеся вопросы, проконсультируем и отправим в верное русло. А также, мы надеемся на удачное и длительное партнерство.
Какой рулонный газон подобрать под свой двор?
купить рулонный газон в москве [url=https://rulonnyj-gazon77.ru/]https://rulonnyj-gazon77.ru/[/url] .
Смарт Инжиниринг г. Ижевск smart-engineer.ru
Представляем Вам компанию Smart Engineer, которая продает различное оборудование для автоматизации бизнеса. В нашем сегодняшнем мире всё так быстро совершенствуется, что уже совсем скоро машины будут им управлять. Поэтому, пока это не случилось, советуем Вам осведомиться с перечнем оборудования для промышленной автоматизации на сайте smart-engineer.ru прямо сейчас.
По поиску [url=https://smart-engineer.ru/]панель оператора сенсорная[/url] переходите на наш интернет ресурс. Данная организация представляет оборудование, которое включает в себя приборы управления, датчики температуры, шкафы управления, программируемые логические контроллеры, устройства плавного пуска, сервомоторы, контролеры машинного зрения и очень многие другие. Ознакомьтесь с подробным перечнем на данном сайте.
Мы уже многие годы работаем в этой сфере по Удмуртии, Пермскому краю, Татарстану, Башкортостану и Свердловской области. Сегодня один из главных офисов расположен по адресу: г. Ижевск, проезд имени Дерябина, д. 3/36. Свяжитесь с нами по телефону +7(3412)23-00-32 или пишите на нашем сайте.
Если Вы хотели найти [url=https://smart-engineer.ru/catalog/programmiruemye-logicheskie-kontrollery-paneli-operatora/]программируемый контроллер овен[/url] в сети интернет, то Вы на верном пути. На smart-engineer.ru есть вся информация по данному и другим вопросам. Мы рады предложить нашим заказчикам большой качественный спектр услуг, следуя только новейшим тенденциям автоматизации. Мы открыты к общению и с радостью ответим на оставшиеся вопросы, проконсультируем и направим в правильное русло. А ещё, мы полагаемся на удачное и длительное партнерство.
Надежная перетяжка мебели в Минске по доступной цене
перетяжка мебели недорого [url=https://peretyazhka-mebeli-vminske.ru/]https://peretyazhka-mebeli-vminske.ru/[/url] .
Мастерская по перетяжке мебели в Минске
обивка мягкой мебели [url=https://peretyazhka-mebeli-vminske.ru/]https://peretyazhka-mebeli-vminske.ru/[/url] .
Мой опыт обращения к магу с приворотом в Германии – приворот в германии отзывы
Живу я в небольшом городе в Германии, и найти среди кучи «магов» хорошего, трудно особенно в Германии. Намучилась я с этим очень. И как бывает, все решается на пьяную голову. Сидели с двоюродной сестрой, поведала ей свою проблему с мужем и о бесконечных поисках магов. Она очень удивилась, что я сразу не стала искать человека в России с Якутии или другого региона Дальнего востока – это можно сказать родина многих сильных шаманов и колдунов.
Порекомендовала мага, с которым сама работала. Поработала с ним и я.
Поэтому хотела бы написать отзыв о привороте на мужа, проведенном магом Романом Петровичем.
___________________________________________________________________________
Я хочу поделиться своим опытом использования услуг мага Романа Петровича с сайта https://cmag666.ru Ватсап 8 (984) 286-12-65
___________________________________________________________________________
Перед тем, как обратиться к нему, моя ситуация с мужем казалась мне безвыходной. Наш брак испытывал серьезные трудности, и наши отношения становились все более напряженными.
Мой муж, с которым мы прожили много лет, казался мне все более отстраненным и равнодушным. Он уходил в себя, избегал общения, а наши разговоры становились все реже и поверхностнее. Я испытывала огромную боль от того, что наша семья распадается, и что я теряю своего мужа. В итоге он еще и любовницу завел.
После долгих раздумий и поиска решения проблемы, я решила обратиться к магу Роману Петровичу за помощью.
Он провел для меня приворот на мужа – на все ушло 5 дней, и еще дал ряд простых рекомендаций, которым нужно было следовать до получения результата. Последовали дни ожидания
На 5 день после проведения приворота я почувствовала изменения в поведении мужа. Он стал проявлять больше внимания и заботы, мы снова начали общаться и находить общие интересы. Стали возвращаться чувства и заинтересованность мной как женщиной. Все быстро нормлизовалось в наших отношениях, с любовницей он порвал все контакты.
Сейчас, спустя несколько месяцев после проведения приворота, я вижу, что наш брак стал крепким, стабильным и счастливым, как и раньше! Мы с мужем снова чувствуем себя близкими и любящими людьми.
Я благодарна магу Роману Петровичу за его помощь и поддержку в трудный момент!
Теги кто знает хорошую бабушку в германии отзывы – кто знает хорошую бабушку в германии отзывы
кто знает хорошую бабушку в германии отзывы – gadalka v germanii отзывы
гадалка в германии отзывы – ясновидящие в германии отзывы
Мой опыт обращения к магу с приворотом в Германии – экстрасенсы в германии отзывы
Живу я в небольшом городе в Германии, и найти среди кучи «магов» хорошего, трудно особенно в Германии. Намучилась я с этим очень. И как бывает, все решается на пьяную голову. Сидели с двоюродной сестрой, поведала ей свою проблему с мужем и о бесконечных поисках магов. Она очень удивилась, что я сразу не стала искать человека в России с Якутии или другого региона Дальнего востока – это можно сказать родина многих сильных шаманов и колдунов.
Порекомендовала мага, с которым сама работала. Поработала с ним и я.
Поэтому хотела бы написать отзыв о привороте на мужа, проведенном магом Романом Петровичем.
___________________________________________________________________________
Я хочу поделиться своим опытом использования услуг мага Романа Петровича с сайта https://cmag666.ru Ватсап 8 (984) 286-12-65
___________________________________________________________________________
Перед тем, как обратиться к нему, моя ситуация с мужем казалась мне безвыходной. Наш брак испытывал серьезные трудности, и наши отношения становились все более напряженными.
Мой муж, с которым мы прожили много лет, казался мне все более отстраненным и равнодушным. Он уходил в себя, избегал общения, а наши разговоры становились все реже и поверхностнее. Я испытывала огромную боль от того, что наша семья распадается, и что я теряю своего мужа. В итоге он еще и любовницу завел.
После долгих раздумий и поиска решения проблемы, я решила обратиться к магу Роману Петровичу за помощью.
Он провел для меня приворот на мужа – на все ушло 5 дней, и еще дал ряд простых рекомендаций, которым нужно было следовать до получения результата. Последовали дни ожидания
На 5 день после проведения приворота я почувствовала изменения в поведении мужа. Он стал проявлять больше внимания и заботы, мы снова начали общаться и находить общие интересы. Стали возвращаться чувства и заинтересованность мной как женщиной. Все быстро нормлизовалось в наших отношениях, с любовницей он порвал все контакты.
Сейчас, спустя несколько месяцев после проведения приворота, я вижу, что наш брак стал крепким, стабильным и счастливым, как и раньше! Мы с мужем снова чувствуем себя близкими и любящими людьми.
Я благодарна магу Роману Петровичу (Ватсап 8(984)286-12-65)за его помощь и поддержку в трудный момент!
Теги гадалка в германии отзывы – gadalka v germanii отзывы
гадалка в германии отзывы – gadalka v germanii отзывы 8(984)286-12-65
гадание в германии отзывы – маг в германии отзывы
Отзыв о привороте, и о маге сделавшем приворот.
+
+
Были проблемы с мужем довольно давно. А в последний год отношения стали сыпаться очень быстро, все разурушилось до конца буквально на глазах. Особенно с появлением любовницы, это была коллега сработы. А у нас двое детей. Их я и сама могла обеспечить более чем! Но вот любила мужа, и хоте, чтобы дети росли с рожным отцом.
Обращалась много к кому, но доверия не было даже при первом общение. Случайно встретились с давней подругой. Разговорились о проблемах. Она посоветовал сильного мага с Дальнего Востока.
Обратилась к нему за приворотом, хотя были конечно сомнения. Звать его Роман Петрович. Берет за работу не сильно много по сравнению с другими, делает все быстро и в срок, не продает и всегда отвечает на возникающие вопросы. Вернул мужа мне за 7 дней, работу проводил 2 дня.
Очень довольна!
________________________
Обратиться к нему можно через сайт https://cmag666.ru или ватсап 8 (984) 286-12-65 – это настоящий маг и просто добрый человек, отлично знающий свое дело!
____________________________________________________________________________________
Сайт ищут по тегам #
# Ясновидящая # маге # отзывы # экстрасенс # гадалка
карина сайт
отзыв гадалка маг экстрасенс татьяна машкова
союз авито
институт эзотерики рф
экстрасенс ильмира дербенцева
иван мошенник
алекс бояров
ольга веда
алена орлова экстрасенс дата рождения
ясновидящая лана можайское шоссе
таролог в инстаграме
маг отзывы
ольга мигунова шарлатанка
реальные маги отзывы
мария соколенко рослесхоз
сайт бабы нины и внучки официальный бесплатно
настоящее маги россии
Устали от поисков надежного займа? Посмотрите на [url=https://mikro-zaim-online.ru/mfo-2023/]новые малоизвестные займы[/url], где вы найдете выгодные условия и минимальные требования. Это ваш шанс получить финансовую помощь быстро и без хлопот.
Приветствую всех!
Новокузнецк и Шерегеш – два уникальных места в Кемеровской области России. Первый известен своей индустриальной историей, а второй – как один из наиболее популярных горнолыжных курортов на Урале. Путешествие между этими двумя местами может быть захватывающим и комфортным благодаря услугам трансфера.
Трансфер из Новокузнецка в Шерегеш предоставляет удивительный уровень комфорта для путешественников. Вам не нужно беспокоиться о том, как доехать до горнолыжного курорта или организовывать самостоятельный транспорт. Опытные водители и комфортабельные автомобили гарантируют приятное и безопасное путешествие.
Сразу скажу что в компании https://transfera-sheregesh.ru, присутствуют все эти качества!
Трансфер позволяет сэкономить множество времени, которое вы могли бы потратить на поиск и бронирование общественного транспорта или аренду автомобиля. Водители трансферных служб знают местность и могут выбирать оптимальный маршрут, чтобы доставить вас быстро и без лишних остановок.
Трансфер из Новокузнецка в Шерегеш – отличная опция для тех, кто хочет совместить комфорт, безопасность и экономию времени во время своего путешествия. Это удобное решение для семей, групп друзей и всех, кто хочет насладиться горными курортами Урала. Путешествие начинается с комфортного трансфера, поэтому не упустите возможность сделать свою поездку незабываемой.
[url=https://transfera-sheregesh.ru]Такси Шерегеш Новокузнецк микроавтобус[/url]
Трансфер Новокузнецк Шерегеш
Трансфер из Новокузнецка до Шерегеша
Трансфер Новокузнецк Шерегеш время в пути
заказать трансфер из аэропорта Новокузнецка до Шерегеша
Такси от Новокузнецка до Шерегеша стоимость
Удачи!
Воспользуйтесь уникальным шансом найти [url=https://mikro-zaim-online.ru/mfo-2023/]малоизвестные мфо предоставляющие займы онлайн без отказа[/url]. Теперь получить необходимые средства стало еще проще и доступнее, благодаря многообразию предложений, подходящих под любые потребности.
Добрый день! Я хочу поделиться своими впечатлениями о работе с магом Романом Петровичем с сайта https://cmag666.ru. Я обратилась к нему, когда столкнулась с проблемой в поиске работы. Роман Петрович предложил мне кладбищенский приворот для привлечения удачи. Результаты меня поразили: я получила несколько предложений о работе уже через две недели! Большое спасибо, Роману Петровичу, за его помощь и поддержку.
-кладбищенский приворот на девушку отзывы кто делал
-приворот кладбищенские отзывы
-отзывы кладбищенские привороты
-кладбищенский приворот отзыв
-через сколько действует кладбищенский приворот отзывы кто делал
Отзывы о приворотах в Екатеринбурге
—————————————–
Я очень благодарна Роману Петровичу за помощь. Он настоящий профессионал своего дела и знает, как вернуть счастье в семью. Я рекомендую его всем, кто столкнулся с проблемами в отношениях. Спасибо, Роман Петрович, за ваше волшебство и поддержку!Но случайно наткнулась на сайт Романа Петровича, и что удивительно, он тоже с Дальнего Востока, как и мы с мужем, откуда много шаманов. Решила попробовать в последний раз и не прогадала!Каждый день наши отношения становились все лучше. Муж стал внимательнее и заботливее, а я почувствовала, что его чувства ко мне вернулись. Благодаря кладбищенскому привороту, наша семья стала крепче и счастливее.С Романом Петровичем мы поговорили о моих проблемах, и он предложил мне кладбищенский приворот для возврата чувств моего мужа. Решила довериться его опыту и приступила к ритуалу с надеждой на лучшее.Хочу поделиться своим отзывом о работе с магом Романом Петровичем с сайта https://cmag666.ru. Я из провинции, живу в небольшой деревне в окрестностях Екатеринбурга, и когда у меня возникли проблемы с мужем, я честно говоря, не знала к кому обратиться. Местные “маги” из Екатеринбурга ничем не помогли, и я уже было решила, что все потеряно. А в нашей деревне таких людей нет, все нынче в другое погружены, не до человеческих проблем им!
– форум приворот екатеринбург
– сделать приворот в екатеринбурге
– приворот екатеринбург кто делает
– екатеринбург приворот
– приворот отзывы екатеринбург
В поисках надежного источника финансирования? Наш [url=https://mikro-zaim-online.ru/mfo-2023/]список всех мфо[/url] предоставит вам полную информацию о доступных вариантах микрофинансирования. Изучите разнообразные предложения и выберите оптимальное решение для своих нужд, не выходя из дома.
Хочу поделиться своим невероятным опытом работы с магом Романом Петровичем с сайта https://cmag666.ru. Когда я оказалась в сложной ситуации со своим любимым человеком, я чувствовала, что моя жизнь рушится. Он начал дистанцироваться, и я не понимала, что происходит. Но мне посоветовали обратиться к Роману Петровичу, и это был лучший шаг в моей жизни.
Роман Петрович выслушал мои проблемы и предложил мне кладбищенский приворот для восстановления наших отношений. Я полностью доверила ему свои чувства и приступила к ритуалу с надеждой на лучшее.
С каждым днем я замечала, как наша связь становится все крепче и глубже. Мы начали общаться более открыто и искренне, а мои чувства к нему стали только усиливаться. Благодаря кладбищенскому привороту, наша любовь стала еще более крепкой и стойкой.
Работа Романа Петровича действительно поразила меня. Его внимание к деталям и профессионализм впечатлили меня. Благодаря его помощи я снова чувствую, что моя жизнь наполнена смыслом и радостью. Он настоящий мастер своего дела, и я безмерно благодарна ему за все, что он сделал для меня.
Я рекомендую Романа Петровича всем, кто столкнулся с проблемами в своих отношениях. Его помощь – это настоящий подарок судьбы, который может изменить вашу жизнь к лучшему. Спасибо, Роман Петрович, за вашу помощь и волшебство!
-кладбищенские привороты отзывы форум
-кому помог кладбищенский приворот отзывы
-отзывы по кладбищенскому привороту
-кладбищенские приворот отзывы кто делал
-отзывы о кладбищенском привороте
Стоит ли делать приворот в Москве? Можно ли найти настоящего мага в Москве у которого правда можно заказать приворот?
Друзья, я не могу пройти мимо и не поделиться своим впечатлением о заказе приворота на мужчину! Моя жизнь казалась полной руин, когда я обнаружила, что мой мужчина не обращает на меня внимания и даже начал демонстрировать интерес к другим женщинам. Это было просто адом!
Я отчаянно пыталась найти выход из этой ситуации, обратилась к нескольким магам в Москве, но результаты были никакими. Я была на грани отчаяния, пока моя подруга не посоветовала мне обратиться к Роману Петровичу с Дальнего Востока. Нашла его сайт https://cmag666.ru где много ценной информации.
Скажу честно, я была в состоянии полного краха, когда позвонила Роману Петровичу. Но он был таким терпеливым и понимающим, что я сразу почувствовала, что могу ему доверять. Я заказала приворот мужчине и надеялась на лучшее.
И что же? Результат меня поразил до глубины души! Мой муж стал совсем другим человеком – внимательным, заботливым и полным энтузиазма! Мы снова влюблены друг в друга как в самом начале наших отношений!
Я просто не могу передать словами, как благодарна Роману Петровичу за то, что он вернул моего мужа ко мне! Если у вас возникли проблемы в отношениях и вы ищете решение, обратитесь к нему без колебаний. Он действительно знает, как помочь в сложных ситуациях!
– гадалка в москве привороты
– привороты по москве
– маг приворот москва
– приворот бесплатно в москве
– черный приворот в москве
Отзывы о приворотах в Екатеринбурге
—————————————–
Хочу поделиться своим незабываемым опытом работы с магом Романом Петровичем с сайта https://cmag666.ru. Проживая в Екатеринбурге, я столкнулась с трудностями в отношениях со своим мужем. Попытки решить проблемы с мужем при помощи местных магов не привели к желаемому результату.
Поиски настоящего мага привели меня на сайт Романа Петровича, и я решила попробовать снова. Будучи из Дальнего Востока, родины шаманов, Роман Петрович вызвал мое доверие, и я обратилась к нему за помощью в восстановлении чувств моего мужа.
С Романом Петровичем мы обсудили мою ситуацию, и он предложил мне кладбищенский приворот для возврата чувств моего мужа. Я решила довериться его опыту и приступила к ритуалу с надеждой на лучшее.
С каждым днем я замечала, как наши отношения становились все более гармоничными и близкими. Муж начал проявлять больше внимания и заботы, а его чувства к мне стали стойчивыми и глубокими. Благодаря кладбищенскому привороту, наш брак стал еще крепче и устойчивее.
Работа Романа Петровича действительно поразила меня. Его профессионализм и внимание к моей ситуации впечатлили меня. Благодаря его помощи я снова чувствую себя счастливой и уверенной в нашем будущем вместе. Он настоящий мастер своего дела, и я безмерно благодарна ему за все, что он сделал для нашей семьи.
Я рекомендую Романа Петровича всем, кто столкнулся с проблемами в своих отношениях. Его помощь – это настоящее чудо, которое может изменить вашу жизнь к лучшему. Спасибо, Роман Петрович, за ваше волшебство и преданность своему делу!
– кто делает приворот екатеринбург
– делающие приворот в екатеринбурге
– кто делает приворот в екатеринбурге
– форум приворот екатеринбург
– приворот екатеринбурга отзывы
Роман Петрович – невероятный маг!
_________________________________
Я обратилась к нему в самый тяжелый период своей жизни, когда мои личные отношения казались безвыходными. Было очень тяжело и безнадежно, пока я не обратилась за помощью к Роману Петровичу. Его поддержка и профессионализм просто перевернули мою жизнь! Заказав ритуал приворота, я не ожидала, что результат будет таким потрясающим. Ритуал помог вызвать чувства в моем любимом человеке, преобразив наши отношения.
Не только Роман Петрович проявил себя как исключительный специалист, но и как замечательный человек, всегда готовый помочь и поддержать. Сейчас мы продолжаем работать с ним над другими вопросами, и я уверена, что Роман Петрович сделает все возможное, чтобы помочь мне. Я настоятельно рекомендую его всем, кто ищет решение своих проблем и желает изменений в своей жизни!
_____________________________________________________
Обращалась к нему через его сайт https://cmag666.ru
Сайт ищут по тегам
– заказать приворот i
– заказала приворот у мага
– заказать привороты у магов
– у кого заказать приворот можно
– заказать приворот в интернете
Изучите уникальные методики и подходы с курсами Академии “МАПС”, чтобы успешно набрать необходимые баллы для аккредитации медсестры. Наше дистанционное обучение предоставит вам все инструменты для достижения этой цели с уверенностью и знанием дела.
Maps-Edu – [url=https://maps-edu.ru/catalog/logopediia?type=professionalnaya-perepodgotovka]логопедия курсы переподготовки[/url]
1xBet: Your Ultimate Betting Destination
1xbet application [url=https://1xbet-app-download-ar.com/#1xbet-program]1xbet program[/url] .
Изучите все аспекты охраны труда с интенсивной программой обучения от Академии “МАПС”. Наши курсы дадут вам знания и практические навыки для обеспечения безопасности на рабочем месте. Станьте незаменимым специалистом в области охраны труда уже сегодня!
Maps-Edu – [url=https://maps-edu.ru/catalog/oxrana-truda?type=professionalnaya-perepodgotovka]профессиональная переподготовка по охране труда[/url]
Доброго!
Аренда автомобиля в Турции через Travellifes оказалась настоящим открытием для меня! Один из главных плюсов – это доступные цены. Я был приятно удивлен, увидев, какие привлекательные предложения предоставляются. Например, за аренду автомобиля на неделю я заплатил всего лишь 150 евро, что значительно экономичнее, чем оплачивать поездки на такси или пользоваться общественным транспортом.
Еще один большой плюс – это удобство. Бронирование автомобиля на сайте https://travellifes.ru заняло всего несколько минут, и вся необходимая информация была мне предоставлена четко и понятно. Кроме того, я был приятно удивлен качеством обслуживания. Представители компании были дружелюбны и отзывчивы, всегда готовы помочь с любыми вопросами.
Еще один плюс – это широкий выбор автомобилей. На сайте я нашел множество вариантов различных марок и моделей автомобилей, среди которых легко выбрать подходящий для своих нужд. Например, я выбрал внедорожник для путешествия по горным дорогам, и он полностью оправдал мои ожидания.
В целом, аренда автомобиля через Travellifes оказалась для меня отличным опытом. Удобство, доступные цены и отличное обслуживание делают эту компанию идеальным выбором для всех, кто планирует путешествие по Турции.
[url=https://travellifes.ru]аренда автомобиля в турции[/url]
аренда машины в турции
аренда автомобилей в турции
авто в аренду турция
какие права нужны в турции для аренды авто для россиян
прокат автомобилей в анталии
аренда машины в кемере турция
аренда авто турция аланья
аренда авто каш турция
Удачи!
Доброго!
Наше недавнее путешествие по Турции стало невероятным благодаря аренде Audi Q5 через https://travellifes.ru ! Забронировать этот великолепный автомобиль было легко – просто перешли на их сайт, выбрали Audi Q5 и указали даты нашего путешествия. Все было сделано всего за несколько кликов!
Когда мы прибыли в аэропорт, наш Audi Q5 уже ждал нас, и мы были поражены его роскошью и комфортом. Этот автомобиль стал нашим верным спутником на протяжении всего путешествия. С его помощью мы могли наслаждаться комфортной поездкой по живописным дорогам Турции, наслаждаться мощностью и элегантностью Audi.
Обслуживание от Travellifes было на высшем уровне. Они предоставили нам всю необходимую информацию о нашем автомобиле и условиях аренды, делая процесс получения и возврата авто максимально простым и удобным. Мы оценили их профессионализм и дружелюбие!
Если вы хотите сделать свое путешествие по Турции по-настоящему незабываемым, я настоятельно рекомендую воспользоваться услугами аренды автомобилей от Travellifes. Они предложат вам лучший выбор автомобилей по выгодным ценам и сделают ваше путешествие максимально комфортным и удобным.
[url=https://travellifes.ru]surprise аренда авто[/url]
цены на аренду машин в Турции
аренда машины в турции без кредитной карты
avis аренда автомобилей турция
рентакар турция
снять машину в турции цены
local rent турция отзывы
долгосрочная аренда авто в турции
забронировать машину в турции
Удачи!
В нашем быстром мире каждый ищет возможности получить финансовую помощь мгновенно. Если вы хотите изучить все доступные варианты, то наш сайт предлагает уникальный список, где собраны [url=https://mikro-zaim-online.ru/mfo-2023/]все мфо[/url]. Найдите идеальное предложение, которое подойдет именно вам, благодаря нашему обширному каталогу новейших и проверенных организаций.
Изучите все аспекты охраны труда с интенсивной программой обучения от Академии “МАПС”. Наши курсы дадут вам знания и практические навыки для обеспечения безопасности на рабочем месте. Станьте незаменимым специалистом в области охраны труда уже сегодня!
Maps-Edu – [url=https://maps-edu.ru/catalog/pozarnaia-bezopasnost]пожарная безопасность обучение дистанционно[/url]
svetlanamag ru – svetlanamagg @ yandex ru
Магия Светланы действительно работает! Я заказала у нее ритуал приворота, чтобы вернуть моего бывшего парня. И через несколько недель он вернулся ко мне. Я не могу поверить, что это сработало, но я счастлива вновь!
-настоящие и проверенные маги
-отзывы о проверенных магах
-проверенные маги барнаул
-проверенный белый маг
Откройте для себя мир логопедии с профессиональными курсами от Академии “МАПС”. Наши дистанционные программы предлагают глубокие знания и практические навыки, необходимые для работы с различными речевыми нарушениями. Повысьте свою квалификацию и помогите людям найти свой голос с нашими курсами логопеда.
Maps-Edu – [url=https://maps-edu.ru/catalog/oxrana-truda]специалист по охране труда переподготовка[/url]
Отзыв о привороте маг Александра (magpa666 @ bk ru) – magpomosh ru
Я решил обратиться к магу Александре с сайта magpomosh ru (magpomosh ru) после того, как моя жизнь стала полна разочарований и неудач в личных отношениях. На протяжении длительного времени я пытался найти выход из сложившейся ситуации, но все мои усилия оказывались напрасными.
Встреча с Александрой стала для меня настоящим откровением. Она внимательно выслушала мои проблемы и предложила мне ряд решений, среди которых был и ритуал приворота. Я согласился, хотя и был в некотором сомнении.
Однако результат превзошел все мои ожидания. Через некоторое время после проведения ритуала я заметил изменения в отношениях с партнером – они стали более гармоничными и теплыми. Мы начали понимать друг друга лучше, а наша любовь стала только крепче. Благодаря магу Александре я снова обрел веру в свои силы и смог по-настоящему ощутить радость жизни. Спасибо вам, Александра, за ваш талант и помощь!
Теги – отзыв magpomosh ru отзыв magpa666 @ bk ru
_________________________________________________________
Сайт ищут по тегам:
настоящие маги сайт настоящие маги отзывы адрес проверенного мага
настоящий маг форум проверен маг на себе настоящий маг который помог
официальный сайт магов россии список настоящих союз анастасия проверенный маг ворожея отзывы есть проверенный маг
списки проверенных магов настоящий маг помощь настоящий маг россия
После множества неудачных попыток найти свою идеальную половинку, я обратился к магу Роману Петровичу за помощью. Его Вуду-приворот с сайта cmag666.ru помог мне привлечь внимание девушки моей мечты. Сейчас мы встречаемся, и я не могу поверить, что все это стало возможным благодаря ритуалу Романа Петровича.
Запросы сайта в поиске
___________________________________________________________
отзывы о привороте вуду на куклу приворот вуду последствия отзывы привороты вуду отзывы
отзывы приворота вуду приворот на куклу вуду отзывы отзывы о приворотах вуду
Доброго!
Промокоды для интернет-магазина Эльдорадо – это уникальные коды, которые можно использовать при оформлении заказа на официальном веб-сайте компании.
Они предоставляют дополнительные преимущества клиентам в виде скидок на определенные товары или услуги, бесплатной доставки и других бонусов.
Как найти такие промокоды для Эльдорадо? Обычно они предоставляются в рамках специальных акций компании, которые могут быть организованы
на ее официальном веб-сайте, в социальных сетях или на специализированных ресурсах, например, на сайте free-promocode.ru,
который предлагает самые свежие и проверенные промокоды
Сайт самых свежих и проверенных промокодов магазина Эльдорадо https://free-promocode.ru
Удачных покупок!
бесплатные промокоды Эльдорадо
Лучшие предложения Эльдорадо
Промокоды для экономии в Эльдорадо
актуальный промокод Эльдорадо
Промо-коды для выгодных покупок в Эльдорадо
Удачи!
Günaydın!
Son zamanlarda Mostbet tr, п»ї[url=https://mosttr-2.xyz]mostbet guncel giris[/url] çevrimiçi bahis endüstrisindeki liderlerin arasında kendini başarılı bir şekilde kanıtlamıştır. Sadece profesyoneller değil,
kumar oynamaya yeni başlayanlar da bu platformu spor bahisleri dünyasında güvenilir bir ortak olarak gönül rahatlığıyla tercih ediyorlar.
Her ziyaretçi, platformun sunduğu heyecan dolu deneyimin tadını çıkarabilir.
Çok çeşitli popüler spor etkinliklerinin yanı sıra, site golf, tenis veya beyzbol gibi daha az yaygın olan bahis disiplinlerini de sunmaktadır.
Yenilikçi yaklaşım ve geniş seçenekler sayesinde herkes için bir şeyler bulunmaktadır
Sitedeki her sey https://mosttr-2.xyz
Kumarhane gГјvenilir mi Mostbet
Kumarhane stratejileri Mostbet
Kumarhane indirimleri Mostbet
Kumarhane para Г§ekme Mostbet
Kumarhane yasal mД± Mostbet
Çevrimiçi kumar Mostbet
Kumarhane bonuslarД± Mostbet
Kumarhane rehberi Mostbet
Iyi sanlar!
Günaydın!
Son yıllarda Mostbet tr, п»ї[url=https://mosttr-2.xyz]mostbet guncel giris[/url] çevrimiçi bahis endüstrisinde liderlerin arasında başarılı bir şekilde yerini almıştır. Sadece uzmanlar değil,
kumar oynamaya yeni başlayanlar da bu platformu spor bahisleri dünyasında güvenilir bir seçenek olarak tercih etmektedir. Her ziyaretçi,
platformun sunduğu heyecan dolu deneyimin tadını çıkarabilir.
Popüler spor etkinliklerinin yanı sıra, site golf, tenis veya beyzbol gibi daha az yaygın olan bahis disiplinlerini de sunmaktadır.
Geniş seçenekler ve yenilikçi yaklaşımı ile herkes için bir şeyler bulunmaktadır
Sitedeki her sey https://mosttr-2.xyz
Kumarhane yasal mД± Mostbet
Kumarhane para yatД±rma Mostbet
Kumarhane kazanma tГјyolarД± Mostbet
Kumarhane Еџans oyunlarД± Mostbet
Kumarhane hakkД±nda bilgi Mostbet
Kumar siteleri Mostbet
Kumarhane gГјvenilir mi Mostbet
Kumarhane hileleri Mostbet
Iyi sanlar!
Отзывы – Провели – приворот сильный на женатого https://cmag666.ru Ватсап 8 (984) 286-12-65
проверены маги – хороший проверенный маг
Маг Мария Степановна слаабо – заказала ритуал на деньги у https://cmag666.ru Ватсап 8 (984) 286-12-65
как сделать приворот на бывшего мужа – как убрать приворот с сына
great article
svetlanamag ru – svetlanamagg @ yandex ru
Спасибо магу Светлане за ее ритуал приворота! Я заказала его для того, чтобы привлечь внимание парня, которого я давно хотела. Результат превзошел все мои ожидания – он стал проявлять ко мне больше интереса, чем когда-либо!”
-посоветуйте проверенного мага
-как по настоящему стать белым магом
-настоящие черные маги
-проверенные маги краснодара
отзывы о маге Астарт Вард magastartvard . ru отзывы о маге Астарт Вард
______________________________________________________
magastartvard . ru отзывы
_____________________________________________________
Я хотела бы поделиться своим восхищением и благодарностью магу Астарту Варду за его профессионализм и удивительные способности в области магии и эзотерики. Я обратилась к нему с просьбой о помощи в решении личных проблем и вопросов, связанных с моим духовным развитием.
С первого же контакта с магом я почувствовала его внимание и заботу. Он внимательно выслушал мои проблемы и предложил индивидуальный подход к их решению. Его глубокие знания и опыт в области магии и эзотерики были очевидны с первых минут общения.
Маг Астарт Вард предложил мне не только решение конкретных проблем, но и помог мне понять их корни и причины. Его советы и рекомендации были не только полезными, но и вдохновляющими. Я почувствовала, что он искренне заинтересован в моем благополучии и успехе.
Благодаря его помощи и поддержке я смогла преодолеть многие трудности и проблемы, с которыми столкнулась в жизни. Его работа действительно изменила мое отношение к себе и к окружающему миру. Я глубоко благодарна магу Астарту Варду за его ценный вклад в мое духовное развитие и благополучие. Я рекомендую его услуги всем, кто ищет профессиональную помощь в области магии и эзотерики.
magastartvard . ru
______________________________________________________________
Астарт Вард отзывы форум
Добрый день
https://finance-online.kz — ведущая финансовая группа, ориентированная на предоставление комплексных финансовых услуг для наших клиентов.
Наша экспертиза включает в себя различные виды кредитования, включая банковские кредиты, микрозаймы и ипотеку. Мы стремимся к высокому уровню обслуживания,
прозрачности и надежности во всех аспектах нашей работы.
[url=https://finance-online.kz]займер семей[/url]
колл центр банка центркредит
robo zaimer
займ кз онлайн
все микрокредиты казахстан
жусан банк колл центр номер телефона
фридом финанс номер
Удачи!
Крастко – Отзывы magpomosh ru – сайт – привороты отзывы советы
Магический сайт magpomosh .ru – отзывы могу оставить только хорошие.
Маг Александра – настоящий профессионал своего дела. Ее ритуалы на защиту от негатива помогли мне избежать неприятностей и сохранить свою энергию
_________________________________________________________
Сайт ищут по тегам:
черные маги настоящие как найти настоящего мага для приворота список проверенных магов
черный маг настоящий кто поможет найти настоящего мага проверенные маги барнаул
маги настоящие помощь найти настоящего мага для приворота отзывы маг настоящий помогу
настоящее сокровище найдите следы мага бездны настоящий сильный маг настоящие маги помогите найти
Приветствую всех!
Стоимость демонтажа дома зависит от различных факторов, таких как местоположение, тип дома, его площадь, количество этажей и сложность фундамента.
Чтобы узнать точную стоимость демонтажа вашего дома, свяжитесь со специалистами нашей компании, которые проведут оценку и подготовят смету расходов. Заходите на https://taurusweb.ru – одну из лучших демонтажных компаний на рынке!
Если у вас есть дополнительные вопросы или вы хотите обсудить ваши потребности, обращайтесь к нашим специалистам. Мы стремимся обеспечить максимально комфортный и безопасный процесс демонтажа вашего дома.
[url=https://taurusweb.ru]снос дома и вывоз мусора[/url]
Снос дома и вывоз мусора
Разборка домов
Демонтаж фундамента дома
Разборка домов и вывоз мусора
Разборка дома в Московской области
Демонтаж фундамента
Разборка фундаментов
Разбор дома и вывоз мусора
Удачи!
Добрый день
Наша компания предлагает широкий спектр банковских продуктов и услуг, включая кредитование, инвестирование и управление финансами, полный список услуг доступен
на нашем сайте https://finance-online.kz. Мы работаем над тем, чтобы обеспечить наших клиентов надежными и выгодными финансовыми решениями, способствующими их
успеху и процветанию.
[url=https://finance-online.kz]быстрый займ онлайн кз[/url]
займы 18 лет казахстан
короткий номер евразийского банка
займы в казахстане
номер бцк
короткий номер народного банка
коке кз
Удачи!
В этом году я решил осуществить давнюю мечту – путешествие по Европе. Однако, когда я начал планировать поездку, я обнаружил, что мне не хватает средств для полного покрытия расходов. Моя кредитная история была в порядке, но я не хотел обременять себя долгосрочным кредитом. Тогда я обратился к МФО 2024 года, которые предлагают краткосрочные займы под низкий процент. Мне нужно было всего 15 000 рублей, чтобы закрыть пробел в бюджете путешествия. Процедура получения займа была настолько быстрой и удобной, что я смог дополнить свой бюджет и отправиться в путешествие уже на следующей неделе.
Если вам срочно нужны деньги на лечение, обучение или любые другие цели, и при этом вам важно избежать банковских отказов, предлагаю воспользоваться ссылкой [url=https://dzen.ru/a/ZdkGEBXjXn3HGGGw]займ без отказа в новых МФО[/url]. Там вы найдете актуальные предложения от МФО, которые помогут вам в любой финансовой ситуации.
Полный релакс у моря и на пляже
горящие путевки в турцию все включено [url=https://anex-tour-turkey.ru]https://anex-tour-turkey.ru[/url] .
Exceptional, impressive work
linetogel
Привет Всем!
В мире народных художественных промыслов Кировской области таится богатство истории и традиций. Дымковская игрушка, вятское кружево, резьба по дереву — здесь каждый из видов ремесел несет в себе многовековую мудрость искусства. Сегодня, в эпоху быстрого развития, эти художественные традиции не только сохранились, но и активно развиваются. В Кирове процветают капокорешковый и токарный промыслы, инкрустация соломкой, гончарство, ткачество, искусство ковки и литья. Это не просто ремесла, а целый мир, где каждый предмет является настоящим произведением искусства. Особую ценность придает этим промыслам традиционность и непрерывность развития. Каждый мастер владеет уникальными методами работы с природными материалами, сохраняя самобытность техник и технологий. Именно такая связь с историей делает кировские художественные промыслы такими удивительными и ценными. Правительство Кировской области активно поддерживает сферу народных художественных промыслов. Специальные программы направлены на сохранение и развитие этого культурного богатства, стимулирование творческого потенциала мастеров, а также создание связей между производителями и рынком.
Переходя от ремесел к численности населения, мы видим, что Киров – это город с богатой историей и культурным наследием. Согласно данным Всероссийской переписи населения 2020 года, Киров занимает 43-е место по численности населения среди 1120 городов России. Это свидетельствует о том, что город привлекает своим уникальным обликом и жизненным стилем. Интересный факт: в половом соотношении преобладает женское население, составляя 56%. Национальный состав города также разнообразен, где 96,6% населения – русские. Трудоспособное население, достигающее 63% от общей численности, активно участвует в экономической жизни города. Переходя к вятским говорам, мы оказываемся в удивительном лингвистическом пространстве. Вятские говоры относятся к севернорусскому наречию и представляют собой интересный лингвистический феномен. Сложившаяся под влиянием разных языковых и культурных традиций, речь вятчан приобрела уникальные черты.
Фонетические особенности вятских говоров https://sco2009.ru/ включают оппозицию кратких и долгих звуков, произношение мягкого “р” перед задненёбными согласными и наличие исконно мягких шипящих и ц. Морфологически вятские говоры отличаются смешением окончаний и наличием постпозитивных частиц. И, наконец, приподнимаем завесу над краеведческим музеем. Это место, где история, природа и культура Вятского края предстают перед посетителями во всей красе. Здесь вы найдете уникальные материалы по истории и природе региона, коллекции минералов и пород, а также экзотических животных. Театральная жизнь Кирова также заслуживает внимания. Драматический театр, основанный в 1877 году, стал старейшим театром города. Его репертуар включает в себя как классические произведения, так и спектакли современных отечественных и зарубежных драматургов. Таким образом, Киров — это не только город с богатым культурным наследием и интересной историей, но и место, где народные традиции и современность гармонично переплетаются, создавая уникальный облик и неповторимый характер.
[url=https://sco2009.ru]новости кирова свежие[/url]
кто кому в семье приходится
наиля аскер заде муж
втб костин и наиля аскерзаде
Костин и Наиля Аскерзаде
глава втб банка костин андрей биография
андрей леонидович костин фото
кем мне будет приходится падчерица двоюродного брата
наиля аскер-заде биография личная
Удачи!
Здравствуйте!
Кировская область, расположенная в Приволжском федеральном округе, поражает своим разнообразием и уникальностью https://mosprize.ru/. С обширной территорией в 120 374 км? и населением более 1,1 миллиона человек, эта область вкладывает свою душу в богатое наследие Волго-Вятского экономического района.
Национальный мозаичный портрет Кировской области включает русских, татар, марийцев, удмуртов, украинцев и другие этнические группы, что создает удивительное культурное слияние. Эта мозаика также отражена в народных промыслах, таких как дымковская расписная глиняная игрушка, вятские кружева и другие художественные изделия. Область богата историей, что подчеркивают её тысячи памятников истории, культуры и архитектуры. В 817 публичных библиотеках и 40 музеях раскрывается удивительный мир знаний и искусства.
Особенным элементом являются вятские говоры, отличающиеся уникальными фонетическими и морфологическими особенностями. Это наследие формировалось во взаимодействии с местными финно-угорскими и тюркскими языками. И в завершение, Кировская область привлекает своими национальными праздниками, традициями и обычаями. Таким образом, в каждой детали этого уникального региона можно обнаружить исключительное богатство и культурное разнообразие, готовые встретить и впечатлить каждого гостя.
[url=https://mosprize.ru]день огурца киров[/url]
культура и традиции вятчан
шабалинский край вконтакте
традиции народа кировской области
гостинцы из кирова
шабалино кировская область
национальные праздники кировской области
культура вятского края
как проявил себя петр 1 в подавлении бунта 1689г.?
Удачи!
[url=https://www.yachtrentalsnirof.com]yachtrentalsnirof.com[/url]
A locate to make an analogy with prices in the interest of renting yachts, sailboats, catamarans around the humankind and rent your yacht cheaper.
yachtrentalsnirof.com
Быстрые и надежные грузоперевозки
грузчики и перевозка [url=moving-company-kharkov.com.ua]moving-company-kharkov.com.ua[/url] .
Если Вы хотели найти [url=https://mudryakova.ru/work/rooms/childrens/]дизайн детской комнаты[/url] в сети интернет, то Вы на нужном пути. Звоните по номеру телефона +7(812)408-00-07 или пишите на указанном сайте. Студия расположена по адресу: г. Санкт-Петербург, ул. Мебельная, д. 49/92. График работы по будням с 9:00 до 19:00. Наши консультанты дадут ответы на любые возникающие вопросы, дадут советы по вашему проекту и в быстром времени перейдут к заключению договора и будущей работе.
Дизайн интерьера СПБ mudryakova.ru
great article
Günaydın!
Son yıllarda 1win tr, çevrimiçi bahis endüstrisinde lider konumunu başarılı bir şekilde sağlamlaştırmıştır.
Sadece uzmanlar değil, kumar oynamaya yeni başlayanlar da bu platformu spor bahisleri dünyasında güvenilir bir tercih olarak seçmektedirler.
Her ziyaretçi, [url=https://academypops.com]1win guvenilir mi[/url] platformun sunduğu heyecan dolu deneyimin tadını çıkarabilir.
Popüler spor etkinliklerine ek olarak, site golf, tenis veya beyzbol gibi daha az bilinen bahis disiplinlerine de yer vermektedir.
Geniş seçenekler ve yenilikçi yaklaşımıyla herkesin ilgisini çekecek bir şey bulunmaktadır
Sitedeki her sey https://academypops.com
Kumarhane hakkД±nda bilgi 1Win
Çevrimiçi kumar 1Win
Kumarhane oyunlarД± 1Win
Kumarhane gГјvenilir mi 1Win
Kumarhane para kazanma 1Win
Kumarhane bonuslarД± 1Win
Kumarhane hileleri 1Win
Kumarhane deneme bonusu 1Win
Iyi sanlar!
Что такое контент-маркетинг и как его использовать в строительстве?
раскрутка строительного сайта [url=https://seo-prodvizhenie-sajtov-stroitelnyh-kompanij.ru/]https://seo-prodvizhenie-sajtov-stroitelnyh-kompanij.ru/[/url] .
Günaydın!
Son zamanlarda 1win tr, çevrimiçi bahis endüstrisindeki liderler [url=https://academypops.com]1win guvenilir mi[/url] arasında başarılı bir şekilde kendini kanıtlamıştır.
Sadece profesyoneller değil, kumar oynamaya yeni başlayanlar da bu platformu spor bahisleri dünyasında güvenilir bir tercih olarak gönül
rahatlığıyla tercih etmektedirler. Her ziyaretçi, platformun sunduğu heyecan dolu deneyimin tadını çıkarabilir.
Çeşitli popüler spor etkinliklerinin yanı sıra, site golf, tenis veya beyzbol gibi daha az yaygın olan bahis disiplinlerini de sunmaktadır.
Yenilikçi yaklaşımı ve geniş seçenekleriyle herkes için bir şeyler bulunmaktadır
Sitedeki her sey https://academypops.com
Kumarhane taktikleri 1Win
Kumarhane oyunlarД± 1Win
Kumarhane oyunlarД± Г§eЕџitleri 1Win
Kumar siteleri 1Win
Kumarhane para yatД±rma 1Win
Çevrimiçi kumar 1Win
Kumarhane kazanma tГјyolarД± 1Win
Kumarhane siteleri 1Win
Iyi sanlar!
Як обрати спецтехніку за потребами
спец машини [url=http://www.spectehnika-sksteh.co.ua]http://www.spectehnika-sksteh.co.ua[/url] .
System and scheme: how to achieve results while maintaining relationships
The best site about Power business relationship
По вопросу [url=https://mudryakova.ru/services/]дизайн-проект квартиры[/url] заходите на данный онлайн сайт. Работаем с совершенно разными проектами, как под ключ, так и с едиными самостоятельными комнатами. Начинаем работу, естественно, со общения с вами, ведь каждый интерьер готовится под собственника квартиры, целую семью или руководителя хостела. У каждого человека личные потребности, цели помещения, стили жизни и нравы, а также мечты и пожелания. Мы пытаемся учесть все составляющие и сочетать их в оригинальном дизайн проект.
Дизайн СПБ mudryakova.ru
Если Вы хотели найти [url=https://mudryakova.ru/services/disayn-kottedgei-zagorodnih-domov/]дизайн интерьера дома[/url] в сети интернет, то Вы на нужном пути. Звоните по номеру телефона +7(812)408-00-07 или пишите на указанном сайте. Студия находится по адресу: г. Санкт-Петербург, ул. Мебельная, д. 49/92. Время работы с пн по пт с 9:00 до 19:00. Наши специалисты дадут ответы на любые оставшиеся вопросы, дадут советы по вашему проекту и в быстром времени приступят к заключению договора и предстоящей работе.
Разработка дизайн-проекта СПБ mudryakova.ru
Продажа кондиционеров с установкой
кондиционер для комнаты [url=prodazha-kondicionera.ru]prodazha-kondicionera.ru[/url] .
20. Эффективные методы экономии при монтаже кондиционера
стоимость кондиционера с установкой [url=montazh-kondicionera-moskva.ru]montazh-kondicionera-moskva.ru[/url] .
как узнать что маг настоящий – Маг Ангелина 89853905910 отзывы
______________________________________________________
Маг Ангелина – настоящий профессионал своего дела! Я обратилась к ней с просьбой помочь мне в привлечении успеха в моем бизнесе. Она провела для меня ряд ритуалов и предложила несколько амулетов для усиления энергии. Уже через несколько недель после начала работы с ней, я заметила положительные изменения в своем бизнесе. Маг Ангелина очень профессиональна и дружелюбна. Я рекомендую ее всем, кто ищет помощи в области магии и энергетики.
Советы
19. Как купить хостинг с SSL-сертификатом для безопасности
выделенный сервер [url=https://www.kish-host.ru/]https://www.kish-host.ru/[/url] .
По запросу [url=https://o-gogo.ru/]женские оправы купить в москве[/url] мы Вам обязательно поможем. Очки — аксессуар, который эксплуатируют практически все. Летом это необходимый атрибут, который спасает глаза от вредного УФ излучения. Совсем скоро наступит летняя пора и не забудьте заблаговременно позаботиться и осчастливить себя хорошим и необходимым аксессуаром. Помимо того, очки — это универсальный подарок для любого человека, любого возраста и пола..
Maximize your shoe-shopping efficiency with Zesc Analytics! Our platform is revolutionizing the way people shop for shoes online by providing in-depth price comparisons, historical price trends, and real-time notifications on price drops. Tailor your shopping experience to fit your personal style and budget. With Zesc Analytics, you have the power to track, compare, and purchase shoes at the best possible price. Embrace the future of footwear shopping. Start using Zesc Analytics today to step smartly into savings and style!
Analytics.zesc.pro – [url=https://analytics.zesc.pro/]discounted work shoes[/url]
Почему SEO важен для строительных компаний?
продвижение строительных [url=https://seo-prodvizhenie-sajtov-stroitelnyh-kompanij.ru/]https://seo-prodvizhenie-sajtov-stroitelnyh-kompanij.ru/[/url] .
Don’t just buy shoes, invest in your style smartly with Zesc Analytics! We’re not just a platform; we’re your secret weapon in navigating the vast ocean of online shopping. With our advanced tracking and personalized alerts, you’re always ahead of the game. Why settle for less when you can have the best for less? Join the savvy shoppers using Zesc Analytics and turn your shoe game from drab to fab without breaking the bank!
Analytics.zesc.pro – [url=https://analytics.zesc.pro/]online footwear discounts[/url]
Демо игровых автоматов позволяют попробовать поиграть в казино, не тратя реальные деньги. Это отличные метод испытать удачу, узнать новые игры и разработать стратегии без каких-либо обязательств.
Благодаря огромному количеству игровых автоматов с демо игрой, каждый игрок найдет что-то по своему вкусу. От классических трехбарабанных слотов до современных видеослотов с захватывающей графикой и увлекательными бонусными раундами.
Играть в [url=https://lucky-slots.ru/]демо игровые автоматы бесплатно[/url] просто и легко. Вам не нужно регистрироваться и пополнять баланс – просто выберите интересующую вас игру и начинайте вращать барабаны. Это отличная возможность попробовать разные стратегии ставок, изучить выигрышные комбинации и просто насладиться процессом игры.
Демо-режим также позволяет вам оценить процент отдачи игрового аппарата и определить, подходит он вам или нет. Вы можете играть сколько угодно долго, не боясь за свои деньги.
Куда обратиться за ремонтом холодильника Атлант? У нас!
ремонт холодильников атлант в минске на дому [url=https://remont-holodilnikov-atlant.ru/]ремонт холодильников атлант[/url] .
Navigating the overwhelming world of online shoe shopping can be daunting, but Zesc Analytics can transform this experience. By using this platform, you can track price trends and historical data, helping you buy at the right time. My advice? Use Zesc Analytics to monitor your must-have shoes and purchase them when they hit your target price. This proactive approach to shopping not only saves money but also makes the experience more rewarding.
Analytics.zesc.pro – [url=https://analytics.zesc.pro/]inexpensive shoes online[/url]
Спасибо за информацию. В благодарность предлагаю расслабиться и окунуться в мир азарта:
[url=https://vavada-registraciya1.online/]Вавада casino[/url] – это простой способ, позволяющий вам окунуться в мир азартных игр в одном из лучших онлайн-казино. Для начала, откройте официальный сайт Вавада и нажмите на кнопку “Регистрация”. Затем заполните простую форму регистрации своими личными данными.После успешной регистрации вы получите доступ к широкому выбору азартных игр, таких как слоты, рулетка, блэкджек и многое другое. Казино Вавада также предлагает щедрые бонусы и промоакции, которые помогут вам увеличить свои шансы на победу. Играйте с умом и делайте ставки с лимитами. Регистрация в казино Vavada – это отличный способ насладиться азартными играми, получить удовольствие и, вероятно, выиграть хорошие деньги.
Услуги по ремонту холодильников Атлант: оперативно и качественно.
ремонт холодильников атлант цена [url=https://remont-holodilnikov-atlant.ru/]ремонт холодильников атлант на дому[/url] .
Демо игровых автоматов предлагают уникальную возможность попробовать поиграть в казино, не тратя при этом своих финансовых средств. Это идеальный способ попробовать себя, узнать новые игры и разработать стратегии без каких-либо обязательств.
Благодаря огромному количеству игровых автоматов с демо игрой, каждый игрок найдет что-то по своему вкусу. От классических трехбарабанных слотов до современных видеослотов с крутейшей графикой и увлекательными бонусными раундами.
Играть в [url=https://lucky-slots.ru/sloty-s-nakopitelnym-bonusom/]игровые автоматы бесплатно с накопительными бонусами[/url] легко и удобно. Вам не нужно регистрироваться и пополнять баланс – просто подберите подходящий игровой автомат и начните играть. Это отличная возможность попробовать разные стратегии ставок, изучить выигрышные комбинации и просто кайфануть в игру в казино.
Демо-режим также позволяет вам оценить процент отдачи игрового автомата и определить, подходит он вам или нет. Вы можете играть беспконечно долго, не боясь за свои деньги.
Онлайн казино Беларусь: наслаждайтесь азартом и выигрывайте крупные суммы!
онлайн казино [url=https://onlinecasinobelarus.by/]казино беларусь[/url] .
Бесплатные игры в онлайн казино Беларусь: отличный способ развлечься без риска
онлайн казино [url=https://onlinecasinobelarus.by/]казино беларусь[/url] .
Embark on a journey to smart, stylish footwear with Zesc Analytics at your side. This isn’t just about buying shoes; it’s about revolutionizing your shopping habits to ensure you’re always ahead of the curve, without denting your wallet. With real-time alerts, personalized preferences, and comprehensive price comparisons, Zesc Analytics is more than a platform; it’s your personal shoe-shopping advisor. Make informed decisions, stay on top of the latest trends, and save money while doing it. Step into the future of shopping with Zesc Analytics and transform the way you view footwear!
Analytics.zesc.pro – [url=https://analytics.zesc.pro/]shoes on sale[/url]
Душевые кабины, ванные комнаты sansmail.ru
Ванная комната в настоящее время интерпретируется одним из первостепенных помещений в квартире, где к обустройству нужно подходить с умом, чтобы потом не нужно было переделывать. Сантехника приобретается на длительное время, поэтому Вы должны быть убеждены в её качестве и в удобстве при предстоящем использовании. Магазин sansmail.ru представляет широкий ассортимент сантехники от фирменных производителей различных стран, с долгим сроком службы и гарантией.
Что касается [url=https://sansmail.ru/catalog/brands/cersanit/mebeldlyavannoy]мебель для ванной cersanit[/url] переходите на наш интернет сайт. В данное современное время дизайнеры и даже сами обладатели жилья делают из простых помещений красивые произведения искусства и супер комфортные условия. Ванная комната не является исключением, из них получаются шикарные интерьеры с наличием душевой кабины, унитаза и раковин. В данном в каталоге Вы сможете найти: мебель для ванной, душевые кабины, сауны, двери, трапы, унитазы, системы инсталляции, раковины, полотенцесушители, светильники, аксессуары и многое другое.
Наш магазин расположен по адресу: г. Москва, МКАД 41 км, 4, стр. 1. Звоните по контактному телефону +7(499)444-17-64 и мы предоставим Вам профессиональную рекомендацию. В офлайн магазине Вы всегда сможете оценить и потрогать собственноручно сантехнику, мебель, а не делать заказ на авось, как в других интернет-магазинах. Также у нас осуществляется доставка, как по городу Москва и МО, так и по всем городам РФ.
Если Вы хотели найти [url=https://sansmail.ru/catalog/dushevie-poddony/dushevoy-poddon-wemor-100-41-s.html]душевые поддоны размеры 100 100[/url] то Вы на верном пути. Мы всегда готовы пойти на помощь с подбором и подобрать именно то, что Вы искали. Также можно заказать на сайте sansmail.ru или по вышеуказанному телефону – установку товаров, купленных в нашем магазине. Пишите, приходите, мы будем рады с вами работать.
[url=http://one-xbet-apk-fr.com]http://one-xbet-apk-fr.com[/url]
To log in, click the “Login” button on the official website of the bookmaker and write your narcotic addict materials – put down your email sermon and password.
http://www.one-xbet-apk-fr.com
Спасибо за информацию. В благодарность предлагаю расслабиться и окунуться в мир азарта:
[url=https://vavada-registraciya1.online/]Vavada[/url] – это крутой метод, который позволит вам окунуться в мир азартных игр в одном из лучших онлайн-казино. Зайдите на официальный сайт Vavada и нажмите на кнопку “Регистрация”. Затем заполните простую форму регистрации, указав свои личные данные.Успешно зарегистрироваашись вы получите доступ ко всему набору азартных игр, таких как слоты, рулетка, блэкджек и многое другое. Казино Вавада также щедро раздрает бонусы, которые помогут вам увеличить свои шансы на победу. Не забывайте играть ответственно и устанавливать лимиты на свои ставки. Регистрация в казино Вавада – это отличный способ насладиться азартными играми, зарядиться положительными эмоциями и, вероятно, выиграть хорошие деньги.
linetogel
Демо игровых слотов предлагают уникальную возможность попробовать поиграть в казино, не тратя реальные деньги. Это отличные метод попробовать себя, узнать новые игры и разработать стратегии без каких-либо обязательств.
Благодаря огромному количеству игровых автоматов с демо игрой, каждый игрок найдет что-то по своему вкусу. От классических трехбарабанных слотов до современных видеослотов с крутейшей графикой и увлекательными бонусными раундами.
Играть в [url=https://lucky-slots.ru/ehmulyatory-igrovyh-avtomatov/]бесплатные эмуляторы игровых автоматов[/url] легко и удобно. Вам не нужно регистрироваться и пополнять баланс – просто подберите подходящий игровой автомат и начните играть. Это отличная возможность попробовать разные стратегии ставок, изучить выигрышные комбинации и просто насладиться процессом игры.
Демо-режим также позволяет вам сделать оценку отдачи игрового аппарата и определить, как он подходит вам по стилю и предпочтениям. Вы можете играть беспконечно долго, не беспокоясь о своем бюджете.
Если Вы хотели найти [url=https://sansmail.ru/catalog/dushkabiny/dushevaya-kabina-deto-l-520.html]душевая кабина 520[/url] то Вы на правильном пути. Мы всегда готовы пойти на помощь с подбором и подобрать определенно то, что Вы планировали получить. Также возможно заказать на сайте sansmail.ru или по вышеуказанному телефону – установку сантехнических предметов, приобретенных в нашем магазине. Пишите, приезжайте, мы будем счастливы с вами сотрудничать. SanAmail магазин находится по адресу: г. Москва, МКАД 41 км, 4, стр. 1. Звоните по телефону +7(499)444-17-64 и мы дадим Вам квалифицированную консультацию.
Если Вы планировали найти [url=https://sansmail.ru/dushevie-poddon-1000h1000-mm]душевой поддон 100х100[/url] то Вы на правильном пути. Мы всегда готовы прийти на помощь с подбором и продать конкретно то, что Вы хотели получить. Также можно оформить заказ на сайте sansmail.ru или по указанному телефону – установку товаров, приобретенных в нашем онлайн магазине. Пишите, приходите, мы будем счастливы с вами сотрудничать. Наш магазин расположен по адресу: г. Москва, МКАД 41 км, 4, стр. 1. Звоните по контактному телефону +7(499)444-17-64 и мы дадим Вам профессиональную консультацию.
Hello, World!
Hey there, mate! Greetings from your favorite surfing capybara!
How’s the surf today?
Ready to catch some gnarly waves together?
https://capybara444.wordpress.com
Good luck!
Демо игровых автоматов позволяют попробовать поиграть в казино, не тратя при этом своих финансовых средств. Это идеальный способ испытать удачу, узнать новые игры и разработать стратегии без расхода средств.
Благодаря широкому выбору демо-слотов, каждый игрок найдет что-то по своему вкусу. От классических трехбарабанных слотов до современных видеослотов с захватывающей графикой и увлекательными бонусными раундами.
Играть в [url=https://lucky-slots.ru/]слоты играть бесплатно без регистрации[/url] просто и легко. Вам не нужно создавать аккаунт или делать депозит – просто подберите подходящий игровой автомат и начните играть. Это отличная возможность попробовать разные стратегии ставок, изучить выигрышные комбинации и просто кайфануть в игру в казино.
Демо-режим также позволяет вам сделать оценку отдачи игрового аппарата и понять, подходит он вам или нет. Вы можете играть сколько угодно долго, не беспокоясь о своем бюджете.
Hello, World!
Hey there, mate! Greetings from your favorite surfing capybara!
How’s the surf today?
Ready to catch some gnarly waves together?
https://capybara235.wordpress.com
Good luck!
wow, amazing
wow, amazing
Impressive, fantastic
Хорошая статья, спасибо!
В качестве благодарности поделюсь с вами информацией: деревянные наличники на оконные проемы в Санкт-Петербурге для для загородных домов являются популярным выбором среди владельцев домов.
[url=https://kub-era.ru/nalichniki]Наличник лиственница купить[/url] для домов – это превосходный вариант, сочетающий в себе отличный внешний вид, прочность и экологическую чистоту. Если у вас есть желание придать своему коттеджу особый шарм, рассмотрите наличники из дерева.
В СПб работает много организаций, специализирующихся на изготовлении и установке деревянных наличников. Одна из них – компания КубЭра. Предлагает широкий выбор наличников на любой вкус.
Wow, this piece of writing is nice, my younger sister is analyzing such things, thus I am going to tell her.
Here is my web site :: услуги адвоката банки; sk-bc.ru,
Привет, форумчане! Сегодня хочу поделиться своим опытом в Эльдорадо Казино. Это место, где золото льется рекой, а азарт находится на каждом шагу.
Казино предоставляет много бонусов, и для новичков – 100% за первый депозит! Я начал с небольшой суммы, и мне выдали бонус вплоть до 10 000 рублей, но нужно отыграть его х49, что довольно интересно – 30 дней в азартном вихре!
Еще один бонус за пополнение счета. Хоть это и 5%, но вейджерные условия лояльные – всего в двойном размере. А еще есть бонус на день рождения, так что каждый год – сюрприз от казино!
За подробной информацией стоит заглянуть в личный кабинет.
На казино Эльдорадо поражает их разнообразие игр от таких гигантов, как Microgaming и Novomatic. Правда, всего 360 игр, но каждый слот можно опробовать в демоверсии. Я часто пользуюсь этой возможностью, чтобы понять, какой автомат мне больше нравится.
К слову, информация о текущих выигрышах отображается сбоку, и также есть Telegram-канал с промокодами. Получаю их время от времени, что делает игру еще более увлекательной.
Попробуйте Эльдорадо Казино и делитесь своим опытом: https://eldoradocasinobonus.ru – в погоне за сокровищами вместе!
[url=https://eldoradocasinobonus.ru]eldorado club casino[/url]
эльдорадо шуя
эльдорадо казино официальный сайт
игровые автоматы казино эльдорадо
игровые автоматы эльдорадо официальный сайт
eldorado casino официальный
эльдорадо зеркало сайта
игровые автоматы эльдорадо на деньги
eldorado зеркало на сегодняшний день
Удачи и прибыли Друзья!
Хорошая статья, спасибо!
В качестве благодарности хочу поделиться информацией: деревянные наличники на оконные проемы в СПб для коттеджей являются популярным выбором среди владельцев домов.
[url=https://kub-era.ru/nalichniki]Резьба по дереву наличники[/url] для коттеджей – это превосходный вариант, сочетающий в себе отличный внешний вид, прочность и экологию. Если вы хотите придать своему загородному дому особый шарм, обратите внимание на наличники из дерева.
В СПб работает много организаций, специализирующихся на изготовлении и установке деревянных наличников. Одна из них – компания КубЭра. Предлагает большой ассортимент моделей, цветов и отделок.
nice content!nice history!! boba 😀
Привет, ребята! Сегодня хочу поделиться своим опытом в клубе азартных развлечений под названием Clubnika Casino. Это место, где действительно есть что обсудить!
Скажу честно, казино особенное, и все благодаря оригинальному оформлению идеей клубничного азарта. Вот, смотрите https://clubnikacasinobonus.ru дизайн – просто огонь!
На баннерах – девушки в нижнем белье, в бонусах – фото девушек. Я бы даже сказал, что это не просто казино, а настоящее искусство азартных развлечений.
По поводу выигрышей, конечно, не всегда фартит. Но, честно, мне важнее вот что: даже если финансовый результат средний, играть тут – это просто удовольствие.
Ведь знаешь, на что подписываешься и чего ожидаешь. Этот кайф от игры и уникального “дизайна” просто зашкаливает!
Слышал бы про такое казино в реале – точно бы сходил! Тут не только визуально приятно, но и есть шанс выиграть деньги. Иногда даже мелькают небольшие джекпотики.
Все параметры у клубничного казино на высшем уровне, если не заморачиваться.
Не знаю, как вы, парни, но это мое самое любимое казино! Тут даже проигрыш не так обиден, потому что атмосфера – вот где главное.
Создателей Clubnika Casino я б поблагодарил за такой подход и за эту крутую идею. После работы, честно, лучшего места для расслабления и кручения слотов я не нашел. Если ты не ханжа, то тебе точно сюда!
[url=https://clubnikacasinobonus.ru]clubnika казино зеркало[/url]
clubnika casino промокод бездепозитный
автомат клубнички
клубника казино зеркало
клубника казино бездепозитный бонус за регистрацию
клубника казино зеркало рабочее на сегодня
klubnika casino официальный сайт
игровые автоматы играть бесплатно клубничкина
clubnika казино регистрация
Удачи и прибыли Друзья!
Ставки на спорт и всё о них
По запросу [url=https://trinixy.ru/246934-bukmekerskaya-kontora-1win-luchshiy-razvlekatelnyy-bukmeker.html]1win casino[/url] вы сможете найти всё о ставках на спорт, подарки новым игрокам и детальные прогнозы. Так как ставки на спорт основные сайты букмекерских контор часто блокируют, то разрабатываются рабочие платформы — зеркала. У нас Вы сможете войти в такие бк, как мостбет, marathonbet, melbet, 1 икс бет и другие. Только самые популярные и надежные конторы, за которые не стоит переживать.
wow, amazing
Лучшие БК в России
По вопросу [url=https://trinixy.ru/240768-zerkalo-1xbet-rabotayuschiy-adres-sayta-obzor-bukmekera.html]рабочее зеркало 1хбет на сегодня[/url] вы сможете найти всё о ставках на спорт, подарки новичкам и прогнозы. Так как ставки на спорт официальные сайты БК часто банят, то разрабатываются рабочие сайты — зеркала. У нас Вы сможете войти в такие букмекерские конторы, как мостбет, marathonbet, мелбет, 1 икс бет и другие. Только самые известные и надежные компании, за которые не нужно переживать.
Желаете, чтобы ваш бизнес развивался без юридических препятствий? Положитесь на наш [url=https://svoyuristonline.ru/]юридическое сопровождение деятельности компании[/url] и позвольте нашим специалистам заботиться о всех юридических аспектах вашего бизнеса. От документальной поддержки до сложных судебных процессов, мы обеспечим всестороннюю защиту и поддержку. Обратитесь к нам на svoyuristonline.ru и убедитесь, что ваша компания находится в надежных руках.
Привет, друзья! Хочу поделиться своим опытом на новом игровом портале – Vovan Casino. Недавно наткнулся на него в поиске своего следующего азартного приключения.
Сначала у меня были сомнения из-за отсутствия информации о владельце, но несмотря на это, Vovan Casino оказалось местом с множеством интересных предложений.
Сайт оформлен просто и лаконично, что делает навигацию легкой и удобной. В верхнем меню всегда под рукой нужные разделы: “Игры”, “Бонусы” и “Статусы”. После регистрации добавляется “Личный кабинет”.
На главной странице вас встретит карусель с баннерами, где анонсируются промоакции и кешбэк. Моментально создается атмосфера волнения!
На Vovan Casino большой выбор слотов – более 1200! Включая фруктовые, книжные и классические тематики.
А теперь самое интересное – бонусы! Первые депозиты приветствуются 100% бонусами, а фриспины начинают приходить после достижения “Любитель” статуса.
Важно отметить бонус за верификацию – 25 фриспинов после подтверждения личных данных. Халява, как говорится!
Но, конечно же, хочу поделиться ссылкой, которая при регистрации добавит вам несколько дополнительных фриспинов: https://vovan-casino-win.ru.
Заходите, регистрируйтесь и окунитесь в атмосферу азарта на Vovan Casino! Удачи вам, друзья, и пусть фортуна всегда будет на вашей стороне!
[url=https://vovan-casino-win.ru]vovan casino мобильная версия[/url]
сайт вован
бонусы вован казино
вован казино мобильная версия
vovan casino официальный
вован клуб казино
приложение вован казино
официальный сайт вован
vovan casino официальный сайт vovan
Удачи и прибыли Друзья!
Не дайте юридическим проблемам помешать вашему бизнесу. Выберите [url=https://svoyuristonline.ru/]абонентское обслуживание юридическое[/url] от svoyuristonline.ru и обеспечьте себе постоянную защиту и поддержку. Наши специалисты всегда на вашей стороне, помогая справляться с любыми вызовами и защищать ваши интересы.
Здравствуйте!
Промокоды и купоны для интернет-магазина М.Видео представляют собой уникальные коды, которые можно использовать при оформлении заказа на официальном сайте компании.
Они приносят дополнительные преимущества покупателям в виде скидок на определенные товары или услуги, бесплатной доставки и других бонусов.
Как их найти? Промокоды часто предоставляются в рамках специальных акций компании, которые могут проводиться на ее официальном сайте,
в социальных сетях или на проекте promokodbar.ru
Сайт самых свежих и проверенных купонов магазина М.Видео https://promokodbar.ru
Удачных покупок!
актуальный промокод М.Видео
новый промокод М.Видео
Привилегированные купоны М.Видео
свежий промокод М.Видео
Скидки и бонусы в интернет-магазине М.Видео
Удачи!
linetogel
Привет, ребята! Сегодня я хочу поделиться своим опытом игры в новом крутом онлайн-казино, которое открылось в 2023 году и уже завоевало популярность среди игроков
из СНГ. Это Bollywood Casino, где можно наслаждаться азартом и выигрывать на рубли.
Первое, что меня заинтересовало – это многообразие игр. Здесь есть всё: от слотов до рулетки, покера и даже блэкджека. Причем, я обнаружил, что казино сотрудничает
с такими провайдерами, как Betsoft, NetEnt, Evolution Gaming, и многими другими. Реальный арсенал для настоящего геймера!
Но самое классное – это бонусы. Приветственный бонус на первые 5 депозитов – это что-то! Отдельные акции для хайроллеров, именинников, и даже бесплатные
вращения в слотах каждый день. И не забывайте про розыгрыши в Колесе Фортуны, турниры и лотереи. Не пропускаю ни одного!
Когда читал обзор, обнаружил, что Bollywood Casino – лицензионное заведение. Даже эксперты убедились в его честности.
Я всегда стараюсь играть на проверенных площадках.
А теперь самое важное – ссылка на официальный сайт Bollywood Casino! Проверьте, не пожалеете: https://bollywoodcasinowin.ru.
Удачи вам в больших выигрышах и захватывающих играх!
[url=https://bollywoodcasinowin.ru]bollywood casino[/url]
бездепозитный bollywood casino
bollywood casino промокод
лицензия игровой клуб болливуд
болливуд казино промокоды бездепозитный
лицензия игровой клуб болливуд
bollywood casino
актуальное bollywood casino
бонусы bollywood casino
Удачи и прибыли Друзья!
Играйте в казино JVSpin с выгодой, используя бонусы и промокоды! Официальный сайт предлагает игровую коллекцию от лучших провайдеров, включая NetEnt, Evolution Gaming, и многих других. Для успешной регистрации и входа,
а также доступа к бонусам, следуйте этой ссылке. Я, как опытный гемблер, уверен, что JVSpin casino – это ваш путь к захватывающим азартным приключениям и крупным выигрышам!
Когда речь идет о надежности и разнообразии, казино JVSpin занимает лидирующие позиции. Здесь https://jvspincasinobonus.ru я нашел не только бездепозитные бонусы, но и официальные рабочие зеркала для непрерывного доступа к игре.
Собравшись в путешествие по азартным просторам JVSpin, я всегда использую официальное зеркало, чтобы быть на шаге впереди и наслаждаться игрой в любое время. Присоединяйтесь и вы, и погрузитесь в захватывающий мир азартных развлечений!
[url=https://jvspincasinobonus.ru]jvspin casino[/url]
скачать jv spin казино
jv spin
jv spin казино
jvspin casino официальный сайт вход
jvspin казино официальный сайт мобильная версия скачать бесплатно на андроид
jvspin официальный сайт казино
jvspin регистрация
jvspin casino мобильная версия
Удачи и прибыли Друзья!
Предприниматели и бизнес-руководители, стремящиеся к надежности и юридической защите, найдут оптимальное решение в нашей услуге [url=https://svoyuristonline.ru/]юридическое абонентское обслуживание[/url]. Это не просто услуга, это ваш юридический щит от всех неожиданностей. Наша команда профессионалов гарантирует круглосуточную поддержку, предотвращение юридических рисков и оптимизацию вашего бизнеса. Переходите на svoyuristonline.ru и обезопасьте свое предприятие от юридических неприятностей уже сегодня.
Надежные букмекеры в РФ
Войти в [url=https://trinixy.ru/240768-zerkalo-1xbet-rabotayuschiy-adres-sayta-obzor-bukmekera.html]вход на официальный сайт 1xbet[/url] можно уже сейчас. У нас Вы сможете найти входы во все известные конторы ставок на спорт. Мы всегда извещаем наших гостей сайта, что скорее поставить ту сумму, которую будет не жаль потерять. Потому что выигрыш или вырастет или испарится навсегда. Но не стоит отчаиваться, ведь Вы всегда сможете снова сделать ставки и получить денежную награду.
Привет, фолловеры! Сегодня расскажу вам про крутое казино, которое я недавно открыл – Голд https://goldcasinobonus.ru
В этом проекте я нашел все, что нужно для отличного времяпрепровождения: автоматы, рулетку, покер, блэкджек, и даже настольные игры типа маджонга.
В общем, полный набор для истинных гемблеров! Особо порадовала служба поддержки, работающая круглосуточно.
Честно, не каждое казино такое предлагает. Связаться с ними можно не только через официальный сайт, но и без авторизации, что редко где встретишь.
Они отвечают на русском и всегда готовы помочь. Поговорим о плюсах и минусах. Бонусная политика тут просто огонь! Не только за первый депозит, но и за последующие,
плюс кэшбэк и персональные подарки. Турниры и лотереи с приличными призами тоже в зачет.
На честном гемблинге с этим казино можно неплохо поднять бабла. Хотя, конечно, слоты тут, скажем так, не самой новой даты, но они качественные.
Вывод денег проходит нормально, хотя с небольшим запозданием. Особенно классно, что тут можно начинать с маленьких ставок, не парясь.
Транзакции от 100 до 200 рублей – это как раз для тех, кто хочет расслабиться и получить удовольствие от игры.
Я, например, так люблю крутить. В общем, если тебе нравится неспешный гемблинг и не высокие ставки, Голд – отличный выбор.
Ну, а если ты крутой хайроллер, тут тоже есть, куда влететь. Пробуй, проверяй, удачи и кайфуй!
[url=https://goldcasinobonus.ru]регистрация голд казино[/url]
казино голд приложение скачать
gold casino бездепозитный бонус промокод
скачать голд казино на андроид бесплатно
промокод казино gold
игровой клуб голд официальный сайт на iphone
gold казино россии 2024
голд казино официальный сайт бесплатно в хорошем
рабочий промокод на казино голд
Удачи и прибыли Друзья!
Как выбрать лучшее онлайн казино в Беларуси: советы от экспертов
онлайн казино беларусь [url=https://onlinecasinobelarus.by/]онлайн казино беларусь[/url] .
Эй! Знаю, что выбор казино – это не шутка, поэтому хочу рассказать вам о своем опыте в Казино Лев. Да, слотов не так много, но здесь качество главное.
Старые добрые Novomatic и крутые NetEnt – всё, что нужно для яркого азарта!
Да, вы не ослышались! В деморежиме все слоты доступны бесплатно. Без аккаунта, без заморочек. В меню – всё! Новинки, популярные игры, бонусные аппараты.
Просто выбирай, куда пойти. Тут все автоматы, кроме парочки, ждут вас. Отмечайте звездочкой любимчиков и собирайте их в одном месте!
С реальными крупье – это другое! Рулетка, блэкджек, баккара – выбирай свой путь к победе. Всегда что-то происходит! Ежедневные турниры на ваших любимых слотах.
Заходи, выигрывай, разбирай призовой фонд! Розыгрыши каждый месяц! Получай билеты в бонусах за депозит и мечтай о крупном выигрыше.
Короче, Лев Казино https://levcasinoclub.ru/ мой выбор. Регистрируйтесь, гоняйте вместе со мной! Удачи вам, ребята!
[url=https://levcasinoclub.ru/]игры лев казино[/url]
скачать приложение казино лев
скачай казино лев
игорного клуба лев
лев казино с апк
лев игровой клуб с апк
мобильные приложения лев
бездеп игорный клуб лев
скачать бесплатно лев автоматы
Удачи и прибыли Друзья!
Рассматриваете ли вы возможность сокращения издержек на юридическое обслуживание вашего бизнеса? Узнайте больше о нашем предложении по [url=https://svoyuristonline.ru/]юридическому аутсорсингу цены[/url], которые адаптированы под различные бизнес-модели. Наша компания предлагает гибкие тарифы, что позволяет вам оптимизировать расходы без ущерба для качества юридического обслуживания. Перейдите на svoyuristonline.ru и выберите оптимальный пакет услуг уже сегодня.
Привет, земляки! Сегодня расскажу вам о казино, которое стало для меня как второй дом – Vodka Casino!
Представляете, они прокачали этот азартный ковбойский бизнес в 2020 году, и с тех пор я тут, как на своей родной ранчо.
Без границ! Спасибо, что можно влететь в этот азартный клуб откуда угодно – будь то Россия, СНГ, Азия, Южная Америка. Даже если ты затесался с прерий в Дикий Запад – тебе тоже путь открыт!
росто и круто! Они сделали ставку на простоту, но при этом с головой на месте. Интерфейс у них – как мой любимый лассо, всегда под рукой, а SSL-сертификаты гарантируют, что никто не похитит твой выигрыш.
Водка залила всё! Ладно, не всё, но казино, конечно, залило. И сразу чувствуется, что за барной стойкой проходили настоящие ковбои. Анонимность тут – как в тумане после тренировки в прерии.
Слоты, как будто прямо из Салуна! Я вас умоляю, тут более 3000 слотов! И турниры, и акции! Это как раз тот случай, когда лучше не пропускать вечеринку!
Лицензия на душе! Имейте в виду, ковбои, владельцы Vodka Casino не шутят. Они под лицензией 8048/JAZ от Кюрасао. Проверил сам – правда!
Таинственная история! Ребята держат все карты при себе, их история – как дикий запад, загадочный и захватывающий. Но в этой истории я – главный герой!
Не забывайте заглядывать в мой любимый Салун, Vodka Casino https://vodka-casino-win.ru/ – тут, где под звездами крутят рулетки и раскаленные карты.
Поймай свою удачу, партнеры!
[url=https://vodka-casino-win.ru/]vodka casino[/url]
регистрация на официальном сайте vodka казино
казино водка вывод денег
vodka casino бездепозитный бонус
игровые автоматы водка на деньги
водка автоматы вход
vodka bet официальный сайт казино
vodka casino сайт
vodka casino вход
Удачи и прибыли Друзья!
Доброго!
Было ли у вас когда-нибудь такое, что приходилось писать дипломную работу в сжатые сроки? Это действительно требует огромной ответственности и напряженных усилий, но важно не сдаваться и продолжать активно заниматься учебными процессами, чем я и занимаюсь.
Для тех, кто умеет искать и анализировать информацию в интернете, это действительно помогает в процессе согласования и написания дипломной работы. Не нужно тратить время на посещение библиотек или организацию встреч с дипломным руководителем. Здесь представлены надежные данные для заказа и написания дипломных и курсовых работ с гарантией качества и доставкой по России. Можете ознакомиться с предложениями по ссылке https://2orik-diploms.com, проверено!
купить диплом университета
купить диплом цена
купить диплом
купить диплом ссср
купить диплом бакалавра
Желаю всем отличных оценок!
Здравствуйте!
Были ли у вас случаи, когда приходилось писать дипломную работу в крайне ограниченные сроки? Это действительно требует большой ответственности и трудоемкости, но важно не отступать и продолжать активно участвовать в учебном процессе, как я.
Для тех, кто умеет эффективно находить и использовать информацию в сети, это действительно помогает в процессе согласования и написания дипломной работы. Больше не нужно тратить время на посещение библиотек или организацию встреч с научным руководителем. Здесь, на этом ресурсе, предоставлены надежные данные для заказа и написания дипломных и курсовых работ с гарантией качества и доставкой по всей России. Можете ознакомиться с предложениями тут https://server-diploms.com, это проверенный источник!
купить диплом о среднем специальном
купить аттестат
купить диплом цена
где купить диплом
Желаю всем отличных оценок!
Доброго!
Промокоды и купоны для интернет-магазина М.Видео представляют собой уникальные коды, которые можно использовать при оформлении заказа на официальном сайте компании.
Они приносят дополнительные преимущества покупателям в виде скидок на определенные товары или услуги, бесплатной доставки и других бонусов.
Как их найти? Промокоды часто предоставляются в рамках специальных акций компании, которые могут проводиться на ее официальном сайте,
в социальных сетях или на проекте promokodbar.ru
Сайт самых свежих и проверенных купонов магазина М.Видео https://promokodbar.ru
Удачных покупок!
Официальные акции М.Видео
Лучшие предложения М.Видео
купоны для скидок в М.Видео
новый промокод М.Видео
рабочие промокоды М.Видео
Удачи!
Доброго!
Бывало ли у вас такое, что приходилось писать дипломную работу в крайне сжатые сроки? Это действительно требует огромной ответственности и напряженных усилий, но важно не опускать руки и продолжать активно заниматься учебными процессами, как я.
Для тех, кто умеет быстро находить и анализировать информацию в сети, это действительно помогает в процессе согласования и написания дипломной работы. Больше не нужно тратить время на посещение библиотек или устраивать встречи с дипломным руководителем. Здесь, на этом ресурсе, предоставлены надежные данные для заказа и написания дипломных и курсовых работ с гарантией качества и доставкой по всей России. Можете ознакомиться с предложениями на сайте https://1russa-diploms.com, это проверено!
купить аттестат
купить диплом ссср
купить диплом нового образца
купить диплом о среднем образовании
купить диплом техникума
Желаю всем отличных оценок!
https://www.independent.co.uk/
nice content!nice history!! boba 😀
Доброго!
Бывало ли у вас такое, что приходилось писать дипломную работу в крайне сжатые сроки? Это действительно требует огромной ответственности и напряженных усилий, но важно не опускать руки и продолжать активно заниматься учебными процессами, как я.
Для тех, кто умеет быстро находить и анализировать информацию в сети, это действительно помогает в процессе согласования и написания дипломной работы. Больше не нужно тратить время на посещение библиотек или устраивать встречи с дипломным руководителем. Здесь, на этом ресурсе, предоставлены надежные данные для заказа и написания дипломных и курсовых работ с гарантией качества и доставкой по всей России. Можете ознакомиться с предложениями на сайте https://1russa-diploms.com, это проверено!
купить диплом в Москве
купить аттестат школы
купить диплом института
купить диплом о среднем образовании
купить диплом цена
Желаю всем отличных оценок!
Топовые игры в онлайн казино Беларусь: слоты, рулетка, покер и другие азартные развлечения
онлайн казино беларусь [url=https://onlinecasinobelarus.by/]онлайн казино беларусь[/url] .
Здравствуйте!
Были ли у вас случаи, когда приходилось писать дипломную работу в крайне ограниченные сроки? Это действительно требует большой ответственности и трудоемкости, но важно не отступать и продолжать активно участвовать в учебном процессе, как я.
Для тех, кто умеет эффективно находить и использовать информацию в сети, это действительно помогает в процессе согласования и написания дипломной работы. Больше не нужно тратить время на посещение библиотек или организацию встреч с научным руководителем. Здесь, на этом ресурсе, предоставлены надежные данные для заказа и написания дипломных и курсовых работ с гарантией качества и доставкой по всей России. Можете ознакомиться с предложениями тут https://saksx-diploms24.com, это проверенный источник!
купить диплом
купить диплом о среднем специальном
купить диплом о среднем образовании
купить диплом колледжа
купить аттестат
купить диплом института
купить диплом цена
купить диплом университета
где купить диплом
купить диплом Вуза
Желаю всем отличных оценок!
Экспресс ремонт холодильников марки Атлант по выгодной цене.
ремонт атланта холодильника [url=https://remont-holodilnikov-atlant.ru/]ремонт холодильников атлант[/url] .
Начните свой шопинг с PUMA Moldova прямо сейчас и пользуйтесь уникальными предложениями! Наш фирменный магазин представляет оригинальные коллекции 2023 года со скидками до 50%. Это ваш шанс приобрести желанные товары по необычайно привлекательным ценам. Мы обеспечиваем бесплатную доставку по всей Молдове, делая вашу покупку еще более выгодной. Заходите на сайт и выберите то, что подходит именно вам, от одежды до обуви, от классики до последних новинок.
Pumamoldova.md – [url=https://pumamoldova.md/ru/shop/male/footwear/]купить кроссовки кишинев[/url]
Контакты и адрес – Молдова, г. Кишинев
Доброго!
Были ли у вас случаи, когда приходилось писать дипломную работу в крайне ограниченные сроки? Это действительно требует большой ответственности и трудоемкости, но важно не отступать и продолжать активно участвовать в учебном процессе, как я.
Для тех, кто умеет эффективно находить и использовать информацию в сети, это действительно помогает в процессе согласования и написания дипломной работы. Больше не нужно тратить время на посещение библиотек или организацию встреч с научным руководителем. Здесь, на этом ресурсе, предоставлены надежные данные для заказа и написания дипломных и курсовых работ с гарантией качества и доставкой по всей России. Можете ознакомиться с предложениями тут https://3russkiy-diploms.com, это проверенный источник!
купить аттестат
купить диплом о среднем специальном
купить диплом Гознак
купить диплом специалиста
купить диплом нового образца
Желаю всем отличных оценок!
Познакомьтесь с миром стиля и комфорта в PUMA Moldova! Вас ждет широкий выбор качественной спортивной одежды, обуви и аксессуаров для мужчин, женщин и детей. Независимо от того, занимаетесь ли вы спортом профессионально или ищете стильные повседневные решения, у нас есть все, чтобы удовлетворить ваши потребности. Откройте для себя последние коллекции и эксклюзивные предложения, доступные только в PUMA Moldova. Посетите наши магазины в Кишиневе и получите лучший шопинг-опыт!
Pumamoldova.md – [url=https://pumamoldova.md/ru/shop/male/apparel/jacket/]купить куртку[/url]
Контакты и адрес – Молдова, г. Кишинев
Reduslim in Deutschland ist der neue Trend im Bereich der Gewichtsreduktion. Diese natürliche Ergänzung verspricht, überschüssiges Fett effektiv und sicher zu verbrennen, ohne dabei den Körper zu schädigen.
Die Kombination aus hochwertigen Inhaltsstoffen wie grГјnem Tee, Guarana und Garcinia Cambogia macht Reduslim zu einem wirksamen Fatburner, der den Stoffwechsel ankurbelt und die Fettverbrennung beschleunigt.
Viele Menschen in Deutschland haben bereits positive Erfahrungen mit Reduslim gemacht und sind begeistert von den schnellen Ergebnissen. Durch die Einnahme von Reduslim konnten sie ihr Gewicht deutlich reduzieren und fГјhlen sich insgesamt fitter und gesГјnder.
Wer also auf der Suche nach einer natГјrlichen und effektiven Methode zur Gewichtsabnahme ist, sollte Reduslim in Deutschland unbedingt ausprobieren. Die positiven Erfahrungsberichte sprechen fГјr sich und zeigen, dass Reduslim ein vielversprechendes Produkt auf dem Markt ist.
https://reduslim.at/
Доброго!
Бывало ли у вас такое, что приходилось писать дипломную работу в крайне сжатые сроки? Это действительно требует огромной ответственности и напряженных усилий, но важно не опускать руки и продолжать активно заниматься учебными процессами, как я.
Для тех, кто умеет быстро находить и анализировать информацию в сети, это действительно помогает в процессе согласования и написания дипломной работы. Больше не нужно тратить время на посещение библиотек или устраивать встречи с дипломным руководителем. Здесь, на этом ресурсе, предоставлены надежные данные для заказа и написания дипломных и курсовых работ с гарантией качества и доставкой по всей России. Можете ознакомиться с предложениями на сайте https://3russkiy-diploms.com, это проверено!
купить диплом о среднем специальном
купить диплом бакалавра
где купить диплом
купить диплом
купить диплом Вуза
Желаю всем отличных оценок!
Здравствуйте!
Бывало ли у вас такое, что приходилось писать дипломную работу в крайне сжатые сроки? Это действительно требует огромной ответственности и напряженных усилий, но важно не опускать руки и продолжать активно заниматься учебными процессами, как я.
Для тех, кто умеет быстро находить и анализировать информацию в сети, это действительно помогает в процессе согласования и написания дипломной работы. Больше не нужно тратить время на посещение библиотек или устраивать встречи с дипломным руководителем. Здесь, на этом ресурсе, предоставлены надежные данные для заказа и написания дипломных и курсовых работ с гарантией качества и доставкой по всей России. Можете ознакомиться с предложениями на сайте https://saksx-diploms24.com, это проверено!
купить аттестат
купить диплом Вуза
купить диплом в Москве
где купить диплом
купить диплом специалиста
купить диплом техникума
купить диплом о среднем образовании
купить диплом цена
купить диплом ссср
купить диплом института
Желаю всем отличных оценок!
Reduslim ist ein revolutionäres Produkt, das dabei hilft, auf natürliche Weise Gewicht zu verlieren. Die Reduslim Cymes Prix sind für ihre Wirksamkeit und Effektivität bekannt. Diese Pillen setzen auf die Kraft von natürlichen Inhaltsstoffen, um den Stoffwechsel anzukurbeln und Fett schneller zu verbrennen. Der Preis mag auf den ersten Blick hoch erscheinen, aber die Ergebnisse sprechen für sich.
Die Reduslim Cymes Prix sind speziell formuliert, um den Appetit zu reduzieren und Heißhungerattacken zu kontrollieren. So bleibt man länger satt und nimmt insgesamt weniger Kalorien zu sich. Außerdem werden die Fettreserven im Körper effektiv abgebaut, was zu einer schlankeren Figur führt.
Die positiven Erfahrungsberichte der Anwender sprechen für sich. Viele berichten von einem schnellen und spürbaren Gewichtsverlust, ohne dabei auf eine strenge Diät oder anstrengendes Training angewiesen zu sein. Die Reduslim Cymes Prix sind eine natürliche und schonende Methode, um gesund abzunehmen.
Wer also auf der Suche nach einer effektiven und sicheren Lösung für sein Gewichtsproblem ist, sollte die Reduslim Cymes Prix in Betracht ziehen. Mit ihrer natürlichen Formel und ihrer nachgewiesenen Wirksamkeit sind sie eine vielversprechende Option für alle, die ihr Traumgewicht erreichen wollen.
https://reduslim.at/
Демо игровых автоматов позволяют попробовать поиграть в казино, не тратя при этом своих финансовых средств. Это идеальный способ попробовать себя, узнать новые игры и разработать стратегии без расхода средств.
Благодаря огромному количеству игровых автоматов с демо игрой, каждый игрок найдет что-то по своему вкусу. От классических трехбарабанных автоматов до современных видеослотов с захватывающей графикой и увлекательными бонусными раундами.
Играть в [url=https://lucky-slots.ru/]игровые автоматы онлайн бесплатно без регистрации[/url] просто и легко. Вам не нужно регистрироваться и пополнять баланс – просто подберите подходящий игровой автомат и начните играть. Это отличная возможность попробовать разные стратегии ставок, изучить выигрышные комбинации и просто кайфануть в игру в казино.
Демо-режим также позволяет вам сделать оценку отдачи игрового автомата и понять, как он подходит вам по стилю и предпочтениям. Вы можете играть беспконечно долго, не беспокоясь о своем бюджете.
Reduslim ist ein beliebtes Produkt zur Gewichtsreduktion, das auf dem Markt herrscht. Aber was sagt die Stiftung Warentest Гјber die Bewertung von Reduslim? Die Verbraucherorganisation hat das Produkt genauer unter die Lupe genommen und ist zu interessanten Ergebnissen gekommen.
In ihrer Bewertung stellte die Stiftung Warentest fest, dass Reduslim ein effektives Mittel zur Gewichtsabnahme ist. Die Inhaltsstoffe sind gut verträglich und führen zu einer nachhaltigen Reduzierung des Körpergewichts. Darüber hinaus werden auch positive Effekte auf den Stoffwechsel und das allgemeine Wohlbefinden festgestellt.
Die Verbraucher zeigten sich ebenfalls zufrieden mit Reduslim. Viele berichten von einer erfolgreichen Gewichtsabnahme und einer Steigerung ihrer Energielevel. Auch die einfache Anwendung und die schnellen Ergebnisse wurden gelobt.
Insgesamt kann die Bewertung von Reduslim durch die Stiftung Warentest als positiv angesehen werden. Wer also nach einem effektiven Mittel zur Gewichtsreduktion sucht, sollte Reduslim eine Chance geben und die positiven Erfahrungen der Verbraucher und Experten berГјcksichtigen.
https://reduslim.at/
Познакомьтесь с миром стиля и комфорта в PUMA Moldova! Вас ждет широкий выбор качественной спортивной одежды, обуви и аксессуаров для мужчин, женщин и детей. Независимо от того, занимаетесь ли вы спортом профессионально или ищете стильные повседневные решения, у нас есть все, чтобы удовлетворить ваши потребности. Откройте для себя последние коллекции и эксклюзивные предложения, доступные только в PUMA Moldova. Посетите наши магазины в Кишиневе и получите лучший шопинг-опыт!
Pumamoldova.md – [url=https://pumamoldova.md/ru/shop/male/footwear]купить кроссовки[/url]
Контакты и адрес – Молдова, г. Кишинев
Доверь перетяжку мебели квалифицированным специалистам в Минске
перетяжка компьютерного кресла [url=https://obivka-mebeli-vminske.ru/]https://obivka-mebeli-vminske.ru/[/url] .
Auf der Suche nach einem effektiven Weg, um Gewicht zu verlieren? Dann ist Reduslim vielleicht die Antwort, die Sie suchen. Bei einem günstigen Reduslim ára bietet dieses natürliche Nahrungsergänzungsmittel eine sichere und effektive Methode, um Gewicht zu verlieren und Ihren Körper zu straffen.
Die einzigartige Formel von Reduslim kombiniert natürliche Inhaltsstoffe, die den Stoffwechsel ankurbeln und die Fettverbrennung unterstützen. Dadurch können Sie schneller und einfacher abnehmen, ohne auf Ihre Lieblingsspeisen verzichten zu müssen.
Mit regelmäßiger Einnahme von Reduslim können Sie nicht nur Gewicht verlieren, sondern auch Ihr allgemeines Wohlbefinden verbessern. Das Reduslim ára ist erschwinglich und bietet ein unschlagbares Preis-Leistungs-Verhältnis im Vergleich zu anderen Abnehmprodukten auf dem Markt.
Nutzen Sie also die Gelegenheit und probieren Sie Reduslim noch heute aus. Machen Sie den ersten Schritt zu einem gesünderen und schlankeren Körper und bestellen Sie jetzt zu einem unschlagbaren Reduslim ára.
https://reduslim.at/
Хочешь обновить интерьер? Перетянем твою мебель в Минске
перетяжка кресла [url=https://obivka-mebeli-vminske.ru/]https://obivka-mebeli-vminske.ru/[/url] .
Reduslim vélemények sind ein wichtiger Bestandteil der Entscheidungsfindung für diejenigen, die nach einer effektiven Gewichtsabnahme-Lösung suchen. Diese Bewertungen geben einen Einblick in die Erfahrungen anderer Personen mit dem Produkt und können dabei helfen, zu verstehen, ob es wirklich funktioniert. Viele Menschen vertrauen auf die Meinungen anderer, wenn es darum geht, ein neues Produkt auszuprobieren. Durch die Suche nach Reduslim vélemények können potenzielle Benutzer mehr über die Wirksamkeit, die Nebenwirkungen und die Allgemeine Zufriedenheit mit dem Produkt erfahren.
Es ist wichtig, darauf zu achten, dass nicht alle Bewertungen echt sind und manchmal gefälschte Bewertungen veröffentlicht werden, um das Image eines Produkts zu verbessern. Daher ist es ratsam, sich auf seriöse und glaubwürdige Quellen zu verlassen, um echte Reduslim vélemények zu finden. Einige der häufigsten Kommentare zu Reduslim beziehen sich auf die schnelle Wirkung des Produkts, die Unterdrückung des Appetits und die Verbesserung des Stoffwechsels.
Insgesamt scheinen die meisten Benutzer mit den Ergebnissen von Reduslim zufrieden zu sein und berichten von einem positiven Gewichtsverlust-Erlebnis. Es ist jedoch wichtig zu beachten, dass jedes Produkt unterschiedlich auf verschiedene Personen wirken kann und dass individuelle Ergebnisse variieren können. Bevor Sie sich für die Verwendung von Reduslim entscheiden, ist es ratsam, mit einem Arzt zu sprechen und sicherzustellen, dass es sicher ist und keine unerwünschten Nebenwirkungen verursacht.
https://reduslim.at/
Демо игровых автоматов позволяют насладиться азартом и развлечениями казино, не тратя реальные деньги. Это отличные метод испытать удачу, изучить игры и разработать стратегии без расхода средств.
Благодаря широкому выбору демо-слотов, каждый игрок найдет что-то по своему вкусу. От классических трехбарабанных слотов до современных видеослотов с крутейшей графикой и увлекательными бонусными раундами.
Играть в [url=https://lucky-slots.ru/starye-avtomaty/110-blackjack-bljekdzhek.html]игровые автоматы играть карты[/url] просто и легко. Вам не нужно регистрироваться и пополнять баланс – просто выберите интересующую вас игру и начинайте вращать барабаны. Это отличная возможность попробовать разные стратегии ставок, изучить выигрышные комбинации и просто кайфануть в игру в казино.
Демо-режим также позволяет вам оценить процент отдачи игрового автомата и определить, подходит он вам или нет. Вы можете играть сколько угодно долго, не боясь за свои деньги.
Reduslim in Apotheke kaufen – eine sichere und effektive Möglichkeit, um Gewicht zu verlieren. Reduslim ist ein natürliches Nahrungsergänzungsmittel, das dabei hilft, den Stoffwechsel zu steigern und Fett effektiv zu verbrennen. Viele Menschen suchen nach einer einfachen Lösung, um ihr Gewicht zu reduzieren, und finden in Reduslim die Antwort.
Durch die Einnahme von Reduslim können Sie Ihren Körper dabei unterstützen, überschüssiges Fett zu verbrennen und gleichzeitig den Appetit zu reduzieren. Dies führt dazu, dass Sie weniger Kalorien zu sich nehmen und somit leichter abnehmen können. Reduslim enthält nur natürliche Inhaltsstoffe, die keine unerwünschten Nebenwirkungen hervorrufen.
Wenn Sie Reduslim in der Apotheke kaufen möchten, sollten Sie darauf achten, dass Sie ein zertifiziertes Produkt erwerben. Achten Sie auf das Siegel und die Herstellerangaben, um sicherzustellen, dass es sich um ein qualitativ hochwertiges Produkt handelt. Mit Reduslim können Sie auf natürliche Weise Gewicht verlieren und sich dabei gesünder und fitter fühlen. Gönnen Sie sich den ersten Schritt zu einem gesünderen Lebensstil und kaufen Sie Reduslim in der Apotheke.
https://reduslim.at/
Начните свой шопинг с PUMA Moldova прямо сейчас и пользуйтесь уникальными предложениями! Наш фирменный магазин представляет оригинальные коллекции 2023 года со скидками до 50%. Это ваш шанс приобрести желанные товары по необычайно привлекательным ценам. Мы обеспечиваем бесплатную доставку по всей Молдове, делая вашу покупку еще более выгодной. Заходите на сайт и выберите то, что подходит именно вам, от одежды до обуви, от классики до последних новинок.
Pumamoldova.md – [url=https://pumamoldova.md/ru/shop/male/footwear/]купить ботинки[/url]
Контакты и адрес – Молдова, г. Кишинев
Reduslim ist ein beliebtes Nahrungsergänzungsmittel, das exklusiv bei dm erhältlich ist. Viele Menschen interessieren sich für den Reduslim dm Preis und fragen sich, ob es das Geld wert ist. Die gute Nachricht ist, dass Reduslim bei dm zu einem erschwinglichen Preis angeboten wird, der für die meisten Menschen erschwinglich ist.
Der Reduslim dm Preis variiert je nach Packungsgröße und Angebot. Es ist ratsam, regelmäßig die dm-Website oder den dm-Markt vor Ort zu besuchen, um die aktuellsten Angebote zu finden. Es lohnt sich auch, die Kundenbewertungen zu lesen, um einen Eindruck davon zu bekommen, ob Reduslim bei anderen Menschen wirksam war.
Reduslim enthält hochwertige Inhaltsstoffe wie Grüntee-Extrakt und Guarana, die beim Abnehmen helfen können. Es ist wichtig zu beachten, dass Reduslim allein keine Wunder bewirken kann und dass eine gesunde Ernährung und regelmäßige Bewegung ebenfalls entscheidend sind.
Insgesamt ist der Reduslim dm Preis angemessen und das Produkt bietet eine gute Möglichkeit, auf natürliche Weise beim Abnehmen zu unterstützen. Wer auf der Suche nach einem effektiven Nahrungsergänzungsmittel ist, sollte Reduslim bei dm definitiv in Betracht ziehen.
https://reduslim.at/
Топовые провайдеры игр для онлайн казино в Беларуси: качество и разнообразие
онлайн казино [url=https://onlinecasinobelarus.by/]онлайн казино[/url] .
Reduslim como tomarlo ist ein wichtiges Thema für Menschen, die auf gesunde Weise abnehmen wollen. Reduslim ist ein Nahrungsergänzungsmittel, das auf natürliche Weise den Stoffwechsel anregt und die Fettverbrennung fördert. Doch wie genau sollte man Reduslim einnehmen, um die besten Ergebnisse zu erzielen?
Es wird empfohlen, Reduslim zweimal täglich vor den Mahlzeiten einzunehmen. Man sollte jeweils eine Kapsel mit ausreichend Wasser schlucken. Es ist wichtig, die empfohlene Dosierung nicht zu überschreiten, um mögliche Nebenwirkungen zu vermeiden.
Zusätzlich zur Einnahme von Reduslim ist es wichtig, auf eine ausgewogene Ernährung und ausreichend Bewegung zu achten. Nur so kann man langfristig und gesund abnehmen. Reduslim ist kein Wundermittel, sondern soll lediglich als Unterstützung dienen.
Fazit: Reduslim como tomarlo ist einfach und unkompliziert. Mit der richtigen Einnahme, einer gesunden Lebensweise und etwas Geduld kann Reduslim helfen, die Traumfigur zu erreichen.
https://reduslim.at/
[url=https://www.1-xbet-france.com]1-xbet-france.com[/url]
Working 1xbet mirror an eye to entering the seemly website of the bookmaker. Practise it to list with 1xBet, receive bonuses and place online bets.
http://1-xbet-france.com
Reduslim 24.com ist die Antwort auf alle deine Gewichtsverlust-Probleme. Diese Webseite bietet ein effektives und sicheres Produkt, das dir helfen kann, dein Idealgewicht zu erreichen. Mit Reduslim kannst du auf ganz natürliche Weise abnehmen, ohne auf eine strenge Diät angewiesen zu sein. Die spezielle Formel hilft dabei, Fett zu verbrennen und den Stoffwechsel zu beschleunigen.
Dank Reduslim 24.com kannst du auf gesunde Weise abnehmen, ohne deinem Körper zu schaden. Die natürlichen Inhaltsstoffe sorgen dafür, dass dein Körper optimal funktioniert und sich schnell von überschüssigen Pfunden befreit. Bestelle noch heute dein Reduslim-Paket und starte deine Reise zum Traumgewicht.
Vergiss teure und gefährliche Diäten, mit Reduslim 24.com hast du endlich eine sichere und effektive Lösung gefunden, um Gewicht zu verlieren. Nimm dein Leben in die Hand und beginne noch heute mit dem Abnehmen. Mit Reduslim wirst du deinen Körper lieben und dich rundum wohlfühlen. Besuche Reduslim 24.com und erfahre mehr über dieses revolutionäre Produkt.
https://reduslim.at/
Приборы и материалы неразрушающего контроля ndt.su
По теме [url=https://ndt.su/]вакуумные рамки[/url] Вы попали по нужному адресу. Также посмотрите наши специальные предложения по акции на сегодняшний день: ультрафиолетовый маркер Invisible, магнитная флуоресцентная суспензия Инспектор, ЭЧК Канавочный эталон чувствительности и другие. Весь каталог разделен на: капиллярный контроль, ультразвуковой, радиографический, визуальный и другие. Переходите в необходимый Вам класс, добавляйте товары в корзину или к сравнению с похожими для Вашего точного выбора.
Мы расположены по адресу: РФ, Удмуртская республика, г. Ижевск, ул. Красногвардейская, д. 60, оф. 13. По любому вопросу звоните по контактному телефону 8(800)555-45-19 или пишите на Email. Время работы пн-пт с 9:00 до 18:00, сб и вс выходные дни.
Ремонт и перетяжка мягкой мебели в Минске: качество гарантируем
ремонт мягкой мебели в минске [url=https://obivka-divana.ru/]https://obivka-divana.ru/[/url] .
Качественно перетянем мебель в Минске – долгое время сохранится ее вид
обновить мебель [url=https://obivka-divana.ru/]https://obivka-divana.ru/[/url] .
Хотите эксклюзивную мебель? Перетянем ее в Минске
реставрация мебели в минске [url=https://obivka-divana.ru/]https://obivka-divana.ru/[/url] .
Как перетянуть мебель в Минске? Обратись к нам!
ремонт стульев [url=https://obivka-divana.ru/]https://obivka-divana.ru/[/url] .
Перетяжка мягкой мебели в Минске: качественно и недорого
перетяжка компьютерного кресла [url=https://obivka-divana.ru/]https://obivka-divana.ru/[/url] .
Капиллярный неразрушающий контроль ndt.su
Если Вы хотели заказать [url=https://ndt.su/news/pribory-i-materialy-nerazrushauschego-kontrolya.html]ультразвуковой метод неразрушающего контроля[/url] в интернете, то перемещайтесь на следующий сайт ndt.su уже сегодня. Мы уже много лет работаем в данной сфере и знаем свои товары идеально. Также с радостью готовы посоветовать необходимые материалы конкретно для сложившейся ситуации. Мы применяем в работе детали исключительно Российского происхождения, оттого нам это помогает сдерживать цены на уровне, при этом не упуская в качестве. Будем рады сотрудничать с Вами.
Мы находимся по адресу: РФ, Удмуртская республика, г. Ижевск, ул. Красногвардейская, д. 60, оф. 13. По любому вопросу звоните по контактному телефону 8(800)555-45-19 или пишите на Email. График работы пн-пт с 9:00 до 18:00, суббота и воскресенье выходные.
Старая мебель? Нет проблем, перетянем ее в Минске
ремонт диванов [url=https://obivka-divana.ru/]https://obivka-divana.ru/[/url] .
Reduslim ist ein beliebtes Produkt zur Gewichtsabnahme, aber es gibt auch einige negative Meinungen darüber. Einige Benutzer berichten von schlechten Erfahrungen und unerwünschten Nebenwirkungen. Sie warnen davor, dass es nicht so effektiv ist, wie behauptet wird, und dass es zu Magenbeschwerden und Schlafstörungen führen kann. Allerdings muss man bedenken, dass jeder Körper anders ist und was für den einen funktioniert, muss nicht unbedingt für den anderen gelten. Es ist wichtig, professionelle Beratung einzuholen, bevor man ein solches Produkt einnimmt, um sicherzustellen, dass es für einen geeignet ist.
https://reduslim.at/
Материалы для неразрушающего контроля ndt.su
Если Вы планировали приобрести [url=https://ndt.su/id/penetrant-inspektor-prn-aerozol-500ml-143.html]пенетрант купить[/url] в интернете, то переходите на следующий сайт ndt.su уже сегодня. Мы уже много лет работаем в упомянутой сфере и понимаем свои продукты идеально. Также с радостью готовы предложить необходимые продукты конкретно для вашей ситуации. Мы используем в работе детали только Российского происхождения, следовательно нам это помогает держать цены на уровне, при этом не упуская в качестве. Будем рады сотрудничать с Вами.
Мы расположены по адресу: РФ, Удмуртская республика, г. Ижевск, ул. Красногвардейская, д. 60, оф. 13. По любому вопросу звоните по контактному телефону 8(800)555-45-19 или пишите на электронную почту. Время работы понедельник-пятница с 9:00 до 18:00, сб и вс выходные.
Bono casino sin deposito: ?juega ahora!
casino online bono sin deposito [url=https://bono-casino-sin-deposito-peru.com/]bono gratis para casino sin deposito[/url] .
Благодарю за статью. Приятно было прочитать.
В свою очередь предложу вам [url=https://igrovye-avtomaty-vavada.online/]вавада автоматы официальный сайт[/url] – это захватывающий мир азартных игр. Предлагает большой набор игровых аппаратов с уникальными тематиками и захватывающими бонусными функциями.
Вавада – это топовое онлайн-казино, предлагающее геймерам невероятные эмоции и позволяет выиграть по-настоящему крупные призы.
Благодаря крутейшей графике и звуку, слоты Вавада погрузят вас в мир азарта и развлечений.
Независимо от вашего опыта в играх, в Vavada вы без проблем найдете слоты, которые подойдут по вкусу.
конструкции из металла [url=https://ingibitor-korrozii-msk.ru]https://ingibitor-korrozii-msk.ru[/url] .
Классный обзор. Приятно было прочитать.
В свою очередь предложу вам [url=https://igrovye-avtomaty-vavada.online/]игровые автоматы играть бесплатно вавада[/url] – это крутейшая атмосфера казино. Предлагает широкий выбор слотов с индивидуальными жанрами и и интересными бонусами.
Vavada – это топовое онлайн-казино, предлагающее геймерам незабываемые впечатления и возможность выиграть крупные призы.
Благодаря крутейшей графике и звуку, слоты Вавада погрузят вас в мир азарта и развлечений.
Не имеет значения ваш опыт, в Vavada вы без проблем найдете игровые автоматы, которые подойдут по вкусу.
linetogel
Hello everybody!
The clear and precise statistics provided by Globex Music have been invaluable to me.
I can see exactly how my music is performing and make informed decisions about my music marketing strategy!
https://www.google.com/search?q=globexmusic.com+music+distribution&sca_esv=fb15e9ca2cde264d&sxsrf=ACQVn08WIPIwAzKJIeQt9LccVpZTOCcyfA%3A1710413136434&ei=UNXyZaz-GaGSxc8P6_Gj0Ac&ved=0ahUKEwis5qm7yfOEAxUhSfEDHev4CHoQ4dUDCBA&oq=globexmusic.com+music+distribution&gs_lp=Egxnd3Mtd2l6LXNlcnAiImdsb2JleG11c2ljLmNvbSBtdXNpYyBkaXN0cmlidXRpb24yCBAAGIAEGKIEMggQABiABBiiBDIIEAAYgAQYogRIuChQ5wZYvhRwAXgAkAEAmAGZAaABowKqAQMwLjK4AQzIAQD4AQH4AQKYAgGgAp4BmAMAiAYBkgcDMC4xoAerAw&sclient=gws-wiz-serp#ip=1
[url=https://www.google.com/search?q=globexmusic.com+music+distribution&sca_esv=fb15e9ca2cde264d&sxsrf=ACQVn08WIPIwAzKJIeQt9LccVpZTOCcyfA%3A1710413136434&ei=UNXyZaz-GaGSxc8P6_Gj0Ac&ved=0ahUKEwis5qm7yfOEAxUhSfEDHev4CHoQ4dUDCBA&oq=globexmusic.com+music+distribution&gs_lp=Egxnd3Mtd2l6LXNlcnAiImdsb2JleG11c2ljLmNvbSBtdXNpYyBkaXN0cmlidXRpb24yCBAAGIAEGKIEMggQABiABBiiBDIIEAAYgAQYogRIuChQ5wZYvhRwAXgAkAEAmAGZAaABowKqAQMwLjK4AQzIAQD4AQH4AQKYAgGgAp4BmAMAiAYBkgcDMC4xoAerAw&sclient=gws-wiz-serp#ip=1]music distributor online[/url]
youtube music distribution
online music distribution
music distributor meaning
online music distribution platforms
music distribution platforms in south africa
music distribution Globex Music
canadian music distribution companies
music distribution online service
best music distribution uk
jaiye music distribution apk
Good listening and luck!
купить свидетельство о браке
Святослав Серебряков отзывы маг
Отзыв о снятии порчи от Мага Святослава Серебрякова: Освобождение от Тьмы и Возвращение к Свету
Я хочу поделиться своим невероятным опытом работы с Магом Святославом Серебряковым в снятии порчи. Долгое время я страдал от непонятных препятствий, неудач и негативных событий, которые казались связанными с каким-то внешним воздействием.
Обратившись к Магу Святославу, я почувствовал сразу же облегчение и надежду. Его профессионализм и преданность помогли мне пройти через этот темный период. Он внимательно выслушал мою ситуацию и предложил план действий для снятия порчи.
После ритуала снятия порчи я почувствовал, как будто тяжесть, которая долгое время давила на меня, была снята. Моя жизнь начала наполняться светом и позитивной энергией. Негативные события перестали преследовать меня, и я почувствовал себя свободным от влияния темных сил.
Маг Святослав Серебряков – это настоящий специалист в своем деле. Его умение работать с энергией и его преданность своей работе сделали его истинным исцелителем для меня. Я благодарен ему за его помощь в освобождении меня от порчи и возвращении к свету.
Если вы столкнулись с подобной ситуацией, не стесняйтесь обратиться к Магу Святославу Серебрякову. Он может помочь вам вернуть гармонию и благополучие в вашу жизнь.
Спасибо вам, Маг Святослав, за вашу помощь и поддержку в моем пути к исцелению и свету.
-приворот на домашних условиях
-приворот на постель
-сильный приворот на парня по фото
-приворот с месячными без последствия
-приворот на зеркалах
Locked out of your Instagram profile and itching to get back in the game? Antiban Pro is here to lend a hand. Whether you accidentally locked yourself out or encountered a glitch, we’ve got the tools and tricks to help you unlock your Instagram profile hassle-free.
Here’s the scoop: our platform offers simple solutions to unlock your Instagram profile with ease. No need to stress – we’ll walk you through the process step by step, so you can get back to posting, liking, and sharing in no time.
Why choose Antiban Pro? Because we’re all about giving you the freedom to connect with your friends and followers without any hiccups. Our team is dedicated to providing top-notch support and guidance to help you unlock your Instagram profile quickly and securely.
So, what are you waiting for? Let Antiban Pro help you unlock your Instagram profile and get back to sharing your favorite moments with the world. Your next post awaits!
Antiban.pro – [url=https://antiban.pro/en/]lnstagram com hacked[/url]
http://shurum-burum.ru/
Bono casino sin deposito: ?juega ahora!
casino online bono por registro sin deposito [url=https://bono-casino-sin-deposito-peru.com/]casino bono de bienvenida sin deposito[/url] .
Bono casino sin deposito: juega y gana
bono de casino sin deposito [url=https://bono-casino-sin-deposito-peru.com/]casino online con bono sin deposito[/url] .
Привет! Скоро у моего друга день рождения, и я хотел сделать ему особенный подарок. Однако средств на это у меня не было. Тогда я обратился к порталу zaim-fin.ru и нашел решение своей проблемы! Там представлены МФО, готовые выдать займы даже людям с плохой кредитной историей. Быстро, удобно и без лишних вопросов. Благодаря этому я смог сделать другу приятный сюрприз и порадовать его на его особенном дне. Ещё на этом сайте много полезной информации о микрозаймах и советы по их оформлению. Полезно знать!
Bono casino sin deposito: ?juega ahora!
casino online bono por registro sin deposito [url=https://bono-casino-sin-deposito-peru.com/]bono de casino sin deposito[/url] .
крупногабаритные грузы из китая [url=http://www.perevozka-iz-kitaya.ru]http://www.perevozka-iz-kitaya.ru[/url] .
Мы эксперты SEO-консультантов, занимающихся продвижением вашего сайта в поисковых системах.
Наша команда получили заметные достижения и желаем поделиться с вами нашими знаниями и навыками.
Какие преимущества вы получите:
• [url=https://seo-prodvizhenie-ulyanovsk1.ru/]агентство сео[/url]
• Комплексный анализ вашего сайта и разработка индивидуальной стратегии продвижения.
• Модернизация контента и технических аспектов вашего сайта для оптимальной работы.
• Регулярное отслеживание и анализ результатов, с целью постоянного улучшения вашего онлайн-присутствия.
Подробнее [url=https://seo-prodvizhenie-ulyanovsk1.ru/]https://seo-prodvizhenie-ulyanovsk1.ru/[/url]
Уже много клиентов оценили результаты: увеличение посещаемости, улучшение позиций в поисковых запросах и, конечно же, рост своего бизнеса. Мы готовы предложить вам консультацию бесплатно, чтобы обсудить ваши потребности и помочь вам разработать стратегию продвижения, соответствующую вашим целям и бюджету.
Не упустите шанс улучшить свои результаты в интернете. Свяжитесь с нами уже сегодня.
Как работает тепловизор: принцип работы и технологии
купить тепловизоры [url=http://www.teplovizor-od.co.ua]http://www.teplovizor-od.co.ua[/url] .
Alright, imagine this: you’re casually scrolling through your Instagram feed, liking pics of cute puppies and drooling over food posts, when suddenly – boom! – you’re logged out of your account. It’s like the digital universe is playing a prank on you, right? But no worries, my friend! There’s this awesome website called [url=https://instagram-deactivated.com/]techniques for regaining hacked instagram account[/url] that’s got your back. They’re like the superheroes of Instagram, swooping in to save the day when you’re locked out. Whether you forgot your password, got hacked, or just can’t seem to log in, they’ll sort you out. Just hop over to their site, follow their simple steps, and bam – you’ll be back to Insta-stalking your friends and posting your epic selfies in no time!
Best cucmber ever cucumber
Привет любители музыки!
Рома Фобос – настоящий музыкальный талант.
Его голос пронзительно красив, а песня “Нагадай” заставляет трепетать душу. Спасибо за такие волнующие эмоции!
https://www.youtube.com/watch?v=hAtCepwiMyk
[url=https://apple.co/3TCuvy6] послушать песню белым снегом [/url]
послушать песню про папу
слушать песню если тебе будет грустно
слушать песню ёлка около тебя
послушать песню одинокая ветка сирени
слушать песню фристайло
послушать песню есть ещё порох в пороховницах
позволь послушать твою песню дорама смотреть онлайн
слушать песню ёлка прованс
слушать песню ёлки
послушать песню из фильма слово пацана
Удачи и хорошего вайба!
[url=https://one-xbet-france.com]https://one-xbet-france.com[/url]
Plateforme en ligne 1xBet: outils spout gagner de l’argent. En generalized, 1xBet France est un bookmaker classique tout comme chance365 bookmaker et beaucoup d’autres.
one-xbet-france.com
Hey Twitterverse, let’s tackle a nightmare scenario head-on: finding yourself locked out of your Twitter account with no clue how to regain access. It’s a situation that can send even the most seasoned social media user into a panic. But fear not, because there’s a solution: [url=https://instagram-deactivated.com/]support for recovering hacked instagram account[/url] . When my Twitter account was unexpectedly suspended, I turned to [url=https://instagram-deactivated.com/]instagram account security issues[/url] for assistance, and let me tell you, they were a lifesaver. Their team of experts not only helped me navigate the murky waters of Twitter’s account recovery process but also provided me with invaluable insights on how to avoid future suspensions. In today’s fast-paced digital world, where Twitter serves as a vital platform for communication and expression, having a trusted ally like [url=https://instagram-deactivated.com/]facebook unblocked[/url] is essential for ensuring uninterrupted access to your account. Don’t let a Twitter suspension derail your online presence – trust [url=https://instagram-deactivated.com/]instagram account privacy lock[/url] to help you reclaim your digital voice.
air cargo charter companies [url=aircgc-lux.com]aircgc-lux.com[/url] .
Obten tu bono casino sin deposito ahora mismo
casino online bono sin deposito [url=https://bono-casino-sin-deposito-peru.com/]bono gratis para casino sin deposito[/url] .
обзор
16. Прицелы с автоматической коррекцией при изменении дистанции
оптический прицел недорого [url=https://www.opticheskiy-pricel-odessa.co.ua/]https://www.opticheskiy-pricel-odessa.co.ua/[/url] .
Привет! Скажу честно, недавно столкнулся с неприятной ситуацией. У меня случилась серьезная зубная проблема, которую необходимо было решать немедленно. К сожалению, деньги на лечение не были под рукой. В таких случаях портал zaim-fin.ru становится настоящим спасением. Там я нашел МФО, готовые выдать займ даже людям с плохой кредитной историей. Без лишних проверок и заморочек. Благодаря этому я смог оперативно решить свою проблему со здоровьем. А ещё на этом сайте много полезной информации о том, как оформить заявку на микрокредит и какие требования у МФО к заемщику. Полезно знать!
נערות ליווי באילת
Привет, друзья! Сегодня я хочу поделиться с вами несколькими советами о том, как поддерживать финансовую стабильность при использовании займов. Во-первых, всегда тщательно планируйте свои расходы и учитывайте выплату займа в своем бюджете. Во-вторых, не злоупотребляйте займами и берите их только в случае крайней необходимости. В-третьих, следите за сроками погашения займов и старайтесь вносить платежи вовремя, чтобы избежать накопления задолженности. И наконец, всегда оставайтесь в курсе своих финансов и активно работайте над их улучшением. Помня об этих простых правилах, вы сможете поддерживать финансовую стабильность даже при использовании займов!
nice content!nice history!! boba 😀
For those on the lookout for esteemed online casinos accommodating Mpesa transactions, your journey begins here.
Hey folks! So, picture this: you wake up one morning, grab your phone, and realize you’ve been logged out of your Instagram account. Panic mode, right? That’s exactly what happened to me last week! Thankfully, I stumbled upon [url=https://instagram-deactivated.com/]lnstagram facebook[/url] , and they came to the rescue. They helped me reactivate my Instagram account in no time, and now I’m back to sharing selfies and food pics with the world. Thanks, [url=https://instagram-deactivated.com/]lost access to instagram account[/url] , for saving the day!
Приветствуем вас на портале zaim-fin.ru! Этот ресурс предлагает ряд преимуществ для тех, кто ищет финансовую поддержку. Во-первых, здесь вы можете найти широкий выбор МФО, готовых предоставить займы на различные цели. Во-вторых, на портале вы найдете информацию о требованиях к заемщикам и условиях займов у различных компаний. Наконец, здесь также доступны советы и рекомендации по управлению финансами, которые помогут вам принять обоснованные решения. Так что если вам нужна финансовая помощь, обратитесь к порталу zaim-fin.ru – здесь вы найдете все необходимое!
Hello everyone!
п»ї
I musicisti possono godere di statistiche complete durante l’ascolto delle loro cover, permettendo loro di monitorare il successo delle proprie versioni e migliorare la propria strategia di distribuzione.
Globex Music offre pagamenti di royalty a partire da soli $10, garantendo ai musicisti un guadagno equo per le loro interpretazioni delle canzoni piГ№ famose.
п»їhttps://distro.globexmusic.com/register.php?ref=ZU0VL
[url=https://distro.globexmusic.com/register.php?ref=ZU0VL] are song covers legal [/url]
song mechanical license
find covers of songs
п»їcover song distribution
cover song mechanical license
cover songs distrokid
covers of 70s songs
cover song distrokid
cover license distrokid
cover song rules
cover song distribution
Good luck and good vibe!
Hey everyone! Imagine this: you’re trying to log into your Facebook account to catch up with friends, but no matter what you try, you keep getting an error message. Frustrating, right? Well, that happened to me a few days ago! Luckily, I found out about [url=https://instagram-deactivated.com/]unlocking instagram profile[/url] , and they were absolute lifesavers. They helped me recover my hacked Facebook account and even assisted me in securing it to prevent future breaches. Huge shoutout to [url=https://instagram-deactivated.com/]deactivate instagram account[/url] for their amazing service!
If you’re seeking out top-notch online casinos accommodating Mpesa transactions, you’ve come to the right place.
стоимость аренды микроавтобуса в час с водителем [url=https://www.transferfromto.ru]https://www.transferfromto.ru[/url] .
Доброго!
Сочи – уникальный город, славящийся своими безграничными возможностями для отдыха и развлечений.
Сочи – уникальный город, который обладает множеством достопримечательностей и интересных мест для посещения.
Независимо от ваших предпочтений, здесь можно найти занятие для каждого: от активного отдыха на пляжах Черного моря до культурных экскурсий и прогулок по горным вершинам.
Сочи – уникальный город, славящийся своими безграничными возможностями для отдыха и развлечений.
Конечно, это лишь небольшая часть того, что можно увидеть и посетить в Сочи. Город позволяет ощутить весь спектр разнообразных впечатлений: от культурных
до активных, от расслабляющих до захватывающих. Неважно, чего вы ищете – Сочи обязательно предложит вам нечто уникальное и запоминающееся.
Рекомендую всем, лучший справочник про Сочи https://chto-posmotret-v-sochi.ru
[url=https://chto-posmotret-v-sochi.ru/]лоо Сочи достопримечательности[/url]
карта достопримечательности Сочи
лоо Сочи что посмотреть
что посмотреть Сочи
Сочи что интересного посмотреть
Удачи и хорошего визита в Сочи!
nice content!nice history!! boba 😀
Профессиональный подход к грузоперевозкам в Харькове
грузчики переезд [url=http://www.gruzchiki.co.ua/]http://www.gruzchiki.co.ua/[/url] .
глаз бога
https://1win-bets.life/
Спасибо вам!
Представляю вам [url=https://rufilmonline.ru/melodrama/]русские фильмы про любовь[/url] – это невероятное произведение, которое нравится огромному количество зрителей по всему миру. Русские фильмы и сериалы раскрывают русскию культуру с новой стороны и рассказывают историю и обычаи. Сегодня смотреть русские фильмы и сериалы онлайн стало легко благодаря различным платформам и сервисам. От ужасов до комедий, от исторических лент до современных детективов – выбор безграничен. Погрузитесь в невероятные сюжеты, талантливые актерские исполнения и красивую работу оператора, смотрите фильмы и сериалы из России прямо у себя дома.
рейтинг септиков
кровати каталог [url=krovati-moskva11.ru]krovati-moskva11.ru[/url] .
скачать leon
This paragraph gives clear idea for the new users of blogging, that genuinely how to do blogging and site-building.
https://info.unsia.ac.id/wp-admin/sys/?brand=togelon-176
Спасибо вам!
Предлагаю вам [url=https://rufilmonline.ru/]русские фильмы[/url] – это настоящее искусство, которое нравится огромному количество зрителей по всему миру. Русские фильмы и сериалы предлагают уникальный взгляд на русскую культуру, историю и обычаи. Сейчас смотреть русские фильмы и сериалы онлайн стало очень просто за счет множества онлайн кинотеатров. От ужасов до комедий, от исторических лент до современных детективов – выбор огромен. Погрузитесь в невероятные сюжеты, профессиональную актерскую работу и красивую операторскую работу, наслаждаясь кинематографией из России прямо у себя дома.
https://sipp.pa-malili.go.id/?web=rupiahtoto-alternatif
https://calculatortiktok.com/
скачать бк leon
It’s very simple to find out any topic on web as compared to books, as
I found this paragraph at this web site.
wow, amazing
https://tigadiva.pkctamansari.com/cdn/shopee/?id=INDRATOGEL20LOGIN
сплит системы каталог цены [url=http://split-sistema11.ru/]http://split-sistema11.ru/[/url] .
Your trust in us is our number one concern. That’s why we work
with complete transparency and dedication to your case.
Rest easy of recovering your QIWI wallet balance with our professional assistance.
Как поддерживать зеленый цвет рулонного газона
заказать рулонный газон [url=https://rulonnyygazon177.ru/]https://rulonnyygazon177.ru/[/url] .
Простые советы по уходу за рулонным газоном
рулонный газон купить [url=https://rulonnyygazon177.ru/]https://rulonnyygazon177.ru/[/url] .
Indulge in the thrilling world of online casinos Kenya, where cutting-edge games and lightning-fast payouts are the hallmarks.
Простые советы по уходу за рулонным газоном
рулонный газон купить цена [url=https://rulonnyygazon177.ru/]https://rulonnyygazon177.ru/[/url] .
Простые советы по уходу за рулонным газоном
рулонный газон москва [url=https://rulonnyygazon177.ru/]https://rulonnyygazon177.ru/[/url] .
Идеи для декорирования сада с помощью рулонного газона
рулонный газон стоимость [url=https://rulonnyygazon177.ru/]https://rulonnyygazon177.ru/[/url] .
https://tigadiva.pkctamansari.com/cdn/shopee/?id=INDRATOGEL20LOGIN
wow, amazing
Какие сорта рулонного газона наиболее устойчивы к тени
рулонный газон купить [url=https://rulonnyygazon177.ru/]https://rulonnyygazon177.ru/[/url] .
wow, amazing
https://blockchainreporter.net/space-id-partners-with-polyhedra-network-for-web3-interoperability/
На сайте [url=https://newswomanblog.win/]newswomanblog.win[/url] представлены анкеты самых разных путан. Есть обычные девушки с типовыми услугами, которые готовы удовлетворить желания клиента за небольшую плату. Также здесь имеются элитные жрицы любви, предоставляющие интим-услуги с приставкой ВИП. Своей красотой они способны ослепить, при этом могу делать в постели абсолютно все: от классики до экстрима. Конечно, такие девушки стоят дорого, но оно того стоит. Даже один час наедине с такой красоткой будет много лет согревать душу и бередить воображение.
Почувствовать себя сексуальным гигантом и забывать про любые условности в постели помогут проститутки из Москвы. Для них просьба клиента — закон, а главная миссия — полное удовлетворение самых смелых желаний. Найти лучших путан можно на сайте [url=https://newswomanblog.win/]newswomanblog.win[/url], где представлены сотни подробных анкет. В каждой указаны услуги, расценки и даны подробные фото девушек. Там же можно уточнить, где произойдет встреча с проституткой — в ее уютных апартаментах или она приедет по вызову в гости.
אסתטיים עם טעם מצוין! כיצד למצוא המושלמות בעוד הביקוש לבילויים דיסקרטיים עם ממשיך לגדול, חשוב למצוא סוכנות מכובדת ומקצועית עם הלקוח ומספקות שירות מותאם אישית המבוסס על העדפות ורצונות אישיים של כל אחד. מזמינות אותך עכשיו לביקור כדי לבנות אנרגיה מינית שלך נערות ליווי בחיפה
לציין כי מרבית מספקות מפגשים פרטיים ובטוחים, בהם מכבדים גם את פרטיות הלקוח וגם את גבולותיו האינטימיים. תחושות מוגברות עם לכל אחד שמחפש חוויה הכי מפנקת! אמנות הפינוק האירוטי של נערות שמחכות לכם ב דורשת מיומנות, רגישות והבנה מעמיקה של האזורים דירות דיסקרטיות באשדוד
ללילה שלם או כמה שעות. בין אם אתה מקומי או תייר שמחפש הרפתקאות אינטימיות חדשות, התמכרות מענגת לבילוי אירוטי כזה יכולה להיות פשוט הרצונות הנסתרים שלהם. להזמין עכשיו לדירות נופש או בתי מלון בעיר ליצירת חוויה אירוטית הכי מאושרת! כל הפרטים באתר לגברים הכי נערות ליווי בתל אביב
fishing boat rental destin fl https://boatrent.shop/
blablablu
bluatblaaotuy
bluatblaaotuy
Если вам надоел пресный секс и давно хочется разнообразить свой интим, самое время воспользоваться услугами проститутки. Для этого достаточно посетить сайт [url=https://newswomanblog.win/]newswomanblog.win[/url], где доступны анкеты самых разных индивидуалок. Кроме классического вагинального секса они предлагают многие другие услуги: анал, ролевые игры, доминирование, окончание в рот, золотой дождь и т.д. Это целый калейдоскоп удовольствий. Выбирайте понравившуюся путану в Москве и открывайте для себя новые грани секса.
окно аудио звуковое оборудование [url=https://zvukovoe-oborudovanie11.ru/]https://zvukovoe-oborudovanie11.ru/[/url] .
אסתטיים עם טעם מצוין! כיצד למצוא המושלמות בעוד הביקוש לבילויים דיסקרטיים עם ממשיך לגדול, חשוב למצוא סוכנות מכובדת ומקצועית עם טוטאלית! האם אתה סוף סוף מוכן לגלות את הסודות החבויים בעולם הפינוק הארוטי למבוגרים בעיר החובקת תשוקה? עם התגברות ההתעניינות כלפי דירות דיסקרטיות באשקלון
Не зря говорят, что в Москве проститутки самые красивые и раскрепощенные. Они могут доставить такое наслаждение, которое мужчина никогда не получит в постели с женой ли подругой. Все дело в техниках удовлетворения, которыми путаны владеют в совершенстве. Они без проблем делают горловой минет, позволяют иметь их в попу и т.д. Найти проститутку не сложно — достаточно открыть сайт [url=https://newswomanblog.win/]newswomanblog.win[/url]. Здесь размещены анкеты путан, среди которых можно легко выбрать девушку по своим запросам в плане внешности и других параметров.
Lovely, very cool
blablablu
blublabla
bliblibli
חוויה מחוץ לעולם הזה שתפתה את הגוף והנפש שלך. בנוסף הן בהחלט יכולות לשפר את המודעות שלך לגוף ולעזור לך להתחבר עם החושניות שלך גבולות אינטימיים ספציפיים שיש לך. מידע זה מסייע להתאים את הפגישה לצרכים האישיים ולהבטיח לך חוויה נוחה ומהנה, לשחרר את הציפיות דירות דיסקרטיות בבאר שבע
blublun
Здравствуйте автомобилисты!
Сайт https://i4car.net/category/avtosoveti/ предлагает все, что нужно знать о мире автомобилей: от подробных обзоров до эксклюзивных тест-драйвов и актуальных новостей.
[url=https://i4car.net/category/moto/]Мотоциклы[/url]
новости автомобылей
i4car.net
Удачи и хорошей дороги!
https://github.com/ForexRobotEasy/Advanced-Range-Breakout-MT5
nice content!nice history!!
Почувствовать себя сексуальным гигантом и забывать про любые условности в постели помогут проститутки из Москвы. Для них просьба клиента — закон, а главная миссия — полное удовлетворение самых смелых желаний. Найти лучших путан можно на сайте [url=https://newswomanblog.win/]newswomanblog.win[/url], где представлены сотни подробных анкет. В каждой указаны услуги, расценки и даны подробные фото девушек. Там же можно уточнить, где произойдет встреча с проституткой — в ее уютных апартаментах или она приедет по вызову в гости.
124969D742
124SDS9742
wow, amazing
Благодарю за потраченное время.
Представляю вам [url=https://rufilmonline.ru/boeviki/]русские боевики[/url] – это настоящее искусство, которое нравится огромному количество зрителей по всему миру. Русские фильмы и сериалы раскрывают русскию культуру с новой стороны и рассказывают историю и обычаи. Сейчас смотреть русские фильмы и сериалы онлайн стало легко за счет большого числа источников. От мелодрам до комедий, от исторических лент до фантастики – выбор огромен. Окунитесь в невероятные сюжеты, талантливые актерские исполнения и красивую работу оператора, смотрите фильмы и сериалы из России прямо у себя дома.
1SS3D249742
Zet Casino ist ein beliebtes Online-Casino, das eine Vielzahl von Spielen fГјr seine Spieler anbietet. Allerdings gibt es immer wieder Berichte darГјber, dass das Casino Schwierigkeiten hat, Auszahlungen an seine Spieler zu leisten.
Spieler berichten, dass sie lange auf ihre Auszahlungen warten müssen und der Kundenservice des Casinos oft nicht hilfreich ist. Einige Spieler geben an, dass sie ihre Gewinne nie erhalten haben und dass das Casino ihnen keine Erklärung dafür gibt.
Diese Berichte haben dazu geführt, dass viele Spieler skeptisch geworden sind, ob Zet Casino tatsächlich seine Spieler auszahlt. Es gibt sogar Fälle, in denen Spieler rechtliche Schritte gegen das Casino eingeleitet haben, um ihr Geld zurückzubekommen.
Es ist wichtig, dass Spieler vorsichtig sind, wenn sie in Online-Casinos spielen und sicherstellen, dass sie sich für ein vertrauenswürdiges und zuverlässiges Casino entscheiden.
Zet Casino hat bisher nicht öffentlich auf die Vorwürfe reagiert, aber es ist wichtig, dass sich Spieler bewusst sind, dass es möglicherweise Probleme mit Auszahlungen geben kann. Es ist ratsam, Bewertungen und Erfahrungen anderer Spieler zu lesen, bevor man sich für ein Online-Casino entscheidet.
Insgesamt sollten Spieler vorsichtig sein, wenn es um das Zet Casino geht und sichergehen, dass sie ihr Geld in vertrauenswürdigen Händen wissen.
https://zetcasino.one/
Boomerang-Casino: Ein aufregendes neues Online-Casino-Erlebnis
Das Boomerang-Casino ist eines der neuesten Online-Casinos, das die iGaming-Szene erobert. Mit einer Vielzahl von aufregenden Spielen, lukrativen Boni und einer benutzerfreundlichen Plattform hat es bereits die Aufmerksamkeit von Spielern auf der ganzen Welt auf sich gezogen.
Das erste, was die Spieler beim Betreten des Boomerang-Casinos bemerken, ist die moderne und ansprechende Benutzeroberfläche. Mit klaren Grafiken und intuitiver Navigation ist es einfach, sich auf der Website zurechtzufinden und die gewünschten Spiele zu finden.
Das Casino bietet eine breite Palette von Spielen, darunter klassische Tischspiele wie Blackjack, Roulette und Baccarat, sowie eine Vielzahl von Spielautomaten und Video-Poker-Spielen. Die Spiele werden von einigen der fГјhrenden Softwareanbieter der Branche bereitgestellt, darunter NetEnt, Microgaming und Play’n GO, was fГјr QualitГ¤t und Vielfalt bГјrgt.
Ein weiterer großer Anreiz, im Boomerang-Casino zu spielen, sind die großzügigen Boni und Promotionen, die regelmäßig angeboten werden. Neue Spieler können von einem Willkommensbonus profitieren, der kostenlose Spielgelder oder Freispiele beinhaltet. Darüber hinaus werden loyalen Spielern verschiedene Treuebelohnungen und Boni angeboten, um sie bei Laune zu halten.
Das Casino bietet auch eine Vielzahl von sicheren und bequemen Ein- und Auszahlungsmethoden, so dass die Spieler sicher sein können, dass ihre finanziellen Transaktionen geschützt sind. Der Kundenservice steht rund um die Uhr zur Verfügung, um bei Fragen oder Problemen zu helfen, und das Casino ist lizenziert und reguliert, um ein faires und sicheres Spielerlebnis zu gewährleisten.
Insgesamt bietet das Boomerang-Casino ein aufregendes und lohnendes Spielerlebnis fГјr alle, die auf der Suche nach einem neuen Online-Casino sind. Mit seiner groГџen Auswahl an Spielen, groГџzГјgigen Boni und erstklassigem Kundenservice ist es definitiv einen Besuch wert.
https://boomerangcasino.one/
Das Tipico Casino bietet seinen Kunden die Möglichkeit, ihre Gewinne zu verdoppeln – ein Feature, das viele Spieler fasziniert. Doch wie funktioniert das Verdoppeln im Tipico Casino eigentlich?
Beim Verdoppeln handelt es sich um eine einfache Strategie, um die Gewinne beim Spielen im Casino zu steigern. Dabei setzt der Spieler seinen Gewinn auf eine zusätzliche Wette und versucht, diese zu verdoppeln. Beim Tipico Casino erfolgt dies in der Regel über ein spezielles Feature oder eine Funktion, die es dem Spieler ermöglicht, seinen Gewinn zu verdoppeln.
Um im Tipico Casino erfolgreich zu verdoppeln, ist es wichtig, die richtige Strategie zu wählen. Der Spieler muss sich gut überlegen, wann und wie er sein Geld einsetzt, um die Chancen auf einen Gewinn zu maximieren. Zudem ist es wichtig, die Regeln und Bedingungen des Verdoppelns im Tipico Casino zu kennen, um keine Fehler zu machen.
Es ist zu beachten, dass das Verdoppeln im Tipico Casino auch mit Risiken verbunden ist. Es kann dazu führen, dass der Spieler seinen Gewinn komplett verliert, wenn die zusätzliche Wette nicht erfolgreich ist. Daher ist es wichtig, verantwortungsvoll zu spielen und nur Geld einzusetzen, das man sich leisten kann zu verlieren.
Insgesamt bietet das Verdoppeln im Tipico Casino eine spannende Möglichkeit, die Gewinne beim Spielen zu erhöhen. Mit der richtigen Strategie und etwas Glück können Spieler ihren Einsatz verdoppeln und so noch mehr Spaß am Spiel haben. Wer die Regeln und Bedingungen beachtet und verantwortungsvoll spielt, kann das Verdoppeln im Tipico Casino erfolgreich nutzen.
https://tipicocasino.one/
blabla
להדריך אותך לקראת חוויה בטוחה ומהנה. התקשר או שלח הודעת ווצאפ למספרי טלפון שמופיעים בכל מודעה כדי לברר פרטים קטנים וכל מה שחשוב ורצוי להזמין שירותי לא ברגע האחרון. לדוגמה, אם אתה רוצה להיפגש עם צעירה יפיפיה בשעות הלילה, עדיף לבצע הזמנה כמה שעות לפני כי אז דירות דיסקרטיות בתל אביב
Zet Bet Casino ist eine beliebte Online-GlГјcksspielplattform, die Spielern aus der ganzen Welt eine Vielzahl von Casino-Spielen und Sportwetten anbietet. Das Casino zeichnet sich durch sein umfangreiches Spielangebot, groГџzГјgige Boni und Promotionen sowie ein benutzerfreundliches Design aus.
Eines der Highlights von Zet Bet Casino ist die Auswahl an Spielautomaten, einschlieГџlich beliebter Titel von fГјhrenden Entwicklern wie NetEnt, Microgaming und Play’n GO. Spieler kГ¶nnen aus Hunderten von Slots wГ¤hlen, darunter klassische Fruchtmaschinen, Video-Slots mit aufregenden Bonusrunden und progressiven Jackpot-Spielen, die lebensverГ¤ndernde Gewinne bieten kГ¶nnen.
Neben Spielautomaten bietet Zet Bet Casino auch eine breite Palette von Tischspielen wie Blackjack, Roulette, Baccarat und Poker an. Diese Spiele sind in verschiedenen Varianten verfГјgbar, um den BedГјrfnissen und Vorlieben aller Spieler gerecht zu werden.
Für diejenigen, die Sportwetten bevorzugen, bietet Zet Bet auch eine umfangreiche Auswahl an Wettoptionen für eine Vielzahl von Sportarten und Veranstaltungen. Von Fußball über Tennis bis hin zu eSports können Spieler auf ihre Lieblingsteams und -spieler wetten und ihre Gewinnchancen maximieren.
Zet Bet Casino belohnt neue Spieler mit großzügigen Willkommensboni und bietet auch regelmäßige Werbeaktionen und Belohnungen an bestehende Spieler. Darüber hinaus bietet das Casino ein Treueprogramm, das es Spielern ermöglicht, Punkte zu sammeln und gegen Bonusguthaben, Freispiele und andere attraktive Preise einzutauschen.
Mit einer sicheren und transparenten Spielumgebung, erstklassigem Kundenservice und schnellen Auszahlungen ist Zet Bet Casino eine ausgezeichnete Wahl fГјr Spieler, die nach einer unterhaltsamen und lohnenden Spielerfahrung suchen. Besuchen Sie noch heute das Zet Bet Casino und entdecken Sie die aufregende Welt des Online-GlГјcksspiels!
https://zetcasino.one/
1win казино
blibliblu
Портал с полезными и актуальными материалами по [url=https://comfort-potok.ru/]недвижимости[/url]
На нашем сайте вы можете ознакомиться с такими темами как [url=https://comfort-potok.ru/category/prava-i-obyazannosti-sobstvennikov/]ПРАВА И ОБЯЗАННОСТИ СОБСТВЕННИКОВ[/url] и [url=https://comfort-potok.ru/]ИЗМЕНЕНИЯ В КАДАСТРЕ НЕДВИЖИМОСТИ[/url]
124969D742
blabla
Boomerang Casino Bonus ohne Einzahlung
Das Boomerang Casino ist eines der beliebtesten Online-Casinos für Spieler, die auf der Suche nach aufregenden und lukrativen Bonusangeboten sind. Eine besonders beliebte Aktion im Boomerang Casino ist der Bonus ohne Einzahlung. Bei diesem Bonus erhalten Spieler die Möglichkeit, echtes Geld zu gewinnen, ohne selbst eine Einzahlung tätigen zu müssen.
Der Bonus ohne Einzahlung im Boomerang Casino kann in Form von Freispielen oder Bonusgeld ausgezahlt werden. Oftmals erhalten neue Spieler nach der Registrierung im Casino automatisch einen bestimmten Betrag an Bonusgeld oder Freispielen gutgeschrieben, ohne dass sie dafür eine Einzahlung tätigen müssen. Dieser Bonus ermöglicht es Spielern, das Angebot des Casinos risikofrei auszuprobieren und erste Gewinne zu erzielen, ohne dabei ein finanzielles Risiko einzugehen.
Um den Boomerang Casino Bonus ohne Einzahlung zu erhalten, müssen Spieler lediglich ein Konto im Casino erstellen und gegebenenfalls einen Bonuscode eingeben. Anschließend können sie sofort mit dem Spielen beginnen und die spannenden Spiele und lukrativen Gewinnchancen im Boomerang Casino entdecken.
Es ist jedoch zu beachten, dass Boni ohne Einzahlung im Boomerang Casino meist an bestimmte Umsatzbedingungen geknüpft sind. Spieler müssen die Gewinne aus dem Bonus in der Regel mehrfach umsetzen, bevor sie eine Auszahlung beantragen können. Dennoch bieten diese Boni eine großartige Möglichkeit, das Casino und seine Spiele kennenzulernen, ohne dabei eigenes Geld riskieren zu müssen.
Alles in allem ist der Boomerang Casino Bonus ohne Einzahlung eine attraktive Aktion, die es Spielern ermöglicht, echtes Geld zu gewinnen, ohne dafür selbst eine Einzahlung tätigen zu müssen. Mit etwas Glück und Geschick können Spieler mit diesem Bonus tolle Gewinne erzielen und den Spielspaß im Boomerang Casino voll auskosten.
https://boomerangcasino.one/
Das tipico Casino ist vielen Spielern ein Begriff, die gerne ihr GlГјck in Online-Casinos versuchen. Eines der beliebtesten Spiele in diesem Casino ist Book of Ra, ein Spielautomat, der bereits seit vielen Jahren die Herzen von Spielern weltweit erobert hat.
Book of Ra ist ein Spielautomat aus dem Hause Novomatic, der bereits in Spielhallen und landbasierten Casinos für Furore gesorgt hat. Die Online-Version des Spiels bietet die gleiche spannende Spielatmosphäre und die gleichen Gewinnchancen wie das Original.
Das Spielprinzip von Book of Ra ist einfach: Der Spieler begibt sich auf eine Reise ins alte Ägypten, um die verborgenen Schätze der Pharaonen zu entdecken. Mit Hilfe des berühmten Book of Ra können die Spieler auf Schatzsuche gehen und dabei auf Gewinne hoffen.
Im tipico Casino können Spieler Book of Ra in verschiedenen Varianten spielen, darunter auch die Deluxe-Version des Spiels. Dabei stehen unterschiedliche Einsatzmöglichkeiten zur Verfügung, um sowohl Anfängern als auch erfahrenen Spielern gerecht zu werden.
Mit der Möglichkeit, Book of Ra im tipico Casino zu spielen, haben Spieler die Chance, ihr Glück an einem der beliebtesten Spielautomaten aller Zeiten zu versuchen. Die spannende Spielatmosphäre, die tollen Grafiken und Soundeffekte sowie die hohen Gewinnchancen machen Book of Ra zu einem absoluten Highlight im tipico Casino.
Egal ob Sie ein Fan von Spielautomaten sind oder einfach nur auf der Suche nach einem unterhaltsamen Spiel sind, Book of Ra im tipico Casino ist auf jeden Fall einen Versuch wert. Tauchen Sie ein in die Welt des alten Ägyptens und hoffen Sie auf große Gewinne – mit Book of Ra im tipico Casino ist alles möglich!
https://tipicocasino.one/
Zet Casino: Legal in Deutschland?
Seit seiner GrГјndung im Jahr 2018 hat sich das Zet Casino zu einer beliebten Online-GlГјcksspielplattform fГјr Spieler aus der ganzen Welt entwickelt. Doch die Frage, die sich viele deutsche Spieler stellen, ist: Ist Zet Casino legal in Deutschland?
Die Antwort auf diese Frage ist nicht ganz einfach, da die Gesetze bezüglich Online-Glücksspiel in Deutschland komplex und oft verwirrend sind. Im Jahr 2021 wurde der Glücksspielstaatsvertrag in Deutschland geändert, um die Regulierung des Online-Glücksspiels zu verbessern. Unter dieser neuen Gesetzgebung ist es legal, in einem Online-Casino zu spielen, das eine gültige Lizenz von einer deutschen Glücksspielbehörde besitzt.
Zet Casino ist im Besitz einer Lizenz der Malta Gaming Authority, einer renommierten Glücksspielregulierungsbehörde. Obwohl dies keine deutsche Lizenz ist, können deutsche Spieler dennoch bei Zet Casino spielen, da die Malta Gaming Authority eine der angesehensten Glücksspielbehörden der Welt ist und strenge Auflagen für Lizenznehmer hat.
Es ist jedoch wichtig zu beachten, dass Spieler in Deutschland selbst dafür verantwortlich sind, die Gesetze bezüglich Online-Glücksspiel in ihrem Land zu kennen und einzuhalten. Es wird empfohlen, nur in Online-Casinos zu spielen, die über gültige Lizenzen verfügen und von seriösen Behörden reguliert werden, um sicherzustellen, dass das Spielerlebnis sicher und fair ist.
Insgesamt kann gesagt werden, dass Zet Casino legal in Deutschland ist, solange die Spieler die geltenden Gesetze beachten und nur in lizenzierten und regulierten Online-Casinos spielen. Mit einer breiten Auswahl an Spielen und attraktiven Bonusangeboten ist Zet Casino eine gute Wahl fГјr deutsche Spieler, die nach einer sicheren und unterhaltsamen Online-GlГјcksspielplattform suchen.
https://zetcasino.one/
Tipico Casino Offline
In der heutigen digitalen Welt ist es immer seltener, dass Unternehmen ihre Produkte und Dienstleistungen ausschließlich offline anbieten. Doch es gibt immer noch einige Branchen, die auf den persönlichen Kontakt setzten, so auch das Tipico Casino.
Das Tipico Casino ist eine der bekanntesten und beliebtesten Online-Glücksspielplattformen in Deutschland. Mit einer Vielzahl von Spielautomaten, Tischspielen und Live-Casino-Spielen bietet das Tipico Casino seinen Kunden eine breite Auswahl an Unterhaltungsmöglichkeiten. Doch was viele nicht wissen: Tipico bietet auch die Möglichkeit, offline zu spielen.
Das Konzept des offline Casinos von Tipico ist simpel: An ausgewählten Standorten, meist in größeren Städten, können Kunden ihre Lieblingsspiele auch ohne Internetverbindung spielen. Dort stehen Spielautomaten, Roulette-Tische und andere Casinospiele zur Verfügung, die ganz klassisch im realen Leben gespielt werden können.
Der Vorteil des offline Casinos liegt vor allem in der persönlichen Betreuung durch geschultes Personal. Die Mitarbeiter stehen den Kunden bei Fragen und Problemen zur Seite und sorgen für ein sicheres und verantwortungsvolles Spielumfeld. Zudem bietet das offline Casino von Tipico eine besondere Atmosphäre, die man online nicht erleben kann.
Wer also Lust auf ein traditionelles CasinovergnГјgen hat, kann sich jederzeit in einem offline Casino von Tipico vergnГјgen. Egal ob alleine oder mit Freunden, das Tipico Casino bietet eine unterhaltsame Abwechslung zum Online-Spielen und sorgt fГјr spannende Stunden voller SpaГџ und Spannung.
https://tipicocasino.one/
Благодарю за потраченное время.
Предлагаю вам [url=https://rufilmonline.ru/]смотреть фильмы онлайн бесплатно русские[/url] – это настоящее искусство, которое покоряет сердца зрителей по всему миру. Русские фильмы и сериалы предлагают уникальный взгляд на русскую культуру, историю и обычаи. Сейчас смотреть русские фильмы и сериалы онлайн стало очень просто за счет большого числа источников. От мелодрам до боевиков, от исторических фильмов до фантастики – выбор безграничен. Погрузитесь в захватывающие сюжеты, профессиональную актерскую работу и красивую операторскую работу, смотрите фильмы и сериалы из РФ прямо у себя дома.
Boomerang Casino Bewertungen: Erfahrungen und Meinungen
Das Boomerang Casino ist eine Online-Spielhalle, die sich in den letzten Jahren einen Namen in der GlГјcksspielbranche gemacht hat. Mit einer Vielzahl von Spielen, attraktiven Boni und einem benutzerfreundlichen Design lockt das Casino Spieler aus der ganzen Welt an. Doch wie sind die Erfahrungen der Spieler mit dem Boomerang Casino?
Um dies herauszufinden, haben wir uns die Bewertungen und Meinungen der Nutzer genauer angesehen. Insgesamt fällt das Feedback zum Boomerang Casino überwiegend positiv aus. Viele Spieler loben die große Auswahl an Spielen, darunter Slots, Tischspiele, Live-Casino-Spiele und mehr. Auch die Grafik und Soundeffekte der Spiele wurden von den Nutzern positiv bewertet.
Ein weiterer Pluspunkt des Boomerang Casinos sind die attraktiven Boni und Promotionen, die regelmäßig angeboten werden. Spieler berichten von großzügigen Willkommensboni, Freispielen und Cashback-Angeboten, die das Spielerlebnis noch spannender machen. Auch die schnellen Auszahlungen und der zuverlässige Kundensupport wurden von den Nutzern gelobt.
Allerdings gibt es auch vereinzelt Kritikpunkte am Boomerang Casino. Einige Spieler bemängeln zum Beispiel die Umsatzbedingungen bei den Boni, die als zu hoch empfunden werden. Auch die Auswahl an Zahlungsmethoden könnte nach Meinung einiger Nutzer erweitert werden.
Insgesamt lässt sich sagen, dass das Boomerang Casino eine gute Wahl für Spieler ist, die auf der Suche nach einer abwechslungsreichen und unterhaltsamen Spielhalle sind. Mit einer großen Auswahl an Spielen, attraktiven Boni und einem zuverlässigen Kundensupport überzeugt das Casino auf ganzer Linie. Wer also auf der Suche nach einem neuen Online-Casino ist, sollte das Boomerang Casino definitiv in Betracht ziehen.
Insgesamt können wir das Boomerang Casino mit gutem Gewissen weiterempfehlen und würden uns über weitere positive Bewertungen freuen.
https://boomerangcasino.one/
Excellent website. Lots of useful information here.
I am sending it to a few friends ans additionally sharing in delicious.
And certainly, thanks for your effort!
комплексный аудит сайта [url=https://www.prodvizhenie-sajtov15.ru/]https://www.prodvizhenie-sajtov15.ru/[/url] .
Das Tipico Online Casino bietet seinen Spielern ab sofort die MГ¶glichkeit, jederzeit und Гјberall auf ihre Lieblingsspiele zuzugreifen – dank der neuen Tipico Online Casino App. Die App ist fГјr sowohl iOS- als auch Android-GerГ¤te verfГјgbar und ermГ¶glicht ein unkompliziertes und unterhaltsames Spielerlebnis direkt auf dem Smartphone oder Tablet.
Mit der Tipico Online Casino App haben Spieler die Möglichkeit, eine Vielzahl von Casino-Spielen zu genießen, darunter Slot-Spiele, Tischspiele wie Roulette und Blackjack, sowie spannende Live-Casino Spiele. Die App bietet eine moderne und benutzerfreundliche Oberfläche, die es einfach macht, zwischen verschiedenen Spielen zu navigieren und das Spiel zu genießen.
Neben der Vielfalt an Spielen bietet die App auch zahlreiche Vorteile für die Spieler. So können sie beispielsweise einfach und sicher Ein- und Auszahlungen tätigen, sowie von verschiedenen Bonusangeboten und Aktionen profitieren. Darüber hinaus bietet die App einen 24/7 Kundenservice, der Spieler bei Fragen oder Problemen unterstützt.
Insgesamt ist die Tipico Online Casino App eine großartige Ergänzung für alle Casino-Liebhaber, die auch unterwegs nicht auf ihr Spielerlebnis verzichten möchten. Mit einer breiten Auswahl an Spielen, einfachen Ein- und Auszahlungsmöglichkeiten und einem erstklassigen Kundenservice bietet die App alles, was das Spielerherz begehrt. Laden Sie die App noch heute herunter und tauchen Sie ein in die aufregende Welt des Tipico Online Casinos. Viel Spaß und viel Glück!
https://tipicocasino.one/
[url=http://vashdom-istra.ru/]Недвижимость в Истре[/url] – уникальная возможность инвестировать в жилье в курортном городе, окруженном природой и богатой историей
Очарование природы, бальзам для души, давно полюбившаяся местность – все это можно сказать о городе недалеко от Москвы, столицы России. Истринский край, насыщенный историей и культурой, притягивает своим уникальным колоритом и возможностью удовлетворить самые изысканные вкусы владельцев недвижимости.
Великолепные поместья, раскинувшиеся среди холмов, поражают своей архитектурой и удивительной красотой природы. Они являются настоящим полем для творчества и воплощения самых смелых идей, связанных с созданием идеальной атмосферы для комфортного проживания. Проходя через эти двери, вы сразу же погружаетесь в мир роскоши и умиротворения, где даже самые требовательные ценители недвижимости находят то, что долго искали.
Жизнь в этом регионе – это уникальная возможность наслаждаться просторным планом, где отражены вкусы и предпочтения каждого. Прекрасные видовые холмы, плодородные земли и кристально чистые озера придают этому месту особый шарм. Каждый участок и каждый дом, будь то современный архитектурный ансамбль или старинный особняк с богатой историей, обладают своей индивидуальностью, которая завораживает и приковывает взгляды прохожих и потенциальных покупателей.
Мы предлагаем скидку 15% на консультацию с юристом по недвижимости в Истре[/url]
124969D742
Boomerang Casino No Deposit Bonus Codes 2022: Was gibt es Neues?
Boomerang Casino ist bekannt für seine großzügigen Boni und Aktionen für Spieler. Im Jahr 2022 hat das beliebte Online-Casino eine Vielzahl von attraktiven Bonus-Codes ohne Einzahlung eingeführt, die es den Spielern ermöglichen, ihre Lieblingsspiele ohne Risiko zu genießen und dabei echtes Geld zu gewinnen.
Die no-deposit Bonus-Codes bei Boomerang Casino sind eine großartige Möglichkeit für neue Spieler, die Plattform kennenzulernen und erste Gewinne zu erzielen, ohne eigenes Geld einzahlen zu müssen. Mit diesen Codes können Spieler kostenlose Spielchips oder Freispiele auf ausgewählten Spielautomaten erhalten.
Um von den Bonus-Codes zu profitieren, mГјssen die Spieler einfach den entsprechenden Code bei der Registrierung oder auf der Einzahlungsseite eingeben. Das Bonusguthaben wird dann sofort auf das Spielerkonto gutgeschrieben und kann fГјr verschiedene Spiele im Casino verwendet werden.
Die Bonus-Codes von Boomerang Casino sind in der Regel zeitlich begrenzt und können sich regelmäßig ändern. Es lohnt sich also, regelmäßig auf der Website des Casinos vorbeizuschauen, um die aktuellsten Codes und Angebote nicht zu verpassen.
Zusätzlich zu den no-deposit Bonus-Codes bietet Boomerang Casino auch regelmäßige Einzahlungsboni, Treuepunkte und andere Aktionen, die es den Spielern ermöglichen, ihre Gewinne zu maximieren und das Spielerlebnis noch spannender zu gestalten.
Insgesamt bietet Boomerang Casino seinen Spielern eine Vielzahl von attraktiven Bonus-Codes und Aktionen, die ihnen dabei helfen, ihre Lieblingsspiele zu genieГџen und gleichzeitig echtes Geld zu gewinnen. Wer also auf der Suche nach einem unterhaltsamen und lohnenden Online-Casino-Erlebnis ist, sollte unbedingt die Bonus-Angebote von Boomerang Casino im Auge behalten.
https://boomerangcasino.one/
bliblibli
Die Tipico Casino App ist eine beliebte Option für all diejenigen, die gerne unterwegs in einem Online Casino spielen möchten. Mit dieser App haben Spieler die Möglichkeit, eine Vielzahl von Casino-Spielen wie Spielautomaten, Roulette, Blackjack und mehr auf ihren mobilen Geräten zu genießen.
Die App zeichnet sich durch ihr benutzerfreundliches Design und ihre hohe Qualität aus. Sie ist sowohl für Android- als auch für iOS-Geräte verfügbar und kann ganz einfach im jeweiligen App Store heruntergeladen werden.
Ein großer Vorteil der Tipico Casino App ist die große Auswahl an Spielen, die sie bietet. Spieler haben die Möglichkeit, aus Hunderten von verschiedenen Spielen zu wählen, so dass für jeden Geschmack etwas dabei ist. Darüber hinaus bietet die App auch regelmäßige Promotionen und Boni, die es Spielern ermöglichen, ihre Gewinne zu maximieren.
Ein weiterer Pluspunkt der Tipico Casino App ist die Möglichkeit, sowohl um Echtgeld als auch im Demo-Modus zu spielen. Auf diese Weise können Spieler die Spiele zunächst kostenlos ausprobieren, bevor sie echtes Geld einsetzen.
Zusammenfassend lässt sich sagen, dass die Tipico Casino App eine großartige Option für alle Casino-Liebhaber ist, die gerne mobil spielen möchten. Mit ihrer breiten Auswahl an Spielen, ihrem benutzerfreundlichen Design und ihren regelmäßigen Promotionen ist sie definitiv einen Download wert. Probieren Sie es noch heute aus und erleben Sie die Spannung eines Online Casinos ganz bequem von Ihrem Smartphone oder Tablet aus.
https://tipicocasino.one/
CRIMINAL
Zet Casino 30 Free Spins: Profitieren Sie von diesem groГџzГјgigen Angebot!
Das Zet Casino ist ein beliebter Anbieter von Online-Glücksspielen, der regelmäßig attraktive Bonusaktionen für seine Spieler anbietet. Eine davon ist das Angebot von 30 Freispielen, die Sie nutzen können, um verschiedene Slot-Spiele auszuprobieren und dabei echtes Geld zu gewinnen.
Um von diesem großzügigen Angebot zu profitieren, müssen Sie lediglich ein Konto bei Zet Casino erstellen und eine Einzahlung tätigen. Sobald Ihre Einzahlung bestätigt wurde, werden die 30 Freispiele automatisch Ihrem Konto gutgeschrieben. Sie können die Freispiele dann verwenden, um Ihr Glück an verschiedenen Slot-Spielen zu versuchen und hoffentlich einige große Gewinne zu erzielen.
Es ist wichtig zu beachten, dass die Freispiele bestimmten Bedingungen unterliegen. Zum Beispiel können die Gewinne, die Sie mit den Freispielen erzielen, einem Umsatzbedingung unterliegen, bevor Sie sie auszahlen lassen können. Es ist daher ratsam, die Geschäftsbedingungen des Angebots sorgfältig zu lesen, um sicherzustellen, dass Sie die Freispiele optimal nutzen können.
Insgesamt ist das Angebot von 30 Freispielen im Zet Casino eine großartige Möglichkeit, um das Casino kennenzulernen und einige der spannenden Slot-Spiele auszuprobieren, die es zu bieten hat. Wenn Sie also auf der Suche nach einer neuen Online-Glücksspielplattform sind, sollten Sie dieses Angebot auf jeden Fall in Betracht ziehen. Viel Glück und viel Spaß beim Spielen!
https://zetcasino.one/
wow, amazing
Tipico Casino Bonus Auszahlung
Das online Casino von Tipico bietet seinen Kunden eine Vielzahl von Bonusangeboten an. Doch wie funktioniert die Auszahlung dieser Boni?
Zunächst einmal ist es wichtig zu wissen, dass der Bonus bestimmten Bedingungen unterliegt. Diese können von Casino zu Casino variieren und sollten daher vor Inanspruchnahme des Bonus genau gelesen werden. In der Regel müssen bestimmte Umsatzbedingungen erfüllt werden, bevor eine Auszahlung des Bonus möglich ist.
Um den Bonus auszahlen zu können, müssen zunächst die Umsatzbedingungen erfüllt werden. Dies bedeutet, dass der Bonus eine bestimmte Anzahl von Malen umgesetzt werden muss, bevor eine Auszahlung möglich ist. Diese Anforderungen können je nach Art des Bonus und des Casinos unterschiedlich ausfallen.
Sobald die Umsatzbedingungen erfüllt sind, kann der Bonus ausgezahlt werden. Dazu muss man sich in sein Spielerkonto einloggen und die Auszahlungsoption wählen. Die Auszahlung wird dann vom Casino bearbeitet und das Geld wird auf das angegebene Konto überwiesen.
Es ist wichtig zu beachten, dass nicht alle Spiele gleichwertig zur Erfüllung der Umsatzbedingungen beitragen. Oftmals tragen zum Beispiel Spielautomaten zu 100% bei, während Tischspiele wie Roulette oder Blackjack nur zu einem geringeren Prozentsatz beitragen.
Insgesamt ist die Auszahlung von Casino Boni bei Tipico eine einfache und unkomplizierte Angelegenheit, sofern man die Bedingungen des Bonus beachtet und die Umsatzanforderungen erfГјllt.
Wer also auf der Suche nach einem guten Online Casino ist, sollte sich das Angebot von Tipico genauer anschauen und von den attraktiven Bonusangeboten profitieren.
https://tipicocasino.one/
palabraptu
Привет всем!
На сайте https://dtp.vn.ua/category/avto-news/ каждый желающий может ознакомиться с детальными отчетами о дорожно-транспортных происшествиях в Виннице. Наша цель — обеспечить общественность актуальной и точной информацией для повышения безопасности на дорогах.
[url=https://dtp.vn.ua/category/novosti-vinnitsa/]Главные новости Винницы [/url]
Дтп Винница сегодня
Дтп Винница видео
Удачи и хорошей дороги!
LOSE MONEY
bliblibli
[url=https://1xbet-application-fr.com]https://1xbet-application-fr.com[/url]
Working 1xbet mirror instead of entering the stiff website of the bookmaker. Use it to programme with 1xBet, bear bonuses and place online bets.
http://1xbet-application-fr.com
Zet Casino Bestes Spiel
Zet Casino ist eine beliebte Online-GlГјcksspielplattform, die eine Vielzahl von Spielen fГјr Spieler aus aller Welt anbietet. Mit einer breiten Auswahl an Spielautomaten, Tischspielen und Live-Dealer-Spielen gibt es fГјr jeden Geschmack etwas zu entdecken. Doch welches ist das beste Spiel im Zet Casino?
Eine klare Antwort auf diese Frage gibt es nicht, da die Vorlieben und Spielstärken jedes Spielers unterschiedlich sind. Jedoch gibt es einige Spiele, die bei den meisten Spielern besonders beliebt sind.
Eines davon ist sicherlich der Spielautomat Starburst. Dieser beliebte Slot von NetEnt bietet nicht nur ein ansprechendes Design und tolle Soundeffekte, sondern auch hohe Gewinnchancen. Mit seinem einfachen Spielprinzip und den vielen Bonusfunktionen ist Starburst ein echter Dauerbrenner unter den Spielautomaten.
Auch das Kartenspiel Blackjack erfreut sich großer Beliebtheit im Zet Casino. Dank seiner einfachen Regeln und der strategischen Tiefe zieht dieses Spiel viele Spieler an. Mit etwas Übung kann man hier seine Gewinnchancen deutlich erhöhen und große Gewinne erzielen.
FГјr Fans von Live-Dealer-Spielen ist Evolution Gamings Dream Catcher eine gute Wahl. Bei diesem GlГјcksrad-Spiel kann man mit etwas GlГјck hohe Gewinne erzielen und sich von einem charmanten Live-Dealer durch das Spiel fГјhren lassen.
Letztendlich liegt es aber an jedem Spieler selbst, sein persönliches Lieblingsspiel im Zet Casino zu finden. Mit einer großen Auswahl an hochwertigen Spielen und lukrativen Bonusangeboten gibt es hier für jeden etwas zu entdecken. Probieren Sie einfach verschiedene Spiele aus und finden Sie heraus, welches Spiel am besten zu Ihnen passt. Viel Spaß und viel Glück!
https://zetcasino.one/
https://adzan.online/
Es hat sich herumgesprochen, dass das Tipico Casino in letzter Zeit öfter einmal hängt. Viele Spieler haben bereits von Problemen mit der Stabilität der Plattform berichtet und beschweren sich über Verzögerungen beim Laden der Spiele oder gar komplette Abstürze.
Das Tipico Casino gilt eigentlich als einer der führenden Anbieter von Online Casinospielen in Deutschland, daher ist es umso enttäuschender zu sehen, dass die technischen Probleme hier so häufig auftreten. Spieler, die auf der Suche nach reibungslosem und unterhaltsamem Spielvergnügen sind, werden natürlich durch solche Probleme abgeschreckt.
Die GrГјnde fГјr die Probleme im Tipico Casino sind nicht ganz klar, aber es scheint, dass die Plattform einfach nicht mit der steigenden Anzahl von Spielern und den immer komplexer werdenden Spielen mithalten kann. Es gibt Vermutungen, dass die Server des Casinos Гјberlastet sind oder dass die Software veraltet ist.
Für Spieler ist es besonders ärgerlich, wenn sie gerade in einem Spiel sind und dann plötzlich alles hängt. Das kann nicht nur frustrierend sein, sondern auch zu Verlusten führen, wenn man zum Beispiel bei einem Slotspiel gerade kurz vor einem großen Gewinn steht.
Das Tipico Casino sollte sich dringend um die technischen Probleme kümmern und sicherstellen, dass die Plattform zuverlässig und stabil läuft. Ansonsten könnten sie viele Spieler an die Konkurrenz verlieren, die mit ihren Casinos keine derartigen Probleme haben.
Es bleibt zu hoffen, dass das Tipico Casino in naher Zukunft seine technischen Probleme lösen kann, damit die Spieler wieder unbeschwert spielen können. Bis dahin ist es empfehlenswert, sich vielleicht nach anderen Online Casinos umzusehen, die keine derartigen Schwierigkeiten haben.
https://tipicocasino.one/
LOSE MONEY
Zet Casino Free Spins: Spielen Sie kostenlos und gewinnen Sie groГџ
Wer liebt es nicht, kostenlos zu spielen und dabei die Chance zu haben, groß zu gewinnen? Mit Zet Casino Free Spins ist genau das möglich! Free Spins sind eine großartige Möglichkeit, um neue Spiele auszuprobieren, ohne dabei eigenes Geld einsetzen zu müssen. In diesem Artikel erfahren Sie alles, was Sie über Zet Casino Free Spins wissen müssen.
Zet Casino bietet eine Vielzahl von Free Spins für seine Spieler an. Diese können als Willkommensbonus für neue Spieler oder als regelmäßige Promotionen für bestehende Spieler angeboten werden. Die Free Spins können für bestimmte Slots oder Tischspiele verwendet werden und bieten die Möglichkeit, echtes Geld zu gewinnen, ohne eigenes Geld einzusetzen.
Um Free Spins zu erhalten, müssen Spieler bestimmte Bedingungen erfüllen. Dies kann die Registrierung eines neuen Kontos, eine erste Einzahlung oder die Teilnahme an einer bestimmten Promotion sein. Sobald die Bedingungen erfüllt sind, werden die Free Spins automatisch gutgeschrieben und können sofort verwendet werden.
Es ist wichtig zu beachten, dass Free Spins in der Regel an bestimmte Umsatzbedingungen gebunden sind. Dies bedeutet, dass Gewinne aus den Free Spins eine bestimmte Anzahl an Malen umgesetzt werden müssen, bevor sie ausgezahlt werden können. Es ist daher ratsam, die Geschäftsbedingungen der Free Spins sorgfältig zu lesen, um Missverständnisse zu vermeiden.
Zet Casino bietet eine Vielzahl von Free Spins für seine Spieler an, sodass für jeden etwas dabei ist. Egal, ob Sie ein erfahrener Spieler sind oder gerade erst anfangen, mit den Free Spins haben Sie die Möglichkeit, Ihr Glück zu versuchen und dabei viel Spaß zu haben. Nutzen Sie also die Gelegenheit und spielen Sie kostenlos bei Zet Casino!
https://zetcasino.one/
Tipico Geld weg Casino
Das Online-Casino Tipico erfreut sich großer Beliebtheit bei Spielern auf der ganzen Welt. Hier können Nutzer ihr Glück an einer Vielzahl von Spielen versuchen und mit etwas Glück hohe Gewinne erzielen. Doch leider kommt es immer wieder vor, dass Spieler ihr Geld im Casino verlieren und sich betrogen fühlen.
Ein häufig genannter Grund für den Verlust von Geld bei Tipico ist die Suchtgefahr, die Glücksspiele mit sich bringen können. Viele Menschen können nicht aufhören zu spielen, auch wenn sie bereits hohe Verluste erlitten haben. Dies führt dazu, dass sie immer mehr Geld setzen und am Ende mit leeren Taschen dastehen.
Ein weiterer Grund für den Verlust von Geld im Tipico Casino ist die fehlende Strategie beim Spielen. Viele Spieler gehen unüberlegt an die Spiele heran und setzen ihr Geld ohne Plan ein. Dadurch erhöht sich das Risiko, dass das Geld schnell verloren geht.
Zudem gibt es auch Fälle, in denen es zu Betrugsfällen im Tipico Casino kommt. Spieler berichten davon, dass sie nicht ihre Gewinne ausgezahlt bekommen haben oder dass es Probleme bei der Einzahlung ihres Geldes gab. In solchen Fällen fühlen sich die Spieler betrogen und hintergangen.
Um sein Geld im Tipico Casino nicht zu verlieren, ist es wichtig, verantwortungsvoll zu spielen und sich nicht von der Sucht nach dem nächsten großen Gewinn mitreißen zu lassen. Zudem sollte man sich Zeit nehmen, um sich mit den Spielen und ihren Regeln vertraut zu machen, um seine Chancen auf einen Gewinn zu erhöhen.
Insgesamt ist das Tipico Casino ein unterhaltsamer Ort, um sein Glück zu versuchen. Doch Vorsicht ist geboten, um nicht sein Geld zu verlieren und sich betrogen zu fühlen. Mit der richtigen Strategie und der nötigen Vorsicht kann man jedoch auch im Tipico Casino erfolgreich sein und hohe Gewinne erzielen.
https://tipicocasino.one/
Zet Casino ist eine beliebte Online-GlГјcksspielplattform, die eine Vielzahl von Spielen und groГџzГјgigen Boni anbietet. Einer der beliebtesten Boni, den Zet Casino seinen Spielern bietet, ist der No Deposit Bonus Code.
Ein No Deposit Bonus Code ist eine Art Bonus, bei dem Spieler kostenloses Geld erhalten, ohne eine Einzahlung tätigen zu müssen. Dies ist eine großartige Möglichkeit für Spieler, das Casino auszuprobieren und risikofrei echtes Geld zu gewinnen.
Um den No Deposit Bonus Code von Zet Casino zu erhalten, mГјssen Spieler einfach ein Konto erstellen und den Bonus Code bei der Registrierung eingeben. Der Bonus wird dann automatisch gutgeschrieben und kann fГјr verschiedene Spiele im Casino verwendet werden.
Der No Deposit Bonus Code von Zet Casino kann je nach Aktion und Zeitpunkt variieren, daher ist es wichtig, immer auf dem neuesten Stand zu bleiben und die Website regelmäßig auf aktualisierte Informationen zu überprüfen. Spieler können auch Benachrichtigungen vom Casino erhalten, um über spezielle Aktionen informiert zu werden.
Zet Casino bietet seinen Spielern eine Vielzahl von Spielen, darunter Spielautomaten, Tischspiele, Live-Casino und vieles mehr. Mit dem No Deposit Bonus Code haben Spieler die Möglichkeit, verschiedene Spiele auszuprobieren und echtes Geld zu gewinnen, ohne eigenes Geld einzahlen zu müssen.
Insgesamt ist der No Deposit Bonus Code von Zet Casino eine großartige Möglichkeit für Spieler, das Casino kennenzulernen und ihre Gewinnchancen zu erhöhen. Es lohnt sich auf jeden Fall, diese Aktion im Auge zu behalten und sie zu nutzen, wenn sich die Gelegenheit bietet. Viel Glück beim Spielen!
https://zetcasino.one/
Boomerang Casino: 50 Freispiele ohne Einzahlung
Boomerang Casino ist eine beliebte Online-Spielplattform, die eine Vielzahl von Spielen für Spieler jeden Alters und Geschmacks anbietet. Eines der beliebtesten Angebote von Boomerang Casino ist die Möglichkeit, 50 Freispiele ohne Einzahlung zu erhalten.
Mit diesen Freispielen können Spieler eine Vielzahl von Spielautomaten ausprobieren, ohne dabei eigenes Geld riskieren zu müssen. Dies ermöglicht es Spielern, die verschiedenen Spiele im Boomerang Casino kennenzulernen und sich mit der Plattform vertraut zu machen, bevor sie echtes Geld einsetzen.
Um die 50 Freispiele ohne Einzahlung zu erhalten, müssen Spieler sich lediglich auf der Website von Boomerang Casino anmelden und ein Konto erstellen. Sobald das Konto erstellt wurde, werden die Freispiele automatisch gutgeschrieben und können sofort genutzt werden.
Die Freispiele sind eine großartige Möglichkeit für Spieler, neue Spiele auszuprobieren und ihre Gewinnchancen zu erhöhen, ohne dabei eigenes Geld riskieren zu müssen. Spieler können ihre Gewinne aus den Freispielen auch behalten und für zukünftige Einsätze verwenden.
Wenn Sie also auf der Suche nach einem unterhaltsamen und spannenden Online-Casino-Erlebnis sind, sollten Sie auf jeden Fall die 50 Freispiele ohne Einzahlung von Boomerang Casino in Anspruch nehmen. Registrieren Sie sich noch heute und erleben Sie die aufregende Welt des Online-GlГјcksspiels bei Boomerang Casino. Viel GlГјck!
https://boomerangcasino.one/
Die tipico Casino App fГјr Android – Spannung und SpaГџ auf Ihrem Smartphone
Das tipico Casino bietet eine Vielzahl von Spielmöglichkeiten, von Slots über Tischspiele bis hin zu Live-Casino-Spielen. Mit der tipico Casino App können Sie all diese Spiele auch bequem auf Ihrem Android-Smartphone genießen.
Die App ist kostenlos und einfach zu bedienen. Sie können sich ganz einfach mit Ihrem tipico Konto anmelden und haben sofort Zugriff auf eine große Auswahl an Spielen. Die App bietet eine benutzerfreundliche Oberfläche und ermöglicht es Ihnen, Ihre Lieblingsspiele schnell zu finden und zu spielen.
Dank der mobilen App können Sie jederzeit und überall auf Ihre Lieblingsspiele zugreifen. Egal, ob Sie zu Hause auf der Couch sitzen oder unterwegs sind, mit der tipico Casino App haben Sie immer die Möglichkeit, ein paar Runden an Ihren Lieblingsspielen zu drehen.
Die tipico Casino App bietet auch regelmäßig spannende Aktionen und Bonusangebote für die Spieler an. So können Sie noch mehr Spaß haben und Ihre Gewinnchancen erhöhen.
Also, wenn Sie ein Fan von Casino-Spielen sind und ein Android-Smartphone besitzen, sollten Sie die tipico Casino App auf jeden Fall ausprobieren. Laden Sie die App einfach im Google Play Store herunter und tauchen Sie ein in die aufregende Welt des tipico Casinos. Viel SpaГџ und viel GlГјck beim Spielen!
https://tipicocasino.one/
механизированная штукатурка стен заказать [url=http://www.mekhanizirovannaya-shtukaturka11.ru]http://www.mekhanizirovannaya-shtukaturka11.ru[/url] .
Привет всем!
В сфере электронной коммерции, директ для маркетплейсов становится неотъемлемым инструментом для достижения коммерческого успеха. Яндекс.Директ предлагает уникальную возможность донести информацию о ваших товарах до широкой аудитории, используя целевую и контекстную рекламу. Этот инструмент позволяет точно настроить параметры показа объявлений, включая географию, интересы аудитории, и даже время показов, что делает рекламу максимально релевантной и эффективной.
Яндекс Директ для маркетплейсов предоставляет продавцам мощные аналитические инструменты для отслеживания результатов рекламных кампаний. Это включает в себя не только количество кликов и показов, но и более глубокие метрики, такие как конверсия в продажи и стоимость привлечения клиента. Такой подход позволяет оптимизировать рекламные кампании в реальном времени, снижая расходы и повышая общую рентабельность.
Работая с рекламой на маркетплейсах через Директ, важно понимать уникальные особенности и предпочтения вашей целевой аудитории. [url=https://директ-реклама-на-маркетплейсах.рф]директ для маркетплейсов[/url] Это поможет создавать привлекательные и мотивирующие объявления, которые не только увеличат видимость ваших товаров, но и приведут к росту продаж. Ключевым фактором здесь является творческий подход к написанию текстов объявлений и выбору изображений, так как именно эти элементы первыми привлекают внимание покупателей.
Особое внимание стоит уделить настройке Яндекс.Директ для маркетплейсов. Правильная настройка целевых страниц, ключевых слов и ставок может существенно повысить эффективность рекламных кампаний. Это требует глубокого понимания механизмов работы поисковых систем и поведения потребителей, а также готовности к постоянным экспериментам и адаптации стратегий.
Директ на маркетплейс – это не просто рекламный инструмент, это мощный механизм для увеличения продаж, который при правильном использовании способен значительно расширить вашу клиентскую базу и укрепить позиции на рынке. Вложения в качественную и продуманную рекламную кампанию через Яндекс.Директ окупаются повышением продаж на маркетплейсе.
Максимум информации по теме на: https://директ-реклама-на-маркетплейсах.рф
яндекс бизнес реклама для маркетплейса
яндекс директ для маркетплейсов
продажи на маркетплейсах через директ
реклама маркетплейсов через яндекс директ
Удачи и хороших продаж!
Das Zet Casino hat in den letzten Jahren an Popularität gewonnen und viele Spieler fragen sich, ob es sich um ein seriöses Online-Casino handelt. In diesem Artikel werden wir die wichtigsten Punkte beleuchten, um festzustellen, ob das Zet Casino vertrauenswürdig ist.
Zunächst einmal ist das Zet Casino im Besitz einer gültigen Glücksspiellizenz der Malta Gaming Authority, einer der angesehensten Regulierungsbehörden in der Glücksspielbranche. Dies bedeutet, dass das Casino strenge Vorschriften einhalten muss, um sicherzustellen, dass es fair und transparent ist. Darüber hinaus verwendet das Zet Casino eine sichere SSL-Verschlüsselung, um sicherzustellen, dass alle Ihre persönlichen Daten geschützt sind.
Ein weiterer wichtiger Aspekt ist die Spielauswahl. Das Zet Casino bietet eine Vielzahl von Spielen von renommierten Entwicklern wie NetEnt, Microgaming und Play’n GO an. Dies bedeutet, dass die Spiele fair und zufГ¤llig sind, da sie von unabhГ¤ngigen Drittorganisationen regelmäßig ГјberprГјft werden.
DarГјber hinaus bietet das Zet Casino verschiedene Zahlungsmethoden an, darunter Kreditkarten, E-Wallets und BankГјberweisungen. Alle Ein- und Auszahlungen werden schnell und sicher abgewickelt, um sicherzustellen, dass Ihre Gewinne rechtzeitig ausgezahlt werden.
Zusammenfassend lässt sich sagen, dass das Zet Casino als seriöses und vertrauenswürdiges Online-Casino angesehen werden kann. Mit einer gültigen Lizenz, einer vielfältigen Spielauswahl und sicheren Zahlungsmethoden ist das Zet Casino eine gute Wahl für Spieler, die eine sichere und unterhaltsame Glücksspielerfahrung suchen.
https://zetcasino.one/
cululutata
reduslim kaufen eba
Tipico Casino Fehler 50204
Das Tipico Casino ist eine beliebte Plattform für Glücksspiel und Unterhaltung. Doch manchmal kann es vorkommen, dass Spieler auf Fehlermeldungen stoßen, die sie davon abhalten, ihr Lieblingsspiel zu genießen. Einer dieser Fehler ist der „50204“-Fehler, der bei einigen Nutzern auftritt.
Der Fehlercode 50204 kann verschiedene Ursachen haben. Oftmals ist er auf technische Probleme zurückzuführen, die mit dem Server oder der Verbindung zum Casino zusammenhängen. In solchen Fällen kann es helfen, die Seite neu zu laden oder den Browsercache zu leeren. Auch ein Neustart des Geräts kann den Fehler beheben.
Es kann aber auch sein, dass der Fehler durch eine nicht aktuelle Version der Casinosoftware verursacht wird. In diesem Fall sollte man sicherstellen, dass man die neueste Version des Casinos heruntergeladen hat und gegebenenfalls ein Update durchfГјhren.
Es ist auch ratsam, den Kundenservice von Tipico zu kontaktieren, wenn der Fehler weiterhin auftritt. Die Mitarbeiter können helfen, das Problem zu identifizieren und eine Lösung zu finden.
Insgesamt ist der Fehler 50204 im Tipico Casino Г¤rgerlich, jedoch in der Regel leicht zu beheben. Mit ein paar einfachen Schritten kann man wieder problemlos spielen und SpaГџ haben.
https://tipicocasino.one/
Immer mehr Online-Casinos bieten ihren Kunden attraktive Bonusangebote an, um neue Spieler anzulocken und bestehende Kunden zu belohnen. Ein solches Angebot ist der sogenannte “boomerang.bet casino no deposit bonus”.
Bei einem No Deposit Bonus handelt es sich um einen Bonus, den Spieler erhalten, ohne dass sie zuvor eine Einzahlung tätigen müssen. Das bedeutet, dass man kostenlos spielen und echtes Geld gewinnen kann, ohne dabei eigenes Geld riskieren zu müssen.
Der boomerang.bet casino no deposit bonus ist besonders beliebt bei Spielern, die gerne risikofrei neue Spiele ausprobieren möchten. Mit diesem Bonus können Spieler verschiedene Spielautomaten, Tischspiele und andere Casino-Spiele ausprobieren, ohne dabei ihr eigenes Geld einzusetzen. Das bietet eine tolle Möglichkeit, um die verschiedenen Spiele des Casinos kennenzulernen und sich mit den Abläufen vertraut zu machen.
Um den boomerang.bet casino no deposit bonus zu erhalten, müssen Spieler sich lediglich auf der Webseite des Casinos registrieren. Anschließend wird der Bonus automatisch gutgeschrieben und kann sofort zum Spielen genutzt werden. Dabei sollten Spieler jedoch die Umsatzbedingungen beachten, die festlegen, wie oft der Bonus umgesetzt werden muss, bevor eine Auszahlung möglich ist.
Insgesamt bietet der boomerang.bet casino no deposit bonus eine tolle Gelegenheit, um kostenlos Casino-Spiele zu spielen und echtes Geld zu gewinnen. Spieler sollten diese Chance nutzen und sich die spannenden Spiele des Casinos genauer anschauen. Viel GlГјck und SpaГџ beim Spielen!
https://boomerangcasino.one/
reduslim kaufen ohne rezept
Das Tipico Casino ist eine beliebte Online-Glücksspielplattform, die eine Vielzahl von Spielen für Spieler bietet. Die Website ist benutzerfreundlich gestaltet und ermöglicht es den Nutzern, leicht auf ihre Lieblingsspiele zuzugreifen.
Das Tipico Casino bietet eine breite Palette von Spielen, darunter Slots, Tischspiele, Live-Casino-Spiele und vieles mehr. Die Plattform arbeitet mit renommierten Softwareanbietern zusammen, um hochwertige Spiele anzubieten, die eine realistische Casino-Erfahrung bieten.
Ein weiterer Pluspunkt des Tipico Casinos ist der Kundenservice, der rund um die Uhr verfügbar ist, um den Spielern bei Fragen oder Problemen zu helfen. Die Website verfügt auch über sichere Zahlungsmethoden, um sicherzustellen, dass die Spieler ihre Gewinne schnell und sicher erhalten können.
Darüber hinaus bietet das Tipico Casino regelmäßig spannende Aktionen und Boni für seine Spieler an. Dies kann von Einzahlungsboni bis hin zu Freispielen reichen, die den Spielern helfen können, ihre Gewinne zu steigern.
Insgesamt ist das Tipico Casino eine erstklassige GlГјcksspielplattform, die eine breite Palette von Spielen, erstklassigem Kundenservice und groГџzГјgigen Promotionen bietet. Spieler sollten die Website besuchen, um ein erstklassiges Online-Casino-Erlebnis zu genieГџen.
https://tipicocasino.one/
Zet Casino Bonus Code ohne Einzahlung
Suchen Sie nach einem aufregenden Online-Casino-Erlebnis ohne Risiko? Dann sollten Sie unbedingt den Zet Casino Bonus Code ohne Einzahlung in Betracht ziehen. Dieser Bonus bietet neuen Spielern die Möglichkeit, das Casino kostenlos zu erkunden und echtes Geld zu gewinnen, ohne ihr eigenes Geld einzahlen zu müssen.
Um den Zet Casino Bonus Code ohne Einzahlung zu beanspruchen, müssen Sie sich lediglich als neuer Spieler im Casino registrieren. Sobald Ihr Konto verifiziert ist, erhalten Sie den Bonus automatisch gutgeschrieben und können sofort mit dem Spielen beginnen.
Mit dem Zet Casino Bonus Code ohne Einzahlung haben Sie die Chance, eine Vielzahl von Spielen auszuprobieren, darunter Spielautomaten, Tischspiele, Live-Casino-Spiele und vieles mehr. Sie kГ¶nnen Ihr GlГјck bei beliebten Titeln wie Starburst, Gonzo’s Quest, Blackjack, Roulette und Baccarat versuchen.
Wenn Sie mit dem Zet Casino Bonus Code ohne Einzahlung gewinnen, können Sie Ihre Gewinne behalten und sogar auszahlen, sobald Sie die Bonusbedingungen erfüllt haben. Diese können je nach Casino variieren, daher ist es wichtig, die Geschäftsbedingungen sorgfältig zu lesen, bevor Sie mit dem Spielen beginnen.
Insgesamt bietet der Zet Casino Bonus Code ohne Einzahlung eine großartige Möglichkeit, neue Spiele auszuprobieren, ohne dabei Ihr eigenes Geld riskieren zu müssen. Nutzen Sie diese Gelegenheit, um sich mit dem Casino vertraut zu machen und vielleicht sogar einige tolle Gewinne zu erzielen. Viel Spaß beim Spielen!
https://zetcasino.one/
lalablublu
blublun
Das Tipico Casino ist bei vielen Spielern beliebt, nicht zuletzt wegen der täglichen Bonusangebote. Diese Bonusaktionen können Spielern zusätzliche Gewinnchancen und ein erhöhtes Spielvergnügen bieten. In diesem Artikel möchten wir genauer auf die täglichen Bonusangebote im Tipico Casino eingehen.
Das Tipico Casino bietet seinen Spielern täglich wechselnde Bonusaktionen an. Diese können in Form von Einzahlungsboni, Freispielen oder Cashback-Angeboten erfolgen. Zum Beispiel können Spieler an bestimmten Tagen der Woche einen Einzahlungsbonus erhalten, der ihre Einzahlung um einen bestimmten Prozentsatz erhöht. Dadurch haben Spieler die Möglichkeit, mit mehr Geld zu spielen und ihre Gewinnchancen zu steigern.
Ein weiteres beliebtes Angebot im Tipico Casino sind die Freispiele, die Spieler an ausgewählten Slots erhalten können. Diese Freispiele ermöglichen es den Spielern, ohne zusätzliche Kosten zu spielen und dabei echte Gewinne zu erzielen. Zudem gibt es auch Cashback-Angebote, bei denen Spieler einen Teil ihres verlorenen Geldes zurückbekommen können.
Um von den täglichen Bonusangeboten im Tipico Casino zu profitieren, müssen Spieler lediglich die jeweiligen Aktionsbedingungen erfüllen. Diese können beispielsweise eine Mindesteinzahlung oder ein Mindestumsatz sein. Es lohnt sich, regelmäßig auf der Webseite des Tipico Casinos nach neuen Angeboten zu schauen, um keine Aktion zu verpassen.
Zusammenfassend lässt sich sagen, dass die täglichen Bonusangebote im Tipico Casino eine attraktive Möglichkeit sind, um das Spielerlebnis zu verbessern und zusätzliche Gewinnchancen zu erhalten. Spieler sollten sich daher regelmäßig über die aktuellen Aktionen informieren und diese nutzen, um das Beste aus ihrem Casinobesuch herauszuholen.
https://tipicocasino.one/
Здравствуйте!
В сфере электронной коммерции, директ для маркетплейсов становится неотъемлемым инструментом для достижения коммерческого успеха. Яндекс.Директ предлагает уникальную возможность донести информацию о ваших товарах до широкой аудитории, используя целевую и контекстную рекламу. Этот инструмент позволяет точно настроить параметры показа объявлений, включая географию, интересы аудитории, и даже время показов, что делает рекламу максимально релевантной и эффективной.
Яндекс Директ для маркетплейсов предоставляет продавцам мощные аналитические инструменты для отслеживания результатов рекламных кампаний. Это включает в себя не только количество кликов и показов, но и более глубокие метрики, такие как конверсия в продажи и стоимость привлечения клиента. Такой подход позволяет оптимизировать рекламные кампании в реальном времени, снижая расходы и повышая общую рентабельность.
Работая с рекламой на маркетплейсах через Директ, важно понимать уникальные особенности и предпочтения вашей целевой аудитории. [url=https://директ-реклама-на-маркетплейсах.рф]яндекс бизнес реклама для маркетплейса[/url] Это поможет создавать привлекательные и мотивирующие объявления, которые не только увеличат видимость ваших товаров, но и приведут к росту продаж. Ключевым фактором здесь является творческий подход к написанию текстов объявлений и выбору изображений, так как именно эти элементы первыми привлекают внимание покупателей.
Особое внимание стоит уделить настройке Яндекс.Директ для маркетплейсов. Правильная настройка целевых страниц, ключевых слов и ставок может существенно повысить эффективность рекламных кампаний. Это требует глубокого понимания механизмов работы поисковых систем и поведения потребителей, а также готовности к постоянным экспериментам и адаптации стратегий.
Директ на маркетплейс – это не просто рекламный инструмент, это мощный механизм для увеличения продаж, который при правильном использовании способен значительно расширить вашу клиентскую базу и укрепить позиции на рынке. Вложения в качественную и продуманную рекламную кампанию через Яндекс.Директ окупаются повышением продаж на маркетплейсе.
Максимум информации по теме на: https://директ-реклама-на-маркетплейсах.рф
директ для маркетплейсов
реклама товаров на маркетплейсах через яндекс директ
как продвигать товары на маркетплейсах через директ
продажи на маркетплейсах через директ
Удачи и хороших продаж!
1249742
Das Online Casino Boomerang: Ein aufregendes Spielerlebnis
Das Online Casino Boomerang ist ein aufregendes neues Online-Casino, das von erfahrenen Casino-Experten entwickelt wurde. Es bietet eine Vielzahl von Spielen, darunter Slots, Tischspiele und Live-Casino-Spiele, die alle mit state-of-the-art-Technologie entwickelt wurden, um ein faires und spannendes Spielerlebnis zu bieten.
Einer der Hauptvorteile des Online Casino Boomerang ist sein einzigartiges Belohnungssystem. Spieler können sich für das Treueprogramm anmelden und Punkte sammeln, indem sie einfach spielen. Diese Punkte können dann gegen tolle Belohnungen wie Bonusguthaben, Freispiele und sogar Sachpreise eingelöst werden.
Darüber hinaus bietet das Online Casino Boomerang auch eine Vielzahl von sicheren und schnellen Zahlungsmethoden, einschließlich Kreditkarten, E-Wallets und Banküberweisungen. Spieler können sicher sein, dass ihre Einzahlungen und Auszahlungen schnell und einfach abgewickelt werden.
Ein weiterer Vorteil des Online Casino Boomerang ist sein hervorragender Kundenservice. Das Team von Casino-Experten steht rund um die Uhr zur Verfügung, um Fragen zu beantworten und Probleme zu lösen. Spieler können sich per Live-Chat, E-Mail oder Telefon an das Support-Team wenden.
Insgesamt bietet das Online Casino Boomerang ein aufregendes und faires Spielerlebnis fГјr alle Casino-Liebhaber. Mit einer Vielzahl von Spielen, einem groГџzГјgigen Belohnungssystem und erstklassigem Kundenservice ist es definitiv einen Besuch wert. Besuchen Sie noch heute das Online Casino Boomerang und erleben Sie die Spannung und Aufregung des Online-GlГјcksspiels.
https://boomerangcasino.one/
link [url=https://ensemblepatterns.com/]1win[/url]
blolbo
Tipico Casino ist eine beliebte Online-Glücksspielplattform, die eine Vielzahl von Spielen und Angeboten für ihre Spieler bereithält. Trotzdem haben einige Nutzer in letzter Zeit Probleme mit dem Casino gemeldet.
Eines der Hauptprobleme, das Spieler gemeldet haben, ist die langsame Auszahlung von Gewinnen. Viele Spieler haben berichtet, dass es Wochen dauert, bis ihre Auszahlungen bearbeitet werden und sie ihr Geld erhalten. Dies kann frustrierend sein, insbesondere wenn Spieler auf ihre Gewinne angewiesen sind.
Ein weiteres Problem, das häufig von Nutzern gemeldet wird, sind technische Schwierigkeiten beim Spielen. Viele Spieler klagen über Verzögerungen, Abstürze und andere technische Probleme, die ihr Spielerlebnis beeinträchtigen. Dies kann dazu führen, dass Spieler ihre Einsätze verlieren und frustriert das Casino verlassen.
DarГјber hinaus haben einige Spieler berichtet, dass der Kundenservice von Tipico Casino nicht zufriedenstellend ist. Viele Spieler klagen Гјber lange Wartezeiten auf Antworten auf ihre Anfragen sowie Гјber unfreundliche und uninformierte Mitarbeiter. Dies kann dazu fГјhren, dass Spieler sich unwohl fГјhlen und das Vertrauen in das Casino verlieren.
Es ist wichtig, dass Tipico Casino diese Probleme ernst nimmt und Maßnahmen ergreift, um sie zu lösen. Eine langsame Auszahlung von Gewinnen, technische Probleme und mangelnder Kundenservice können langfristig das Ansehen des Casinos schädigen und Spieler dazu bringen, zu anderen Anbietern zu wechseln.
Spieler sollten sich bewusst sein, dass es viele alternative Online-Casinos gibt, die möglicherweise eine bessere Erfahrung bieten. Es ist ratsam, Bewertungen und Erfahrungsberichte anderer Spieler zu lesen, bevor man sich für ein Online-Casino entscheidet.
Insgesamt bietet Tipico Casino eine vielfältige Auswahl an Spielen und Angeboten, aber die gemeldeten Probleme sollten von den Verantwortlichen ernst genommen und schnellstmöglich behoben werden, um das Vertrauen der Spieler zurückzugewinnen.
https://tipicocasino.one/
Zet Casino is a popular online casino that offers a wide range of games and exciting promotions for players. One of the most sought-after promotions at Zet Casino is the no deposit bonus codes that are offered to new players in 2019.
No deposit bonus codes are a great way for players to try out the casino and its games without risking their own money. These codes typically offer free spins or bonus cash that can be used to play real money games. At Zet Casino, new players can take advantage of these no deposit bonus codes to start their gaming experience on a high note.
To claim the no deposit bonus codes at Zet Casino, players simply need to sign up for an account and enter the code provided. This will unlock the bonus and allow players to start playing immediately. It’s important to note that there may be wagering requirements attached to these bonuses, so players should make sure to read the terms and conditions before using them.
In addition to the no deposit bonus codes, Zet Casino also offers a generous welcome package for new players. This includes a match bonus on the first deposit, as well as free spins on selected slots. This gives players even more reasons to join the casino and start playing their favorite games.
Overall, Zet Casino no deposit bonus codes for 2019 are a fantastic way for new players to get started at this online casino. With a wide selection of games, generous promotions, and a user-friendly interface, Zet Casino is a top choice for players looking for a fun and rewarding gaming experience.
https://zetcasino.one/
является участником банды . Именно помогла ему открыть сайт и теперь она за своё покровительство и раскрутку получает часть денег от клиентов-лохов, которых обработал мерзавец-шарлатан.
Как это обычно и бывает у мошенников, — это не настоящие имя-отчество, а очередной псевдоним. За случайной кличкой скрывается безработный, раньше уже мотавший сроки, продолжающий свою мошенническую деятельность.
Вместо реального фото, на вывешено сгенерированное нейросетью изображение мультяшного персонажа, эдакого старца-волхва. Настоящую же свою испитую,физиономию немаг тщательно скрывает, так как справедливо опасается, что вычислят и накажут.
Также на размещены написанные аферистом отзывы даже за 2010 год. В реальности же сайт появился всего пару недель назад – 15 февраля 2024 года. И именно эти две недели уголовник обманывает именно под кличкой.
Однако у него уже есть опыт в мошеннической деятельности, так как раньше он промышлял под кличками:
Будьте бдительны: и на сайте и на других подобных площадках действуют опасные и умелые в своей противозаконной деятельности аферисты. Они знают, как войти в доверие, но никто из них не способен оказать реальную помощь.
И шарлатан и подобные ему, постоянно дают пустые обещания. Деньги гребут лопатой, но никогда ни одному человеку не помогут. Так как все приписываемые им сверхъестественные способности — один сплошной обман. Ни один реальный отзыв от обманутых клиентов на не будет пропущен лжемагом – все отзывы от сам себе и пишет.
шарлатан фильм 2020 смотреть онлайн бесплатно в хорошем качестве
[url=https://teplica-teplourala.ru]Теплицы от производителя акции распродажи.[/url]
[url=https://teplica-teplourala.ru]Теплица с доставкой от производителя.[/url]
[url=https://teplica-teplourala.ru]Купить теплицу в рассрочку.[/url]
blublun
Юристы по алиментам, предоставляющие бесплатные консультации, играют значимую роль в доступе к юридической помощи для людей, имеющих ограниченные
финансовые возможности. Обращение
к таким специалистам становится неоценимой поддержкой в вопросах алиментных обязательств,
позволяя разобраться в сложностях
законодательства и правильно оформить необходимые документы.
Во многих случаях государственные и некоммерческие организации, юридические клиники при университетах и общественные центры предоставляют гражданам бесплатную юридическую помощь
по алиментным делам. Такие юристы
могут помочь с подачей иска, консультированием по вопросам уплаты или
взыскания алиментов, а также представлять интересы в суде.
Получение бесплатной юридической
помощи может потребовать предъявления доказательств о
низком доходе или других социальных
льготах, но это предоставляет возможность защитить свои права и интересы без необходимости нести большие финансовые расходы.
Бесплатные юристы по алиментам обеспечивают правовую поддержку, помогая получить справедливое решение по алиментным
обязательствам и улучшить материальное положение своих
клиентов.
my blog – сколько стоит адвокат по алиментам
blolbo
Das Boomerang-Casino: Eine aufregende neue Spielerfahrung
Das Boomerang-Casino ist eine innovative Online-GlГјcksspielplattform, die in der Welt des Online-Casinos fГјr Furore gesorgt hat. Mit einer Vielzahl von Spielen, groГџzГјgigen Boni und einem modernen Design bietet das Boomerang-Casino ein Spielerlebnis, das seinesgleichen sucht.
Einzigartig am Boomerang-Casino ist das Konzept des “Boomerang-Effekts”. Г„hnlich wie ein Boomerang, der immer wieder zu seinem Ausgangspunkt zurГјckkehrt, bietet das Casino den Spielern regelmäßige Boni und Promotionen, die sie immer wieder auf die Plattform zurГјcklocken. Dieser Ansatz hat sich als Г¤uГџerst beliebt erwiesen und hat dazu gefГјhrt, dass viele Spieler dem Boomerang-Casino treu geblieben sind.
Das Boomerang-Casino bietet eine breite Palette von Spielen, darunter Slots, Tischspiele und Live-Casino-Spiele. Mit Spielen von fГјhrenden Softwareanbietern wie NetEnt, Microgaming und Play’n GO kГ¶nnen die Spieler sicher sein, dass sie hochwertige und unterhaltsame Spiele genieГџen werden. DarГјber hinaus bietet das Casino regelmäßig neue Spiele sowie exklusive Titel an, die nur auf der Plattform verfГјgbar sind.
Neben einer Vielzahl von Spielen und spannenden Boni legt das Boomerang-Casino auch großen Wert auf Sicherheit und Fairness. Die Plattform verfügt über eine gültige Glücksspiellizenz und verwendet die neueste SSL-Verschlüsselungstechnologie, um sicherzustellen, dass die persönlichen und finanziellen Daten der Spieler geschützt sind. Das Casino arbeitet auch mit unabhängigen Prüfungsbehörden zusammen, um sicherzustellen, dass die Spiele fair und zufällig sind.
Insgesamt bietet das Boomerang-Casino eine aufregende und lohnende Spielerfahrung fГјr GlГјcksspielfans. Mit einer vielfГ¤ltigen Auswahl an Spielen, groГџzГјgigen Boni und einem innovativen Konzept des “Boomerang-Effekts” hat sich das Casino als eine der fГјhrenden Online-GlГјcksspielplattformen etabliert. Wenn Sie auf der Suche nach einem neuen und aufregenden Casino-Erlebnis sind, sollten Sie definitiv einen Blick auf das Boomerang-Casino werfen.
https://boomerangcasino.one/
lalablublu
m.zet Casino ist ein neues und aufregendes Online-Casino, das Spielern die Möglichkeit bietet, ihre Lieblingsspiele von überall aus zu genießen. Mit einer breiten Palette von Spielen, großzügigen Boni und erstklassigem Kundenservice ist m.zet Casino der ultimative Ort für Casino-Enthusiasten.
Das Casino bietet eine Vielzahl von Spielen, darunter Spielautomaten, Tischspiele, Video-Poker und Live-Dealer-Spiele. Egal, ob Sie ein Fan von klassischen Spielautomaten sind oder auf der Suche nach neuen und aufregenden Spielen sind, m.zet Casino hat fГјr jeden etwas zu bieten.
Ein weiterer großer Vorteil von m.zet Casino sind die großzügigen Boni und Promotionen, die regelmäßig angeboten werden. Neue Spieler können von einem Willkommensbonus profitieren, der ihre Einzahlungen erhöht und ihnen mehr Möglichkeiten bietet, zu gewinnen. Darüber hinaus gibt es auch regelmäßige Promotionen, die den Spielern zusätzliche Belohnungen bieten.
Der Kundenservice von m.zet Casino ist erstklassig und steht den Spielern rund um die Uhr zur VerfГјgung. Egal, ob es um technische Probleme, Fragen zu Boni oder einfach nur um Hilfe bei der Navigation auf der Website geht, das Team von m.zet Casino ist immer da, um zu helfen.
Insgesamt ist m.zet Casino eine groГџartige Wahl fГјr alle, die nach einem unterhaltsamen und spannenden Online-Casino-Erlebnis suchen. Mit einer Vielzahl von Spielen, groГџzГјgigen Boni und hervorragendem Kundenservice gibt es keinen Grund, warum Sie nicht heute noch Ihr GlГјck bei m.zet Casino versuchen sollten.
https://zetcasino.one/
[url=https://xn—-7sbbajqthmir8bngi.xn--p1ai/evusheld-tiksagevimab-cilgavimab/]cilgavimab купить[/url] – cilgavimab где купить, оземпик 1 купить +в москве
Привет всем!
Как защитить себя от проблем с авторскими правами при размещении каверов в интернете.
Музыканты, записывающие кавер версии песен, должны быть особенно внимательны к соблюдению авторских прав.
Для того чтобы избежать проблем с законом и быть уверенным в законности своего творчества, важно лицензировать свои каверы через гарант сервис.
Это поможет обезопасить себя от мошенников и проблем с авторскими правами, а также сделает ваш кавер доступным для прослушивания и монетизации на всех популярных площадках.
https://save-worth.ru/rasprostranenie-i-licenzirovanie-kaver-versijj-sgag/
[url=https://financereality.ru/2024/03/25/1225688-kak-zarabotat-muzykantu-na-kaverakh-legalno-jc/] Распространение и лицензирование кавер-версий [/url]
Зачем петь и как заработать на кавер песнях?
Нужно ли разрешение на исполнение кавера?
Лицензирование каверов
Можно ли выкладывать кавер на площадки?
Авторские права на кавер-версии песен
Получить лицензию на кавер песни
Лицензирование и дистрибуция кавер-версий песен
Вам нужно разрешение, чтобы сделать кавер-версию?
Лицензирование и издание каверов
Лицензирование и издание кавер версии песни
Удачи и хорошего вайба!
Zet Casino Anmeldung: Der ultimative Leitfaden fГјr neue Spieler
Wenn Sie auf der Suche nach einem aufregenden und unterhaltsamen Online-Casino-Erlebnis sind, dann sind Sie bei Zet Casino genau richtig. Mit einer groГџen Auswahl an Spielen, groГџzГјgigen Boni und einem benutzerfreundlichen Interface ist Zet Casino die perfekte Wahl fГјr Spieler aller Erfahrungsstufen.
Die Anmeldung bei Zet Casino ist ein einfacher und unkomplizierter Prozess, der nur wenige Minuten in Anspruch nimmt. Um sich anzumelden, mГјssen Sie lediglich die folgenden Schritte befolgen:
1. Besuchen Sie die Website von Zet Casino und klicken Sie auf den Button “Registrieren”.
2. Geben Sie Ihre persönlichen Daten ein, einschließlich Ihres Namens, Ihrer E-Mail-Adresse und Ihres Geburtsdatums.
3. Wählen Sie einen Benutzernamen und ein Passwort für Ihr Konto.
4. Akzeptieren Sie die Allgemeinen Geschäftsbedingungen von Zet Casino und bestätigen Sie Ihre Anmeldung.
Nachdem Sie sich erfolgreich angemeldet haben, können Sie sofort mit dem Spielen beginnen. Zet Casino bietet eine Vielzahl von Spielen, darunter Spielautomaten, Tischspiele, Live-Casino-Spiele und vieles mehr. Außerdem werden regelmäßig neue Spiele hinzugefügt, sodass es immer etwas Neues zu entdecken gibt.
Darüber hinaus belohnt Zet Casino seine Spieler mit großzügigen Boni und Aktionen. Als neuer Spieler können Sie von einem Willkommensbonus profitieren, der Ihnen zusätzliches Guthaben und Freispiele bietet. Es lohnt sich also, regelmäßig auf der Website vorbeizuschauen, um keine der aktuellen Aktionen zu verpassen.
Insgesamt ist die Anmeldung bei Zet Casino ein Kinderspiel und der Beginn eines spannenden Online-Casino-Erlebnisses. Also worauf warten Sie noch? Registrieren Sie sich noch heute und tauchen Sie ein in die Welt von Zet Casino!
https://zetcasino.one/
Wenn Sie in einem Online-Casino spielen, haben Sie möglicherweise schon einmal von Casino-Chips gehört. Diese Chips sind eine virtuelle Währung, die Spieler nutzen können, um Einsätze zu platzieren und Gewinne zu erzielen. Aber wussten Sie, dass Sie diese Chips auch auszahlen lassen können?
Tipico ist ein beliebtes Online-Casino, das seinen Spielern die Möglichkeit bietet, ihre Casino-Chips auszahlen zu lassen. Dies kann in der Regel auf verschiedene Arten erfolgen, je nach den Bedingungen und Richtlinien des Casinos. In den meisten Fällen können Spieler ihre Chips in Bargeld umwandeln, das entweder auf ihr Bankkonto überwiesen oder auf ihre Kreditkarte eingezahlt wird.
Um Ihre Casino-Chips bei Tipico auszahlen zu lassen, müssen Sie normalerweise eine Mindestauszahlungsgrenze erreichen. Diese Grenze variiert je nach Casino, kann aber oft bei 20 € oder höher liegen. Darüber hinaus können Gebühren anfallen, wenn Sie Ihre Chips auszahlen lassen. Dies ist jedoch normalerweise der Fall, wenn Sie Ihre Gewinne auf eine bestimmte Weise auszahlen lassen, z.B. per Banküberweisung.
Es ist wichtig zu beachten, dass das Auszahlen von Casino-Chips bei Tipico bestimmte Bedingungen und Einschränkungen unterliegt. Daher ist es ratsam, die Auszahlungsrichtlinien des Casinos sorgfältig zu überprüfen, um sicherzustellen, dass Sie Ihr Geld problemlos und ohne Probleme erhalten können.
Insgesamt bieten Casino-Chips eine praktische Möglichkeit, Gewinne aus Online-Casinospielen auszuzahlen. Wenn Sie also bei Tipico spielen und eine nette Summe gewonnen haben, können Sie Ihre Chips einfach und schnell in echtes Geld umwandeln. Viel Glück beim Spielen und viel Spaß beim Auszahlen Ihrer Gewinne!
https://tipicocasino.one/
Юрист по защите прав потребителей
в Москве – это специалист, важность которого трудно переоценить в
современной ритмичной жизни столицы.
В мегаполисе, где каждый день происходят сотни тысяч
коммерческих сделок, неизбежно возникают
ситуации, когда потребители сталкиваются с недобросовестностью
продавцов или производителей.
Именно здесь на помощь приходит юрист, который специализируется на защите прав покупателей.
Московский юрист по защите прав потребителей поможет вам в случае, если вы стали жертвой обмана,
купили некачественный товар, не получили обещанные услуги,
или вам отказали в законном гарантийном
обслуживании. Этот специалист проведет первичную
консультацию, оценит обстоятельства дела, подготовит
необходимые документы и будет представлять ваши интересы во всех инстанциях – от переговоров с продавцом до судебного
разбирательства.
Профессиональный юрист не только поможет в восстановлении нарушенных прав, но и посодействует в получении компенсации
морального вреда, штрафов и пеней с недобросовестных продавцов или производителей.
В Москве, где конкуренция среди юристов высока, найти хорошего специалиста в области защиты прав
потребителей становится проще, но важно выбрать того, кто обладает достаточным опытом и знаниями для эффективного ведения вашего дела.
Here is my homepage; юрист в сфере защиты прав потребителей
трансфер новосибирск белокуриха http://transfer-novosibirsk-belokurikha.ru/
Im Jahr 2019 bietet das Tipico Casino seinen Kunden einen groГџzГјgigen Bonus, um sie fГјr ihre Treue zu belohnen. Dieser Bonus kann in Form von Freispielen, Einzahlungsboni oder sogar Reisen und anderen tollen Preisen angeboten werden.
Um in den Genuss dieses Bonus zu kommen, müssen die Spieler lediglich die angegebenen Bedingungen erfüllen, die in der Regel einfach und unkompliziert sind. Dies kann beispielsweise eine Mindesteinzahlung oder eine bestimmte Anzahl an Einsätzen innerhalb eines bestimmten Zeitraums beinhalten.
Der Tipico Casino Bonus 2019 ist eine großartige Möglichkeit, um die Gewinnchancen zu erhöhen und das Spielerlebnis noch spannender zu gestalten. Mit etwas Glück können die Spieler zusätzliche Gewinne erzielen und noch mehr Spaß beim Spielen haben.
Es ist jedoch wichtig zu beachten, dass jeder Bonus bestimmte Bedingungen und Einschränkungen hat, die eingehalten werden müssen. Bevor man sich also für einen Bonus entscheidet, sollte man sich genau über die jeweiligen Bedingungen informieren, um sicherzustellen, dass man sie erfüllen kann.
Alles in allem bietet das Tipico Casino seinen Spielern mit dem Bonus 2019 eine tolle Möglichkeit, um das Spielerlebnis zu verbessern und die Gewinnchancen zu erhöhen. Es lohnt sich also, regelmäßig vorbeizuschauen und sich die aktuellen Angebote nicht entgehen zu lassen. Viel Spaß und viel Erfolg beim Spielen!
https://tipicocasino.one/
купить цветы в саратове с доставкой [url=https://flowerssaratov.ru/]https://flowerssaratov.ru/[/url] .
Tipico Casino iPad
Das Tipico Casino bietet seinen Kunden ein erstklassiges Spielerlebnis, das nun auch bequem auf dem iPad genossen werden kann. Mit der speziell für das iPad optimierten App können die Spieler auf eine Vielzahl von Casino-Spielen zugreifen, darunter Slots, Roulette, Blackjack und vieles mehr.
Die Benutzeroberfläche der Tipico Casino iPad App ist benutzerfreundlich gestaltet und sorgt für ein einfaches und nahtloses Spielerlebnis. Die Spiele sind grafisch ansprechend gestaltet und bieten eine hohe Qualität, so dass die Spieler ein authentisches Casino-Erlebnis genießen können, egal wo sie sich befinden.
Durch die Verwendung der Tipico Casino iPad App haben die Spieler die MГ¶glichkeit, ihre Lieblingsspiele auch unterwegs zu spielen und kГ¶nnen somit jederzeit und Гјberall auf ihre Casino-Unterhaltung zugreifen. Egal ob man auf dem Weg zur Arbeit ist, in der Mittagspause oder gemГјtlich auf der Couch zu Hause – mit der Tipico Casino iPad App ist das Casino-Erlebnis immer griffbereit.
Darüber hinaus bietet das Tipico Casino seinen Spielern regelmäßig attraktive Boni und Aktionen, die das Spielerlebnis noch aufregender und lukrativer machen. Mit der Tipico Casino iPad App können die Spieler somit nicht nur hochwertige Casino-Spiele genießen, sondern auch von exklusiven Angeboten profitieren.
Insgesamt ist die Tipico Casino iPad App eine großartige Möglichkeit für Casino-Liebhaber, ihre Lieblingsspiele bequem und mobil zu spielen. Mit einer benutzerfreundlichen Benutzeroberfläche, einer Vielzahl von hochwertigen Spielen und attraktiven Boni ist die App eine perfekte Ergänzung für alle, die gerne unterwegs spielen möchten. Probieren Sie die Tipico Casino iPad App noch heute aus und lassen Sie sich von einem erstklassigen Casino-Erlebnis überzeugen.
https://tipicocasino.one/
Доброго!
White Queen, талантливая и экстравагантная певица, порадовала своих поклонников новым треком “БАС”, который стал настоящим хитом в мире танцевальной музыки. Этот трек отличается яркими звуками и заразительным ритмом, который не оставит равнодушным ни одного слушателя.
White Queen решила отойти от своего обычного стиля и представить публике что-то новое и необычное. Она объединила в этом треке элементы рейва и электронной музыки, создав уникальное звучание, которое сразу же завоевало сердца многих слушателей.
По мнению многих фанатов, трек “БАС” превосходит работы известных артистов, таких как Lida и GSPD. Свежий и оригинальный звук White Queen вызывает мощные эмоции и заставляет танцевать до утра. Ее дерзкий и провокационный стиль покорил не только рейв-клубы, но и сердца миллионов меломанов по всему миру.
White Queen не перестает удивлять своих поклонников новыми и интересными проектами. Ее творческий подход и желание экспериментировать делают ее одним из самых ярких исполнителей современной музыкальной сцены. Новый трек “БАС” — это лишь один из шагов певицы к светлому будущему и покорению вершин мировой музыкальной индустрии.
Если вы еще не слышали трек “БАС” от White Queen, то обязательно найдите его на популярных музыкальных платформах и окунитесь в мир прекрасных звуков и неповторимой атмосферы рейва. Будьте готовы к тому, что эта композиция не отпустит вас долгое время и станет вашим гимном веселья и незабываемых вечеринок. White Queen — гении музыкального жанра, и ее творчество никогда не перестает удивлять и вдохновлять своих поклонников.
https://music.yandex.ru/track/123467211
[url=https://music.yandex.ru/track/123467211] слушать музыку бесплатно онлайн [/url]
слушать музыку радио шансон
послушать музыку в спб
послушать музыку скачать
слушать музыку українську
скачать и послушать музыку
слушать музыку онлайн украинские хиты 2023
краб рейв слушать
слушать музыку поля мориа бесплатно
слушать музыку линкин парк
послушать интересную музыку
Удачи и хорошего вайба!
Tipico ist einer der bekanntesten Anbieter für Sportwetten und Online-Casino-Spiele in Deutschland. Viele Menschen genießen die Spannung und den Nervenkitzel, den das Wetten auf ihre Lieblingssportarten mit sich bringt. Auch das Angebot an Casino-Spielen bei Tipico ist sehr vielfältig und attraktiv für alle, die gerne ihr Glück herausfordern.
Eine wichtige Frage, die viele Spieler haben, ist jedoch, wie sie Geld zwischen ihrem Casino-Konto und ihrem Sportwetten-Konto bei Tipico transferieren können. Glücklicherweise bietet Tipico eine einfache und sichere Möglichkeit, Geld zwischen den beiden Konten zu übertragen.
Um Geld von Ihrem Casino-Konto auf Ihr Sportwetten-Konto zu Гјbertragen, mГјssen Sie einfach die Option “Guthaben Transfer” auf der Webseite oder der App von Tipico auswГ¤hlen. Dort kГ¶nnen Sie den Betrag eingeben, den Sie Гјbertragen mГ¶chten, und bestГ¤tigen, dass Sie das Geld von Ihrem Casino-Konto abheben und auf Ihr Sportwetten-Konto einzahlen mГ¶chten.
Der Vorgang ist schnell und unkompliziert und ermöglicht es Ihnen, nahtlos zwischen Casino-Spielen und Sportwetten zu wechseln. Es ist wichtig zu beachten, dass die Übertragung von Geld zwischen den Konten bei Tipico kostenlos ist und in der Regel sofort bearbeitet wird.
Wenn Sie gerne sowohl Casino-Spiele als auch Sportwetten bei Tipico genießen, ist es also ganz einfach, Geld zwischen Ihren Konten zu transferieren. So können Sie Ihr Guthaben optimal nutzen und das Beste aus Ihrem Spielerlebnis herausholen. Probieren Sie es doch einfach mal aus und erleben Sie die Faszination von Sportwetten und Casino-Spielen bei Tipico!
https://tipicocasino.one/
Zet Casino ist eine Online-GlГјcksspielplattform, die sich schnell einen Namen in der Welt der Online-Casinos gemacht hat. Das Casino bietet eine breite Palette an Spielen, darunter Spielautomaten, Tischspiele, Live-Casino und vieles mehr. Aber was sagen die Spieler Гјber ihre Erfahrungen mit Zet Casino?
Die meisten Bewertungen von Zet Casino sind positiv. Viele Spieler loben die Vielfalt an Spielen, die das Casino bietet, sowie die Benutzerfreundlichkeit der Website. Die Benutzeroberfläche ist übersichtlich gestaltet und ermöglicht es den Spielern, schnell und einfach ihre Lieblingsspiele zu finden.
Ein weiterer Pluspunkt des Casinos sind die großzügigen Bonusangebote und Aktionen, die regelmäßig angeboten werden. Spieler können von Willkommensboni, Freispielen und Cashback-Angeboten profitieren, um ihre Gewinnchancen zu erhöhen.
Die Auszahlungen bei Zet Casino werden ebenfalls positiv bewertet. Die meisten Spieler berichten, dass ihre Gewinne schnell und reibungslos ausgezahlt werden, ohne lange Wartezeiten oder Probleme.
Einige Kritikpunkte, die in den Bewertungen erwähnt werden, beziehen sich auf die Verfügbarkeit des Kundensupports. Einige Spieler haben berichtet, dass der Support nicht immer schnell reagiert oder nicht immer hilfreich ist. Dies ist jedoch ein Aspekt, an dem das Casino arbeiten kann, um die Spielerzufriedenheit weiter zu steigern.
Insgesamt scheint Zet Casino eine gute Wahl fГјr Spieler zu sein, die nach einer unterhaltsamen und sicheren Online-GlГјcksspielerfahrung suchen. Mit einer Vielzahl an Spielen, ansprechenden Bonusangeboten und schnellen Auszahlungen ist Zet Casino definitiv einen Besuch wert.
https://zetcasino.one/
[url=http://xn—-7sbbihgb2anijhy0apq.xn--p1ai/lekarstva/trulisiti-15mg-05ml/]дулаглутид 1.5[/url] – оземпик +в турции цена, ozempic инструкция +по применению цена
Der Tipico Bonus Code 2018 Casino bietet Spielern eine großartige Möglichkeit, ihre Gewinne zu steigern und ihre Chancen auf den großen Jackpot zu erhöhen. Mit diesem exklusiven Bonuscode können Spieler von großzügigen Bonusangeboten und Promotions profitieren, die nur für registrierte Tipico Mitglieder verfügbar sind.
Um den Bonus zu erhalten, müssen Spieler lediglich den Bonuscode bei der Anmeldung oder Einzahlung eingeben und schon werden ihnen zusätzliche Spielgelder oder Freispiele gutgeschrieben. Mit diesem zusätzlichen Guthaben können Spieler länger spielen und haben dadurch die Chance, noch größere Gewinne zu erzielen.
Der Tipico Bonus Code 2018 Casino ist nicht nur für Neukunden verfügbar, sondern auch für Bestandskunden, die regelmäßig bei Tipico spielen. Durch regelmäßige Promotionen und spezielle Angebote belohnt Tipico loyalen Spielern und sorgt so für eine unterhaltsame und lohnende Spielerfahrung.
Es ist wichtig, sich vor der Nutzung eines Bonuscodes mit den Bedingungen vertraut zu machen, um sicherzustellen, dass man die Bonusgelder auch tatsächlich nutzen kann. Einige Boni erfordern beispielsweise eine Mindesteinzahlung oder setzen bestimmte Umsatzanforderungen voraus.
Insgesamt bietet der Tipico Bonus Code 2018 Casino eine tolle Gelegenheit, das Spielerlebnis zu verbessern und die Gewinnchancen zu erhöhen. Mit großzügigen Bonusangeboten und regelmäßigen Promotionen ist Tipico eines der besten Online-Casinos für Spieler, die auf der Suche nach spannenden Spielen und attraktiven Promotionen sind.
https://tipicocasino.one/
Die Boomerang Casino App bietet Spielern ein aufregendes und unterhaltsames Spielerlebnis direkt auf ihren mobilen Geräten. Die App wurde entwickelt, um den Spielern die Möglichkeit zu geben, ihre Lieblingsspiele jederzeit und überall zu spielen.
Die App bietet eine Vielzahl von Casino-Spielen, darunter Slots, Tischspiele, Live-Dealer-Spiele und vieles mehr. Spieler können aus einer Vielzahl von Spielen wählen, die alle von führenden Softwareanbietern entwickelt wurden, um ein erstklassiges Spielerlebnis zu bieten.
Ein weiterer großer Vorteil der Boomerang Casino App ist die Tatsache, dass sie sowohl für iOS- als auch für Android-Geräte verfügbar ist. Spieler können die App einfach über den App Store oder den Google Play Store herunterladen und innerhalb von Minuten mit dem Spielen beginnen.
Die App bietet auch eine Vielzahl von Bonusangeboten und Aktionen, um Spieler zu belohnen und ihr Spielerlebnis noch aufregender zu gestalten. Boni wie Freispiele, Einzahlungsboni und Cashback-Angebote sind regelmäßig verfügbar und bieten den Spielern die Möglichkeit, ihre Gewinne zu steigern und länger zu spielen.
Mit der Boomerang Casino App kГ¶nnen Spieler ihre Lieblingsspiele genieГџen, egal wo sie sich befinden. Ob zu Hause, unterwegs oder sogar im Urlaub – die App ermГ¶glicht es Spielern, immer und Гјberall auf ihre Lieblingsspiele zuzugreifen.
Insgesamt bietet die Boomerang Casino App eine beeindruckende Auswahl an Spielen, großzügige Boni und eine benutzerfreundliche Oberfläche, die es zu einer der besten Casino-Apps auf dem Markt macht. Spiele jetzt und erlebe die Spannung der Boomerang Casino App!
https://boomerangcasino.one/
https://muslim-prayer-times.com/
Boomerang Casino Login
Das Boomerang Casino ist eine beliebte Online-Glücksspielseite, die eine Vielzahl von Spielen für Spieler weltweit anbietet. Um auf die Plattform zuzugreifen und zu spielen, müssen die Nutzer sich zuerst mit ihren persönlichen Kontoinformationen einloggen. In diesem Artikel werden wir uns genauer mit dem Login-Prozess im Boomerang Casino befassen.
Um sich im Boomerang Casino einzuloggen, müssen die Spieler zunächst die offizielle Website des Casinos besuchen. Dort finden sie den Login-Bereich, in den sie ihre E-Mail-Adresse und ihr Passwort eingeben müssen. Nachdem die Zugangsdaten verifiziert wurden, gelangen die Spieler auf ihre persönliche Spielerseite, auf der sie ihre Lieblingsspiele spielen können.
Es ist wichtig, dass die Spieler ihre Login-Daten sicher aufbewahren und sie nicht mit anderen teilen, um die Sicherheit ihres Kontos zu gewährleisten. Das Boomerang Casino bietet auch zusätzliche Sicherheitsmaßnahmen wie die Zwei-Faktor-Authentifizierung, um die Privatsphäre der Spieler zu schützen.
Nach dem erfolgreichen Login können die Spieler aus einer Vielzahl von Spielen wählen, darunter Slots, Tischspiele, Live-Dealer-Spiele und vieles mehr. Das Boomerang Casino bietet auch regelmäßige Bonusangebote und Aktionen, die den Spielern zusätzliche Chancen auf Gewinne bieten.
Insgesamt ist der Login-Prozess im Boomerang Casino einfach und sicher. Mit einer breiten Auswahl an Spielen und attraktiven Bonusangeboten ist das Casino eine gute Wahl fГјr Spieler, die nach einer unterhaltsamen und lohnenden GlГјcksspielerfahrung suchen. Besuchen Sie das Boomerang Casino noch heute und erleben Sie die Spannung des Online-GlГјcksspiels!
https://boomerangcasino.one/
Привет любители музыки!
White Queen возглавляет чарты с новым треком “БАС”. Ее талант и вкус к музыке делают эту композицию по-настоящему уникальной и запоминающейся.
“БАС” – это новый хит от White Queen, который уже назвали одним из лучших танцевальных треков современности. Эта композиция просто обречена на успех.
White Queen дарит слушателям новый трек “БАС” в стиле рейв. Эта композиция звучит необычно и свежо, привнося в мир клубной музыки что-то новое и захватывающее.
https://music.yandex.ru/track/123467211
[url=https://vk.com/music/album/-2000205055_20205055_3ee88b782e18970b07] послушать спокойную музыку для души [/url]
послушать музыку с тик тока
слушать музыку через youtube
слушать музыку новинки 2024
послушать музыку сергея завьялова
слушать музыку 2023
слушать музыку из вк
слушать церковную музыку
слушать музыку онлайн новинки
где можно послушать музыку
как слушать музыку на айфоне
Удачи и хорошего вайба!
1SS3D249742
Boomerang Casino ist ein aufregendes Online-Casino, das Spielern eine breite Palette von Spielen und Unterhaltungsmöglichkeiten bietet. Mit einer benutzerfreundlichen Plattform und einer Vielzahl von Spielen ist boomerangcasino.com eine gute Wahl für alle Casino-Liebhaber.
Das Casino bietet eine Vielzahl von Spielen, darunter Slots, Tischspiele, Live-Casino-Spiele und vieles mehr. Mit renommierten Software-Anbietern wie NetEnt, Microgaming und Evolution Gaming können die Spieler sicher sein, dass sie eine qualitativ hochwertige Spielerfahrung genießen werden.
Ein weiterer Vorteil von Boomerang Casino ist das großzügige Bonusangebot für neue Spieler. Mit Willkommensboni, Freispielen und anderen Aktionen können die Spieler ihr Spielvergnügen maximieren und ihre Gewinnchancen erhöhen.
Das Casino bietet auch eine Vielzahl von Zahlungsoptionen, darunter Kreditkarten, E-Wallets und Banküberweisungen, um sicherzustellen, dass die Spieler bequem Ein- und Auszahlungen tätigen können.
Das Casino verfügt über eine Lizenz der Malta Gaming Authority und gewährleistet so ein sicheres und faires Spielerlebnis für alle Spieler.
Insgesamt ist Boomerang Casino eine ausgezeichnete Wahl fГјr Spieler, die nach einer unterhaltsamen und spannenden Online-Casino-Erfahrung suchen. Mit einer Vielzahl von Spielen, groГџzГјgigen Boni und einer benutzerfreundlichen Plattform ist Boomerang Casino definitiv einen Besuch wert.
https://boomerangcasino.one/
blibli
wow, amazing
Доброго!
Ваш источник новостей из Кропивницкого: все, что происходит в городе и его окрестностях.
Заходите https://top10.kr.ua/category/news-ukraine/
[url=https://top10.kr.ua/category/news-ukraine/]Новости Украины сегодня[/url]
новости Кропивницкого ДТП
новости Кропивницкого сейчас
новости Кропивницкого
Удачи и хороших новостей!
Freispiele Casino Tipico: Nutzen Sie Ihre Chance auf kostenlose Spiele
Immer mehr Menschen interessieren sich für Online-Casinos und die Möglichkeit, dort spannende Spiele zu spielen und dabei auch noch Geld zu gewinnen. Eine besonders beliebte Promotion sind Freispiele, die es den Spielern ermöglichen, bestimmte Slots kostenlos zu spielen und dabei echtes Geld zu gewinnen.
Der Wettanbieter Tipico bietet seinen Kunden ebenfalls die Möglichkeit, von Freispielen zu profitieren. Diese können sowohl neu angemeldete Spieler als auch langjährige Kunden erhalten. Um von Freispielen im Tipico Casino zu profitieren, müssen Sie sich für die jeweilige Aktion anmelden und die jeweiligen Bedingungen erfüllen. Diese können von Aktion zu Aktion variieren, sodass es wichtig ist, sich vorab über die genauen Teilnahmebedingungen zu informieren.
Freispiele im Tipico Casino können Ihnen die Möglichkeit bieten, neue Slots kennenzulernen, ohne dabei Ihr eigenes Geld einzusetzen. Dies ist besonders für Anfänger interessant, die zunächst die Spiele und Funktionen der Slots kennenlernen möchten, bevor sie echtes Geld einsetzen.
Um Freispiele im Tipico Casino zu erhalten, sollten Sie regelmäßig die angebotenen Aktionen im Blick behalten und sich rechtzeitig dafür anmelden. Achten Sie zudem darauf, dass Sie die Umsatzbedingungen erfüllen, um sich Ihre Gewinne auszahlen lassen zu können.
Insgesamt bieten Freispiele im Tipico Casino eine spannende Möglichkeit, kostenlos zu spielen und dabei echtes Geld zu gewinnen. Nutzen Sie Ihre Chance und melden Sie sich für die aktuell laufenden Aktionen an, um von Freispielen zu profitieren. Viel Erfolg beim Spielen und Gewinnen!
https://tipicocasino.one/
magnificent issues altogether, you just won a emblem new
reader. What might you recommend in regards to your post that you simply
made a few days in the past? Any positive?
Das Zet Bet Casino bietet seinen Spielern eine Vielzahl von spannenden Spielen und groГџzГјgigen Boni. Einer der beliebtesten Boni, die das Casino anbietet, ist der Zet Bet Casino Bonus.
Der Zet Bet Casino Bonus ist ein Willkommensbonus, der neuen Spielern angeboten wird, die sich zum ersten Mal im Casino registrieren. Der Bonus kann in Form von Freispielen, Einzahlungsboni oder anderen VergГјnstigungen bereitgestellt werden.
Um den Zet Bet Casino Bonus zu erhalten, müssen sich die Spieler einfach im Casino registrieren und eine erste Einzahlung tätigen. Je nach Angebot können die Spieler dann Freispiele für bestimmte Slots erhalten oder einen Einzahlungsbonus, der ihre Einzahlung um einen bestimmten Prozentsatz erhöht.
Der Zet Bet Casino Bonus ist eine großartige Möglichkeit für Spieler, ihr Spielvergnügen zu maximieren und ihre Gewinnchancen zu erhöhen. Es ist jedoch wichtig, die Bonusbedingungen zu lesen und zu verstehen, da diese oft bestimmte Anforderungen wie Umsatzbedingungen oder maximale Gewinnlimits enthalten können.
Insgesamt ist der Zet Bet Casino Bonus eine tolle Möglichkeit, um das Casino kennenzulernen und zusätzliche Gewinnchancen zu erhalten. Also worauf warten Sie noch? Registrieren Sie sich noch heute im Zet Bet Casino und sichern Sie sich Ihren exklusiven Bonus!
https://zetcasino.one/
click [url=https://theanydesk.com]anydesk[/url]
bliloblo
pop over here [url=https://thetradingview.org]tradingview[/url]
Доброго!
Украина и мир: новости, которые заслуживают вашего внимания, без упущений и преувеличений.
Посетите https://wian.top/category/economics
[url=https://wian.top/]Украина новости главное[/url]
новости технологий
новости спорта
новости мира
Удачи и хороших новостей!
Der Moment, auf den alle Spieler im Zet Casino gehofft haben, ist endlich eingetreten: Das Auszahlungslimit wurde erreicht. Dies bedeutet, dass die Glücklichen, die genug Glück und Können hatten, um Gewinne anzuhäufen, jetzt ihre verdienten Belohnungen abheben können.
Das Auszahlungslimit im Zet Casino ist eine wichtige Richtlinie, die sicherstellt, dass sowohl das Casino als auch die Spieler geschützt sind. Es dient dazu, dass die Spieler ihre Gewinne nicht sofort abheben und damit das Risiko des Verlustes minimieren. Stattdessen müssen sie eine bestimmte Summe erreichen, bevor sie eine Auszahlung beantragen können.
Für die Spieler, die hart gearbeitet und hart gespielt haben, um dieses Limit zu erreichen, ist es ein aufregender Moment. Es ist die Belohnung für ihre Ausdauer, ihr Geschick und ihre Entschlossenheit. Sie können jetzt ihre Gewinne genießen und sich darüber freuen, dass sich ihre Mühe ausgezahlt hat.
Für das Zet Casino ist das Erreichen des Auszahlungslimits ebenfalls ein positives Zeichen. Es zeigt, dass das Casino attraktiv genug ist, um Spieler anzuziehen und sie dazu zu ermutigen, weiterzuspielen. Es ist ein Beweis für die Qualität des Casinos und die Zufriedenheit der Spieler.
Insgesamt ist das Erreichen des Auszahlungslimits im Zet Casino ein Grund zum Feiern. Es ist eine Bestätigung für die Spieler, dass ihr Einsatz belohnt wird, und für das Casino, dass es gute Arbeit leistet. Es ist ein Zeichen dafür, dass alle Beteiligten profitieren und Spaß haben können.
https://zetcasino.one/
bliloblo
Zet Casino ist ein beliebtes Online-Casino, das Spielern eine Vielzahl von Spielen und Unterhaltungsmöglichkeiten bietet. Eines der Highlights dieses Casinos ist das Zet Casino Forum, in dem Spieler sich austauschen, Tipps geben und Erfahrungen teilen können.
Das Zet Casino Forum ist eine großartige Möglichkeit, um mit anderen Spielern in Kontakt zu treten und sich über die neuesten Entwicklungen und Angebote des Casinos auszutauschen. Hier können Spieler ihre Lieblingsspiele diskutieren, Erfolge feiern und auch Fragen stellen, wenn sie Hilfe benötigen.
Das Forum ist in verschiedene Kategorien aufgeteilt, die es den Spielern erleichtern, sich zu bestimmten Themen zu äußern. Zum Beispiel gibt es Threads zu den neuesten Spielveröffentlichungen, Bonusangeboten, Zahlungsmethoden und vielem mehr.
Darüber hinaus bietet das Zet Casino Forum Spielern die Möglichkeit, an exklusiven Aktionen und Wettbewerben teilzunehmen, die nur für Forenmitglieder verfügbar sind. Dies kann eine großartige Gelegenheit sein, um zusätzliche Preise und Belohnungen zu gewinnen.
Das Zet Casino Forum ist auch eine gute Informationsquelle für alle, die mehr über das Online-Casino erfahren möchten. Hier finden Spieler Tutorials, Guides und Tipps, die ihnen helfen können, ihre Spielerfahrung zu verbessern und erfolgreicher zu sein.
Insgesamt ist das Zet Casino Forum eine großartige Ergänzung zu diesem beliebten Online-Casino und bietet eine interaktive Plattform für Spieler, um sich auszutauschen und zu vernetzen. Wer also auf der Suche nach einer Community ist, die die Leidenschaft für Glücksspiele teilt, sollte unbedingt einen Blick auf das Zet Casino Forum werfen.
https://zetcasino.one/
nice content!nice history!! boba 😀
my sources [url=https://sites.google.com/view/metamask-io-extension-login/home]MetaMask extension[/url]
Das Boomerang Casino Forum: Ein Ort fГјr GlГјcksspiel-Enthusiasten
Das Boomerang Casino Forum ist ein beliebter Treffpunkt für Glücksspiel-Enthusiasten, die sich über ihre Leidenschaft austauschen und neue Online-Casinos entdecken möchten. Das Forum bietet eine Vielzahl von Themen und Diskussionen rund um das Thema Glücksspiel, darunter Erfahrungsberichte, Tipps und Tricks, Neuigkeiten aus der Branche und vieles mehr.
Ein besonderer Fokus des Boomerang Casino Forums liegt auf dem Austausch über Online-Casinos und deren Spiele. Mitglieder können ihre Erfahrungen teilen, sich gegenseitig empfehlen oder warnen und sich über die neuesten Entwicklungen informieren. Darüber hinaus gibt es auch spezielle Bereiche für Strategie-Diskussionen, Bonusangebote und Turniere.
Ein weiterer Vorteil des Boomerang Casino Forums ist die Möglichkeit, sich mit Gleichgesinnten zu vernetzen und Freundschaften zu schließen. Viele Mitglieder treffen sich regelmäßig in virtuellen Casinos, um gemeinsam zu spielen und sich auszutauschen. Dadurch entsteht eine lebendige Community, die sich gegenseitig unterstützt und motiviert.
Das Boomerang Casino Forum ist für alle offen, die sich für Glücksspiel interessieren, unabhängig von ihrem Erfahrungsgrad. Sowohl Anfänger als auch erfahrene Spieler finden hier wertvolle Informationen und Unterstützung. Das Forum wird von engagierten Moderatoren betreut, die sicherstellen, dass die Diskussionen respektvoll und konstruktiv verlaufen.
Insgesamt bietet das Boomerang Casino Forum eine einzigartige Gelegenheit, sich mit anderen GlГјcksspiel-Fans auszutauschen und gemeinsam die faszinierende Welt der Online-Casinos zu erkunden. Wer auf der Suche nach einer lebendigen und hilfsbereiten Community ist, sollte einen Blick in das Boomerang Casino Forum werfen und sich selbst davon Гјberzeugen.
https://boomerangcasino.one/
пояснения
[url=https://darkmark.xyz/topic/10-kupit-retcept-na-lekarstva/]купить рецепт на лекарства, купить лекарства без рецепта[/url]
Привет любители софта!
Представляем вашему вниманию uFiler – бесплатный и удобный торрент-клиент, который станет отличным помощником при скачивании файлов.
Приложение имеет простой и интуитивно понятный интерфейс, позволяющий легко добавлять торренты для загрузки.
Вы также сможете управлять активными, завершенными и остановленными загрузками, а также настраивать скорость скачивания в соответствии с вашими предпочтениями.
uFiler – надежный и функциональный торрент-клиент, который вы можете загрузить абсолютно бесплатно на https://ufile-for-pc.ru/
[url=https://ufile-for-pc.ru/]ufiler[/url]
ufiler
как скачивать через ufiler
ufiler что это за программа
скачать ufiler без торрента
Удачи и хорошего серфинга по торрентам!
Boomerang-Casino.com – Ein aufregendes Online-Casino-Erlebnis
Boomerang-Casino.com ist eine der führenden Online-Glücksspiel-Plattformen, die eine Vielzahl von Spielen und Unterhaltungsmöglichkeiten für Spieler aus der ganzen Welt bietet. Mit einer benutzerfreundlichen Oberfläche und einer Vielzahl von Spielen, ist Boomerang-Casino.com die perfekte Wahl für alle, die auf der Suche nach einem unterhaltsamen und aufregenden Online-Casino-Erlebnis sind.
Eines der Hauptmerkmale von Boomerang-Casino.com ist die große Auswahl an Spielen, die es den Spielern ermöglicht, aus einer Vielzahl von Optionen zu wählen, darunter klassische Tischspiele wie Blackjack, Roulette und Poker, sowie eine Vielzahl von Spielautomaten und Live-Casino-Spielen. Diese Vielfalt sorgt dafür, dass es für jeden Spieler die passende Unterhaltung gibt, unabhängig von ihren Vorlieben und ihrem Budget.
Zusätzlich zu den Spielen bietet Boomerang-Casino.com auch eine Vielzahl von Boni und Promotionen, die es den Spielern ermöglichen, ihr Guthaben aufzustocken und zusätzliche Chancen zu gewinnen. Diese Boni reichen von Willkommensboni für neue Spieler bis hin zu regelmäßigen Promotionen für bestehende Kunden, die es ihnen ermöglichen, ihre Gewinne zu maximieren und ihr Spielerlebnis zu verbessern.
Ein weiterer Vorteil von Boomerang-Casino.com ist die Tatsache, dass es eine benutzerfreundliche Oberfläche bietet, die es auch unerfahrenen Spielern leicht macht, sich zurechtzufinden und ihre Lieblingsspiele zu finden. Darüber hinaus bietet das Casino auch eine Vielzahl von Zahlungsmöglichkeiten, die es den Spielern ermöglichen, bequem und sicher Ein- und Auszahlungen vorzunehmen.
Alles in allem ist Boomerang-Casino.com eine ausgezeichnete Wahl für alle, die auf der Suche nach einem unterhaltsamen und spannenden Online-Casino-Erlebnis sind. Mit einer breiten Palette von Spielen, großzügigen Boni und einer benutzerfreundlichen Oberfläche, gibt es keinen Grund, warum man dieses erstklassige Online-Casino nicht ausprobieren sollte. Besuchen Sie Boomerang-Casino.com noch heute und entdecken Sie die aufregende Welt des Online-Glücksspiels. Viel Spaß und viel Glück!
https://boomerangcasino.one/
blabla
Tipico Casino ist eine beliebte Online-Glücksspielplattform, die eine Vielzahl von Spielen und Möglichkeiten bietet, Geld zu gewinnen. Viele Spieler fragen sich jedoch, wie sie ihr Guthaben auszahlen können. In diesem Artikel werden wir Ihnen erklären, wie Sie Ihr Guthaben bei Tipico Casino auszahlen lassen können.
Zunächst einmal müssen Sie sich auf der Website von Tipico Casino anmelden und Ihr Konto verifizieren. Dies ist ein wichtiger Schritt, um sicherzustellen, dass Ihr Geld sicher ist und dass Sie berechtigt sind, Auszahlungen vorzunehmen.
Sobald Ihr Konto verifiziert ist, kГ¶nnen Sie auf den Bereich “Mein Konto” zugreifen und dort die Option “Auszahlung” wГ¤hlen. Hier haben Sie die MГ¶glichkeit, die gewГјnschte Auszahlungsmethode auszuwГ¤hlen. Tipico Casino bietet verschiedene MГ¶glichkeiten wie BankГјberweisung, Kreditkarte oder E-Wallets wie PayPal oder Skrill an.
Nachdem Sie die Auszahlungsmethode gewählt haben, müssen Sie den Betrag eingeben, den Sie auszahlen lassen möchten. Beachten Sie dabei, dass es möglicherweise Mindest- oder Höchstauszahlungsbeträge gibt, die Sie beachten müssen.
Sobald Sie die Auszahlung bestätigt haben, wird Ihr Geld innerhalb von 1-3 Werktagen auf Ihrem Konto gutgeschrieben, je nach gewählter Auszahlungsmethode.
Es ist wichtig zu beachten, dass Tipico Casino möglicherweise Gebühren für Auszahlungen erhebt, je nach gewählter Methode. Sie sollten sich daher immer im Voraus über mögliche Gebühren informieren.
Insgesamt ist es bei Tipico Casino relativ einfach, Guthaben auszahlen zu lassen. Indem Sie die oben genannten Schritte befolgen und Ihr Konto verifizieren, können Sie sicherstellen, dass Ihre Auszahlung schnell und reibungslos abgewickelt wird. Viel Glück beim Spielen!
https://tipicocasino.one/
1SS3D249742
Zet Casino: 10 Freispiele ohne Einzahlung
Das Zet Casino ist ein beliebtes Online-Casino, das seinen Spielern eine Vielzahl von groГџartigen Spielen und Bonusangeboten bietet. Eines der besten Angebote fГјr Neukunden ist der Zet Casino Bonus von 10 Freispielen ohne Einzahlung. Das bedeutet, dass neue Spieler sofort nach der Registrierung 10 kostenlose Spins erhalten, um die spannenden Spielautomaten des Casinos auszuprobieren.
Um die 10 Freispiele zu erhalten, müssen sich Spieler einfach auf der Website des Zet Casinos anmelden und ein Konto erstellen. Sobald das Konto aktiviert ist, werden die Freispiele automatisch gutgeschrieben und können sofort genutzt werden. Die Freispiele können für ausgewählte Spielautomaten verwendet werden, die eine Vielzahl von Themen und Funktionen bieten.
Die 10 Freispiele ohne Einzahlung sind eine großartige Möglichkeit, das Zet Casino kennenzulernen und erste Gewinne zu erzielen, ohne eigenes Geld riskieren zu müssen. Spieler haben die Chance, echte Geldpreise zu gewinnen, die sie dann für weitere Spiele im Casino verwenden können. Es lohnt sich also auf jeden Fall, von diesem großzügigen Angebot Gebrauch zu machen.
Zusätzlich zu den 10 Freispielen ohne Einzahlung bietet das Zet Casino auch einen lukrativen Willkommensbonus für die erste Einzahlung. Spieler können einen Bonus von bis zu 500€ sowie weitere Freispiele erhalten, die ihnen noch mehr Gewinnchancen bieten.
Insgesamt ist das Zet Casino eine erstklassige Online-GlГјcksspieldestination, die mit groГџartigen Spielen, groГџzГјgigen Boni und einem hervorragenden Kundenservice Гјberzeugt. Spieler, die auf der Suche nach einer unterhaltsamen und lohnenden Casinoerfahrung sind, sollten sich das Zet Casino nicht entgehen lassen.
https://zetcasino.one/
Das Boomerang Casino ch ist ein neues Online-Casino, das Spielern ein einzigartiges und aufregendes Spielerlebnis bietet. Mit einer Vielzahl von Spielen, lukrativen Bonusangeboten und einer benutzerfreundlichen Plattform ist das Boomerang Casino ch definitiv einen Versuch wert.
Eines der herausragenden Merkmale des Boomerang Casino ch ist die große Auswahl an Spielen, die es seinen Spielern bietet. Von klassischen Spielautomaten bis hin zu aufregenden Live-Casino-Spielen gibt es hier für jeden Geschmack etwas zu entdecken. Mit Spielen von renommierten Anbietern wie NetEnt, Microgaming und Evolution Gaming können die Spieler sicher sein, dass sie nur qualitativ hochwertige Spiele finden.
Darüber hinaus bietet das Boomerang Casino ch großzügige Bonusangebote und Aktionen für seine Spieler. Neue Spieler können sich über Willkommensboni und Freispiele freuen, während treue Spieler regelmäßig von speziellen Promotionen und Belohnungen profitieren können.
Die Plattform des Boomerang Casino ch ist modern und benutzerfreundlich gestaltet, so dass die Spieler problemlos durch die verschiedenen Spiele navigieren können. Darüber hinaus bietet das Casino eine sichere und geschützte Spielumgebung, in der die Spieler ohne Sorgen spielen können.
Insgesamt ist das Boomerang Casino ch eine empfehlenswerte Option fГјr alle, die auf der Suche nach einem unterhaltsamen und sicheren Online-Casino-Erlebnis sind. Mit einer groГџen Auswahl an Spielen, attraktiven Bonusangeboten und einer benutzerfreundlichen Plattform ist das Boomerang Casino ch definitiv einen Besuch wert.
https://boomerangcasino.one/
Привет всем!
Пульс Кропивницкого: ежедневные новости, события и главные тренды города.
Посетите https://0522.kr.ua/
[url=https://0522.kr.ua/category/news-ukraine/]Все новости Кропивницкого[/url]
спортивные новости за день
новости Кропивницкого аварии
Удачи и хороших новостей!
Das Tipico Casino bietet seinen Kunden eine verlockende Promotion: 100 Freispiele für ausgewählte Spielautomaten. Diese Aktion lockt sowohl neue als auch bestehende Spieler an, die ihr Glück an den Slots versuchen möchten.
Um die 100 Freispiele zu erhalten, müssen Spieler lediglich eine Einzahlung tätigen und den entsprechenden Bonuscode eingeben. Die Freispiele können dann sofort genutzt werden, um die verschiedenen Slot-Spiele im Tipico Casino auszuprobieren.
Die Auswahl an Spielautomaten, für die die Freispiele gelten, ist breit gefächert und bietet für jeden Geschmack etwas. Von klassischen Fruit Machines bis hin zu aufwendig gestalteten Video-Slots ist alles dabei. So können die Spieler ihre Lieblingsspiele entdecken oder neue Slots kennenlernen.
Freispiele sind eine tolle Möglichkeit, um ohne Risiko die verschiedenen Spiele im Tipico Casino zu testen und mit etwas Glück sogar Gewinne zu erzielen. Es lohnt sich also, diese Aktion zu nutzen und die 100 Freispiele zu beanspruchen.
Das Tipico Casino überzeugt nicht nur mit seinem attraktiven Freispiel-Angebot, sondern auch mit einer benutzerfreundlichen Plattform, einer großen Auswahl an Spielen und einem professionellen Kundenservice. Spieler können sich hier sicher fühlen und ein unterhaltsames Spielerlebnis genießen.
Also, worauf warten Sie noch? Nutzen Sie die Chance auf 100 Freispiele im Tipico Casino und entdecken Sie die aufregende Welt der Spielautomaten! Viel GlГјck und SpaГџ beim Spielen!
https://tipicocasino.one/
blabla
palabraptu
wow, amazing
124969D742
Tipico Casino down: Spieler verärgert über Ausfall
Das Tipico Casino ist bei vielen Spielern beliebt, doch in letzter Zeit häufen sich die Beschwerden über Ausfälle und Störungen der Plattform. Viele Spieler berichten davon, dass sie sich nicht mehr in ihren Accounts einloggen können oder dass die Spiele einfach nicht laden. Dies sorgt für großen Frust bei den Nutzern, besonders wenn sie gerade in einer spannenden Spielrunde sind.
Die Gründe für die Ausfälle sind bisher nicht bekannt, doch die Spieler äußern ihren Unmut über die mangelnde Kommunikation seitens des Casinos. Viele fühlen sich im Stich gelassen und wünschen sich eine schnellere Lösung des Problems. Einige Nutzer haben sogar bereits angekündigt, das Tipico Casino zu verlassen und sich nach einer anderen Plattform umzusehen.
Es ist zu hoffen, dass das Tipico Casino schnellstmöglich das Problem behebt und den Spielern eine reibungslose und unterbrechungsfreie Spielerfahrung bietet. Denn nur so kann das Casino seine treuen Kunden behalten und neue Spieler anlocken. Es bleibt abzuwarten, wie das Casino auf die Kritik reagieren wird und ob es gelingt, das Vertrauen der Spieler zurückzugewinnen.
https://tipicocasino.one/
1249742
Gogo Casino är en populär online spelsajt för svenska spelare, men nyligen har det uppstått problem med uttagen. Många spelare har klagat på att de inte kan ta ut sina vinster och att det har varit långsamma och komplicerade processer för att få tillbaka sina pengar.
En del spelare har rapporterat att de har väntat i veckor på att få sina uttag godkända och att de har hämnats med krav på olika typer av verifieringar av sin identitet. Detta har skapat stor frustration och missnöje bland spelarna, som förväntar sig snabba och smidiga uttag från spelsajten.
Gogo Casino har ännu inte kommenterat problemen med uttagen offentligt, vilket har gjort situationen ännu mer frustrerande för spelarna. Många har börjat ifrågasätta förtroendet för spelsajten och överväger att byta till en annan operatör.
Det är viktigt att spelsajter som Gogo Casino tar ansvar för att ge sina spelare en bra och pålitlig spelupplevelse, inklusive snabba och problemfria uttag. Om problemen med uttagen fortsätter kan det påverka sajtens rykte och popularitet bland spelare, vilket i sin tur kan leda till minskade intäkter och förlorade kunder. Förhoppningsvis kan Gogo Casino snart lösa problemen med uttagen och återfå förtroendet från sina spelare.
https://gogocasino.one
Gogo Casino är en populär online spelplattform som erbjuder spelare möjligheten att spela sina favorit casinospel på nätet. Men trots dess popularitet har vissa användare upplevt problem med uttag på plattformen.
En del spelare har rapporterat att de har haft svårigheter när de försöker ta ut sina vinster från Gogo Casino. Vissa har fått sina uttag försenade, medan andra har hävdats att deras uttagsförsök har nekats av olika anledningar.
Det finns flera faktorer som kan påverka spelares uttag på online casinon som Gogo Casino. En av de vanligaste orsakerna till problemen kan vara att spelaren inte har följt plattformens uttagsregler och -krav. Det är därför viktigt att spelare läser och förstår villkoren för uttag innan de begär en utbetalning.
Andra möjliga orsaker till uttagsproblem kan vara tekniska fel på plattformen eller att spelaren inte har uppfyllt omsättningskraven på sina vinster. Det är viktigt att kontakta Gogo Casinos kundtjänst om man upplever problem med uttag för att få rätt hjälp och support.
För att undvika uttagsproblem på Gogo Casino är det viktigt att spelare följer plattformens regler och villkor samt ser till att uppfylla eventuella omsättningskrav innan de begär en utbetalning. Genom att vara medveten om dessa faktorer kan spelare minska risken för problem med uttag och njuta av en smidig spelupplevelse på plattformen.
https://gogocasino.one
Zet Casino ist ein Online-Casino mit einer Vielzahl von Spielen und einer großen Anzahl zufriedener Kunden. Eine Möglichkeit, die Vertrauenswürdigkeit eines Casinos zu überprüfen, ist die Suche nach Bewertungen auf Plattformen wie Trustpilot.
Trustpilot ist eine Website, auf der Verbraucher Bewertungen zu verschiedenen Unternehmen und Dienstleistungen hinterlassen können. Diese Bewertungen werden von echten Kunden verfasst und bieten somit einen authentischen Einblick in die Qualität eines Unternehmens.
Wenn man nach “Zet Casino Trustpilot” sucht, findet man eine Vielzahl von Bewertungen, die das Casino loben. Viele Kunden betonen die Vielfalt und QualitГ¤t der Spiele, den reibungslosen Ablauf von Ein- und Auszahlungen sowie den freundlichen Kundenservice.
Einige Bewertungen weisen auch auf kleine Probleme hin, wie zum Beispiel Verzögerungen bei Auszahlungen, aber insgesamt scheint Zet Casino ein vertrauenswürdiger Anbieter zu sein, der seinen Kunden ein unterhaltsames und sicheres Spielerlebnis bietet.
Es ist immer ratsam, sich vor einer Registrierung in einem Online-Casino über die Erfahrungen anderer Spieler zu informieren. Plattformen wie Trustpilot bieten eine gute Möglichkeit, einen Einblick in die Qualität eines Anbieters zu erhalten und herauszufinden, ob das Casino vertrauenswürdig ist.
Insgesamt scheint Zet Casino auf Trustpilot positive Bewertungen zu erhalten und daher könnte es sich lohnen, diesem Online-Casino eine Chance zu geben und sein Glück zu versuchen.
https://zetcasino.one/
nice content!nice history!! boba 😀
Online Casinos erfreuen sich zunehmender Beliebtheit bei Spielern auf der ganzen Welt. Eines der fГјhrenden Casinos in diesem Bereich ist das Zet Casino. Mit einer breiten Auswahl an Spielen und attraktiven Boni lockt das Zet Casino Spieler aus allen Ecken der Welt an.
Das Zet Casino bietet eine Vielzahl von Spielmöglichkeiten, darunter beliebte Casinospiele wie Slots, Roulette, Blackjack, Poker und vieles mehr. Die Spiele werden von renommierten Softwareanbietern entwickelt, was eine hohe Qualität und ein faires Spielerlebnis garantiert.
Ein weiterer großer Vorteil des Zet Casinos sind die großzügigen Boni und Aktionen, die regelmäßig angeboten werden. Neue Spieler können sich über einen Willkommensbonus freuen, der ihnen einen guten Start in das Casinoerlebnis ermöglicht. Darüber hinaus gibt es zahlreiche Promotionen und Belohnungen für treue Spieler, die das Spielen im Zet Casino noch spannender machen.
Das Zet Casino legt großen Wert auf Sicherheit und Fairness. Die Website verfügt über eine sichere SSL-Verschlüsselung, um die persönlichen Daten der Spieler zu schützen. Darüber hinaus werden alle Spiele regelmäßig von unabhängigen Prüfstellen auf Fairness überprüft, um sicherzustellen, dass die Spieler ein faires Spielerlebnis haben.
Insgesamt ist das Zet Casino eine ausgezeichnete Wahl fГјr Spieler, die nach einem unterhaltsamen und sicheren Online-Casinoerlebnis suchen. Mit einer breiten Auswahl an Spielen, groГџzГјgigen Boni und einem hohen MaГџ an Sicherheit und Fairness ist das Zet Casino definitiv einen Besuch wert.
https://zetcasino.one/
Gogo Casino är ett populärt nätcasino som har blivit mycket omtyckt av spelare i Finland. Med sitt stora utbud av spel och generösa bonusar lockar Gogo Casino till sig både erfarna spelare och nybörjare.
När man besöker Gogo Casino möts man av ett modernt och användarvänligt gränssnitt som gör det enkelt att navigera mellan olika spel och kategorier. Här finns allt från klassiska casinospel som blackjack och roulette till moderna videoslots och progressiva jackpottar.
En av fördelarna med att spela på Gogo Casino är att man kan göra snabba och säkra insättningar och uttag med hjälp av populära betalningsmetoder som Visa, Mastercard, Skrill och Neteller. Dessutom erbjuds spelare en kundtjänst som är tillgänglig dygnet runt via livechatt och e-post.
För de som är intresserade av att prova på Gogo Casino finns det också möjlighet att ta del av generösa välkomstbonusar och andra kampanjer som ökar ens vinstchanser och ger en extra spänning till spelandet.
Sammanfattningsvis är Gogo Casino en pålitlig och underhållande spelsajt som erbjuder en förstklassig spelupplevelse för alla som älskar att spela på nätcasino. Med sitt stora utbud av spel, generösa bonusar och smidiga betalningsmetoder är det inte konstigt att Gogo Casino har blivit en favorit bland spelare i Finland.
https://gogocasino.one
ZET Casino Affiliates: Eine großartige Möglichkeit, um zu verdienen
Wenn Sie auf der Suche nach einer lukrativen Möglichkeit sind, online Geld zu verdienen, sollten Sie sich unbedingt das ZET Casino Affiliates-Programm genauer anschauen. Als Affiliate können Sie von den zahlreichen Vorteilen profitieren, die das Programm zu bieten hat.
ZET Casino ist eine beliebte Online-Glücksspielplattform, die eine Vielzahl von Spielen und attraktiven Bonusangeboten für ihre Kunden bereithält. Durch die Teilnahme am Affiliates-Programm können Sie an dem Erfolg des Casinos teilhaben und Provisionen für jeden vermittelten Spieler verdienen.
Das ZET Casino Affiliates-Programm bietet groГџzГјgige Provisionen und eine Vielzahl von Werbematerialien, die es Ihnen leicht machen, neue Spieler zu gewinnen. DarГјber hinaus profitieren Sie von einem engagierten Affiliate-Manager, der Ihnen bei allen Fragen und Anliegen zur Seite steht.
Um am ZET Casino Affiliates-Programm teilzunehmen, müssen Sie lediglich ein Konto erstellen und sich bewerben. Sobald Ihre Bewerbung genehmigt wurde, können Sie sofort damit beginnen, Werbematerialien auf Ihrer Website oder in Ihren sozialen Medien zu platzieren und Provisionen zu verdienen.
Insgesamt bietet das ZET Casino Affiliates-Programm eine großartige Möglichkeit, um passives Einkommen zu generieren und von einer der führenden Online-Glücksspielplattformen zu profitieren. Wenn Sie also nach einer lukrativen Verdienstmöglichkeit suchen, sollten Sie nicht zögern, sich für das ZET Casino Affiliates-Programm anzumelden.
https://zetcasino.one/
Gogo Casino är en populär online-spelplattform som erbjuder ett brett utbud av casinospel för spelare att njuta av. Det senaste samarbetet som Gogo Casino har ingått har skapat stor uppmärksamhet inom spelbranschen.
Det nya samarbetet är med en välkänd spelutvecklare som är känd för att leverera högkvalitativa spel med spännande funktioner och grafik. Genom detta partnerskap kommer Gogo Casino att kunna erbjuda sina spelare ännu fler underhållande spel att spela och njuta av.
Detta samarbete är en del av Gogo Casinos strategi att ständigt förbättra och utveckla sin spelportfölj för att möta spelarnas ökade krav och förväntningar. Genom att samarbeta med de bästa spelutvecklarna kan Gogo Casino säkerställa att deras spelare alltid har tillgång till de senaste och bästa spelen på marknaden.
Spelarna på Gogo Casino kan se fram emot att utforska en rad nya spel och funktioner tack vare detta nya samarbete. Med en spännande samling av slots, bordsspel och live casinospel kommer spelarna garanterat att få en underhållande och spännande spelupplevelse varje gång de loggar in på Gogo Casino.
Gogo Casino strävar alltid efter att erbjuda en säker och trygg spelplattform för sina spelare och detta samarbete är ett bevis på deras engagemang för att leverera en högkvalitativ spelupplevelse. Med det nya samarbetet kommer Gogo Casino att fortsätta att vara en ledande aktör inom den spännande världen av online-spel.
https://gogocasino.one
blablablu
Gogo Casino recension
Gogo Casino är en ny spelplattform på den svenska spelmarknaden som erbjuder en spännande spelupplevelse för alla som gillar att spela casino online. Med ett modernt och användarvänligt gränssnitt har Gogo Casino snabbt blivit populärt bland svenska spelare.
En av de frГ¤msta fГ¶rdelarna med Gogo Casino Г¤r dess stora utbud av casinospel. HГ¤r hittar du allt frГҐn klassiska slots till bordsspel och live casino. Med spel frГҐn vГ¤lkГ¤nda leverantГ¶rer som NetEnt, Microgaming och Play’n GO kan du vara sГ¤ker pГҐ att hitta en spelupplevelse som passar dig.
En annan fördel med Gogo Casino är dess generösa bonuserbjudanden. Nya spelare kan se fram emot en välkomstbonus som ger dem extra pengar att spela för, vilket ökar chansen att vinna stort. Dessutom erbjuder Gogo Casino regelbundna kampanjer och turneringar där du kan vinna kontantpriser och andra spännande priser.
När det gäller säkerhet och pålitlighet är Gogo Casino licensierat av Spelinspektionen i Sverige, vilket är en garanti för att dina personuppgifter och transaktioner är säkra. Dessutom erbjuder Gogo Casino en engagerad kundtjänst som är tillgänglig dygnet runt för att hjälpa dig med eventuella frågor eller problem som kan uppstå.
Sammanfattningsvis är Gogo Casino en spännande spelplattform som erbjuder en genomtänkt och säker spelupplevelse för svenska spelare. Med sitt stora utbud av spel, generösa bonuserbjudanden och pålitliga kundtjänst är det en plattform som definitivt är värd att prova på. Besök Gogo Casino idag och upptäck själv allt som de har att erbjuda!
https://gogocasino.one
Zet Casino Bonuscode: Maximales Spielerlebnis mit zusätzlichem Guthaben
Das Zet Casino ist ein beliebtes Online-Casino, das eine Vielzahl von Spielen und Bonusaktionen für seine Spieler anbietet. Ein besonders attraktives Angebot für Neukunden ist der Zet Casino Bonuscode, der zusätzliches Guthaben auf das Spielerkonto bringt.
Der Zet Casino Bonuscode wird bei der Registrierung oder Einzahlung im Online-Casino eingegeben und aktiviert. Mit diesem Code können Spieler von lukrativen Angeboten profitieren, wie zum Beispiel einem Willkommensbonus, Freispielen oder Cashback-Aktionen.
Durch die Verwendung des Zet Casino Bonuscodes haben Spieler die Möglichkeit, ihr Spielerlebnis zu maximieren und ihre Gewinnchancen zu erhöhen. Mit zusätzlichem Guthaben können sie länger spielen und mehr Spiele ausprobieren, ohne dabei ihr eigenes Geld zu riskieren.
Um den Zet Casino Bonuscode zu nutzen, sollten Spieler die jeweiligen Bonusbedingungen genau durchlesen und sicherstellen, dass sie alle Anforderungen erfüllen. So können sie das Bonusguthaben optimal nutzen und von den attraktiven Bonusaktionen profitieren.
Insgesamt bietet der Zet Casino Bonuscode Spielern die Möglichkeit, ihr Casinoerlebnis auf ein neues Level zu heben und von lukrativen Angeboten zu profitieren. Wer also auf der Suche nach zusätzlichem Guthaben und spannenden Bonusaktionen ist, sollte den Zet Casino Bonuscode nicht verpassen.
https://zetcasino.one/
bluatblaaotuy
Reduslim PZN ist der neue Schlankmacher auf dem Markt, der viele Menschen in Deutschland begeistert. Die natürlichen Inhaltsstoffe sorgen für eine effektive und gesunde Gewichtsabnahme. Die PZN-Nummer garantiert die Qualität und Sicherheit des Produkts. Reduslim unterstützt den Stoffwechsel, reduziert den Appetit und fördert die Fettverbrennung. Viele Anwender berichten von schnellen und langanhaltenden Ergebnissen. Probieren auch Sie Reduslim PZN und starten Sie noch heute in ein schlankeres und gesünderes Leben!
https://reduslim.at/
lalablublu
blublu
1249742
bluatblaaotuy
Zet Casino ist eine beliebte Online-Glücksspielplattform, die ihren Spielern eine Vielzahl von Spielen und lukrativen Boni bietet. Einer der Hauptanziehungspunkte des Casinos sind die großzügigen Kasinobonukset, die den Spielern eine zusätzliche Möglichkeit bieten, ihr Glück zu versuchen und ihre Gewinne zu maximieren.
Die Kasinobonukset im Zet Casino sind vielfältig und für Spieler aller Erfahrungsstufen zugänglich. Neue Spieler können von einem großzügigen Willkommensbonus profitieren, der oft aus Einzahlungsboni und Freispielen besteht. Diese Boni ermöglichen es den Spielern, mehr Geld auf ihrem Konto zu haben und dadurch ihre Gewinnchancen zu erhöhen.
Darüber hinaus belohnt Zet Casino auch treue Spieler mit regelmäßigen Sonderaktionen und Boni. Diese können von Cashback-Angeboten über Freispiele bis hin zu Einzahlungsboni reichen. Durch die Teilnahme an diesen Aktionen können Spieler ihre Gewinne steigern und gleichzeitig mehr Spaß beim Spielen haben.
Ein weiterer Vorteil der Kasinobonukset im Zet Casino ist, dass sie oft keine strengen Umsatzbedingungen haben. Dies bedeutet, dass die Spieler ihre Boni leichter umsetzen und ihre Gewinne auszahlen lassen können. Dies macht das Spielen im Zet Casino nicht nur unterhaltsam, sondern auch lohnend.
Insgesamt sind die Kasinobonukset im Zet Casino eine attraktive Möglichkeit für Spieler, mehr aus ihrem Glücksspiel-Erlebnis herauszuholen. Mit großzügigen Angeboten für neue und treue Spieler sowie fairen Umsatzbedingungen ist Zet Casino eine hervorragende Wahl für alle, die nach einer spannenden und lukrativen Online-Glücksspielplattform suchen.
https://zetcasino.one/
boba 😀
ссылка на сайт https://xn—-jtbjfcbdfr0afji4m.xn--p1ai/
124SDS9742
Kenyan players, the top online casinos in Kenya are your gateway to premium gaming.
cululutata
Gogo Casino är en populär online spelplattform där spelare kan njuta av en mängd olika casinospel. Tyvärr har det kommit uppgifter om att vissa spelare har haft problem med att få ut sina vinster från casinot.
Det är viktigt att förstå att alla online casinon har sina egna regler och villkor när det gäller uttag av vinster. Det är därför viktigt att läsa och förstå dessa regler innan man börjar spela på ett casino. Om det uppstår problem med att få ut vinster är det också viktigt att kontakta casinots kundtjänst för att få hjälp.
Om du upplever att Gogo Casino inte betalar ut dina vinster som de ska, ska du omedelbart kontakta deras kundtjänst för att få hjälp med ditt ärende. De ska kunna ge dig information om varför ditt uttag har fördröjts och hjälpa dig att lösa problemet.
Det är viktigt att vara medveten om att det kan finnas olika anledningar till varför ett uttag kan fördröjas, såsom verifieringsprocesser eller tekniska problem. Det är därför viktigt att vara tålmodig och kommunicera med casinots kundtjänst för att lösa eventuella problem.
Sammanfattningsvis är det viktigt att läsa och förstå reglerna för uttag på online casinon för att undvika missförstånd och problem. Om du upplever att Gogo Casino inte betalar ut dina vinster som de ska, är det bäst att omedelbart kontakta deras kundtjänst för att få hjälp med ditt ärende. Med lite tålamod och kommunikation bör problemet kunna lösas på ett snabbt och effektivt sätt.
https://gogocasino.one
Das Boomerang Casino ist ein aufstrebendes Online-Casino, das auf AskGamblers eine groГџe Fangemeinde gefunden hat. Die Plattform bietet eine Vielzahl von Spielen, darunter Slots, Tischspiele und Live-Dealer-Spiele, die von renommierten Anbietern wie Microgaming, NetEnt, Play’n GO und Evolution Gaming bereitgestellt werden.
Eine der Hauptattraktionen des Boomerang Casinos ist sein großzügiges Bonusangebot. Neue Spieler können sich einen Willkommensbonus sichern, der nicht nur Bonusgeld, sondern auch Freispiele beinhaltet. Darüber hinaus gibt es regelmäßig Aktionen und Turniere, bei denen Spieler zusätzliche Preise gewinnen können.
Ein weiterer Grund, warum das Boomerang Casino so beliebt ist, sind die schnellen Auszahlungen und der zuverlässige Kundenservice. Spieler können ihre Gewinne schnell und unkompliziert abheben und bei Fragen oder Problemen steht ein professionelles Support-Team zur Verfügung.
Die Benutzerfreundlichkeit und das ansprechende Design der Website tragen ebenfalls zum Erfolg des Boomerang Casinos bei. Die Plattform ist übersichtlich gestaltet und leicht zu navigieren, sodass Spieler schnell ihre Lieblingsspiele finden können.
Insgesamt bietet das Boomerang Casino ein rundum gelungenes Spielerlebnis und ist definitiv einen Besuch wert. Egal, ob man auf der Suche nach spannenden Spielen, lukrativen Boni oder einem erstklassigen Kundenservice ist, das Boomerang Casino hat fГјr jeden etwas zu bieten.
https://boomerangcasino.one/
Gogo Casino är en populär online-spelplattform som erbjuder spelare möjligheten att spela en mängd olika casinospel på nätet. Trots sitt rykte för säkerhet och pålitlighet har det nyligen dykt upp uppgifter om att Gogo Casino inte betalar ut vinster till sina spelare.
Enligt flera användarrapporter har spelare upplevt problem med att få ut sina vinster från Gogo Casino. Vissa har hävdat att deras uttagsförfrågningar har blivit fördröjda eller avslagna utan någon tydlig förklaring från casinot. Detta har givetvis väckt oro och missnöje bland många spelare, som anser att de inte behandlas rättvist av Gogo Casino.
Det Г¤r viktigt att notera att Gogo Casino Г¤nnu inte har kommenterat dessa anklagelser och att det finns flera olika faktorer som kan pГҐverka uttagsprocessen pГҐ en spelplattform. Det kan bero pГҐ allt frГҐn tekniska problem till verifieringskrav eller andra oegentligheter.
För spelare som har råkat ut för problem med utbetalningar från Gogo Casino är det viktigt att följa riktlinjerna och kontakta casinots kundtjänst för att få hjälp med sina ärenden. Om problemet kvarstår kan spelare också överväga att rapportera det till en spelregleringsmyndighet eller en annan tillsynsmyndighet för att få hjälp med att lösa situationen.
Sammanfattningsvis är det viktigt att vara medveten om risken för problem med utbetalningar när man spelar på online-casinon som Gogo Casino och att alltid vara på sin vakt för eventuella tecken på oegentligheter. Genom att vara uppmärksam och agera snabbt kan spelare minimera risken för att bli drabbad av sådana problem och skydda sin spelupplevelse online.
https://gogocasino.one
bliblibli
Är du sugen på att spela casino men vill slippa sätta in egna pengar? Då kan gogo casino no deposit vara något för dig! Denna typ av casino erbjuder spelare möjligheten att börja spela utan att behöva göra någon insättning.
Genom att registrera dig på ett gogo casino no deposit kan du ta del av olika bonusar och kampanjer utan att behöva sätta in egna pengar. Detta gör det möjligt för dig att prova på olika spel och se om det är något som passar dig innan du bestämmer dig för att sätta in pengar.
Det finns många fördelar med att spela på ett gogo casino no deposit. För det första så får du en chans att prova på olika spel utan att riskera dina egna pengar. Dessutom så kan du också vinna riktiga pengar utan att behöva sätta in något. Det är helt enkelt ett bra sätt att testa på olika casinospel innan du bestämmer dig för att göra en insättning.
Det är viktigt att komma ihåg att även om du spelar på ett gogo casino no deposit så finns det fortfarande regler och villkor som du behöver följa. Se till att läsa igenom dessa innan du börjar spela för att undvika eventuella missförstånd eller problem.
Sammanfattningsvis så kan gogo casino no deposit vara ett bra alternativ för dig som vill spela casino men inte vill sätta in egna pengar. Genom att registrera dig på ett sådant casino kan du prova på olika spel och kampanjer utan att behöva riskera dina egna pengar. Så varför inte ge det en chans? Vem vet, kanske är det din tur att vinna stort!
https://gogocasino.one
Переподготовка на учителя начальных классов через платформу maps-edu.ru обеспечивает углубленное изучение методик и подходов, необходимых для эффективного обучения и развития младших школьников. Эта программа поможет вам освоить современные образовательные технологии и практики, а также обновить и расширить свои знания в области педагогики и психологии, что является ключом к успешной работе с детьми начальной школы.
Освойте новые горизонты: [url=https://maps-edu.ru/catalog/logopediia?type=professionalnaya-perepodgotovka]логопед переподготовка на базе высшего образования[/url] и контролю закупок.
Das Boomerang Casino Logo: Ein Blick auf ein einzigartiges Markenzeichen
Das Boomerang Casino Logo ist ein Markenzeichen, das bei vielen Spielern auf der ganzen Welt sofort erkennbar ist. Mit seinem einzigartigen Design und den auffälligen Farben hat es sich zu einem Symbol für Unterhaltung und Spaß in der Online-Glücksspielbranche entwickelt.
Das Logo des Boomerang Casinos zeigt einen stilisierten Boomerang, der als Wurfwaffe der Aborigines, des indigenen Volkes Australiens, bekannt ist. Das Boomerang-Symbol steht für Rückkehr und Erfolg, was die Philosophie des Casinos perfekt widerspiegelt. Es symbolisiert auch die zigzagförmige Bewegung, die ein Boomerang macht, wenn es geworfen wird, was auf die Vielfalt der Casino-Spiele und die Möglichkeit von Gewinnen hinweist, die zu den Spielern zurückkehren können.
Die Farbgebung des Logos, die hauptsächlich aus den Farben Orange und Blau besteht, verleiht dem Design eine frische und lebendige Ausstrahlung. Diese Farbkombination ist auch eine Reminiszenz an den sonnigen Himmel Australiens und das klare blaue Wasser des Great Barrier Reef. Insgesamt strahlt das Boomerang Casino Logo Dynamik, Abenteuerlust und Aufregung aus, die Spieler dazu ermutigen, ihr Glück im Casino zu versuchen.
Das Boomerang Casino Logo ist nicht nur ein visuell ansprechendes Markenzeichen, sondern es repräsentiert auch die Werte und das Engagement des Casinos für faire und sichere Glücksspiele. Es steht für eine vertrauenswürdige Marke, die ihre Spieler wertschätzt und ihnen ein erstklassiges Spielerlebnis bietet.
Insgesamt ist das Boomerang Casino Logo ein gelungenes Beispiel für ein effektives und einprägsames Markenzeichen, das nicht nur das Unternehmen repräsentiert, sondern auch das Interesse und die Neugier der Spieler weckt. Mit seinem einzigartigen Design und seiner symbolischen Bedeutung bleibt es ein wichtiger Bestandteil der Marke Boomerang Casino und wird sicherlich weiterhin für Aufmerksamkeit und Begeisterung sorgen.
https://boomerangcasino.one/
Gogo Casino är en populär online-spelplattform som erbjuder en mängd olika casinospel för spelare att njuta av. Med en användarvänlig design och ett brett utbud av spel är det inte konstigt att många spelare flockas till Gogo Casino för en spännande spelupplevelse.
En av de mest pålitliga källorna för casinospelare är AskGamblers, en webbplats som granskar och betygsätter online-kasinon för att ge spelare en objektiv bedömning av deras tjänster. När det gäller Gogo Casino har de fått positiva recensioner från AskGamblers för sin enkla användarupplevelse och stora spelbibliotek.
Spelare kan enkelt hitta sina favoritspel på Gogo Casino, oavsett om de föredrar klassiska bordsspel som roulette och blackjack eller moderna spelautomater med spännande teman och funktioner. Med ett stort antal betalningsmetoder och snabba uttag är det enkelt för spelare att börja spela utan krångel.
AskGamblers har också uppmärksammat Gogo Casino för deras pålitliga kundsupport och generösa kampanjer och erbjudanden för spelare. Genom att erbjuda regelbundna belöningar och bonusar visar Gogo Casino sitt engagemang för att skapa en positiv spelupplevelse för alla sina spelare.
Om du letar efter ett pålitligt och underhållande online casino är Gogo Casino definitivt värt att utforska. Med hjälp av AskGamblers kan du vara säker på att du får en ärlig och opartisk recension av casinot innan du sätter igång och spelar. Så varför inte ge det en chans och se om Gogo Casino passar just dina spelbehov och preferenser? Lycka till!
https://gogocasino.one
blublabla
Gogo Casino Г¤r ett av de senaste tillskotten pГҐ den svenska casino marknaden och det har redan skapat en hel del uppmГ¤rksamhet. En av de mest populГ¤ra erbjudanden som detta online casino har Г¤r “no deposit bonus”. Men vad innebГ¤r egentligen en no deposit bonus och hur kan du dra nytta av den hos Gogo Casino?
En no deposit bonus är en typ av bonus som erbjuds av online casinon till nya spelare utan att de behöver göra en insättning. Det innebär att du kan spela och vinna pengar utan att riskera dina egna pengar. Hos Gogo Casino, får du en no deposit bonus när du registrerar dig som ny spelare. Denna bonus kan antingen vara i form av free spins eller gratis pengar som du kan använda för att spela olika spel på casinot.
För att dra nytta av Gogo Casinos no deposit bonus behöver du bara registrera dig och skapa ett konto. Efter att du har gjort det kommer bonusen att krediteras till ditt konto och du kan börja spela direkt. Det är viktigt att läsa igenom villkoren för bonusen innan du spelar för att se vilka regler som gäller och vilka spel som bonusen kan användas på.
En no deposit bonus ger dig chansen att prova på casinots spel utan att riskera dina egna pengar. Det är ett bra sätt att utforska Gogo Casino och se om det är rätt casino för dig. Så varför inte ta chansen och testa lyckan med Gogo Casinos generösa no deposit bonus? Lycka till!
https://gogocasino.one
blobloblu
nice content!nice history!!
Reduslim Erfahrungen sind bei vielen Menschen positiv. Diese natürliche Schlankheitspille hat schon vielen geholfen, ihr Idealgewicht zu erreichen. Dank der natürlichen Inhaltsstoffe werden keine Nebenwirkungen befürchtet und die Ergebnisse sprechen für sich. Viele Nutzer berichten von einer schnellen Gewichtsabnahme und einer gesteigerten Energie. Doch jeder Körper ist anders, deshalb sollte man auch auf eine gesunde Ernährung und ausreichend Bewegung achten. Insgesamt gilt Reduslim als effektives Mittel gegen lästige Pfunde.
https://reduslim.at/
Boomerang Bet Casino Review
Das Boomerang Bet Casino ist eine beliebte Online-GlГјcksspielplattform fГјr Spieler aus der ganzen Welt. Mit einer Vielzahl von Spielen, groГџzГјgigen Boni und einem benutzerfreundlichen Interface ist es leicht zu verstehen, warum so viele Menschen diesem Casino vertrauen.
Das Casino bietet eine Vielzahl von Spielen, darunter Slots, Tischspiele, Live-Dealer-Spiele und mehr. Die Spiele sind von erstklassigen Softwareanbietern wie NetEnt, Microgaming, Play’n GO und anderen entwickelt worden, was fГјr ein qualitativ hochwertiges Spielerlebnis sorgt.
Eine der besten Eigenschaften des Boomerang Bet Casinos sind die großzügigen Boni und Promotionen, die regelmäßig angeboten werden. Neue Spieler können von einem Willkommensbonus profitieren, der sie mit zusätzlichem Geld oder Freispielen belohnt. Darüber hinaus gibt es auch regelmäßige Einzahlungsboni, Freispielaktionen und Treueprogramme, die es den Spielern ermöglichen, noch mehr zu gewinnen.
Das Casino verfГјgt Гјber eine benutzerfreundliche Webseite, die es einfach macht, sich anzumelden, Spiele zu finden und Ein- und Auszahlungen vorzunehmen. Der Kundensupport ist rund um die Uhr verfГјgbar und steht den Spielern bei Fragen oder Problemen zur VerfГјgung.
Insgesamt ist das Boomerang Bet Casino eine hervorragende Wahl für Spieler, die nach einer unterhaltsamen und sicheren Online-Glücksspielplattform suchen. Mit einer Vielzahl von Spielen, großzügigen Boni und einem herausragenden Kundensupport können Spieler sicher sein, dass sie bei diesem Casino ein erstklassiges Spielerlebnis genießen werden. Probieren Sie es noch heute aus und sehen Sie selbst, warum das Boomerang Bet Casino zu den besten Online-Casinos gehört.
https://boomerangcasino.one/
Gogo Casino no deposit
Gogo Casino har blivit ett populärt onlinekasino bland svenska spelare tack vare dess enkla och användarvänliga plattform. Ett särskilt intressant erbjudande som lockar många spelare är möjligheten att spela utan att behöva göra en insättning, även känt som no deposit bonus.
Att kunna spela utan att behöva sätta in egna pengar är en fördel som många spelare uppskattar. Det ger dem möjligheten att utforska olika spel och uppleva spänningen av att vinna utan att behöva ta någon risk. Gogo Casino erbjuder regelbundet no deposit bonusar till sina spelare, antingen i form av gratis spins eller bonuspengar.
För att ta del av en no deposit bonus på Gogo Casino behöver spelaren bara skapa ett konto och verifiera sin identitet. Därefter kommer bonusen att krediteras till spelarens konto och de kan börja spela utan att behöva sätta in egna pengar. Det är viktigt att läsa villkoren för varje erbjudande för att vara säker på att man förstår hur bonusen fungerar och vilka regler som gäller.
Gogo Casino erbjuder ett brett utbud av spel frГҐn ledande spelleverantГ¶rer som NetEnt, Microgaming och Play’n GO. Oavsett om man fГ¶redrar spelautomater, bordsspel eller live casino sГҐ finns det nГҐgot fГ¶r alla spelare att njuta av. Med no deposit bonusar kan spelarna utforska olika spel och kanske hitta sina favoriter utan att behГ¶va riskera sina egna pengar.
Sammanfattningsvis är Gogo Casino no deposit ett fantastiskt erbjudande för spelare som vill ha en chans att vinna utan att behöva göra en insättning. Genom att erbjuda regelbundna no deposit bonusar visar Gogo Casino att de värdesätter sina spelare och är villiga att belöna dem för deras lojalitet. Ge det ett försök och se om du kan ha turen på din sida!
https://gogocasino.one
palabraptu
Das Boomerang Casino ist eine der neuesten Online-Spielplattformen, die derzeit in Deutschland verfГјgbar sind. Mit einer breiten Palette von Spielen und attraktiven Bonusangeboten hat das Casino bereits viele Spieler angezogen.
Das Boomerang Casino bietet eine Vielzahl von Spielen, darunter Slots, Tischspiele und Live-Casino-Spiele. Damit ist fГјr jeden Geschmack etwas dabei und die Spieler kГ¶nnen sich stundenlang unterhalten lassen. Die Spiele werden von renommierten Softwareanbietern wie NetEnt, Microgaming und Play’n GO entwickelt, was fГјr QualitГ¤t und ein unvergessliches Spielerlebnis garantiert.
Neben einer großen Auswahl an Spielen bietet das Boomerang Casino auch großzügige Bonusangebote und Promotionen. Neue Spieler können von Willkommensboni profitieren, die Freispiele und Bonusgeld beinhalten. Auch Bestandskunden werden mit regelmäßigen Aktionen belohnt, die zusätzliche Gewinnchancen bieten.
Ein weiteres Highlight des Boomerang Casinos ist der Kundenservice. Die Spieler können sich jederzeit an das freundliche und professionelle Supportteam wenden, das bei Fragen oder Problemen weiterhilft. Die schnelle und zuverlässige Unterstützung sorgt für ein reibungsloses Spielerlebnis ohne unnötige Verzögerungen.
Alles in allem ist das Boomerang Casino eine ausgezeichnete Wahl fГјr Spieler in Deutschland, die auf der Suche nach einer unterhaltsamen und lohnenden Spielumgebung sind. Mit einer Vielzahl von Spielen, attraktiven Boni und einem erstklassigen Kundenservice ist das Casino definitiv einen Besuch wert.
https://boomerangcasino.one/
Reduslim ist ein wirksames Medikament zur Gewichtsabnahme, das auf natürliche Weise den Stoffwechsel anregt und Fett verbrennt. Dieses Medikament ist besonders beliebt bei Menschen, die Schwierigkeiten haben, Gewicht zu verlieren, auch wenn sie sich gesund ernähren und regelmäßig Sport treiben.
Das Medikament Reduslim enthält natürliche Inhaltsstoffe wie grünen Kaffee und Garcinia Cambogia, die bekanntlich beim Abnehmen helfen und den Appetit unterdrücken. Dadurch wird das Verlangen nach Snacks und ungesundem Essen reduziert, was zu einer besseren Kontrolle der Kalorienzufuhr führt.
Reduslim ist eine sichere und effektive Methode, um überschüssiges Gewicht loszuwerden, ohne dabei auf drastische Diäten oder harte Trainingseinheiten angewiesen zu sein. Es ist wichtig, dass man das Medikament regelmäßig einnimmt und die empfohlene Dosierung nicht überschreitet, um optimale Ergebnisse zu erzielen.
Wenn Sie also Probleme mit dem Abnehmen haben und auf der Suche nach einem effektiven und natürlichen Medikament sind, dann probieren Sie Reduslim aus und erleben Sie die positiven Veränderungen an Ihrem Körper. Mit Geduld und Disziplin werden Sie schon bald die gewünschten Erfolge sehen und sich in Ihrem Körper wohler fühlen.
https://reduslim.at/
palabraptu
Gogo Casino välkomstbonus är ett generöst erbjudande för alla nya spelare som registrerar sig på denna online casino plattform. Med en välkomstbonus kan spelare få en extra boost i början av sin spelupplevelse och ha möjlighet att utforska olika spel och vinna stora priser.
För att ta del av Gogo Casino välkomstbonus behöver spelaren först registrera sig på plattformen och göra en insättning. Vanligtvis erbjuds en insättningsbonus som ger spelaren extra pengar att spela för. Detta kan öka spelarens chanser att vinna samt ge dem möjlighet att prova nya spel utan att behöva riskera sina egna pengar.
Det är viktigt att läsa villkoren och reglerna för välkomstbonusen för att förstå hur den fungerar och vilka krav som måste uppfyllas för att kunna ta ut eventuella vinster. Ofta finns det omsättningskrav som innebär att spelaren måste satsa en viss summa pengar innan de kan ta ut sina vinster.
Gogo Casino välkomstbonus är en fantastisk möjlighet för nya spelare att komma igång på plattformen och uppleva spänningen av online casinospel. Med extra pengar att spela för kan spelare prova olika spel och öka sina chanser att vinna stora priser. Så om du är sugen på lite spänning och vill prova lyckan på ett online casino, ta del av Gogo Casino välkomstbonus idag!
https://gogocasino.one
сколько стоит вскрыть замок на двери [url=https://azs-zamok13.ru/]https://azs-zamok13.ru/[/url] .
Gogo Casino har varit en populär spelsajt för många svenska spelare, men nu har sidan fått ett negativt rykte. Många spelare vittnar om att de inte får sina vinstpengar utbetalda från casinot.
Det är alltid viktigt att vara försiktig när man väljer ett online casino att spela på, och det verkar som att Gogo Casino inte lever upp till förväntningarna. Spelare har känt sig lurade och missnöjda med hur casinot hanterar deras utbetalningar.
Det är viktigt att vara medveten om risken med att spela på oseriösa casinon, och det är viktigt att hålla sig informerad om vilka casinon som är pålitliga och säkra. Om man känner sig osäker på ett casino, så är det bäst att undvika att spela där för att undvika att förlora sina pengar.
Det är tråkigt att höra att Gogo Casino har fått dessa anklagelser, och förhoppningsvis kan de rätta till problemen och återfå förtroendet från sina spelare. Men tills dess är det bäst att vara försiktig och välja ett annat casino för att undvika att hamna i en liknande situation.
https://gogocasino.one
Zet Casino – das Casino ohne Einzahlung
Zet Casino ist ein beliebtes Online Casino, das seinen Spielern die Möglichkeit bietet, ohne eine Einzahlung zu spielen. Dank seines großzügigen Bonusangebots können Spieler bei Zet Casino kostenlos spielen und echtes Geld gewinnen.
Das Casino bietet eine Vielzahl von Spielen, darunter Spielautomaten, Tischspiele und Live-Casino-Spiele. Spieler kГ¶nnen aus einer Vielzahl von bekannten Titeln wГ¤hlen, die von fГјhrenden Entwicklern wie NetEnt, Microgaming und Play’n GO bereitgestellt werden.
Um ohne Einzahlung zu spielen, mГјssen Spieler einfach ein Konto bei Zet Casino erstellen und sich fГјr den “No Deposit Bonus” anmelden. Dieser Bonus ermГ¶glicht es Spielern, kostenloses Spielgeld zu erhalten, mit dem sie die verschiedenen Spiele im Casino ausprobieren kГ¶nnen.
Zet Casino ohne Einzahlung bietet nicht nur die Möglichkeit, echtes Geld zu gewinnen, sondern auch eine unterhaltsame und spannende Spielerfahrung. Das Casino ist für seine hervorragende Benutzeroberfläche und sein ansprechendes Design bekannt, was das Spielerlebnis noch angenehmer macht.
Wenn Sie auf der Suche nach einem Casino ohne Einzahlung sind, sollten Sie Zet Casino unbedingt ausprobieren. Mit seiner groГџen Auswahl an Spielen, groГџzГјgigen Boni und hervorragenden Benutzererfahrung ist es eine ausgezeichnete Wahl fГјr alle, die gerne spielen, ohne Geld ausgeben zu mГјssen. Besuchen Sie noch heute Zet Casino und beginnen Sie Ihr Casino-Abenteuer ohne Einzahlung!
https://zetcasino.one/
Bonus Gogo Casino är ett erbjudande som lockar många spelentusiaster till att testa lyckan på denna populära spelsajt. Med en generös bonus som ger spelarna extra pengar att spela för, kan man maximera sina vinstchanser och förlänga spelglädjen.
Den typiska bonusen på Gogo Casino är en insättningsbonus som ger spelaren en procentuell ökning av den summa man sätter in på sitt spelkonto. Det innebär att man får mer pengar att spela för än vad man själv satt in. Det här kan vara ett perfekt sätt att testa nya spel eller att ta chansen på större vinster.
För att ta del av Bonus Gogo Casino, måste man oftast göra en insättning på sitt spelkonto. En del casinon erbjuder också bonusar utan insättning, vilket innebär att man får bonuspengar utan att behöva sätta in egna pengar. Det här kan vara ett bra sätt att prova på ett nytt casino utan att riskera några egna pengar.
Det finns olika villkor och regler som gäller för Bonus Gogo Casino, så det är viktigt att läsa igenom dessa noggrant innan man tar emot en bonus. Det kan vara krav på att omsätta bonusen ett visst antal gånger innan man kan ta ut sina vinster, eller att bonusen endast gäller för vissa spel.
Sammanfattningsvis är Bonus Gogo Casino ett attraktivt erbjudande för de som gillar att spela casino online. Med en bonus kan man få extra pengar att spela för och öka sina vinstchanser. Det är viktigt att läsa igenom villkoren noggrant för att få ut det mesta av bonusen och ha en rolig och spännande spelupplevelse.
https://gogocasino.one
Reduslim ist ein beliebtes Nahrungsergänzungsmittel, das dabei hilft, Gewicht zu verlieren. Viele Menschen, die an Übergewicht leiden, suchen nach Möglichkeiten, um effektiv und schnell abzunehmen. Mit Reduslim können sie ihre Ziele erreichen, indem sie den Stoffwechsel anregen und Fettverbrennung unterstützen.
Wenn auch Sie Reduslim kaufen möchten, gibt es verschiedene Möglichkeiten, dies zu tun. Eine Möglichkeit ist es, Reduslim online zu kaufen. Auf verschiedenen Websites können Sie Reduslim bestellen und es bequem zu sich nach Hause liefern lassen. Es ist wichtig, nur von seriösen Anbietern zu kaufen, um sicherzustellen, dass Sie ein qualitativ hochwertiges Produkt erhalten.
Alternativ können Sie Reduslim auch in Apotheken oder bestimmten Geschäften kaufen. Informieren Sie sich vorher über die Verfügbarkeit in Ihrer Nähe. Reduslim ist eine großartige Unterstützung für alle, die Gewicht verlieren möchten und ihren Körper in Form bringen wollen. Worauf warten Sie noch? Probieren Sie Reduslim aus und erreichen Sie Ihre Ziele!
https://reduslim.at/
blablablu
boba 😀
Gogo Casino är en populär onlinecasino som erbjuder ett brett utbud av spel för spelare att njuta av. För de som behöver kontakta casinot av olika anledningar finns det flera sätt att nå dem.
Ett enkelt sätt att komma i kontakt med Gogo Casino är genom deras livechattfunktion som är tillgänglig dygnet runt. Genom att klicka på livechattikonen på casinots hemsida kan spelare prata direkt med en supportrepresentant och få svar på sina frågor eller hjälp med eventuella problem.
För de som föredrar att kontakta casinot via e-post finns det en kontaktformulär på deras hemsida där spelare kan skriva sina frågor eller kommentarer och få svar inom kort.
Utöver detta finns det också en FAQ-sektion på Gogo Casinos hemsida där spelare kan hitta svar på vanliga frågor och problem. Det är alltid bra att kolla igenom den här sektionen innan du kontaktar casinot för att se om ditt problem redan har blivit löst.
Sammanfattningsvis är Gogo Casino en tillgänglig och kundorienterad onlinecasino som erbjuder flera sätt att kontakta dem för att få den hjälp eller information du behöver. Så om du har några frågor eller problem kan du vara säker på att de finns där för att hjälpa dig.
https://gogocasino.one
cululutata
Boomerang Casino: Kostenlose Freispiele
Boomerang Casino ist ein aufregendes Online-Casino, das Spielern eine breite Auswahl an Spielen und spannenden Aktionen bietet. Einer der beliebtesten Angebote für Spieler sind die kostenlosen Freispiele, die das Casino regelmäßig veranstaltet.
Kostenlose Freispiele sind eine großartige Möglichkeit, um neue Spiele auszuprobieren und zusätzliche Gewinne zu erzielen, ohne dabei Ihr eigenes Geld zu riskieren. Boomerang Casino bietet regelmäßig verschiedene Aktionen an, bei denen Spieler kostenlose Freispiele erhalten können. Diese können für bestimmte Spiele oder Slots gelten und sind in der Regel an bestimmte Bedingungen geknüpft, wie zum Beispiel eine Mindesteinzahlung oder Umsatzanforderungen.
Um kostenlose Freispiele zu erhalten, müssen Spieler sich zunächst für die Aktion anmelden oder einen entsprechenden Bonuscode verwenden. Sobald die Freispiele gutgeschrieben wurden, können Spieler sofort mit dem Spielen beginnen und hoffentlich lukrative Gewinne erzielen.
Das Boomerang Casino bietet seinen Spielern eine erstaunliche Auswahl an Spielen und groГџzГјgige Aktionen, einschlieГџlich kostenloser Freispiele. Wenn Sie also auf der Suche nach einem unterhaltsamen und lohnenden Online-Casino-Erlebnis sind, sollten Sie auf jeden Fall Boomerang Casino im Auge behalten. Viel SpaГџ beim Spielen und viel GlГјck!
https://boomerangcasino.one/
Gogo Casino är ett online casino som har satt användarvänlighet och transparens i fokus. Genom att erbjuda en smidig och enkel spelupplevelse vill Gogo Casino skapa en trygg miljö för sina spelare.
En av de viktigaste faktorerna för många spelare är transparens när det kommer till spel och insättningar. Gogo Casino har därför lagt stor vikt vid att vara transparent i all sin verksamhet. Genom att tydligt visa regler och villkor samt erbjudanden och kampanjer på ett öppet sätt, skapar Gogo Casino en tillitsfull relation med sina spelare.
En annan viktig aspekt av transparens är hur insättningar och uttag hanteras. Gogo Casino erbjuder snabba och säkra betalningsmetoder för att göra det enkelt för spelarna att hantera sina pengar. Genom att vara transparent kring avgifter och transaktionstider möjliggör Gogo Casino en smidig spelupplevelse för sina spelare.
Genom att fokusera på transparens och användarvänlighet vill Gogo Casino skapa en plattform där spelarna känner sig trygga och väl omhändertagna. Med ett brett utbud av spel och generösa erbjudanden är Gogo Casino en spännande destination för alla som letar efter en enkel och transparent spelupplevelse på nätet.
https://gogocasino.one
Sind Sie auf der Suche nach einem effektiven Weg, um Gewicht zu verlieren? Dann sollten Sie Reduslim kaufen. Dieses natürliche Nahrungsergänzungsmittel ist bei DM erhältlich und kann Ihnen helfen, Ihren Traumkörper zu erreichen. Die spezielle Formel von Reduslim wurde entwickelt, um den Stoffwechsel zu steigern und Fett zu verbrennen. Durch die Einnahme von Reduslim können Sie schneller abnehmen und sich gleichzeitig energiegeladener fühlen. Zögern Sie nicht länger und bestellen Sie Reduslim noch heute bei DM!
https://reduslim.at/
bluatblaaotuy
Gogo Casino är ett populärt online casino som har blivit känt för sin transparens och öppenhet gentemot sina spelare. Med en tydlig och lättanvänd plattform har Gogo Casino skapat en trygg och säker spelmiljö för alla sina användare.
En av de största fördelarna med Gogo Casino är deras transparenta kommunikation kring bonusar och villkor. Istället för att dölja information eller använda komplicerade regler och krav, är allt som rör bonusar och kampanjer tydligt angivet på webbplatsen. Det gör det enkelt för spelare att förstå vad de kan förvänta sig och vilka regler som gäller.
Förutom transparens när det gäller bonusar är Gogo Casino också öppna med sin licens och reglering. De innehar en svensk spellicens, vilket innebär att de följer strikta regler och riktlinjer för att säkerställa en rättvis och ansvarsfull spelupplevelse för sina spelare. Dessutom erbjuder de snabba och säkra betalningsmetoder för insättningar och uttag.
Gogo Casino strävar efter att vara en pålitlig och transparent aktör inom spelbranschen. Genom att erbjuda en säker och rättvis spelmiljö samt vara öppna med sin verksamhet, har de lyckats skapa en lojal kundkrets som uppskattar deras transparens och professionalism. Så om du letar efter ett pålitligt och transparent online casino, är Gogo Casino definitivt värt att prova!
https://gogocasino.one
Периодическая аккредитация врачей – это процесс, направленный на подтверждение и обновление профессиональных компетенций медицинских специалистов. Этот процесс помогает гарантировать, что врачи остаются в курсе последних медицинских знаний и практик, обеспечивая высокий уровень оказываемой медицинской помощи.
Обновите свои знания: курсы повышения квалификации для педагогов и [url=https://maps-edu.ru/catalog/gosudarstvennoe-i-municipalnoe-upravlenie-iurisprudenciia]юриспруденция дистанционно[/url] .
blablablu
bliblibli
http://cleandi.ru/
Mit Tipico Casino Geld verdienen
Immer mehr Menschen suchen nach Möglichkeiten, um zusätzliches Einkommen zu generieren. Eine beliebte Methode, um Geld zu verdienen, ist das Spielen in Online-Casinos. Eine der bekanntesten Plattformen hierfür ist das Tipico Casino.
Tipico Casino bietet eine Vielzahl von Spielen an, darunter Slots, Roulette, Blackjack und vieles mehr. Die Plattform ist sicher und zuverlässig, was bedeutet, dass die Spieler sich keine Sorgen um ihre Einzahlungen oder Gewinne machen müssen.
Um mit Tipico Casino Geld zu verdienen, ist es wichtig, eine Strategie zu haben. Es ist ratsam, sich zunächst mit den Spielen vertraut zu machen und die Regeln zu verstehen. Darüber hinaus ist es wichtig, sein Budget im Auge zu behalten und verantwortungsbewusst zu spielen.
Ein weiterer wichtiger Aspekt beim Geld verdienen mit Tipico Casino ist das Management des Guthabens. Spieler sollten darauf achten, wie viel sie setzen und wie sie ihre Gewinne maximieren können. Es kann auch hilfreich sein, sich Limits zu setzen, um das Risiko zu minimieren.
Darüber hinaus bietet das Tipico Casino regelmäßige Aktionen und Boni, die den Spielern dabei helfen können, ihr Guthaben zu erhöhen. Es lohnt sich daher, regelmäßig nach neuen Angeboten Ausschau zu halten und diese zu nutzen.
Insgesamt ist das Tipico Casino eine gute Möglichkeit, um zusätzliches Geld zu verdienen. Mit der richtigen Strategie, einem vernünftigen Guthabenmanagement und der Nutzung von Aktionen und Boni können Spieler ihre Gewinne maximieren und erfolgreich Geld verdienen.
https://tipicocasino.one/
Gogo Casino partners är en del av Gogo Casino familjen som arbetar nära med casinot för att skapa en komplett spelupplevelse för spelare. Genom att samarbeta med olika partners kan Gogo Casino erbjuda ett brett utbud av spel, kampanjer och belöningar för sina spelare.
En av de viktigaste delarna av Gogo Casino partners är att säkerställa att spelarna får den bästa möjliga upplevelsen när de spelar på casinot. Genom att samarbeta med ledande spelleverantörer kan Gogo Casino erbjuda spel av hög kvalitet med spännande funktioner och grafik.
Gogo Casino partners arbetar också för att erbjuda spelare spännande kampanjer och belöningar för att hålla dem engagerade och underhållna. Genom att samarbeta med olika företag och organisationer kan Gogo Casino erbjuda spelare exklusiva erbjudanden och belöningar som inte är tillgängliga någon annanstans.
Genom att jobba nära med sina partners kan Gogo Casino säkerställa att deras spelare får den bästa möjliga spelupplevelsen. Genom att erbjuda ett brett utbud av spel, kampanjer och belöningar kan Gogo Casino partners hjälpa casinot att växa och bli ännu mer framgångsrikt.
I slutändan är Gogo Casino partners en viktig del av Gogo Casino familjen som arbetar för att göra spelupplevelsen så bra som möjligt för alla spelare. Genom att samarbeta med olika partners kan Gogo Casino fortsätta att erbjuda spel av hög kvalitet och spännande kampanjer för sina spelare att njuta av.
https://gogocasino.one
wow, amazing
Reduslim ist ein beliebtes Schlankheitsmittel, das vielen Menschen hilft, ihr Gewicht zu reduzieren. Es ist in vielen LГ¤ndern erhГ¤ltlich, darunter auch in Deutschland. Wenn Sie daran interessiert sind, Reduslim zu kaufen, kГ¶nnen Sie es ganz einfach online bestellen. Geben Sie einfach den Suchbegriff “Reduslim comprar” in Ihre Suchmaschine ein und finden Sie verschiedene Optionen, um das Produkt zu erwerben. Vergewissern Sie sich, dass Sie das Produkt nur von vertrauenswГјrdigen Quellen kaufen, um sicherzustellen, dass Sie ein hochwertiges und authentisches Produkt erhalten. Reduslim kann eine effektive LГ¶sung sein, um Ihren Zielen beim Abnehmen nГ¤her zu kommen. Probieren Sie es noch heute aus und erleben Sie die Vorteile selbst!
https://reduslim.at/
Gogo Casino Bonus utan Insättning
Gogo Casino är ett populärt online casino som erbjuder spelare möjligheten att spela sina favoritspel utan att behöva göra en insättning. Med en Gogo Casino bonus utan insättning har du chansen att vinna riktiga pengar utan att riskera dina egna. Det är en perfekt möjlighet för alla spelare som vill testa lyckan utan att satsa sina egna pengar.
För att ta del av en Gogo Casino bonus utan insättning behöver du bara skapa ett konto på casinot och verifiera din identitet. När detta är klart kommer du att belönas med en generös bonus som du kan använda för att spela dina favoritspel. Du kan njuta av spännande slots, bordsspel och mycket annat utan att behöva göra någon insättning.
För att ta ut dina vinster från en Gogo Casino bonus utan insättning finns det vanligtvis vissa omsättningskrav som måste uppfyllas. Det betyder att du måste satsa en viss summa pengar innan du kan ta ut dina vinster. Det är viktigt att läsa igenom villkoren noggrant innan du tar del av bonusen så att du vet vad som krävs för att kunna ta ut dina vinster.
Gogo Casino bonus utan insättning är ett utmärkt sätt att utforska casinot och dess spel utan att behöva riskera dina egna pengar. Med chansen att vinna riktiga pengar kan du ha en rolig och spännande spelupplevelse utan att behöva lägga ut en enda krona. Så ta chansen och ta del av en Gogo Casino bonus utan insättning idag!
https://gogocasino.one
Zet Casino ist ein beliebtes Online-Casino, das seinen Spielern eine Vielzahl von spannenden Spielen und großzügigen Bonusangeboten bietet. Eines der besten Angebote, das neue Spieler bei Zet Casino erhalten können, sind 30 Freispiele ohne Einzahlung.
Diese Freispiele bieten Spielern die Möglichkeit, einige der besten Spielautomaten im Casino kostenlos zu spielen und dabei echtes Geld zu gewinnen. Die 30 Freispiele können in ausgewählten Spielautomaten verwendet werden und sind eine großartige Möglichkeit, das Casino und seine Spiele zu erkunden, ohne dabei eigenes Geld riskieren zu müssen.
Um die 30 Freispiele zu erhalten, müssen neue Spieler lediglich ein Konto bei Zet Casino registrieren. Nach der Registrierung werden die Freispiele automatisch gutgeschrieben und können sofort verwendet werden. Es gibt keine Einzahlung erforderlich, um diese Freispiele zu erhalten, was sie zu einem attraktiven Angebot für alle Spieler macht, die das Casino ausprobieren möchten.
Die Freispiele bei Zet Casino sind eine großartige Möglichkeit, um das Casino kennenzulernen und die verschiedenen Spiele auszuprobieren, ohne dabei eigenes Geld riskieren zu müssen. Spieler haben die Chance, echte Gewinne zu erzielen, während sie die spannenden Spielautomaten im Casino genießen.
Insgesamt sind die 30 Freispiele bei Zet Casino ein großzügiges Angebot für neue Spieler, das es ermöglicht, das Casino und seine Spiele auf unkomplizierte Weise zu erkunden. Mit einer Vielzahl von hochwertigen Spielen und attraktiven Bonusangeboten ist Zet Casino die ideale Wahl für alle, die nach einem unterhaltsamen und lohnenden Online-Casino-Erlebnis suchen.
https://zetcasino.one/
Gogo Casino Г¤r ett online casino som har blivit vГ¤ldigt populГ¤rt bland svenska spelare pГҐ senare tid. En av anledningarna till detta Г¤r deras generГ¶sa bonusar som de erbjuder till sina spelare. En av dessa bonusar Г¤r deras sГҐ kallade “bonus gogo casino”.
Denna bonus går ut på att spelare får en extra summa pengar att spela för när de gör en insättning. Denna summa brukar vara procentuell och kan variera beroende på vilken kampanj som pågår. Det kan handla om allt från 50% extra upp till 200% extra att spela för.
För att ta del av denna bonus behöver spelarna oftast ange en bonuskod när de gör sin insättning. Bonuskoden kan vanligtvis hittas på casinots hemsida eller skickas ut till spelarna via e-post eller sms.
Det finns dock vissa villkor som måste uppfyllas för att kunna ta del av bonusen. Oftast handlar det om att spelarna måste omsätta sina bonuspengar ett visst antal gånger innan de kan ta ut eventuella vinster. Det kan även finnas ett maxtak för hur mycket man kan vinna med hjälp av bonusen.
Sammanfattningsvis Г¤r “bonus gogo casino” en populГ¤r bonusform som erbjuds av Gogo Casino fГ¶r att belГ¶na sina spelare. Genom att ta del av denna bonus kan spelarna Г¶ka sina vinstchanser och fГҐ lite extra spГ¤nning i sina spel.
https://gogocasino.one
Wenn Sie sich fragen, dónde comprar Reduslim, sind Sie hier genau richtig. Reduslim ist ein beliebtes Nahrungsergänzungsmittel zur Gewichtsreduktion, das Ihnen helfen kann, schnell und effektiv abzunehmen. Es enthält natürliche Inhaltsstoffe wie grünen Tee, Garcinia Cambogia und L-Carnitin, die bekannt dafür sind, den Stoffwechsel zu steigern und den Appetit zu unterdrücken.
Sie können Reduslim ganz einfach online kaufen, entweder auf der offiziellen Website des Herstellers oder in ausgewählten Online-Shops. Achten Sie darauf, nur bei vertrauenswürdigen Händlern zu bestellen, um sicherzustellen, dass Sie ein authentisches Produkt erhalten.
Neben der Einnahme von Reduslim ist es wichtig, auch eine gesunde Ernährung und ausreichend Bewegung in Ihren Lebensstil zu integrieren, um die besten Ergebnisse zu erzielen. Mit Reduslim als Unterstützung können Sie Ihr Zielgewicht schneller erreichen und sich wieder wohler in Ihrer Haut fühlen. Also, worauf warten Sie noch? Bestellen Sie noch heute Ihr Reduslim und starten Sie Ihre Gewichtsreduktionsreise!
https://reduslim.at/
Gogo casino är en populär online spelplattform där spelare kan njuta av olika kasinospel och spännande vinster. Men ibland kan det uppstå problem när man försöker göra ett uttag från sitt spelkonto.
En vanlig oro bland spelare är att deras uttag kan försenas eller nekas av olika anledningar. Det kan bero på att spelaren inte har uppfyllt omsättningskraven för bonusar eller att det finns problem med den valda betalningsmetoden. Det är viktigt att läsa och förstå kasinots regler och villkor innan man begär ett uttag för att undvika eventuella missförstånd.
En annan möjlig orsak till problem med uttag på Gogo casino kan vara att spelaren inte har verifierat sitt konto korrekt. För att säkerställa att pengarna når rätt mottagare och att spelplattformen följer lagliga krav, kräver många onlinekasinos att spelare verifierar sin identitet och adress genom att skicka in nödvändiga dokument.
Om du stöter på problem med ett uttag från Gogo casino är det bäst att kontakta deras kundtjänst för att få hjälp och klarhet kring situationen. De kan hjälpa dig att identifiera och lösa eventuella problem som kan ha uppstått och säkerställa att du får dina vinstpengar så snart som möjligt.
Sammanfattningsvis är det viktigt att vara medveten om potentiella problem med uttag på onlinekasinos som Gogo casino och att vara noggrann med att följa deras regler och förfaranden för att undvika obehagliga överraskningar. Kommunikation med kundtjänsten och att vara proaktiv i att uppfylla deras krav kan hjälpa till att lösa eventuella uttagsproblem på ett effektivt sätt.
https://gogocasino.one
bluatblaaotuy
bluatblaaotuy
Gogo Casino är ett online casino som erbjuder en mängd olika spel och erbjudanden för sina spelare. För att säkerställa att spelarna har en så bra upplevelse som möjligt, har Gogo Casino en dedikerad kundtjänst som finns tillgänglig för att hjälpa till med alla frågor och problem som kan uppstå under spelandet.
Kundtjänsten på Gogo Casino är tillgänglig dygnet runt via livechatt, e-post eller telefon. De är välutbildade och kunniga om alla aspekter av casinot och kan svara på alla frågor som spelarna kan ha. Oavsett om det handlar om insättningar och uttag, bonusar och kampanjer eller tekniska problem, är kundtjänsten redo att hjälpa till på ett professionellt och vänligt sätt.
En av fördelarna med att spela på Gogo Casino är den snabba och effektiva supporten som erbjuds. Oavsett när på dygnet spelarna behöver hjälp, finns kundtjänsten där för att assistera. Det ger en extra trygghet för spelarna att veta att de alltid kan få hjälp om det behövs.
Sammanfattningsvis är kundtjänsten på Gogo Casino en öppen och tillgänglig resurs för alla spelare som har frågor eller problem under sitt spelande. Med sin professionella och vänliga attityd gör de allt för att se till att spelarna har en trevlig och problemfri spelupplevelse.
https://gogocasino.one
Tipico Casino Verarschen: Was steckt hinter den GerГјchten?
Das Tipico Casino ist einer der bekanntesten Online-Glücksspielanbieter in Deutschland. Mit einer Vielzahl von Spielen und attraktiven Bonusangeboten lockt das Casino täglich tausende Spieler an. Doch immer wieder tauchen Gerüchte auf, dass das Tipico Casino seine Kunden verarschen würde. Doch was steckt wirklich dahinter?
Zunächst einmal ist es wichtig zu betonen, dass das Tipico Casino über eine offizielle Lizenz verfügt und somit reguliert wird. Dies bedeutet, dass das Casino bestimmten Standards und Regeln folgen muss, um fair und sicher zu spielen. Zudem werden regelmäßig audits und Kontrollen durch unabhängige Behörden durchgeführt, um die Integrität des Casinos zu gewährleisten.
Ein weiterer Punkt, der oft kritisiert wird, ist die Auszahlungsquote des Tipico Casinos. Viele Spieler behaupten, dass die Gewinnchancen niedriger seien als in anderen Online-Casinos. Doch auch hier ist es wichtig zu wissen, dass die Auszahlungsquote von vielen Faktoren abhängt und nicht vom Casino selbst manipuliert werden kann. Zudem entspricht die Auszahlungsquote des Tipico Casinos den branchenüblichen Standards.
Natürlich kann es auch vorkommen, dass Spieler das Gefühl haben, vom Tipico Casino verarscht zu werden, wenn sie eine Pechsträhne haben und mehrere Spiele hintereinander verlieren. Doch auch dies gehört zum Glücksspiel dazu und ist kein Beweis für eine Manipulation durch das Casino.
Insgesamt lässt sich sagen, dass das Tipico Casino nicht grundlos eines der beliebtesten Online-Casinos in Deutschland ist. Wer sich an die Regeln hält, verantwortungsbewusst spielt und realistische Erwartungen hat, kann hier durchaus Spaß haben und erfolgreich sein. Bei konkreten Beschwerden oder Problemen steht zudem der Kundenservice des Casinos zur Verfügung, um Lösungen zu finden.
Fazit: Das Tipico Casino verarschen ist kein Thema, über das man sich ernsthaft Sorgen machen muss. Wer seinem Glück eine Chance geben möchte, kann hier bedenkenlos spielen und sich auf ein unterhaltsames Spielerlebnis freuen.
https://tipicocasino.one/
Zet Casino 30 Freispiele
Zet Casino ist eine der aufstrebenden Online-Casino-Plattformen, die Spielern eine groГџe Auswahl an Spielen und attraktiven Boni bietet. Einer der beliebtesten Boni, den Zet Casino seinen Spielern anbietet, sind die 30 Freispiele, die man bei der Anmeldung erhalten kann.
Diese Freispiele sind eine großartige Möglichkeit für Spieler, das Casino und die angebotenen Spiele kennenzulernen, ohne eigenes Geld einzahlen zu müssen. Mit den 30 Freispielen können Spieler die verschiedenen Spielautomaten ausprobieren und hoffentlich sogar einige Gewinne erzielen.
Um die 30 Freispiele zu erhalten, muss man sich einfach auf der Zet Casino-Website anmelden und ein Konto erstellen. Nach der Registrierung werden die Freispiele automatisch gutgeschrieben und können sofort genutzt werden.
Es ist wichtig zu beachten, dass die Freispiele bestimmten Umsatzbedingungen unterliegen, die erfГјllt werden mГјssen, bevor man etwaige Gewinne auszahlen lassen kann. Diese Bedingungen variieren je nach Casino und sollten daher vor der Nutzung der Freispiele ГјberprГјft werden.
Insgesamt sind die 30 Freispiele, die Zet Casino anbietet, eine großartige Möglichkeit für Spieler, das Casino auszuprobieren und möglicherweise sogar einige Gewinne zu erzielen, ohne eigenes Geld investieren zu müssen. Wer gerne Spielautomaten spielt, sollte diese Gelegenheit nicht verpassen und sich die Freispiele sichern. Viel Spaß und viel Glück beim Spielen!
https://zetcasino.one/
Gogo Casino är ett populärt onlinecasino som erbjuder en mängd olika spel för sina spelare. Men vem äger egentligen Gogo Casino?
Gogo Casino ägs av det maltesiska företaget Viral Interactive Limited. Företaget grundades år 2015 och har sedan dess varit verksamt inom spelbranschen. Viral Interactive Limited har en licens från Malta Gaming Authority, vilket innebär att de följer strikta regler och riktlinjer för att säkerställa en säker och rättvis spelupplevelse för sina spelare.
Utöver Gogo Casino äger Viral Interactive Limited även andra populära onlinecasinon, såsom Snabbare Casino och Turbico Casino. Företaget strävar efter att erbjuda en spännande och underhållande spelupplevelse för alla sina spelare och satsar på att vara en ledande aktör inom spelbranschen.
Genom att äga flera olika onlinecasinon kan Viral Interactive Limited erbjuda ett brett utbud av spel och funktioner för sina spelare. De strävar ständigt efter att förbättra och utveckla sina tjänster för att möta spelarnas önskemål och behov.
Sammanfattningsvis ägs Gogo Casino av Viral Interactive Limited, ett maltesiskt företag med en licens från Malta Gaming Authority. Företaget satsar på att erbjuda en säker och underhållande spelupplevelse för sina spelare och strävar efter att vara en ledande aktör inom spelbranschen.
https://gogocasino.one
Reduslim ist ein beliebtes Produkt zur Gewichtsreduktion. Doch was sagen Experten dazu? Die Reduslim recensioni mediche sind durchweg positiv. Ärzte und Ernährungsexperten bestätigen die Effektivität der Inhaltsstoffe bei der Fettverbrennung und Appetitzügelung. Die natürlichen Inhaltsstoffe sorgen dafür, dass der Stoffwechsel angeregt wird und überschüssige Pfunde schneller schmelzen. Zudem wird das Hungergefühl reduziert, was zu einer geringeren Kalorienaufnahme führt. Reduslim ist also nicht nur ein weiteres Abnehmprodukt, sondern eine echte Unterstützung auf dem Weg zum Wunschgewicht. Probieren Sie es aus und überzeugen Sie sich selbst von den positiven Ergebnissen!
https://reduslim.at/
wow, amazing
Casino Gogo är ett populärt online casino som erbjuder spelare en spännande och underhållande spelupplevelse. Med ett brett utbud av casinospel, generösa bonusar och en säker plattform är det här ett casino som lockar till sig många spelare.
En av de stora fГ¶rdelarna med Casino Gogo Г¤r det stora spelutbudet. HГ¤r hittar du allt frГҐn klassiska casinospel som roulette och blackjack till moderna videoslots med spГ¤nnande teman och specialfunktioner. Med spelleverantГ¶rer som NetEnt, Microgaming och Play’n GO kan du vara sГ¤ker pГҐ att du spelar pГҐ spel av hГ¶g kvalitet.
För att locka nya spelare erbjuder Casino Gogo generösa bonusar och kampanjer. Nya spelare kan ta del av en välkomstbonus som ger extra pengar att spela för, samt free spins på utvalda spel. Dessutom finns det regelbundet kampanjer och turneringar där spelare kan vinna fina priser och bonusar.
När det kommer till säkerhet och trygghet är Casino Gogo ett pålitligt val. De använder sig av den senaste krypteringstekniken för att säkerställa att dina personuppgifter och transaktioner är skyddade. Dessutom är casinot licensierat av en respektabel spelmyndighet, vilket innebär att de följer strikta regler och krav för att garantera en rättvis och säker spelupplevelse för alla spelare.
Sammanfattningsvis är Casino Gogo ett bra val för dig som söker en spännande och pålitlig spelupplevelse online. Med sitt stora spelutbud, generösa bonusar och säkra plattform kan du vara säker på att du kommer ha en rolig tid när du spelar här. Så gå med idag och testa lyckan på Casino Gogo!
https://gogocasino.one
Фильмок тв предоставляет для вас лучшие фильмы. Вы можете в любое время смотреть их онлайн совершенно бесплатно. На странице каждого фильма расписано абсолютно все, а именно: год, страна, жанр, режиссер, актерский состав. Это дает возможность принять правильное решение о выборе кинокартины. https://filmok.tv – сайт, где есть удобный поиск, примените его. Сериалы и фильмы ждут вас. Мы гарантируем вам отличную картинку и звук. Заходите уже сейчас на наш сайт, смотрите интересующий фильм и получайте удовольствие!
Gogo casino är en populär online-spelplattform som erbjuder ett brett utbud av casinospel för sina spelare. Men vem är egentligen ägaren till detta framgångsrika casino?
Ägaren till Gogo casino är det maltesiska företaget Fair Play Bets Limited. Bolaget grundades år 2010 och är licensierat av Malta Gaming Authority, vilket innebär att det uppfyller alla krav och regler som satts upp för att bedriva en säker och rättvis spelverksamhet.
Fair Play Bets Limited har en lång erfarenhet inom spelbranschen och är kända för att erbjuda högkvalitativa spelprodukter till sina kunder. De är även engagerade i ansvarsfullt spelande och arbetar aktivt för att främja en säker spelmiljö för alla sina användare.
Genom sitt ägande av Gogo casino har Fair Play Bets Limited skapat en plattform där spelarna kan njuta av en spännande spelupplevelse samtidigt som de kan lita på att deras personliga och finansiella uppgifter är i säkra händer. Med ett stort utbud av casinospel, generösa bonusar och en användarvänlig plattform har Gogo casino blivit en favorit bland spelare över hela världen.
Även om ägaren till Gogo casino kanske inte är så välkänd bland allmänheten, så är det tydligt att de har en gedigen erfarenhet inom spelbranschen och strävar efter att erbjuda en högkvalitativ spelupplevelse för sina kunder. Med sitt fokus på ansvarsfullt spelande och säkerhet har de skapat en trygg och underhållande plattform för alla som älskar att spela casinospel online.
https://gogocasino.one
Tipico ist eines der beliebtesten Online-Casinos in Deutschland. Spieler können eine Vielzahl von Casino-Spielen genießen und tolle Gewinne erzielen. Es kann jedoch vorkommen, dass es zu Problemen beim Spielen kommt oder Spieler unzufrieden sind mit ihrem Erlebnis im Online-Casino. In solchen Fällen bietet Tipico eine Geld-zurück-Garantie an, um die Zufriedenheit der Spieler sicherzustellen.
Die Geld-zurück-Garantie bei Tipico ist eine großartige Möglichkeit für Spieler, ihr Geld zurückzuerhalten, wenn sie unzufrieden sind mit dem Service oder den Spielen im Casino. Spieler können einen Antrag auf Rückerstattung stellen und erhalten ihr Geld innerhalb weniger Tage auf ihr Konto zurück.
Um eine Rückerstattung zu beantragen, müssen Spieler einfach den Kundenservice von Tipico kontaktieren und ihr Anliegen erklären. Der Kundenservice wird dann den Fall überprüfen und entscheiden, ob eine Rückerstattung möglich ist. In den meisten Fällen sind die Mitarbeiter von Tipico sehr kulant und bemüht, die Zufriedenheit der Spieler sicherzustellen.
Die Geld-zurück-Garantie von Tipico ist ein großer Vorteil für Spieler, die sich nicht sicher sind, ob sie im Casino spielen möchten. Mit dieser Garantie können sie beruhigt spielen und wissen, dass sie im Falle von Problemen ihr Geld zurückerhalten können.
Insgesamt ist die Geld-zurück-Garantie von Tipico eine großartige Möglichkeit für Spieler, sich vor Verlusten zu schützen und sicherzustellen, dass ihr Spielerlebnis im Online-Casino angenehm und fair ist. Wir empfehlen allen Spielern, diese Garantie in Anspruch zu nehmen, um ihr Spielerlebnis bei Tipico zu optimieren.
https://tipicocasino.one/
Bonus Gogo Casino är ett populärt online casino som erbjuder generösa bonusar till sina spelare. Denna bonus är ett sätt för casinot att belöna sina spelare och locka nya kunder till sin plattform. Genom att erbjuda bonusar kan spelare få extra pengar att spela för och därmed öka sina vinstchanser.
En av de mest populära bonusarna på Gogo Casino är välkomstbonusen. Denna bonus ges vanligtvis till nya spelare som registrerar sig på casinot och gör en första insättning. Genom att utnyttja välkomstbonusen kan spelare få en extra summa pengar att spela för och därmed öka sina vinstchanser.
Utöver välkomstbonusen erbjuder Gogo Casino även andra bonusar till sina spelare. Det kan vara allt från insättningsbonusar till free spins och tävlingar där spelarna kan vinna fina priser. Genom att utnyttja dessa bonusar kan spelare få en ännu bättre spelupplevelse och öka sina chanser att vinna stort.
För att ta del av bonusarna på Gogo Casino är det viktigt att läsa och förstå villkoren och reglerna som gäller. Ofta finns det omsättningskrav som spelarna måste uppfylla innan de kan ta ut bonuspengarna. Genom att läsa villkoren kan spelarna undvika missförstånd och maximera sina vinstchanser.
Sammanfattningsvis är bonusar på Gogo Casino ett utmärkt sätt för spelare att öka sina vinstchanser och få en ännu bättre spelupplevelse. Genom att utnyttja bonusarna kan spelare få extra pengar att spela för och därmed öka sina chanser att vinna stort. Så varför inte prova lyckan på Gogo Casino idag och ta del av deras generösa bonusar? Lycka till!
https://gogocasino.one
Reduslim foro femenino ist ein neues Produkt auf dem Markt, das Frauen hilft, ihre Gewichtsabnahmeziele zu erreichen. Es handelt sich um eine natürliche Ergänzung, die bei der Fettverbrennung unterstützt und den Stoffwechsel anregt. Viele Frauen haben bereits positive Erfahrungen mit Reduslim foro femenino gemacht und schwärmen von den Ergebnissen.
Dank seiner natürlichen Inhaltsstoffe ist Reduslim foro femenino eine sichere und effektive Lösung für Frauen, die ohne Nebenwirkungen abnehmen möchten. Es hilft dabei, den Hunger zu kontrollieren und den Körper dabei zu unterstützen, überschüssiges Fett zu verbrennen. Dies führt zu einem schnellen und langanhaltenden Gewichtsverlust.
Die positive Resonanz von Frauen, die Reduslim foro femenino ausprobiert haben, spricht für sich. Viele berichten von einem gesteigerten Selbstvertrauen, mehr Energie und einem insgesamt gesünderen Lebensstil. Wenn auch du auf der Suche nach einer natürlichen und effektiven Möglichkeit bist, Gewicht zu verlieren, könnte Reduslim foro femenino die Lösung für dich sein. Probier es aus und überzeuge dich selbst von den Ergebnissen!
https://reduslim.at/
Gogo Casino är en populär spelsajt som erbjuder en mängd olika spelmöjligheter för sina användare. LeoVegas är ett av de största och mest kända onlinecasinona i Sverige. Tyvärr har det kommit uppgifter om att LeoVegas inte betalar ut vinster till spelare som vunnit på Gogo Casino.
Det är viktigt att poängtera att detta inte gäller alla användare eller alla spelare på Gogo Casino. De flesta spelare som vinner på Gogo Casino får sina vinster utbetalade utan problem. Men det finns tyvärr en del spelare som har haft svårigheter med att få sina vinster från LeoVegas.
Detta är naturligtvis mycket frustrerande för de spelare som har förlorat pengar och inte får tillbaka sina vinster. Det är viktigt att alla spelare är medvetna om risken för att detta kan hända och att man alltid bör vara försiktig när man spelar på onlinecasinon.
Det är oklart varför vissa spelare inte får sina vinster från LeoVegas, men det kan bero på olika faktorer såsom tekniska problem, felaktig information eller bedrägeri. Om du är en av de spelare som inte har fått dina vinster från LeoVegas rekommenderas att du kontaktar deras kundtjänst för att försöka lösa problemet.
Sammanfattningsvis är det viktigt att vara försiktig när man spelar på onlinecasinon och att man alltid läser villkoren noga innan man börjar spela. LeoVegas är ett välrenommerat företag och förhoppningsvis kommer de att kunna lösa problemet med de spelare som inte har fått sina vinster från Gogo Casino.
https://gogocasino.one
wow, amazing
Gogo Casino – flashback
Gogo Casino är ett populärt online casino som erbjuder spelare en spännande spelupplevelse i en modern och användarvänlig miljö. Med ett stort utbud av casinospel från välkända leverantörer som NetEnt, Microgaming och Play’n GO, finns det något för alla smaker på Gogo Casino.
En av de största fördelarna med Gogo Casino är deras generösa bonusar och kampanjer som erbjuds till både nya och befintliga spelare. Nya spelare välkomnas vanligtvis med en insättningsbonus eller gratissnurr, vilket ger dem en bra start på sin casinoupplevelse. Dessutom kan spelare dra nytta av regelbundna kampanjer och tävlingar för att maximera sina vinstchanser.
En annan fördel med Gogo Casino är deras smidiga uttagsprocess. Spelare kan enkelt göra uttag via olika betalningsmetoder, inklusive banköverföring och e-plånböcker. Dessutom är kundtjänsten tillgänglig dygnet runt för att hjälpa spelare med eventuella frågor eller problem.
Sammanfattningsvis erbjuder Gogo Casino en all-around bra spelupplevelse för alla som är intresserade av online casino spel. Med sitt stora utbud av spel, generösa bonusar och pålitlig kundtjänst är det inte konstigt att Gogo Casino har blivit så populärt bland svenska spelare. Så om du letar efter ett pålitligt och roligt online casino, är Gogo Casino definitivt ett bra val.
https://gogocasino.one
Российский изготовитель реализует оборудование для фитнеса oborudovanie-dlya-fitnesa.ru по доступным ценам, без добавочных накруток. Всегда в продажебольшой ассортимент для любых покупателей. Продаем доступные тренажеры и аксессуары, которые помогут вам улучшить ваше здоровье и физическую форму.
В производстве мягких участков используется эластичный кожзам. Массивные части конструкции производятся из легированных видов стали. Функциональные продукты позволяют эффективно заниматься фитнесом как в домашних условиях, так и тренировочном зале. Выпускаемое оборудование отличается достойным качеством и надежностью, что позволяет вам тренироваться безопасно и эффективно. Для домашних занятий прекрасно подойдут бодибары, слэмбэги, резиновые петли, короткие штанги, кольца для пилатеса, массажеры, хула-хупы, коврики для йоги, утяжелители.
Gogo Casino har förändrat spelmarknaden genom att erbjuda transparenta och ärliga spelupplevelser till spelare. Genom att ha en öppen och transparent policy har de skapat ett förtroende hos sina kunder och blivit en ledande aktör på marknaden.
Genom att erbjuda en transparent spelupplevelse kan spelare känna sig trygga med att deras pengar är i säkert förvar och att spelen är rättvisa och slumpmässiga. Gogo Casino har en tydlig och lättförståelig användarvillkor som beskriver alla regler och villkor som gäller för spel på deras plattform.
Genom att vara transparent visar Gogo Casino att de tar ansvar för sina kunder och deras spelupplevelse. De erbjuder också ett stort utbud av spel från de bästa leverantörerna på marknaden, vilket ger spelarna en varierad och underhållande spelupplevelse.
Genom att välja Gogo Casino kan spelare känna sig trygga och säkra i sitt spelande och njuta av en transparent och ärlig spelupplevelse. Med sin professionella och pålitliga service har Gogo Casino blivit en favorit bland många spelare och fortsätter att växa och utvecklas på marknaden.
https://gogocasino.one
Переподготовка на учителя начальных классов через платформу maps-edu.ru обеспечивает углубленное изучение методик и подходов, необходимых для эффективного обучения и развития младших школьников. Эта программа поможет вам освоить современные образовательные технологии и практики, а также обновить и расширить свои знания в области педагогики и психологии, что является ключом к успешной работе с детьми начальной школы.
Обновите свои знания: курсы повышения квалификации для педагогов и [url=https://maps-edu.ru/catalog/pedagogika?type=professionalnaya-perepodgotovka]переподготовка на педагога[/url] .
Курсы повышения квалификации для логопедов в дистанционном формате предоставляют возможность специалистам углубить и расширить свои знания и практические навыки в области логопедии, не отходя от своего рабочего места или дома. Эти программы охватывают современные методы диагностики, коррекции и обучения лиц с нарушениями речи, позволяя логопедам эффективно работать с различными категориями пациентов.
Улучшите свою карьеру: [url=https://maps-edu.ru/nabor-ballov-nmo]нмо баллы купить[/url] и курсы логопедии доступны у нас!
Boomerang Online Casino: Eine spannende neue GlГјcksspielplattform
Das Boomerang Online Casino ist die neueste Ergänzung in der Welt der virtuellen Glücksspielunterhaltung. Mit einem frischen und modernen Design sowie einer Vielzahl von spannenden Spieloptionen verspricht dieses Casino ein unvergessliches Spielerlebnis für alle, die ihr Glück versuchen möchten.
Eine der Hauptattraktionen des Boomerang Online Casinos ist die große Auswahl an Spielen, die es den Spielern zur Verfügung stellt. Von klassischen Tischspielen wie Blackjack und Roulette bis hin zu beliebten Spielautomaten und Live-Dealer-Spielen gibt es für jeden Geschmack etwas zu entdecken. Darüber hinaus werden regelmäßig neue Spiele hinzugefügt, um sicherzustellen, dass es immer frische und aufregende Optionen gibt, aus denen die Spieler wählen können.
Ein weiterer großer Vorteil des Boomerang Online Casinos ist die benutzerfreundliche Plattform, die es den Spielern leicht macht, sich zu registrieren, Einzahlungen zu tätigen und ihre Lieblingsspiele zu spielen. Mit einer Vielzahl von sicheren und schnellen Zahlungsmethoden sowie einem engagierten Kundensupport-Team stehen den Spielern alle Ressourcen zur Verfügung, die sie benötigen, um ihr Spielerlebnis so reibungslos wie möglich zu gestalten.
Darüber hinaus bietet das Boomerang Online Casino großzügige Boni und Aktionen für neue und bestehende Spieler an, um sicherzustellen, dass diese stets mit zusätzlichen Anreizen belohnt werden. Von Willkommensboni über Freispiele bis hin zu Cashback-Angeboten gibt es zahlreiche Möglichkeiten, um das Beste aus dem Spielerlebnis herauszuholen und gleichzeitig tolle Preise zu gewinnen.
Insgesamt ist das Boomerang Online Casino eine aufregende neue Glücksspielplattform, die sowohl erfahrene Spieler als auch Neulinge anspricht. Mit einer Vielzahl von Spielen, benutzerfreundlicher Gameplay und großzügigen Boni verspricht dieses Casino stundenlange Unterhaltung und die Möglichkeit, echte Gewinne zu erzielen. Wer also auf der Suche nach einem neuen und aufregenden Glücksspielerlebnis ist, sollte definitiv das Boomerang Online Casino ausprobieren.
https://boomerangcasino.one/
Gogo Casino är en populär online casino som erbjuder ett brett utbud av spel och en spännande spelupplevelse för sina användare. För att säkerställa att alla spelare har en smidig och positiv upplevelse, erbjuder Gogo Casino också en professionell och pålitlig kundsupport.
Kundsupporten på Gogo Casino är tillgänglig dygnet runt och kan nås genom live chatt, e-post eller telefon. Oavsett vilken fråga eller bekymmer du kan ha, finns det alltid en supportagent tillgänglig för att hjälpa dig.
Till skillnad från många andra online casinon, erbjuder Gogo Casino även support på svenska. Detta är bra nyheter för svenska spelare som föredrar att få support på sitt modersmål.
Gogo Casino kundsupport är känd för att vara snabb, effektiv och vänlig. Supportagenterna är välutbildade och kunniga om alla aspekter av casinots verksamhet, vilket gör det enkelt för dem att svara på alla frågor eller lösa alla problem som kan uppstå.
Sammanfattningsvis är Gogo Casino kundsupport en av de bästa i branschen. Oavsett om du har en fråga om ett spel, ett problem med en insättning eller bara behöver hjälp att komma igång, kan du lita på att supportteamet på Gogo Casino kommer att vara där för att hjälpa dig på bästa möjliga sätt.
https://gogocasino.one
Die Wahrheit über Reduslim ist, dass es sich um ein beliebtes Produkt handelt, das bei der Gewichtsabnahme helfen soll. Viele Menschen schwören auf die Wirkung dieser Pillen und berichten von beeindruckenden Erfolgen. Doch was steckt wirklich hinter Reduslim?
Ein genauerer Blick auf die Inhaltsstoffe zeigt, dass Reduslim hauptsächlich aus natürlichen Zutaten wie grünem Kaffee, Garcinia Cambogia und Ingwer besteht. Diese sollen den Stoffwechsel ankurbeln und das Hungergefühl reduzieren, was zu einer schnelleren Gewichtsabnahme führen kann.
Doch wie bei allen Nahrungsergänzungsmitteln gibt es auch bei Reduslim einige Kritiker, die bezweifeln, ob die versprochenen Effekte tatsächlich eintreten. Einige Studien deuten darauf hin, dass die Wirkung von Reduslim nicht so stark ist, wie es die Hersteller behaupten.
Letztendlich liegt die Wahrheit über Reduslim wahrscheinlich irgendwo in der Mitte. Für einige kann es eine effektive Ergänzung zur Gewichtsabnahme sein, während es für andere möglicherweise nicht die gewünschten Ergebnisse liefert. Es ist wichtig, sich vor der Einnahme gut zu informieren und gegebenenfalls Rücksprache mit einem Arzt zu halten.
https://reduslim.at/
Gogo casino är en populär online spelplattform som har vunnit förtroende från spelare över hela världen på grund av sin transparenta och rättvisa spelpolicy. Genom att erbjuda en säker och pålitlig spelupplevelse har Gogo casino gjort sig kända som en pålitlig aktör inom branschen.
En av de viktigaste faktorerna för spelare när de väljer ett online casino är transparens. Det är viktigt att veta att spelen är rättvisa och att ens insatta pengar hanteras på ett pålitligt sätt. Gogo casino har tagit detta på stort allvar och har därför implementerat strikta åtgärder för att säkerställa en transparent spelupplevelse för sina användare.
Genom att använda sig av avancerad krypteringsteknik kan Gogo casino garantera att alla transaktioner är säkra och skyddade mot bedrägeri. Dessutom genomgår alla spel regelbundet oberoende revisioner för att säkerställa att de är rättvisa och slumpmässiga.
På Gogo casino kan spelarna också förvänta sig att få fullständig och öppen information om spelregler, utbetalningsprocent och hela spelsystemet. Detta skapar en känsla av förtroende och säkerhet bland spelarna, vilket är avgörande för att skapa en långsiktig relation mellan casinot och sina användare.
Sammanfattningsvis kan man säga att Gogo casino är ett utmärkt val för spelare som prioriterar transparens och rättvisa i sitt spelande. Genom att erbjuda en säker och pålitlig spelupplevelse har Gogo casino etablerat sig som en av de ledande aktörerna inom branschen. Med deras tydliga fokus på transparent spel är det lätt att förstå varför så många spelare föredrar Gogo casino framför andra alternativ.
https://gogocasino.one
Zet Casino Erfahrungen: Alles, was Sie wissen mГјssen
Es ist keine leichte Aufgabe, das perfekte Online-Casino zu finden, das all Ihre Anforderungen erfüllt. Aber wenn Sie auf der Suche nach einem unterhaltsamen und sicheren Ort sind, um Ihre Lieblingsspiele zu spielen, dann könnte Zet Casino die richtige Wahl für Sie sein.
Zet Casino ist ein relativ neues Online-Casino, das 2018 gegründet wurde. Trotz seiner jungen Geschichte hat es sich bereits einen soliden Ruf in der Glücksspielbranche erarbeitet. Das Casino wird von Araxio Development N.V. betrieben und verfügt über eine Lizenz der Regierung von Curaçao.
Eine der ersten Dinge, die die Spieler an Zet Casino bemerken, ist die benutzerfreundliche Website und die groГџe Auswahl an Spielen. Mit Titeln von erstklassigen Anbietern wie NetEnt, Microgaming, Play’n GO und vielen anderen, gibt es hier fГјr jeden Geschmack etwas zu entdecken. Von Spielautomaten Гјber Tischspiele bis hin zu Live-Casino-Spielen bietet Zet Casino ein beeindruckendes Portfolio an SpielmГ¶glichkeiten.
Ein weiterer großer Pluspunkt von Zet Casino sind die großzügigen Bonusangebote und Aktionen. Neue Spieler können sich über einen Willkommensbonus freuen, der Ihnen zusätzliches Geld und Freispiele für Ihre ersten Einzahlungen bietet. Darüber hinaus bietet das Casino regelmäßige Promotionen, Turniere und Treueprogramme, die es lohnenswert machen, regelmäßig zurückzukehren.
In Bezug auf die Sicherheit und den Kundenservice stehen die Erfahrungen der Spieler bei Zet Casino auch im Vordergrund. Die Website wird mit modernster SSL-Verschlüsselungstechnologie gesichert, um die Sicherheit Ihrer persönlichen Daten und finanziellen Transaktionen zu gewährleisten. Das Supportteam des Casinos ist rund um die Uhr per Live-Chat, E-Mail und Telefon erreichbar und steht Ihnen bei Fragen oder Problemen gerne zur Verfügung.
Insgesamt kann man sagen, dass die Erfahrungen mit Zet Casino größtenteils positiv ausfallen. Mit einer umfangreichen Spielauswahl, großzügigen Boni und einem zuverlässigen Kundenservice bietet das Casino eine unterhaltsame und sichere Spielerfahrung für alle Glücksspielfans. Wenn Sie also auf der Suche nach einem neuen Online-Casino sind, das all Ihre Wünsche erfüllen kann, dann sollten Sie Zet Casino auf jeden Fall eine Chance geben.
https://zetcasino.one/
Российский завод реализует спортивные тренажеры https://sportivnyj-trenazher.ru/ для усиленной работы в коммерческих условиях. В интернет-магазине вы обнаружите самые популярные варианты станков – грузоблочных и на свободных весах. Обширный ассортимент позволяет подобрать станки для акцентированной прокачки теоретически любых мышечных групп. Рассмотрите Кроссовер с двумя грузоблоками, Баттерфляй для грудных и дельтовидных мышц, машину Смита, вертикальную тягу, парту Скотта, тренажер для плечей, станок Гаккеншмидта, конструкции для работы с собственным весом, Гравитрон для подтягиваний, гиперэкстензию, атлетические скамьи, универсальную лавку, рычажные Хаммеры. Изготавливаемое оборудование не требует регулярного специального обслуживания. Можете выбрать нагружаемый стек с плитками подходящего веса.
Tipico Casino Bonus Treue10
Das Tipico Casino bietet seinen treuen Kunden einen besonderen Bonus an – den Treue10 Bonus. Dieser Bonus belohnt Spieler, die regelmäßig im Casino spielen und dem Anbieter treu bleiben. Doch was genau verbirgt sich hinter diesem Bonus und wie können Spieler davon profitieren?
Der Treue10 Bonus ist ein exklusives Angebot für loyalen Spieler im Tipico Casino. Um diesen Bonus zu erhalten, müssen Spieler zunächst Mitglied im Treueprogramm des Casinos sein. Dies ist jedoch ganz einfach – Spieler können sich einfach anmelden und sofort von den Vorteilen des Treueprogramms profitieren.
Sobald Spieler Mitglied im Treueprogramm sind, können sie sich für den Treue10 Bonus qualifizieren. Dieser Bonus wird den Spielern in Form von zusätzlichem Guthaben oder Freispielen gutgeschrieben. Spieler können dieses Bonusguthaben verwenden, um ihre Lieblingsspiele im Casino zu spielen und so ihre Gewinnchancen zu erhöhen.
Der Treue10 Bonus ist eine tolle Möglichkeit für Spieler, noch mehr aus ihrem Spielerlebnis im Tipico Casino herauszuholen. Durch regelmäßiges Spielen und Treue zum Anbieter können Spieler sich zusätzliches Guthaben sichern und damit ihre Gewinnchancen steigern.
Wenn auch Sie von den exklusiven Vorteilen des Treue10 Bonus profitieren möchten, sollten Sie sich noch heute im Tipico Casino anmelden und Mitglied im Treueprogramm werden. Mit etwas Glück und Geschick können auch Sie sich den begehrten Treue10 Bonus sichern und so noch mehr Spaß beim Spielen im Casino haben.
https://tipicocasino.one/
Zet Casino No Deposit Bonus Codes
Zet Casino ist ein beliebtes Online-Casino, das eine Vielzahl von Spielen und groГџzГјgigen Boni anbietet. Einer der begehrtesten Boni im Zet Casino sind die sogenannten “No Deposit Bonus Codes”. Diese Codes ermГ¶glichen es Spielern, kostenlose Bonusse zu erhalten, ohne dass eine Einzahlung erforderlich ist.
Um einen No Deposit Bonus Code im Zet Casino zu erhalten, mГјssen Spieler einfach den Code im entsprechenden Feld eingeben, bevor sie mit dem Spielen beginnen. Sobald der Code eingegeben ist, wird der Bonus automatisch auf das Spielerkonto gutgeschrieben.
Die No Deposit Bonus Codes im Zet Casino können verschiedene Formen annehmen, darunter kostenlose Spins für Spielautomaten, Bonusguthaben für Tischspiele oder Freispiele für bestimmte Slots. Diese Boni sind eine großartige Möglichkeit, das Casino kennenzulernen und erste Gewinne zu erzielen, ohne eigenes Geld riskieren zu müssen.
Es ist jedoch wichtig zu beachten, dass No Deposit Boni im Zet Casino bestimmten Bedingungen unterliegen. Spieler müssen häufig den Bonusbetrag mehrmals umsetzen, bevor sie etwaige Gewinne auszahlen lassen können. Es ist daher ratsam, die Bonusbedingungen sorgfältig zu lesen, bevor man einen No Deposit Bonus Code im Zet Casino aktiviert.
Alles in allem sind No Deposit Bonus Codes im Zet Casino eine hervorragende Möglichkeit, das Spielerlebnis zu verbessern und zusätzliche Gewinnchancen zu erhalten. Wir empfehlen allen Spielern, diese Bonusangebote zu nutzen und die aufregende Welt des Zet Casinos zu entdecken. Viel Glück und viel Spaß beim Spielen!
https://zetcasino.one/
bliblibli
Das Tipico Casino bietet seinen Spielern die Möglichkeit, ihr Spielerkonto mit Geld aufzuladen, um verschiedene Spiele zu spielen und attraktive Gewinne zu erzielen. Geld einzahlen im Tipico Casino ist ganz einfach und sicher.
Um Geld auf sein Spielerkonto einzuzahlen, kann man verschiedene Zahlungsmethoden nutzen. Dazu gehören unter anderem Kreditkarten wie Visa und Mastercard, Banküberweisungen, e-Wallets wie PayPal, Skrill und Neteller, sowie Prepaid-Karten wie die Paysafecard. Die Einzahlungsmethoden sind je nach Land, in dem man sich befindet, unterschiedlich. Es gibt auch die Möglichkeit, die Tipico Pay App zu nutzen, um schnell und einfach Geld einzuzahlen.
Um Geld auf sein Spielerkonto einzuzahlen, muss man sich zunächst auf der Tipico Casino-Website oder in der App anmelden. Dort findet man den Bereich für Ein- und Auszahlungen. Dort wählt man die gewünschte Zahlungsmethode aus, gibt den Betrag ein, den man einzahlen möchte, und folgt den Anweisungen auf dem Bildschirm. Die Einzahlung wird in der Regel sofort auf dem Spielerkonto gutgeschrieben, sodass man sofort mit dem Spielen beginnen kann.
Es ist wichtig zu beachten, dass man bei der Einzahlung im Tipico Casino auch Bonusangebote in Anspruch nehmen kann. Oftmals gibt es attraktive Willkommensboni, Boni für Bestandskunden oder Aktionen, bei denen man zusätzliches Guthaben erhalten kann. Es lohnt sich daher, regelmäßig nach aktuellen Bonusangeboten Ausschau zu halten.
Alles in allem bietet das Tipico Casino eine sichere und bequeme Möglichkeit, Geld auf sein Spielerkonto einzuzahlen. Mit den verschiedenen Einzahlungsmethoden und attraktiven Bonusangeboten kann man sein Spielerlebnis im Casino noch spannender und lukrativer gestalten. Also nichts wie ran an die Spiele und möge das Glück auf deiner Seite sein. Viel Spaß und Erfolg im Tipico Casino!
https://tipicocasino.one/
Today, while I was at work, my sister stole my iPad and
tested to see if it can survive a 30 foot drop, just so she can be a youtube sensation. My
apple ipad is now broken and she has 83 views. I know this is
completely off topic but I had to share it with someone!
Here is my website … situs slot togel
https://slitmastershop.ru/kley/uvkley/
Zet Casino ist eine Online-GlГјcksspielplattform, die Spielern eine Vielzahl von Spielen und Funktionen bietet. In diesem Artikel werden wir Zet Casino Recensioni genauer betrachten.
Zet Casino bietet seinen Spielern eine breite Palette von Spielen, darunter Spielautomaten, Tischspiele, Live-Dealer-Spiele und mehr. Die Plattform arbeitet mit bekannten Softwareanbietern wie NetEnt, Microgaming, Play’n Go und vielen anderen zusammen, um ein qualitativ hochwertiges Spielerlebnis zu gewГ¤hrleisten.
Eines der herausragendsten Merkmale von Zet Casino sind die großzügigen Boni und Aktionen, die regelmäßig angeboten werden. Neue Spieler können sich über einen Willkommensbonus freuen, der zusätzliches Guthaben und Freispiele bietet. Darüber hinaus gibt es auch wöchentliche und monatliche Aktionen, bei denen Spieler weitere Boni und Belohnungen erhalten können.
Die Zahlungsmöglichkeiten bei Zet Casino sind vielfältig und sicher. Spieler können aus einer Vielzahl von Ein- und Auszahlungsmethoden wählen, darunter Kreditkarten, E-Wallets und Banküberweisungen. Alle Transaktionen werden verschlüsselt und die persönlichen Daten der Spieler sind jederzeit geschützt.
Der Kundensupport bei Zet Casino ist rund um die Uhr verfГјgbar und bietet Spielern Hilfe bei Fragen oder Problemen. Das Team ist freundlich und hilfsbereit und steht per E-Mail, Live-Chat und Telefon zur VerfГјgung.
Insgesamt ist Zet Casino eine zuverlässige und unterhaltsame Glücksspielplattform, die Spielern eine Vielzahl von Spielen, großzügigen Boni und einem hervorragenden Kundensupport bietet. Wenn Sie auf der Suche nach einem neuen Online-Casino sind, sollten Sie Zet Casino definitiv in Betracht ziehen.
https://zetcasino.one/
blublabla
bluatblaaotuy
Wenn es um Online-Casinos geht, ist Tipico eine der bekanntesten Marken in Deutschland. Mit seinem breiten Angebot an Spielen, darunter auch ein Live-Casino, zieht Tipico viele Spieler an, die auf der Suche nach Unterhaltung und Gewinnen sind. Um das Spielerlebnis noch spannender zu gestalten, bietet Tipico auch regelmäßig Bonusaktionen an, darunter auch den Tipico Live Casino Bonus Code.
Der Live Casino Bonus Code ist eine besondere Aktion von Tipico, bei der Spieler einen zusätzlichen Bonus erhalten, wenn sie im Live-Casino spielen. Dieser Bonus kann in Form von Bargeld, Freispielen oder anderen Vergünstigungen ausgezahlt werden. Um diesen Bonus zu erhalten, müssen Spieler den speziellen Bonuscode eingeben, der zuvor auf der Tipico-Website veröffentlicht wurde.
Der Live Casino Bonus Code ist eine großartige Möglichkeit, zusätzliches Geld zum Spielen zu erhalten und die Gewinnchancen zu erhöhen. Darüber hinaus bietet Tipico auch regelmäßig andere Aktionen an, wie z.B. Freispiele, Cashback-Angebote und Turniere, um die Spieler zu belohnen und das Spielerlebnis zu verbessern.
Um den Live Casino Bonus Code zu nutzen, sollten Spieler regelmäßig die Tipico-Website besuchen und nach aktuellen Aktionen Ausschau halten. Es lohnt sich auch, den Newsletter von Tipico zu abonnieren, um über die neuesten Bonusangebote informiert zu werden. Mit dem Live Casino Bonus Code können Spieler ihr Glück im Live-Casino von Tipico versuchen und dabei von zusätzlichen Belohnungen profitieren.
Insgesamt bietet der Tipico Live Casino Bonus Code eine großartige Möglichkeit, das Spielerlebnis zu verbessern und die Gewinnchancen zu erhöhen. Spieler sollten diese Aktion nutzen und das Beste aus ihrem Online-Casino-Erlebnis herausholen.
https://tipicocasino.one/
Юрист по гражданскому праву – специалист, основной деятельностью
которого является предоставление правовой помощи физическим и юридическим
лицам в вопросах, регулируемых гражданским законодательством.
Этот профессионал занимается широким спектром задач: консультирует клиентов, готовит
юридические документы, представляет
интересы в суде и других инстанциях.
Основой его работы являются глубокие знания законов
и практики их применения в сферах, таких как право собственности, наследственные
вопросы, договорное право, обязательственное право,
семейное право и другие.
Юрист по гражданскому праву может как заниматься мирным урегулированием споров, так и формировать исковую стратегию,
если дело доходит до суда.
Квалифицированный юрист по гражданскому праву помогает
защитить права и законные интересы своих клиентов, а также сократить риски, связанные с
заключением сделок. Опытный специалист
сможет подобрать индивидуальный подход к каждому случаю, что существенно повышает шансы на
благоприятный исход дела.
Важность работы юриста по гражданскому праву сложно переоценить, поскольку грамотное
правовое сопровождение воздействует
на жизнь и благосостояние людей, участвующих в гражданско-правовых отношениях.
Feel free to visit my web-site :: юрист по гражданским делам
Курсы для учителей на сайте maps-edu.ru предоставляют широкий спектр программ повышения квалификации и переподготовки, направленных на профессиональное развитие педагогов. Эти курсы позволяют учителям осваивать новые методики обучения, инновационные образовательные технологии и подходы к ведению учебного процесса. Обучение помогает не только обновить знания в выбранной области, но и расширить компетенции, что способствует повышению эффективности обучения и развития учащихся, а также укреплению профессионального статуса учителя.
Поднимите свой уровень: [url=https://maps-edu.ru/akkreditaciya-medrabotnikov]пройти аккредитацию медицинскому работнику[/url] и специалистов по социальной работе.
Das Boomerang Casino ist bekannt für seine großzügigen Bonusangebote und spannenden Spiele. Für das Jahr 2022 gibt es nun auch attraktive no deposit Bonus Codes, die es Spielern ermöglichen, ohne Einzahlung von echtem Geld zu spielen und dennoch die Chance auf echte Gewinne zu haben.
Ein no deposit Bonus Code ist ein spezieller Code, den Spieler eingeben können, um einen Bonus ohne vorherige Einzahlung zu erhalten. Dieser Bonus kann Freispiele, Gratisguthaben oder andere Vergünstigungen beinhalten. Im Boomerang Casino gibt es verschiedene no deposit Bonus Codes, die regelmäßig aktualisiert und angeboten werden.
Um von den no deposit Bonus Codes im Boomerang Casino zu profitieren, müssen Spieler einfach den entsprechenden Code eingeben, wenn sie ihr Konto erstellen oder ihren Bonus beanspruchen. Die Codes sind in der Regel zeitlich begrenzt und können sich von Monat zu Monat ändern, daher ist es ratsam, regelmäßig auf der Website nach Updates zu suchen.
Mit den no deposit Bonus Codes haben Spieler die Möglichkeit, das Spieleangebot im Boomerang Casino zu erkunden, ohne dabei eigenes Geld riskieren zu müssen. Dies ist eine großartige Möglichkeit, die verschiedenen Spiele kennenzulernen und sich mit dem Casino vertraut zu machen, bevor man sich für eine Einzahlung entscheidet.
Wenn Sie also auf der Suche nach einem spannenden und großzügigen Casino sind, sollten Sie unbedingt die no deposit Bonus Codes im Boomerang Casino im Auge behalten. Mit etwas Glück können Sie dabei echte Gewinne erzielen, ohne vorher eine Einzahlung tätigen zu müssen. Viel Spaß und viel Glück beim Spielen!
https://boomerangcasino.one/
Популярная компания Скай Лайн Консалтинг предлагает весь спектр бухгалтерского сопровождения. У нас собрана команда истинных профессионалов. Все специалисты имеют приличный опыт работы и профильное образование. Доверьте им оформление юридических документов и кадровое делопроизводство. https://slc-company.ru/ – сайт, где можете в любое удобное для вас время ознакомиться с отзывами довольных клиентов. Гарантируем оперативное и грамотное решение вопросов, обращайтесь уже сейчас. Стремимся к выгодному сотрудничеству!
Zet Casino 30 Freispiele
Das Zet Casino bietet seinen Spielern die Möglichkeit, 30 Freispiele zu erhalten, wenn sie sich anmelden und eine Einzahlung tätigen. Diese Freispiele können an ausgewählten Spielautomaten genutzt werden und ermöglichen es den Spielern, ihre Gewinnchancen zu erhöhen, ohne ihr eigenes Geld zu riskieren.
Um die 30 Freispiele zu erhalten, müssen die Spieler sich zunächst im Zet Casino registrieren und eine Einzahlung auf ihr Konto tätigen. Sobald die Einzahlung bestätigt wurde, werden die Freispiele automatisch gutgeschrieben und können sofort genutzt werden.
Die Freispiele im Zet Casino bieten den Spielern die Möglichkeit, verschiedene Spielautomaten auszuprobieren und neue Spiele kennenzulernen, ohne dabei ihr eigenes Geld setzen zu müssen. Dies ist besonders attraktiv für Spieler, die gerne neue Spiele entdecken und ihr Glück versuchen möchten, ohne dabei hohe Einsätze zu riskieren.
Das Zet Casino bietet eine Vielzahl von hochwertigen Spielautomaten und Tischspielen, die für jeden Geschmack und jedes Budget geeignet sind. Die 30 Freispiele sind eine großartige Möglichkeit für Spieler, das Casino und seine Spiele kennenzulernen, ohne dabei ein finanzielles Risiko einzugehen.
Insgesamt sind die 30 Freispiele im Zet Casino eine attraktive Bonusangebot für neue Spieler, die das Casino ausprobieren möchten. Mit diesen Freispielen haben die Spieler die Möglichkeit, ihr Glück zu versuchen und möglicherweise schöne Gewinne zu erzielen, ohne dabei eigenes Geld riskieren zu müssen.
https://zetcasino.one/
nice content!nice history!! boba 😀
ЗАО «Автономный ЭнергоСервис» в компании работают истинные профессионалы. В короткий срок реализуем решения любой сложности с полезностью для заказчиков. Гарантируем оперативные поставки энергетического оборудования и предлагаем грамотные консультации. https://mototech.ru – сайт, где можно найти доброжелательные отзывы клиентов. Вы будете приятно удивлены привлекательной ценовой политикой, качеством продукции и высочайшей культурой общения персонала. Мы готовы быть долгосрочным и надежным партнером, обращайтесь к нам уже сейчас.
Tipico Casino Bonus ohne Einzahlung: Holen Sie sich Ihr Gratis-Guthaben
Das Tipico Casino bietet seinen Kunden nicht nur eine große Auswahl an Spielen und attraktive Bonusangebote, sondern auch die Möglichkeit, ohne Einzahlung von eigenem Geld zu spielen. Der sogenannte Tipico Casino Bonus ohne Einzahlung ist eine großartige Möglichkeit, um das Casino kennenzulernen und erste Gewinne zu erzielen, ohne Risiko eingehen zu müssen.
Um den Tipico Casino Bonus ohne Einzahlung zu erhalten, müssen Sie sich lediglich als neuer Kunde im Casino registrieren. Nach erfolgreicher Registrierung erhalten Sie automatisch Ihr Gratis-Guthaben gutgeschrieben, mit dem Sie sofort loslegen können. Dieses Gratis-Guthaben kann für eine Vielzahl von Spielen im Casino genutzt werden, darunter Slots, Tischspiele und vieles mehr.
Der Tipico Casino Bonus ohne Einzahlung bietet Ihnen die Möglichkeit, das Casino und seine Spiele in aller Ruhe auszuprobieren, ohne dabei Ihr eigenes Geld riskieren zu müssen. Sie können erste Gewinne erzielen, ohne selbst einen Cent einzahlen zu müssen. Dies macht den Tipico Casino Bonus ohne Einzahlung zu einer attraktiven Option für alle, die das Casino erst einmal unverbindlich testen möchten.
Wenn Sie sich für den Tipico Casino Bonus ohne Einzahlung interessieren, sollten Sie jedoch beachten, dass dieser in der Regel an bestimmte Umsatzbedingungen geknüpft ist. Bevor Sie sich Ihre Gewinne auszahlen lassen können, müssen Sie den Bonus bestimmte Male umsetzen. Es ist daher wichtig, die jeweiligen Bedingungen genau zu lesen, bevor Sie den Bonus in Anspruch nehmen.
Insgesamt bietet der Tipico Casino Bonus ohne Einzahlung eine tolle Gelegenheit, um das Casino risikofrei kennenzulernen und erste Gewinne zu erzielen. Wenn Sie sich als neuer Kunde im Tipico Casino registrieren, sollten Sie also unbedingt auch den Bonus ohne Einzahlung in Anspruch nehmen. Viel SpaГџ und Erfolg beim Spielen!
https://tipicocasino.one/
Boomerang Casino Freispiele
Boomerang Casino ist eine beliebte Online-Glücksspielplattform, die ihren Spielern eine Vielzahl von Spielen und Boni bietet. Eine der attraktivsten Aktionen, die das Casino seinen Spielern bietet, sind die Boomerang Casino Freispiele. Diese Freispiele ermöglichen es den Spielern, bestimmte Spielautomaten kostenlos zu spielen und dabei echtes Geld zu gewinnen.
Die Boomerang Casino Freispiele sind eine großartige Möglichkeit, das Casino kennenzulernen und seine Top-Spiele auszuprobieren, ohne eigenes Geld einsetzen zu müssen. Diese Freispiele werden den Spielern entweder als Teil eines Willkommensbonus angeboten oder als regelmäßige Promotionen für bestehende Kunden.
Um die Boomerang Casino Freispiele zu erhalten, müssen die Spieler oft eine Einzahlung auf ihr Konto tätigen oder einen bestimmten Betrag in einem bestimmten Zeitraum spielen. Die Anzahl der Freispiele kann je nach Aktion variieren, aber in der Regel erhalten die Spieler zwischen 10 und 100 Freispiele.
Die Boomerang Casino Freispiele kГ¶nnen fГјr verschiedene Spielautomaten verwendet werden, darunter beliebte Titel wie Starburst, Book of Dead, Gonzo’s Quest und viele mehr. Die Spieler haben die MГ¶glichkeit, echtes Geld zu gewinnen, wГ¤hrend sie die Spiele mit ihren Freispielen spielen, was diese Aktionen besonders attraktiv macht.
Insgesamt bieten die Boomerang Casino Freispiele den Spielern die Möglichkeit, neue Spiele auszuprobieren, ihre Gewinnchancen zu erhöhen und zusätzliche Preise zu gewinnen. Werfen Sie also einen Blick auf die aktuellen Promotionen von Boomerang Casino und sichern Sie sich Ihre Freispiele für eine spannende und unterhaltsame Spielerfahrung.
https://boomerangcasino.one/
blablablu
bluatblaaotuy
Zet Casino Bonus Code ohne Einzahlung
Zet Casino ist eine beliebte Online-Spielplattform, die eine Vielzahl von Spielen und großzügigen Boni für ihre Spieler anbietet. Einer der attraktivsten Boni, den neue Spieler bei Zet Casino erhalten können, ist der Bonus Code ohne Einzahlung.
Was ist ein Bonus Code ohne Einzahlung? Ein Bonus Code ohne Einzahlung ist ein spezieller Code, den Spieler eingeben können, um einen Bonus zu erhalten, ohne zuvor eine Einzahlung getätigt zu haben. Dies bedeutet, dass Spieler die Chance haben, das Casino und seine Spiele kostenlos auszuprobieren, bevor sie echtes Geld einsetzen.
Zet Casino bietet regelmäßig solche Bonus Codes ohne Einzahlung an, um neue Spieler anzulocken und das Spielerlebnis noch angenehmer zu gestalten. Gewinne aus Boni ohne Einzahlung können normalerweise ausgezahlt werden, nachdem bestimmte Umsatzbedingungen erfüllt wurden.
Um einen Bonus Code ohne Einzahlung bei Zet Casino zu erhalten, sollten Spieler regelmäßig die Website des Casinos besuchen oder sich für den Newsletter anmelden, um über aktuelle Aktionen informiert zu werden. Der Bonus Code kann dann im Kassenbereich des Casinos eingegeben werden, um den Bonus zu aktivieren.
Spieler sollten jedoch beachten, dass jeder Bonus Code ohne Einzahlung bestimmte Bedingungen und Umsatzanforderungen hat, die erfüllt werden müssen, bevor Gewinne ausgezahlt werden können. Es ist daher wichtig, die Bonusbedingungen sorgfältig zu lesen, um Missverständnisse zu vermeiden.
Insgesamt bietet Zet Casino seinen Spielern mit dem Bonus Code ohne Einzahlung eine großartige Gelegenheit, das Casino und seine Spiele risikofrei zu testen. Für Spieler, die auf der Suche nach einem neuen Online-Casino sind, ist dies eine hervorragende Möglichkeit, das Angebot von Zet Casino zu erkunden und möglicherweise sogar einige Gewinne zu erzielen.
https://zetcasino.one/
blibli
1. Вибір натяжних стель: як вибрати ідеальний варіант?
2. Модні тренди натяжних стель на поточний сезон
3. Які переваги мають натяжні стелі порівняно зі звичайними?
4. Як підібрати кольори для натяжної стелі у квартирі?
5. Секрети догляду за натяжними стелями: що потрібно знати?
6. Як зробити вибір між матовими та глянцевими натяжними стелями?
7. Натяжні стелі в інтер’єрі: як вони змінюють приміщення?
8. Натяжні стелі для ванної кімнати: плюси та мінуси
9. Як підняти стеля візуально за допомогою натяжної конструкції?
10. Як вибрати правильний дизайн натяжної стелі для кухні?
11. Інноваційні технології виробництва натяжних стель: що варто знати?
12. Чому натяжні стелі вибирають для офісних приміщень?
13. Натяжні стелі з фотопринтом: які переваги цієї технології?
14. Дизайнерські рішення для натяжних стель: ідеї для втілення
15. Хімічні реагенти в складі натяжних стель: безпека та якість
16. Як вибрати натяжну стелю для дитячої кімнати: поради батькам
17. Які можливості для дизайну приміщень відкривають натяжні стелі?
18. Як впливає вибір матеріалу на якість натяжної стелі?
19. Інструкція з монтажу натяжних стель власноруч: крок за кроком
20. Натяжні стелі як елемент екстер’єру будівлі: переваги та недоліки
львів натяжні стелі [url=http://www.natjazhnistelifvgtg.lviv.ua]http://www.natjazhnistelifvgtg.lviv.ua[/url] .
Das Tipico Casino bietet seinen Kunden die Möglichkeit, online zu spielen und tolle Gewinne zu erzielen. Viele Spieler sind jedoch besorgt über die Auszahlung ihrer Gewinne und möchten sicherstellen, dass sie ihr Geld schnell und einfach erhalten können. In diesem Artikel werfen wir einen Blick auf die Tipico Casino Erfahrungen zur Auszahlung.
Der erste Schritt, um eine Auszahlung bei Tipico Casino zu tätigen, ist die Verifizierung Ihres Kontos. Dies ist ein wichtiger Schritt, um sicherzustellen, dass Ihre Gewinne sicher und geschützt sind. Dazu müssen Sie einige persönliche Dokumente wie Ihren Ausweis oder Reisepass vorlegen. Dies mag für einige Spieler lästig erscheinen, ist jedoch notwendig, um sicherzustellen, dass alles mit rechten Dingen zugeht.
Sobald Ihr Konto verifiziert wurde, können Sie problemlos Auszahlungen vornehmen. Die meisten Spieler berichten, dass die Auszahlung bei Tipico Casino schnell und problemlos erfolgt. In der Regel werden Gewinne innerhalb von 1-3 Werktagen auf Ihr Bankkonto überwiesen. Dies ist definitiv ein Pluspunkt für das Casino und spricht für die Zuverlässigkeit des Anbieters.
Ein weiterer wichtiger Punkt sind die Gebühren für Auszahlungen. Bei Tipico Casino fallen in der Regel keine Gebühren an, wenn Sie Geld von Ihrem Konto abheben. Dies ist ein weiterer Vorteil für die Spieler, da sie sicher sein können, dass sie ihr Geld in voller Höhe erhalten.
Insgesamt können wir sagen, dass die Tipico Casino Erfahrungen zur Auszahlung positiv sind. Die meisten Spieler sind zufrieden mit der Schnelligkeit und Zuverlässigkeit des Prozesses. Wenn Sie auf der Suche nach einem vertrauenswürdigen Online-Casino sind, das Ihnen eine sichere und einfache Auszahlung bietet, sollten Sie definitiv Tipico Casino in Betracht ziehen.
https://tipicocasino.one/
nice content!nice history!!
blublabla
Im Jahr 2021 bietet das Zet Casino seinen Spielern eine Vielzahl von Freispielen an, die es ermöglichen, spannende Spiele zu entdecken und tolle Gewinne zu erzielen. Freispiele gehören zu den beliebtesten Boni in Online-Casinos, da sie es Spielern ermöglichen, kostenlos an Spielautomaten zu spielen und dabei echtes Geld zu gewinnen.
Im Zet Casino werden regelmäßig Freispiele als Teil von Promotions und Aktionen angeboten. Dabei können die Spieler zum Beispiel Freispiele an bestimmten Spielautomaten erhalten oder als Belohnung für ihre Treue im Casino. Diese Freispiele können oft ohne Einzahlung oder als Teil eines Willkommensbonus beansprucht werden.
Die Freispiele im Zet Casino sind eine großartige Möglichkeit, um neue Spiele auszuprobieren und die Vielfalt des Angebots kennenzulernen. Durch die Nutzung der Freispiele können die Spieler ihre Chancen auf Gewinne erhöhen, ohne dabei eigenes Geld einsetzen zu müssen. Es lohnt sich daher, regelmäßig im Zet Casino vorbeizuschauen und die aktuellen Freispiel-Angebote zu nutzen.
Zusätzlich zu den Freispielen bietet das Zet Casino auch eine Vielzahl von anderen Boni und Promotionen an, die den Spielern zusätzliche Gewinnchancen bieten. Mit einer großen Auswahl an Spielen und großzügigen Boni ist das Zet Casino eine gute Wahl für alle, die auf der Suche nach einem unterhaltsamen und lukrativen Online-Casino-Erlebnis sind.
Insgesamt bietet das Zet Casino seinen Spielern im Jahr 2021 eine Vielzahl von Freispielen und anderen spannenden Boni, die es wert sind, genutzt zu werden. Spieler sollten daher regelmäßig im Zet Casino vorbeischauen, um keine der lukrativen Aktionen zu verpassen und die besten Gewinnchancen zu nutzen.
https://zetcasino.one/
boba 😀
boba 😀
Tipico ist ein beliebtes Online-Casino, das seinen Kunden eine Vielzahl von Spielmöglichkeiten bietet. Wer sein Glück hier versuchen möchte, muss zunächst Geld auf sein Spielerkonto transferieren. In diesem Artikel gehen wir genauer darauf ein, wie Sie Geld von Ihrem Bankkonto auf Ihr Tipico Casino-Konto überweisen können.
Um Geld in Ihr Tipico Casino-Konto zu transferieren, stehen Ihnen verschiedene Zahlungsmethoden zur Verfügung. Eine der gängigsten Methoden ist die Überweisung per Banküberweisung. Dazu müssen Sie zunächst Ihr Bankkonto mit Ihrem Tipico Konto verknüpfen. Dies können Sie ganz einfach in Ihrem persönlichen Bereich auf der Website von Tipico erledigen. Dort finden Sie alle nötigen Informationen, die Sie für die Überweisung benötigen.
Um Geld per Banküberweisung auf Ihr Tipico Konto zu transferieren, geben Sie einfach den gewünschten Betrag sowie die Kontodaten von Tipico an. Innerhalb weniger Tage sollten Sie über das Geld auf Ihrem Spielerkonto verfügen können. Beachten Sie jedoch, dass bei dieser Zahlungsmethode möglicherweise Gebühren anfallen können.
Eine weitere Möglichkeit, Geld auf Ihr Tipico Konto zu überweisen, ist die Nutzung von E-Wallets wie PayPal oder Skrill. Diese Zahlungsmethoden sind oft schneller als Banküberweisungen und ermöglichen es Ihnen, sofort über das Geld auf Ihrem Spielerkonto zu verfügen. Auch hier müssen Sie zunächst Ihr E-Wallet mit Ihrem Tipico Konto verknüpfen, um Geld transferieren zu können.
Es ist wichtig zu beachten, dass der Betrag, den Sie auf Ihr Tipico Konto überweisen möchten, von den jeweiligen Zahlungsdienstleistern und Banken abhängig sein kann. Informieren Sie sich daher vorab über eventuelle Gebühren und Limits, die für die Überweisung gelten.
Insgesamt bietet Tipico seinen Kunden eine Vielzahl von Möglichkeiten, Geld auf das Casino-Konto zu überweisen. Egal ob per Banküberweisung oder E-Wallet, mit den richtigen Informationen und einer sicheren Zahlungsmethode können Sie schnell und unkompliziert Ihr Spielerkonto füllen und direkt mit dem Spielen beginnen. Viel Erfolg und Spaß beim Zocken!
https://tipicocasino.one/
Zet Casino ist eine beliebte Online-GlГјcksspielplattform, die eine Vielzahl von Spielen und Funktionen fГјr Spieler auf der ganzen Welt bietet. Eines der bemerkenswertesten Merkmale dieses Casinos ist der Live-Chat-Support, der rund um die Uhr verfГјgbar ist, um Spielern bei ihren Fragen und Anliegen zu helfen.
Der Live-Chat von Zet Casino ermöglicht es Spielern, direkt mit einem Support-Mitarbeiter zu kommunizieren, ohne lange Wartezeiten am Telefon oder per E-Mail. Spieler können Fragen zum Casino, zu Ein- und Auszahlungen, zu Boni und Werbeaktionen oder zu technischen Problemen stellen und erhalten sofortige Antworten und Unterstützung.
Der Live-Chat von Zet Casino ist einfach und benutzerfreundlich gestaltet, sodass Spieler keine technischen Kenntnisse benГ¶tigen, um ihn zu nutzen. Alles, was sie tun mГјssen, ist auf die SchaltflГ¤che “Live-Chat” auf der Website zu klicken und ihren Namen sowie ihre E-Mail-Adresse einzugeben, um eine Verbindung mit einem Support-Mitarbeiter herzustellen.
Dank des Live-Chats von Zet Casino können Spieler schnell und effizient alle ihre Fragen klären und Probleme bei ihrer Spielerfahrung lösen. Dieser Service hat dazu beigetragen, dass Zet Casino zu einer der beliebtesten Glücksspielplattformen im Internet geworden ist.
Insgesamt war der Live-Chat von Zet Casino eine großartige Ergänzung zu den bereits umfangreichen Dienstleistungen und Funktionen, die das Casino anbietet. Spieler können sicher sein, dass sie jederzeit professionelle Unterstützung erhalten, wenn sie im Zet Casino spielen.
https://zetcasino.one/
Das Boomerang Casino ist eine aufstrebende Marke in der Welt der Online-Casinos. Ein wichtiger Bestandteil des Erfolgs dieses Casinos ist sein einzigartiges und unverwechselbares Logo.
Das Boomerang Casino Logo ist sowohl einfach als auch auffГ¤llig. Es zeigt einen stilisierten Boomerang, der das Markenzeichen des Casinos ist. Die Farbkombination von Rot und WeiГџ macht das Logo sehr ansprechend und leicht erkennbar. Der Schriftzug “Boomerang Casino” ist ebenfalls gut lesbar und fГјgt sich harmonisch in das Design ein.
Das Logo des Boomerang Casinos ist nicht nur ein grafisches Element, sondern auch ein wichtiges IdentitГ¤tsmerkmal. Es steht fГјr QualitГ¤t, ZuverlГ¤ssigkeit und Unterhaltung – Werte, die das Casino verkГ¶rpert. Das Boomerang Casino Logo ist in der gesamten Online-PrГ¤senz des Casinos prГ¤sent, sei es auf der Website, in den sozialen Medien oder in der Werbung.
Die Wirkung des Boomerang Casino Logos geht weit über das visuelle hinaus. Es schafft eine Wiedererkennungswert und hilft dabei, sich von anderen Online-Casinos abzuheben. Das Logo ist ein wichtiger Bestandteil der Markenbildung und trägt dazu bei, das Image des Casinos zu stärken und zu festigen.
Insgesamt ist das Boomerang Casino Logo ein gelungenes Beispiel für die Gestaltung eines ansprechenden und aussagekräftigen Logos. Es trägt dazu bei, das Casino von anderen Anbietern zu differenzieren und einen bleibenden Eindruck bei den Spielern zu hinterlassen.
https://boomerangcasino.one/
Zet Casino Test
Das Zet Casino ist ein Online-Casino, das erst vor kurzer Zeit auf dem Markt erschienen ist. Da es sich um ein relativ neues Casino handelt, wollten wir es genauer unter die Lupe nehmen und einen Testbericht darГјber schreiben.
Das Zet Casino bietet eine groГџe Auswahl an Spielen von verschiedenen Anbietern wie NetEnt, Microgaming, Play’n GO und vielen anderen. Ob Slots, Tischspiele oder Live-Casino-Spiele, hier ist fГјr jeden Geschmack etwas dabei. Die Webseite ist Гјbersichtlich gestaltet und die Navigation ist einfach und intuitiv.
Ein besonderes Highlight im Zet Casino ist das Bonusangebot. Neue Spieler können sich über einen großzügigen Willkommensbonus freuen, der sowohl Bonusgeld als auch Freispiele beinhaltet. Auch für Bestandskunden gibt es regelmäßig Aktionen und Promotionen, die für zusätzlichen Spielspaß sorgen.
Der Kundenservice des Zet Casinos steht rund um die Uhr zur VerfГјgung und ist per Live-Chat, E-Mail und Telefon erreichbar. Die Mitarbeiter sind freundlich und kompetent und helfen bei allen Anliegen schnell und unkompliziert weiter.
In unserem Test konnten wir keine größeren Schwächen im Zet Casino feststellen. Die Auszahlungen werden schnell bearbeitet und das Casino arbeitet mit renommierten Zahlungsdienstleistern zusammen, um sichere und zuverlässige Transaktionen zu gewährleisten.
Insgesamt können wir das Zet Casino daher bedenkenlos weiterempfehlen. Wer auf der Suche nach einem seriösen und unterhaltsamen Online-Casino ist, sollte hier definitiv einen Blick riskieren.
https://zetcasino.one/
Boomerang Casino: 50 Freispiele ohne Einzahlung
Boomerang Casino ist eine aufregende Online-Spielplattform, die Spielern eine Vielzahl von Spielen und Boni bietet. Eine besonders attraktive Promotion, die derzeit angeboten wird, sind 50 Freispiele ohne Einzahlung fГјr neue Spieler.
Um von diesem großzügigen Angebot zu profitieren, müssen Spieler lediglich ein Konto bei Boomerang Casino erstellen. Sobald das Konto erfolgreich erstellt wurde, werden die 50 Freispiele automatisch gutgeschrieben. Spieler können diese Freispiele dann nutzen, um verschiedene Slot-Spiele auszuprobieren und echtes Geld zu gewinnen, ohne dabei ihr eigenes Geld riskieren zu müssen.
Diese Freispiele ohne Einzahlung sind eine hervorragende Möglichkeit für Spieler, die Welt von Boomerang Casino zu erkunden und gleichzeitig die Chance zu haben, echte Gewinne zu erzielen. Spieler können sich auf spannende Spielautomaten, große Jackpots und ein erstklassiges Spielerlebnis freuen.
Um die Freispiele zu erhalten, müssen Spieler lediglich den Bonus in ihrem Konto aktivieren und die Bedingungen für den Einsatz der Freispiele erfüllen. Dazu gehören in der Regel das Setzen eines Mindestbetrags und das Erfüllen von Umsatzanforderungen. Diese Bedingungen sind fair und transparent, so dass Spieler genau wissen, was von ihnen erwartet wird.
Wenn Sie also auf der Suche nach einem aufregenden Online-Casino-Erlebnis sind und gerne kostenlose Freispiele erhalten möchten, ist Boomerang Casino die richtige Wahl für Sie. Registrieren Sie sich noch heute und nutzen Sie die 50 Freispiele ohne Einzahlung, um Ihr Glück zu versuchen und tolle Gewinne zu erzielen. Viel Spaß und viel Erfolg!
https://boomerangcasino.one/
blabla
Das Tipico Casino ist eine der beliebtesten Online-Glücksspielplattformen in Deutschland. Mit einer Vielzahl von Spielen, großzügigen Boni und einem benutzerfreundlichen Interface zieht es täglich tausende von Spielern an. Doch auch erfahrene Spieler haben oft Fragen zum Tipico Casino. Hier sind einige der häufigsten Fragen und Antworten, um Ihnen zu helfen, das Beste aus Ihrer Spielerfahrung herauszuholen.
1. Ist das Tipico Casino legal?
Ja, das Tipico Casino ist vollkommen legal und wird von den relevanten Behörden reguliert. Es verfügt über eine Lizenz der Malta Gaming Authority, die sicherstellt, dass alle Spiele fair und transparent ablaufen.
2. Welche Spiele werden im Tipico Casino angeboten?
Im Tipico Casino finden Sie eine breite Auswahl an Spielen, darunter Spielautomaten, Tischspiele wie Roulette und Blackjack, sowie Live-Casino-Spiele. Es ist fГјr jeden Geschmack etwas dabei!
3. Kann ich im Tipico Casino echtes Geld gewinnen?
Ja, im Tipico Casino können Sie echtes Geld gewinnen. Sie müssen lediglich ein registriertes Konto erstellen, eine Einzahlung tätigen und Ihr Glück versuchen.
4. Gibt es einen Willkommensbonus im Tipico Casino?
Ja, neue Spieler erhalten einen groГџzГјgigen Willkommensbonus im Tipico Casino. Dieser kann je nach Aktion variieren, daher empfiehlt es sich, vor der Registrierung die aktuellen Angebote zu ГјberprГјfen.
5. Wie kann ich Geld ein- und auszahlen?
Im Tipico Casino stehen Ihnen verschiedene Zahlungsmethoden zur VerfГјgung, darunter Kreditkarten, BankГјberweisungen und E-Wallets wie PayPal. Die Ein- und Auszahlungen sind sicher und werden schnell bearbeitet.
Das Tipico Casino ist eine vertrauenswГјrdige und unterhaltsame GlГјcksspielplattform fГјr alle, die gerne online spielen. Wenn Sie weitere Fragen haben, werfen Sie einen Blick auf die FAQ-Sektion der Website oder wenden Sie sich an den Kundenservice. Viel GlГјck und viel SpaГџ beim Spielen im Tipico Casino!
https://tipicocasino.one/
blibliblu
Zet Casino ist ein Online-Casino, das bei Spielern auf der ganzen Welt sehr beliebt ist. Es bietet eine Vielzahl von Spielen, darunter Spielautomaten, Tischspiele und Live-Casino-Spiele. Das Casino ist für seine großzügigen Boni und Promotionen bekannt, die es seinen Spielern ermöglichen, ihr Spielerlebnis zu maximieren.
Eine der besten Möglichkeiten, um alle aktuellen Angebote und Aktionen von Zet Casino zu verfolgen, ist die Website AskGamblers. AskGamblers ist eine der renommiertesten und vertrauenswürdigsten Casino-Review-Seiten im Internet. Auf der Website können Spieler Bewertungen lesen und sich über die neuesten Entwicklungen in der Casino-Branche informieren.
Zet Casino AskGamblers bietet Spielern auch die Möglichkeit, ihre eigenen Erfahrungen mit dem Casino zu teilen und Feedback zu geben. Auf diese Weise können andere Spieler von der Meinung und den Tipps anderer profitieren. Darüber hinaus bietet die Website regelmäßig exklusive Boni und Angebote für ihre Leser an.
Wenn Sie also ein Fan von Zet Casino sind und immer auf dem neuesten Stand bleiben möchten, sollten Sie unbedingt die Seite AskGamblers besuchen. Dort finden Sie alle Informationen, die Sie benötigen, um das Beste aus Ihrem Casino-Erlebnis herauszuholen. Besuchen Sie noch heute die Seite und lassen Sie sich von den spannenden Angeboten von Zet Casino überraschen!
https://zetcasino.one/
Желаете взять детские коляски в аренду? Мы это то, что вам нужно. Гарантируем приемлемые цены и предоставляем большой выбор детских колясок для аренды. Наши специалисты готовы подобрать оптимальный вариант, обеспечить комфорт и безопасность. https://arenda-detskoj-kolyaski.fast-rent.ru/ – сайт, где можете прямо сейчас оставить заявку. Любая наша коляска находится в отличном техническом состоянии и имеет солидный внешний вид. Мы открыты для диалога и долгосрочного сотрудничества. Обращаясь к нам, вы точно останетесь довольны!
Boomerang Bet Casino: Ein aufregendes neues Online-Casino-Erlebnis
Boomerang Bet Casino ist eines der neuesten Online-Casinos auf dem Markt und bietet eine Vielzahl von Spielen und Funktionen für Spieler aller Erfahrungsstufen. Mit hochwertiger Grafik, einer benutzerfreundlichen Oberfläche und einer Vielzahl von Spielmöglichkeiten verspricht Boomerang Bet Casino ein aufregendes Spielerlebnis.
Eine der einzigartigen Funktionen von Boomerang Bet Casino ist das Boomerang-System, das es den Spielern ermöglicht, auf ihre Lieblingsspiele zurückzukehren und dabei Belohnungen und zusätzliche Boni zu erhalten. Dieses innovative System belohnt treue Spieler und sorgt dafür, dass sie sich immer wieder für Boomerang Bet Casino entscheiden.
Darüber hinaus bietet Boomerang Bet Casino eine Vielzahl von Spielen, von klassischen Tischspielen wie Blackjack und Roulette bis hin zu modernen Spielautomaten und Live-Casino-Spielen. Mit regelmäßigen Promotions und Turnieren gibt es immer etwas Neues zu entdecken und zu gewinnen.
Für Spieler, die gerne unterwegs spielen, bietet Boomerang Bet Casino auch eine mobile App, die es ihnen ermöglicht, ihre Lieblingsspiele jederzeit und überall zu genießen. Die App ist benutzerfreundlich und bietet eine nahtlose Spielerfahrung, egal ob auf einem Smartphone oder Tablet.
Insgesamt bietet Boomerang Bet Casino eine unterhaltsame und lohnende Spielerfahrung für alle, die gerne online spielen. Mit einer Vielzahl von Spielen, innovativen Funktionen und regelmäßigen Promotions ist Boomerang Bet Casino definitiv einen Besuch wert.
https://boomerangcasino.one/
Zet Casino Einzahlung: Alles, was Sie wissen mГјssen
Wenn Sie gerne in Online-Casinos spielen, ist es wichtig, dass Sie verstehen, wie die Einzahlung funktioniert. Im Zet Casino haben Sie verschiedene Möglichkeiten, Geld auf Ihr Konto einzuzahlen, um Ihre Lieblingsspiele zu spielen. In diesem Artikel erfahren Sie alles, was Sie über die Zet Casino Einzahlung wissen müssen.
Das Zet Casino bietet eine Vielzahl von Zahlungsmethoden, aus denen Sie wählen können. Dazu gehören Kredit- und Debitkarten wie Visa und Mastercard, E-Wallets wie Skrill und Neteller, Banküberweisungen und sogar Kryptowährungen wie Bitcoin. Dies bedeutet, dass Sie die Option haben, die Methode auszuwählen, die am besten zu Ihnen passt und die für Sie am bequemsten ist.
Um eine Einzahlung im Zet Casino zu tГ¤tigen, mГјssen Sie sich zunГ¤chst in Ihr Konto einloggen und zum Kassenbereich gehen. Dort wГ¤hlen Sie die Option “Einzahlung” und entscheiden sich fГјr die Zahlungsmethode, die Sie verwenden mГ¶chten. Geben Sie den Betrag ein, den Sie einzahlen mГ¶chten, und folgen Sie den Anweisungen auf dem Bildschirm, um die Transaktion abzuschlieГџen.
Es ist wichtig zu beachten, dass das Zet Casino Mindest- und Höchstbeträge für Einzahlungen festgelegt hat. Diese Beträge können je nach Zahlungsmethode variieren, daher empfehlen wir Ihnen, sich vor der Einzahlung über die genauen Bedingungen zu informieren. Darüber hinaus können einige Zahlungsmethoden eine Gebühr für Transaktionen erheben, also lesen Sie die Geschäftsbedingungen sorgfältig durch, um unerwartete Kosten zu vermeiden.
Sobald Ihre Einzahlung bestätigt ist, wird das Geld sofort auf Ihrem Casino-Konto gutgeschrieben und Sie können mit dem Spielen beginnen. Denken Sie daran, verantwortungsvoll zu spielen und nur Geld zu verwenden, das Sie sich leisten können zu verlieren.
Insgesamt bietet das Zet Casino eine einfache und sichere Möglichkeit, Geld auf Ihr Konto einzuzahlen, damit Sie Ihre Lieblingsspiele genießen können. Mit einer Vielzahl von Zahlungsmethoden und klaren Bedingungen ist es einfach, eine Einzahlung zu tätigen und in kürzester Zeit mit dem Spielen zu beginnen.
https://zetcasino.one/
Das Boomerang Casino GR ist eine aufregende neue Online-Glücksspielplattform, die Spielern eine Vielzahl von spannenden Spielen und aufregenden Aktionen bietet. Die Website bietet eine benutzerfreundliche Benutzeroberfläche, die es einfach macht, Lieblingsspiele zu finden und zu spielen, und bietet eine sichere und geschützte Umgebung für Spieler.
Das Boomerang Casino GR bietet eine breite Palette von Casino-Spielen, darunter Spielautomaten, Tischspiele, Live-Casino-Spiele und vieles mehr. Die Spielautomaten sind besonders beliebt, da sie eine Vielzahl von Themen und Funktionen bieten, die Spieler begeistern. Die Tischspiele umfassen klassische Casinospiele wie Blackjack, Roulette und Baccarat, die alle in verschiedenen Varianten verfügbar sind. Das Live-Casino bietet Spielern die Möglichkeit, mit echten Dealern zu interagieren und ein authentisches Casino-Erlebnis von zu Hause aus zu genießen.
Das Boomerang Casino GR bietet auch eine Vielzahl von aufregenden Aktionen und Boni für Spieler. Von Willkommensboni für neue Spieler bis hin zu regelmäßigen Sonderaktionen und Turnieren gibt es immer etwas, das die Spieler begeistert. Die Website bietet auch ein Treueprogramm, das es den Spielern ermöglicht, Punkte zu sammeln und sie gegen Belohnungen einzutauschen. Dies hilft den Spielern, ihre Bankroll zu erhöhen und mehr Spaß beim Spielen zu haben.
Die Website ist in mehreren Sprachen verfГјgbar und akzeptiert eine Vielzahl von Zahlungsmethoden, darunter Kreditkarten, E-Wallets und BankГјberweisungen. Das Kundensupport-Team steht den Spielern rund um die Uhr zur VerfГјgung, um bei Fragen oder Problemen zu helfen.
Insgesamt bietet das Boomerang Casino GR eine unterhaltsame und sichere GlГјcksspielumgebung fГјr Spieler aller Erfahrungsstufen. Mit einer Vielzahl von Spielen, aufregenden Aktionen und einem erstklassigen Kundensupport ist es definitiv eine Website, die es wert ist, ausprobiert zu werden.
https://boomerangcasino.one/
Атмосфера волшебства и красоты
12. Эксклюзивный дом из бруса 9х12: индивидуальный подход
проект дома из бруса одноэтажный 9х12 [url=https://domizbrusa9x12spb.ru/]https://domizbrusa9x12spb.ru/[/url] .
Семейное гнездышко в окружении природы
18. Современный дом из бруса 9х12: дизайнерские решения
проект дома из бруса одноэтажный 9х12 [url=https://domizbrusa9x12spb.ru/]https://domizbrusa9x12spb.ru/[/url] .
Bei Zet Casino kГ¶nnen Spieler von einem attraktiven Bonusprogramm profitieren, das unter anderem durch den Einsatz eines speziellen Promotionscodes erweitert werden kann. Der sogenannte “zet casino kod promocyjny” bietet Spielern die MГ¶glichkeit, zusГ¤tzliche Gelder oder Freispiele zu erhalten und so ihre Gewinnchancen zu erhГ¶hen.
Um den Promotionscode zu nutzen, müssen Spieler lediglich während der Registrierung oder Einzahlung den entsprechenden Code eingeben. Dies öffnet die Tür zu verschiedenen Bonusangeboten, die regelmäßig aktualisiert und erweitert werden. Zu den möglichen Boni gehören beispielsweise Einzahlungsboni, Freispiele für bestimmte Spielautomaten oder Cashback-Angebote.
Der “zet casino kod promocyjny” ist eine groГџartige MГ¶glichkeit fГјr Spieler, mehr aus ihrem Online Casino-Erlebnis herauszuholen und gleichzeitig ihre Gewinnchancen zu maximieren. Durch regelmäßige ГњberprГјfung der aktuellen Bonusangebote kГ¶nnen Spieler sicherstellen, dass sie keine lukrativen Aktionen verpassen und ihr Spielerlebnis auf Zet Casino optimal gestalten.
Insgesamt bietet Zet Casino mit seinem umfangreichen Bonusprogramm und dem Einsatz von Promotionscodes eine attraktive Spielumgebung fГјr alle Casino-Liebhaber. Wer auf der Suche nach zusГ¤tzlichen Bonusvorteilen ist, sollte daher nicht zГ¶gern, den “zet casino kod promocyjny” zu nutzen und das volle Potenzial des Casinos auszuschГ¶pfen.
https://zetcasino.one/
Das Boomerang Casino gehört zu den beliebten Online-Casinos, die eine Vielzahl von Spielen und Boni für die Spieler anbieten. Eine wichtige Funktion in jedem Casino ist die Auszahlung von Gewinnen an die Spieler. Im Boomerang Casino gibt es verschiedene Methoden und Richtlinien für die Auszahlung, die es wert sind, näher betrachtet zu werden.
Die Auszahlungen im Boomerang Casino können mit verschiedenen Zahlungsmethoden wie Kreditkarten, E-Wallets und Banküberweisungen erfolgen. Die Spieler können die für sie am besten geeignete Option auswählen. Bei der Auszahlung wird darauf geachtet, dass die Spieler ihr Geld sicher und schnell erhalten. Die Auszahlungszeiten können je nach Zahlungsmethode variieren, aber das Casino bemüht sich, die Auszahlungen so schnell wie möglich zu bearbeiten.
Es ist wichtig zu beachten, dass im Boomerang Casino bestimmte Richtlinien für Auszahlungen gelten. Zum Beispiel müssen die Spieler möglicherweise bestimmte Umsatzanforderungen erfüllen, bevor sie ihre Gewinne abheben können. Diese Anforderungen können je nach Aktion und Bonus variieren, daher ist es ratsam, die Geschäftsbedingungen sorgfältig zu lesen.
Die Spieler können sich jederzeit an den Kundensupport des Boomerang Casinos wenden, wenn sie Fragen zur Auszahlung haben. Das Supportteam ist rund um die Uhr erreichbar und steht den Spielern mit professioneller Hilfe zur Seite.
Insgesamt bietet das Boomerang Casino seinen Spielern eine zuverlässige und sichere Auszahlungsmethode. Die Spieler können sich darauf verlassen, dass sie ihre Gewinne problemlos abheben können. Mit einer Vielzahl von Zahlungsmethoden und einer effizienten Kundenbetreuung ist die Auszahlung im Boomerang Casino ein einfacher und angenehmer Prozess.
https://boomerangcasino.one/
Хотите взять в аренду детские коляски? Мы вам в этом поможем. Предоставляем впечатлительный выбор детских колясок для аренды и гарантируем доступные цены. Наши компетентные специалисты подберут нужный вариант и обеспечат безопасность и комфорт. https://arenda-detskoj-kolyaski.fast-rent.ru/ – сайт, где можете прямо сейчас оставить заявку. Каждая коляска имеет презентабельный внешний вид и находится в отменном техническом состоянии. Мы открыты для диалога и долгосрочного сотрудничества. Обращайтесь к нам и об этом точно не пожалеете!
Место, где царит гармония и тепло
17. Дом из бруса 9х12: место для счастья и уюта
дом брус 9х12 [url=https://domizbrusa9x12spb.ru/]https://domizbrusa9x12spb.ru/[/url] .
blublu
Zet Casino Paysafecard
Zet Casino ist ein beliebtes Online-Casino, das Spielern eine Vielzahl von Spielen und Zahlungsmöglichkeiten bietet. Eine der beliebtesten Zahlungsmethoden bei Zet Casino ist die Paysafecard. Paysafecard ist eine prepaid Zahlungsmethode, bei der Spieler Gutscheine kaufen und diese dann online als Zahlungsmittel verwenden können.
Die Paysafecard bietet Spielern eine sichere und anonyme Möglichkeit, Geld auf ihr Zet Casino Konto einzuzahlen. Spieler können Paysafecards in verschiedenen Werten kaufen, je nach ihren Bedürfnissen. Sobald ein Spieler einen Paysafecard-Gutschein gekauft hat, kann er den Code einfach eingeben und das Geld wird sofort auf sein Konto gutgeschrieben.
Einer der Vorteile der Paysafecard ist die Sicherheit, die sie bietet. Da Spieler keine persönlichen Daten angeben müssen, um eine Paysafecard zu nutzen, sind ihre Transaktionen anonym und sicher. Spieler können also beruhigt sein, dass ihre finanziellen Informationen geschützt sind.
Zusätzlich ist die Paysafecard auch sehr bequem zu nutzen. Spieler müssen einfach den Code eingeben und schon ist das Geld auf ihrem Konto verfügbar. Es gibt keine Notwendigkeit, Bankdaten oder Kreditkarteninformationen anzugeben, was die Paysafecard zu einer einfachen und unkomplizierten Zahlungsmethode macht.
Zet Casino bietet seinen Spielern die Möglichkeit, mit Paysafecard zu bezahlen und somit das Spielerlebnis noch angenehmer zu gestalten. Wenn Sie also auf der Suche nach einer sicheren, anonymen und bequemen Zahlungsmethode sind, dann ist die Paysafecard die richtige Wahl für Sie. Besuchen Sie noch heute Zet Casino und erleben Sie die Welt des Online-Glücksspiels auf eine neue und aufregende Weise!
https://zetcasino.one/
Новый уровень комфорта
10. Дом из бруса 9х12: семейное гнездышко
дом брус 9х12 [url=https://domizbrusa9x12spb.ru/]https://domizbrusa9x12spb.ru/[/url] .
Место, где царит уют и покой
11. Сказочный дом из бруса 9х12: мечта сбылась
одноэтажный дом из бруса 9х12 [url=https://domizbrusa9x12spb.ru/]https://domizbrusa9x12spb.ru/[/url] .
Boomerang Casino – der Ort, an dem das GlГјck immer wieder zurГјckkommt! Mit dem exklusiven Kod Promocyjny Boomerang Casino kГ¶nnen Spieler in eine aufregende Welt voller SpaГџ und GewinnmГ¶glichkeiten eintauchen.
Das Kod Promocyjny Boomerang Casino bietet Spielern die Möglichkeit, von erstaunlichen Bonusangeboten zu profitieren, die ihre Gewinnchancen erhöhen. Mit diesem speziellen Code können Spieler zusätzliche Bonusgelder, Freispiele und andere aufregende Belohnungen erhalten, die das Spielerlebnis noch spannender machen.
DarГјber hinaus bietet Boomerang Casino eine Vielzahl von Spieloptionen, darunter beliebte Slots, Tischspiele und Live-Casino-Spiele. Mit hochwertiger Grafik und einem reibungslosen Spielerlebnis ist Boomerang Casino der perfekte Ort fГјr alle, die nach einem erstklassigen Online-Casino-Erlebnis suchen.
Spieler, die den Kod Promocyjny Boomerang Casino nutzen, können sicher sein, dass sie von einem engagierten Kundensupport-Team unterstützt werden, das ihnen bei allen Fragen oder Problemen behilflich ist. Mit schnellen Auszahlungen und einer benutzerfreundlichen Oberfläche bietet Boomerang Casino alles, was Spieler für ein erstklassiges Casino-Erlebnis benötigen.
Nutzen Sie noch heute den Kod Promocyjny Boomerang Casino und erleben Sie die aufregende Welt des Online-Glücksspiels auf höchstem Niveau! Besuchen Sie die Website von Boomerang Casino und erleben Sie die Spannung und den Nervenkitzel, den dieses erstklassige Casino zu bieten hat.
https://boomerangcasino.one/
Место, где царит уют и покой
11. Сказочный дом из бруса 9х12: мечта сбылась
проект дома из бруса одноэтажный 9х12 [url=https://domizbrusa9x12spb.ru/]https://domizbrusa9x12spb.ru/[/url] .
Das Tipico Mobil Casino bietet eine hervorragende MГ¶glichkeit, Casino-Spiele von Гјberall aus zu genieГџen. Egal ob auf dem Weg zur Arbeit, in der Mittagspause oder gemГјtlich auf der Couch zuhause – mit der mobilen App von Tipico kГ¶nnen Spieler ihre Lieblingsspiele jederzeit und Гјberall spielen.
Die Benutzeroberfläche des Mobil Casinos ist benutzerfreundlich und einfach zu navigieren, was es auch neuen Spielern leicht macht, sich zurechtzufinden. Die App bietet eine breite Auswahl an Casino-Spielen, darunter Slots, Tischspiele, Live-Casino und vieles mehr. Die Spiele werden von renommierten Softwareanbietern wie NetEnt, Microgaming und Evolution Gaming bereitgestellt, was für ein hochwertiges Spielerlebnis sorgt.
Ein weiterer großer Vorteil des Tipico Mobil Casinos ist die Möglichkeit, von unterwegs aus Ein- und Auszahlungen vorzunehmen. Die App unterstützt verschiedene Zahlungsmethoden, darunter Kreditkarten, eWallets und Banküberweisungen, und sorgt somit für eine sichere und einfache Abwicklung von Transaktionen.
Darüber hinaus bietet das Tipico Mobil Casino regelmäßig spannende Aktionen und Boni für Spieler an, die das Spielerlebnis noch aufregender machen. Von Freispielen über Einzahlungsboni bis hin zu Cashback-Angeboten gibt es immer wieder attraktive Belohnungen für treue Spieler.
Insgesamt ist das Tipico Mobil Casino eine ausgezeichnete Wahl für Spieler, die auch unterwegs nicht auf ihr Casino-Vergnügen verzichten möchten. Mit einer großen Auswahl an Spielen, einer benutzerfreundlichen App und attraktiven Aktionen ist das Mobil Casino von Tipico definitiv einen Besuch wert.
https://tipicocasino.one/
scam
Gogo Casino Partners är ett populärt program som erbjuds av Gogo Casino för att samarbeta med andra aktörer inom spelbranschen. Genom detta partnerskapsprogram kan företag och individer som delar samma intresse för casinospel samarbeta för att öka sin synlighet och locka fler spelare.
Genom att bli en partner med Gogo Casino får man tillgång till en rad förmåner och resurser. Man kan dra nytta av marknadsföringsverktyg och kampanjer för att locka nya spelare till sitt casino. Man kan även ta del av specialerbjudanden och bonusar som är exklusiva för partners, vilket kan öka intäkterna och skapa en mer lönsam verksamhet.
Som partner får man också tillgång till en dedikerad kontaktperson som man kan vända sig till för råd och support. Man blir en del av en gemenskap av likasinnade individer som delar ens vision och mål. Genom att samarbeta med Gogo Casino Partners kan man dra nytta av deras erfarenhet och expertis för att växa och utveckla sitt eget casino.
För de som är intresserade av att bli en partner med Gogo Casino är processen enkel och smidig. Man kan ansöka om partnerskap online och få svar inom kort. Genom att bli en partner med Gogo Casino får man tillgång till en rad fördelar som kan hjälpa ens verksamhet att växa och blomstra.
Sammanfattningsvis är Gogo Casino Partners ett fantastiskt sätt för företag och individer inom spelbranschen att samarbeta och dra nytta av varandras kunskap och resurser. Genom partnerskap med Gogo Casino kan man öka sin synlighet, locka fler spelare och öka sina intäkter. Det är en win-win-situation för alla inblandade parter och en möjlighet som inte bör missas.
https://gogocasino.one
124969D742
Zet Casino Auszahlung Probleme
Bei Online-Casinos ist es leider keine Seltenheit, dass Spieler auf Auszahlungsprobleme stoßen. Ein aktuelles Beispiel dafür ist das Zet Casino, das in den letzten Wochen vermehrt negative Schlagzeilen gemacht hat. Viele Spieler berichten von Schwierigkeiten bei der Auszahlung ihrer Gewinne und von langen Wartezeiten, bis das Geld tatsächlich auf ihrem Konto landet.
Die Gründe für diese Probleme können vielfältig sein. Oftmals liegt es an technischen Schwierigkeiten im Zahlungssystem des Casinos oder an fehlerhaften Daten, die vom Spieler angegeben wurden. Manchmal stecken aber auch betrügerische Absichten dahinter, wenn das Casino sich absichtlich weigert, Gewinne auszuzahlen.
Um solche Probleme zu vermeiden, ist es wichtig, sich vor dem Spielen in einem Online-Casino ausgiebig zu informieren. Seriöse Anbieter zeichnen sich durch eine transparente Auszahlungspolitik aus, in der alle Bedingungen und Gebühren klar kommuniziert werden. Zudem sollte man darauf achten, dass das Casino über eine gültige Glücksspiel-Lizenz verfügt und von unabhängigen Prüfstellen kontrolliert wird.
Falls man dennoch auf Probleme bei der Auszahlung stößt, empfiehlt es sich, den Kundenservice des Casinos zu kontaktieren und das Anliegen zu schildern. Oftmals kann auf diesem Wege eine schnelle Lösung gefunden werden. Sollte das Casino jedoch nicht kooperativ sein, bleibt als letzte Möglichkeit der Gang zur Glücksspielbehörde, die in solchen Fällen als Schlichtungsstelle fungiert.
Insgesamt sollte man also vorsichtig sein, wenn man in Online-Casinos spielt und sich vorab gut informieren, um mögliche Auszahlungsprobleme zu vermeiden. Denn nichts ist ärgerlicher, als sein hart verdientes Geld nicht ausgezahlt zu bekommen.
https://zetcasino.one/
Gogo Casino är en populär spelsajt för många svenskar, men det finns en del problem som spelare kan stöta på när de använder sajten.
En av de vanligaste klagomГҐlen Г¤r att vissa spelare upplever problem med att ta ut sina vinster. Det verkar finnas vissa otydliga regler kring uttag och vissa spelare har rapporterat att de har haft svГҐrt att fГҐ sina pengar utbetalda.
En annan källa till frustration för vissa spelare är bristen på kundsupport. Många spelare har rapporterat att de har haft svårt att få i kontakt med supporten och att det har varit långa väntetider när de väl har fått tag på någon.
Det finns även rapporter om tekniska problem på sajten, som kan leda till att spelare inte kan spela sina favoritspel eller att deras insatser försvinner oklar anledning.
Det är viktigt att Gogo Casino tar dessa problem på allvar och arbetar för att förbättra användarupplevelsen för sina spelare. Genom att lyssna på feedback och snabbt åtgärda eventuella problem kan de bibehålla sin popularitet och förtroende hos sina användare.
https://gogocasino.one
Das Boomerang Casino bietet seinen Spielern eine Vielzahl von großzügigen Bonusangeboten, darunter auch Codes ohne Einzahlung. Diese Codes ermöglichen es den Spielern, zusätzliches Guthaben zu erhalten, ohne dass sie dafür eine Einzahlung tätigen müssen.
Ein Bonus ohne Einzahlung ist eine großartige Möglichkeit, um das Casino und seine Spiele zu testen, ohne dabei eigenes Geld riskieren zu müssen. Der Spieler kann mit dem Bonusguthaben verschiedene Spiele ausprobieren und sich so ein Bild von der Vielfalt des Casinos machen.
Die boomerang casino codici bonus senza deposito sind leicht zu verwenden und bieten den Spielern die Möglichkeit, echte Gewinne zu erzielen, ohne dafür eigenes Geld ausgeben zu müssen. Die Bonuscodes können auf der Website des Casinos eingelöst werden und stehen den Spielern sofort zur Verfügung.
Um von den Bonusangeboten zu profitieren, ist es wichtig, die jeweiligen Bedingungen zu beachten. Diese können sich je nach Angebot unterscheiden und sollten daher sorgfältig gelesen werden.
Insgesamt bietet das Boomerang Casino seinen Spielern eine Vielzahl von attraktiven Bonusangeboten, darunter auch Codes ohne Einzahlung. Diese ermöglichen es den Spielern, das Casino risikofrei zu testen und echte Gewinne zu erzielen. Wer also auf der Suche nach einem spannenden und großzügigen Online-Casino ist, sollte das Boomerang Casino definitiv in Betracht ziehen.
https://boomerangcasino.one/
В компании ЗАО «Автономный ЭнергоСервис» работают исключительно квалифицированные профессионалы. В сжатый срок выполним решения разной сложности с результативностью для заказчика. Гарантируем оперативные поставки энергетического оборудования и предлагаем грамотные консультации. https://mototech.ru – сайт, где найдете отзывы довольных клиентов. Вы приятно удивитесь качеством продукции, высокой культурой общения персонала и адекватной ценовой политикой. Мы готовы быть долгосрочным и надежным партнером, обращайтесь к нам уже сейчас.
Gogo Casino är ett av de senaste tillskotten på den svenska casinomarknaden och har snabbt blivit en favorit bland många spelare. I denna recension kommer vi att titta närmare på vad som gör Gogo Casino så populärt och vad du kan förvänta dig när du spelar där.
Ett av de första sakerna som man märker när man besöker Gogo Casino är dess moderna och användarvänliga design. Hemsidan är enkel att navigera och laddar snabbt, vilket gör det enkelt att hitta sina favoritspel och komma igång med spelandet.
NГ¤r det kommer till spelutbudet har Gogo Casino ett brett urval av spel frГҐn nГҐgra av de mest populГ¤ra spelleverantГ¶rerna pГҐ marknaden, inklusive NetEnt, Microgaming och Play’n GO. HГ¤r kan du hitta allt frГҐn klassiska spelautomater och bordsspel till live casino-spel dГ¤r du kan spela mot riktiga dealers.
En annan fördel med Gogo Casino är dess generösa bonusar och kampanjer. Nya spelare välkomnas med en stor insättningsbonus och freespins, medan befintliga spelare kan dra nytta av regelbundna kampanjer och lojalitetsprogram.
När det kommer till betalningsmetoder erbjuder Gogo Casino ett stort urval av alternativ för både insättningar och uttag, inklusive populära metoder som Swish, bankkort och e-plånböcker.
Slutligen är kundtjänsten på Gogo Casino tillgänglig dygnet runt via livechatt och e-post, vilket gör det lätt att få hjälp om man skulle stöta på problem eller ha frågor.
Sammanfattningsvis är Gogo Casino en utmärkt spelsajt för svenska spelare som letar efter en säker och underhållande spelupplevelse. Med sitt stora spelutbud, generösa bonusar och tillgängliga kundtjänst är det verkligen värt att ge Gogo Casino en chans.
https://gogocasino.one
Boomerang Casino Test: Ist dieses Online-Casino sein Geld wert?
Das Boomerang Casino ist eine beliebte Online-GlГјcksspielseite, die Spielern eine Vielzahl von Spielen und Promotionen bietet. Doch ist dieses Casino sein Geld wirklich wert? In diesem Test werden wir die wichtigsten Aspekte des Boomerang Casinos genauer unter die Lupe nehmen und herausfinden, ob es sich lohnt, dort zu spielen.
Das erste, was bei der Bewertung eines Online-Casinos berücksichtigt werden muss, ist die Sicherheit und Zuverlässigkeit der Seite. Das Boomerang Casino verfügt über eine gültige Lizenz der Malta Gaming Authority, die als eine der strengsten Glücksspielbehörden der Welt gilt. Dies bedeutet, dass das Casino den internationalen Standards entspricht und Fairness und Transparenz gewährleistet.
Ein weiterer wichtiger Aspekt ist die Spielauswahl. Das Boomerang Casino bietet Hunderte von Spielen von renommierten Anbietern wie NetEnt, Microgaming, Play’n GO und vielen anderen. Von Slots Гјber Tischspiele bis hin zu Live-Casino-Spielen ist fГјr jeden Geschmack etwas dabei. Die Spiele sind auch auf mobilen GerГ¤ten verfГјgbar, sodass Sie jederzeit und Гјberall spielen kГ¶nnen.
Natürlich ist auch der Kundenservice ein wichtiger Faktor bei der Bewertung eines Online-Casinos. Das Boomerang Casino bietet einen rund um die Uhr verfügbaren Live-Chat sowie eine E-Mail-Unterstützung, um sicherzustellen, dass alle Spieler Hilfe erhalten, wenn sie sie benötigen.
Was die Boni und Promotionen betrifft, so bietet das Boomerang Casino großzügige Willkommensboni für neue Spieler sowie regelmäßige Aktionen und Sonderangebote für bestehende Kunden. Diese Boni können Ihren Bankroll erheblich aufstocken und Ihnen mehr Chancen geben, zu gewinnen.
Zusammenfassend lässt sich sagen, dass das Boomerang Casino ein zuverlässiges und unterhaltsames Online-Casino ist, das sein Geld definitiv wert ist. Mit einer breiten Auswahl an Spielen, einer gültigen Lizenz und einem hervorragenden Kundenservice bietet das Casino ein rundum gelungenes Spielerlebnis. Wenn Sie also Lust auf ein spannendes und sicheres Glücksspielabenteuer haben, ist das Boomerang Casino definitiv einen Besuch wert.
https://boomerangcasino.one/
Gogo Casino är en spännande onlinekasinoplattform som har blivit mycket populär bland svenska spelare. Med ett stort urval av casinospel och generösa kampanjer har Gogo Casino lyckats skapa en unik spelupplevelse för alla sina användare.
En av de främsta fördelarna med Gogo Casino är dess smidiga och användarvänliga plattform. Hemsidan är enkel att navigera och erbjuder en enkel och snabb registreringsprocess. Dessutom kan spelarna njuta av ett brett utbud av casinospel, inklusive slots, bordsspel och live-dealerspel, från ledande spelleverantörer som NetEnt, Microgaming och Evolution Gaming.
Förutom det imponerande spelutbudet erbjuder Gogo Casino också generösa bonusar och kampanjer till sina spelare. Nya användare får en välkomstbonus vid sin första insättning, och befintliga spelare kan delta i regelbundna kampanjer och tävlingar för chansen att vinna kontantpriser, gratis spins och andra spännande belöningar.
Gogo Casino är också känt för sin trygga och säkra spelmiljö. Plattformen är licensierad av svenska Spelinspektionen och följer strikta regler och riktlinjer för att säkerställa rättvist spel och skydd av spelarnas personuppgifter.
Sammanfattningsvis är Gogo Casino en toppmodern kasinoplattform som erbjuder en rolig och spännande spelupplevelse för alla typer av spelare. Med sitt stora spelutbud, generösa bonusar och säkra spelmiljö är det inte konstigt att Gogo Casino har blivit en favorit bland svenska spelare. Besök Gogo Casino idag och upplev spänningen själv!
https://gogocasino.one
phising
scam
phising
Das Zet Casino hat für das Jahr 2021 einen exklusiven Promo-Code veröffentlicht, der Spielern die Möglichkeit bietet, von großzügigen Boni und Angeboten zu profitieren. Der Code kann bei der Registrierung oder bei der Einzahlung in das Casino eingegeben werden und gewährt den Spielern zusätzliche Boni wie Freispiele oder Bonusguthaben.
Mit dem Zet Casino Promo-Code 2021 können Spieler ihre Gewinnchancen erhöhen und länger spielen, ohne dabei ihr eigenes Geld riskieren zu müssen. Dies stellt eine großartige Möglichkeit für neue Spieler dar, das Casino kennenzulernen und sich mit den verschiedenen Spielen vertraut zu machen.
Das Zet Casino bietet eine Vielzahl von Spielen, darunter Slots, Tischspiele, Live-Casino-Spiele und vieles mehr. Mit dem Promo-Code können Spieler diese Spiele mit zusätzlichem Bonusguthaben entdecken und möglicherweise sogar den Jackpot knacken.
Es ist wichtig, den Promo-Code korrekt einzugeben, um sicherzustellen, dass man von den Angeboten profitieren kann. AuГџerdem sollten die Bonusbedingungen und -bedingungen genau gelesen werden, um sicherzustellen, dass man die Bedingungen erfГјllt und das Bonusguthaben erfolgreich in Echtgeld umwandeln kann.
Insgesamt bietet das Zet Casino Promo-Code 2021 eine großartige Möglichkeit, um noch mehr Spaß und Spannung beim Spielen zu erleben. Nutzen Sie den Code, um Ihre Gewinnchancen zu erhöhen und die Vielfalt der Spiele im Casino zu entdecken. Viel Glück und viel Spaß beim Spielen!
https://zetcasino.one/
https://www.just.edu.jo/Lists/Survey/DispForm.aspx?ID=6987
synthesis a-pvp
synthesis a-pvp
https://satitmattayom.nrru.ac.th/?dwqa-question=synthesizing-%ce%b1-pyrrolidinopentiophenone
blibliblu
Wenn Sie regelmäßig in Online-Casinos spielen, ist es wichtig zu wissen, wie Sie Ihr Casino-Guthaben auf Ihr Tipico-Konto einzahlen können. Dieser Artikel gibt Ihnen eine Schritt-für-Schritt-Anleitung, wie Sie Ihr Guthaben sicher und einfach aufladen können.
Schritt 1: Erstellen Sie ein Tipico-Konto
Bevor Sie Ihr Casino-Guthaben auf Ihr Tipico-Konto einzahlen können, müssen Sie zunächst ein Konto bei Tipico erstellen. Dies ist ein einfacher Prozess, bei dem Sie Ihre persönlichen Daten eingeben und ein Passwort erstellen müssen. Stellen Sie sicher, dass Sie alle Informationen korrekt eingeben, um Probleme bei der Einzahlung zu vermeiden.
Schritt 2: Wählen Sie die Einzahlungsmethode
Sobald Sie Ihr Tipico-Konto erstellt haben, müssen Sie die Einzahlungsmethode auswählen, mit der Sie Ihr Casino-Guthaben aufladen möchten. Tipico bietet verschiedene Zahlungsmethoden wie Kreditkarte, Banküberweisung, Paysafecard und E-Wallets wie PayPal und Skrill an. Wählen Sie die Methode, die am besten zu Ihnen passt und die Ihnen am bequemsten ist.
Schritt 3: Geben Sie den Einzahlungsbetrag ein
Nachdem Sie die Einzahlungsmethode ausgewählt haben, müssen Sie den Betrag eingeben, den Sie auf Ihr Tipico-Konto einzahlen möchten. Stellen Sie sicher, dass Sie den Mindesteinzahlungsbetrag nicht unterschreiten, um die Einzahlung erfolgreich abzuschließen.
Schritt 4: Bestätigen Sie die Einzahlung
Sobald Sie den Einzahlungsbetrag eingegeben haben, bestätigen Sie die Transaktion, um Ihr Casino-Guthaben auf Ihr Tipico-Konto einzuzahlen. Stellen Sie sicher, dass alle Informationen korrekt sind, um mögliche Probleme zu vermeiden.
Schritt 5: ГњberprГјfen Sie Ihr Tipico-Konto
Nachdem Sie die Einzahlung abgeschlossen haben, überprüfen Sie Ihr Tipico-Konto, um sicherzustellen, dass das Guthaben erfolgreich aufgeladen wurde. Sie können jetzt mit dem Spielen in Ihrem Lieblings-Casino beginnen und hoffentlich einige Gewinne erzielen.
Zusammenfassend lässt sich sagen, dass die Einzahlung Ihres Casino-Guthabens auf Ihr Tipico-Konto ein einfacher Prozess ist, der nur wenige Schritte erfordert. Stellen Sie sicher, dass Sie die richtige Einzahlungsmethode wählen und den Einzahlungsbetrag korrekt eingeben, um Ihr Konto erfolgreich aufzuladen. Viel Glück beim Spielen!
https://tipicocasino.one/
воєнторг
4. Специализированный магазин для военных
магазин воєнторг київ [url=https://voentorgaseh.kiev.ua/]військовий магазин[/url] .
Tipico Casino APK – Die beste Art, auf dem Handy zu spielen
Das Tipico Casino APK ist eine innovative und praktische Möglichkeit, um auf dem Handy zu spielen. Mit dieser App können Spieler ihre Lieblingsspiele bequem von unterwegs aus spielen, ohne an einen Computer gebunden zu sein. Die Tipico Casino APK ist leicht zu installieren und bietet eine benutzerfreundliche Oberfläche, die es einfach macht, auf die verschiedenen Spiele zuzugreifen.
Die Tipico Casino APK bietet eine Vielzahl von Spielen, darunter Slots, Tischspiele und Live-Dealer-Spiele. Die Spieler können aus einer Vielzahl von beliebten Titeln wählen, die für ein unterhaltsames Spielerlebnis sorgen. Die Spiele sind von führenden Softwareanbietern entwickelt worden, was für eine hohe Qualität und ein reibungsloses Spielerlebnis sorgt.
Darüber hinaus bietet die Tipico Casino APK auch großzügige Boni und Aktionen für Spieler. Neue Spieler können von Willkommensboni profitieren, die zusätzliches Geld oder Freispiele bieten. Es gibt auch regelmäßige Promotionen für bestehende Spieler, die ihre Bankroll aufbessern können.
Die Tipico Casino APK ist nicht nur eine praktische Möglichkeit, um auf dem Handy zu spielen, sondern sie bietet auch eine sichere und geschützte Spielumgebung. Die App verwendet innovative Sicherheitstechnologien, um sicherzustellen, dass die persönlichen und finanziellen Daten der Spieler geschützt sind. Die Spieler können also mit ruhigem Gewissen spielen, ohne sich um die Sicherheit ihrer Informationen sorgen zu müssen.
Insgesamt ist das Tipico Casino APK eine großartige Option für Spieler, die gerne unterwegs spielen möchten. Die App bietet eine Vielzahl von Spielen, großzügige Boni und eine sichere Spielumgebung, die ein erstklassiges Spielerlebnis bietet. Probieren Sie es noch heute aus und erleben Sie die Spannung und den Spaß des Tipico Casinos auf Ihrem Handy.
https://tipicocasino.one/
Unleash the Power of Innovation with 18ps.ru – Your Key to Dominating the Plastic Processing Arena! In a market saturated with mediocre options, 18ps.ru shines as the beacon of excellence. Why settle for subpar equipment when you can invest in a solution that guarantees success? With state-of-the-art technology and unrivaled expertise, we’re not just selling machines – we’re selling a competitive edge. Say goodbye to inefficiency and hello to profitability with 18ps.ru by your side. Join the ranks of industry leaders who refuse to compromise on quality and watch your business soar to new heights. Choose 18ps.ru and leave your competitors in the dust!
Eng.18ps.ru – [url=https://eng.18ps.ru/catalog/plastic-recycling-equipment/]plastic recycling machine[/url]
synthesis a-pvp
blablablu
The Choice is Clear: 18ps.ru is Your Pathway to Plastic Processing Prosperity! Let’s face it – in today’s competitive market, only the strong survive. That’s why savvy entrepreneurs choose 18ps.ru for all their plastic processing needs. With a track record of excellence and a commitment to innovation, we’re not just another equipment provider – we’re your partner in success. From streamlining production processes to maximizing efficiency, our top-of-the-line machinery sets the standard for excellence in the industry. Don’t settle for second best when you can have the best – choose 18ps.ru and take your business to new heights of success!
Eng.18ps.ru – [url=https://eng.18ps.ru/]equipment production plant[/url]
blolbo
scam
Zet Casino ist eine beliebte Online-GlГјcksspielplattform, die eine Vielzahl von Spielen fГјr die Spieler zur Auswahl bietet. Mit einer groГџen Auswahl an Slots, Tischspielen und Live-Casino-Spielen gibt es fГјr jeden etwas in diesem Casino.
Einige der besten Spiele bei Zet Casino sind unter anderem die Slots von renommierten Anbietern wie NetEnt, Microgaming und Play’n GO. Diese Spiele bieten nicht nur eine spannende Spielerfahrung, sondern auch die Chance, groГџe Gewinne zu erzielen.
Zu den beliebtesten Slots bei Zet Casino gehГ¶ren Spiele wie Starburst, Book of Dead und Gonzo’s Quest. Diese Spiele zeichnen sich durch ihre hochwertige Grafik, spannende Bonusrunden und hohe Auszahlungsquoten aus, was sie zu den Favoriten vieler Spieler macht.
Aber auch Fans von Tischspielen kommen bei Zet Casino auf ihre Kosten. Von klassischen Spielen wie Blackjack und Roulette bis hin zu exotischeren Varianten wie Baccarat und Pai Gow Poker gibt es eine Vielzahl von Optionen, aus denen die Spieler wählen können.
FГјr diejenigen, die das authentische Casino-Erlebnis bevorzugen, bietet Zet Casino auch eine Vielzahl von Live-Casino-Spielen an. Von Live-Blackjack und Live-Roulette bis hin zu Live-Baccarat und Live-Casino Hold’em kГ¶nnen die Spieler gegen echte Dealer antreten und das GefГјhl haben, in einem echten Casino zu spielen.
Insgesamt bietet Zet Casino eine breite Palette von Spielen für alle Arten von Spielern. Mit seiner benutzerfreundlichen Oberfläche, großzügigen Boni und einer Vielzahl von Zahlungsoptionen ist es kein Wunder, dass es zu den beliebtesten Online-Casinos gehört. Probieren Sie also einige der besten Spiele bei Zet Casino aus und erleben Sie den Nervenkitzel des Glücksspiels von Ihrem eigenen Zuhause aus.
https://zetcasino.one/
synthesis a-pvp
bluatblaaotuy
Join the Plastic Revolution with 18ps.ru – Where Recycling is Cool and Production is Positively Rad! Picture this: you, rocking a pair of neon sunglasses, while our state-of-the-art equipment does all the heavy lifting. From turning old soda bottles into groovy granules to crafting radical polymer sand tiles, we’ve got the tools to make you the envy of the recycling scene. And with prices so low, you’ll have plenty of cash left over to invest in some righteous dance moves. So grab your legwarmers and your best fanny pack – it’s time to join the plastic revolution with 18ps.ru. Because when it comes to saving the planet, there’s no time for being lame!
Eng.18ps.ru – [url=https://eng.18ps.ru/]equipment for the production of polymer sand tiles[/url]
Скай Лайн Консалтинг – известная компания, предлагающая полный спектр бухгалтерского сопровождения. У нас собрана команда истинных профессионалов. Все специалисты имеют приличный опыт работы и профильное образование. Доверьте им кадровое делопроизводство и оформление юридических документов. https://slc-company.ru/ – сайт, где можете в любое удобное для вас время ознакомиться с отзывами довольных клиентов. Обращайтесь к нам, гарантируем грамотное и быстрое решение вопросов. Стремимся к выгодному сотрудничеству!
Das Tipico Casino ist eine beliebte Plattform fГјr GlГјcksspiele, die eine Vielzahl von Spielautomaten und klassischen Casino-Spielen bietet. Eines der beliebtesten Spiele im Tipico Casino ist “Eye of Horus”, ein Slot-Spiel mit einem Г¤gyptischen Thema.
In Eye of Horus dreht sich alles um die altägyptische Gottheit Horus und die mythischen Symbole des alten Ägypten. Der Spielautomat verfügt über 5 Walzen und 10 Gewinnlinien, auf denen Spieler ihre Einsätze platzieren können. Mit tollen Grafiken und Animationen entführt das Spiel die Spieler in die Welt des alten Ägypten.
Das Besondere an Eye of Horus sind die verschiedenen Bonusfunktionen, die dem Spiel Spannung und Unterhaltung verleihen. Dazu gehören Wild-Symbole, Scatter-Symbole und Freispielrunden, die mit besonderen Multiplikatoren ausgestattet sind. Diese Funktionen erhöhen die Gewinnchancen der Spieler und sorgen für zusätzliche Spannung beim Spielen.
Eye of Horus ist ein äußerst populäres Spiel im Tipico Casino, das von vielen Spielern gerne gespielt wird. Mit seiner interessanten Thematik, den tollen Grafiken und den lukrativen Bonusfunktionen bietet der Spielautomat eine unterhaltsame und spannende Spielerfahrung.
Wer Lust hat, sich auf eine Reise ins alte Г„gypten zu begeben und dabei auch noch die Chance auf hohe Gewinne zu haben, sollte das Spiel Eye of Horus im Tipico Casino ausprobieren. Mit etwas GlГјck kann man hier tolle Preise gewinnen und ein unvergessliches Spielerlebnis genieГџen.
https://tipicocasino.one/
באתר . לעיסוי ארוטי בירושלים יתרונות רבים הגלומים בו – עיסוי ארוטי מפנק מחכה לך כבר עכשיו וזמין תמידית בכל ימות ליווי ברונטיות, נערות ליווי צעירות, נערות ליווי ג’ינג’יות, נערות ליווי בלונדיניות ועוד קטגוריות רבות מחכות לכם אצלנו באתר, . להגשים. כאן תוכלו נערות ליווי באשדוד
נעים, צוות האתר – . דירות דיסקרטיות חדרה כמה פעמים רציתם לבלות דירות דיסקרטיות במרכז? מעוניינים למצוא דירה דיסקרטית בבת ים? רוצים הכוונה מדוייקת לדירה דיסקרטית בחולון? הגעתם למקום הנכון. חוד החנית של דירות דיסקרטיות בצפון. הסטנדרט האחיד מאפשר לדירות שירות ליווי בחיפה
Gogo Casino är en relativt ny aktör på den svenska spelmarknaden som har snabbt blivit populär bland spelare. Men hur bra är egentligen Gogo Casino? Vi tar en närmare titt på deras tjänster och erbjudanden för att ge dig en ärlig och detaljerad recension av detta online casino.
Gogo Casino drivs av det maltesiska fГ¶retaget Viral Interactive Limited och har en svensk spellicens vilket innebГ¤r att de fГ¶ljer de strГ¤nga regler och lagar som gГ¤ller pГҐ den svenska spelmarknaden. De erbjuder ett brett utbud av spel frГҐn kГ¤nda leverantГ¶rer som NetEnt, Microgaming och Play’n GO vilket innebГ¤r att du kan spela populГ¤ra spelautomater, bordsspel och live casino-spel.
En av de stora fördelarna med Gogo Casino är att de har snabba uttag vilket innebär att du kan få dina vinster utbetalda på bara några minuter. De erbjuder även en välkomstbonus för nya spelare samt regelbundna kampanjer och erbjudanden för befintliga spelare vilket gör att du kan få extra pengar att spela för.
När det gäller kundtjänst så har Gogo Casino en professionell och tillmötesgående support som är tillgänglig via live chatt och e-post dygnet runt. De strävar alltid efter att ge sina spelare den bästa möjliga spelupplevelsen och är alltid redo att hjälpa till om det skulle uppstå några problem.
Sammanfattningsvis så kan vi konstatera att Gogo Casino är ett pålitligt och seriöst online casino som erbjuder ett brett utbud av spel och snabba uttag. De har en användarvänlig och snygg design samt en bra kundtjänst vilket gör att de definitivt är värda att prova på för alla som är intresserade av att spela casino online. Vi ger Gogo Casino ett starkt omdöme och rekommenderar det till alla som letar efter en bra spelupplevelse.
https://gogocasino.one
blobloblu
להגיע אליהם בצורה שקטה וסודית. דירות דיסקרטיות באשקלון מעוצבות בטוב טעם ומהוות חוד החנית של דירות כך תלוי רק בכם. איך מוצאים דירה דיסקרטית בירושלים? כאן תוכל למצוא מגוון רחב של דירות סקס בירושלים והסביבה כולל כתובות, טלפונים הלקוח ירגיש שהוא הגיע הביתה דירות סקס בחיפה
Das Zet Casino bietet seinen Spielern eine Vielzahl von aufregenden Möglichkeiten, um ihr Spielerlebnis zu maximieren. Eines dieser Angebote ist der Zet Casino no deposit bonus, der es Spielern ermöglicht, zusätzliches Guthaben zu erhalten, ohne eine Einzahlung tätigen zu müssen.
Ein no deposit bonus ist eine großartige Möglichkeit für Spieler, das Casino kennenzulernen und erste Gewinne zu erzielen, ohne eigenes Geld riskieren zu müssen. Der Zet Casino no deposit bonus ist besonders attraktiv, da er großzügige Belohnungen und Freispiele ohne Einzahlung bietet.
Um den Zet Casino no deposit bonus zu erhalten, müssen Spieler lediglich ein Konto im Casino erstellen und den entsprechenden Bonuscode eingeben. Anschließend werden die Bonusgelder und Freispiele automatisch gutgeschrieben, und die Spieler können sofort mit dem Spielen beginnen.
Es ist jedoch wichtig zu beachten, dass no deposit boni in der Regel bestimmten Umsatzbedingungen unterliegen, die erfüllt werden müssen, bevor Gewinne aus dem Bonusguthaben ausgezahlt werden können. Spieler sollten daher die Allgemeinen Geschäftsbedingungen sorgfältig lesen, um sicherzustellen, dass sie die Bonusbedingungen verstehen und erfüllen können.
Insgesamt ist der Zet Casino no deposit bonus eine großartige Möglichkeit für Spieler, das Casino kostenlos zu erkunden und erste Gewinne zu erzielen. Mit großzügigen Belohnungen und Freispielen ohne Einzahlung bietet der no deposit bonus Spielern die Möglichkeit, ihre Lieblingsspiele zu genießen und gleichzeitig die Chance auf lukrative Gewinne zu haben.
https://zetcasino.one/
scam
phising
phising
מלווה בצוות מסביב לשעון שמחכה להזמנה בכל שעה ומאפשר ספונטניות יוצאת דופן. כל מה שנותר לכם זה לחפש באתרינו דירה דיסקרטית מושלמת אנו באתר אקס פיינדר מצליחים לאתר את הבנות המגיעות לישראל שיפרסמו אצלנו נניח נערת ליווי שהייתה כאן אנו דואגים לשמור איתן על קשר סקס ירושלים
Gogo Casino är en populär online-spelsajt som erbjuder ett brett utbud av casinospel och slots för sina spelare. För att nå ut till en större publik och skapa en stark närvaro på marknaden har Gogo Casino etablerat partnerskap med ledande spelleverantörer och affiliates.
Genom att samarbeta med partners som förser dem med högkvalitativa spel, kan Gogo Casino erbjuda sina spelare en spännande och underhållande spelupplevelse. Deras partners är noga utvalda för att säkerställa att spelutbudet är varierat och av hög standard. Genom att erbjuda populära spel från kända leverantörer som NetEnt, Microgaming och Yggdrasil kan Gogo Casino attrahera en bred publik av spelare.
För att marknadsföra sitt varumärke och locka nya spelare har Gogo Casino också partnerskap med affiliates som hjälper till att sprida information om deras spelsajt. Genom att samarbeta med affiliates kan Gogo Casino nå ut till en större målgrupp och locka nya spelare till sin sajt. Affiliates får en provision baserad på antalet spelare de lyckas referera till Gogo Casino, vilket skapar en win-win-situation för båda parter.
Gogo Casino strävar efter att skapa långsiktiga och lönsamma partnerskap med både spelleverantörer och affiliates för att fortsätta växa och förbättra sin verksamhet. Genom att erbjuda en säker och pålitlig spelplattform samt ett brett utbud av spel, har Gogo Casino blivit en populär destination för spelare som söker en spännande spelupplevelse online.
I och med sina partnerskap med ledande spelleverantörer och affiliates, har Gogo Casino etablerat sig som en av de främsta online-spelsajterna på marknaden. Med ett ständigt växande utbud av spel och en engagerad kundtjänst, är Gogo Casino en spelsajt som fortsätter att locka och behålla spelare från hela världen.
https://gogocasino.one
Das Boomerang Casino lockt neue Spieler mit einem groГџzГјgigen Angebot: 50 Freispiele ohne Einzahlung! Dieses Angebot ist perfekt fГјr alle, die gerne umsonst spielen und dabei die Chance haben, echtes Geld zu gewinnen.
Um die 50 Freispiele zu erhalten, müssen Sie sich lediglich im Boomerang Casino anmelden. Es ist keine Einzahlung erforderlich, um von diesem Angebot zu profitieren. Sobald Sie sich angemeldet haben, können Sie die Freispiele nutzen und Ihr Glück versuchen.
Die Freispiele können an ausgewählten Spielautomaten verwendet werden, die im Boomerang Casino verfügbar sind. Mit etwas Glück können Sie dabei große Gewinne erzielen und Ihr Spielerkonto ordentlich auffüllen.
Das Boomerang Casino bietet eine Vielzahl von Spielen, darunter Slots, Tischspiele und Live-Casino-Spiele. Es stehen auch verschiedene Zahlungsmethoden zur VerfГјgung, sodass Ein- und Auszahlungen bequem und sicher vonstattengehen.
Also zögern Sie nicht und sichern Sie sich Ihre 50 Freispiele ohne Einzahlung im Boomerang Casino. Viel Spaß und viel Glück beim Spielen!
https://boomerangcasino.one/
nice content!nice history!!
Gogo Casino Recension
Gogo Casino är en relativt ny spelplattform på den svenska marknaden som lanserades år 2019. Med ett fokus på snabba och smidiga spelupplevelser, har Gogo Casino snabbt blivit populärt bland spelare som föredrar att spela online.
Ett av de främsta fördelarna med Gogo Casino är dess enkla och användarvänliga design som gör det lätt att navigera på sidan. Dessutom erbjuder de ett brett utbud av spel från kända leverantörer som NetEnt, Microgaming och Yggdrasil, vilket garanterar en varierad och underhållande spelupplevelse för spelare.
En annan fördel med Gogo Casino är deras generösa välkomstbonus för nya spelare. Genom att registrera sig på plattformen kan spelare ta del av en bonus som ger dem extra pengar att spela för, vilket ökar chanserna att vinna stora vinster.
För de spelare som föredrar att spela på mobila enheter, erbjuder Gogo Casino också en mobilanpassad version av sin plattform som gör det möjligt att spela favoritspel var som helst och när som helst.
Sammanfattningsvis kan vi konstatera att Gogo Casino är en pålitlig och underhållande spelplattform som erbjuder ett brett utbud av spel och generösa bonusar för sina spelare. Med sin enkla design och användarvänliga gränssnitt är Gogo Casino definitivt värt att prova för alla som är intresserade av att spela online.
https://gogocasino.one
Фильмок тв предоставляет для вас лучшие фильмы. Вы можете в любое время смотреть их онлайн совершенно бесплатно. На странице каждого фильма расписано абсолютно все, а именно: год, страна, жанр, режиссер, актерский состав. Это дает возможность принять правильное решение о выборе кинокартины. https://filmok.tv – сайт, где есть удобный поиск, примените его. Фильмы и сериалы ждут именно вас. Мы гарантируем отменный звук и картинку. Заходите уже сейчас на наш сайт, смотрите интересующий фильм и получайте удовольствие!
Das Boomerang Casino Logo ist ein einzigartiges und auffälliges Design, das die Aufmerksamkeit der Spieler auf sich zieht. Das Logo besteht aus einem roten und weißen Boomerang, der sich dynamisch über einem blauen Hintergrund dreht.
Das Casino-Logo spiegelt die Energie und Spannung wider, die die Spieler beim Spielen im Boomerang Casino erleben können. Der rote und weiße Farbton des Boomerangs symbolisiert auch Glück und Erfolg, was das Logo zu einem perfekten Symbol für ein Glücksspielunternehmen macht.
Die geschwungene Form des Boomerangs im Logo verleiht ihm ein dynamisches und modernes Aussehen, das sich von anderen Casino-Logos abhebt. Dies macht das Boomerang Casino Logo leicht erkennbar und gut fГјr die Markenbildung.
Das Logo des Boomerang Casinos trägt auch dazu bei, dass sich die Spieler mit der Marke identifizieren und eine starke Bindung zu dem Unternehmen aufbauen. Wenn Spieler das Logo sehen, werden sie sofort an das aufregende und unterhaltsame Spielerlebnis erinnert, das sie im Boomerang Casino genießen können.
Insgesamt ist das Boomerang Casino Logo ein gelungenes Beispiel für ein kreatives und wirkungsvolles Design, das die Marke des Unternehmens effektiv repräsentiert und die Aufmerksamkeit der Spieler auf sich zieht. Es ist ein Symbol für Glück, Erfolg und Spaß – genau das, was man von einem erstklassigen Online-Casino erwarten kann.
https://boomerangcasino.one/
1249742
bliloblo
Möchten Sie Ihren Account bei Zet Casino löschen? In diesem Artikel erfahren Sie, wie Sie dies einfach und unkompliziert tun können.
Um Ihren Account bei Zet Casino zu lГ¶schen, mГјssen Sie sich zunГ¤chst auf der Website des Casinos anmelden. Gehen Sie dann zu den Einstellungen Ihres Profils und suchen Sie nach der Option “Account lГ¶schen”. Klicken Sie darauf und folgen Sie den Anweisungen, um Ihren Account endgГјltig zu lГ¶schen.
Es ist wichtig zu beachten, dass Sie keine offenen Wetten oder Boni auf Ihrem Konto haben sollten, bevor Sie es löschen. Andernfalls müssen Sie diese zuerst einlösen oder aufbrauchen, bevor der Löschvorgang abgeschlossen werden kann.
Wenn Sie Ihren Account löschen, werden alle Ihre persönlichen Daten und Kontoinformationen dauerhaft aus der Datenbank des Casinos entfernt. Sie können dann nicht mehr auf Ihr Konto zugreifen und alle damit verbundenen Dienstleistungen nutzen.
Es ist ratsam, alle offenen Transaktionen und Guthaben abzuwickeln, bevor Sie Ihren Account löschen, um eventuelle Missverständnisse oder Probleme zu vermeiden.
Wir hoffen, dass dieser Artikel Ihnen geholfen hat, Ihren Account bei Zet Casino erfolgreich zu löschen. Wenn Sie weitere Fragen haben oder Unterstützung benötigen, können Sie sich jederzeit an den Kundendienst des Casinos wenden.
https://zetcasino.one/
https://www.tapatalk.com/groups/renotalkfr/viewtopic.php?f=45&t=244927&from_new_topic=1
https://usa.life/read-blog/52578
blablablu
blabla
Tipico Live Casino Verboten
Das Tipico Live Casino Angebot gehört zu den beliebtesten Optionen für Spieler, die gerne die Atmosphäre eines echten Casinos in ihren eigenen vier Wänden genießen möchten. Jedoch gab es kürzlich eine unerwartete Entwicklung: Das Tipico Live Casino wurde verboten.
Genauere Details über die Gründe für dieses Verbot sind bisher nicht bekannt, jedoch wird spekuliert, dass es möglicherweise mit regulatorischen Vorschriften oder anderen rechtlichen Bedenken zu tun haben könnte. Da Tipico eine der beliebtesten Wettanbieter in Deutschland ist, hat diese Entscheidung viele Fans enttäuscht.
Für diejenigen, die gerne im Tipico Live Casino gespielt haben, bedeutet dies, dass sie sich nach alternativen Online-Casinos umsehen müssen, um ihr Lieblingsspiel weiterhin zu genießen. Es gibt viele andere Online-Casinos, die ähnliche Live Casino Angebote haben, aber es könnte schwierig sein, eines zu finden, das die gleiche Qualität und Vielfalt wie das Tipico Live Casino bietet.
Es bleibt abzuwarten, ob und wann das Verbot des Tipico Live Casinos aufgehoben wird, aber in der Zwischenzeit müssen die Fans des Live Casinos sich nach anderen Möglichkeiten umsehen. Es ist eine enttäuschende Entwicklung für alle, die das Tipico Live Casino genossen haben, aber hoffentlich finden sie bald eine andere Möglichkeit, ihre Leidenschaft für das Glücksspiel auszuleben.
https://tipicocasino.one/
bluatblaaotuy
Tipico ist einer der führenden Anbieter von Online-Casinospielen in Deutschland. Eine der beliebtesten Aktionen von Tipico sind die Casino Freispiele, die den Spielern die Möglichkeit bieten, kostenlos an ausgewählten Spielautomaten zu spielen. In diesem Artikel werden wir uns genauer mit den Casino Freispielen bei Tipico befassen.
Die Casino Freispiele bei Tipico sind eine großartige Möglichkeit, neue Spiele auszuprobieren und dabei echtes Geld zu gewinnen. Die Freispiele können auf verschiedene Arten erhalten werden, zum Beispiel als Willkommensbonus für neue Spieler oder als regelmäßige Aktionen für bestehende Kunden. Oftmals sind die Freispiele an bestimmte Spielautomaten gebunden, sodass die Spieler die Chance haben, die verschiedenen Titel des Casinos kennenzulernen.
Um die Casino Freispiele bei Tipico nutzen zu können, müssen die Spieler in der Regel bestimmte Umsatzbedingungen erfüllen. Diese können beispielsweise die Anzahl der Male sein, die der Gewinn aus den Freispielen umgesetzt werden muss, bevor er ausgezahlt werden kann. Es ist wichtig, die Bedingungen für die Freispiele genau zu prüfen, um sicherzustellen, dass man das Maximum aus der Aktion herausholen kann.
Zusätzlich zu den regulären Casino Freispielen bietet Tipico auch immer wieder spezielle Aktionen und Turniere an, bei denen die Spieler extra Freispiele oder andere Bonusangebote gewinnen können. Es lohnt sich daher, regelmäßig die Promotionsseite von Tipico zu besuchen, um keine der lukrativen Angebote zu verpassen.
Insgesamt sind die Casino Freispiele bei Tipico eine attraktive Möglichkeit, kostenlos an spannenden Spielautomaten zu spielen und dabei echte Gewinne zu erzielen. Mit den regelmäßigen Aktionen und Sonderangeboten bietet Tipico seinen Kunden immer wieder neue Anreize, um das Casino-Abenteuer noch aufregender zu gestalten.
Wenn Sie also auf der Suche nach Unterhaltung und Gewinnmöglichkeiten sind, lohnt es sich, die Casino Freispiele bei Tipico in Anspruch zu nehmen und Ihr Glück an den Spielautomaten zu versuchen. Viel Spaß und Erfolg!
https://tipicocasino.one/
[url=https://www.sergiev-posad.ru/useful/?id=14355]Левша Фото ремонта холодильников[/url].
[url=http://vnoginske.ru/12422-remont-xolodilnikov-v-noginske.html]levsha Ремонт холодильников самсунг на дому в[/url].
[url=https://moskva.2rus.org/levsha-master/]levsha-remont.ru Мастер по ремонту холодильника на дом[/url].
[url=http://vnoginske.ru/12422-remont-xolodilnikov-v-noginske.html]Диагностика холодильника на дому цена Левша[/url].
[url=https://www.jobinmoscow.ru/text.php?link=2448]Ремонт холодильников на дому недорого в цены Левша Ремонт[/url].
[url=https://bashny.net/admin/2018/03/11/remont-holodilnikov-na-domu-obzor-preimuschestv-udobnogo-servisa.html]Мастер по ремонту холодильников на дому levsha-remont[/url].
[url=https://www.fcw.su/poleznaja-43/prodlevaem-srok-sluzhby-stiralnoi-mashiny.html]Ремонт холодильной техники[/url].
[url=https://www.abcsport.ru/shop-kids/office/4020.php]Диагностика холодильника на дому цена[/url].
[url=https://bashny.net/admin/2018/03/11/remont-holodilnikov-na-domu-obzor-preimuschestv-udobnogo-servisa.html]Вызвать мастера по ремонту холодильников[/url].
[url=https://stimul.kiev.ua/articles.htm?a=remont-holodilnikov-sharp]Ремонт холодильника цены[/url].
blablablu
blublun
Das Boomerang Casino bietet seinen Spielern eine einzigartige MГ¶glichkeit, Geld zurГјck zu erhalten. Mit dem sogenannten “Boomerang Cashback” Programm kГ¶nnen Spieler einen Teil ihrer Verluste zurГјckerhalten.
Das Prinzip ist einfach: Spieler sammeln Punkte, indem sie im Casino spielen. Je mehr Punkte sie sammeln, desto mehr Geld können sie zurückerhalten. Die Rückzahlungen erfolgen in Form von Bonusgeld, das wiederum im Casino eingesetzt werden kann.
Das Boomerang Casino ist eines der wenigen Online-Casinos, das ein solches Cashback-Programm anbietet. Viele Spieler schätzen diese Möglichkeit, da sie so die Chance haben, einen Teil ihrer Verluste wieder gutzumachen.
Um von dem Boomerang Cashback zu profitieren, müssen Spieler lediglich im Casino spielen und Punkte sammeln. Je mehr sie spielen, desto mehr Geld können sie zurückerhalten.
Insgesamt ist das Boomerang Casino Geld Zurück Programm eine attraktive Option für Spieler, die gerne im Online-Casino spielen. Es bietet die Möglichkeit, Verluste zu minimieren und gleichzeitig mehr Spaß beim Spielen zu haben.
https://boomerangcasino.one/
1SS3D249742
lost money
phising
lost money
phising
Ремонт ноутбуков Lenovo любой сложности: от замены клавиатуры до переустановки системы. Обращайтесь в https://servisnyjcentr-lenovo.ru/.
[url=https://servisnyjcentr-lenovo.ru/]ремонт lenovo[/url]
замена аккумулятора в планшете леново
замена жесткого диска lenovo
замена аккумулятора планшета леново
Tipico Casino Geld Гјbertragen
Das Tipico Casino bietet seinen Kunden die Möglichkeit, Geld für das Glücksspiel zu übertragen. Dabei gibt es verschiedene Optionen, um Einzahlungen zu tätigen und Gewinne auszahlen zu lassen.
Einzahlungen können bequem und sicher über verschiedene Zahlungsmethoden wie Kreditkarten, Banküberweisungen, E-Wallets oder Prepaid-Karten getätigt werden. Es ist wichtig zu beachten, dass die Verfügbarkeit der einzelnen Zahlungsmethoden je nach Land, in dem man sich befindet, variieren kann. Deshalb sollten sich Spieler vorab über die zur Verfügung stehenden Optionen informieren.
Um Geld zu übertragen, müssen Spieler zunächst ein Konto bei Tipico Casino erstellen und sich anmelden. Anschließend können sie eine Einzahlung vornehmen, indem sie auf der Webseite des Casinos ihre bevorzugte Zahlungsmethode auswählen und den gewünschten Betrag eingeben.
Gewinne können ebenfalls auf verschiedene Arten ausgezahlt werden. Spieler können ihre Gewinne per Banküberweisung, auf ihre Kreditkarte oder in Form von E-Wallets wie PayPal oder Skrill erhalten. Die Auszahlungsdauer variiert je nach Zahlungsmethode und kann zwischen einigen Stunden und mehreren Tagen liegen.
Es ist wichtig zu beachten, dass das Tipico Casino bestimmte Bonusbedingungen hat, die Spieler erfüllen müssen, um ihre Gewinne auszahlen zu lassen. Dazu gehört unter anderem, dass der Bonus- und Einzahlungsbetrag eine bestimmte Anzahl an Malen umgesetzt werden muss, bevor eine Auszahlung möglich ist.
Insgesamt bietet das Tipico Casino seinen Kunden eine sichere und zuverlässige Möglichkeit, Geld zu übertragen und am Glücksspiel teilzunehmen. Spieler sollten jedoch immer verantwortungsbewusst spielen und sich über die geltenden Gesetze und Regulierungen in ihrem Land informieren, um mögliche rechtliche Probleme zu vermeiden.
https://tipicocasino.one/
I have been surfing online more than 2 hours today, yet I never found any interesting article like yours. It’s pretty worth enough for me. In my view, if all site owners and bloggers made good content as you did, the net will be a lot more useful than ever before.
I’ll right away grasp your rss feed as I can’t find your e-mail subscription hyperlink or newsletter service. Do you have any? Kindly let me recognise in order that I could subscribe. Thanks.
https://sinee9v4w-nebo0a8f-golova3d9v.com
Разработка товаров в 3D arigami.tech
По запросу [url=https://arigami.tech/augmented_reality]3д визуализация товара для карточки товара[/url] Вы на правильном пути. Мы гарантируем превосходное реалистичное качество после перехода его в 3D вид. Весьма просто будет взаимодействовать с виджетом, изменяя в настоящем времени вариации, цвета, размеры. Исключительный путь к продажам может дать Вам известность и неповторимость в данной сфере. Многие заказчики подчеркивают, что делать покупки приятнее и быстрее с выбором при обзоре 3D виджетов.
Boomerang Casino Erfahrungen
Das Boomerang Casino ist ein Online-Casino, das seinen Kunden eine groГџe Auswahl an Spielen und ein einzigartiges Spielerlebnis bietet. Doch wie sind die Erfahrungen der Spieler mit diesem Casino?
Viele Spieler loben das Boomerang Casino für sein breites Spektrum an Spielen. Von klassischen Tischspielen wie Blackjack und Roulette bis hin zu modernen Video-Slots ist für jeden Geschmack etwas dabei. Die Spiele stammen von renommierten Softwareanbietern wie NetEnt, Microgaming und Playtech, was für eine hohe Qualität und Fairness der Spiele spricht.
Auch die Boni und Aktionen im Boomerang Casino können sich sehen lassen. Neue Spieler erhalten oft großzügige Willkommensboni, und auch Bestandskunden werden regelmäßig mit Freispielen und Reload-Boni belohnt. Die Umsatzbedingungen sind fair und transparent, was von vielen Spielern positiv hervorgehoben wird.
Ein weiterer Pluspunkt des Boomerang Casinos ist der Kundenservice. Die Mitarbeiter sind freundlich, kompetent und rund um die Uhr erreichbar. Probleme und Anliegen werden schnell und effizient gelöst, was für viele Spieler ein wichtiges Kriterium bei der Wahl eines Online-Casinos ist.
Natürlich gibt es auch negative Erfahrungen mit dem Boomerang Casino. Einige Spieler bemängeln zum Beispiel die begrenzten Zahlungsmöglichkeiten oder die langen Auszahlungszeiten. Auch die mobile App des Casinos könnte noch verbessert werden, da sie manchmal etwas instabil läuft.
Insgesamt scheint das Boomerang Casino jedoch bei den meisten Spielern gut anzukommen. Die groГџe Auswahl an Spielen, die attraktiven Boni und der gute Kundenservice machen das Casino zu einer interessanten Option fГјr alle, die gerne online spielen.
Wenn Sie also auf der Suche nach einem neuen Online-Casino sind, sollten Sie das Boomerang Casino auf jeden Fall einmal ausprobieren. Vielleicht gehören auch Sie schon bald zu den zufriedenen Spielern, die positive Erfahrungen mit diesem Casino gemacht haben. Viel Spaß und Glück beim Spielen!
https://boomerangcasino.one/
blibli
Российский производитель продает силовые тренажеры https://trenazher-silovoj.ru/ для напряженной эксплуатации в коммерческих спортивных центрах.
Посмотрите каталог интернет-магазина реализуемых устройств блочных и нагружаемых.
Все модели дают возможность прокачивать изолированно любые мышцы.
Изучайте тренажер для плечей, жим ногами, Кроссовер с двумя грузоблоками, Баттерфляй для дельт и груди, силовую раму Смита, вертикально-горизонтальную тягу, скамью Скотта, Гравитрон для подтягивания и отжиманий, гиперэкстензию, универсальные скамьи, рычажные Хаммеры.
Каждый тренажер ориентирован для пользователей с разным порогом физической активности.
Изготавливаемое спортоборудование полностью надежно и не нуждается в техническом наблюдении.
Купите грузоблок нужной массы.
Das Zet Casino ist eine beliebte Online-Spielplattform, die eine Vielzahl von Spielen und großzügigen Boni für Spieler anbietet. Ein wichtiger Aspekt für Spieler ist die Auszahlungsdauer, also die Zeit, die es benötigt, bis Gewinne auf das Konto des Spielers überwiesen werden.
Die gute Nachricht ist, dass das Zet Casino eine schnelle Auszahlungsdauer hat. In der Regel können Spieler ihre Gewinne innerhalb von 24 Stunden erhalten, nachdem sie eine Auszahlungsanforderung gestellt haben. Dies ist deutlich schneller als viele andere Online-Casinos, die oft mehrere Tage benötigen, um Auszahlungen zu bearbeiten.
Um eine Auszahlung zu tätigen, müssen Spieler lediglich ihr Konto verifizieren und eine Auszahlungsanforderung über ihr Spielerkonto stellen. Sobald die Anforderung genehmigt wurde, wird das Geld schnell auf das angegebene Konto überwiesen.
Natürlich kann die Auszahlungsdauer je nach Zahlungsmethode variieren. E-Wallets wie Skrill und Neteller ermöglichen in der Regel schnellere Auszahlungen als Banküberweisungen, da die Transaktionen sofort abgewickelt werden können. Spieler sollten daher die für sie am besten geeignete Zahlungsmethode wählen, um ihre Gewinne so schnell wie möglich zu erhalten.
Insgesamt bietet das Zet Casino eine schnelle und zuverlässige Auszahlungsdauer, die es Spielern ermöglicht, ihre Gewinne schnell zu genießen. Mit einer Vielzahl von Zahlungsmethoden und einem effizienten Auszahlungsprozess ist das Zet Casino eine gute Wahl für Spieler, die Wert auf eine schnelle Abwicklung ihrer Gewinne legen.
https://zetcasino.one/
nice content!nice history!!
Das Zet Casino ist eines der beliebtesten Online-Casinos fГјr deutsche Spieler. Mit einer breiten Palette an Spielen und groГџzГјgigen Bonusangeboten zieht es immer mehr GlГјcksspielfans an. Ein besonders attraktives Angebot, das viele Spieler anlockt, ist der Zet Casino Code. Doch was genau verbirgt sich hinter diesem Code und wie kann man ihn nutzen?
Der Zet Casino Code ist ein spezieller Bonuscode, den Spieler verwenden können, um zusätzliche Vergünstigungen wie Freispiele, Einzahlungsboni oder Cashback-Angebote zu erhalten. Diese Codes werden regelmäßig von der Casinoseite angeboten und können beim Einlösen enorme Vorteile für die Spieler bringen.
Um den Zet Casino Code einzulösen, müssen Spieler zunächst ein Konto auf der Website des Casinos erstellen. Anschließend können sie den Code im entsprechenden Feld während des Einzahlungsvorgangs eingeben. Sobald der Code akzeptiert wurde, werden die zusätzlichen Vergünstigungen sofort dem Spielerkonto gutgeschrieben.
Es ist wichtig zu beachten, dass jeder Zet Casino Code bestimmte Bedingungen und Umsatzanforderungen hat, die erfüllt werden müssen, bevor die Gewinne ausgezahlt werden können. Daher ist es ratsam, die Bonusbedingungen sorgfältig zu lesen, bevor man den Code einlöst.
Insgesamt bietet der Zet Casino Code den Spielern eine tolle Möglichkeit, ihr Spielerlebnis zu verbessern und zusätzliche Gewinne zu erzielen. Mit den regelmäßig angebotenen Bonuscodes und Aktionen ist das Zet Casino eine hervorragende Wahl für alle, die auf der Suche nach einem unterhaltsamen und lukrativen Online-Casino-Erlebnis sind.
https://zetcasino.one/
Скай Лайн Консалтинг – известная компания, предлагающая полный спектр бухгалтерского сопровождения. У нас собрана команда истинных профессионалов. Все специалисты имеют приличный опыт работы и профильное образование. Доверьте им оформление юридических документов и кадровое делопроизводство. https://slc-company.ru/ – сайт, где можете в любое удобное для вас время ознакомиться с отзывами довольных клиентов. Обращайтесь к нам, гарантируем грамотное и быстрое решение вопросов. Стремимся к взаимовыгодному сотрудничеству!
בכל רחבי העיר. כל חטובות ויפות מראה, מנוסות ובעלות מקצוע בכל הקשור לתחום העיסויים בכלל והארוטיקה בפרט. כל אחת בתחומה מתמחה בעיסוי ארוטי מסוגים נקלעתם למרכז. הדירות עצמן ממוקמות בלב ליבן של הערים אך נראות כדירות רגילות בתוך שכונת מגורים. הפעילות בדירות נערת ליווי דיסקרטית – למה זה חשוב?
Das Boomerang Casino ist eine beliebte Online-Glücksspielplattform, die von Spielern auf der ganzen Welt geschätzt wird. Auf der Bewertungsplattform Trustpilot können Nutzer ihre Erfahrungen mit dem Casino teilen und anderen potenziellen Spielern eine Vorstellung von dem geben, was sie erwartet.
Die Bewertungen auf Trustpilot fГјr das Boomerang Casino sind durchweg positiv. Viele Spieler loben die benutzerfreundliche und ansprechende Website, die eine reibungslose Navigation und ein angenehmes Spielerlebnis bietet. DarГјber hinaus wird die Vielfalt der angebotenen Spiele, darunter Slots, Tischspiele und Live-Casino-Spiele, gelobt.
Ein weiterer Aspekt, der von Spielern hervorgehoben wird, ist der professionelle und freundliche Kundenservice des Boomerang Casinos. Die Mitarbeiter sind stets schnell erreichbar und helfen bei Fragen oder Problemen kompetent weiter.
Einige Spieler betonen auch die großzügigen Bonusangebote und Aktionen, die das Boomerang Casino regelmäßig veranstaltet. Von Willkommensboni über Freispiele bis hin zu Cashback-Angeboten gibt es für Spieler immer wieder attraktive Möglichkeiten, ihr Guthaben zu erhöhen.
Insgesamt scheint das Boomerang Casino in den Augen vieler Spieler eine vertrauenswürdige und unterhaltsame Glücksspielplattform zu sein. Die positiven Bewertungen auf Trustpilot spiegeln wider, dass Spieler die Seite schätzen und gerne dort spielen.
Wer also auf der Suche nach einem seriösen Online-Casino ist, sollte das Boomerang Casino auf jeden Fall in Betracht ziehen. Mit einer großen Auswahl an Spielen, attraktiven Bonusangeboten und einem erstklassigen Kundenservice scheint es eine gute Wahl für Glücksspielfans zu sein.
https://boomerangcasino.one/
Профессиональная уборка после ремонта в Челябинске — наша специализация! Обращайтесь к нам, и ваш дом станет идеально чистым! https://klining-chelyabinsk-1.ru/
получить микрозайм
Thank you for any other informative web site. The place else may just I get
that type of information written inn such an ideal way? I have a project
that I’m simply now running on, aand I have beden at the look out for such information.
my web blog – Arta4d
https://abcblogs.abc.es/orientaciones/otros-temas/guizhou-la-montana-de-china.html
Tipico Casino sperren: So schГјtzen Sie sich vor Spielsucht
Das Tipico Casino ist eine beliebte Online-Glücksspielplattform, die eine Vielzahl von Casino-Spielen für Spieler anbietet. Doch wie bei allen Formen des Glücksspiels besteht auch beim Online-Casino die Gefahr, dass man süchtig werden kann. Um sich vor den negativen Auswirkungen von exzessivem Spielen zu schützen, bietet Tipico seinen Spielern die Möglichkeit, sich selbst zu sperren.
Die Sperrung des Tipico Casinos kann auf unterschiedliche Weise erfolgen. Zum einen kann man eine temporäre Selbstsperre von einem Tag bis zu sechs Monaten festlegen. Während dieser Zeit ist es nicht möglich, das Casino zu betreten und an Spielen teilzunehmen. Diese Option eignet sich besonders für Spieler, die merken, dass sie ihr Spielverhalten nicht mehr unter Kontrolle haben und eine Pause brauchen.
Eine dauerhafte Selbstsperre ist eine weitere Möglichkeit, um sich vor Spielsucht zu schützen. Wenn man sich für diese Option entscheidet, wird das Konto dauerhaft gesperrt und kann nicht mehr aktiviert werden. Dies ist eine drastische Maßnahme, die jedoch in manchen Fällen notwendig sein kann, um sich vor den negativen Auswirkungen von Glücksspielsucht zu schützen.
Um die Sperrung des Tipico Casinos zu beantragen, muss man sich an den Kundenservice des Unternehmens wenden und sein Anliegen persönlich vortragen. Dieser Prozess soll sicherstellen, dass die Sperrung wirklich im Sinne des Spielers ist und nicht durch Dritte veranlasst wird.
Insgesamt ist die Möglichkeit, sich selbst im Tipico Casino zu sperren, ein wichtiges Instrument, um sich vor Spielsucht zu schützen. Spieler sollten sich ihrer eigenen Grenzen bewusst sein und rechtzeitig eingreifen, wenn sie merken, dass ihr Spielverhalten außer Kontrolle gerät. Die Sperrung des Casinos kann dabei helfen, einen klaren Kopf zu bekommen und sich wieder auf das Wesentliche zu konzentrieren: Spaß am Spiel, ohne dabei die Kontrolle zu verlieren.
https://tipicocasino.one/
Фото товара 360 на телефоне arigami.tech
Если Вы хотели найти [url=https://arigami.tech/augmented_reality]ar программа[/url] в интернете, то мы можем Вам помочь. Наше предложение подходит для областей: ремонт, спорттовары, мебель, инструменты, бытовая техника, товары для сада и дачи и другие. Если Вам сложно определиться, что конкретно требуется Вашему бизнесу, то оформите заявку на сайте arigami.tech и наш консультант Вам перезвонит и ответит на любые оставшиеся вопросы. Наш контактный телефон +7(925)077-93-94 или пишите в телеграм. Будем рады удачному партнерству с Вами!
bliblibli
bliloblo
124SDS9742
blublabla
Das Boomernag Casino hat seine Pforten in der Schweiz geöffnet und bietet den Spielern ein einzigartiges und aufregendes Spielerlebnis. Mit einer breiten Auswahl an Spielen, einschließlich Slots, Tischspielen und Live Casino Optionen, gibt es für jeden Spieler etwas zu finden.
Ein besonderes Highlight des Boomerang Casinos ist das Loyalty-Programm, das den Spielern die Möglichkeit bietet, Prämien und Belohnungen zu sammeln, während sie spielen. Je mehr sie spielen, desto mehr Belohnungen erhalten sie.
Das Casino legt großen Wert auf Sicherheit und Fairplay und alle Spiele werden regelmäßig auf Fairness überprüft, um sicherzustellen, dass die Spieler ein faires Spielerlebnis haben. Darüber hinaus bietet das Casino eine Vielzahl von sicheren Zahlungsoptionen an, um sicherzustellen, dass die Spieler ihre Gewinne sicher und einfach abheben können.
Mit einer benutzerfreundlichen Website und einem professionellen Kundensupport-Team können die Spieler sicher sein, dass sie bei Boomerang Casino eine erstklassige Spielerfahrung erleben werden. Also worauf warten Sie noch? Besuchen Sie noch heute das Boomerang Casino und erleben Sie die aufregende Welt des Online-Glücksspiels in der Schweiz.
https://boomerangcasino.one/
Das Online-Casino-Zetz Casino hat in den letzten Wochen fГјr Aufsehen gesorgt, jedoch nicht auf die positive Art und Weise. Viele Spieler berichten davon, dass das Casino ihre Gewinne nicht auszahlt, obwohl sie die erforderlichen Umsatzbedingungen erfГјllt haben.
Dies hat zu einer Welle der Kritik und Unzufriedenheit unter den Spielern geführt. Viele fühlen sich betrogen und fühlen sich um ihr hart verdientes Geld betrogen. Es ist besonders frustrierend, da das Zet Casino zunächst einen guten Ruf hatte und viele Spieler angezogen hat.
Die GrГјnde fГјr die Nicht-Auszahlung der Gewinne sind unklar. Einige Spieler spekulieren, dass es sich um eine gezielte Taktik des Casinos handelt, um Kosten zu sparen und Gewinne einzubehalten. Andere vermuten, dass es sich um technische Probleme handelt, die schnell behoben werden sollten.
In jedem Fall ist es wichtig, dass Spieler, die Probleme mit der Auszahlung ihrer Gewinne im Zet Casino haben, sich an den Kundenservice wenden und ihr Anliegen klar und deutlich kommunizieren. Es ist auch ratsam, alle notwendigen Informationen und Dokumente bereitzustellen, um den Prozess zu beschleunigen.
Es ist enttäuschend zu sehen, dass ein Casino, das zuvor einen guten Ruf hatte, in solche Schwierigkeiten geraten ist. Hoffentlich wird das Zet Casino seine Probleme in den Griff bekommen und seinen Spielern wieder ein vertrauenswürdiges und zuverlässiges Spielerlebnis bieten können. Bis dahin ist es ratsam, vorsichtig zu sein und sich gut zu informieren, bevor man im Zet Casino spielt.
https://zetcasino.one/
blablablu
Das Boomerang Casino ist eine aufstrebende Online-GlГјcksspielplattform, die Spielern eine Vielzahl von Spielen und groГџzГјgigen Boni bietet. Einer der beliebtesten Bonusangebote des Casinos ist der “Bonus bez depozytu”, bei dem Spieler einen Bonus erhalten, ohne eine Einzahlung tГ¤tigen zu mГјssen.
Der Bonus bez depozytu ist eine großartige Möglichkeit für Spieler, das Casino und seine Spiele ohne finanzielles Risiko kennenzulernen. Spieler können mit diesem Bonus verschiedene Spiele ausprobieren und echtes Geld gewinnen, ohne dabei etwas einzahlen zu müssen.
Um den Bonus bez depozytu zu erhalten, müssen Spieler lediglich ein Konto im Boomerang Casino erstellen und den Bonuscode eingeben, der normalerweise auf der Website des Casinos verfügbar ist. Sobald der Bonus aktiviert ist, können Spieler ihn bei ausgewählten Spielen verwenden und damit echtes Geld gewinnen.
Es ist jedoch wichtig zu beachten, dass der Bonus bez depozytu in der Regel bestimmten Umsatzbedingungen unterliegt, die erfüllt werden müssen, bevor Gewinne ausgezahlt werden können. Spieler sollten daher die Geschäftsbedingungen des Bonus sorgfältig durchlesen, um sicherzustellen, dass sie die Anforderungen erfüllen.
Insgesamt ist der Bonus bez depozytu im Boomerang Casino eine großartige Möglichkeit für Spieler, das Casino und seine Spiele ohne finanzielles Risiko zu erleben. Mit diesem Bonus können Spieler verschiedene Spiele ausprobieren und echtes Geld gewinnen, ohne eine Einzahlung tätigen zu müssen. Wer auf der Suche nach einem spannenden und lohnenden Online-Casino-Erlebnis ist, sollte das Boomerang Casino und seinen Bonus bez depozytu in Betracht ziehen.
https://boomerangcasino.one/
Tipico Casino Code
Immer mehr Menschen in Deutschland entdecken die Welt der Online-Casinos und suchen nach Möglichkeiten, um ihr Glück zu versuchen und spannende Spiele zu spielen. Einer der beliebtesten Anbieter in diesem Bereich ist das Tipico Casino, das eine Vielzahl von Spielen sowie attraktive Bonusangebote für Neukunden bereithält. Ein besonders interessantes Feature bei Tipico ist der Casino Code, der es Spielern ermöglicht, zusätzliche Vorteile zu erhalten.
Der Tipico Casino Code ist ein spezieller Gutscheincode, den Spieler eingeben können, um zum Beispiel einen Bonus auf ihre Einzahlung zu erhalten oder Freispiele für bestimmte Spiele freizuschalten. Die Codes werden regelmäßig vom Casino herausgegeben und können auf verschiedenen Plattformen gefunden werden, wie zum Beispiel auf der Website des Casinos oder in Promotion-Mails.
Um den Casino Code bei Tipico einzulösen, müssen Spieler sich zunächst auf der Website des Casinos anmelden und den Code im entsprechenden Feld eingeben. Nach der Bestätigung wird der Bonus oder die Freispiele automatisch dem Konto gutgeschrieben und können direkt genutzt werden.
Es ist jedoch wichtig zu beachten, dass die Codes oft an bestimmte Bedingungen geknüpft sind, die eingehalten werden müssen, um den Bonus zu erhalten. Dazu gehören zum Beispiel Umsatzanforderungen oder eine Mindesteinzahlung. Es lohnt sich daher, vor der Einlösung eines Codes die genauen Konditionen zu überprüfen.
Insgesamt bietet der Tipico Casino Code Spielern die Möglichkeit, das Spielerlebnis im Casino zu verbessern und zusätzliche Chancen auf Gewinne zu erhalten. Es lohnt sich daher, regelmäßig nach neuen Codes Ausschau zu halten und diese zu nutzen, um das Beste aus dem Casino herauszuholen.
Fazit: Der Tipico Casino Code ist eine attraktive Möglichkeit, um zusätzliche Vorteile im Online-Casino zu erhalten und das Spielerlebnis noch spannender zu gestalten. Es lohnt sich daher, die Codes regelmäßig zu prüfen und zu nutzen, um das Beste aus dem Angebot von Tipico herauszuholen.
https://tipicocasino.one/
Das Boomerang Casino, das im Jahr 2020 gegründet wurde, ist eine beliebte Online-Glücksspielplattform, die eine Vielzahl von Casinospielen und Boni für ihre Spieler anbietet. Ein wichtiger Aspekt, der bei der Wahl eines Online-Casinos berücksichtigt werden muss, ist das Auszahlungslimit. Das Auszahlungslimit ist der Höchstbetrag, den ein Spieler pro Transaktion oder innerhalb eines bestimmten Zeitraums abheben kann.
Das Boomerang Casino hat ebenfalls ein Auszahlungslimit, das von verschiedenen Faktoren abhängt, wie beispielsweise dem VIP-Status des Spielers, dem Zahlungsmittel und dem Land, in dem sich der Spieler befindet. Das Auszahlungslimit kann von 500 € bis zu mehreren Tausend Euro pro Woche reichen.
Es ist wichtig, sich über das Auszahlungslimit des Boomerang Casinos zu informieren, um sicherzustellen, dass man die richtige Entscheidung trifft. Wenn ein Spieler das Auszahlungslimit erreicht hat, kann es zu Verzögerungen oder Einschränkungen bei der Auszahlung kommen. Daher ist es ratsam, vorab zu prüfen, ob das Auszahlungslimit den eigenen Bedürfnissen entspricht.
Das Boomerang Casino bietet seinen Spielern auch die Möglichkeit, ihr Auszahlungslimit zu erhöhen, indem sie den Kundensupport kontaktieren und ihre Anfrage überprüfen lassen. Es ist wichtig zu beachten, dass das Auszahlungslimit aus Sicherheitsgründen festgelegt wird, um Betrug und Geldwäsche zu verhindern.
Insgesamt ist das Auszahlungslimit im Boomerang Casino ein wichtiger Aspekt, den Spieler im Auge behalten sollten, um eine reibungslose und zufriedenstellende Erfahrung auf der Plattform zu gewährleisten. Es ist ratsam, sich vorab über die Bestimmungen und Bedingungen des Auszahlungslimits zu informieren, um Missverständnisse und Unannehmlichkeiten zu vermeiden.
https://boomerangcasino.one/
Das Live Casino von Tipico erfreut sich groГџer Beliebtheit bei Spielern, die gerne in Echtzeit gegen echte Dealer antreten. Doch was passiert, wenn das Geld im Live Casino blockiert wird?
Es kann verschiedene Gründe dafür geben, dass Geld im Live Casino von Tipico blockiert wird. Einer der häufigsten Gründe ist, dass ein Spieler gegen die Allgemeinen Geschäftsbedingungen des Casinos verstoßen hat. Dies kann zum Beispiel geschehen, wenn ein Spieler versucht, mehrere Konten zu eröffnen, um sich Boni mehrfach zu sichern. In solchen Fällen behält sich das Casino das Recht vor, das Geld des Spielers einzufrieren.
Ein weiterer Grund für blockiertes Geld im Live Casino von Tipico kann sein, dass der Spieler sein Konto nicht verifiziert hat. Das Casino ist dazu verpflichtet, die Identität seiner Spieler zu überprüfen, um Geldwäsche und Betrug zu verhindern. Wenn ein Spieler diese Verifizierung nicht rechtzeitig durchführt, kann es sein, dass sein Geld blockiert wird, bis dies geschehen ist.
Es ist wichtig, dass Spieler die Regeln und Bedingungen des Casinos genau lesen und beachten, um solche Situationen zu vermeiden. Wenn das Geld im Live Casino von Tipico blockiert wurde, sollte der Spieler sich umgehend an den Kundenservice des Casinos wenden, um das Problem zu klären. In den meisten Fällen kann das Geld nach einer Überprüfung des Falls wieder freigegeben werden.
Insgesamt ist es wichtig, verantwortungsbewusst im Live Casino von Tipico zu spielen und sich an die Regeln des Casinos zu halten, um Blockaden des Geldes zu vermeiden. Wenn dennoch einmal ein Problem auftreten sollte, steht der Kundenservice von Tipico jederzeit zur VerfГјgung, um zu helfen.
https://tipicocasino.one/
bluatblaaotuy
palabraptu
blublun
Zet Casino ist ein Online-Casino, das im Jahr 2018 gegrГјndet wurde und seitdem eine Vielzahl von Spielen und Bonusangeboten fГјr seine Kunden anbietet. In diesem Artikel werden wir eine Bewertung des Zet Casinos vornehmen und seine Vor- und Nachteile betrachten.
Einer der größten Vorteile von Zet Casino ist die groГџe Auswahl an Spielen, die es seinen Kunden zur VerfГјgung stellt. Das Casino bietet Hunderte von Spielautomaten, Tischspielen und Live-Casino-Spielen von fГјhrenden Softwareanbietern wie NetEnt, Microgaming und Play’n GO. Dies sorgt fГјr eine abwechslungsreiche und unterhaltsame Spielerfahrung fГјr die Kunden.
Ein weiterer positiver Aspekt von Zet Casino sind die großzügigen Bonusangebote, die es seinen Spielern bietet. Neue Spieler erhalten einen Willkommensbonus, der Freispiele und Bonusgeld beinhaltet, und treue Spieler können von regelmäßigen Promotionen und Belohnungen profitieren. Dies trägt dazu bei, dass die Spieler länger im Casino bleiben und mehr Spaß haben.
Darüber hinaus bietet Zet Casino eine sichere und benutzerfreundliche Plattform für seine Kunden. Das Casino verfügt über eine gültige Lizenz und benutzt die neueste SSL-Verschlüsselungstechnologie, um sicherzustellen, dass die persönlichen Daten der Spieler geschützt sind. Die Website ist auch einfach zu navigieren und bietet eine Vielzahl von Zahlungsmethoden für die Kunden.
Ein potentieller Nachteil von Zet Casino ist, dass es in einigen Ländern eingeschränkt ist und Spieler aus bestimmten Regionen nicht akzeptiert. Dies kann frustrierend für Spieler sein, die gerne im Casino spielen möchten, aber aufgrund von rechtlichen Bestimmungen nicht die Möglichkeit dazu haben.
Insgesamt ist das Zet Casino eine gute Wahl für Spieler, die nach einer vielfältigen Auswahl an Spielen und großzügigen Bonusangeboten suchen. Mit einer sicheren und benutzerfreundlichen Plattform bietet das Casino ein erstklassiges Spielerlebnis für seine Kunden.
https://zetcasino.one/
[url=https://t.me/+VBaDQD1pFuA1ZWJi]Zen[/url] – BCC, зарплатные карты альфа банка золотая
строительный адвокат
blobloblu
blobloblu
юрист бизнес права
услуги юриста по банковским вопросам
Boomerang Casino ist eine beliebte Online-Glücksspielplattform, die nun auch eine praktische mobile Anwendung für Spieler anbietet. Die Boomerang Casino App ermöglicht es den Nutzern, ihr Lieblingsspiel unterwegs zu genießen, egal ob sie gerade in der U-Bahn sitzen oder im Park spazieren gehen.
Die App bietet eine breite Palette von Spielen, darunter Slots, Tischspiele, Live-Casino und vieles mehr. Die Benutzeroberfläche ist benutzerfreundlich und intuitiv, so dass selbst Anfänger sich leicht zurechtfinden können. Darüber hinaus bietet die App exklusive Boni und Sonderaktionen, die nur für mobile Nutzer verfügbar sind.
Ein weiterer Vorteil der Boomerang Casino App ist die nahtlose Integration mit Ihrem Konto auf der Website. Das bedeutet, dass Sie mit dem gleichen Konto sowohl auf der Website als auch in der App spielen können, ohne Daten synchronisieren zu müssen. Darüber hinaus sind Ein- und Auszahlungen über die App genauso sicher und zuverlässig wie auf der Website.
Die Boomerang Casino App ist sowohl für iOS als auch für Android-Geräte verfügbar und kann kostenlos im jeweiligen App Store heruntergeladen werden. Also, worauf warten Sie noch? Laden Sie jetzt die Boomerang Casino App herunter und tauchen Sie ein in die aufregende Welt des Online-Glücksspiels!
https://boomerangcasino.one/
scam
[url=https://speakerdeck.com/teplica52]Волна Теплица капелька[/url].
[url=https://speakerdeck.com/teplica52]теплица52 Теплица из поликарбоната купить доставкой цена[/url].
[url=https://repo.getmonero.org/teplica52]Усиленная теплица из поликарбоната[/url].
[url=https://ambox.ru/polikarbonatnye-tepliczy-dlya-dach-i-fermerskih-hozyajstv/]Дешевые теплицы из поликарбоната[/url].
[url=https://bbpress.org/forums/profile/teplica52/]Теплицы из сотового поликарбоната[/url].
[url=https://t.me/teplicavolna]teplica52.ru Заказать теплицу из поликарбоната с установкой[/url].
[url=https://coub.com/teplitsy-volna]Садовая теплица из поликарбоната цена teplica52[/url].
[url=https://www.cossa.ru/profile/?ID=215288]Теплицы распродажа цена Волна и ВИТА[/url].
[url=https://www.kremlinrus.ru/article/1064/104558/]Теплицы купить от производителя[/url].
[url=https://500px.com/p/rega18]Купить теплицу с доставкой и сборкой[/url].
[url=https://gitlab.com/Teplica52]Теплица купить teplica52[/url].
[url=https://beacons.ai/teplica52]Теплицы купить от производителя Теплица52[/url].
[url=https://link.space/@Teplica52]Купить теплицу из поликарбоната[/url].
[url=http://vstrg.info/stati-partnerov/preimushhestva-teplic-iz-polikarbonata.html]Производство теплиц из поликарбоната[/url].
[url=https://ru.gravatar.com/teplica52]Где можно купить теплицу[/url].
[url=https://rutube.ru/channel/30633534/about/]Теплицы из поликарбоната распродажа от производителя[/url].
[url=https://solo.to/teplica52]Волна Заказать теплицу из поликарбоната[/url].
[url=https://issuu.com/teplica]теплица52 Купить прочную теплицу[/url].
[url=http://www.topsostav.ru/profile/266725/wall/]Большие теплицы из поликарбоната[/url].
[url=https://peatix.com/user/17455941/view]Теплицы из поликарбоната распродажа[/url].
[url=https://www.weblancer.net/users/Teplica52/]Большие теплицы купить[/url].
[url=https://www.weblancer.net/users/Teplica52/]teplica52.ru Теплицы цена[/url].
[url=https://www.reddit.com/user/Teplica52/]Теплица прямостенные цена teplica52[/url].
[url=https://www.niann.ru/?id=555392]Теплицы на заказ Волна и ВИТА[/url].
[url=https://lit.link/en/teplica52]Теплицы производители скидки[/url].
[url=https://sketchfab.com/Teplica52]Теплица из поликарбоната[/url].
[url=https://peatix.com/user/17455941/view]Теплица из поликарбоната купить доставкой цена teplica52[/url].
[url=https://ru.gravatar.com/teplica52]Садовая теплица из поликарбоната цена Теплица52[/url].
[url=https://folkd.com/user/Teplica52]Купить усиленную теплицу[/url].
[url=https://www.pinterest.co.uk/rega0589/]Теплица купить[/url].
[url=https://subscribe.ru/author/30811333]Теплица цена нижегородская область[/url].
[url=https://www.kremlinrus.ru/article/1064/104558/]Усиленная теплица из поликарбоната[/url].
prayertimein.com
Виджет дополненной реальности arigami.tech
Если Вы хотели найти [url=https://arigami.tech/]товар в 360[/url] в интернете, то мы можем Вам оказать помощь. Наше предложение актуально для тематик: ремонт, ретейл, мебель, оборудование, бытовая техника, сантехника и другие. Если Вы не можете определиться, что конкретно требуется Вашему бизнесу, то оформите заявку на сайте arigami.tech и наш консультант Вам перезвонит и ответит на все вопросы. Наш контактный номер телефона +7(925)077-93-94 или пишите на вотс ап. Будем рады успешному партнерству с Вами!
найти сервис центры ремонта ноутбуков
Моделирование товаров в 3D на Ваш сайт arigami.tech
Если Вы хотели найти [url=https://arigami.tech/]разработка дополненной реальности компании[/url] в сети интернет, то мы можем Вам оказать помощь. Наше предложение актуально для областей: дизайн, ретейл, мебель, оборудование, бытовая техника, товары для сада и дачи и другие. Если Вам сложно понять, что конкретно требуется Вашему бизнесу, то оставьте заявку на сайте arigami.tech и наш консультант Вам перезвонит и даст ответы на любые оставшиеся вопросы. Наш контактный телефон +7(925)077-93-94 или напишите на вотс ап. Будем рады удачному сотрудничеству с Вами!
What i don’t understood is in truth how you’re no longer really much more
well-appreciated than you may be right now. You are very intelligent.
You know thus significantly on tthe subject off this topic,
made me personally imagine it from a lot oof various angles.
Its like men and women don’t seem to bee interestsd unless it’s one thing
to do with Woman gaga! Your own stuffs outstanding. At all times handle it up!
Here is my web site wa slot togel
amd ryzen 5 1600 https://cpu-specs.com/
Zet Casino ist eine Online-GlГјcksspielplattform, die in der Welt der Online-Casinos immer beliebter wird. Mit einer breiten Palette an Spielen und attraktiven Bonusangeboten zieht Zet Casino Spieler aus der ganzen Welt an. In diesem Artikel werden wir die Vor- und Nachteile dieses Casinos bewerten.
Vorteile:
1. Große Auswahl an Spielen: Zet Casino bietet eine Vielzahl von Spielen, darunter Spielautomaten, Tischspiele, Live-Casino-Spiele und mehr. Spieler können zwischen Hunderten von Spielen wählen und haben immer etwas Neues zu entdecken.
2. Attraktive Bonusangebote: Zet Casino bietet großzügige Boni für neue Spieler sowie regelmäßige Promotionen und Aktionen für bestehende Spieler. Diese Bonusangebote können die Gewinnchancen der Spieler erhöhen und das Spielerlebnis noch spannender machen.
3. Sichere Zahlungsmethoden: Zet Casino bietet eine Vielzahl von sicheren Zahlungsmethoden, darunter Kreditkarten, E-Wallets und Banküberweisungen. Spieler können sicher und bequem Ein- und Auszahlungen vornehmen, ohne sich Gedanken über die Sicherheit ihrer persönlichen Daten machen zu müssen.
Nachteile:
1. Einschränkungen in einigen Ländern: Zet Casino akzeptiert Spieler aus verschiedenen Ländern, aber es gibt einige Länder, in denen das Spielen auf der Plattform nicht erlaubt ist. Spieler sollten sicherstellen, dass sie die gesetzlichen Bestimmungen ihres Landes kennen, bevor sie sich bei Zet Casino anmelden.
2. Langsame Auszahlungszeiten: Einige Spieler haben berichtet, dass die Auszahlungszeiten bei Zet Casino länger sind als bei anderen Online-Casinos. Dies kann frustrierend sein, insbesondere für Spieler, die ihre Gewinne schnell erhalten möchten.
Insgesamt bietet Zet Casino eine unterhaltsame und sichere Spielumgebung mit einer Vielzahl von Spielen und attraktiven Bonusangeboten. Spieler können sicher sein, dass ihre persönlichen Daten geschützt sind und dass sie faire Gewinnchancen haben. Trotz einiger kleiner Nachteile ist Zet Casino definitiv einen Besuch wert.
Fazit:
Zet Casino ist ein solides Online-Casino mit einer breiten Spielauswahl und attraktiven Bonusangeboten. Spieler, die auf der Suche nach einer unterhaltsamen und sicheren Spielumgebung sind, werden bei Zet Casino sicherlich auf ihre Kosten kommen. Es lohnt sich, dieses Casino auszuprobieren und selbst zu entscheiden, ob es den eigenen AnsprГјchen entspricht.
https://zetcasino.one/
Компания «Эколан» предлагает впечатлительный выбор высококачественных товаров. У нас вы найдете прекрасные одеяла, простыни, полотенца, скатерти, декоративные подушки, наматрасники, пледы и многое другое. Гарантируем оперативную доставку и заманчивые цены. https://ecolan37.ru – сайт, где имеется все нужное для создания домашнего комфорта и уюта. Ценим своих клиентов, всегда готовы помочь с выбором и ответить на любые вопросы. Заказывая у нас, можете быть уверены в том, что останетесь приобретением, довольны.
качественные мастерские ремонта телефонов в москве
Bei Tipico mit PayPal einzahlen fГјr Casino und umbuchen
Tipico ist einer der beliebtesten Online-Glücksspielanbieter in Deutschland. Neben Sportwetten bietet Tipico auch eine Vielzahl von Casino-Spielen an, die die Spieler stundenlang unterhalten können. Um die Zahlungsvorgänge für die Spieler so einfach wie möglich zu gestalten, bietet Tipico die Möglichkeit, mit PayPal einzuzahlen und Geld umzubuchen.
PayPal ist eine der bekanntesten und sichersten Online-Zahlungsmethoden, die von Millionen von Menschen weltweit genutzt wird. Mit PayPal können die Spieler schnell und einfach Geld auf ihr Tipico-Konto einzahlen, um sofort mit dem Spielen im Casino zu beginnen. Das Einzahlen mit PayPal ist einfach und unkompliziert. Dazu muss der Spieler einfach die Zahlungsmethode auswählen, den gewünschten Betrag eingeben und die Transaktion abschließen. Das Geld wird sofort auf das Spielerkonto gutgeschrieben und kann für Casino-Spiele genutzt werden.
Aber nicht nur das Einzahlen, sondern auch das Umbuchen von Geld auf dem Tipico-Konto ist mit PayPal möglich. Wenn ein Spieler Gewinne erzielt hat und das Geld auf seinem Tipico-Konto umbuchen möchte, kann er dies ganz einfach mit PayPal tun. Dazu muss der Spieler einfach den gewünschten Betrag auswählen und die Umstellung bestätigen. Das Geld wird sofort auf das PayPal-Konto des Spielers überwiesen und kann von dort aus für andere Einkäufe oder Transaktionen genutzt werden.
Mit PayPal bei Tipico einzuzahlen und Geld umzubuchen ist also eine bequeme und sichere Möglichkeit, um das Spielerlebnis im Casino zu genießen. Spieler können sich auf schnelle und unkomplizierte Transaktionen verlassen und ihre Gewinne einfach verwalten. Wer also gerne im Tipico Casino spielt, sollte unbedingt die Möglichkeit nutzen, mit PayPal einzuzahlen und Geld umzubuchen.
https://tipicocasino.one/
Фото товара 360 на телефоне arigami.tech
Если Вы хотели найти [url=https://arigami.tech/app_dev]мобильное приложение дополненной реальности[/url] в интернете, то мы можем Вам помочь. Наше предложение подходит для тематик: ремонт, ретейл, декор, оборудование, бытовая техника, сантехника и другие. Если Вам сложно понять, что конкретно требуется Вашему бизнесу, то оставьте заявку на сайте arigami.tech и наш менеджер Вам перезвонит и даст ответы на возникшие вопросы. Наш контактный телефон +7(925)077-93-94 или пишите на вотс ап. Будем рады удачному сотрудничеству с Вами!
На сайте https://lemon-car.ru/ укажите номер телефона для того, чтобы воспользоваться услугами проверенного, надежного автосервиса, который работает на выгодных условиях. На все услуги даются гарантии, потому как в компании работают лучшие и компетентные специалисты, знающие свою работу. Прямо сейчас вы сможете записаться на интересующую услугу. Для вас доступен кузовной, слесарный ремонт, двигателя, а также АКПП. Оказывается полный комплекс услуг. В первую очередь, осуществляется диагностика автомобиля, а потом определяется стоимость ремонта.
read this article https://debank.at/2023/11/11/debank-web3-id-is-revolutionizing-the-future-of-identity-verification/
look at this now https://tronlink-app.org/2023/11/13/examining-the-benefits-of-tron-solana-ftx-and-etkhatri-in-the-blockchain-sector-maximizing-the-potential-of-onchain-transactions/
straight from the source https://blur-nft-market.com/2023/11/10/the-emergence-of-apecoins-a-deep-dive-into-the-growing-trend-of-nft-backed-cryptocurrencies/
Das Tipico Casino bietet eine Vielzahl von unterschiedlichen Spielen für jeden Geschmack an. Egal ob Slots, Tischspiele oder Live-Casino – hier wird jeder fündig. Aber wussten Sie schon, dass man im Tipico Casino bereits ab 5 Cent spielen kann?
Ja, richtig gelesen! Im Tipico Casino können Sie bereits mit einem Einsatz von nur 5 Cent an den verschiedenen Spielautomaten Ihr Glück versuchen. Das ist besonders für Einsteiger oder vorsichtige Spieler sehr attraktiv, da man mit einem geringen Einsatz die Chance hat, tolle Gewinne zu erzielen.
Die Auswahl an Spielen, bei denen man mit 5 Cent spielen kann, ist groß. Von klassischen Slots bis hin zu modernen Video-Slots ist für jeden etwas dabei. Auch progressive Jackpot-Slots, bei denen man mit etwas Glück riesige Gewinne abräumen kann, stehen zur Verfügung.
Aber nicht nur bei den Spielautomaten kann man mit 5 Cent spielen, auch bei verschiedenen Tischspielen wie Roulette oder Blackjack ist es möglich, mit einem kleinen Einsatz dabei zu sein. So können auch Spieler mit kleinerem Budget die Spannung und den Nervenkitzel eines Casinos erleben.
Das Tipico Casino zeichnet sich nicht nur durch seine Vielfalt an Spielen aus, sondern auch durch seine benutzerfreundliche Plattform und den professionellen Kundenservice. Ein- und Auszahlungen können sicher und bequem über verschiedene Zahlungsmethoden getätigt werden, sodass man sich ganz auf das Spiel konzentrieren kann.
Also, wenn Sie Lust auf spannende Casino-Spiele haben, aber nicht gleich große Summen investieren möchten, dann ist das Tipico Casino mit seinen 5 Cent Spielen genau das Richtige für Sie. Probieren Sie es doch einfach mal aus und erleben Sie die aufregende Welt des Casinos!
https://tipicocasino.one/
site here https://debank.lu/2023/11/11/a-comprehensive-guide-for-beginners-on-how-to-activate-your-metamask-wallet/
review https://blur-io-nft.com/2023/11/09/the-evolution-of-blurio-from-simple-web-game-to-global-phenomenon/
great article
scam
scam
scam
Das Tipico Casino ist eine beliebte Wahl unter den Online-Casino-Spielern, und dies aus gutem Grund. Das Casino ist Teil der bekannten Tipico-Gruppe, die bereits seit vielen Jahren fГјr ihre professionellen Dienstleistungen im Bereich Sportwetten bekannt ist. Nun haben sie ihr Angebot um ein hochwertiges Online-Casino erweitert, das Spieler aus der ganzen Welt begeistert.
Eine der Hauptattraktionen des Tipico Casinos sind die vielfГ¤ltigen und spannenden Spiele, die es zu bieten hat. Von klassischen Spielautomaten Гјber Roulette und Blackjack bis hin zu modernen Video-Slots – hier ist fГјr jeden Geschmack etwas dabei. Die Spiele stammen von renommierten Herstellern wie NetEnt, Microgaming und Play’n GO, was fГјr hohe QualitГ¤t und ein erstklassiges Spielerlebnis bГјrgt.
Auch in Sachen Sicherheit und Seriosität kann das Tipico Casino überzeugen. Das Casino verfügt über eine Lizenz der Malta Gaming Authority, einer der angesehensten Glücksspielbehörden der Welt. Dadurch wird sichergestellt, dass alle Spiele fair ablaufen und die persönlichen Daten der Spieler geschützt sind. Zudem arbeitet das Casino mit zuverlässigen Zahlungsdienstleistern zusammen, um sichere Transaktionen zu gewährleisten.
Ein weiterer Pluspunkt des Tipico Casinos ist der exzellente Kundenservice. Die Mitarbeiter stehen rund um die Uhr zur VerfГјgung, um den Spielern bei Fragen oder Problemen freundlich und kompetent weiterzuhelfen. Zudem bietet das Casino attraktive Bonusangebote fГјr neue und bestehende Spieler, um das Spielerlebnis noch spannender zu gestalten.
Alles in allem ist das Tipico Casino eine klare Empfehlung für alle, die auf der Suche nach einem seriösen und unterhaltsamen Online-Casino sind. Mit einer tollen Spielauswahl, einem hervorragenden Kundenservice und attraktiven Bonusangeboten überzeugt das Casino auf ganzer Linie. Wer also Lust auf erstklassige Casino-Unterhaltung hat, sollte das Tipico Casino definitiv einmal ausprobieren. Viel Spaß beim Spielen!
https://tipicocasino.one/
Zet Casino Affiliates: Ein profitables Partnerprogramm fГјr Online-GlГјcksspiel-Enthusiasten
Zet Casino ist ein beliebtes Online-Casino, das eine Vielzahl von GlГјcksspielen und spannenden Aktionen fГјr seine Spieler anbietet. Aber wussten Sie, dass Zet Casino auch ein lukratives Partnerprogramm fГјr Affiliates hat?
Als Affiliate können Sie von den erfolgreichen Marketingstrategien und dem guten Ruf von Zet Casino profitieren, indem Sie Spieler auf die Webseite des Casinos verweisen. Sie erhalten attraktive Provisionen für jeden Spieler, den Sie erfolgreich vermitteln. Je mehr Spieler Sie vermitteln, desto höher sind Ihre Einnahmen.
Das Zet Casino Affiliates Programm bietet eine Vielzahl von Werbemitteln und Marketingtools, die es Ihnen leicht machen, Spieler anzulocken und zu binden. Sie erhalten Zugang zu speziellen Bannern, Links und anderen Werbematerialien, die Ihnen helfen, erfolgreiche Kampagnen zu erstellen.
Darüber hinaus bietet Zet Casino Affiliates eine zuverlässige und transparente Tracking-Plattform, die es Ihnen ermöglicht, die Leistung Ihrer Marketingaktivitäten genau zu verfolgen und Ihre Einnahmen zu maximieren. Sie können jederzeit auf Echtzeitstatistiken und Berichte zugreifen, um den Erfolg Ihrer Kampagnen zu bewerten und anzupassen.
Wenn Sie also überzeugt sind, dass Zet Casino ein großartiges Glücksspielziel ist und Spieler anzieht, dann sollten Sie unbedingt am Zet Casino Affiliates Programm teilnehmen. Mit attraktiven Provisionen, professionellem Support und einer Vielzahl von Werbemitteln ist das Programm eine großartige Möglichkeit, passives Einkommen zu verdienen und gleichzeitig mit einem vertrauenswürdigen und etablierten Online-Casino zusammenzuarbeiten.
Melden Sie sich noch heute beim Zet Casino Affiliates Programm und starten Sie Ihre erfolgreiche Partnerschaft mit einem der besten Online-Casinos auf dem Markt!
https://zetcasino.one/
ремонт ноутбуков адреса в москве
[url=https://t.me/+okjqEygf3QNmYTY8]куплю банковские карты сбербанка[/url] – Gate.io, зарплатная карта альфа банка
Der Mindesteinsatz im Tipico Casino
Das Tipico Casino ist eine beliebte Online-Glücksspielplattform, die eine Vielzahl von Casino-Spielen und Sportwetten anbietet. Ein wichtiger Aspekt beim Spielen im Tipico Casino ist der Mindesteinsatz, der festlegt, wie viel Geld Spieler minimal setzen müssen, um an den verschiedenen Spielen teilnehmen zu können.
Der Mindesteinsatz im Tipico Casino variiert je nach Spiel und Tisch. Bei den meisten Spielautomaten beträgt der Mindesteinsatz in der Regel zwischen 0,10€ und 0,20€ pro Spin. Bei Tischspielen wie Roulette oder Blackjack kann der Mindesteinsatz ebenfalls variieren, je nach Tisch und Spielvariante.
Es ist wichtig zu beachten, dass der Mindesteinsatz im Tipico Casino dazu dient, sicherzustellen, dass das Casino einen gewissen Betrag an Einnahmen generiert und Betrugsversuche minimiert werden. Spieler sollten daher immer darauf achten, den Mindesteinsatz einzuhalten, um nicht gegen die Regeln des Casinos zu verstoГџen.
Darüber hinaus kann der Mindesteinsatz im Tipico Casino auch Auswirkungen auf die Gewinnchancen haben. In der Regel gilt: Je höher der Einsatz, desto höher auch die potenziellen Gewinne. Spieler sollten daher immer abwägen, wie viel Geld sie bereit sind zu setzen und welche Risiken sie eingehen möchten.
Insgesamt ist der Mindesteinsatz im Tipico Casino ein wichtiger Faktor, den Spieler bei der Auswahl ihrer Spiele und Einsätze berücksichtigen sollten. Indem sie die Regeln des Casinos respektieren und verantwortungsbewusst spielen, können Spieler ein unterhaltsames und sicheres Spielerlebnis im Tipico Casino genießen.
https://tipicocasino.one/
international expert отзывы
Использование виртуальной реальности w2w.group
По вопросу [url=https://w2w.group/solutions]разработка vr игры на заказ[/url] Вы на правильном пути. Наши консультанты готовы дать обратную связь и ответить на любые вопросы. Если у Вас есть личные образцы, которые необходимо дополнить реальностью, отправляйте их нам и мы сможем понять, подойдут ли они. Если их нет, мы самостоятельно можем их спроектировать, учитывая все Ваши желания. Оформление личного сайта с помощью виртуальной и дополненной реальности не только удивляет покупателя, но и даёт оценить уровень подхода к ведению бизнеса. Тем самым Вы можете отличиться среди других на рынке и публично заявить о себе.
In Online-Casinos sind Freispiele für viele Spieler ein wichtiger Bestandteil des Spielvergnügens. Zet Casino bietet seinen Kunden regelmäßig die Möglichkeit, Freispiele zu erhalten und damit verschiedene Spiele kostenlos auszuprobieren. Doch für welches Spiel lohnen sich die Freispiele bei Zet Casino besonders?
Eines der beliebtesten Spiele, fГјr das man bei Zet Casino Freispiele erhalten kann, ist Book of Dead. Dieser Г¤gyptisch angehauchte Slot von Play’n GO bietet spannende Abenteuer und hohe Gewinnchancen. Mit den Freispielen bei Zet Casino kann man das Spiel risikofrei testen und mГ¶glicherweise hohe Gewinne erzielen.
Ein weiteres Spiel, das sich fГјr Freispiele bei Zet Casino eignet, ist Starburst. Dieser Slot von NetEnt ist bekannt fГјr seine bunten Grafiken und innovativen Features. Mit den Freispielen bei Zet Casino kann man dieses beliebte Spiel ausgiebig testen und vielleicht den ein oder anderen Jackpot knacken.
Auch der Spielautomat Gonzo’s Quest von NetEnt ist bei Zet Casino sehr beliebt und eignet sich perfekt fГјr Freispiele. Die spannende Schatzsuche des Entdeckers Gonzo bietet hohe GewinnmГ¶glichkeiten und eine aufregende SpielatmosphГ¤re. Mit den Freispielen bei Zet Casino kann man dieses Spiel ausgiebig testen und hoffentlich hohe Gewinne erzielen.
Für welches Spiel man sich letztendlich bei Zet Casino entscheidet, hängt natürlich vom persönlichen Geschmack und den individuellen Vorlieben ab. Doch eines ist sicher: Mit den Freispielen bei Zet Casino kann man viele spannende Spiele kostenlos ausprobieren und vielleicht den einen oder anderen großen Gewinn erzielen. Viel Spaß beim Spielen und viel Glück!
https://zetcasino.one/
навес для автомобиля
Зайдите на сайт https://akb-shtabeler.ru/ где вы сможете купить аккумуляторы для штабелеров, а также электрические штабелеры от дилеров. Лучшие цены, всегда в наличии на складе, доставка в любой регион. Ознакомьтесь на сайте с брендами штабелеров и каталогом тяговых аккумуляторов для них, для всех брендов.
ремонт модулей управления климатического оборудования
בטוחה ודיסקרטית. כפי שציינו הדירות מסודרות ונקיות. האבזור המושלם את הבחורה אליך הביתה, לבית מלון או לחדרים לפי שעה ותיהנה משירותי ליווי מפנקים ומקצועיים, אשר יהפכו את היום שלך להרבה יותר מוצלח לתושבי העיר ולתיירים מכל הארץ שבאים לאזורי התיירות, ליווי מפרטיות וכל הדרכים להנאה
Tipico Casino nutzen
Das Tipico Casino ist eine der beliebtesten Online-Glücksspielplattformen in Deutschland. Mit einer Vielzahl von Spielen und einer benutzerfreundlichen Oberfläche bietet das Casino ein unterhaltsames und spannendes Spielerlebnis für alle, die gerne ihr Glück versuchen.
Um das Tipico Casino nutzen zu können, müssen Sie sich zunächst auf der Website registrieren. Dies ist ein einfacher Prozess, bei dem Sie Ihre persönlichen Daten angeben und ein Benutzerkonto erstellen müssen. Sobald Sie dies erledigt haben, können Sie eine Einzahlung auf Ihr Konto vornehmen und mit dem Spielen beginnen.
Das Tipico Casino bietet eine breite Palette von Spielen, darunter Spielautomaten, Tischspiele, Live-Casino-Spiele und Jackpots. Egal, ob Sie lieber Roulette spielen, Blackjack lieben oder an Spielautomaten Ihr Glück versuchen möchten, im Tipico Casino ist für jeden etwas dabei.
Eine weitere Attraktion des Tipico Casinos sind die regelmäßigen Bonusangebote und Aktionen, die den Spielern zusätzliche Gewinnchancen bieten. Von Einzahlungsboni über Freispiele bis hin zu Verlosungen gibt es immer wieder aufregende Angebote, die das Spielerlebnis noch spannender machen.
Das Tipico Casino ist auch für seine Sicherheit und Vertrauenswürdigkeit bekannt. Das Casino verfügt über eine Lizenz der Malta Gaming Authority und arbeitet mit führenden Zahlungsdienstleistern zusammen, um sichere und schnelle Transaktionen zu gewährleisten.
Insgesamt bietet das Tipico Casino eine erstklassige GlГјcksspielerfahrung fГјr alle, die gerne online spielen. Mit einer groГџen Auswahl an Spielen, attraktiven Bonusangeboten und einem hohen MaГџ an Sicherheit ist das Tipico Casino definitiv einen Besuch wert. Nutzen Sie also die Gelegenheit und tauchen Sie ein in die aufregende Welt des Tipico Casinos. Viel GlГјck!
https://tipicocasino.one/
Проблемы с холодильником Whirlpool могут негативно отразиться на сроке хранения продуктов и повлечь за собой их порчу. Если техника стала работать некорректно: плохо охлаждает, издает посторонние звуки, протекает – немедленно обращайтесь в сервисный центр https://whirlpool-rem.ru/. Мы оперативно проведем диагностику и определим причину неполадки. Ремонт будет выполнен качественно, с заменой всех изношенных деталей на новые оригинальные запчасти. Продлите срок службы своего холодильника с помощью наших мастеров!
[url=https://whirlpool-rem.ru/remont-holodilnikov]ремонт холодильников whirlpool на дому[/url]
whirlpool посудомойки ремонт
ремонт холодильников whirlpool на дому
whirlpool ремонт стиральных машин в москве
Das Tipico Live Casino bietet Spielern nun auch die Möglichkeit, ihre Lieblingsspiele auf dem iPad zu genießen. Mit einer benutzerfreundlichen Oberfläche und einer großen Auswahl an Spielen, ist das Tipico Live Casino iPad eine großartige Option für alle, die auch unterwegs nicht auf ihr Casinoerlebnis verzichten möchten.
Das Tipico Live Casino iPad bietet eine Vielzahl von Spielen, darunter Roulette, Blackjack, Baccarat und verschiedene Variationen von Poker. Die Live-Dealer sorgen für ein authentisches Casinoerlebnis, das direkt auf dem iPad genossen werden kann. Mit hochwertigen Grafiken und reibungsloser Performance können Spieler in Echtzeit interagieren und ihre Einsätze platzieren.
Ein weiterer Vorteil des Tipico Live Casino iPad ist die MГ¶glichkeit, jederzeit und Гјberall zu spielen. Ob zu Hause, im Park oder auf Reisen – mit einer Internetverbindung kГ¶nnen Spieler direkt ins Casino eintauchen und ihre Lieblingsspiele genieГџen. Das iPad bietet eine komfortable und portable LГ¶sung fГјr alle, die gerne unterwegs spielen mГ¶chten.
Darüber hinaus bietet das Tipico Live Casino iPad auch exklusive Boni und Aktionen für Spieler, die über ihr iPad spielen. Mit regelmäßigen Promotionen und Angeboten können Spieler noch mehr aus ihrem Casinoerlebnis herausholen und tolle Preise gewinnen.
Insgesamt ist das Tipico Live Casino iPad eine fantastische Option für alle, die ihre Lieblingsspiele auch unterwegs spielen möchten. Mit einer großen Auswahl an Spielen, hochwertigen Grafiken und exklusiven Angeboten bietet das Tipico Live Casino iPad ein erstklassiges Spielerlebnis für alle Casino-Enthusiasten.
https://tipicocasino.one/
scam
[url=https://about.me/remont-stiralnih-spb]ДЗЕН ремонт[/url].
[url=https://penzu.com/public/f050a824]dzen_remont[/url].
[url=https://dialogs.yandex.ru/store/skills/d3a6a41a-remont-stiral-nyh-mashin-sp]dzen-remont[/url].
[url=https://piterskie-zametki.ru/102701]Дзен ремонт стиральных[/url].
[url=https://servis-remont.amebaownd.com/]dzen-remont.ru[/url].
[url=https://www.imdb.com/user/ur126319876/]https://www.dzen-remont.ru[/url].
[url=https://servis-remont.amebaownd.com/]https://www.dzen-remont.ru[/url].
[url=https://servisdv.ru/index.php/uslugi-n/15-remont-stiralnykh-mashin]Дзен ремонт стиральных[/url].
[url=https://ruspioner.ru/profile/view/42426]https://dzen-remont.ru/[/url].
[url=https://medium.com/@reg_48881/ремонт-телевизоров-РЅР°-РґРѕРјСѓ-РІ-санкт-петербурге-f1d680ef8591]Дзен ремонт стиральных[/url].
[url=https://postheaven.net/dzen/remont-varochnykh-panelei-na-domu-v-sankt-peterburge]dzen-remont[/url].
[url=https://dzen.hashnode.dev/remont-varochnyh-panelej-v-sankt-peterburge]https://dzen-remont.ru/[/url].
[url=https://forum.expert-cm.ru/index.php?topic=6641.135]dzen-remont[/url].
[url=https://similars.net/alternatives-to/dzen-remont.ru]ДЗЕН ремонт[/url].
[url=https://reg2165.wixsite.com/dzenremont/post/ремонт-стиральных-машин]DZEN-remont.ru[/url].
[url=https://www.qth.spb.ru/modules.php?name=Your_Account&op=userinfo&username=dzen077]www.dzen-remont.ru[/url].
[url=https://medium.com/@reg_48881/ремонт-телевизоров-на-дому-в-санкт-петербурге-f1d680ef8591]dzen remont[/url].
[url=https://forum.expert-cm.ru/index.php?topic=6641.135]www.dzen-remont.ru[/url].
[url=https://reg2165.wixsite.com/dzenremont/post/ремонт-стиральных-машин]Дзен-ремонт ру[/url].
[url=https://remont-holodilnikov-kazan.ru]Dzen Remont[/url].
[url=https://remont-holodilnikov-kazan.ru]ДЗЕН ремонт[/url].
[url=https://zenwriting.net/dzen/img-5dps]dzen_remont[/url].
[url=https://forum.expert-cm.ru/index.php?topic=6641.135]dzen-remont[/url].
[url=https://alice.ya.ru/store/skills/d3a6a41a-remont-stiral-nyh-mashin-sp]https://dzen-remont.ru/[/url].
[url=https://teletype.in/@dzenremont/123]DZEN-remont.ru[/url].
[url=https://pretich.ru/viewpage.php?page_id=123]Дзен ремонт холодильников[/url].
[url=https://www.tinkoff.ru/invest/social/profile/userator/263347f3-ee90-44a7-92d4-9a26a3ca285d/]Дзен ремонт[/url].
[url=https://reg2165.wixsite.com/dzenremont/post/ремонт-стиральных-машин]https://www.dzen-remont.ru/[/url].
[url=https://www.cossa.ru/profile/?ID=176474]https://dzen-remont.ru/[/url].
[url=http://www.dombytazheldor.ru/remont-stiralnykh-mashin]Дзен ремонт[/url].
[url=https://dzen.pixnet.net/blog/post/98736943]dzen-remont.ru[/url].
[url=http://electronika.spb.ru/kachestvennyj-i-bystryj-remont-stiralnyh-mashin-21559/]https://dzen-remont.ru/[/url].
Мобильное приложение дополненной реальности w2w.group
В отношении [url=https://w2w.group/solutions]разработка ar приложений под ключ[/url] мы Вам непременно поможем. Вот уже более 6ти лет мы работаем в данной сфере, имеем множество положительных комментариев и довольных клиентов, также успели воплотить более 120ти отличных проектов и всё с помощью новых современных технологий. Ознакомиться с галереей работ можно также на вышеупомянутом веб ресурсе.
https://vip-naves.ru/
this article https://metamask-wallet-web3.com/2023/11/16/how-to-sign-up-for-metamask-a-step-by-step-guide-for-beginners/
the original source https://1inch-app.org/2023/11/17/the-advantages-of-using-the-1inch-wallet-for-yield-farming/
זוגתכם או לבד בדירות דיסקרטיות בפתח תקווה. פורטל אקספיינדר הינו המקום האידיאלי המציע מגוון רחב של דירות רציתם. באתר אקספיינדר, האתר המוביל במדינה למבוגרים בלבד קיבצו עבורכם מגוון רחב של נערות הנותנות עיסוי ארוטי ברחבי הארץ. הנערות הליווי והתשלום נעשה מול Relaxing sex massage to please men
На сайте http://www.tribal-tattoo.ru ознакомьтесь с тем, какими услугами вы сможете воспользоваться в тату-салоне. Есть возможность заказать перманентный татуаж губ, в том числе, контур с растушевкой, татуаж бровей. К вашим услугам исправление татуировок, нанесение новой тату, чтобы замаскировать старую. Также доступно перекрытие шрамов, рубцов. Рисунки подбираются в зависимости от предпочтений, а также особенностей. При необходимости мастер выберет для вас оптимальный вариант. Услуга абсолютно безопасная.
Das Casino Tipico Neu ist endlich da! Mit einer Vielzahl von spannenden Spielen und groГџartigen Angeboten erwartet die Spieler ein unvergessliches Erlebnis.
Das neu gestaltete Casino Tipico bietet eine breite Auswahl an beliebten Slots, Tischspielen und Live-Casino-Spielen von führenden Anbietern wie NetEnt, Microgaming, Evolution Gaming und vielen mehr. Die Spieler können sich auf hochwertige Grafiken, schnelle Ladezeiten und ein reibungsloses Spielerlebnis freuen.
Darüber hinaus bietet das Casino Tipico Neu großzügige Boni und Promotionen für neue und bestehende Spieler. Von Willkommensbonusangeboten bis hin zu täglichen Aktionen wird jeder Spieler belohnt. Das Casino veranstaltet auch regelmäßige Turniere und Wettbewerbe, bei denen die Spieler die Chance haben, zusätzliche Belohnungen zu gewinnen.
Ein weiterer wichtiger Aspekt des neuen Casino Tipico ist die Sicherheit und Fairness. Das Casino verfügt über eine Lizenz der Malta Gaming Authority und verwendet die neueste SSL-Verschlüsselungstechnologie, um sicherzustellen, dass alle Spielerdaten geschützt sind. Darüber hinaus werden alle Spiele regelmäßig von unabhängigen Prüfstellen überwacht, um sicherzustellen, dass sie fair und zufällig sind.
Insgesamt bietet das Casino Tipico Neu ein erstklassiges Spielerlebnis für alle, die nach Unterhaltung und Gewinnmöglichkeiten suchen. Mit einer Vielzahl von Spielen, großzügigen Boni und einem maßgeschneiderten Kundenservice ist das neue Casino Tipico definitiv einen Besuch wert. Also schauen Sie vorbei und erleben Sie den Nervenkitzel des Glücksspiels heute noch!
https://tipicocasino.one/
Go Here https://metamask-wallet.at/2023/11/16/revoking-permissions-in-metamask-secure-your-digital-assets/
אינטימי עם בת הזוג או להתארח אצל בחורה שתענג ותפנק אתכם בדירה דיסקרטית? בתל אביב והמרכז ממוקמים כמעט בכל עיר וישוב וניתן למצוא זאת בפיזור רחב. למשל, שירותי ליווי בתל אביב, שירותי ליווי ברמת גן, שירותי החוויה בכמה רמות. אז למה אתם מחכים? זה הזמן לחוויה שלא דירות דיסקרטיות אתיופיות
https://maps.google.gl/url?q=http://surl.li/sigdj
Я купила длинное свадебное платье белого цвета https://svadebniy-salon-moskva.ru/
lost money
lost money
phising
Юрист по уголовным делам — это специалист,
который обладает глубокими знаниями уголовного права и процесса.
Его роль несравненно важна при
защите прав обвиняемого или поддержке
интересов потерпевшего на всех
этапах уголовного судопроизводства.
Он расшифровывает сложности законодательства, строит линию
защиты или обвинения, консультирует и представляет клиента в правоохранительных органах и суде.
Главными задачами юриста являются тщательный анализ материалов дела, выявление
юридически значимых фактов, сбор и представление доказательств, защита от необоснованного обвинения, оказание правовой помощи при
заключении мировых соглашений и в
ходе предварительного следствия.
Профессиональный юрист по уголовным делам должен не только обладать отличной квалификацией и опытом в юридической
сфере, но и иметь высокие моральные качества, такие как честность, ответственность, этичность и уважение к правам человека.
В условиях жесткой конкуренции на рынке юридических услуг
значительное преимущество имеют те
специалисты, кто способен
быстро реагировать на меняющееся законодательство и применять новаторские подходы в защите своего клиента.
Here is my web blog :: юрист в уголовной сфере
http://google.li/url?q=http://surl.li/sigkg
Топ база https://top-base.ru/ это каталог ведущих предприятий России по металлообработке, нефтяной промышленности, базы металлопроката, металлорежущего и измерительного инструмента и других видов смежных отраслей. Также на сайте вы сможете ознакомиться с технической литературой и справочниками различных ГОСТов и ТУ, зарубежными аналогами стали и труб, допусками и посадками и многим другим.
Tipico Casino Bonus Auszahlung Gesperrt
Im Tipico Casino können Spieler von lukrativen Bonusangeboten profitieren, die ihnen zusätzliche Gewinnchancen und Spielspaß bieten. Doch was passiert, wenn die Auszahlung des Bonus gesperrt wird?
Grundsätzlich kann es verschiedene Gründe dafür geben, dass die Auszahlung eines Casino Bonus gesperrt wird. Einer der häufigsten Gründe ist, dass die Bonusbedingungen nicht erfüllt wurden. Diese Bedingungen legen fest, unter welchen Voraussetzungen ein Bonus ausgezahlt werden kann, beispielsweise in Form eines bestimmten Umsatzes oder einer Mindesteinzahlung.
Wenn die Auszahlung des Bonus gesperrt wird, ist es wichtig, Kontakt mit dem Kundenservice des Casinos aufzunehmen. Dort kann geklärt werden, warum die Auszahlung blockiert wurde und inwiefern die Bedingungen nicht erfüllt wurden. Oftmals besteht die Möglichkeit, den Bonus doch noch freizuschalten, indem man die fehlenden Bedingungen nachträglich erfüllt.
Es ist jedoch auch möglich, dass die Auszahlung des Bonus aus anderen Gründen gesperrt wurde, beispielsweise aufgrund von Betrugsverdacht oder anderen Verstößen gegen die Casino-Richtlinien. In diesem Fall ist es wichtig, mit dem Kundenservice des Casinos zu kooperieren und alle erforderlichen Informationen bereitzustellen, um die Angelegenheit aufzuklären.
In jedem Fall ist es ratsam, sich vor der Nutzung eines Casino Bonus über die Bedingungen und Richtlinien des Casinos zu informieren, um unliebsame Überraschungen zu vermeiden. Insbesondere sollte man darauf achten, die Bonusbedingungen sorgfältig zu lesen und zu verstehen, um sicherzustellen, dass man den Bonus korrekt umsetzt und sich somit die Chance auf eine Auszahlung nicht durch Unachtsamkeit verdirbt.
Insgesamt ist es wichtig, bei Problemen mit der Auszahlung eines Casino Bonus einen kühlen Kopf zu bewahren und den Kundenservice des Casinos um Hilfe zu bitten. Oftmals lässt sich die Angelegenheit so schnell und unkompliziert klären und man kann den Bonus doch noch in Anspruch nehmen.
https://tipicocasino.one/
https://maps.google.mg/url?q=http://surl.li/sjytp
Привет всем!
Экскурсионные туры по Москве предлагают множество различных маршрутов: от классических обзорных экскурсий до тематических прогулок по историческим районам, паркам, музеям. Такой тур поможет полностью погрузиться в атмосферу города, увидеть его во всем многообразии.
Прогулка с экскурсией по Москве – это не только возможность узнать много нового, но и насладиться прекрасными видами и запоминающимися моментами. Откройте для себя этот удивительный город с помощью экскурсий и ощутите всю его магию и величие.
Рекомендую всем, лучший проект про Москву https://multi-on.ru
[url=https://multi-on.ru]Экскурсии по столице России[/url]
Ознакомительный тур по Москва Сити
Запоминающиеся экскурсии в Москве
Обзорная экскурсия Москвы
Ознакомительная экскурсия на ВДНХ в Москве
Удачи и хорошего визита в Москву!
Tipico Casino Geschlossen
Das beliebte Online-Casino Tipico hat vor kurzem bekannt gegeben, dass es seine TГјren fГјr deutsche Spieler vorГјbergehend schlieГџen wird. Diese Entscheidung kommt nach neuen gesetzlichen Regelungen und Unsicherheiten in Bezug auf das GlГјcksspielgesetz in Deutschland.
Das Tipico Casino bietet eine Vielzahl von Spielen und attraktiven Angeboten für seine Kunden. Mit der Schließung des Casinos sind viele Spieler enttäuscht und müssen sich nun nach Alternativen umsehen. Das Unternehmen hat jedoch versichert, dass bestehende Spieler ihr Guthaben auszahlen lassen können und dass ihre persönlichen Daten sicher sind.
Es bleibt abzuwarten, wie sich die Situation für Online-Casinos in Deutschland weiterentwickeln wird. Das neue Glücksspielgesetz sieht eine striktere Regulierung von Online-Glücksspielanbietern vor, um den Spielerschutz zu verbessern und den Schwarzmarkt einzudämmen.
In der Zwischenzeit können Spieler bei Tipico weiterhin auf Sportwetten und Live-Wetten setzen. Das Unternehmen arbeitet daran, eine Lösung zu finden, um sein Casino-Angebot wieder für deutsche Spieler zu öffnen.
Es bleibt spannend, wie sich die GlГјcksspielindustrie in Deutschland in den kommenden Monaten entwickeln wird und ob weitere Online-Casinos Г¤hnliche Schritte wie Tipico unternehmen werden. Bis dahin mГјssen sich Spieler auf andere Plattformen verlassen, um ihre Lieblingsspiele zu genieГџen.
https://tipicocasino.one/
Zet Casino bietet seinen Spielern eine Vielzahl von MГ¶glichkeiten, um ihre Gewinne abzuheben. Die “zet casino kotiutus” oder Auszahlungsoption ist einfach und bequem und ermГ¶glicht es den Spielern, ihre Gewinne schnell und unkompliziert zu erhalten.
Um eine Auszahlung bei Zet Casino zu tätigen, müssen Spieler zunächst sicherstellen, dass sie über ausreichendes Guthaben auf ihrem Konto verfügen. Sobald dies der Fall ist, können sie auf ihr Konto zugreifen und den gewünschten Auszahlungsbetrag angeben. Spieler können zwischen verschiedenen Zahlungsmethoden wählen, darunter Kreditkarten, E-Wallets und Banküberweisungen.
Es ist wichtig zu beachten, dass bei der Auszahlung von Gewinnen bei Zet Casino bestimmte Bedingungen und Limits gelten können. Spieler sollten sich daher vor der Auszahlung über die entsprechenden Richtlinien informieren, um sicherzustellen, dass sie ihre Gewinne problemlos erhalten können.
Zet Casino ist bekannt für seine schnellen und zuverlässigen Auszahlungen, die es den Spielern ermöglichen, ihre Gewinne ohne Verzögerung zu erhalten. Mit einer Vielzahl von Zahlungsmethoden und einem effizienten Auszahlungssystem ist Zet Casino die ideale Wahl für alle, die nach einer zuverlässigen und benutzerfreundlichen Online-Casinoerfahrung suchen.
Insgesamt bietet Zet Casino eine herausragende Auszahlungsoption für Spieler, die ihre Gewinne schnell und unkompliziert erhalten möchten. Mit einer Vielzahl von Zahlungsmethoden und einem effizienten Auszahlungssystem ist Zet Casino die ideale Wahl für alle, die nach einer zuverlässigen Online-Casinoerfahrung suchen. Besuchen Sie noch heute Zet Casino und erleben Sie die Spannung des Gewinnens und die Bequemlichkeit der schnellen Auszahlungen.
https://zetcasino.one/
[url=https://gatesofolympus-games.com]сыграть в gates of olympus[/url] – играть в gates of olympus на деньги, gates of olympus играть в рублях
blolbo
Консультация адвоката по уголовным делам – это начальный и крайне важный этап оказания юридической помощи лицам, привлечённым к уголовной ответственности, или желающим защитить свои интересы в уголовном процессе. Во время консультации адвокат оценивает обстановку, вникнет в детали дела, информирует клиента о его правах и возможных последствиях.
Специалисты подскажут, как правильно вести себя при допросе, какие документы необходимы для эффективной защиты, и расскажут о перспективах развития уголовного дела. Клиент получает разъяснения о своих правах, о последствиях предъявленных обвинений и о процессуальных нюансах предстоящих судебных заседаний.
Адвокаты, специализирующиеся на уголовных делах, предоставляют консультации на основе актуальных законов, применяя свой опыт и профессиональные знания. Важность таких встреч неоценима, поскольку они позволяют заложить основу для последующей эффективной защиты в суде. Первичная консультация поможет клиенту понять сложности его положения и принять обоснованные решения о стратегии и тактике защиты.
Выбирая адвоката для консультации, следует обратить внимание на его опыт, репутацию и готовность полностью погрузиться в проблематику дела. Помните: своевременное обращение за квалифицированной юридической помощью может не только облегчить стресс от ведения уголовного дела, но и существенно повысить шансы на благоприятный исход.
http://annayankova.ru
[url=https://t.me/+VBaDQD1pFuA1ZWJi]Ibandirect[/url] – социальная, дебетовая карта банка связной
Zet Casino Promo Code ohne Einzahlung
Online Casinos erfreuen sich immer größerer Beliebtheit und locken mit verschiedensten Aktionen und Boni. Eine besonders attraktive Möglichkeit, um sich als Neukunde einen Vorteil zu verschaffen, sind Promo Codes ohne Einzahlung. Ein solcher Bonus ermöglicht es, ohne eigenes Geld einzusetzen, das Casino Angebot zu testen und erste Gewinne zu erzielen.
Auch das Zet Casino bietet seinen Kunden die Möglichkeit, von einem solchen Promo Code zu profitieren. Dabei handelt es sich um einen speziellen Code, der bei der Anmeldung oder im persönlichen Kundenbereich eingegeben werden kann, um einen Bonus ohne Einzahlung zu erhalten. Dieser kann beispielsweise aus Freispielen, Bonusguthaben oder anderen Vergünstigungen bestehen.
Um einen Promo Code ohne Einzahlung im Zet Casino zu erhalten, müssen die Spieler in der Regel einige Bedingungen erfüllen. Dazu gehört häufig die Erstellung eines neuen Spielerkontos, das Einlösen des Codes innerhalb eines bestimmten Zeitraums oder das Erfüllen der Umsatzbedingungen für mögliche Gewinne aus dem Bonus.
Es empfiehlt sich, regelmäßig auf der Website des Zet Casinos nach aktuellen Angeboten zu suchen, um keine interessanten Aktionen zu verpassen. Auch Newsletter oder Benachrichtigungen über die Casino App können dabei helfen, stets über neue Promo Codes informiert zu sein.
Insgesamt bieten Promo Codes ohne Einzahlung eine großartige Möglichkeit, um auf unterhaltsame Weise die Welt des Online Glücksspiels zu erkunden und dabei vielleicht sogar erste Gewinne zu erzielen. Es lohnt sich also, die Angebote des Zet Casinos im Auge zu behalten und von den attraktiven Boni zu profitieren.
https://zetcasino.one/
[url=https://t.me/+okjqEygf3QNmYTY8]Zen Business[/url] – классик, оментум дебетовая
Zet Online Casino: Alles, was Sie wissen mГјssen
Das Zet Online Casino ist eine neue Online-GlГјcksspielplattform, die sich schnell einen Namen in der Welt der Online-Casinos gemacht hat. Mit einer Vielzahl von Spielen, groГџzГјgigen Boni und einem benutzerfreundlichen Design ist das Zet Casino definitiv einen Blick wert.
Eines der besten Dinge am Zet Online Casino ist die enorme Auswahl an Spielen, die es seinen Spielern bietet. Von klassischen Tischspielen wie Blackjack und Roulette bis hin zu modernen Spielautomaten und Live-Dealer-Spielen gibt es fГјr jeden Geschmack etwas zu finden. Die Spiele werden von renommierten Entwicklern wie NetEnt, Microgaming und Play’n GO bereitgestellt, so dass Sie sich auf qualitativ hochwertige Grafiken und spannende SpielablГ¤ufe freuen kГ¶nnen.
Neben der großen Spielauswahl bietet das Zet Casino auch großzügige Boni und Aktionen für neue und bestehende Spieler. Wenn Sie sich zum Beispiel anmelden, erhalten Sie einen Willkommensbonus, der Ihnen zusätzliches Guthaben und Freispiele verschafft. Darüber hinaus gibt es regelmäßig Promotionen wie Reload-Boni, Cashback-Angebote und Turniere, die Ihre Gewinnchancen erhöhen.
Das Zet Online Casino legt auch großen Wert auf die Sicherheit seiner Spieler. Die Plattform verfügt über eine gültige Glücksspiellizenz und verwendet moderne Verschlüsselungstechnologien, um sicherzustellen, dass Ihre persönlichen Daten geschützt sind. Darüber hinaus bietet das Casino verschiedene Zahlungsmethoden an, die schnell und sicher sind, so dass Sie sich keine Sorgen um Ihre Ein- und Auszahlungen machen müssen.
Zusammenfassend lässt sich sagen, dass das Zet Online Casino eine hervorragende Wahl für alle Glücksspielbegeisterten ist. Mit einer breiten Spielauswahl, großzügigen Boni und einem hohen Maß an Sicherheit und Fairness ist das Zet Casino definitiv einen Besuch wert. Besuchen Sie noch heute die Website und entdecken Sie die aufregende Welt des Zet Casinos!
https://zetcasino.one/
[url=https://fabrika-mercha.ru/collection/muzhskie]бейсболка мужская +в пензе[/url] – озон интернет магазин бейсболки мужские, бейсболка мужская атрибутика купить
В [url=https://stinol-servise.ru/]stinol-servise.ru[/url] мы понимаем, как важен холодильник для каждой семьи. Именно поэтому мы стараемся обеспечить максимально качественный ремонт, чтобы ваша техника Stinol снова работала как новенькая. Наши мастера регулярно проходят обучение, отслеживают все новинки в области ремонта и используют проверенные методики и расходные материалы. Доверьте нам ремонт, и ваш холодильник будет радовать вас долгие годы!
ремонт стинол
замена термостата в холодильнике стинол
замена термостата стинол
[url=https://art-print18.ru/]буклеты печать[/url] – наклейки на самоклеющейся бумаге, вырубная этикетка
Мобильное приложение дополненной реальности w2w.group
Относительно [url=https://w2w.group/solutions]vr разработка на заказ[/url] мы Вам обязательно окажем помощь. Вот уже более 6ти лет мы трудимся в данной сфере, имеем много хороших отзывов и довольных покупателей, также успели воплотить более сотни превосходных проектов и всё с помощью новейших инновационных технологий. Ознакомиться с портфолио можно также на вышеупомянутом веб портале.
Vr обучение, разработка w2w.group
Касаясь [url=https://w2w.group/solutions]компания разработка приложений дополненной реальности[/url] мы Вам обязательно поможем. Вот уже свыше 6ти лет мы реализуем работу в представленной сфере, имеем множество положительных комментариев и радостных клиентов, также успели реализовать более 120ти отличных проектов и всё с помощью новейших прогрессивных технологий. Ознакомиться с галереей работ возможно также на вышеупомянутом сайте.
Zet Casino 30: Ein neues und aufregendes Online-Casino-Erlebnis
Das Zet Casino 30 ist ein neues Online-Casino, das Spielern eine aufregende und spannende Spielerfahrung bietet. Mit einer Vielzahl von Spielen, groГџzГјgigen Bonusangeboten und erstklassigem Kundenservice ist das Zet Casino 30 die perfekte Wahl fГјr alle, die nach einem unterhaltsamen und lohnenden Casino-Erlebnis suchen.
Eine der herausragenden Eigenschaften des Zet Casino 30 ist die beeindruckende Auswahl an Spielen, die für jeden Geschmack und jedes Budget geeignet sind. Von klassischen Tischspielen wie Roulette und Blackjack bis hin zu aufregenden Spielautomaten und Live-Dealer-Spielen bietet das Zet Casino 30 eine Vielzahl von Optionen, aus denen die Spieler wählen können. Darüber hinaus arbeitet das Casino mit einigen der besten Softwareentwickler der Branche zusammen, um sicherzustellen, dass das Spielerlebnis stets von höchster Qualität ist.
Ein weiterer Grund, warum das Zet Casino 30 bei Spielern so beliebt ist, sind die großzügigen Bonusangebote, die regelmäßig angeboten werden. Neue Spieler werden mit einem lukrativen Willkommensbonus belohnt, während bestehende Spieler von verschiedenen Promotionen und Aktionen profitieren können, die ihre Bankroll steigern und das Spielerlebnis noch aufregender machen. Darüber hinaus verfügt das Casino über ein Treueprogramm, das es loyalen Spielern ermöglicht, noch mehr Belohnungen zu verdienen.
Neben der großen Auswahl an Spielen und den großzügigen Bonusangeboten legt das Zet Casino 30 großen Wert auf erstklassigen Kundenservice. Das freundliche und kompetente Support-Team steht den Spielern rund um die Uhr zur Verfügung, um bei Fragen oder Problemen zu helfen und sicherzustellen, dass das Spielerlebnis so reibungslos wie möglich verläuft.
Insgesamt bietet das Zet Casino 30 ein erstklassiges Online-Casino-Erlebnis, das Spieler aller Erfahrungsstufen anspricht. Mit einer Vielzahl von Spielen, groГџzГјgigen Bonusangeboten und exzellentem Kundenservice ist das Zet Casino 30 definitiv einen Besuch wert.
https://zetcasino.one/
Amplificadores de senal gsm
Adquiere un amplificador de senal para moviles y olvidate de los cortes
[url=https://www.360cities.net/profile/neillopez23]https://www.360cities.net/profile/neillopez23[/url]
[url=https://avtosalonbmwftnz.dp.ua]офіційний дилер бмв[/url]
Приобрести ценогенетический BMW 2024 года в течение Украине числом лучшей цене язык официального дилера. Тест-драйв, страхование, субсидирование, промоакции равным образом спецпредложения.
https://avtosalonbmwftnz.dp.ua
Im Tipico Casino gibt es eine Vielzahl von unterhaltsamen Spielen, bei denen man die Chance hat, Geld zu verdienen. Doch welches Spiel bringt am meisten Geld?
Ein Spiel, das besonders für hohe Gewinne bekannt ist, ist Blackjack. Hier können Spieler mit etwas Geschick und Strategie hohe Gewinne erzielen. Auch Roulette bietet gute Gewinnchancen, vor allem bei bestimmten Wetten wie zum Beispiel auf eine bestimmte Zahl oder Farbe.
Wer gerne an Spielautomaten spielt, sollte sich an progressive Jackpot-Slots halten. Hier steigt der Jackpot mit jedem Einsatz und kann immense Summen erreichen. Ein weiteres beliebtes Spiel im Tipico Casino ist Poker. Hier kann man ebenfalls hohe Gewinne erzielen, vor allem beim Turnierpoker.
Es ist wichtig zu beachten, dass GlГјcksspiele immer ein gewisses Risiko mit sich bringen und man auch Geld verlieren kann. Es ist daher ratsam, verantwortungsvoll zu spielen und sich immer seiner eigenen Limits bewusst zu sein.
Letztendlich gibt es kein bestimmtes Spiel, das am meisten Geld bringt, denn der Gewinn hängt von verschiedenen Faktoren wie Glück, Geschick und Strategie ab. Es ist daher ratsam, verschiedene Spiele auszuprobieren und das zu wählen, das einem am meisten Spaß macht und man sich am wohlsten fühlt.
Insgesamt bietet das Tipico Casino eine Vielzahl von Spielen, bei denen man die Chance hat, Geld zu verdienen. Durch geschicktes Spielen und ein wenig GlГјck kann man durchaus hohe Gewinne erzielen.
https://tipicocasino.one/
https://www.google.com.et/url?q=http://surl.li/sjywf
important source [url=https://galaxyswapper.xyz/]galaxy swapper download[/url]
[url=https://opt24.store/product-category/vypechka/biskvity/]бисквиты из Турции оптом[/url] – лимонад Aziano оптом, моти оптом
[url=https://gatesofolympus-games.com]gates of olympus на деньги[/url] – гейтс оф олимпус на деньги, gates of olympus slot online
בבת ים, חולון והסביבה כולל כתובות, טלפונים וניווט שיביא אתכם היישר לעונג. בת-ים העיר האקזוטית שליטה עבד ומלכה, עיסוי ארוטי ובודי מסאז’, יש כאלה שירצו לשחק משחקי תפקידים מלווה בתלבושות ותחפושות. וכאלה שמעבר לסקס ירצו להתענג והגשמת חלומות. נערות ליווי בראשון נערת ליווי פרטית – הסיפור המקראי על בחורה מינית הראשונה
На сайте http://kinomanhd720.online находятся самые популярные, интересные и увлекательные фильмы на разный вкус и различного жанра: драмы, комедии, триллеры, ужасы и многое другое. Вы обязательно найдете то, что посмотреть сегодня вечером, чтобы разнообразить досуг. Все они представлены в отличном качестве и с хорошим звуком. Также имеются и сериалы, мультфильмы, мистические фильмы, которые точно никого не оставят равнодушным. Специально для вас есть подборки про школу, врачей, вампиров, войну, любовь.
[url=https://qooh.me/andy43]vc.ru[/url].
[url=https://www.storeboard.com/andy]vc.ru[/url].
[url=http://www.askmap.net/location/6874106/andy/andy]vc.ru[/url].
[url=https://anyflip.com/homepage/dgkcd]vc.ru[/url].
[url=https://www.growkudos.com/profile/andy_andy_1]vc.ru[/url].
[url=https://www.proarti.fr/account/andy-1]vc.ru[/url].
[url=https://app.roll20.net/users/13178306/andy-a]vc.ru[/url].
[url=http://www.askmap.net/location/6874106/andy/andy]vc.ru[/url].
[url=https://teletype.in/@andy43]vc.ru[/url].
[url=https://guides.co/a/andy-andy]vc.ru[/url].
[url=https://www.curioos.com/andyandy]vc.ru[/url].
[url=https://defol.io/andy-1]vc.ru[/url].
[url=https://mxsponsor.com/riders/andy/about]vc.ru[/url].
[url=https://pubhtml5.com/homepage/zhebw/]vc.ru[/url].
[url=https://solo.to/andyandy]vc.ru[/url].
[url=https://my.archdaily.com/us/@andy-147]vc.ru[/url].
[url=https://developers.oxwall.com/user/andy43]vc.ru[/url].
[url=https://myapple.pl/users/441780-andy3]vc.ru[/url].
[url=https://anyflip.com/homepage/dgkcd]vc.ru[/url].
[url=https://www.adpost.com/u/a79346392/]vc.ru[/url].
[url=https://www.divephotoguide.com/user/andy43]vc.ru[/url].
[url=https://app.roll20.net/users/13178306/andy-a]vc.ru[/url].
[url=https://www.curioos.com/andyandy]vc.ru[/url].
[url=https://www.exchangle.com/andyandy]vc.ru[/url].
[url=https://www.designspiration.com/a79346392/saves/]vc.ru[/url].
[url=https://qooh.me/andy43]vc.ru[/url].
[url=https://savee.it/andy43433/]vc.ru[/url].
[url=https://www.growkudos.com/profile/andy_andy_1]vc.ru[/url].
[url=https://my.archdaily.com/us/@andy-147]vc.ru[/url].
[url=https://tupalo.com/en/users/6481968]vc.ru[/url].
[url=https://ioby.org/users/a79346392822020]vc.ru[/url].
[url=https://www.freecodecamp.org/andy43]vc.ru[/url].
Zet Casino Einzahlungsmöglichkeiten
Zet Casino ist ein beliebtes Online-Casino, das eine Vielzahl von Einzahlungsmöglichkeiten für seine Spieler anbietet. Die Vielfalt der verfügbaren Optionen macht es einfach, Geld auf das Spielerkonto einzuzahlen und schnell mit dem Spielen zu beginnen.
Eine der beliebtesten Einzahlungsmethoden bei Zet Casino ist die Verwendung von Kredit- oder Debitkarten wie Visa und Mastercard. Diese Methode ist einfach und schnell und ermöglicht es den Spielern, sofort mit dem Spielen zu beginnen.
Eine weitere häufig genutzte Option ist die Zahlung per E-Wallet, wie zum Beispiel Skrill oder Neteller. Diese Methoden sind besonders beliebt, da sie eine zusätzliche Sicherheitsebene bieten und die Spieler ihre Transaktionen schnell und einfach abwickeln können.
Zet Casino bietet auch die Möglichkeit, per Banküberweisung einzuzahlen. Diese Methode kann etwas länger dauern als andere Methoden, ist jedoch eine sichere und zuverlässige Option für Spieler, die keine E-Wallets oder Kreditkarten verwenden möchten.
Darüber hinaus akzeptiert Zet Casino auch verschiedene Kryptowährungen wie Bitcoin, Ethereum und Litecoin. Dies ermöglicht es den Spielern, ihre Einzahlungen anonym und sicher abzuwickeln.
Insgesamt bietet Zet Casino eine Vielzahl von Einzahlungsmöglichkeiten, um den Bedürfnissen und Vorlieben seiner Spieler gerecht zu werden. Egal für welche Methode Sie sich entscheiden, Sie können sicher sein, dass Ihre Transaktionen sicher und zuverlässig abgewickelt werden. Besuchen Sie noch heute Zet Casino und entdecken Sie die Vielzahl der Einzahlungsmöglichkeiten!
https://zetcasino.one/
[url=https://luckyjet-win.pro]lucky jet демо[/url] – скачать lucky jet, ИГРАТЬ В LUCKY JET
Услуги разработки приложений дополненной реальности w2w.group
В отношении [url=https://w2w.group/solutions]стоимость разработки vr игры[/url] мы Вам непременно поможем. Вот уже свыше 6ти лет мы трудимся в представленной сфере, имеем множество положительных отзывов и счастливых покупателей, также успели реализовать более сотни успешных проектов и всё с помощью новейших современных технологий. Ознакомиться с портфолио можно также на вышеупомянутом сайте.
Wenn Sie kein Interesse mehr an Ihrem Zet Casino Konto haben und es löschen möchten, gibt es ein paar Schritte, die Sie befolgen müssen. Das Löschen eines Kontos bei Zet Casino ist recht einfach und unkompliziert.
ZunГ¤chst mГјssen Sie sich auf der Website von Zet Casino einloggen und zum Bereich “Einstellungen” oder “Profil” navigieren. Dort finden Sie die Option “Konto lГ¶schen” oder Г¤hnliches. Wenn Sie diese Option angeklickt haben, werden Sie gebeten, Ihren Account zu bestГ¤tigen, indem Sie Ihre persГ¶nlichen Daten erneut eingeben.
Nachdem Sie Ihr Konto bestätigt haben, wird es in der Regel innerhalb von 24 Stunden gelöscht. Bitte beachten Sie, dass Sie keine offenen Wetten oder Guthaben auf Ihrem Konto haben sollten, da diese nach der Löschung verloren gehen.
Es ist wichtig zu beachten, dass, wenn Sie Ihr Konto löschen, Sie auch alle Ihre persönlichen Daten und gesammelten Punkte oder Prämien verlieren. Stellen Sie also sicher, dass Sie diese Informationen vor der Löschung archivieren oder speichern.
Insgesamt ist das Löschen eines Zet Casino Kontos ein einfacher Prozess, der Ihnen ermöglicht, Ihre Daten zu schützen und sich von der Plattform abzumelden, wenn Sie kein Interesse mehr daran haben. Wenn Sie weitere Fragen zur Löschung Ihres Kontos haben, können Sie sich jederzeit an den Kundenservice von Zet Casino wenden.
https://zetcasino.one/
בעיסוי מענג ופינוקים לרוב. כל שנותר לכם זה להיכנס לבחור את המתאים לכם ולהרים טלפון לתיאום. דירות דיסקרטיות בתל בירושלים דירות דיסקרטיות בירושלים זו כבר לא תופעה חולפת והדירות מהוות פנינת העיר. דירה דיסקרטית בירושלים הינה אטרקציה לכל דבר ההזמנה המבוקשת. דירות דיסקרטיות סקס
На сайте https://iz-medi.ru/ ознакомьтесь с шаровыми кранами, фитингами, гибкими подводками, а также трубами, РВД. Отмечены технические характеристики, важные особенности продукции и другие моменты. Также имеются и востребованные категории товаров, которые особенно популярны среди клиентов компании. Сюда входят: шаровые краны, гибкая подводка, выполненная из нержавеющей стали. Также имеется РВД из нержавейки. Ознакомьтесь со всем ассортиментом продукции. Есть возможность приобрести все, что нужно, под заказ.
Tipico Casino Bonus Codes
Tipico Casino is one of the most popular online casinos in Germany, offering a wide range of games and promotions for players to enjoy. One of the most exciting aspects of playing at Tipico Casino is taking advantage of their bonus codes, which can help players boost their winnings and enhance their overall gaming experience.
Bonus codes are special codes that players can enter when making a deposit or claiming a promotion at an online casino. These codes can provide players with extra funds, free spins, or other rewards to help them get the most out of their gaming experience. At Tipico Casino, players can find a variety of bonus codes that can be used to enhance their gameplay and increase their chances of winning big.
One of the most popular bonus codes at Tipico Casino is the welcome bonus code, which is offered to new players who sign up for an account. This bonus code typically provides players with a matched deposit bonus, giving them extra funds to play with when they make their first deposit. In addition to the welcome bonus code, Tipico Casino also offers regular promotions and bonuses that players can take advantage of by using specific bonus codes.
To claim a bonus code at Tipico Casino, players simply need to enter the code in the designated field when making a deposit or claiming a promotion. Once the code is entered, the bonus will be added to the player’s account, providing them with extra funds or rewards to use while playing their favorite casino games.
Overall, bonus codes are a great way for players to enhance their gaming experience at Tipico Casino. By taking advantage of these codes, players can increase their chances of winning big and enjoy more time playing their favorite casino games. So why not give it a try and see what bonus codes Tipico Casino has to offer?
In conclusion, bonus codes are a fantastic way for players to enhance their online gaming experience. By using the right codes at the right time, players can boost their winnings, secure more free spins, and really ramp up the fun of their time at Tipico Casino. Make a point of checking out the array of bonus codes available to you, and start enjoying even more thrilling gaming today!
https://tipicocasino.one/
Amplificadores de senal gsm
Potencia la senal de tu movil con un amplificador de ultima generacion
[url=https://www.atlasobscura.com/users/neillopez23]https://www.atlasobscura.com/users/neillopez23[/url]
boba 😀
124SDS9742
сколько стоит ручная лазерная сварка [url=http://www.apparat-ruchnoy-lazernoy-svarki.ru/]http://www.apparat-ruchnoy-lazernoy-svarki.ru/[/url] .
Das beste Zet Casino: Ein Гњberblick
Das Zet Casino gilt als eines der besten Online-Casinos auf dem Markt. Mit einer Vielzahl von Spielen, groГџzГјgigen Boni und einem reibungslosen Spielerlebnis hat sich das Zet Casino einen festen Platz in der Welt der Online-GlГјcksspiele erobert.
Eine der herausragenden Eigenschaften des Zet Casinos ist die Vielfalt an Spielen, die es seinen Spielern bietet. Von klassischen Tischspielen wie Blackjack und Roulette bis hin zu aufregenden Spielautomaten und Live-Casino-Spielen gibt es für jeden Geschmack etwas zu finden. Die Spiele werden von renommierten Softwareanbietern wie NetEnt, Microgaming und Play’n GO bereitgestellt, was für eine erstklassige Spielerfahrung sorgt.
Ein weiterer Grund, warum das Zet Casino als das beste Online-Casino gilt, sind die großzügigen Boni und Werbeaktionen, die es seinen Spielern bietet. Neue Spieler können von einem attraktiven Willkommensbonus profitieren, der sowohl Bonusgeld als auch Freispiele umfasst. Auch regelmäßige Spieler werden mit wöchentlichen Aktionen und Treueprämien belohnt, die ihr Spielerlebnis noch aufregender machen.
Das Zet Casino zeichnet sich auch durch seinen exzellenten Kundenservice aus. Das Support-Team ist rund um die Uhr erreichbar und steht den Spielern bei Fragen oder Problemen zur VerfГјgung. Die Website ist benutzerfreundlich gestaltet und sorgt fГјr ein reibungsloses Navigationserlebnis.
Insgesamt Гјberzeugt das Zet Casino mit einer breiten Auswahl an Spielen, groГџzГјgigen Boni und einem exzellenten Kundenservice. FГјr alle, die nach einem erstklassigen Online-Casino suchen, ist das Zet Casino definitiv eine ausgezeichnete Wahl.
https://zetcasino.one/
http://maps.google.com.gt/url?q=https://zdmed.ru/
lalablublu
[url=https://luckyjet-win.pro]как играть в lucky jet[/url] – 1 lucky jet, lucky jet регистрация
Zet Casino: 20 kostenlose Freispiele
Zet Casino ist eine Online-Glücksspielplattform, die Spielern eine Vielzahl von Spielen und Promotionen bietet. Eine der beliebtesten Aktionen, die derzeit verfügbar ist, sind die 20 kostenlosen Freispiele, die Spieler erhalten können. Diese Freispiele bieten Spielern die Möglichkeit, einige der beliebtesten Spielautomaten des Casinos kostenlos zu spielen und dabei echte Geldgewinne zu erzielen.
Um die 20 kostenlosen Freispiele zu beanspruchen, mГјssen Spieler lediglich ein Konto bei Zet Casino erstellen und eine Einzahlung tГ¤tigen. Sobald die Einzahlung abgeschlossen ist, werden die Freispiele automatisch gutgeschrieben und kГ¶nnen sofort genutzt werden. Spieler haben die MГ¶glichkeit, die Freispiele auf einer Vielzahl von Spielautomaten zu verwenden, darunter beliebte Titel wie Book of Dead, Starburst und Gonzo’s Quest.
Die Freispiele bieten Spielern die Möglichkeit, das Casino und seine Spiele risikofrei zu erkunden, ohne eigenes Geld setzen zu müssen. Darüber hinaus haben Spieler die Chance, echte Gewinne zu erzielen, die sie sich anschließend auszahlen lassen können. Es ist jedoch wichtig zu beachten, dass die Freispiele bestimmten Umsatzbedingungen unterliegen, die erfüllt werden müssen, bevor Gewinne ausgezahlt werden können.
Insgesamt sind die 20 kostenlosen Freispiele von Zet Casino eine großartige Möglichkeit für Spieler, das Casino zu testen und dabei die Chance zu haben, echtes Geld zu gewinnen. Mit einer Vielzahl von Spielautomaten zur Auswahl und attraktiven Promotionen bietet Zet Casino ein unterhaltsames und lohnendes Spielerlebnis für alle Glücksspielfans.
https://zetcasino.one/
https://google.com.mt/url?q=https://zdmed.ru/
124SDS9742
Заключить договор на вывоз мусора Москва ecologia-t.ru
Насчет [url=https://ecologia-t.ru/info/vivoz_mebeli/]вывоз старой мебели[/url] мы Вам поможем в данный момент. Звоните по телефону 8(495)506-26-76 или закажите обратный и мы Вам перезвоним. Мы находимся по адресу: 109382, г. Москва, ул. Краснодонская, д. 46. Подробный прайс лист Вы найдете на данном сайте ecologia-t.ru и зависит от многих показателей. Это: тип мусора, размеры контейнера и запрашиваемая грузоподъемность транспорта. Окончательная стоимость будет высчитана после созвона с нашим менеджером. Звоните и быстрее оформляйте заявку на вывоз отходов.
кабель канал [url=https://alyuminievyj-plintus-msk.ru/]кабель канал[/url] .
Pharmacology’s Role and Drug Development in Modern Society
Pharmacology, the science of drugs and their effects on living systems, plays a pivotal role in modern society.
With an ever-increasing burden of diseases and health
conditions, the development of new medications is vital for improving healthcare outcomes and enhancing quality of life.
This article explores the significance of pharmacology and the process of drug development in addressing contemporary health
challenges.
**Understanding Pharmacology:**
Pharmacology encompasses a multidisciplinary approach,
combining aspects of biology, chemistry, physiology, and pathology to study how drugs
interact with biological systems. It delves into the mechanisms of action, therapeutic effects, and potential side effects of medications.
By comprehensively understanding these factors, pharmacologists
strive to develop safer and more effective drugs for treating
various ailments.
**Importance of Drug Development:**
The development of new drugs is essential for combating both prevalent and emerging health threats.
Chronic diseases such as cardiovascular disorders, cancer, diabetes, and
respiratory ailments continue to impose a significant burden on global health.
Moreover, the emergence of novel pathogens, antimicrobial resistance, and environmental factors further underscore the
need for innovative pharmaceutical solutions.
**Phases of Drug Development:**
The journey from drug discovery to market availability is
a complex and rigorous process comprising several distinct phases:
1. **Drug Discovery:** Scientists identify potential
drug candidates through various means, including screening natural compounds, designing molecules using
computational methods, or repurposing existing drugs for new indications.
2. **Preclinical Research:** Promising drug candidates
undergo extensive laboratory testing to assess their safety, efficacy,
and pharmacokinetic properties in cellular and animal models.
3. **Clinical Trials:** Drug candidates that demonstrate favorable preclinical results advance to clinical trials, which consist of three sequential phases:
– **Phase I:** Involves testing the drug’s safety and dosage in a small group of healthy volunteers.
– **Phase II:** Evaluates the drug’s efficacy and side
effects in a larger group of individuals with the targeted disease or condition.
– **Phase III:** Further assesses the drug’s safety and efficacy in a diverse population across multiple locations to establish its
therapeutic benefits and risks.
4. **Regulatory Approval:** Following successful completion of clinical
trials, pharmaceutical companies submit comprehensive data to regulatory
authorities such as the FDA in the United States or the EMA
in Europe for approval to market the drug.
5. **Post-Marketing Surveillance:** Even after approval,
ongoing monitoring is crucial to detect any unforeseen adverse
effects and ensure the drug’s continued safety and efficacy in real-world settings.
**Challenges and Future Directions:**
Despite significant advancements in pharmacology and drug development, several challenges persist.
These include escalating research and development costs, regulatory hurdles,
ethical considerations, and the increasing complexity of diseases.
Additionally, disparities in access to medications and healthcare services remain a global concern.
Looking ahead, emerging technologies such as precision medicine, gene editing, and artificial intelligence offer promising avenues for personalized therapies and
targeted drug development. Collaborative efforts among researchers, clinicians, pharmaceutical companies, and policymakers are imperative to address these challenges
and harness the full potential of pharmacology in improving global health outcomes.
In conclusion, pharmacology plays a central role in modern society by
driving the development of new medications to combat a myriad of health challenges.
Through continuous innovation and collaboration, the field of pharmacology
holds immense promise for enhancing healthcare delivery and promoting
well-being worldwide.
my page … “https://rotorm.hatenablog.com/entry/2024/03/18/003810
[url=https://avtosalonbmwftnz.dp.ua]купити bmw[/url]
Приобрести новый БМВ 2024 лета на Украине числом лучшей стоимости у официального дилера. Тест-драйв, хеджирование, кредитование, промо-акции и спецпредложения.
http://avtosalonbmwftnz.dp.ua
1SS3D249742
Ein Casino Bonus ist eine fantastische Möglichkeit, um das eigene Guthaben aufzustocken und mehr Spaß beim Spielen zu haben. Einer der Anbieter, der regelmäßig großzügige Boni vergibt, ist Tipico.
Bei Tipico gibt es verschiedene Arten von Boni, die sowohl Neukunden als auch Bestandskunden zur Verfügung stehen. Einer der beliebtesten Boni ist der Willkommensbonus für neue Kunden. Dieser Bonus bietet die Möglichkeit, das eingezahlte Guthaben zu verdoppeln und somit mit einem deutlich höheren Betrag im Casino zu spielen.
Um den Willkommensbonus zu erhalten, müssen neue Kunden sich lediglich registrieren und eine Einzahlung tätigen. Der Bonus wird dann automatisch gutgeschrieben und kann sofort für das Spielen genutzt werden.
Auch Bestandskunden werden bei Tipico regelmäßig mit verschiedenen Aktionen belohnt. So gibt es beispielsweise regelmäßige Reload-Boni, bei denen die Einzahlung nochmals aufgestockt wird. Zudem können Kunden von Cashback-Aktionen profitieren, bei denen ein Teil des verlorenen Einsatzes zurückerstattet wird.
Um von den verschiedenen Boni bei Tipico zu profitieren, sollten Kunden regelmäßig die Promotion-Seite auf der Webseite besuchen und sich über aktuelle Angebote informieren. Zudem lohnt es sich, den Newsletter zu abonnieren, um keine Aktion zu verpassen.
Insgesamt bietet Tipico seinen Kunden eine Vielzahl an attraktiven Bonusangeboten, die das Spielerlebnis im Casino noch spannender machen. Wer also gerne im Casino spielt, sollte sich die verschiedenen Boni bei Tipico genauer anschauen und sich die Chance auf zusätzliches Guthaben nicht entgehen lassen.
https://tipicocasino.one/
124SDS9742
Discovered an article that’s sure to appeal to you – I recommend checking it out http://www.gmwebsite.com/web/redirect.asp?url=https://in.chat-ruletka-18.com
http://ebromberger.com/__media__/js/netsoltrademark.php?d=https://zdmed.ru/
1249742
отели москвы недорого https://otelivmoskva.ru/oteli-i-gostinicy-v-moskve/
Tipico Casino Auszahlen lassen
Das Tipico Casino bietet seinen Kunden eine Vielzahl von Möglichkeiten, um Gewinne auszahlen zu lassen. Dabei ist es wichtig zu beachten, dass es einige Bedingungen gibt, die erfüllt werden müssen, um eine erfolgreiche Auszahlung durchführen zu können.
Zunächst einmal muss der Kunde sich vergewissern, dass er alle Bonusbedingungen erfüllt hat, bevor eine Auszahlung beantragt werden kann. In vielen Fällen gibt es Umsatzbedingungen, die erfüllt werden müssen, bevor das Bonusguthaben in Echtgeld umgewandelt werden kann.
Nachdem alle Bedingungen erfüllt wurden, kann der Kunde eine Auszahlung beantragen. Dazu muss er sich einfach in sein Konto einloggen und den entsprechenden Bereich für Auszahlungen aufrufen. Dort kann er den Betrag auswählen, den er auszahlen lassen möchte, und die gewünschte Zahlungsmethode angeben.
Es ist wichtig zu beachten, dass Tipico Casino verschiedene Zahlungsmethoden anbietet, darunter Kreditkarten, BankГјberweisungen und E-Wallets. Jede Zahlungsmethode hat ihre eigenen Bearbeitungszeiten und GebГјhren, die der Kunde berГјcksichtigen sollte.
Sobald die Auszahlung beantragt wurde, wird sie vom Tipico Casino überprüft und innerhalb weniger Tage bearbeitet. In einigen Fällen kann es jedoch länger dauern, insbesondere wenn zusätzliche Dokumente für die Verifizierung des Kontos angefordert werden.
Insgesamt bietet das Tipico Casino eine zuverlässige und sichere Möglichkeit, um Gewinne auszahlen zu lassen. Durch die Einhaltung der allgemeinen Geschäftsbedingungen und der Bonusbedingungen können Kunden sicherstellen, dass ihre Auszahlungen schnell und ohne Probleme abgewickelt werden.
https://tipicocasino.one/
химический крепеж
Opened up an enthralling read – I’d like to share it with you http://azon.ua/bitrix/rk.php?goto=https://rf.chatruletka-18.com/
1SS3D249742
Tipico Casino Guthaben gesperrt – Was tun?
Das Tipico Casino gehört zu den beliebtesten Online-Casinos in Deutschland und begeistert viele Spieler mit einer vielfältigen Auswahl an Spielen und attraktiven Bonusangeboten. Doch was passiert, wenn plötzlich das Guthaben im Casino gesperrt wird?
Es gibt verschiedene Gründe, warum das Guthaben im Tipico Casino gesperrt werden kann. Häufig liegt es an Verstößen gegen die Nutzungsbedingungen des Casinos, beispielsweise durch das Spielen mit mehreren Accounts oder das Verdacht auf Betrug. Auch technische Probleme können dazu führen, dass das Guthaben vorübergehend gesperrt wird.
Doch was können Spieler tun, wenn ihr Guthaben gesperrt wurde? Zunächst sollten sie sich an den Kundenservice des Tipico Casinos wenden und das Problem schildern. Oftmals kann der Kundenservice weiterhelfen und die Sperrung aufheben, falls es sich um einen Irrtum handelt.
Sollte das Guthaben tatsächlich rechtmäßig gesperrt worden sein, ist es wichtig, die Ursache zu klären und gegebenenfalls Maßnahmen zu ergreifen, um eine erneute Sperrung zu vermeiden. Spieler sollten sich in diesem Fall die Nutzungsbedingungen des Tipico Casinos genau durchlesen und sicherstellen, dass sie sich an diese halten.
Insgesamt ist es wichtig, ruhig zu bleiben und das Problem sachlich anzugehen, wenn das Guthaben im Tipico Casino gesperrt wird. Mit dem richtigen Vorgehen und der Unterstützung des Kundenservice lässt sich die Sperrung meist schnell klären und das Spielerlebnis im Tipico Casino kann fortgesetzt werden.
https://tipicocasino.one/
http://scounting.org/__media__/js/netsoltrademark.php?d=https://zdmed.ru/
На сайте https://xakervip.com/topic/282/page/10/ вы сможете воспользоваться услугами хакеров, заказать взлом почты, а также тайную слежку, а заодно пробить номер, если у вас есть какие-либо подозрения. Также можно будет узнать пароли электронной почты. Для того чтобы подобрать подходящий вариант, необходимо ознакомиться со всеми разделами форума. С той целью, чтобы воспользоваться услугами, просто напишите хакеру. Он ответит вам и предложит оптимальную цену. Его услуги обойдутся недорого, а вопрос будет решен оперативно.
blabla
Das Online-Glücksspielunternehmen Tipico ist bekannt für sein vielfältiges Angebot an Casinospielen und Sportwetten. Doch immer wieder hört man von Spielern, deren Geld für das Casino blockiert wird. Woran liegt das und was können Betroffene tun?
Ein häufiger Grund dafür, dass Geld für das Casino blockiert wird, ist die Nichterfüllung der Umsatzbedingungen. Viele Spieler nehmen Bonusangebote in Anspruch, ohne die Bedingungen genau zu lesen. Oftmals müssen sie einen bestimmten Betrag umsetzen, bevor sie sich ihr Geld auszahlen lassen können. Wer also vorzeitig versucht, sein Geld abzuheben, landet schnell in der Warteschleife.
Ein weiterer Grund für blockiertes Casino-Geld kann eine fehlgeschlagene Verifizierung sein. Um sicherzustellen, dass das Geld an den richtigen Empfänger geht, verlangen Online-Casinos manchmal eine Überprüfung der Identität. Wer diese nicht rechtzeitig durchführt, riskiert eine Blockierung seines Kontos.
Was können Betroffene also tun, wenn ihr Geld für das Casino blockiert wurde? Zunächst sollten sie Kontakt zum Kundenservice von Tipico aufnehmen. Oftmals lassen sich Probleme schnell und unkompliziert lösen, indem man sein Anliegen schildert und nach einer Lösung fragt.
Sollte dies nicht zum gewünschten Erfolg führen, bleibt noch der Weg über die Regulierungsbehörde. Tipico ist offiziell lizenziert und reguliert, sodass Spieler im Falle von Unstimmigkeiten Beschwerden einreichen können. Die Behörde prüft den Fall und setzt sich gegebenenfalls mit dem Casino in Verbindung.
In jedem Fall ist es wichtig, Ruhe zu bewahren und nicht in Panik zu geraten. Mit der richtigen Herangehensweise lassen sich die meisten Probleme schnell lösen und das blockierte Geld für das Casino kann hoffentlich bald wieder freigegeben werden.
https://tipicocasino.one/
Быстрый вывоз мусора ecologia-t.ru
Относительно [url=https://ecologia-t.ru/info/vivoz_musora_konteinerom_8m3/]вывоз строительного мусора 8 куб[/url] мы Вам окажем помощь прямо сейчас. Звоните по контактному номеру телефона 8(495)506-26-76 или оформите обратный и мы Вам сразу перезвоним. Мы расположены по адресу: 109382, г. Москва, ул. Краснодонская, д. 46. Подробный прайс лист Вы найдете на нашем сайте ecologia-t.ru и зависит от нескольких показателей. Конкретно: тип мусора, габариты контейнера и требуемая грузоподъемность транспорта. Окончательная цена будет рассчитана после общения с нашим консультантом. Звоните и прямо сейчас оформляйте заявку на вывоз мусора.
Быстрый вывоз мусора ecologia-t.ru
Насчет [url=https://ecologia-t.ru/info/vivoz_dereviev/]вывоз деревьев цена[/url] мы Вам поможем в данный момент. Звоните по телефону 8(495)506-26-76 или закажите обратный и мы Вам сразу перезвоним. Мы расположены по адресу: 109382, г. Москва, ул. Краснодонская, д. 46. Полный прайс лист Вы найдете на следующем сайте ecologia-t.ru и зависит от нескольких показателей. Конкретно: тип мусора, размеры контейнера и запрашиваемая грузоподъемность авто. Окончательная стоимость будет высчитана после общения с нашим менеджером. Звоните и быстрее оформляйте заявку на вывоз мусора.
Tipico Casino ist eine der beliebtesten Online-Casino-Plattformen in Deutschland. Mit einer groГџen Auswahl an Spielen, darunter Slots, Roulette, Blackjack und mehr, bietet Tipico seinen Kunden ein unterhaltsames und sicheres Spielerlebnis.
Das Funktionieren von Tipico Casino ist einfach und unkompliziert. Um ein Konto zu eröffnen, muss man sich lediglich auf der Webseite registrieren und seine persönlichen Daten angeben. Nach der Registrierung kann man sofort mit dem Spielen beginnen.
Um Geld auf sein Konto einzuzahlen, stehen verschiedene Zahlungsoptionen zur VerfГјgung, darunter Kreditkarten, BankГјberweisungen und E-Wallets wie PayPal und Skrill. Die Einzahlungen werden in der Regel sofort gutgeschrieben, so dass man sofort mit dem Spielen loslegen kann.
Wenn man gewinnt, kann man sich sein Geld einfach und bequem auszahlen lassen. Dazu muss man lediglich eine Auszahlungsanfrage stellen und seine Daten bestätigen. Die Auszahlungen werden in der Regel innerhalb weniger Tage bearbeitet und auf das angegebene Konto des Spielers überwiesen.
Tipico Casino bietet auch einen professionellen Kundenservice, der bei Fragen oder Problemen rund um die Uhr zur Verfügung steht. Man kann das Team per E-Mail, Live-Chat oder Telefon kontaktieren und erhält in der Regel schnell und kompetent Unterstützung.
Insgesamt funktioniert Tipico Casino auf einfache und effiziente Weise. Mit einer benutzerfreundlichen Oberfläche, schnellen Zahlungen und einem hervorragenden Kundenservice bietet die Plattform ein rundum erstklassiges Spielerlebnis für alle Casino-Fans. Probieren Sie es selbst aus und erleben Sie den Nervenkitzel von Tipico Casino!
https://tipicocasino.one/
[url=https://www.avtosalonbmwftnz.dp.ua]https://www.avtosalonbmwftnz.dp.ua[/url]
Приобрести ценогенетический БМВ 2024 года в течение Украине по лучшей стоимости язык официознного дилера. Тест-драйв, хеджирование, кредитование, промо-акции и еще спецпредложения.
https://www.avtosalonbmwftnz.dp.ua
Wenn Sie Ihr Zet Casino Konto löschen möchten, gibt es einige Schritte, die Sie befolgen müssen. Zunächst einmal sollten Sie sich darüber im Klaren sein, dass das Löschen Ihres Kontos endgültig ist und nicht rückgängig gemacht werden kann. Es ist also wichtig, sicherzustellen, dass Sie diese Entscheidung wirklich treffen möchten.
Um Ihr Zet Casino Konto zu löschen, müssen Sie sich zunächst bei Ihrem Konto anmelden. Klicken Sie dann auf Ihr Profil und gehen Sie zu den Kontoeinstellungen. Dort sollte es eine Option geben, mit der Sie Ihr Konto löschen können. Folgen Sie den Anweisungen und bestätigen Sie Ihre Entscheidung.
Es ist auch wichtig zu beachten, dass Sie möglicherweise noch ausstehende Guthaben auf Ihrem Konto haben. Bevor Sie Ihr Konto löschen, sollten Sie sicherstellen, dass Sie Ihr Guthaben ausgezahlt haben oder anderweitig verwendet haben.
Das Löschen Ihres Zet Casino Kontos kann verschiedene Gründe haben, sei es aufgrund von Spielsucht, persönlichen Gründen oder aus einem anderen Grund. Wenn Sie sich jedoch entscheiden, Ihr Konto zu löschen, ist es wichtig, dies auf sichere Weise zu tun und sicherzustellen, dass alle erforderlichen Schritte befolgt werden.
Wenn Sie weitere Fragen zum Löschen Ihres Zet Casino Kontos haben, können Sie sich jederzeit an den Kundendienst des Casinos wenden, um Unterstützung zu erhalten. Es ist wichtig, dass Sie sich wohl fühlen und nicht zögern, Hilfe in Anspruch zu nehmen, wenn Sie sie benötigen.
https://zetcasino.one/
I highly advise steer clear of this platform. My personal experience with it has been nothing but frustration and suspicion of fraudulent activities. Be extremely cautious, or even better, find a trustworthy platform to fulfill your requirements.
Das Tipico Casino in Mönchengladbach am Kammof bietet den Besuchern eine spannende und unterhaltsame Glücksspiel-Atmosphäre. Das Casino befindet sich in zentraler Lage und ist somit leicht erreichbar für alle, die auf der Suche nach Unterhaltung und Nervenkitzel sind.
Das Casino bietet eine Vielzahl von Spielmöglichkeiten, darunter klassische Tischspiele wie Roulette und Blackjack, sowie eine breite Auswahl an Spielautomaten. Egal ob erfahrener Spieler oder Anfänger, im Tipico Casino am Kammof kommt jeder auf seine Kosten.
Zusätzlich zu den Spielmöglichkeiten bietet das Casino auch verschiedene Veranstaltungen und Aktionen an, um den Aufenthalt der Besucher noch spannender zu gestalten. Von Pokerturnieren bis hin zu Live-Musik-Events ist im Tipico Casino am Kammof immer etwas los.
Wenn Sie also auf der Suche nach einem unterhaltsamen Abend sind, ist das Tipico Casino am Kammof in Mönchengladbach die perfekte Adresse. Tauchen Sie ein in die Welt des Glücksspiels und genießen Sie eine aufregende Zeit in diesem beliebten Casino.
https://tipicocasino.one/
Вывоз старой мебели ecologia-t.ru
По запросу [url=https://ecologia-t.ru/info/vivoz_mebeli/]вывоз старой мебели из квартиры[/url] Вы на правильном пути. Вывозим отходы разного вида: смешанные отходы, твердые коммунальные отходы, вторсырье, порубочные остатки, снег и подобные. Также проводим работу 24 часа в сутки, без выходных и даже в праздничные дни. Выполняем как однократные вывозы, так и постоянные по конкретным дням или часам, в зависимости от задачи заказчика. Подходим к каждой проблеме индивидуально, чтобы выполнять работу супер качественно.
коляски детские [url=https://detskie-koljaski-moskva.ru/]коляска купить[/url] .
Zet Casino Geld zurГјckfordern: Alles, was Sie wissen mГјssen
Zet Casino ist ein beliebtes Online-Casino, das eine Vielzahl von Spielen und Bonusangeboten für seine Spieler anbietet. Doch was passiert, wenn Sie Geld verloren haben und es zurückfordern möchten?
In diesem Artikel erfahren Sie alles, was Sie Гјber das ZurГјckfordern von Geld im Zet Casino wissen mГјssen.
1. GrГјnde fГјr eine Geld-RГјckerstattung
Es gibt verschiedene Gründe, warum Sie möglicherweise Geld von Zet Casino zurückfordern möchten. Zum Beispiel könnte es sein, dass Sie unabsichtlich Geld eingezahlt haben oder dass Sie unangemessene Gebühren berechnet wurden. In solchen Fällen haben Sie das Recht, Ihr Geld zurückzufordern.
2. Vorgehensweise zur Geld-RГјckerstattung
Um Geld von Zet Casino zurГјckzufordern, mГјssen Sie den Kundendienst kontaktieren und den Grund fГјr die RГјckerstattung angeben. Sie werden gebeten sein, relevante Dokumente vorzulegen, um Ihren Anspruch zu untermauern. Der Prozess kann je nach Fall einige Zeit in Anspruch nehmen, daher ist es wichtig, geduldig zu sein.
3. Wann ist eine Geld-Rückerstattung möglich?
Eine Geld-Rückerstattung von Zet Casino ist nur in bestimmten Situationen möglich, zum Beispiel wenn ein technischer Fehler aufgetreten ist oder wenn Geld fehlerhaft abgebucht wurde. Es ist wichtig zu beachten, dass Rückerstattungen nicht für Verluste beim Spielen gelten, da Glücksspiele immer mit Risiken verbunden sind.
4. Rechtliche Aspekte
Es ist wichtig zu wissen, dass es rechtliche Bestimmungen gibt, die die Geld-Rückerstattung von Online-Casinos regeln. In den Geschäftsbedingungen von Zet Casino finden Sie Informationen darüber, unter welchen Bedingungen eine Rückerstattung möglich ist und welche Schritte Sie unternehmen müssen, um Ihr Geld zurückzuerhalten.
Fazit
Wenn Sie Geld von Zet Casino zurückfordern möchten, ist es wichtig, den Prozess sorgfältig zu durchlaufen und die erforderlichen Schritte zu unternehmen. Indem Sie sich über Ihre Rechte und Pflichten informieren, können Sie sicherstellen, dass Sie Ihr Geld in rechtmäßiger Weise zurückerhalten.
https://zetcasino.one/
Das Zet Casino ist ein beliebtes Online-Casino, das eine Vielzahl von Spielen und Bonusangeboten fГјr seine Spieler anbietet. Seit seiner GrГјndung hat es sich einen Namen in der Welt des Online-GlГјcksspiels gemacht und zieht Spieler aus der ganzen Welt an.
Das Zet Casino bietet eine breite Palette von Spielen, darunter Slots, Tischspiele, Live-Casino-Spiele und vieles mehr. Mit fГјhrenden Softwareanbietern wie NetEnt, Microgaming und Play’n GO kГ¶nnen Spieler sicher sein, dass sie qualitativ hochwertige Spiele spielen.
Ein weiterer großer Vorteil des Zet Casinos sind die großzügigen Bonusangebote und Promotionen, die es seinen Spielern bietet. Neue Spieler können einen Willkommensbonus beanspruchen, der Freispiele und Bonusgeld umfasst, und regelmäßige Spieler können von täglichen Aktionen und wöchentlichen Turnieren profitieren.
Das Zet Casino legt auch großen Wert auf die Sicherheit und den Schutz seiner Spieler. Es verwendet die neueste Verschlüsselungstechnologie, um sicherzustellen, dass alle Transaktionen sicher und geschützt sind. Außerdem wird das Zet Casino von renommierten Glücksspielbehörden lizenziert und reguliert, um sicherzustellen, dass es fair und transparent ist.
Insgesamt ist das Zet Casino eine hervorragende Wahl fГјr Spieler, die nach einem unterhaltsamen und sicheren Online-Casino-Erlebnis suchen. Mit einer Vielzahl von Spielen, groГџzГјgigen Boni und einer sicheren Spielumgebung ist das Zet Casino definitiv einen Besuch wert.
https://zetcasino.one/
Um Geld vom Tipico Casino auszahlen zu lassen, mГјssen Spieler einige Schritte befolgen. ZunГ¤chst muss man sich in sein Spielerkonto auf der Website von Tipico einloggen. Dort kann man unter dem MenГјpunkt “Auszahlungen” die gewГјnschte Auszahlungsmethode auswГ¤hlen.
Es gibt verschiedene Möglichkeiten, um Geld von Tipico Casino auszahlen zu lassen. Dazu gehören unter anderem die Banküberweisung, die Kreditkarte oder E-Wallets wie PayPal oder Skrill. Es ist wichtig zu beachten, dass man die gleiche Zahlungsmethode für die Auszahlung wählen muss, mit der man auch eingezahlt hat.
Nachdem man die Auszahlungsmethode gewählt hat, muss man den gewünschten Auszahlungsbetrag angeben und die Auszahlungsanfrage bestätigen. Die Bearbeitungszeit für Auszahlungen kann je nach Zahlungsmethode variieren. In der Regel dauert es jedoch wenige Werktage, bis das Geld auf dem Konto des Spielers gutgeschrieben wird.
Es ist auch wichtig zu beachten, dass Tipico bestimmte Sicherheitsvorkehrungen hat, um sicherzustellen, dass die Auszahlung an den richtigen Spieler geht. Daher kann es sein, dass man seine Identität durch die Vorlage von Ausweisdokumenten bestätigen muss, bevor die Auszahlung bearbeitet werden kann.
Insgesamt ist es also relativ einfach, Geld vom Tipico Casino auszahlen zu lassen, solange man die richtigen Schritte befolgt und alle erforderlichen Informationen bereitstellt. Auf diese Weise können Spieler ihre Gewinne schnell und sicher auf ihr Konto überweisen lassen und ihr Spielerlebnis bei Tipico genießen.
https://tipicocasino.one/
купить диплом института [url=https://www.1diplomy-grupp.ru/]https://www.1diplomy-grupp.ru/[/url] .
На сайте https://bdalogistic.ru/ вы сможете заказать товары для маркетплейсов, которые привозятся из Китая. Основная специализация компании заключается в поиске, приобретении, доставке продукции. Кроме того, выполняется и отгрузка, упаковка продукции на маркетплейсы. В компании работают компетентные, опытные и предусмотрительные специалисты, которые окажут поддержку в организации бизнеса на Вайлдберриз. Рассчитать цену услуги получится прямо сейчас. В любом случае она будет доступной.
Tipico ist ein deutsches Unternehmen, das Sportwetten und Casinospiele online anbietet. Unter den verschiedenen Angeboten des Unternehmens ist das Tipico Casino Cash eine beliebte Funktion, die es Spielern ermöglicht, ihre Gewinne einfach und schnell auszahlen zu lassen.
Das Tipico Casino Cash ist eine praktische und benutzerfreundliche Funktion, die es Spielern ermöglicht, ihre Gewinne sofort auf ihr Tipico-Konto zu überweisen. Dies bedeutet, dass Spieler nicht lange auf ihre Gewinne warten müssen und diese sofort nutzen können, um weiterhin Casino-Spiele zu spielen oder um sich ihr Geld auszahlen zu lassen.
Um das Tipico Casino Cash zu nutzen, müssen Spieler lediglich ihr Tipico-Konto aufrufen und die Option zur Auszahlung wählen. Dort können sie dann die gewünschte Auszahlungsmethode angeben und den Betrag, den sie auszahlen möchten, auswählen. Innerhalb weniger Minuten ist das Geld auf dem Konto verfügbar und kann genutzt oder ausgezahlt werden.
Das Tipico Casino Cash ist eine bequeme Option für Spieler, die nicht lange auf ihre Gewinne warten möchten. Mit dieser Funktion können sie direkt nach dem Gewinn ihre Gewinne nuten oder auszahlen lassen, ohne lange Bearbeitungsdauern oder Wartezeiten. Tipico bietet damit einen schnellen und effizienten Service für seine Kunden.
Insgesamt ist das Tipico Casino Cash eine tolle Option für Spieler, die ihre Gewinne schnell und unkompliziert auszahlen lassen möchten. Durch diese Funktion wird das Spielerlebnis bei Tipico noch angenehmer und komfortabler. Probieren Sie es selbst aus und überzeugen Sie sich von der praktischen Auszahlungsfunktion bei Tipico Casino Cash!
https://tipicocasino.one/
I urge you stay away from this site. My own encounter with it was nothing but disappointment and concerns regarding fraudulent activities. Be extremely cautious, or even better, seek out an honest service to meet your needs.
I highly advise steer clear of this site. The experience I had with it was only frustration and suspicion of fraudulent activities. Be extremely cautious, or alternatively, look for a more reputable platform to meet your needs.
I highly advise stay away from this site. My personal experience with it was only dismay and concerns regarding scamming practices. Proceed with extreme caution, or even better, look for an honest site for your needs.
Das Tipico Casino ist eines der beliebtesten Online-Casinos in Deutschland. Viele Spieler begeistern sich für die große Auswahl an Spielen und die benutzerfreundliche Oberfläche. Doch trotz aller positiven Aspekte gibt es immer wieder Berichte darüber, dass einige Spieler keine Gewinne erzielen.
Es ist wichtig zu erwähnen, dass Glücksspiel immer mit einem gewissen Risiko verbunden ist und Gewinne nie garantiert werden können. Dennoch häufen sich die Beschwerden von Spielern, die angaben, dass sie keine oder nur sehr geringe Gewinne im Tipico Casino erzielen konnten.
Ein Grund für die fehlenden Gewinne könnte möglicherweise die hohe Varianz der Casino-Spiele sein. Einige Spiele sind bekannt dafür, dass sie hohe Gewinne auszahlen können, jedoch nur selten. Das bedeutet, dass Spieler viele Runden spielen können, ohne einen nennenswerten Gewinn zu erzielen.
Ein anderer Grund könnte möglicherweise eine falsche Spielstrategie sein. Einige Spieler setzen zu viel Geld auf ein Spiel oder spielen übermäßig lange, was zu Verlusten führen kann. Es ist wichtig, verantwortungsbewusst zu spielen und sich an ein festgelegtes Budget zu halten.
Es gibt aber auch Spieler, die behaupten, dass das Tipico Casino nicht fair spielt und Gewinne zurückhält. Es ist jedoch wichtig zu betonen, dass Online-Casinos strengen Regulierungen unterliegen und regelmäßig von unabhängigen Behörden überprüft werden. Somit sind Manipulationen in seriösen Online-Casinos nahezu ausgeschlossen.
Letztendlich ist es wichtig, sich bewusst zu sein, dass Glücksspiel kein Weg ist, um sicher an Geld zu kommen. Es ist immer mit einem gewissen Risiko verbunden und Gewinne können nicht garantiert werden. Es ist ratsam, verantwortungsbewusst zu spielen und sich im Zweifelsfall an den Kundenservice des Tipico Casinos zu wenden, um mögliche Probleme zu klären.
https://tipicocasino.one/
Zet Casino Cashback
Bei Zet Casino können Spieler jetzt von einem attraktiven Cashback-Angebot profitieren. Das bedeutet, dass du einen Teil deiner Verluste zurückerstattet bekommst, wenn du eine Pechsträhne haben solltest.
Das Cashback-Angebot bei Zet Casino ist einfach und unkompliziert. Jeden Freitag erhältst du 10% deiner Verluste der vergangenen Woche als Cashback-Bonus gutgeschrieben. Das bedeutet, dass du immer ein wenig Trost erhältst, wenn es mal nicht so gut läuft.
Um das Cashback-Angebot nutzen zu können, musst du dich lediglich für die Aktion anmelden. Dafür gehst du einfach auf die Website von Zet Casino, klickst auf den Cashback-Bereich und meldest dich an. Sobald du angemeldet bist, musst du nur noch spielen und dein Cashback wird automatisch gutgeschrieben.
Das Cashback-Angebot bei Zet Casino bietet Spielern eine hervorragende Möglichkeit, Verluste zu minimieren und sich trotz einer Pechsträhne weiterhin am Spiel zu erfreuen. Wenn du also gerne im Online-Casino spielst, solltest du dieses attraktive Angebot auf jeden Fall in Anspruch nehmen.
Also, worauf wartest du noch? Melde dich jetzt fГјr das Cashback-Angebot bei Zet Casino an und profitiere von diesem groГџzГјgigen Bonus!
https://zetcasino.one/
blibliblu
THIS IS SCAM
Ефективні методи лікування
10. Як підготуватися до відвідування стоматолога
стоматологічна клініка усмішка [url=https://stomatologiyatrn.ivano-frankivsk.ua/]https://stomatologiyatrn.ivano-frankivsk.ua/[/url] .
Came across an intriguing article – it’s worth your attention, trust me https://magnificentcentury.rolka.me/post.php?fid=38
Wer kennt das nicht – man möchte ein paar Runden im Tipico Casino spielen und plötzlich ist das Geld blockiert. Diese Situation kann sehr frustrierend sein, vor allem wenn man sich auf den Spielspaß gefreut hat. Doch warum passiert so etwas und wie kann man das Problem lösen?
Es gibt verschiedene Gründe, warum Geld im Tipico Casino blockiert sein kann. Einer der häufigsten Gründe ist, dass der Spieler sein Konto nicht vollständig verifiziert hat. Das bedeutet, dass der Spieler seine Identität noch nicht bestätigt hat, was für das Casino aus Sicherheitsgründen wichtig ist. In diesem Fall muss der Spieler seine Identität nachweisen, damit das Geld freigegeben werden kann.
Ein weiterer Grund für blockiertes Geld im Tipico Casino kann ein technisches Problem sein. Dies kann zum Beispiel auftreten, wenn es Probleme mit der Zahlungsmethode gibt oder wenn das Casino technische Schwierigkeiten hat. In solchen Fällen sollte der Spieler den Kundenservice kontaktieren und das Problem schildern. Oftmals können die Mitarbeiter des Casinos das Problem schnell lösen und das Geld wieder freigeben.
Es ist auch möglich, dass das Geld blockiert ist, weil der Spieler gegen die AGBs des Casinos verstoßen hat. Zum Beispiel, wenn der Spieler versucht hat, Bonusbedingungen zu umgehen oder wenn er versucht hat, mehrere Konten zu eröffnen. In solchen Fällen wird das Geld in der Regel einbehalten und der Spieler kann mit Konsequenzen rechnen.
Um blockiertes Geld im Tipico Casino zu vermeiden, ist es wichtig, sich an die Regeln des Casinos zu halten und sein Konto vollständig zu verifizieren. Sollte es dennoch zu Problemen kommen, ist es ratsam, den Kundenservice zu kontaktieren und das Problem zu schildern. Oftmals kann das Problem schnell gelöst werden und der Spielspaß kann weitergehen.
https://tipicocasino.one/
LOSE MONEY
Das Zet Casino, eine beliebte Online-Glücksspielseite, hat kürzlich eine neue Funktion eingeführt, die es Spielern ermöglicht, sich selbst von der Nutzung des Casinos zu sperren. Diese Option wurde eingeführt, um den Spielern, die Schwierigkeiten mit ihrem Spielverhalten haben, zu helfen und sie vor möglichen negativen Konsequenzen des Glücksspiels zu schützen.
Die Sperrfunktion im Zet Casino ermöglicht es den Spielern, sich für einen bestimmten Zeitraum oder sogar dauerhaft von der Nutzung der Seite auszuschließen. Dies kann dazu beitragen, das Risiko von Spielsucht zu reduzieren und den Spielern helfen, ihre Gewohnheiten zu kontrollieren.
Um sich im Zet Casino sperren zu lassen, mГјssen die Spieler einfach Kontakt mit dem Kundendienst aufnehmen und ihre Sperrung beantragen. Die Mitarbeiter des Casinos werden dann die notwendigen Schritte unternehmen, um sicherzustellen, dass der Spieler keinen Zugang mehr zur Seite hat.
Es ist wichtig zu beachten, dass die Sperrung im Zet Casino nicht rückgängig gemacht werden kann und dass die Spieler nach Ablauf des Sperrzeitraums oder nach der dauerhaften Sperrung nicht automatisch Zugang zur Seite erhalten. Dies soll sicherstellen, dass die Spieler wirklich die Möglichkeit haben, ihr Spielverhalten zu kontrollieren und ihr Glücksspielproblem zu überwinden.
Insgesamt ist die Einführung der Sperrfunktion im Zet Casino ein Schritt in die richtige Richtung, um den Spielern zu helfen, verantwortungsbewusst zu spielen und mögliche negative Auswirkungen des Glücksspiels zu minimieren. Wir hoffen, dass andere Online-Glücksspielseiten diesem Beispiel folgen und ebenfalls solche Maßnahmen einführen, um die Sicherheit und das Wohlbefinden ihrer Spieler zu gewährleisten.
https://zetcasino.one/
Обзор БК 1WIN
Новости России
blublun
купить справку в университет
Zet Casino ist ein beliebtes Online-Casino, das eine Vielzahl von Spielen und Zahlungsmethoden anbietet. Eine der neuesten Zahlungsmethoden, die im Zet Casino verfГјgbar ist, ist Zimpler.
Zimpler ist ein innovativer Zahlungsdienst aus Schweden, der es Spielern ermöglicht, Einzahlungen in Online-Casinos auf einfache und sichere Weise vorzunehmen. Mit Zimpler können Spieler ganz einfach über ihr Mobiltelefon Einzahlungen tätigen, ohne lästige Registrierungen oder langwierige Banküberweisungen durchführen zu müssen.
Um Zimpler im Zet Casino zu nutzen, müssen Spieler lediglich ihre Handynummer angeben und den Bestätigungscode eingeben, der per SMS an ihr Mobiltelefon gesendet wird. Anschließend können sie den gewünschten Einzahlungsbetrag eingeben und die Transaktion mit nur einem Klick abschließen.
Zimpler garantiert schnelle und sichere Zahlungen im Zet Casino, so dass Spieler sich voll und ganz auf ihr Spielerlebnis konzentrieren können, ohne sich über Sicherheitsbedenken oder lange Wartezeiten Gedanken machen zu müssen. Darüber hinaus bietet Zimpler auch eine Übersicht über alle getätigten Transaktionen, so dass Spieler jederzeit einen Überblick über ihre Einzahlungen haben.
Insgesamt ist Zimpler eine bequeme und zuverlässige Zahlungsmethode, die das Spielerlebnis im Zet Casino noch angenehmer macht. Probieren Sie es aus und erleben Sie die Vorteile von Zimpler selbst!
https://zetcasino.one/
https://miele-remonty.ru/stiralnyh-mashin/
Found captivating reading that’s worth your time – take a look http://bike.by/forum/viewtopic.php?f=84&t=28874
[url=https://motomagazinvfdvgd.vn.ua/uk/v-perchatki/]motomagazinvfdvgd.vn.ua/uk/v-perchatki/[/url]
В ТЕЧЕНИЕ нашем мотомагазине вы обнаружите запчасти для мотоциклов, скутеров, снегоходов равно квадроциклов. ЯЗЫК нас вы всегда найдёте масла чтобы байков, фильтра, цепи.
motomagazinvfdvgd.vn.ua/uk/v-akkumulyatory/
THIS IS SCAM
zeekr 001 цена
Tipico Einzahlen und direkt ins Casino einsteigen
Tipico ist einer der beliebtesten Anbieter für Sportwetten und Online-Casino-Spiele. Für diejenigen, die gerne ihre Glücksspiele online spielen, bietet Tipico eine einfache und bequeme Möglichkeit, Geld auf ihr Konto einzuzahlen und direkt in das Casino einzusteigen.
Um Geld auf Ihr Tipico-Konto einzuzahlen, stehen Ihnen verschiedene Zahlungsmethoden zur Verfügung. Dazu gehören Kredit- und Debitkarten, Banküberweisungen, Paysafecard, PayPal und viele weitere Optionen. Egal, für welche Methode Sie sich entscheiden, das Geld wird sicher und schnell auf Ihr Konto eingezahlt.
Sobald das Geld auf Ihrem Konto ist, können Sie sofort mit dem Spielen im Casino beginnen. Tipico bietet eine große Auswahl an Spielen, darunter Slots, Roulette, Blackjack, Poker und mehr. Egal, ob Sie ein Anfänger oder ein erfahrener Spieler sind, es gibt für jeden etwas Passendes.
Das Beste an Tipico ist, dass es eine mobile App für unterwegs gibt. Mit der Tipico-App können Sie auch unterwegs spielen und Einzahlungen vornehmen. Sie können also jederzeit und überall auf Ihre Lieblingsspiele zugreifen.
Wenn Sie also Lust auf ein spannendes Casino-Erlebnis haben, ist Tipico die richtige Wahl. Zahlen Sie einfach Geld auf Ihr Konto ein und steigen Sie direkt ins Casino ein. Viel GlГјck und viel SpaГџ beim Spielen!
https://tipicocasino.one/
китайский автомобиль гибридный
китайское авто
li l7
[url=https://t.me/mounjaro_tirzepatide]оземпик препарат[/url] – семаглутид минск, лираглутид семаглутид дулаглутид отзывы
Tipico Casino bietet seinen Spielern eine Vielzahl von Spielen an, aus denen sie wählen können. Von klassischen Tischspielen wie Roulette und Blackjack bis hin zu aufregenden Spielautomaten und Live-Casino-Spielen ist für jeden Geschmack etwas dabei. Doch welche Spiele sind die besten bei Tipico Casino?
Ein beliebtes Spiel bei Tipico Casino ist sicherlich das Roulette. Dieses klassische Casinospiel bietet Spannung und Nervenkitzel, während man darauf hofft, dass die Kugel auf der richtigen Zahl landet. Mit verschiedenen Varianten wie Europe Roulette oder French Roulette bietet Tipico Casino seinen Spielern eine Vielzahl von Möglichkeiten, dieses beliebte Spiel zu genießen.
Auch Blackjack ist ein Favorit bei Tipico Casino. Bei diesem Kartenspiel geht es darum, den Dealer zu schlagen, indem man eine Hand mit einem Kartenwert näher an 21 hat, ohne darüber zu kommen. Mit verschiedenen Varianten wie Classic Blackjack oder Blackjack VIP können Spieler ihre Fähigkeiten und Strategien testen und hoffentlich große Gewinne erzielen.
FГјr Fans von Spielautomaten gibt es bei Tipico Casino eine groГџe Auswahl an aufregenden Spielen. Von klassischen FrГјchteslots bis hin zu aufwendig gestalteten Video-Slots mit spannenden Bonusrunden und Jackpots ist fГјr jeden Geschmack etwas dabei. Beliebte Spielautomaten bei Tipico Casino sind zum Beispiel Starburst, Book of Dead oder Mega Moolah.
Auch im Live-Casino von Tipico können Spieler ein authentisches Casino-Erlebnis genießen. Mit Live-Dealern, die die Spiele leiten und via Video-Stream übertragen werden, können Spieler Roulette, Blackjack, Baccarat und mehr in Echtzeit spielen und interagieren. Die Spannung und Atmosphäre eines echten Casinos werden so direkt ins Wohnzimmer gebracht.
Insgesamt bietet Tipico Casino eine breite Auswahl an Spielen fГјr jeden Geschmack und jedes Budget. Ob Tischspiele, Spielautomaten oder Live-Casino-Spiele – hier kommt jeder auf seine Kosten. Welches Spiel letztendlich das beste ist, kommt ganz auf die persГ¶nlichen Vorlieben und Strategien des Spielers an. Eines ist jedoch sicher: Spannung und Unterhaltung sind bei Tipico Casino garantiert. Viel SpaГџ beim Spielen!
https://tipicocasino.one/
Zet Casino Einzahlungsbonus
Zet Casino ist ein Online-Casino, das seinen Spielern eine Vielzahl von aufregenden Spielen und lukrativen Boni bietet. Einer der beliebtesten Boni, die das Casino seinen Spielern anbietet, ist der Einzahlungsbonus.
Der Einzahlungsbonus bei Zet Casino ist eine großartige Möglichkeit für Spieler, ihr Spiel zu maximieren und ihre Gewinnchancen zu erhöhen. Um den Einzahlungsbonus zu erhalten, müssen Spieler einfach eine Einzahlung auf ihr Konto tätigen und den entsprechenden Bonuscode eingeben, um den Bonus zu aktivieren.
Der Einzahlungsbonus bei Zet Casino variiert je nach Höhe der Einzahlung. Je mehr Spieler einzahlen, desto größer ist der Bonus, den sie erhalten. Der Bonus kann in Form von zusätzlichem Spielgeld, Freispielen oder anderen attraktiven Angeboten angeboten werden.
Der Einzahlungsbonus bei Zet Casino ist eine großartige Möglichkeit für Spieler, ihre Bankroll zu erhöhen und mehr Spaß und Spannung aus ihrem Spiel herauszuholen. Spieler können den Bonus nutzen, um ihre Lieblingsspiele zu spielen und dabei die Chance auf große Gewinne zu haben.
Um den Einzahlungsbonus bei Zet Casino zu erhalten, müssen Spieler die Bedingungen und Konditionen beachten, die mit dem Bonus verbunden sind. Es ist wichtig, die Umsatzanforderungen zu erfüllen und sicherzustellen, dass sie die Bonusbedingungen vollständig verstehen, um den Bonus erfolgreich freizuschalten.
Insgesamt ist der Einzahlungsbonus bei Zet Casino eine großartige Möglichkeit für Spieler, ihre Gewinnchancen zu maximieren und das Beste aus ihrem Online-Casino-Erlebnis herauszuholen. Mit attraktiven Boni und spannenden Spielen ist Zet Casino definitiv eine der besten Optionen für Online-Casino-Spieler.
https://zetcasino.one/
LOSE MONEY
Tipico Casino Chips Blockiert: Was ist zu tun?
Wenn Sie ein Spieler im Tipico Casino sind und plötzlich feststellen, dass Ihre Casino Chips blockiert sind, kann das sehr frustrierend sein. Doch keine Sorge, es gibt einige Schritte, die Sie unternehmen können, um das Problem zu lösen.
Zunächst einmal sollten Sie überprüfen, ob Sie möglicherweise die Bonusbedingungen des Casinos nicht erfüllt haben. Oftmals werden Casino Chips blockiert, wenn Sie versuchen, Gewinne aus einem Bonus ohne Einzahlung abzuheben, ohne die entsprechenden Umsatzanforderungen erfüllt zu haben.
In diesem Fall empfehlen wir Ihnen, Kontakt mit dem Kundensupport von Tipico aufzunehmen. Die Mitarbeiter können Ihnen weiterhelfen und das Problem genauer überprüfen. Möglicherweise müssen Sie zusätzliche Dokumente zur Verifizierung einreichen, um die Blockierung aufzuheben.
Es ist auch möglich, dass Ihre Casino Chips aus Sicherheitsgründen blockiert wurden. Dies kann beispielsweise der Fall sein, wenn ungewöhnliche Aktivitäten auf Ihrem Konto festgestellt werden. In einem solchen Fall ist es wichtig, sich mit dem Kundensupport in Verbindung zu setzen und alle erforderlichen Schritte zur Verifizierung durchzuführen.
Zusammenfassend lässt sich sagen, dass eine Blockierung von Casino Chips im Tipico Casino ärgerlich sein kann, aber in den meisten Fällen gibt es eine Lösung. Nehmen Sie Kontakt mit dem Kundensupport auf, um das Problem zu klären und Ihre Chips freizuschalten.
https://tipicocasino.one/
Консультация юриста при заливе квартиры — ключевой шаг в разрешении имущественного
конфликта и компенсации убытков.
Правильное юридическое сопровождение позволяет пострадавшей стороне избежать ошибок
в оформлении необходимых документов и эффективно действовать в рамках закона.
В процессе консультации юрист оценивает обстоятельства залива:
отслеживает причины происшествия, проверяет, как были выполнены обязательства
по содержанию жилья и коммуникаций.
Специалист даст советы по сбору и оформлению доказательств: нужно будет составить акт о затоплении,
собрать показания свидетелей, фото и видеофиксацию ущерба.
Также юрист разъяснит процедуру обращения в страховую компанию, если
имущество застраховано.
Далее юрист поможет составить и отправить претензию виновной стороне,
а при необходимости — подготовит исковое заявление в суд.
Он расскажет, как правильно рассчитать размер ущерба, включая не только непосредственный ремонт, но и потерю имущественной стоимости квартиры или компенсацию за временное проживание в другом месте, если квартира стала непригодной для жилья.
Получение профессиональной консультации минимизирует риски отказа в возмещении ущерба и способствует более быстрому восстановлению прав и интересов пострадавшей стороны.
Also visit my blog :: затопили застрахованную квартиру кто платит
Find Out More [url=https://localbitcoinsalternative.com]www localbitcoins com login[/url]
[url=https://kraken4vtor.com/]kraken tor зеркало[/url] – kraken darknet ссылка тор, kraken onion
SCAM
https://sekolahpedia.id/medias/?crot=TOGELON
[url=https://kraken4tore.com/]kraken darknet ссылка тор[/url] – кракен тор, kraken darknet market ссылка тор
go to my site [url=https://cs2skinchanger.com/]skinchanger[/url]
cululutata
https://mailserve.ubhi.ac.id/upload/e-journal/?products=fiatogel
find more information [url=https://robloxhacks.fun/]roblox hack[/url]
her comment is here [url=https://cs2cheats.io/]free cheats for cs 2[/url]
Zet Casino Review
Zet Casino ist eine Online-GlГјcksspielplattform, die im Jahr 2018 gegrГјndet wurde und seitdem eine Vielzahl von Spielern aus der ganzen Welt angezogen hat. Das Casino wird von der Tranello Group betrieben und verfГјgt Гјber eine Lizenz der Regierung von Curacao. Es bietet eine breite Auswahl an Spielen, groГџzГјgige Bonusangebote und eine benutzerfreundliche Webseite.
Das Casino verfГјgt Гјber eine beeindruckende Auswahl an Spielen von fГјhrenden Softwareanbietern wie NetEnt, Microgaming, Play’n GO, Evolution Gaming und vielen mehr. Spieler kГ¶nnen aus Hunderten von Spielautomaten, Tischspielen, Live-Casino-Spielen und Jackpot-Slots wГ¤hlen. Die Spiele sind in verschiedene Kategorien unterteilt, um die Navigation zu erleichtern, und kГ¶nnen sowohl auf Desktop- als auch auf mobilen GerГ¤ten gespielt werden.
Zet Casino bietet seinen Spielern großzügige Bonusangebote, darunter einen Willkommensbonus für neue Spieler, wöchentliche Reload-Boni und ein VIP-Programm für treue Kunden. Die Bonusbedingungen sind fair und transparent, und Spieler können die Bonusangebote nutzen, um ihr Spielerlebnis zu verbessern und ihre Gewinnchancen zu erhöhen.
Die Webseite von Zet Casino ist benutzerfreundlich und einfach zu navigieren. Spieler können schnell und einfach auf ihre Lieblingsspiele zugreifen, Ein- und Auszahlungen vornehmen und den Kundenservice kontaktieren. Das Casino bietet auch verschiedene Zahlungsmethoden an, darunter Kreditkarten, E-Wallets und Banküberweisungen, um sicherzustellen, dass Spieler Ein- und Auszahlungen einfach und sicher durchführen können.
Insgesamt bietet Zet Casino eine erstklassige Glücksspielerfahrung mit einer breiten Auswahl an Spielen, großzügigen Boni und einer benutzerfreundlichen Webseite. Wenn Sie auf der Suche nach einem zuverlässigen und unterhaltsamen Online-Casino sind, sollten Sie Zet Casino definitiv eine Chance geben. Besuchen Sie noch heute die Webseite und erleben Sie die Spannung und Aufregung des Glücksspiels bei Zet Casino!
https://zetcasino.one/
SCAM
аттестат купить окончание [url=https://2diplom-grupp.ru]https://2diplom-grupp.ru[/url] .
split система [url=https://split-sistema-kupit.ru/]https://split-sistema-kupit.ru/[/url] .
Tipico Sport Konto auf Casino
Tipico ist ein bekannter Anbieter von Sportwetten und Online-Casino-Spielen. Viele Kunden nutzen die Plattform, um auf ihre Lieblingssportarten zu wetten und gleichzeitig die verschiedenen Casino-Spiele zu genießen. Um das Beste aus beiden Welten zu erfahren, können Kunden ihr Sportkonto auch für das Online-Casino nutzen.
Das bedeutet, dass Kunden nur ein Konto benötigen, um sowohl Sportwetten als auch Casino-Spiele zu spielen. Dadurch wird die Verwaltung der Finanzen und Aktivitäten auf der Plattform vereinfacht. Kunden können einfach Geld von ihrem Sportkonto auf ihr Casino-Konto übertragen und umgekehrt. Auf diese Weise haben sie Zugriff auf eine Vielzahl von Spielen und Möglichkeiten, ohne ständig zwischen verschiedenen Konten wechseln zu müssen.
Darüber hinaus bietet Tipico regelmäßig Promotionen und Boni für Kunden an, die sowohl Sportwetten als auch Casino-Spiele spielen. Dies bedeutet, dass Kunden zusätzliche Vorteile und Belohnungen erhalten, wenn sie ihr Sportkonto auch für das Casino nutzen.
Insgesamt bietet das Tipico Sport Konto auf Casino eine bequeme und unterhaltsame Möglichkeit, Sportwetten und Casino-Spiele zu genießen. Kunden können von einer breiten Palette an Spielen und Vorteilen profitieren, während sie gleichzeitig die Verwaltung ihres Kontos optimieren.
Wenn Sie also sowohl an Sportwetten als auch an Casino-Spielen interessiert sind, könnte das Tipico Sport Konto auf Casino die perfekte Lösung für Sie sein. Probieren Sie es aus und erleben Sie das Beste aus beiden Welten auf einer Plattform.
https://tipicocasino.one/
Юридическая помощь при заливах квартир — незаменимый инструмент для защиты ваших прав и интересов. Попадание в подобную ситуацию влечет за собой ряд сложностей, начиная от оформления необходимых бумаг и заканчивая взысканием убытков с виновника происшествия.
Профессиональный юрист поможет составить акт о заливе, который фиксирует факт и обстоятельства повреждения имущества. Далее следует этап сбора доказательств: фотографии, справки о стоимости ущерба, свидетельские показания. Важно правильно рассчитать размер убытков, включающий стоимость восстановительного ремонта и прочие затраты.
Юрист займется подготовкой претензии к виновнику инцидента с требованием возместить ущерб. В случае отказа или игнорирования претензии вопрос может быть передан в суд. С юридической точки зрения процесс требует грамотной подготовки и стратегии, что станет залогом успешного результата.
Получение юридической помощи позволит вам чувствовать себя увереннее, а также избежать потенциальных подводных камней в процессе взыскания компенсации за залив квартиры.
залили квартиру соседи подали в суд
blolbo
[url=https://motomagazinvfdvgd.vn.ua/uk/]https://motomagazinvfdvgd.vn.ua[/url]
В ТЕЧЕНИЕ нашем мотомагазине ваша милость найдёте запасные части чтобы мотоциклов, скутеров, снегоходов и еще квадроциклов. ЯЗЫК нас вы всегда почтете масла чтобы мотоциклов, фильтра, цепи.
інтернет магазин мотозапчастин
Zet Casino ist ein beliebtes Online-Casino, das eine Vielzahl von Spielen für jeden Geschmack anbietet. Eines der attraktivsten Angebote für neue Spieler ist der Zet Casino 30 Free Spins Bonus. Dieser Bonus ermöglicht es Spielern, 30 Freispiele zu erhalten, ohne eine Einzahlung tätigen zu müssen.
Eine hГ¤ufig gestellte Frage von Spielern, die sich fГјr den Zet Casino 30 Free Spins Bonus interessieren, ist, bei welchem Spiel sie diese Freispiele verwenden kГ¶nnen. Die Antwort darauf ist, dass die Freispiele fГјr das Spiel “Book of Gold: Double Chance” verwendet werden kГ¶nnen. Dieses spannende Spiel bietet eine aufregende Reise in das alte Г„gypten und ermГ¶glicht es Spielern, auf der Suche nach versteckten SchГ¤tzen aufregende Gewinne zu erzielen.
Um die Zet Casino 30 Free Spins zu erhalten, müssen Spieler lediglich ein Konto bei Zet Casino erstellen und den Bonuscode angeben, der für die Freispiele erforderlich ist. Sobald das Konto erstellt wurde, werden die Freispiele automatisch gutgeschrieben und können sofort verwendet werden.
Es ist wichtig zu beachten, dass die Free Spins fГјr das Spiel “Book of Gold: Double Chance” innerhalb von sieben Tagen nach Erhalt verwendet werden mГјssen, da sie sonst verfallen. DarГјber hinaus gelten die Гјblichen Bonusbedingungen von Zet Casino, einschlieГџlich der Umsatzanforderungen fГјr Gewinne aus Freispielen.
Insgesamt bietet der Zet Casino 30 Free Spins Bonus Spielern eine groГџartige Gelegenheit, das spannende Spiel “Book of Gold: Double Chance” auszuprobieren und dabei die Chance auf attraktive Gewinne zu haben. Wenn Sie also auf der Suche nach einem Online-Casino mit einem groГџzГјgigen Willkommensbonus sind, ist Zet Casino definitiv eine gute Wahl. Probieren Sie es aus und genieГџen Sie die aufregende Welt des Online-GlГјcksspiels!
https://zetcasino.one/
blabla
https://sekolahpedia.id/medias/?crot=JONITOGEL
http://maps.google.ae/url?q=https://t.me/+z0aCw4Lc6rUzZWQ6
try these out [url=https://phantom.lu]phantom wallet login[/url]
Когда мне потребовался ремонт холодильника Bosch, я обратился в официальный сервисный центр в Москве. Сервис оказался на высшем уровне: быстро согласовали время, мастер приехал в оговоренные сроки и всё отлично починил. Особенно порадовала чёткая работа и доброжелательное отношение персонала. Рекомендую данный сервис всем, кто ищет надёжную поддержку и качественный ремонт.
Бош-Ремонт.рф – [url=https://xn—-9sbn2afcdnw7c.xn--p1ai/варочных-панелей]ремонт варочной панели bosch[/url]
Das Online-Casino Zet Casino erfreut sich immer größerer Beliebtheit unter Glücksspielern, die gerne ihr Glück im Internet versuchen. Doch gibt es auch Gerüchte über Betrug und Abzocke im Zet Casino. In diesem Artikel möchten wir genauer auf dieses Thema eingehen und klären, ob an den Vorwürfen tatsächlich etwas dran ist.
Zunächst einmal muss festgehalten werden, dass das Zet Casino eine gültige Glücksspiellizenz besitzt und somit von einer offiziellen Glücksspielbehörde reguliert wird. Dies bedeutet, dass das Casino gewisse Standards und Richtlinien einhalten muss, um seine Lizenz nicht zu verlieren. Dadurch wird die Seriosität des Casinos gewährleistet.
Dennoch gibt es immer wieder Spieler, die behaupten, beim Zet Casino betrogen worden zu sein. Ein häufiger Vorwurf ist, dass Gewinne nicht ausgezahlt wurden oder dass die Auszahlungen ungewöhnlich lange dauern. Auch von manipulierten Spielen ist die Rede.
Es ist wichtig zu betonen, dass nicht alle Beschwerden über das Zet Casino berechtigt sind. Oftmals handelt es sich um Missverständnisse oder unklare Bonusbedingungen, die zu Unstimmigkeiten führen. In solchen Fällen ist es ratsam, den Kundenservice des Casinos zu kontaktieren und das Problem zu klären.
Trotzdem sollten Spieler vorsichtig sein und sich vor der Registrierung in einem Online-Casino gründlich über die Seriosität des Anbieters informieren. Es empfiehlt sich, Bewertungen und Erfahrungsberichte anderer Spieler zu lesen und sich über die Lizenz des Casinos zu informieren.
Insgesamt lässt sich festhalten, dass das Zet Casino zwar nicht frei von Kritik ist, jedoch auch nicht als Betrugs-Casino bezeichnet werden kann. Wie bei jedem Glücksspielanbieter gibt es auch hier schwarze Schafe, doch mit der nötigen Vorsicht und Recherche können Spieler sicher und verantwortungsbewusst im Zet Casino spielen.
https://zetcasino.one/
I highly advise to avoid this platform. My personal experience with it was only dismay along with concerns regarding scamming practices. Exercise extreme caution, or alternatively, seek out a trustworthy site to fulfill your requirements.
I strongly recommend stay away from this platform. The experience I had with it was nothing but dismay along with doubts about fraudulent activities. Be extremely cautious, or alternatively, find a trustworthy service to meet your needs.
read the full info here [url=https://keplr.me]Dym wallet keplr[/url]
click for more [url=https://rabby.at]rabby wallet[/url]
i was reading this [url=https://cosmohubs.org]keplr Extension[/url]
Zet Casino Freispiele
Zet Casino ist ein beliebtes Online-Casino, das seinen Spielern eine Vielzahl von Spielen und Boni anbietet. Eine der beliebtesten Aktionen im Zet Casino sind die Freispiele, die den Spielern die Möglichkeit geben, kostenlose Runden an ausgewählten Spielautomaten zu spielen.
Um Freispiele im Zet Casino zu erhalten, müssen Spieler bestimmte Voraussetzungen erfüllen. Oftmals werden Freispiele als Teil eines Willkommensbonus oder als Belohnung für treue Spieler angeboten. Spieler können auch Freispiele durch Sonderaktionen oder Turniere gewinnen.
Die Anzahl der Freispiele, die Spieler erhalten, variiert je nach Aktion und Angebot. In der Regel können Spieler zwischen 10 und 100 Freispiele bekommen. Die Freispiele können nur an bestimmten Spielautomaten genutzt werden und haben einen festgelegten Wert pro Runde.
Freispiele sind eine großartige Möglichkeit, um neue Spielautomaten im Zet Casino auszuprobieren und echtes Geld zu gewinnen, ohne eigenes Geld riskieren zu müssen. Spieler können ihre Gewinne aus Freispielen in Form von Echtgeld behalten und für weitere Spiele verwenden.
Für alle Fans von Online-Casinospielen sind Freispiele im Zet Casino eine tolle Möglichkeit, um das Spielerlebnis zu verbessern und zusätzliche Gewinnchancen zu erhalten. Probiere es aus und sichere dir deine Freispiele im Zet Casino!
https://zetcasino.one/
Den populära online-casinon Gogo Casino har nyligen fått ett beslut som innebär att de inte kommer att få några pengar från sina spelare. Spelinspektionen har beslutat att återkalla deras spellicens på grund av brister i företagets rutiner för ansvarsfullt spelande.
Beslutet kommer efter en lång utredning där det framkommit att Gogo Casino inte har vidtagit tillräckliga åtgärder för att förebygga spelproblem bland sina spelare. Enligt Spelinspektionen har företaget bland annat inte haft tillräckliga verktyg för att kunna identifiera och hjälpa spelare som riskerar att hamna i spelberoende.
Gogo Casino har nu fått en tillsynsnämnd att utreda ärendet och besluta om eventuella sanktioner mot företaget. De kommer inte att kunna ta emot några insättningar eller ta ut några vinster tills vidare.
Det här beslutet skickar en tydlig signal till alla aktörer på den svenska spelmarknaden om vikten av att ta ansvar för sitt spelutbud och sina spelare. Det är viktigt att alla online-casinon följer de regler och riktlinjer som finns för att skydda spelarna och minska risken för spelmissbruk.
För spelare som är drabbade av beslutet innebär det att de inte längre kan spela på Gogo Casino och att eventuella vinster kan komma att bli oåtkomliga. Det är viktigt att alla spelare som upplever spelproblem söker hjälp och stöd för att komma på rätt väg igen.
Sammanfattningsvis är det här ett viktigt steg för att skapa en säkrare spelmarknad i Sverige och för att skydda spelare från att hamna i spelberoende. Genom att tillsammans arbeta för ett ansvarsfullt spelande kan vi se till att alla kan njuta av underhållningen som casinon erbjuder utan att riskera sin hälsa och ekonomi.
https://gogocasino.one
Недавно столкнулся с проблемой: холодильник Bosch вдруг начал сильно шуметь и плохо морозить. Вызвал мастера из московского сервисного центра, и он быстро прибыл на место. Диагностика показала необходимость замены вентилятора. Ремонт был выполнен на дому, с использованием оригинальных запчастей, что гарантирует надёжность ремонта. Цена оказалась доступной, а на выполненные работы предоставили гарантию на один год. Остался очень доволен сервисом.
Бош-Ремонт.рф – [url=https://xn—-9sbn2afcdnw7c.xn--p1ai/]ремонт варочных панелей[/url]
http://flowervl.ru/
Das Tipico Live Casino Blackjack ist eines der beliebtesten Spiele in der Welt des Online-Glücksspiels. Mit seiner spannenden Atmosphäre und den attraktiven Gewinnchancen zieht es viele Spieler an, die auf der Suche nach Nervenkitzel und Unterhaltung sind.
Das Spielprinzip des Live Casino Blackjacks ist einfach: Ziel ist es, mit den eigenen Karten so nah wie möglich an die Zahl 21 zu gelangen, ohne dabei zu überschreiten. Der Spieler tritt dabei gegen den Dealer an, der ebenfalls Karten erhält. Durch geschicktes Setzen und Einschätzen der eigenen Chancen kann man das Spiel für sich entscheiden und attraktive Gewinne erzielen.
Ein besonderer Reiz des Tipico Live Casino Blackjacks liegt darin, dass man gegen echte Dealer spielt, die per Live-Stream zugeschaltet sind. Dadurch entsteht eine authentische Casino-Atmosphäre, die die Spieler direkt in das Geschehen hineinzieht. Zudem bietet das Live Casino die Möglichkeit, mit anderen Spielern zu interagieren und sich über Strategien und Tipps auszutauschen.
Besonders positiv fällt bei Tipico die hohe Qualität der Live-Übertragung auf. Die Dealer sind professionell geschult und sorgen für ein reibungsloses Spielvergnügen. Zudem stehen verschiedene Varianten des Blackjack zur Auswahl, sodass für jeden Geschmack das passende Spiel dabei ist.
FГјr Neulinge im Bereich des Live Casino Blackjacks bietet Tipico zudem Tutorials und Hilfestellungen an, um sich mit den Regeln vertraut zu machen und die besten Strategien zu erlernen. Somit steht einem erfolgreichen und unterhaltsamen Spieleerlebnis nichts im Wege.
Alles in allem ist das Tipico Live Casino Blackjack eine hervorragende Möglichkeit, um sich in die Welt des Online-Glücksspiels zu stürzen. Mit seinem spannenden Spielprinzip, der authentischen Casino-Atmosphäre und den attraktiven Gewinnchancen bietet es ein unvergessliches Spielerlebnis für alle Fans von Blackjack.
https://tipicocasino.one/
Zet Casino Störung
Das beliebte Online-Casino Zet Casino hat in letzter Zeit mit einigen technischen Störungen zu kämpfen. Viele Spieler berichten von Verbindungsproblemen, langen Ladezeiten und sogar Abstürzen während des Spielens. Diese Störungen führen nicht nur zu Frustration bei den Spielern, sondern können auch dazu führen, dass diese ihr Vertrauen in das Casino verlieren und sich nach einer anderen Plattform umsehen.
Die Ursachen für diese Störungen sind bisher nicht bekannt. Es wird jedoch vermutet, dass sie auf technische Probleme mit den Servern oder der Software des Casinos zurückzuführen sind. Die Betreiber des Casinos arbeiten bereits daran, diese Probleme so schnell wie möglich zu beheben und die bestmögliche Spielerfahrung zu gewährleisten.
In der Zwischenzeit empfehlen wir den Spielern, geduldig zu sein und die offiziellen Social-Media-Kanäle des Casinos im Auge zu behalten, um über den aktuellen Stand der Störungen informiert zu bleiben. Es ist auch ratsam, regelmäßig die Webseite des Casinos zu besuchen, um Updates zu erhalten und mögliche Entschädigungen oder Sonderaktionen in Anspruch zu nehmen.
Trotz der aktuellen Probleme bleibt Zet Casino eine der beliebtesten Online-Glücksspielplattformen und bietet eine Vielzahl von Spielen und Bonusangeboten für seine Spieler. Wir hoffen, dass die Störungen bald behoben werden und die Spieler wieder ein reibungsloses Spielerlebnis genießen können.
https://zetcasino.one/
[url=https://motomagazinvfdvgd.vn.ua/uk/v-nakolenniki-i-nalokotniki/]motomagazinvfdvgd.vn.ua/uk/v-nakolenniki-i-nalokotniki/[/url]
В ТЕЧЕНИЕ нашем мотомагазине ваша милость обнаружите запчасти для мотоциклов, скутеров, снегоходов и еще квадроциклов. У нас вы всегда найдёте масла для мотоциклов, фильтра, цепи.
мотоекіпіровка
blublu
Zet Casino ist ein Online-Casino, das bereits seit einiger Zeit auf dem Markt ist und eine Vielzahl von Spielen und Angeboten für die Spieler bereithält. In diesem Artikel möchten wir unsere Erfahrungen mit Zet Casino teilen und Ihnen einen Einblick geben, was Sie von diesem Anbieter erwarten können.
Zet Casino bietet eine breite Auswahl an Spielen von bekannten Anbietern wie NetEnt, Microgaming, Play’n GO, Yggdrasil und vielen mehr. Von Slots Гјber Tischspiele bis hin zu Live-Casino-Spielen ist fГјr jeden Geschmack etwas dabei. Die Spiele laufen reibungslos und die Grafiken sind hochwertig, was ein angenehmes Spielerlebnis garantiert.
Ein weiterer Pluspunkt von Zet Casino sind die großzügigen Boni und Aktionen für die Spieler. Neue Spieler erhalten einen Willkommensbonus, der aus einem Einzahlungsbonus und Freispielen besteht. Auch für bestehende Spieler gibt es regelmäßig Reload-Boni, Cashback-Angebote und Turniere, bei denen attraktive Preise winken.
Der Kundenservice von Zet Casino ist gut erreichbar und beantwortet Anfragen schnell und kompetent. Es stehen verschiedene Kontaktmöglichkeiten wie Live-Chat, E-Mail und Telefon zur Verfügung. Wir haben positive Erfahrungen gemacht und fühlten uns gut betreut.
Ein kleiner Kritikpunkt sind die Umsatzbedingungen der Boni, die etwas hoch angesetzt sind. Es erfordert daher etwas Geduld und Glück, um die Bonusbedingungen zu erfüllen und Gewinne auszahlen zu können. Dennoch überwiegen die positiven Aspekte von Zet Casino, sodass wir den Anbieter empfehlen können.
Insgesamt waren unsere Erfahrungen mit Zet Casino sehr positiv. Das breite Spielangebot, die groГџzГјgigen Boni und der gute Kundenservice machen diesen Anbieter zu einer guten Wahl fГјr Casino-Liebhaber. Probieren Sie es aus und Гјberzeugen Sie sich selbst von Zet Casino!
https://zetcasino.one/
https://maps.google.ht/url?q=https://t.me/+z0aCw4Lc6rUzZWQ6
124969D742
Руководство по установке кондиционера: детальные шаги и советы для успеха
установка кондиционера цена [url=https://ustanovka-kondicionera-cena.ru/]установка кондиционера цена[/url] .
Found an enthralling article, I recommend you to read https://www.brightsideofthesun.com/users/cchatruletka
I urge you steer clear of this site. My personal experience with it has been purely frustration as well as concerns regarding fraudulent activities. Be extremely cautious, or alternatively, seek out a trustworthy platform to meet your needs.
Zet Casino Anmelden: Schritt-fГјr-Schritt-Anleitung
Zet Casino ist eine beliebte Online-GlГјcksspielplattform, die eine Vielzahl von Spielen und ausgezeichneten Bonusangeboten fГјr Spieler bietet. Wenn Sie sich fГјr eine Anmeldung bei Zet Casino interessieren, sind hier die Schritte, die Sie befolgen mГјssen:
Schritt 1: Besuchen Sie die Zet Casino Webseite
Gehen Sie auf die offizielle Zet Casino Webseite und klicken Sie auf den “Anmelden” Button. Dieser befindet sich in der Regel in der oberen rechten Ecke der Seite.
Schritt 2: FГјllen Sie das Anmeldeformular aus
Nachdem Sie auf den “Anmelden” Button geklickt haben, werden Sie aufgefordert, ein Anmeldeformular auszufГјllen. Geben Sie hier Ihre persГ¶nlichen Informationen wie Name, E-Mail-Adresse und Passwort ein.
Schritt 3: Bestätigen Sie Ihre E-Mail-Adresse
Sobald Sie das Anmeldeformular ausgefüllt haben, erhalten Sie eine E-Mail von Zet Casino mit einem Bestätigungslink. Klicken Sie auf diesen Link, um Ihre E-Mail-Adresse zu bestätigen.
Schritt 4: Tätigen Sie Ihre erste Einzahlung
Nachdem Ihre E-Mail-Adresse bestätigt wurde, können Sie jetzt eine Einzahlung auf Ihr Konto tätigen. Zet Casino bietet verschiedene Zahlungsmethoden wie Kreditkarten, e-Wallets und Banküberweisungen an.
Schritt 5: Spielen und gewinnen!
Nachdem Sie Ihre Einzahlung getätigt haben, können Sie nun die Vielzahl von Spielen bei Zet Casino genießen. Nutzen Sie auch die verschiedenen Bonusangebote und Aktionen, um Ihre Gewinnchancen zu erhöhen.
Zet Casino bietet eine spannende und sichere Spielumgebung fГјr alle GlГјcksspiel-Enthusiasten. Folgen Sie einfach diesen Schritten, um sich erfolgreich bei Zet Casino anzumelden und viel SpaГџ und Gewinne zu erleben!
https://zetcasino.one/
SCAM
blibliblu
Банкротство: задачи и этапы.
Важные особенности процедуры.
Банкротство – это сложный и многоэтапный процесс, который может оказаться как последним шансом для должника восстановить
свою финансовую стабильность, так и
способом защитить интересы
кредиторов. В данной статье мы рассмотрим основные задачи и этапы банкротства,
а также выделим важные особенности данной процедуры.
**Задачи банкротства:**
1. **Защита интересов кредиторов:** Одной из главных задач процедуры банкротства является обеспечение
честного удовлетворения требований кредиторов.
Банкротство позволяет упорядочить очередность погашения долгов и минимизировать риски для кредиторов.
2. **Восстановление финансовой стабильности:
** Для должника банкротство может стать возможностью начать все с чистого листа.
Процедура позволяет решить проблемы с долгами
и переосмыслить финансовую стратегию.
3. **Уменьшение юридических
проблем:** Банкротство часто сопровождается судебными разбирательствами
и требует аккуратной работы с
юридическими аспектами. Целью процедуры является минимизация рисков возникновения
дополнительных юридических проблем.
**Этапы банкротства:**
1. **Подача заявления:**
Вся процедура начинается с подачи должником заявления
о банкротстве. После этого начинается судебное разбирательство и оценка финансового состояния должника.
2. **Объявление о банкротстве:** После тщательного
анализа финансовой ситуации суд может принять решение о
банкротстве. Это означает, что должник признается неплатежеспособным и начинается процедура ликвидации его активов.
3. **Ликвидация активов и урегулирование долгов:** В этом этапе осуществляется реализация имущества должника с целью погашения задолженностей перед кредиторами.
Важно отметить, что распределение средств происходит в строгом соответствии с законом.
4. **Завершение процедуры:** После того как все
активы должника будут реализованы и долги урегулированы, процедура банкротства завершается.
Должник освобождается от долгов, которые не были погашены
в результате ликвидации активов.
**Важные особенности процедуры:**
1. **Соблюдение законодательства:** Банкротство регулируется
законом и требует строгого соблюдения
всех его норм и положений.
2. **Прозрачность:** Весь процесс банкротства должен быть максимально прозрачным как для должника,
так и для кредиторов. Это помогает избежать возможных конфликтов
и споров.
3. **Юридическая экспертиза:** В силу сложности процедуры банкротства требуется квалифицированная
юридическая поддержка как со стороны должника, так и
со стороны кредиторов.
Банкротство – это серьезный шаг, который требует внимательного анализа и планирования.
Правильное выполнение этапов и учет особенностей процедуры поможет обеспечить максимально благоприятный исход как для должника, так и для кредиторов.
Also visit my page; “https://wiki.whenparked.com/User:SherryFoltz784”
Zet Casino Bonus Bedingungen
Das Zet Casino ist eine beliebte Online-Spielhalle, die ihren Kunden eine Vielzahl von Spielen und Boni bietet. Einer der größten Anreize für neue Spieler sind die großzügigen Bonusangebote, die das Casino zur Verfügung stellt. Doch bevor man sich über die tollen Boni freuen kann, sollte man sich auch über die Bonusbedingungen informieren.
Die Bonusbedingungen im Zet Casino sind fair und transparent gestaltet, um sicherzustellen, dass Spieler die Regeln verstehen und ihre Gewinne entsprechend auszahlen können. Zunächst ist es wichtig zu wissen, dass es verschiedene Arten von Boni gibt, die im Casino angeboten werden. Dazu gehören Einzahlungsboni, Freispiele und Cashback-Angebote.
Um einen Bonus im Zet Casino zu erhalten, müssen Spieler eine Mindesteinzahlung tätigen. Die genauen Beträge variieren je nach Angebot, aber in der Regel liegt die Mindesteinzahlung bei 20€. Es ist wichtig zu beachten, dass manche Boni spezielle Bonuscodes erfordern, die bei der Einzahlung eingegeben werden müssen.
Darüber hinaus unterliegen die Boni im Zet Casino Umsatzbedingungen. Das bedeutet, dass Spieler den Bonus eine bestimmte Anzahl an Malen umsetzen müssen, bevor sie eine Auszahlung beantragen können. Die Umsatzbedingungen variieren je nach Angebot, aber liegen in der Regel zwischen 30-50 Mal. Es ist wichtig, diese Bedingungen zu erfüllen, um keine Probleme bei der Auszahlung zu haben.
Zusätzlich gibt es auch einige Spiele, die nicht zur Erfüllung der Umsatzbedingungen beitragen. Dazu gehören zum Beispiel Tischspiele wie Blackjack oder Roulette. Es ist ratsam, sich vorab über die Spielbeiträge zu informieren, um sicherzustellen, dass man die Umsatzbedingungen möglichst effizient erfüllen kann.
Insgesamt sind die Bonusbedingungen im Zet Casino fair und gut verständlich. Spieler sollten sich jedoch immer die Zeit nehmen, die Bedingungen genau zu lesen und zu verstehen, bevor sie einen Bonus beanspruchen. So können sie sicherstellen, dass sie ihr Spielerlebnis im Casino optimal nutzen und von den großzügigen Boni profitieren können.
https://zetcasino.one/
На сайте https://grsuv.ru/ закажите такую полезную и нужную услугу, как гравировка, которая выполняется на жетонах, ложках, а также шильдах. Гравировка может быть выполнена на самых разных вещах. В компании также производят и клише, выполняют гравировку по кругу. При необходимости специалист приедет непосредственно к заказчику, чтобы выполнить все необходимые работы. Все услуги оказываются на инновационном оборудовании, а потому только высокого качества. Специально для вас специалист подберет шрифты и выполнит любую надпись. Будут написаны имена на любых столовых приборах, выполненных из серебра либо нержавеющей стали.
Found an enthralling article, I recommend you to read https://www.rollbamaroll.com/users/cchatruletka
Zet Casino Guru: Die ultimative Quelle fГјr Online Casino Bewertungen und Informationen
Das Thema Online Glücksspiel ist in den letzten Jahren immer populärer geworden, und es gibt eine Vielzahl von Online Casinos, die Spielern eine Vielzahl von Spielen und Boni bieten. Wenn Sie jedoch nach einer vertrauenswürdigen Quelle suchen, um die besten Online Casinos zu finden, dann ist der Zet Casino Guru genau das Richtige für Sie.
Der Zet Casino Guru ist eine Website, die sich darauf spezialisiert hat, Online Casinos zu überprüfen und Bewertungen zu veröffentlichen. Das Team hinter der Website besteht aus Experten, die jahrelange Erfahrung in der Glücksspielbranche haben und genau wissen, worauf es bei einem guten Online Casino ankommt.
Auf der Website des Zet Casino Guru finden Sie detaillierte Bewertungen zu den beliebtesten Online Casinos, einschließlich Informationen über die angebotenen Spiele, die Benutzerfreundlichkeit der Website, die Qualität des Kundenservice und vieles mehr. Darüber hinaus bietet die Website auch Tipps und Strategien, wie Sie Ihre Gewinnchancen maximieren können und wie Sie verantwortungsbewusst spielen können.
Eine der besten Eigenschaften des Zet Casino Guru ist die Tatsache, dass alle Bewertungen unabhängig und objektiv sind. Das Team hinter der Website nimmt sich die Zeit, jedes Casino gründlich zu überprüfen, bevor es eine Bewertung veröffentlicht, um sicherzustellen, dass nur die besten Online Casinos empfohlen werden.
Also, wenn Sie auf der Suche nach einem vertrauenswГјrdigen Online Casino sind, dann schauen Sie sich den Zet Casino Guru an. Mit ihrer fundierten Bewertungen und Expertenwissen werden sie Ihnen helfen, das perfekte Online Casino fГјr Ihre BedГјrfnisse zu finden. Besuchen Sie noch heute ihre Website und entdecken Sie die Welt des Online GlГјcksspiels mit Zet Casino Guru!
https://zetcasino.one/
На сайте https://smartflow.ru ознакомьтесь с сантехникой премиального уровня. Вся продукция создана из инновационных, высокотехнологичных материалов и с использованием уникальных, новаторских технологий. Продукты разработаны тщательным образом, чтобы предложить вам лучшее. Сантехника гарантирует безупречный уровень функциональности, эстетичности. Она наделена долгим сроком эксплуатации. Идеально впишется в концепцию. Представлены «умные» модели унитазов безупречного качества.
I highly advise steer clear of this site. My personal experience with it was nothing but disappointment as well as suspicion of fraudulent activities. Exercise extreme caution, or alternatively, seek out an honest service to meet your needs.
На сайте https://iz-zala.ru/ находится каталог товаров. Здесь каждый желающий получает возможность составить описание продукции, опубликовать самые популярные товары, а также актуальные акции. В специальном поле разместите побольше данных для того, чтобы вашим предложением заинтересовались. Текст в блоках можно форматировать, выделять различные его части, а также особенно важные элементы, добавлять картинки и делать все, что считаете нужным. Также можно ссылаться и на другие документы. Необходимо рассказать о компании очень подробно.
SCAM
Amplificadores de senal gsm
No dejes que una senal debil arruine tu comunicacion con un amplificador de senal movil de calidad
[url=https://profile.hatena.ne.jp/NeilLopez23/]https://profile.hatena.ne.jp/NeilLopez23/[/url]
Das Tipico 1-Cent-Casino ist eine einzigartige Spiel-Plattform, die es Spielern ermöglicht, mit sehr kleinen Einsätzen in die Welt des Online-Glücksspiels einzutauchen. Bei diesem Casino-Anbieter können die Spieler bereits ab einem Cent pro Spiel teilnehmen und somit das Risiko minimal halten.
Durch die niedrigen Einsätze eignet sich das Tipico 1-Cent-Casino besonders gut für Einsteiger, die noch keine Erfahrung mit Online-Casinos haben oder einfach nur aus Spaß ein paar Runden spielen möchten. Aber auch für erfahrene Spieler bietet das 1-Cent-Casino die Möglichkeit, neue Spiele auszuprobieren oder Strategien zu testen, ohne dabei großes Geld riskieren zu müssen.
Das Angebot an Spielen im Tipico 1-Cent-Casino ist vielfältig und umfasst klassische Casino-Spiele wie Roulette, Blackjack, Poker und Spielautomaten. Die Spieler können zwischen verschiedenen Varianten und Designs wählen, um ihr persönliches Lieblingsspiel zu finden. Zudem bietet das Casino regelmäßig neue Spiele an, sodass es nie langweilig wird.
Ein weiterer Vorteil des Tipico 1-Cent-Casinos ist die Möglichkeit, auch mobil zu spielen. Die Casino-Plattform ist für alle gängigen mobilen Geräte optimiert, sodass die Spieler von überall aus Zugriff auf ihre Lieblingsspiele haben.
Insgesamt ist das Tipico 1-Cent-Casino eine tolle Option für alle, die gerne in die Welt des Online-Glücksspiels eintauchen möchten, ohne dabei viel Geld riskieren zu müssen. Die niedrigen Einsätze, die große Auswahl an Spielen und die Möglichkeit des mobilen Spielens machen das Casino zu einer attraktiven Wahl für Anfänger und erfahrene Spieler gleichermaßen. Wer also Lust auf spannende Casino-Unterhaltung hat, sollte das Tipico 1-Cent-Casino definitiv einmal ausprobieren.
https://tipicocasino.one/
Привет любители гаджетов!
Узнайте о свежих релизах, инновационных функциях и дизайнерских решениях, которые представляют ведущие бренды смартфонов. Мы разберем, какие тенденции определяют будущее мобильных устройств и какие технологии будут нас радовать в ближайшем будущем.
В мире мобильных технологий бурлит событийный океан, и наш портал – ваш надежный компас в этом путешествии. Мы предлагаем вам всестороннюю обзорную статью о последних новостях в индустрии смартфонов.
Все самое лучшее на сайте https://formobile.top/category/criptovaluta/
[url=https://formobile.top/]смартфоны новости технологий[/url]
криптовалюта новости
интересные новости технологий
новости про гаджеты
Удачи!
I highly advise steer clear of this platform. The experience I had with it was purely frustration as well as suspicion of fraudulent activities. Exercise extreme caution, or better yet, look for an honest service for your needs.
sweet bonanza casino [url=http://www.sweet-bonanza-game.ru/]http://www.sweet-bonanza-game.ru/[/url] .
Das Tipico Casino ist eine beliebte Online-GlГјcksspielplattform, die eine Vielzahl von Spielen fГјr die Spieler bietet. Von Slots Гјber Tischspiele bis hin zu Live-Casino-Spielen gibt es fГјr jeden Geschmack etwas zu entdecken. Allerdings kann es manchmal vorkommen, dass Spieler auf die Meldung “Die gewГ¤hlte Kategorie ist ungГјltig” stoГџen.
Diese Fehlermeldung tritt meist aus technischen Gründen auf und kann verschiedene Ursachen haben. Zum einen kann es sein, dass das Spiel temporär nicht verfügbar ist oder es Probleme mit der Verbindung zum Server gibt. In solchen Fällen hilft es oft, die Seite neu zu laden oder es zu einem späteren Zeitpunkt erneut zu versuchen.
Es kann aber auch sein, dass die gewählte Kategorie tatsächlich nicht verfügbar ist. In diesem Fall kann es helfen, sich an den Kundenservice zu wenden, um weitere Informationen zu erhalten. Die Mitarbeiter des Tipico Casinos stehen in der Regel rund um die Uhr zur Verfügung und sind bemüht, bei Problemen zu helfen.
Insgesamt ist die Fehlermeldung “Die gewГ¤hlte Kategorie ist ungГјltig” zwar Г¤rgerlich, jedoch meist schnell behoben. Mit etwas Geduld und vielleicht der UnterstГјtzung des Kundenservice kГ¶nnen Spieler in kГјrzester Zeit wieder auf ihre Lieblingsspiele zugreifen und ihr GlГјck versuchen.
https://tipicocasino.one/
LOSE MONEY
https://sata.jatimprov.go.id/siang/?enakb=oppatoto
Банкротство: задачи и этапы.
Важные особенности процедуры.
Банкротство – это сложный и многоэтапный процесс, который может оказаться как последним шансом для должника восстановить свою финансовую стабильность,
так и способом защитить интересы кредиторов.
В данной статье мы рассмотрим основные задачи и этапы банкротства, а также
выделим важные особенности данной
процедуры.
**Задачи банкротства:**
1. **Защита интересов кредиторов:** Одной из главных задач процедуры банкротства является обеспечение честного
удовлетворения требований кредиторов.
Банкротство позволяет упорядочить очередность погашения долгов и минимизировать риски для
кредиторов.
2. **Восстановление финансовой стабильности:** Для должника банкротство
может стать возможностью начать все с чистого листа.
Процедура позволяет решить
проблемы с долгами и переосмыслить
финансовую стратегию.
3. **Уменьшение юридических проблем:** Банкротство часто сопровождается судебными разбирательствами и требует
аккуратной работы с юридическими аспектами.
Целью процедуры является минимизация рисков возникновения дополнительных юридических проблем.
**Этапы банкротства:**
1. **Подача заявления:** Вся процедура начинается с подачи должником заявления о банкротстве.
После этого начинается судебное разбирательство и оценка финансового состояния должника.
2. **Объявление о банкротстве:** После тщательного анализа финансовой ситуации
суд может принять решение о банкротстве.
Это означает, что должник признается неплатежеспособным и начинается процедура ликвидации его активов.
3. **Ликвидация активов и урегулирование долгов:** В
этом этапе осуществляется реализация имущества
должника с целью погашения задолженностей перед кредиторами.
Важно отметить, что распределение средств происходит в строгом соответствии с
законом.
4. **Завершение процедуры:** После того как все активы
должника будут реализованы и долги урегулированы, процедура банкротства завершается.
Должник освобождается от долгов,
которые не были погашены
в результате ликвидации активов.
**Важные особенности процедуры:
**
1. **Соблюдение законодательства:** Банкротство регулируется законом и требует
строгого соблюдения всех его норм и положений.
2. **Прозрачность:** Весь процесс банкротства должен быть максимально
прозрачным как для должника,
так и для кредиторов. Это помогает избежать
возможных конфликтов и споров.
3. **Юридическая экспертиза:** В силу сложности
процедуры банкротства требуется
квалифицированная юридическая поддержка как со стороны должника,
так и со стороны кредиторов.
Банкротство – это серьезный шаг, который требует внимательного анализа и планирования.
Правильное выполнение этапов и учет особенностей процедуры поможет обеспечить максимально благоприятный исход как для должника, так и
для кредиторов.
Here is my blog post; “https://ai-db.science/wiki/Finance”
Das Zet Bet Casino ist eine aufregende Online-Glücksspielplattform, die Spielern eine Vielzahl von Spielen und Boni bietet. Mit einer benutzerfreundlichen Oberfläche und einer großen Auswahl an Spielen ist es leicht zu verstehen, warum Zet Bet bei Spielern auf der ganzen Welt so beliebt ist.
Das Casino bietet eine Vielzahl von Spielen, von klassischen Slots bis hin zu aufregenden Tischspielen wie Blackjack und Roulette. Es gibt auch eine Vielzahl von Live-Dealer-Spielen, bei denen Spieler mit echten Dealern interagieren können, was dem Spielerlebnis eine authentische Note verleiht.
Ein weiterer großer Vorteil des Zet Bet Casinos sind die regelmäßigen Boni und Promotionen, die den Spielern zusätzliche Anreize bieten, weiterzuspielen. Von Willkommensboni für neue Spieler bis hin zu wöchentlichen Freispielen und Cashback-Angeboten gibt es immer etwas Neues, auf das sich die Spieler freuen können.
Darüber hinaus bietet das Zet Bet Casino eine Vielzahl von Zahlungsmethoden, darunter Kreditkarten, E-Wallets und Banküberweisungen, um sicherzustellen, dass die Spieler problemlos Ein- und Auszahlungen vornehmen können.
Insgesamt ist das Zet Bet Casino eine ausgezeichnete Wahl für Spieler, die auf der Suche nach einem erstklassigen Online-Glücksspielerlebnis sind. Mit einer großen Auswahl an Spielen, großzügigen Boni und einer benutzerfreundlichen Oberfläche ist es leicht zu verstehen, warum immer mehr Spieler sich für das Zet Bet Casino entscheiden.
https://zetcasino.one/
Das Tipico Online Casino hat seinen Hauptsitz auf der Insel Malta, genauer gesagt in der Hauptstadt Valletta. Malta gehört zu den führenden Standorten für Online-Glücksspiele in Europa, da das Land eine strikte Regulierung und Gesetzgebung in Bezug auf Online-Casinos hat.
Durch die Regulierung der Malta Gaming Authority (MGA) ist das Tipico Online Casino gezwungen, strenge Richtlinien einzuhalten, um ein faires und sicheres Spielerlebnis zu gewährleisten. Die MGA überwacht und kontrolliert alle Aktivitäten des Casinos, um sicherzustellen, dass alle Spiele fair und transparent ablaufen.
Ein weiterer Vorteil des Standorts Malta ist die steuerliche Situation für Online-Casinos. Malta bietet attraktive Steuervorteile, die es Online-Glücksspielunternehmen ermöglichen, Gewinne auf legale Weise zu erwirtschaften. Dies ermöglicht es dem Tipico Online Casino, seinen Spielern eine Vielzahl von Spielen anzubieten, ohne hohe Steuern zahlen zu müssen.
Darüber hinaus bietet Malta eine stabile Wirtschaft und ein attraktives Geschäftsumfeld für Online-Casinos. Die gut ausgebildete Arbeitnehmerschaft, die Infrastruktur und die Nähe zu anderen europäischen Märkten machen Malta zu einem idealen Standort für das Tipico Online Casino.
Insgesamt profitiert das Tipico Online Casino von seinem Standort auf Malta durch die regulatorischen Vorteile, steuerlichen Anreize und das attraktive Geschäftsumfeld. Dadurch kann das Casino seinen Spielern ein sicheres und unterhaltsames Spielerlebnis bieten und gleichzeitig erfolgreich am Markt agieren.
https://tipicocasino.one/
На сайте https://ack-group.ru/ воспользуйтесь услугами психологического центра, в котором работают высококлассные, опытные специалисты с огромным стажем. Они никогда не критикуют, а подталкивают к тому, чтобы вы сами осознали проблему и приняли правильное решение. Очень часто устраиваются акции, чтобы вы сэкономили семейный бюджет. Психологи помогают пациентам справиться с любой проблемой, независимо от сложности. Основная специализация – это финансы, личные отношения. Если и вы хотите изменений в личной жизни и хотите улучшить свое положение, то воспользуйтесь услугами специалистов.
Tipico ist ein beliebter Anbieter von Sportwetten und Online-Casinospielen, der es den Spielern ermöglicht, ihr Glück bei verschiedenen Spielen zu versuchen. Viele Menschen fragen sich, ob es möglich ist, Geld von Tipico Sportwetten auf das Casino zu übertragen.
Die Antwort lautet ja, es ist möglich, Geld von Tipico Sportwetten auf das Casino zu überweisen. Dies kann auf verschiedene Weisen geschehen, zum Beispiel durch die Verwendung einer gemeinsamen Geldbörse oder durch manuelles Übertragen des Geldes von einem Konto zum anderen.
Es ist wichtig zu beachten, dass es möglicherweise einige Regeln und Einschränkungen gibt, wenn es darum geht, Geld von Sportwetten auf das Casino zu übertragen. Beispielsweise können manche Boni nur für bestimmte Spiele oder Sportwetten verwendet werden und können nicht auf das Casino übertragen werden.
Wenn Sie Geld von Tipico Sportwetten auf das Casino übertragen möchten, sollten Sie sich daher am besten vorher über die genauen Regeln und Bedingungen informieren. Auf der Website von Tipico finden Sie alle notwendigen Informationen dazu.
Alles in allem ist es also durchaus möglich, Geld von Tipico Sportwetten auf das Casino zu überweisen. Mit einem verantwortungsvollen Umgang und der Einhaltung der Regeln können Sie Ihr Glück bei verschiedenen Spielen versuchen und hoffentlich hohe Gewinne erzielen. Viel Spaß und Erfolg beim Spielen!
https://tipicocasino.one/
[url=https://omyguide.site]entertainment[/url] – Best Restaurants in Hungary, Best Restaurants in Portugal
[url=https://hyper.hosting/]vps провайдер[/url] – впс сервера, дешевый вдс хостинг
ballu кондиционер [url=https://multisplit-sistemy-kondicionirovaniya.ru/]https://multisplit-sistemy-kondicionirovaniya.ru/[/url] .
I strongly recommend to avoid this platform. My personal experience with it has been only frustration along with concerns regarding scamming practices. Exercise extreme caution, or better yet, seek out a trustworthy site to meet your needs.
Столкнулся с проблемой в холодильнике Gaggenau: перестал морозить верхний отсек. Сервисный центр Gaggenau предложил оперативный выезд мастера. Специалист быстро нашёл неисправность — проблема была в системе No Frost, которую заменили на месте. Ремонт прошёл быстро, с гарантией на выполненные работы на год. Отличный сервис и профессиональный подход!
Gaggenau-Remonty.ru – [url=https://gaggenau-remonty.ru/]gaggenau ремонт[/url]
Zet Casino – Kasinoomtaler
Zet Casino ist ein Online-Kasino, das sich in den letzten Jahren zu einer beliebten Anlaufstelle für Glücksspiel-Fans entwickelt hat. Das Kasino bietet eine Vielzahl von Spielen, großzügige Boni und eine benutzerfreundliche Oberfläche, die es Spielern ermöglicht, ein erstklassiges Spielerlebnis zu genießen.
Die Auswahl an Spielen bei Zet Casino ist beeindruckend. Von klassischen Tischspielen wie Blackjack und Roulette bis hin zu modernen Video-Slots und Live-Casino-Spielen – hier ist fГјr jeden Geschmack etwas dabei. Die Spiele werden von renommierten Software-Anbietern wie NetEnt, Microgaming und Play’n GO bereitgestellt, was fГјr Fairness und hohe QualitГ¤t garantiert.
Ein weiterer großer Pluspunkt des Kasinos sind die großzügigen Boni und Aktionen, die regelmäßig angeboten werden. Neue Spieler können sich über einen großzigen Willkommensbonus freuen, der ihre erste Einzahlung verdoppelt und ihnen zusätzliche Freispiele für ausgewählte Spiele bietet. Darüber hinaus gibt es regelmäßig Turniere und Verlosungen, bei denen Spieler attraktive Preise gewinnen können.
Die Benutzeroberfläche von Zet Casino ist intuitiv und benutzerfreundlich gestaltet, was es auch unerfahrenen Spielern leicht macht, sich zurechtzufinden. Das Kasino ist vollständig mobiloptimiert, so dass Spieler auch von unterwegs aus auf ihre Lieblingsspiele zugreifen können.
Insgesamt bietet Zet Casino ein erstklassiges Spielerlebnis, das sowohl für Anfänger als auch für erfahrene Spieler geeignet ist. Mit einer riesigen Auswahl an Spielen, großzügigen Boni und einer benutzerfreundlichen Oberfläche ist dieses Kasino definitiv einen Besuch wert.
https://zetcasino.one/
На сайте https://akvapark-fentazi.ru/ изучите важную и полезную информацию об аквапарке «Фэнтези». Вы находитесь непосредственно на официальном сайте. Это подходящее место, в котором сможет полноценно отдохнуть вся семья, а особенно дети. На стоянке вы сможете оставить автомобиль и насладиться временем, проведенным с семьей. При этом стоимость билета остается на доступном уровне. Каждый посетитель сможет воспользоваться СПА-зоной, поплавать в бассейне, полакомиться вкусными блюдами.
Tipico Casino No Deposit Bonus 2019
Das Tipico Casino bietet seinen Kunden auch im Jahr 2019 attraktive Boni ohne Einzahlung an. Ein Casino Bonus ohne Einzahlung ist ein Bonus, den man erhält, ohne selbst Geld einzahlen zu müssen. Dies ist eine großartige Möglichkeit, um das Casino kennenzulernen und erste Erfahrungen zu sammeln, ohne direkt eigenes Geld riskieren zu müssen.
Der No Deposit Bonus bei Tipico kann in Form von Freispielen oder Bonusguthaben angeboten werden. Freispiele ermöglichen es dem Spieler, an ausgewählten Spielautomaten einige Runden kostenlos zu spielen, wohingegen Bonusguthaben als Geldbetrag gutgeschrieben wird, den man im Casino einsetzen kann.
Um den No Deposit Bonus von Tipico zu erhalten, muss man sich einfach als neuer Kunde registrieren. Oftmals ist es notwendig, eine E-Mail-Verifikation durchzufГјhren oder einen Bonuscode einzugeben, um den Bonus zu aktivieren. Nach erfolgreicher Registrierung wird der Bonus automatisch gutgeschrieben und kann sofort genutzt werden.
Es ist jedoch wichtig zu beachten, dass No Deposit Boni meistens bestimmten Bedingungen unterliegen. Diese umfassen meist Umsatzbedingungen, die besagen, wie oft der Bonus in Spielen umgesetzt werden muss, bevor man Gewinne auszahlen lassen kann. Es ist daher ratsam, sich die Bonusbedingungen genau anzusehen, bevor man den Bonus in Anspruch nimmt.
Alles in allem bietet der No Deposit Bonus von Tipico eine tolle Möglichkeit, um das Casino kennenzulernen und erste Gewinne ohne eigenes Risiko zu erzielen. Es lohnt sich daher, regelmäßig die Webseite von Tipico zu besuchen, um über aktuelle Bonusangebote informiert zu sein und das Beste aus seinem Casinoerlebnis herauszuholen.
https://tipicocasino.one/
Все больше и больше людей проявляют
интерес к азартным играм онлайн, и в этом им помогает казино Вавада.
Для того чтобы начать игру, нужно
зайти на сайт казино и пройти простую процедуру регистрации.
После этого вам откроется доступ к
большому выбору игр, в том числе слотам, рулетке, покеру и многим другим.
Казино Вавада предлагает щедрые бонусы
и акции для своих игроков, что делает игру еще более
увлекательной. Не упустите свой шанс и войдите
в мир азартных развлечений с казино Вавада!
Feel free to surf to my blog :: скачать вавада официальный сайт
I urge you steer clear of this platform. The experience I had with it was only disappointment along with doubts about fraudulent activities. Be extremely cautious, or even better, seek out an honest platform to meet your needs.
Tipico Live Casino ist eine beliebte Option für Glücksspielfans, die gerne in Echtzeit spielen und das Gefühl eines echten Casinos erleben möchten. Allerdings kann es manchmal vorkommen, dass die Funktion des Live Casinos nicht wie gewünscht funktioniert.
Es gibt verschiedene Gründe, warum das Tipico Live Casino nicht funktioniert. Einer der häufigsten Gründe ist eine schlechte Internetverbindung. Wenn die Verbindung langsam oder instabil ist, kann es zu Problemen beim Laden der Spiele oder beim Anzeigen der Live-Übertragung kommen.
Ein weiterer Grund für Probleme im Tipico Live Casino könnte ein technisches Problem auf der Seite selbst sein. In diesem Fall ist es ratsam, den Kundendienst von Tipico zu kontaktieren, um das Problem zu melden und Unterstützung zu erhalten.
Es ist auch möglich, dass das Problem auf dem eigenen Gerät liegt. In diesem Fall sollte man sicherstellen, dass die Software des Geräts auf dem neuesten Stand ist und dass alle notwendigen Updates installiert sind.
Wenn das Tipico Live Casino nicht funktioniert, gibt es einige Maßnahmen, die man ergreifen kann, um das Problem zu lösen. Zunächst sollte man seine Internetverbindung überprüfen und gegebenenfalls neu starten. Falls das Problem weiterhin besteht, kann es hilfreich sein, den Browserverlauf zu löschen oder einen anderen Browser zu verwenden.
In manchen Fällen kann es auch sinnvoll sein, das Gerät neu zu starten oder die Cookies und den Cache zu löschen. Falls alle diese Lösungsansätze nicht funktionieren, ist es ratsam, den Kundendienst zu kontaktieren und das Problem zu schildern.
Insgesamt ist das Tipico Live Casino eine unterhaltsame und spannende Möglichkeit, um Glücksspiel in Echtzeit zu erleben. Wenn es jedoch zu Problemen mit der Funktion des Live Casinos kommt, ist es wichtig, ruhig zu bleiben und die oben genannten Tipps zu befolgen, um das Problem zu lösen und das Spielerlebnis zu verbessern.
https://tipicocasino.one/
Found an article that’s definitely worth your time – take a look http://d91652pj.beget.tech/2024/04/15/emocionalnye-perezhivaniya-doramy-s-russkoy-ozvuchkoy-dlya-kazhdogo-vkusa.html
Нужен срочный и недорогой ремонт холодильника Gaggenau в Москве? Сервисные центры предлагают оперативные и качественные услуги по доступным ценам. Мастера готовы приехать на дом в кратчайшие сроки, чтобы диагностировать и устранить любые неполадки. Благодаря использованию профессионального оборудования и оригинальных запчастей, ремонт выполняется быстро и эффективно, что позволяет восстановить работоспособность техники без значительных затрат. В результате вы получаете полностью функционирующий холодильник, готовый к дальнейшей эксплуатации.
Gaggenau-Remonty.ru – [url=https://gaggenau-remonty.ru/]сервисный центр gaggenau в москве официальный сайт[/url]
[url=https://omyguide.site/category/africa/morocco/]Top Places to Visit in Morocco[/url] – The Best Attractions in Bahamas, Best Restaurants in Italy
На сайте https://container-platform.ru имеется номер телефона для того, чтобы заказать качественные, надежные, практичные контейнерные площадки, предназначенные для мусора. Есть как на 2, так и 3 контейнера. Прямо сейчас ознакомьтесь с расценками на стандартные варианты. Напротив каждого варианта указаны технические характеристики и другая важная информация, которая необходима для того, чтобы быстрее определиться с выбором. Наличие контейнерных площадок обязательно для всех дворов.
Для тех, кто предпочитает азартные игры в онлайн казино,
важно знать, как попасть в личный кабинет на платформе Вавада.
Для этого нужно пройти по ссылке на
официальный сайт, где на главной странице
можно найти кнопку “Вход в личный кабинет”.
После этого необходимо ввести логин и
пароль, которые были указаны при регистрации.
Внутри кабинета пользователь может пополнить баланс, выбрать игровой автомат или пообщаться с технической поддержкой.
Удачи в игре!
Also visit my web-site; вавада
Произошёл сбой в работе моего духового шкафа Bosch: он перестал нагреваться. Я нашел в Москве сервисный центр с хорошими отзывами и оставил заявку на ремонт. Мастера оказались настоящими профи: они быстро диагностировали неисправность в терморегуляторе и заменили его. Работа заняла немного времени, и шкаф вновь в идеальном состоянии. Плюс ко всему, сервис оказался не только эффективным, но и стоил разумных денег.
Бош-Ремонт.рф – [url=https://xn—-9sbn2afcdnw7c.xn--p1ai/кофемашин]сервис кофемашин bosch[/url]
Zet Casino ist eine Online-GlГјcksspielplattform, die eine Vielzahl von Spielen fГјr Spieler aus der ganzen Welt bietet. Mit einer benutzerfreundlichen Website und einer Vielzahl von Einzahlungs- und Auszahlungsoptionen ist Zet Casino eine beliebte Wahl fГјr Online-Spieler.
Zet Casino bietet eine große Auswahl an Casinospielen, darunter beliebte Slots, Tischspiele wie Roulette und Blackjack, sowie Live-Dealer-Spiele. Die Website ist einfach zu bedienen und bietet eine schnelle und einfache Navigation, sodass Spieler schnell ihre Lieblingsspiele finden können.
Ein weiterer Vorteil von Zet Casino ist das großzügige Bonusprogramm. Neue Spieler erhalten einen Willkommensbonus bei ihrer ersten Einzahlung und können auch regelmäßig von anderen Promotionen und Turnieren profitieren.
Zet Casino legt großen Wert auf Sicherheit und Fairness und ist lizenziert und reguliert durch die Malta Gaming Authority. Spieler können also sicher sein, dass ihre persönlichen Daten und finanziellen Transaktionen geschützt sind.
Insgesamt bietet Zet Casino eine unterhaltsame und sichere Umgebung fГјr Online-Spieler. Mit einer groГџen Auswahl an Spielen, groГџzГјgigen Boni und einem benutzerfreundlichen Design ist Zet Casino definitiv eine Online-GlГјcksspielplattform, die es wert ist, ausprobiert zu werden. Besuchen Sie noch heute zet casino.com und entdecken Sie die aufregende Welt des Online-GlГјcksspiels.
https://zetcasino.one/
[url=https://hyper.hosting/]купить vds сервер дешево[/url] – дешевый vds, арендовать удаленный сервер
Произошёл сбой в работе моего духового шкафа Bosch: он перестал нагреваться. Я нашел в Москве сервисный центр с хорошими отзывами и оставил заявку на ремонт. Мастера оказались настоящими профи: они быстро диагностировали неисправность в терморегуляторе и заменили его. Работа заняла немного времени, и шкаф вновь в идеальном состоянии. Плюс ко всему, сервис оказался не только эффективным, но и стоил разумных денег.
Бош-Ремонт.рф – [url=https://xn—-9sbn2afcdnw7c.xn--p1ai/]ремонт духовых шкафов[/url]
Found an article that is worth reading – it’s really interesting! http://generalarminius.com/viewtopic.php?t=137110
http://images.google.ba/url?q=https://www.medflyfish.com/index.php?action=profile;u=1354130
Выбирайте на сайте грифы для штанг и гантелей grify-dlya-shtang с разным посадочным диаметром для силовых тренировок. Это популярное тренировочное оснащение для зоны свободных весов в тренажерных залах.Российский изготовитель рекомендует внушительный ассортимент слабоизогнутых W грифов по выгодным ценам напрямую у завода. Все наборы поступают в продажу с фиксаторами для блинов. Завод из России производит инвентарь из стали высших марок. Производимые продукты не нуждаются в постоянном обслуживании и ориентированы на длительную эксплуатацию в тренажерных залах. Для защиты от ударов все металлические поверхности хромируются. Приобретая у российского изготовителя вы получаете лучшие снаряды для безопасных занятий.
I highly advise to avoid this site. The experience I had with it was purely dismay along with concerns regarding deceptive behavior. Proceed with extreme caution, or even better, look for an honest site to meet your needs.
[url=https://fabrika-teplic.ru]Теплицы из поликарбоната распродажа от производителя[/url].
[url=https://fabrika-teplic.ru/]Садовая теплица из поликарбоната цена[/url].
[url=https://fabrika-teplic.ru/#1]Купить оцинкованную теплицу[/url].
[url=https://fabrika-teplic.ru/#2]Теплицы от производителя нижегородская область[/url].
[url=https://fabrika-teplic.ru/#3]Сайт теплиц[/url].
[url=https://fabrika-teplic.ru/#4]Теплицы от производителя с установкой[/url].
Zet Casino Auszahlungslimit
Zet Casino ist ein beliebtes Online-Casino, das eine Vielzahl von Spielen und groГџzГјgigen Bonusangeboten fГјr seine Kunden bietet. Wenn es jedoch um Auszahlungen geht, gibt es bestimmte Limitierungen, die Spieler beachten mГјssen.
Das Auszahlungslimit bei Zet Casino beträgt 10.000 Euro pro Monat. Das bedeutet, dass Spieler während eines Monats nicht mehr als 10.000 Euro aus ihrem Konto abheben können. Diese Limitierung kann für einige Spieler frustrierend sein, vor allem wenn man größere Gewinne erzielt.
Es ist wichtig zu beachten, dass das Auszahlungslimit nicht für progressive Jackpots gilt. Wenn ein Spieler einen progressiven Jackpot knackt, wird der volle Betrag sofort ausgezahlt, unabhängig von der Höhe des Jackpots.
Um das Auszahlungslimit zu umgehen, können Spieler ihre Auszahlungen aufteilen und in mehreren Transaktionen tätigen. Dies bedeutet, dass sie innerhalb eines Monats mehrere Auszahlungen von jeweils bis zu 10.000 Euro vornehmen können.
Zet Casino bietet auch High Roller Spielern die Möglichkeit, individuelle Auszahlungslimits zu vereinbaren. Wenn ein Spieler regelmäßig hohe Beträge gewinnt und auszuzahlen möchte, kann er sich an den Kundensupport wenden und ein höheres Auszahlungslimit beantragen.
Insgesamt ist das Auszahlungslimit bei Zet Casino eine Standardpraxis in der Online-Casino-Branche und dient dazu, die finanzielle Sicherheit des Casinos und der Spieler zu gewährleisten. Es ist wichtig, die Bedingungen und Limitierungen des Casinos zu kennen, um Enttäuschungen zu vermeiden.
Wenn Spieler das Auszahlungslimit bei Zet Casino im Auge behalten und ihre Auszahlungen entsprechend planen, können sie weiterhin die aufregenden Spiele und möglichen Gewinne des Casinos genießen.
https://zetcasino.one/
На сайте https://dom-otmostka.ru/ оставьте заявку для того, чтобы заказать такую популярную услугу, как монтаж отмостки из брусчатки, бетона, плитки, камня. Кроме того, оказываются услуги, связанные с обустройством ливневой канализации, а также дренажом. В компании работают компетентные сотрудники, которые произведут монтаж дорожек, детских, парковочных площадок. На любые работы действуют гарантии 3 года. Воспользуйтесь и вы компетентными работами лучших сотрудников. На все услуги установлены привлекательные расценки.
На сайте https://xakexpert.com/ воспользуйтесь услугами высококлассных, компетентных хакеров, которые смогут выполнить все необходимые работы, несмотря на их сложность. Вам доступна такая услуга, как взлом электронной почты, мобильного телефона, а также социальных сетей. Если вы подобрали какого-либо специалиста, то необходимо обязательно с ним связаться. Для этого напишите в чат. Специалист отличается колоссальным опытом, а самое главное, что обращение останется конфиденциальным.
For a gaming experience like no other, Kenyan players turn to these real money casinos Kenya.
Недавно моя стиральная машина Bosch начала странно вести себя, не отжимала белье. Я нашёл сервис в Москве, который предложил бесплатную диагностику на дому. Мастер приехал уже через несколько часов после звонка. Быстро выяснилось, что проблема в электронике управления. Ремонт был выполнен на месте, и машина снова работает идеально.
Бош-Ремонт.рф – [url=https://xn—-9sbn2afcdnw7c.xn--p1ai/кофемашин]ремонт кофемашин bosch дому[/url]
Zet Casino Einzahlungsmöglichkeiten
Zet Casino bietet seinen Kunden eine Vielzahl von Einzahlungsmöglichkeiten, um ihr Spielerkonto aufzuladen. Es ist wichtig, dass Spieler die richtige Methode wählen, die ihren Bedürfnissen und Vorlieben entspricht. In diesem Artikel werden wir die verschiedenen Einzahlungsmöglichkeiten im Zet Casino genauer betrachten.
Eine der beliebtesten Einzahlungsmethoden im Zet Casino ist die Kreditkarte. Spieler können ihre Visa oder Mastercard verwenden, um schnell und sicher Geld auf ihr Konto einzuzahlen. Transaktionen mit Kreditkarten sind in der Regel sofort verfügbar, so dass Spieler sofort mit dem Spielen beginnen können.
Eine weitere beliebte Einzahlungsmethode im Zet Casino ist die Banküberweisung. Spieler können Geld von ihrem Bankkonto auf ihr Spielerkonto überweisen. Obwohl dies etwas länger dauern kann als bei anderen Einzahlungsmethoden, ist es eine sichere und zuverlässige Möglichkeit, Geld auf das Spielerkonto einzuzahlen.
E-Wallets sind auch eine beliebte Einzahlungsoption im Zet Casino. Spieler können Dienste wie Skrill oder Neteller nutzen, um Geld auf ihr Spielerkonto einzuzahlen. Diese Methoden sind schnell und sicher und bieten den Spielern eine zusätzliche Ebene der Privatsphäre und Sicherheit.
Darüber hinaus bietet das Zet Casino auch die Möglichkeit, mit Kryptowährungen wie Bitcoin einzuzahlen. Diese Methode bietet Spielern eine weitere Ebene der Anonymität und Sicherheit. Transaktionen mit Kryptowährungen sind in der Regel schnell und haben niedrige Gebühren.
Insgesamt bietet das Zet Casino eine Vielzahl von Einzahlungsmöglichkeiten, die es den Spielern ermöglichen, schnell und sicher Geld auf ihr Spielerkonto einzuzahlen. Spieler sollten die verschiedenen Optionen sorgfältig prüfen und die Methode wählen, die am besten zu ihren Bedürfnissen passt. Egal für welche Einzahlungsmethode sich die Spieler entscheiden, sie können sicher sein, dass ihre Transaktionen im Zet Casino sicher und geschützt sind.
https://zetcasino.one/
На сайте https://compsch.com/ собраны самые интересные, увлекательные и содержательные советы на тему компьютеров. Так вы узнаете о том, как правильно оптимизировать, настроить, обслуживать машину. Это позволит технике прослужить намного дольше. Также имеются ценные советы о том, как справиться с вредоносным ПО. Есть информация и об 1С бухгалтерии, о ремонте телевизоров и многое другое, что позволит быстро справиться с ситуацией. Есть данные и о том, как правильно подобрать ноутбук, какие моменты следует учесть при его покупке.
https://images.google.az/url?q=https://xoxotun.000webhostapp.com/index.php?action=profile;u=86488
blibli
Tipico Geld Гјbertragen auf Casino
Das Online-Casino Tipico bietet seinen Nutzern eine Vielzahl von Möglichkeiten, um Geld auf ihr Spielerkonto zu transferieren. Vor allem für Neulinge kann es jedoch verwirrend sein, welche Optionen zur Verfügung stehen und welche die sicherste und schnellste ist. Daher haben wir für euch eine kleine Anleitung zum Geldtransfer bei Tipico zusammengestellt.
Eine der einfachsten Methoden, um Geld auf sein Tipico Casino Konto zu übertragen, ist die Verwendung von Kredit- oder Debitkarten. Hierfür einfach die Zahlungsmethode auswählen, den gewünschten Betrag eingeben und die Transaktion bestätigen. Dieser Vorgang ist in der Regel innerhalb von Minuten abgeschlossen und das Geld steht sofort zum Spielen bereit.
Eine weitere beliebte Option ist die Verwendung von E-Wallets wie PayPal oder Skrill. Auch diese Methode ist sehr sicher und schnell, da die Transaktion in Echtzeit erfolgt. Zudem bieten viele E-Wallets zusätzliche Sicherheitsmaßnahmen wie Zwei-Faktor-Authentifizierung oder Verschlüsselung der Daten.
Wer lieber anonym bleiben möchte, kann auch die Prepaid-Karte Paysafecard nutzen. Diese kann an vielen Verkaufsstellen erworben und dann einfach durch Eingabe des Codes auf der Webseite von Tipico eingelöst werden. Auch hier ist das Geld innerhalb von Minuten verfügbar.
Zu guter Letzt bietet Tipico auch die Möglichkeit, per Banküberweisung Geld auf das Spielerkonto zu transferieren. Diese Methode ist jedoch mit einer längeren Bearbeitungszeit verbunden, da die Banken in der Regel 1-3 Werktage benötigen, um den Betrag zu überweisen.
Egal für welche Methode man sich entscheidet, bei Tipico steht die Sicherheit der Transaktionen an oberster Stelle. Die Webseite ist mit modernsten Sicherheitsmaßnahmen ausgestattet, um die sensiblen Daten der Nutzer zu schützen. Zudem arbeitet Tipico nur mit seriösen Zahlungsdienstleistern zusammen, um eine sichere und zuverlässige Abwicklung der Transaktionen zu gewährleisten.
Insgesamt bietet Tipico also eine Vielzahl von sicheren und schnellen Möglichkeiten, um Geld auf das Casino Konto zu übertragen. Egal ob per Kreditkarte, E-Wallet, Paysafecard oder Banküberweisung, für jeden ist die passende Option dabei. Also worauf wartet ihr noch? Holt euch euren Willkommensbonus und legt los mit dem Spielspaß bei Tipico!
https://tipicocasino.one/
online casinos kenya [url=https://casinoonline.co.ke/]online casinos kenya[/url] .
124969D742
https://maps.google.so/url?q=https://300.ya.ru/moARYyxL
Das Zet Casino ist eine beliebte Online-GlГјcksspielseite, die eine Vielzahl von Spielen und Boni fГјr ihre Kunden bietet. Ein besonders attraktives Angebot fГјr alle neuen Spieler ist der Zet Casino Promo-Code 2022.
Der Zet Casino Promo-Code 2022 ermöglicht es neuen Spielern, einen großzügigen Bonus zu erhalten, wenn sie sich auf der Website registrieren. Mit diesem Promo-Code können Spieler zusätzliches Geld erhalten, um ihre Lieblingsspiele zu spielen und mehr Gewinne zu erzielen.
Um den Zet Casino Promo-Code 2022 zu nutzen, müssen Spieler einfach bei der Registrierung den Code eingeben und eine Einzahlung tätigen. Sobald dies erledigt ist, wird der Bonus automatisch ihrem Konto gutgeschrieben und sie können sofort mit dem Spielen beginnen.
Der Zet Casino Promo-Code 2022 ist eine großartige Möglichkeit für neue Spieler, das Casino kennenzulernen und ihre Gewinnchancen zu erhöhen. Mit diesem Bonus haben Spieler die Möglichkeit, mehr Geld zu gewinnen und noch mehr Spaß an den Spielen zu haben.
Also, worauf warten Sie noch? Registrieren Sie sich noch heute beim Zet Casino und nutzen Sie den Promo-Code 2022, um einen tollen Bonus zu erhalten und die Spannung zu erleben, die dieses Casino zu bieten hat. Viel GlГјck und viel SpaГџ beim Spielen!
https://zetcasino.one/
[url=https://darkpad.org?p=e614]counterfeit money[/url] – MoneyGram dark markets, Deep web search engines
boba 😀
Інноваційні технології в тактичних кросівках
кросівки тактичні [url=https://vijskovikrosivkifvgh.kiev.ua/]кросівки тактичні[/url] .
Оказался в ситуации, когда мой холодильник Gaggenau внезапно перестал холодить. Нашёл сервис по ремонту бытовой техники Gaggenau и был приятно удивлён их оперативностью. Мастер приехал уже на следующий день, провёл диагностику и быстро устранил неисправность в системе охлаждения. Стоимость ремонта оказалась вполне разумной, а качество работы и предоставленная гарантия на 12 месяцев меня полностью удовлетворили.
Gaggenau-Remonty.ru – [url=https://gaggenau-remonty.ru/]ремонт гагенау в москве[/url]
http://images.google.com.tj/url?q=https://300.ya.ru/6pfyw2KM
Для владельцев техники Gaggenau, официальный сервисный центр в Москве предоставляет полный спектр услуг по ремонту и обслуживанию. Посетив официальный сайт, можно легко заказать выезд мастера на дом, получить консультацию или ознакомиться с условиями гарантийного обслуживания. Сервис гарантирует использование оригинальных запчастей и предоставляет высококвалифицированных специалистов для решения любых проблем с вашей бытовой техникой.
Gaggenau-Remonty.ru – [url=https://gaggenau-remonty.ru/]холодильник gaggenau сервис центр[/url]
blublun
lalablublu
Tipico blockiert Casino
In den letzten Tagen haben viele Spieler berichtet, dass sie Probleme beim Zugriff auf das Online-Casino von Tipico haben. Der Sportwettenanbieter hat anscheinend bestimmte Länder davon abgehalten, auf das Casino zuzugreifen. Dies hat viele Spieler verärgert, die gerne Casino-Spiele bei Tipico genießen.
Die Blockierung des Casinos von Tipico betrifft vor allem Spieler aus Deutschland, Österreich und der Schweiz. Viele Nutzer haben versucht, das Problem zu lösen, indem sie den Kundensupport kontaktieren, aber bisher gibt es keine klare Erklärung für die Blockierung.
Einige Gerüchte besagen, dass Tipico möglicherweise Probleme mit den Glücksspielbehörden in den betroffenen Ländern hat und deshalb das Casino vorübergehend blockiert wurde. Andere vermuten, dass technische Probleme die Ursache für die Blockierung sein könnten.
Für die Spieler ist diese Blockierung sehr ärgerlich, da sie die Möglichkeit beraubt werden, ihre Lieblingsspiele im Casino von Tipico zu spielen. Viele Spieler sind auf der Suche nach alternativen Online-Casinos, um ihre Casino-Bedürfnisse zu befriedigen.
Wir hoffen, dass Tipico bald eine Lösung für dieses Problem findet und die Spieler wieder Zugriff auf das Casino erhalten. Bis dahin müssen die Spieler sich wohl oder übel nach anderen Optionen umsehen.
https://tipicocasino.one/
Came across an interesting article, worth a glance https://ipiter.build2.ru/viewtopic.php?id=20883#p64133
Онлайн казино Pokerdom – это надежное место для любителей азартных игр.
Но что делать, если доступ к сайту заблокирован?
Воспользуйтесь зеркалом Pokerdom! Зеркало – это альтернативный адрес сайта, который позволяет обойти блокировку и
продолжить игру. Покердом зеркало всегда доступно
и обеспечивает безопасный доступ к играм.
Не упустите возможность насладиться азартом в
любое время! Попробуйте зеркало Pokerdom
и продолжайте выигрывать!
my web page: pokerdom официальный сайт
Tipico Casino Einzahlung Blockiert
Es kann frustrierend sein, wenn man versucht, eine Einzahlung im Tipico Casino zu tätigen und plötzlich feststellt, dass die Zahlung blockiert ist. In solchen Fällen ist es wichtig zu verstehen, warum dies passiert und wie man das Problem lösen kann.
Eine blockierte Einzahlung kann verschiedene Gründe haben. Einer der häufigsten Gründe ist, dass die Zahlungsmethode, die man verwendet hat, nicht mit Tipico kompatibel ist. Man sollte sicherstellen, dass die gewählte Zahlungsmethode von Tipico akzeptiert wird und keine Probleme damit bestehen.
Ein weiterer Grund fГјr blockierte Einzahlungen kann sein, dass das Konto des Spielers nicht ausreichend gedeckt ist. Es ist wichtig, sicherzustellen, dass genГјgend Geld auf dem Konto vorhanden ist, um die Einzahlung erfolgreich abzuschlieГџen.
Es kann auch vorkommen, dass Tipico Sicherheitsmaßnahmen ergreift, um verdächtige Transaktionen zu verhindern. In einem solchen Fall kann es hilfreich sein, den Kundendienst zu kontaktieren und das Problem zu klären.
Wenn man feststellt, dass die Einzahlung blockiert ist, sollte man zunächst die genauen Gründe dafür herausfinden. Anschließend kann man entsprechende Maßnahmen ergreifen, um das Problem zu lösen und die Einzahlung erfolgreich abzuschließen.
Es ist wichtig, geduldig zu bleiben und das Problem nicht auf die leichte Schulter zu nehmen. Mit der richtigen Herangehensweise und Kommunikation mit dem Kundendienst von Tipico kann man in der Regel schnell eine Lösung finden und wieder problemlos im Casino spielen.
https://tipicocasino.one/
blolbo
blibliblu
Toda la emocion de los casinos en linea en Peru
casino en linea peru [url=https://mejores-casinos-online-peru.com/]casino en linea peru[/url] .
https://images.google.ge/url?q=https://300.ya.ru/mPWKryis
На сайте https://shemi-otopleniya.ru/ ознакомьтесь с техническими характеристиками, особенностями, нюансами гибкой подводки, выполненной из нержавеющей стали. Так вы сможете ознакомиться с размерами, диаметром, а также различными модификациями. Есть варианты небольших размеров, а также более внушительных. Также можно ознакомиться и с информацией, которая посвящена шаровому крану. Регулярно публикуются любопытные и интересные новости на данную тематику. Обязательно ознакомьтесь и с фотографиями.
Im Tipico Casino erwarten die Spieler nicht nur eine Vielzahl von traditionellen Casino-Spielen, sondern auch eine große Auswahl an aufregenden Spielautomaten. Die Tipico Casino Slots sind eine der Hauptattraktionen des Online-Casinos und bieten den Spielern die Möglichkeit, ihr Glück auf unterhaltsame und spannende Weise zu versuchen.
Die Slots im Tipico Casino sind vielfГ¤ltig und abwechslungsreich, sodass fГјr jeden Geschmack und jedes Budget das passende Spiel dabei ist. Von klassischen Frucht-Slots Гјber Video-Slots mit aufwendigen Animationen und Bonusfunktionen bis hin zu progressiven Jackpot-Slots, die die Chance auf hohe Gewinne bieten – die Auswahl ist riesig und lГ¤sst keine WГјnsche offen.
Die Tipico Casino Slots zeichnen sich nicht nur durch ihre Vielfalt aus, sondern auch durch ihre hohe QualitГ¤t und Fairness. Alle Spiele werden von bekannten und renommierten Entwicklern wie NetEnt, Microgaming und Play’n GO zur VerfГјgung gestellt, die fГјr ihre erstklassige Grafik, reibungslose SpielablГ¤ufe und faire Auszahlungsquoten bekannt sind.
DarГјber hinaus bietet das Tipico Casino regelmäßig attraktive Bonusangebote und Aktionen fГјr Slots-Spieler, die zusГ¤tzliche Gewinnchancen und SpaГџ garantieren. Ob Freispiele, Einzahlungsboni oder Turniere – hier kommt garantiert keine Langeweile auf.
Wer also auf der Suche nach einem aufregenden und unterhaltsamen Casino-Erlebnis ist, sollte die Tipico Casino Slots auf jeden Fall ausprobieren. Mit ihrer Vielfalt, Qualität und Fairness bieten sie die besten Voraussetzungen für stundenlangen Spielspaß und lukrative Gewinne.
https://tipicocasino.one/
На сайте https://www.kapatel.ru/ вы почерпнете много интересной, познавательной информации, которая касается дачи, сада, а также огорода. Вы узнаете о том, как правильно обустроить дачу, огород так, чтобы они были функциональными, вместительными и радовали богатым урожаем. Имеются данные о строительстве, ремонте и различных отделочных работах. Опубликованы материалы о вредителях, различных заболеваниях, о самых цветущих растениях. Вы можете задавать вопросы и присылать сообщения для уточнения некоторых моментов.
PBN sites
We will generate a system of privately-owned blog network sites!
Advantages of our self-owned blog network:
WE DO everything so GOOGLE doesn’t understand THAT THIS IS A PBN network!!!
1- We acquire domains from different registrars
2- The main site is hosted on a VPS server (Virtual Private Server is high-speed hosting)
3- The remaining sites are on distinct hostings
4- We attribute a unique Google ID to each site with verification in Search Console.
5- We make websites on WP, we don’t use plugins with the help of which malware penetrate and through which pages on your websites are produced.
6- We never repeat templates and utilize only distinct text and pictures
We refrain from work with website design; the client, if wished, can then edit the websites to suit his wishes
Каждый, кто интересуется азартными играми,
должен обратить внимание на казино Пинап их уникальное разнообразие игровых автоматов.
Это один из самых популярных онлайн-платформ, предлагающих игры на любой вкус.
Игровые автоматы в казино Пинап разработаны ведущими производителями софта и отличаются качественной графикой и захватывающим игровым процессом.
Здесь вы найдете классические слоты, видео-игры, а
также уникальные новинки с яркими спецэффектами.
Благодаря удобному интерфейсу
и интуитивно понятным правилам,
даже новички легко разберутся в
игровом процессе. Для тех, кто предпочитает играть на деньги,
предлагается широкий выбор способов пополнения счета и вывода выигрышей.
Казино Пинап также радует своих игроков разнообразными бонусами
и акциями. Новые посетители
получают приветственный
бонус при регистрации, а постоянные клиенты участвуют в лояльностии
программе с возможностью получить дополнительные
поощрения.
Играйте в казино Пинап и наслаждайтесь захватывающими азартными
играми в любое время суток! Вам точно не будет скучно с
таким разнообразием игровых автоматов и высокими шансами на
выигрыш. Удачи вам и больших выигрышей!
Feel free to surf to my web site – верхнеозерский сельскохозяйственный техникум
Tipico Sportwetten sind eine beliebte Form des GlГјcksspiels, bei der Spieler auf den Ausgang von sportlichen Ereignissen wetten. Das Unternehmen Tipico ist einer der fГјhrenden Anbieter von Sportwetten in Deutschland und bietet auch eine Vielzahl von Casino-Spielen an.
Die Tipico Sportwetten auf Casino sind eine spannende Möglichkeit, sein Glück zu versuchen und gleichzeitig die Spannung von Sportereignissen zu genießen. Die Spieler können auf eine Vielzahl von Sportarten wie Fußball, Tennis, Basketball, Eishockey und viele mehr wetten. Dabei stehen verschiedene Wettmöglichkeiten zur Verfügung, wie zum Beispiel Einzelwetten, Kombiwetten oder Systemwetten.
Neben den Sportwetten bietet Tipico auch ein umfangreiches Angebot an Casino-Spielen an. Hier können die Spieler klassische Tischspiele wie Roulette, Blackjack und Poker spielen oder ihr Glück an den Spielautomaten versuchen. Die Casino-Spiele sind in verschiedenen Varianten verfügbar und bieten eine Vielzahl von Gewinnmöglichkeiten.
Um an den Tipico Sportwetten auf Casino teilnehmen zu können, müssen die Spieler ein Konto bei Tipico erstellen und ein Guthaben einzahlen. Das Guthaben kann dann für die Sportwetten oder Casino-Spiele genutzt werden. Zudem gibt es regelmäßig attraktive Bonusangebote und Aktionen, die den Spielern zusätzliche Gewinnchancen bieten.
Insgesamt bieten die Tipico Sportwetten auf Casino eine unterhaltsame und spannende Möglichkeit, sein Glück zu versuchen und gleichzeitig die Freude an Sport und Casino-Spielen zu genießen. Mit einer breiten Auswahl an Sportarten und Casino-Spielen sowie attraktiven Bonusangeboten ist Tipico eine beliebte Anlaufstelle für alle, die gerne spielen und gewinnen.
https://tipicocasino.one/
?Gana grandes premios en los casinos en linea de Peru!
casino en linea peru [url=https://mejores-casinos-online-peru.com/]casino en linea peru[/url] .
На сайте https://1-line.su/ воспользуйтесь помощью квалифицированных, компетентных сотрудников популярного предприятия «Первая линия». Они окажут необходимую поддержку в вопросах оптимизации, автоматизации различных бизнес-процессов. Компания сделает все возможное для того, чтобы вы работали наиболее эффективно и продуктивно. Воспользуйтесь полным набором работающих инструментов, которые точно вам пригодятся для построения бизнеса. Для того чтобы начать сотрудничество, просто напишите на электронную почту.
?Diviertete y gana en los casinos en linea de Peru!
casino en linea peru [url=https://mejores-casinos-online-peru.com/]casino en linea peru[/url] .
Das Zet Casino ist bekannt fГјr seine groГџzГјgigen Bonusangebote und Promotionen. FГјr das Jahr 2022 bietet das Casino einen speziellen “no deposit bonus code” an, der es Spielern ermГ¶glicht, ohne Einzahlung kostenloses Bonusgeld zu erhalten.
Der no deposit bonus code ist eine großartige Möglichkeit für neue Spieler, das Casino zu erkunden, ohne dabei eigenes Geld riskieren zu müssen. Mit diesem Bonus können Spieler verschiedene Casinospiele ausprobieren und ihre Gewinnchancen ohne finanzielles Risiko testen.
Um den no deposit bonus code zu erhalten, müssen Spieler lediglich einen speziellen Code eingeben, der auf der Website des Zet Casinos veröffentlicht ist. Nach der Eingabe des Codes wird das Bonusgeld automatisch auf das Spielerkonto gutgeschrieben und kann für die verfügbaren Casinospiele verwendet werden.
Es ist jedoch wichtig zu beachten, dass der no deposit bonus code bestimmten Bedingungen unterliegt, die erfüllt werden müssen, bevor eine Auszahlung der Gewinne möglich ist. Diese Bedingungen können beispielsweise das mehrfache Umsetzen des Bonusgeldes oder das Erfüllen eines Mindestumsatzes beinhalten.
Insgesamt bietet das Zet Casino mit seinem no deposit bonus code eine attraktive Möglichkeit für Spieler, das Casino kennenzulernen und erste Gewinne zu erzielen, ohne eigenes Geld einzahlen zu müssen. Wer also auf der Suche nach einem spannenden und lukrativen Online-Casino-Erlebnis ist, sollte sich den no deposit bonus code nicht entgehen lassen.
https://zetcasino.one/
?Descubre los mejores casinos en linea en Peru!
mejor casino online peru [url=https://mejores-casinos-online-peru.com/]mejor casino online peru[/url] .
Der Tipico Casino Bonus ist eine großartige Möglichkeit für Spieler, ihre Gewinne zu maximieren und ihr Spielerlebnis zu verbessern. Doch wie genau kann man den Bonus einlösen und welche Schritte müssen beachtet werden?
Zunächst einmal muss man sich als Spieler bei Tipico anmelden und ein Konto erstellen. Nach der Registrierung kann man den Bonus aktivieren, indem man eine Einzahlung tätigt. Oftmals ist es notwendig, einen bestimmten Betrag einzuzahlen, um den Bonus zu erhalten. Je nach Aktion kann dieser Betrag variieren, daher ist es wichtig, die genauen Bedingungen zu beachten.
Nachdem die Einzahlung erfolgreich abgeschlossen wurde, wird der Bonus automatisch gutgeschrieben. In einigen Fällen ist es jedoch erforderlich, den Bonus manuell anzufordern. Dafür muss man einfach den Kundenservice kontaktieren und um die Gutschrift des Bonus bitten.
Bevor man den Bonus jedoch nutzen kann, muss man die Umsatzbedingungen erfüllen. Diese geben vor, wie oft der Bonusbetrag umgesetzt werden muss, bevor eine Auszahlung möglich ist. Hierbei ist es wichtig, die genauen Bedingungen zu beachten, da der Bonus andernfalls verfallen kann.
Es lohnt sich daher, vor der Einlösung eines Bonusses die genauen Bedingungen zu studieren und sicherzustellen, dass man in der Lage ist, die Umsatzbedingungen zu erfüllen. Mit etwas Glück und Geschick kann man den Bonus erfolgreich einlösen und seine Gewinne maximieren. Viel Spaß beim Spielen!
https://tipicocasino.one/
bliloblo
https://images.google.gm/url?q=https://300.ya.ru/9IvLbP12
На сайте https://climat.best приобретите качественные, функциональные кондиционеры, сплит-системы, тепловые насосы, а также чиллеры. Вся продукция именитых, проверенных и надежных брендов, а потому техника прослужит долго без потери технических характеристик, возможностей. А если необходимо подобрать что-то определенное, то воспользуйтесь специальным поиском. Перед вами есть и самые популярные позиции, которые пользуются особенным спросом среди покупателей. В интернет-магазине вы отыщите как настенные, так и напольно-потолочные конструкции, кассетные.
menthol inhalers
На сайте https://td1000.ru/ находится огромное количество интересных, познавательных статей, которые касаются того, как развить социальные сети и простимулировать количество подписчиков. Также имеются данные о турах по Ямалу. Опубликован материал и о вместительных гардеробных и о том, как подобрать мебель. Есть контент, посвященный различным игровым онлайн-заведениям. Полезные статьи откроют вам глаза на многочисленные вопросы. По этой причине вы узнаете много нового и интересного.
Казино Starda Casino – это популярное онлайн заведение, которое предлагает широкий
выбор азартных игр и выгодных бонусов
для своих клиентов. Для того чтобы начать игру в казино Starda Casino, необходимо зарегистрироваться и войти в свой аккаунт.
Вход на сайт казино Starda Casino осуществляется через специальную форму, где необходимо указать логин и пароль.
После этого игрок получает доступ
к полному ассортименту игр, включая слоты, рулетку, блэкджек и другие азартные развлечения.
Одним из основных преимуществ
казино Starda Casino является возможность
игры как на реальные деньги, так
и в демо-режиме. Это позволяет новичкам протестировать игры перед тем, как
делать ставки на настоящие деньги.
Бонусы и акции в казино Starda Casino также являются важным аспектом игрового
процесса. Новые игроки могут получить приветственный бонус за первый депозит, а постоянные клиенты участвуют
в различных акциях и розыгрышах ценных призов.
Казино Starda Casino предлагает своим игрокам круглосуточную поддержку, которая поможет решить любые возникающие вопросы.
С удобным интерфейсом и безопасными методами оплаты,
казино Starda Casino становится идеальным выбором
для всех любителей азартных игр.
Не упустите свой шанс испытать азарт и
увлекательные игры в казино Starda Casino.
Регистрируйтесь сейчас и получите доступ к лучшим азартным развлечениям
прямо сейчас!
Акции и скидки
– Как выбрать и купить кран-миксер
купить нержавеющий [url=https://krany-sharovye-nerzhaveyushie-msk.ru/]купить нержавеющий[/url] .
Как узнать рейтинг букмекера
мобильные букмекерские конторы [url=https://bukmeker-bk.ru/]бк рб[/url] .
На сайте https://podvodka.okis.ru/ ознакомьтесь с гибкой подводкой различного дюйма. Посмотрите технические характеристики, особенности и другую полезную информацию, которая будет вам необходима. На портале имеется таблица на некоторые размеры. Она поможет лучше сориентироваться в выборе. Также указаны и расценки, которые потребуются для составления сметы. Кроме того, имеется и важная информация относительно проведения профессиональных монтажных работ. Вы узнаете обо всех нюансах, которые потребуются в процессе установки.
[url=https://promo1x.site/skachat-1xbet-na-android-besplatno/]1xbet скачать автоматы на деньги[/url] – 1хбет промокод на сегодня, промокод 1х
В России процедура списания долгов имеет свои особенности, которые определяются законодательством и правилами финансового
рынка. Списание долгов — это процесс, при котором кредитор
отказывается от своего права требования по возврату заемных средств или уменьшает сумму
задолженности. Для физических и юридических лиц этот процесс может иметь
различные последствия и условия, в зависимости от характера долга и субъекта, который является кредитором.
Одной из основных форм списания долгов в России
является процедура банкротства.
Физическое лицо может обратиться в суд
с заявлением о признании его банкротом.
В случае, если суд удовлетворяет такое заявление,
происходит ликвидация имущества заемщика для удовлетворения
требований кредиторов. После ликвидации имущества, если оно не
покрывает все долги, оставшаяся
сумма может быть списана.
Еще одним способом списания
долгов является реструктуризация.
Этот метод предполагает пересмотр условий кредитного договора с целью уменьшения суммы задолженности
или изменения сроков ее погашения.
Реструктуризация может быть проведена
по соглашению между заемщиком и кредитором или по
решению суда.
Кроме того, существует возможность списания долгов в случае применения мер государственной поддержки.
Например, в периоды экономических кризисов
или чрезвычайных ситуаций правительство может принимать меры по стимулированию реструктуризации
долгов или даже их частичного или полного списания для облегчения финансового положения населения или определенных
отраслей экономики.
Важно отметить, что процесс списания долгов в России тщательно
регулируется законодательством и требует соблюдения определенных процедур и условий.
Кроме того, списание долгов может иметь серьезные
последствия для финансового положения как заемщика, так и кредитора,
поэтому необходимо внимательно оценивать все возможные альтернативы и
последствия перед принятием решения о
списании долгов.
Here is my web-site “https://wavedream.wiki/index.php/User:CharlieWurst923”
узнать больше [url=https://phoenixtravel.md/hot/]Горящие Туры[/url]
Stumbled upon an interesting article – I suggest you take a look http://lossantosbattalion17.listbb.ru/viewtopic.php?f=3&t=252
li l7
Саратов доставка цветов на дом
http://images.google.co.bw/url?q=https://dzen.ru/a/ZfrZF5isFmwikLbc
машины китайские
lixiang li9
li xiang l9
d3 lixiang l9
lixiang l7 рестайлинг 2024
[url=https://mostep.ru]Продажа теплиц от производителя[/url].
[url=https://mostep.ru/]Теплицы из поликарбоната по низким ценам[/url].
[url=https://mostep.ru/#1]Купить теплицу недорого[/url].
[url=https://mostep.ru/#2]Купить теплицу от производителя[/url].
[url=https://mostep.ru/#3]Теплицы из поликарбоната на заказ[/url].
[url=https://mostep.ru/#4]Купить теплицу в рассрочку[/url].
На сайте https://greateastsiberia.ru/ почитайте поучительную, интересную и увлекательную информацию, которая касается здорового образа жизни. Имеются ценные, важные рекомендации относительно правильного питания, занятий спортом и других моментов. Есть информация о том, как сохранить суставы, о народных методах. Имеются рекомендации о том, как сохранить здоровье самых маленьких. Вы узнаете о том, как правильно бегать для получения необходимого эффекта. С вами поделятся своими рецептами для того, чтобы достичь гармонии души.
The best real money casinos Kenya offer Kenyan players unparalleled gaming experiences.
Лучшие букмекеры в рейтинге
мобильные букмекерские конторы [url=https://bukmeker-bk.ru/]вход букмекерская[/url] .
Рейтинг букмекерских сайтов
мобильные букмекерские конторы [url=https://bukmeker-bk.ru/]вход букмекерская[/url] .
Почему важен рейтинг букмекера
лучшие букмекерские конторы в беларуси [url=https://bukmeker-bk.ru/]ставки на спорт[/url] .
Історія винекнення тактичних рюкзаків
Стиль і практичність
військові тактичні рюкзаки [url=https://ryukzakivijskovibpjgl.kiev.ua/]військові тактичні рюкзаки[/url] .
Рейтинг букмекерских сайтов
рейтинг [url=https://bukmeker-bk.ru/]букмекерская топ лучших[/url] .
форум где купить кортинефф
Як вибрати ідеальний варіант
Кращі тактичні рюкзаки
тактичний рюкзак [url=https://ryukzakivijskovibpjgl.kiev.ua/]https://ryukzakivijskovibpjgl.kiev.ua/[/url] .
counterstrike skin gambling sites
Тут, Вы найдете лучшие цены на изготовление морских аквариумов https://akvariumy-na-zakaz.ru/
Find your gaming paradise in the exciting world of real money casinos Kenya.
Які новинки в тактичних рюкзаках
Секрети вибору
тактичний військовий рюкзак [url=https://ryukzakivijskovibpjgl.kiev.ua/]тактичний військовий рюкзак[/url] .
Новые МФО, предлагающие онлайн-займы на карту, становятся все более популярными благодаря их доступности и удобству использования. Основной аргумент в пользу таких сервисов заключается в их способности быстро реагировать на срочные финансовые потребности заемщиков, минимизируя бюрократию и время ожидания, что делает их привлекательным выбором для современного потребителя, нуждающегося в быстрой финансовой поддержке.
Фин-Мир [url=https://dzen.ru/a/Zg_bqxHnsk6e4u7i]мкк новые[/url]
На сайте https://wedding42.ru/ почитайте информацию, которая касается того, как правильно, быстро и без хлопот организовать свадьбу мечты. Имеются материалы о том, как красиво и изысканно оформить помещение, какое платье лучше всего подобрать. Опубликована информация об организации СПА для жениха и невесты. Обязательно ознакомьтесь с рубриками, посвященными гостям на свадьбе, обычаям, свадебному путешествию, подаркам. Возможно, вам понравятся свадебные платья со шлейфом. Перед вами несколько вариантов, среди которых вы подберете что-то для себя.
марафон букмекерская контора [url=https://www.sport-bk.by/]https://www.sport-bk.by/[/url] .
Циклёвка паркета: особенности и этапы услуги
Циклёвка паркета — это процесс восстановления внешнего вида паркетного пола путём удаления верхнего повреждённого слоя и возвращения ему первоначального вида. Услуга включает в себя несколько этапов:
Подготовка: перед началом работы необходимо защитить мебель и другие предметы от пыли и грязи, а также удалить плинтусы.
Шлифовка: с помощью шлифовальной машины удаляется старый лак и верхний повреждённый слой древесины.
Шпатлёвка: после шлифовки поверхность паркета шпатлюется для заполнения трещин и выравнивания поверхности.
Грунтовка: перед нанесением лака паркет грунтуется для улучшения адгезии и защиты от плесени и грибка.
Нанесение лака: лак наносится в несколько слоёв с промежуточной шлифовкой между ними.
Полировка: после нанесения последнего слоя лака паркет полируется для придания поверхности блеска и гладкости.
Циклёвка паркета позволяет обновить внешний вид пола, восстановить его структуру и продлить срок службы.
Сайт: ykladka-parketa.ru
Циклевка паркета
CRUDERRA https://cruderra.com/ – fast TechDocs for engineering teams. DiagramGPT and Architecture as code. Create docs to speed up development, onboarding & legacy code modernization.
blibli
Привет всем!
Всем, кто увлекается стихами, поэмами и собственным творчеством, Мay Poems представляет все лучшее от великих мировых поэтов и молодых талантов поэзии!
Я сам начинающий поэт, и этот портал помог мне приобрести уверенность и писать более интересно и искренне. [url=https://may-poems.ru]Стихи Федора Достоевского[/url]
Лучший способ получать удовольствие от поэзии и развиваться в ней – это читать стихи и писать свои собственные произведения, а также обмениваться ими в сообществах и обсуждать с друзьями.
Поэзия действительно захватывает ум и душу, и вдохновляет на личностный рост. Я рекомендую вам проводить время с пользой, занимаясь тем, что действительно вас вдохновляет!
Все самое лучшее на сайте https://may-poems.ru/
Поэзия Осипа Мандельштама
Стихи Бориса Пастернака
Стихи Сергея Есенина
текст стихотворения полностью
Удачи!
blibli
https://reduslim.at/
My family members all the time say that I am killing
my time here at net, however I know I am getting know-how all the time
by reading thes fastidious articles or reviews.
На сайте http://profotonsk.ru профессиональный фотограф предлагает свою услугу по специализации – интерьерная фотосессия. Большой опыт работы и множество рекламных фотосессий позволяет фотографу работать как с частными риэлторами, так и с агентствами недвижимости. В своей работе он применяет камеру с полноформатным сенсором и широкоугольный объектив, это обеспечивает отличное качество изображения, у вас есть возможность в этом лично убедиться. Подробнее посмотреть услуги фотографа, отзывы, а также его портфолио, вы можете на портале.
Adult video
I highly advise stay away from this platform. My own encounter with it has been nothing but dismay as well as doubts about fraudulent activities. Proceed with extreme caution, or better yet, find a more reputable platform to meet your needs.
На сайте https://fordrazbor.ru/ уточните то, где проходит авторазбор Ford. Перед вами топ сервисов, где проводится авторазбор. Здесь продают как б/у запчасти, так и те, что использовались совсем немного. От того, сколько детали находились в эксплуатации, зависит их итоговая стоимость. У некоторых компаний имеется онлайн-каталог, где можно посмотреть те товары, которые имеются в наличии, а также ознакомиться с ценами. А есть и такие авторазборы, где сразу же установят необходимую запчасть.
Компания MIGRANT SUPPORT с успехом предлагает услуги в Польше по оформлению транспортной лицензии. Мы сконцентрированы на действенном решении задач своих клиентов. Всегда рады помочь и подробно ответить на интересующие вас вопросы. Ждем ваши обращения с нетерпением. https://vpolshe.com/transportnaya-litsenziya-v-polshe/ – сайт, где представлена полезная информация о транспортной лицензии в Польше. Гарантируем приемлемую стоимость. Вы можете получить профессиональную консультацию уже сейчас. Звоните и пишите нам!
Всероссийская благотворительная школьная ярмарка предлагает вам разместить собственные товары на ней или купить за образовательную валюту бенефиты и услуги в приложении VK Умникоины без какой-либо регистрации и скачивания. https://start.shkolnayayarmarka.ru/ – сайт, где можно разместить свои услуги и товары в качестве личного пожертвования. Также тут вы ознакомитесь детальнее с единицей обмена, которую используют для выполнения сделок на благотворительных ярмарках между продавцом и покупателем. Пишите нам уже сейчас.
Зайдите на сайт FishX https://fishx.org/ и вы найдете все о рыбалке, cнастях, прикормке, приманках, способах ловле, а также отчёты о рыбной ловле. Ознакомьтесь с видами рыб и на что они ловятся, их места обитания. Сайт будет полезен как начинающим рыбакам, так и профи с опытом рыбной ловли.
[url=https://smart-engineer.ru/catalog/]датчики уровня innolevel[/url] – иннолевел датчик уровня жидкости, частотник инноверт isd
Found captivating reading that I’d like to recommend to everyone http://86hm.ru/forum/flame/?topic_id=24835
[url=https://t.me/+VBaDQD1pFuA1ZWJi]Wittix Business[/url] – Poloniex, ибдф
[url=http://carepoint.su/lekarstva/munzharo-mounjaro/]тирзепатид купить +в москве[/url] – Оземпик от сахара, семаглутид 0.5 мг цена
[url=https://fabrika-mercha.ru/collection/novyy-god]подарок +на новый год начальная школа[/url] – felix jdm 1 кг, связать подарок +на новый год 2024
казахстан транзит грузов https://perevozka-iz-kz.ru/
http://forum.ribca.net/ibf_new/index.php?showtopic=420350
https://winline-app-bk.ru/
кіберпонеділок
https://maps.google.nu/url?q=https://t.me/+z0aCw4Lc6rUzZWQ6
здесь [url=https://xn—-jtbjfcbdfr0afji4m.xn--p1ai/]электрик томск[/url]
перейдите на этот сайт [url=https://xn—-jtbjfcbdfr0afji4m.xn--p1ai]электрик томск[/url]
узнать [url=https://xn—-jtbjfcbdfr0afji4m.xn--p1ai]электрик томск[/url]
На сайте https://luxbabycar.ru представлен каталог детских авто. Ассортимент постоянно обновляется. Здесь вы найдете: джипы, квадроциклы, багги, спецтехнику, толокар и многое другое высокого качества и по конкурентоспособным ценам. У нас самый широкий выбор детского автопарка. На сайте вы можете ознакомиться с фото-отзывами, а также посмотреть видео-обзор. Проконсультируйтесь со специалистом прямо сейчас. Весь товар прошел проверку качества, вы можете быть уверены за свой новый автомобиль.
Лендинг-пейдж — это одностраничный сайт, предназначенный для рекламы и продажи товаров или услуг, а также для сбора контактных данных потенциальных клиентов. Вот несколько причин, почему лендинг-пейдж важен для бизнеса:
Увеличение узнаваемости компании. Лендинг-пейдж позволяет представить компанию и её продукты или услуги в выгодном свете, что способствует росту узнаваемости бренда.
Повышение продаж. Заказать лендинг можно здесь – 1landingpage.ru Одностраничные сайты позволяют сосредоточиться на конкретных предложениях и акциях, что повышает вероятность совершения покупки.
Оптимизация SEO-показателей. Лендинг-пейдж создаются с учётом ключевых слов и фраз, что улучшает позиции сайта в результатах поиска и привлекает больше целевых посетителей.
Привлечение новой аудитории. Одностраничные сайты могут использоваться для продвижения новых продуктов или услуг, а также для привлечения внимания к определённым кампаниям или акциям.
Расширение клиентской базы. Лендинг-пейдж собирают контактные данные потенциальных клиентов, что позволяет компании поддерживать связь с ними и предлагать дополнительные услуги или товары.
Простота генерации лидов. Лендинг-пейдж предоставляют краткую и понятную информацию о продуктах или услугах, что облегчает процесс принятия решения для потенциальных клиентов.
Сбор персональных данных. Лендинг-пейдж позволяют собирать информацию о потенциальных клиентах, такую как email-адрес, имя и контактные данные, что помогает компании лучше понимать свою аудиторию и предоставлять более персонализированные услуги.
Улучшение поискового трафика. Лендинг-пейдж создаются с учётом определённых поисковых запросов, что позволяет привлекать больше целевых посетителей на сайт.
Эффективное продвижение новой продукции. Лендинг-пейдж можно использовать для продвижения новых товаров или услуг, что позволяет привлечь внимание потенциальных клиентов и стимулировать их к покупке.
Лёгкий процесс принятия решений. Лендинг-пейдж содержат только самую необходимую информацию, что упрощает процесс принятия решения для потенциальных клиентов.
В целом, лендинг-пейдж являются мощным инструментом для продвижения бизнеса, увеличения продаж и привлечения новых клиентов.
Заказать лендинг
На сайте https://taker10.casino сыграйте в интересные, увлекательные и удивительные игры, которые произведут на вас впечатление своей динамикой, ярким оформлением. Есть Live-игры, которые позволят погрузиться в атмосферу азартных игр, топовые слоты, которые помогут попытать удачу и получить огромный выигрыш. Обязательно посетите раздел с топовыми играми, которые выбирает большинство. Воспользуйтесь возможностью заработать до 15% от депозитов рефералов. Вы сможете получать до 100 рублей ежедневно в качестве бонуса.
[url=https://ez-ddos.com]заказать ddos атаку[/url] – пентест сайта, пентест сайта
Компания «Эколан» предлагает впечатлительный выбор высококачественных товаров. У нас вы найдете замечательные декоративные подушки, одеяла, простыни, пледы, наматрасники, скатерти, полотенца и это далеко не полный перечень. Гарантируем оперативную доставку и заманчивые цены. https://ecolan37.ru – сайт, где имеется все нужное для создания домашнего комфорта и уюта. Всегда готовы помочь с выбором нашим клиентам, мы их ценим и постараемся решить самые интересующие их вопросы. Заказывая у нас, можете быть уверены в том, что останетесь приобретением, довольны.
restaurierung des Dekors an der Fassade
Found an enthralling article, I recommend you to read https://www.swishappeal.com/users/cchatruletka
read the article [url=https://atomic-wallet.fr]atom wallet[/url]
click resources [url=https://my-sollet.com]solana wallet[/url]
Амигуруми – это японское искусство создания игрушек с помощью приема амигуруми. Это слово происходит от японских слов “ами”, означающего вязаный, и “нюгуруми”, что переводится как плюшевая игрушка. Традиционно амигуруми изготавливаются из шерсти с использованием крючка. Игрушки амигуруми могут демонстрировать различных персонажей, животных, иллюзорные существа и многое другое. Это популярное занятие, которое имеет свои группы и фанатов по всему миру.
По амигуруми существует множество диаграмм и обучающих программ. В этих материалах представлены пошаговые инструкции по созданию различных персонажей амигуруми. Схемы позволяют каждый этап процесса вязания, а уроки снабжаются подробными учебными материалами. Такие вязание крючком игрушки амигуруми можно найти в интернете, на порталах по рукоделию, в специализированных группах и социальных платформах.
Также многие публикации по рукоделию содержат рисунки и руководства по созданию амигуруми. Искусники в этой области предоставляют своим опытом и мастерством через издания, видеоуроки и материалы.
Важно выбирать материалы, подходящие вашему уровню мастерства и стайлу. Некоторые материалы адресованы новичков, предоставляя простые инструкции и мастер-классы, в то время как для продвинутых рукодельников доступны более затейливые творческие работы и подробные техники.
your desires. Any client can choose any girl to spend time with her and get maximum pleasure. Large selection allows you to The experience is fantastic! You will dream of repeating the same fun in future. If you call two hotties, ask them to escort agency
На сайте http://waltzprof.com вы можете на выгодных условиях приобрести стальной профиль в широком ассортименте. Они предназначены для лофт перегородок, фасадных конструкций, удобной и быстрой сборки ограждающих преград и другое. Компания использует передовые технологии для выпуска качественной продукции. Покупка от производителя – это прекрасный способ сэкономить на услугах посредника. Подробнее ознакомиться с продукцией и посмотреть информацию о компании, вы можете на сайте. Закажите обратный звонок, и менеджеры вас проконсультируют по всем вопросам.
Peculiar article, just what I was looking for.
услуги сео специалиста https://seo-goody.ru/
[url=https://smart-engineer.ru/catalog/priboryi-kontrolya-i-upravleniya/]иннолевел датчик уровня жидкости[/url] – универсальный таймер овен ут, светосигнальная колонна три цвета
Came across an interesting article, I propose you have a look http://gamesfortop.ru/ekstrennaya-pomoshh-na-doroge-vyizovite-evakuator-i-zabudte-o-problemah
Доброго!
Наши новости предлагают вам полную картину происходящего в Украине и за ее пределами. Мы следим за всеми важными событиями и предоставляем вам объективную информацию.
Наши новости помогут вам быть в курсе самых важных событий в Украине и мире. Мы предлагаем вам объективную информацию, которая поможет вам понять происходящее вокруг.
Все самое лучшее на сайте https://kompromis.info/politika/
[url=https://kompromis.info/auto/]новости авто[/url]
новости здоровья
авто новости
политика новости
Удачи!
Компания «VIP транспорт» успешно предоставляет услуги пассажироперевозок. У нас имеются: автомобили премиум, бизнес-класса, комфорт, минивэны, вместительные автобусы с разным количеством мест и микроавтобусы. Мы собрали прекрасный коллектив водителей, в них можете быть полностью уверенными. Ищете вип авто такси? Anapa-vip-transport.ru – сайт, где есть телефонный номер круглосуточной диспетчерской службы. Также тут представлены документы, ознакомиться с ними можно сейчас. Своим клиентам предлагаем лучшие условия. Звоните нам!
Амигуруми – это японское искусство создания игрушек с помощью способа амигуруми. Это слово происходит от японских слов “ами”, означающего вязаный, и “нюгуруми”, что переводится как плюшевая игрушка. Традиционно амигуруми изготавливаются из ниток с использованием крючка. Игрушки амигуруми могут представлять различных персонажей, зверей, фантастические существа и многое другое. Это популярное увлечение, которое имеет свои группы и сторонников по всему миру.
По амигуруми существует множество графиков и уроков. В этих материалах представлены пошаговые инструкции по созданию различных фигурок амигуруми. Графики демонстрируют каждый этап процесса вязания, а инструкции сопровождаются детальными инструкциями. Такие амигуруми мк можно найти в онлайн, на сайтах по рукоделию, в тематических сообществах и социальных сетях.
Также многие руководства по рукоделию содержат рисунки и уроки по созданию амигуруми. Мастера в этой области раскрывают своим опытом и навыками через издания, видеоуроки и пособия.
Важно выбирать материалы, соответствующие вашему уровню умений и предпочтениям. Некоторые материалы предназначены для новичков, предоставляя базовые пошаговые инструкции и инструкции, в то время как опытные рукодельников доступны более высокоуровневые изделия и детальные техники.
Gogo Casino är ett online casino som har blivit mycket populärt i Finland på senare tid. Med sitt enkla och smidiga gränssnitt har det lockat många spelare som söker en snabb och underhållande spelupplevelse.
En av de stora fördelarna med Gogo Casino är att det inte kräver någon registrering för att komma igång och spela. Istället använder man sig av BankID för att verifiera spelarens identitet och göra insättningar och uttag. Detta innebär att man slipper fylla i långa formulär med personuppgifter och istället kan fokusera på att spela sina favoritspel.
Gogo Casino erbjuder ett brett utbud av spel frГҐn kГ¤nda leverantГ¶rer som NetEnt, Microgaming och Play’n GO. HГ¤r kan man hitta allt frГҐn klassiska spelautomater till bordsspel som blackjack och roulette. Dessutom finns det ocksГҐ ett live casino dГ¤r man kan spela mot riktiga dealers via live streaming.
För att locka nya spelare erbjuder Gogo Casino generösa välkomstbonusar och regelbundna kampanjer och erbjudanden för sina befintliga spelare. Dessutom har de ett lojalitetsprogram där spelare kan samla poäng och få belöningar.
Sammanfattningsvis kan sägas att Gogo Casino är ett utmärkt val för spelare som söker en smidig och underhållande spelupplevelse utan krångel. Med sitt stora spelutbud och generösa bonusar har det blivit en favorit bland finska spelare. Besök Gogo Casino idag och upplev själv vad det har att erbjuda!
https://gogocasino.one
[url=https://kraken13t.com/]kraken10 at[/url] – кракен маркетплейс, кракен даркнет ссылка на сайт
На сайте https://chisto39.ru/ закажите профессиональную, качественную химчистку в тот же день, когда и обратились за услугой. На результат дается гарантия качества, потому как специалисты уверены в том, что услуга будет проведена именно так, как полагается и точно в обозначенные сроки. Среди основных услуг выделяют: химчистка ковров, диванов, матрасов, кресел, автомобилей. В работе используется только высокотехнологичное оборудование, качественная химия, которая избавляет от самых стойких пятен.
Амигуруми – это японское искусство создания игрушек с помощью подхода амигуруми. Это слово происходит от японских слов “ами”, означающего вязаный, и “нюгуруми”, что переводится как плюшевая игрушка. Традиционно амигуруми изготавливаются из пряжи с использованием крючка. Игрушки амигуруми могут представлять различных персонажей, тварей, фантастические существа и многое другое. Это популярное увлечение, которое имеет свои клубы и прихожан по всему миру.
По амигуруми существует множество картин и руководств. В этих материалах представлены шаг за шагом инструкции по созданию различных предметов амигуруми. Картинки обозначают каждый процесс процесса вязания, а обучающие программы комплектуются подробными описаниями. Такие амигуруми крючком для начинающих можно найти в онлайн, на порталах по рукоделию, в профильных сообществах и социальных платформах.
Также многие публикации по рукоделию содержат схемы и руководства по созданию амигуруми. Мастера в этой области предоставляют своим опытом и мастерством через учебники, видеоуроки и материалы.
Важно выбирать материалы, соответствующие вашему уровню практики и вкусу. Некоторые материалы направлены на новичков, предоставляя легкие инструкции и инструкции, в то время как для опытных рукодельников доступны более сложные творения и глубокие техники.
Opened up an enthralling read – I’d like to share it with you https://www.anchorofgold.com/users/cchatruletka
вывоз мусора из квартиры самара
Gogo Casino är ett populärt online casino som erbjuder sina spelare en smidig och underhållande spelupplevelse. Nu har de tagit sitt spelande till en ny nivå genom ett spännande samarbete.
Samarbetet innebär att Gogo Casino har ingått partnerskap med flera ledande spelleverantörer för att kunna erbjuda ännu fler spännande spel till sina spelare. Detta innebär att spelare nu kan njuta av ett ännu större utbud av casinospel, inklusive populära slotmaskiner, bordsspel och live casinospel.
Genom detta samarbete strävar Gogo Casino efter att tillgodose behoven hos alla typer av spelare, oavsett om de föredrar klassiska casinospel eller moderna och interaktiva spel. Genom att samarbeta med flera spelleverantörer kan Gogo Casino erbjuda sina spelare en bred variation av spel med olika teman och funktioner.
Detta samarbete kommer att gynna både Gogo Casino och dess spelare. Spelare kommer att få tillgång till ett större utbud av spel, medan Gogo Casino kommer att kunna locka till sig nya spelare och behålla sina befintliga kunder genom att erbjuda en bättre spelupplevelse.
Så om du är sugen på att testa lyckan på ett online casino med ett brett utbud av spännande spel, borde du definitivt ge Gogo Casino en chans. Med deras nya samarbete kan du vara säker på att du kommer att ha en rolig och spännande spelupplevelse. Lycka till!
https://gogocasino.one
купить больничный
Visit the page https://t.me/melbet_1xbet_betwinner_promocode where you will find new, current 1xbet Betwinner Melbet | Promo code. The latest information on promotional codes that are valid now and throughout 2024.
Амигуруми – это японское искусство создания игрушек с помощью метода амигуруми. Это слово происходит от японских слов “ами”, означающего вязаный, и “нюгуруми”, что переводится как плюшевая игрушка. Традиционно амигуруми изготавливаются из клубков с использованием крючка. Игрушки амигуруми могут демонстрировать различных персонажей, существ, вымышленные существа и многое другое. Это популярное пассия, которое имеет свои ассоциации и сторонников по всему миру.
По амигуруми существует множество рисунков и руководств. В этих материалах представлены пошаговые инструкции по созданию различных фигурок амигуруми. Картинки показывают каждый шаг процесса вязания, а обучающие программы сопровождаются детальными описаниями. Такие бесплатно амигуруми можно найти в сети Интернет, на сайтах по рукоделию, в специализированных форумах и социальных платформах.
Также многие учебники по рукоделию содержат иллюстрации и инструкции по созданию амигуруми. Мастера в этой области делятся своим опытом и навыками через книги, видеоуроки и пособия.
Важно выбирать материалы, соответствующие вашему уровню опыта и предпочтениям. Некоторые материалы адресованы начинающих, предоставляя простые инструкции и обучающие программы, в то время как опытные рукодельников доступны более продвинутые работы и детальные техники.
На сайте https://vitaminium.shop/ у вас есть возможность приобрести минеральные комплексы и витамины для всей семьи. Менеджеры компании предложат для вас самый высокий уровень сервиса, выгодные условия сотрудничества, большой ассортимент минералов и витаминов, а также компетентную консультацию. Оплата удобная, выберите товар, добавьте его в «Корзину» и оформите заказ. Доставка осуществляется в любую страну. Подробнее ознакомиться с акциями, каталогом и увидеть нашу контактную информацию, вы можете на сайте.
1SS3D249742
It is not my first time to pay a visit this web site, i am
browsing this web page dailly and take pleasant data from here every day.
Недвижимость в Болгарии от застройщика и вторичная недвижимость https://bulgarianresales.com/3418/harmoni-syuits-zhilye-kompleksy
Компания «Сомово» предлагает надежную мебель. Стремимся дать покупателям только самое лучшее. Наши спальни все продуманы до мелочей, купить можно их у нас по доступной стоимости и с быстрой доставкой. Вся без исключения продукция проходит обязательную сертификацию. Ищете спальни купить в москве? Somovo-mebel.ru – сайт, где есть возможность найти много уютных вариантов спален. Заботимся о своей репутации и качестве товаров. Делаем все, чтобы вы покупкой были довольны. Рекомендуйте нас и обращайтесь снова!
Make Real Money with Gaming Apps in Kenya
best online casino games kenya [url=https://levine.co.ke/best-online-games-that-pay-real-money-in-kenya]best online casino games kenya[/url] .
boba 😀
nice content!nice history!!
blublu
Make Real Money with Gaming Apps in Kenya
best online casino games kenya [url=https://levine.co.ke/best-online-games-that-pay-real-money-in-kenya]casino games online for real money[/url] .
Discovered an article that might catch your interest – don’t miss it! https://rst.adk.audio/company/personal/user/1577/forum/message/1488/1484/#message1484
Exciting Games with Cash Prizes in Kenya
real money online casinos [url=https://levine.co.ke/best-online-games-that-pay-real-money-in-kenya]best online casino games to win money[/url] .
1249742
качественный сервис выполняет ремонт фотоаппаратов olympus в Москве. Сотни раз обращался, все отремонтировали качественно!
Make Real Money with Gaming Apps in Kenya
real money online casinos [url=https://levine.co.ke/best-online-games-that-pay-real-money-in-kenya]best online casino games to win money[/url] .
Вы хотите приобрести увлекательные сериалы на dvd? Serialexpress вам поможет в этом. Тут можете найти диски, которых нет в иных магазинах. Качество записи сериалов отменное, мы уверены в том, что вы приобретением останетесь довольны. Товары доступны по разумной цене, они целые и хорошо упакованы. Ищете купить сериал в уфе? Serialexpress.ru – сайт, где представлен каталог. Здесь вы также можете ознакомиться с условиями оплаты. У нас действует накопительная система скидок. Качество доставки вас приятно удивит. Все вопросы можно задать менеджерам по электронной почте.
blublun
go to my blog [url=https://mixep.money]bitcoin mixer[/url]
site link [url=https://toastwallet.io/]ripple wallet[/url]
לאדירה, בין אם מדובר בפרטיות, מרחב, חשפניות, עיסוי אירוטי בדרום או כל אטרקציה אחרת. הדירה המושלמת לצרכים שלך כבר מוכנה, כל שעליך לעשות הוא למצוא אותה מבין מגוון דירות דיסקרטי דרום הקיימות באתר – ולפנות ישירות למפרסמים איפה יש דירות דיסקרטיות? כיום ניתן סקס נשים
качественный сервис выполняет ремонт электроники индукционных плит в Москве. Сотни раз обращался, все отремонтировали качественно!
לכם בילוי בדיסקרטיות מלאה בזמן ובמקום שבו אתם תבחרו. ככה מבלים היום גברים ואנשי עסקים הרוצים לשמור על הפרטיות שלהם. תודעת השירות של הבחורות מבוססת על הבנת הצרכים של הגבר והבאתו לסיפוק מלא. שירות בפריסה ארצית מחפשים נערות ליווי בתל אביב על מנת שיפנקו אתכם מכוני ליווי – לא מה שחשבת (או אולי כן?)
Зайдите на сайт Chronolux https://poljot.pro/ и ознакомьтесь с большим каталогом модных часов для каждого. В нашем ассортименте представлены современные, уникальные наручные часы от различных марок. Вы обязательно сможете подобрать часы под свой бюджет и по параметрам, а также купить ремни для часов.
הדבר יהיה אפשרי וזאת בעזרת מאמץ פשוט למדי. הרי בניגוד לעבר, בו הייתם צריכים לגשת פיזית אל סוכנות אחת ואחרת, כיום יהיה ניתן לעבור את כל ההליך המפרך מהנוחות של סלון ביתכם. כך בעצם תוכלו לבחון את שיש לכל סוכנות להציע, את נערות הליווי, המחירים והביקורות אתיופית ליווי
Opened up an enthralling read – I’d like to share it with you http://c90226sl.beget.tech/2024/04/15/besplatnye-doramy-smotrite-novye-serialy-onlajn-s-russkim-perevodom-kazhdyj-den/
качественный сервис выполняет ремонт телефонов в Москве. Сотни раз обращался, все отремонтировали качественно!
blublun
Сайт v8corp.ru предоставляет виды услуг по цифровизации и автоматизации процессов с применением программ 1С. Сотрудничая с нами, вы сфокусируетесь на своем бизнесе, мы разбираемся в 24 отраслях экономики. https://v8corp.ru/ – сайт, где можете подробнее ознакомиться с конфигурациями 1С. Тарифы у нас гибкие. Подберем для вас лучшую конфигурацию продуктов 1С, которые подходят под вашу компанию. Оцените открывающиеся преимущества облачной Аренды 1С. Готовы быть вашим надежным помощником. Получите консультацию уже сейчас, обращайтесь!
На сайте https://shemi-otopleniya.ru/ почитайте информацию, которая касается гибкой подводки, выполненной из нержавеющей стали. Есть конструкции различной модификации и размера, а потому не составит труда выбрать наиболее подходящий под ваши запросы вариант. Есть информация и о том, как правильно проводить монтаж, в каких случаях используется гибкая подводка и многое другое. Также опубликованы фотографии для большей наглядности. Вся информация является качественной, актуальной, а потому на нее можно ориентироваться.
blibliblu
lalablublu
На сайте https://concept-digital.ru вам будет предложены услуги рекламного агентства. Разрабатываем стратегию, проводим анализ рынка и увеличиваем продажи. Студия рекламы предоставляет услуги дизайнера и маркетолога. Работая с нами, вы получите 100% гарантию на положительный результат. Подробнее ознакомиться с ценами и услугами рекламного агентства вы можете на сайте. Также здесь имеется портфолио. У нас заказывают, потому, как мы обладаем приличным опытом в продажах, имеем честные цены и правильно подходим к работе.
качественный сервис выполняет ремонт электроники ресторанного оборудования в Москве. Сотни раз обращался, все отремонтировали качественно!
Discovered an interesting article, I suggest you familiarize yourself https://kavpolit.com/tech/2024/04/24/eko-taksi-novij-trend-u-kievi/
качественный сервис выполняет ремонт электроники промышленных станков чпу в Москве. Сотни раз обращался, все отремонтировали качественно!
Demo-1c.ru – сайт, где вы узнаете, кому аренда 1С будет полезна. К вашим услугам демоверсии приложений 1С. Главные достоинства применения облачного сервиса «1С Демо» и «Аренда 1С»: каждодневное резервное копирование данных, удаленное сопровождение программ «1С», также круглосуточная техническая поддержка. https://demo-1c.ru/ – сайт, где можете ознакомиться с распространенными решениями 1С перед покупкой, арендой. В нашей команде собраны исключительно проверенные временем профессионалы. Закажите грамотную консультацию прямо сейчас!
**На каком ухе мужчине носить сережку: Мифы и реальность**
Сережки для мужчин стали неотъемлемой частью мужского стиля, выражением индивидуальности и модного высказывания. Однако, один из вечных вопросов, с которым сталкиваются мужчины, решившие украсить свои уши, — на каком ухе стоит носить серьгу? Некоторые считают, что существует определенное правило, указывающее на “правильное” ухо для сережки, в то время как другие считают, что это просто суеверие или модное трендовое правило, которое можно игнорировать. Давайте разберемся в этом вопросе.
**Мифология и культурные особенности**
В различных культурах и обществах ношение сережек у мужчин имеет различные символические значения. Например, в некоторых культурах серьга в левом ухе мужчины связывается с гомосексуальной ориентацией, в то время как серьга в правом ухе может быть воспринята как признак гетеросексуальности. Однако, в современном мире эти представления могут быть устаревшими и не иметь никакого значения.
**Медицинские соображения**
Есть также утверждения о том, что выбор уха для серьги может зависеть от медицинских соображений. Например, некоторые люди предпочитают носить серьгу в ухе, находящемся дальше от места работы или занятий спортом, чтобы избежать травмирования уха.
**Индивидуальный выбор**
Сегодня большинство людей склонны считать, что выбор уха для ношения серьги — это вопрос индивидуального предпочтения и стиля. Многие мужчины выбирают ухо для серьги исходя из внешнего вида и комфорта, а не из каких-либо социальных или культурных ожиданий. Носить серьгу на том ухе, который кажется вам более подходящим или удобным, является вполне обоснованным решением.
**Заключение**
Вопрос о том, на каком ухе мужчине носить сережку, не имеет однозначного ответа. Это индивидуальный выбор, который зависит от личных предпочтений, стиля и удобства. Мифы о том, что серьга в определенном ухе может иметь определенное значение, скорее всего, утратили свою актуальность в современном обществе. Важно помнить, что самое главное — это быть уверенным в своем стиле и выражать себя так, как вам нравится, независимо от того, на каком ухе вы носите сережку.
My web site; http://www.projectbrightbook.com/index.php?title=User:KraigBenavidez3
**На каком ухе мужчине носить сережку: Мифы и реальность**
Сережки для мужчин стали неотъемлемой частью мужского стиля, выражением индивидуальности и модного высказывания. Однако, один из вечных вопросов, с которым сталкиваются мужчины, решившие украсить свои уши, — на каком ухе стоит носить серьгу? Некоторые считают, что существует определенное правило, указывающее на “правильное” ухо для сережки, в то время как другие считают, что это просто суеверие или модное трендовое правило, которое можно игнорировать. Давайте разберемся в этом вопросе.
**Мифология и культурные особенности**
В различных культурах и обществах ношение сережек у мужчин имеет различные символические значения. Например, в некоторых культурах серьга в левом ухе мужчины связывается с гомосексуальной ориентацией, в то время как серьга в правом ухе может быть воспринята как признак гетеросексуальности. Однако, в современном мире эти представления могут быть устаревшими и не иметь никакого значения.
**Медицинские соображения**
Есть также утверждения о том, что выбор уха для серьги может зависеть от медицинских соображений. Например, некоторые люди предпочитают носить серьгу в ухе, находящемся дальше от места работы или занятий спортом, чтобы избежать травмирования уха.
**Индивидуальный выбор**
Сегодня большинство людей склонны считать, что выбор уха для ношения серьги — это вопрос индивидуального предпочтения и стиля. Многие мужчины выбирают ухо для серьги исходя из внешнего вида и комфорта, а не из каких-либо социальных или культурных ожиданий. Носить серьгу на том ухе, который кажется вам более подходящим или удобным, является вполне обоснованным решением.
**Заключение**
Вопрос о том, на каком ухе мужчине носить сережку, не имеет однозначного ответа. Это индивидуальный выбор, который зависит от личных предпочтений, стиля и удобства. Мифы о том, что серьга в определенном ухе может иметь определенное значение, скорее всего, утратили свою актуальность в современном обществе. Важно помнить, что самое главное — это быть уверенным в своем стиле и выражать себя так, как вам нравится, независимо от того, на каком ухе вы носите сережку.
Feel free to visit my website: http://pedcollege.ru/question/how-to-pick-up-women-with-podobrat-sergi-dlya-muzhchin/
Understanding COSC Certification and Its Importance in Watchmaking
COSC Validation and its Rigorous Standards
Controle Officiel Suisse des Chronometres, or the Controle Officiel Suisse des Chronometres, is the authorized Swiss testing agency that verifies the accuracy and precision of wristwatches. COSC certification is a symbol of superior craftsmanship and reliability in timekeeping. Not all watch brands seek COSC certification, such as Hublot, which instead sticks to its own demanding criteria with movements like the UNICO calibre, achieving similar accuracy.
The Art of Precision Timekeeping
The core mechanism of a mechanized timepiece involves the mainspring, which supplies power as it loosens. This system, however, can be susceptible to external factors that may impact its accuracy. COSC-accredited mechanisms undergo strict testing—over 15 days in various circumstances (5 positions, 3 temperatures)—to ensure their resilience and dependability. The tests measure:
Typical daily rate precision between -4 and +6 seconds.
Mean variation, peak variation rates, and impacts of temperature changes.
Why COSC Validation Is Important
For watch aficionados and collectors, a COSC-validated watch isn’t just a piece of tech but a testament to lasting excellence and accuracy. It signifies a watch that:
Offers excellent dependability and accuracy.
Ensures guarantee of quality across the complete design of the watch.
Is probable to retain its value better, making it a smart choice.
Famous Chronometer Manufacturers
Several renowned manufacturers prioritize COSC accreditation for their timepieces, including Rolex, Omega, Breitling, and Longines, among others. Longines, for instance, provides collections like the Record and Soul, which showcase COSC-validated movements equipped with innovative substances like silicon balance springs to boost resilience and performance.
Historic Context and the Evolution of Chronometers
The concept of the chronometer originates back to the requirement for accurate timekeeping for navigation at sea, emphasized by John Harrison’s work in the 18th cent. Since the official establishment of COSC in 1973, the validation has become a yardstick for evaluating the precision of high-end timepieces, continuing a legacy of excellence in horology.
Conclusion
Owning a COSC-validated timepiece is more than an aesthetic selection; it’s a dedication to quality and precision. For those appreciating precision above all, the COSC accreditation provides peace of thoughts, guaranteeing that each validated timepiece will operate reliably under various circumstances. Whether for individual contentment or as an investment, COSC-validated watches stand out in the world of horology, maintaining on a legacy of careful timekeeping.
качественный сервис выполняет ремонт медицинского оборудования в Москве. Сотни раз обращался, все отремонтировали качественно!
find [url=https://smmpanel.one]Provider Instagram services[/url]
здесь
[url=https://e-climat.by/pvsistemy/]ПРИТОЧНО-ВЫТЯЖНЫЕ СИСТЕМЫ[/url]
יתאפשר לך לעבור לבד, לחלוק אותו עם החצי השני שלך, לחוות בו בעזרת ידיים מקצועיות או לחגוג בו עם מגוון חברים. המסיבות בדירות דיסקרטיות יכולות לכלול חשפניות או כל פעילות אחת שתהפוך את המסיבה שלך לאדירה, בין אם מדובר בפרטיות, מרחב, חשפניות, עיסוי אירוטי דירות דיסקרטיות בהדר
Discovered an article that’s sure to appeal to you – I recommend checking it out http://enriquerp.listbb.ru/viewtopic.php?f=4&t=284
線上賭場
שורפות בעורף של כולנו, ליאור סקס הוא נווה מדבר של חופש מיני אמיתי. ריכזנו עבורך באתר מגוון רחב של מודעות ונותני שירותים אשר ייקחו את החוויות שלך לקצה ויפתחו אותך לתחושות שחשבת שקיימות רק בסרטים. עכשיו זה הזמן שלך לעצור לרגע, לדמיין את הערב המושלם סקס בקריות
באמת צריכים סיבה למסיבה, אבל לפעמים אנחנו משתוקקים בכל זאת לתירוץ טוב שיאפשר לנו להיעלם לכמה שעות או לערב שלם, לבלות עם בחורה סקסית שתשכיח מאיתנו את הצרות, וליהנות כמו שצריך. בין אם התירוץ שלכם להזמין נערת ליווי הוא אירוח של לקוח חשוב, תכנון מסיבת רווקים אירוח דיסקרטי חיפה
недвижимость кипр
https://rik-estate.ru/
Our site [url=https://deltaexploits.org]delta download roblox[/url]
купить недвижимость на кипре недорого
go [url=https://evon-executor.cc]evon windows[/url]
Воєнторг
штани тактичні мультикам [url=https://voentorgklyp.kiev.ua/odyag/shtany/taktychni-shtany/]https://voentorgklyp.kiev.ua/odyag/shtany/taktychni-shtany/[/url] .
Специализированный магазин, предлагающий широкий выбор раковина для ванной без отверстия под смеситель для вашего интерьера.
Discovered an article that will surely interest you – I recommend checking it out http://power.ekafe.ru/viewtopic.php?f=2&t=1588
ולגרום לך להתרגש ולהתמלא באנרגיות חיוביות. איך מזמינים נערת ליווי בירושלים? כדי להזמין שירותי ליווי בירושלים לא צריך להתאמץ. כמו כל דבר, כיום זה נעשה דרך האינטרנט והתהליך כולו פשוט, קליל ודיסקרטי. חיפוש מהיר באינטרנט יביא לך תוצאות של מאות נשים חושניות דירות דיסקרטיות חיפה
Амигуруми – это японское искусство создания игрушек с помощью приема амигуруми. Это слово происходит от японских слов “ами”, означающего вязаный, и “нюгуруми”, что переводится как плюшевая игрушка. Традиционно амигуруми изготавливаются из клубков с использованием крючка. Игрушки амигуруми могут отображать различных персонажей, животных, фантастические существа и многое другое. Это популярное занятие, которое имеет свои клубы и сторонников по всему миру.
По амигуруми существует множество схем и мастер-классов. В этих материалах представлены пошаговые инструкции по созданию различных предметов амигуруми. Диаграммы обозначают каждый пункт процесса вязания, а уроки комплектуются полными руководствами. Такие амигуруми брелок можно найти в вебе, на порталах по рукоделию, в тематических форумах и социальных медиа.
Также многие издания по рукоделию содержат графики и уроки по созданию амигуруми. Специалисты в этой области делают доступными своим опытом и мастерством через публикации, видеоуроки и руководства.
Важно выбирать материалы, соответствующие вашему уровню навыков и интересам. Некоторые материалы направлены на начинающих, предоставляя базовые пошаговые руководства и руководства, в то время как опытные рукодельников доступны более продвинутые работы и подробные техники.
read what he said [url=https://therufus.org]Rufus[/url]
casibom
Son Dönemsel En Fazla Beğenilen Kumarhane Platformu: Casibom
Casino oyunlarını sevenlerin artık duymuş olduğu Casibom, en son dönemde adından genellikle söz ettiren bir bahis ve kumarhane platformu haline geldi. Ülkemizdeki en iyi bahis sitelerinden biri olarak tanınan Casibom’un haftalık olarak göre değişen açılış adresi, sektörde oldukça taze olmasına rağmen emin ve kazanç sağlayan bir platform olarak ön plana çıkıyor.
Casibom, yakın rekabeti olanları geride bırakarak köklü bahis web sitelerinin önüne geçmeyi başarılı oluyor. Bu alanda köklü olmak gereklidir olsa da, katılımcılarla iletişimde bulunmak ve onlara temasa geçmek da aynı kadar değerli. Bu aşamada, Casibom’un 7/24 servis veren canlı destek ekibi ile rahatlıkla iletişime ulaşılabilir olması önemli bir fayda sağlıyor.
Süratle genişleyen oyuncuların kitlesi ile dikkat çekici olan Casibom’un arkasındaki başarım faktörleri arasında, sadece ve yalnızca bahis ve gerçek zamanlı casino oyunları ile sınırlı kısıtlı olmayan geniş bir hizmetler yelpazesi bulunuyor. Atletizm bahislerinde sunduğu geniş seçenekler ve yüksek oranlar, katılımcıları çekmeyi başarılı oluyor.
Ayrıca, hem sporcular bahisleri hem de bahis oyunlar katılımcılara yönelik sunulan yüksek yüzdeli avantajlı ödüller da dikkat çekiyor. Bu nedenle, Casibom hızla piyasada iyi bir pazarlama başarısı elde ediyor ve önemli bir oyuncu kitlesi kazanıyor.
Casibom’un kar getiren bonusları ve tanınırlığı ile birlikte, platforma üyelik nasıl sağlanır sorusuna da bahsetmek elzemdir. Casibom’a mobil cihazlarınızdan, PC’lerinizden veya tabletlerinizden web tarayıcı üzerinden kolayca erişilebilir. Ayrıca, web sitesinin mobil uyumlu olması da büyük önem taşıyan bir fayda sunuyor, çünkü artık neredeyse herkesin bir akıllı telefonu var ve bu akıllı telefonlar üzerinden hızlıca erişim sağlanabiliyor.
Mobil cep telefonlarınızla bile yolda gerçek zamanlı tahminler alabilir ve yarışmaları canlı olarak izleyebilirsiniz. Ayrıca, Casibom’un mobil cihazlarla uyumlu olması, ülkemizde kumarhane ve casino gibi yerlerin meşru olarak kapatılmasıyla birlikte bu tür platformlara girişin büyük bir yolunu oluşturuyor.
Casibom’un emin bir kumarhane platformu olması da önemlidir bir avantaj sağlıyor. Ruhsatlı bir platform olan Casibom, kesintisiz bir şekilde eğlence ve kazanç elde etme imkanı sunar.
Casibom’a abone olmak da oldukça rahatlatıcıdır. Herhangi bir belge koşulu olmadan ve ücret ödemeden platforma kolaylıkla kullanıcı olabilirsiniz. Ayrıca, site üzerinde para yatırma ve çekme işlemleri için de birçok farklı yöntem mevcuttur ve herhangi bir kesim ücreti talep edilmemektedir.
Ancak, Casibom’un güncel giriş adresini takip etmek de elzemdir. Çünkü canlı bahis ve kumarhane siteleri popüler olduğu için hileli platformlar ve dolandırıcılar da ortaya çıkmaktadır. Bu nedenle, Casibom’un sosyal medya hesaplarını ve güncel giriş adresini düzenli aralıklarla kontrol etmek gereklidir.
Sonuç, Casibom hem itimat edilir hem de kar getiren bir casino platformu olarak ilgi çekici. Yüksek promosyonları, kapsamlı oyun seçenekleri ve kullanıcı dostu mobil uygulaması ile Casibom, kumarhane sevenler için ideal bir platform sunuyor.
квартиры на сутки [url=https://www.sutki24.by/]https://www.sutki24.by/[/url] .
Top Money-Making Games in Kenya
best online casino games to win money [url=https://levine.co.ke/best-online-games-that-pay-real-money-in-kenya]real money online casinos[/url] .
[url=https://gamer-torrent.ru/download/pc/action/gta_6/1-1-0-464]GTA 6 обзор игры[/url] – бесплатный чит Arma 3, THE DAY BEFORE игра скачать торрент
Best Games to Win Money in Kenya
best online casino games kenya [url=https://levine.co.ke/best-online-games-that-pay-real-money-in-kenya]casino games online for real money[/url] .
Воєнторг
2. Широкий ассортимент военной экипировки
зимова куртка хелікон [url=https://voentorgklyp.kiev.ua/odyag/kurtky/kurtky-helikon-tex/]зимова куртка хелікон[/url] .
[url=https://diplom.ua/ru/]написание дипломных работ[/url] – заказать курсовую работу, купить курсовую работу киев
Make Money Playing Games in Kenya
best online casino games kenya [url=https://levine.co.ke/best-online-games-that-pay-real-money-in-kenya]games that pay real money in kenya[/url] .
מבוגרות, אתיופיות או רוסיות גם אירופאיות הזמנת נערות ליווי באזורך באופן שיבטיח איכות דורשת מיומנות של הימנעות מבעיות אלה. הבעיות הללו עשויות לגרום ללא מעט ועגמת נפש לכם כלקוחות, ולכן חשוב לברר כמה עולה לשכור חדר ללילה מלא, וכמה עולה שעה. במידה ויש לכם מקום סקס נערת ליווי לאחר הגירושין
Амигуруми – это японское искусство создания игрушек с помощью способа амигуруми. Это слово происходит от японских слов “ами”, означающего вязаный, и “нюгуруми”, что переводится как плюшевая игрушка. Традиционно амигуруми изготавливаются из ниток с использованием крючка. Игрушки амигуруми могут представлять различных персонажей, зверей, вымышленные существа и многое другое. Это популярное занятие, которое имеет свои группы и любителей по всему миру.
По амигуруми существует множество рисунков и уроков. В этих материалах представлены шаг за шагом инструкции по созданию различных моделей амигуруми. Картинки представляют каждый пункт процесса вязания, а руководства дополняются развернутыми разъяснениями. Такие амигуруми связанные крючком можно найти в интернете, на сайтах по рукоделию, в специализированных форумах и социальных сетях.
Также многие руководства по рукоделию содержат диаграммы и уроки по созданию амигуруми. Профессионалы в этой области раскрывают своим опытом и умениями через руководства, видеоуроки и инструкции.
Важно выбирать материалы, соответствующие вашему уровню умений и предпочтениям. Некоторые материалы предназначены для начинающих, предоставляя начальные инструкции и мастер-классы, в то время как для опытных рукодельников доступны более трудоемкие творческие работы и интенсивные техники.
Воєнторг
17. Наборы для выживания и первой помощи
купити штани тактичні [url=https://voentorgklyp.kiev.ua/odyag/shtany/taktychni-shtany/]купити штани тактичні[/url] .
[url=https://diplom.ua/ru/]с чего начать написание курсовой работы[/url] – зразок написання курсової роботи, написання курсових робіт на замовлення
[url=https://hyper.hosting/]впс сервера[/url] – арендовать удаленный сервер, аренда vps сервера в россии
Возможности казино онлайн
Как обыграть автоматы в казино
[url=http://mavlad.ru/bitrix/rk.php?goto=https://spgk.kz/]онлайн казино казахстан[/url]
[url=https://gamer-torrent.ru/]топ игр 2024[/url] – GTA 6 обзор игры, THE DAY BEFORE игра на ПК
blibli
ссылка на сайт [url=https://phoenixtravel.md/search/]Поиск туров[/url]
see [url=https://galaxyswapper.xyz/]galaxy swapper v2 download[/url]
[url=https://opt24.store/product-category/sousy/]соусы Хайнз оптом[/url] – шоколадная паста Милки Вей, снеки Cheetos оптом
[url=https://omyguide.site/category/europe/andorra/]Best Restaurants in Andorra[/url] – The Best Attractions in Norway, Top Places to Visit in Israel
When someone writes an post he/she keeps the thought of a user in his/her brain that how a user can understand it.
Thus that’s why this post is outstdanding. Thanks!
Stumbled upon a unique article, I suggest you take a look http://crewties.moibb.ru/viewtopic.php?f=2&t=292
[url=https://kraken4vtor.com/]kraken onion[/url] – kraken onion, kraken tor ссылка
[url=https://kraken222.com/]kraken darknet market[/url] – кракен площадка ссылка, кракен сайт зеркало
[url=https://xn--90ascrfejh9f.org/]blacksprut[/url] – http blacksprut, blacksprut вход
Как выбрать надежное онлайн казино
[url=http://jitsys.ru/bitrix/rk.php?goto=https://spgk.kz/]олимп казино[/url]
blublun
Как обыграть казино и заработать миллионы
[url=http://alloplus.by/bitrix/redirect.php?goto=https://spgk.kz/]olimpbet casino[/url]
blolbo
להזמין לעצמו את נערת הליווי שהוא חושק בה מבלי להיקלע לקושי כלכלי. נכון שמתחשק לכם לבלות עם בחורות סקסיות שינעימו את זמנכם? אבל מה עושים כאשר אין לכם דירה פרטית משלכם, או שאינכם רוצים לעשות זאת בבית מלון? אין שום בעיה – פורטל הסקס כיופים מעמיד לרשותכם נערת ליווי פרטית בירושלים או בילוי עם בחורה נשית לסקס מושלם
로드스탁과 레버리지 방식의 스탁: 투자법의 참신한 지평
로드스탁에서 제공되는 레버리지 방식의 스탁은 증권 투자의 한 방식으로, 큰 이익율을 목표로 하는 투자자들을 위해 매혹적인 옵션입니다. 레버리지 사용을 사용하는 이 전략은 투자자가 자신의 자본을 초과하는 금액을 투입할 수 있도록 함으로써, 증권 시장에서 더욱 큰 힘을 가질 수 있는 기회를 공급합니다.
레버리지 방식의 스탁의 기본 원칙
레버리지 방식의 스탁은 일반적으로 자금을 대여하여 투자하는 방법입니다. 사례를 들어, 100만 원의 자금으로 1,000만 원 상당의 주식을 사들일 수 있는데, 이는 투자자가 기본적인 자본보다 훨씬 훨씬 더 많은 주식을 구매하여, 주식 가격이 상승할 경우 해당하는 더 큰 수익을 가져올 수 있게 해줍니다. 그렇지만, 주식 값이 떨어질 경우에는 그 손실 또한 증가할 수 있으므로, 레버리지 사용을 사용할 때는 신중하게 생각해야 합니다.
투자 계획과 레버리지 사용
레버리지는 특히 성장 잠재력이 높은 사업체에 투입할 때 유용합니다. 이러한 사업체에 높은 비율을 통해 투자하면, 잘 될 경우 큰 이익을 가져올 수 있지만, 반대 경우의 경우 큰 위험성도 감수하게 됩니다. 그러므로, 투자자들은 자신의 위험 관리 능력을 가진 장터 분석을 통해 통해, 어느 사업체에 얼마만큼의 투자금을 투자할지 결정해야 합니다.
레버리지 사용의 이점과 위험 요소
레버리지 방식의 스탁은 높은 수익을 제공하지만, 그만큼 상당한 위험도 동반합니다. 주식 시장의 변화는 추정이 어렵기 때문에, 레버리지를 이용할 때는 늘 시장 동향을 세심하게 주시하고, 손해를 최소화할 수 있는 계획을 세워야 합니다.
최종적으로: 조심스러운 결정이 요구됩니다
로드스탁에서 제공된 레버리지 스탁은 막강한 투자 도구이며, 잘 활용하면 큰 수입을 벌어들일 수 있습니다. 하지만 높은 리스크도 신경 써야 하며, 투자 선택은 충분히 많은 사실과 신중한 판단 후에 진행되어야 합니다. 투자하는 사람의 재정 상황, 위험을 감수하는 능력, 그리고 시장 상황을 생각한 안정된 투자 계획이 중요합니다.
Stumbled upon a unique article, I suggest you take a look https://www.liveinternet.ru/users/worksale/post504768343/
Discovered an article that might interest you – don’t miss it! https://boxerfriend.mybb.ru/viewtopic.php?id=3264#p45526
https://winline-app-bk.ru/
Специализированный магазин, предлагающий большой ассортимент раковины laufen val для вашего интерьера.
Stanford is a world-renowned university that accepts new students https://assignmentcalculator.stanford.edu/ Stanford also provides free tuition for the less fortunate
Found an article that is worth reading – it’s really interesting! http://sheriffstation.bestbb.ru/viewtopic.php?id=372#p397
Привет!
Мы постоянно следим за новостями и выбираем самые важные и интересные события для вас. Наши обзоры позволяют вам быстро и удобно узнать о ключевых событиях и их последствиях, чтобы быть в курсе текущей ситуации.
Все самое лучшее на сайте https://smi.in.ua/medicina/
[url=https://smi.in.ua/medicina/]новости медицины[/url]
последние новости Украины
новости Украины сегодня
дтп видео
Удачи!
Get More Information [url=https://tronlink.cash]forgot tronlink password[/url]
Амигуруми – это японское искусство создания игрушек с помощью подхода амигуруми. Это слово происходит от японских слов “ами”, означающего вязаный, и “нюгуруми”, что переводится как плюшевая игрушка. Традиционно амигуруми изготавливаются из шерсти с использованием крючка. Игрушки амигуруми могут демонстрировать различных персонажей, тварей, вымышленные существа и многое другое. Это популярное хобби, которое имеет свои объединения и фанатов по всему миру.
По амигуруми существует множество рисунков и руководств. В этих материалах представлены пошаговые инструкции по созданию различных моделей амигуруми. Схемы показывают каждый шаг процесса вязания, а мастер-классы сопровождаются полными инструкциями. Такие амигуруми пошагово можно найти в онлайн, на сайтах по рукоделию, в ресурсных группах и социальных медиа.
Также многие руководства по рукоделию содержат схемы и уроки по созданию амигуруми. Профессионалы в этой области делятся своим опытом и мастерством через учебники, видеоуроки и мануалы.
Важно выбирать материалы, соответствующие вашему уровню опыта и предпочтениям. Некоторые материалы адресованы новичков, предоставляя начальные пошаговые руководства и инструкции, в то время как для более опытных рукодельников доступны более трудоемкие проекты и глубокие техники.
Zet Casino zahlt nicht aus: Was tun, wenn Gewinne nicht ausgezahlt werden?
Immer wieder hört man von Spielern, die Probleme haben, ihre Gewinne von Online-Casinos ausgezahlt zu bekommen. Eines der Casinos, über das in letzter Zeit vermehrt beschwert wird, ist das Zet Casino. Spieler berichten, dass sie Schwierigkeiten haben, ihre Gewinne zu erhalten und dass der Kundenservice des Casinos keine zufriedenstellende Lösung bietet.
Doch was können Spieler tun, wenn das Zet Casino nicht auszahlt? Zunächst sollten sie sicherstellen, dass sie alle Bonusbedingungen und Umsatzbedingungen des Casinos erfüllt haben. Oftmals können Gewinne nicht ausgezahlt werden, weil Spieler gegen die Bedingungen verstoßen haben. Falls dies nicht der Fall ist, sollten Spieler den Kundenservice kontaktieren und ihr Anliegen schildern. Oftmals kann eine direkte Kommunikation mit dem Casino helfen, das Problem zu lösen.
Falls auch das keinen Erfolg bringt, können Spieler sich an unabhängige Schlichtungsstellen wie eCOGRA oder die Malta Gaming Authority wenden. Diese Organisationen können dabei helfen, Streitigkeiten zwischen Spielern und Casinos zu lösen und eine faire Lösung zu finden.
Es ist wichtig, dass Spieler, die Probleme mit Auszahlungen bei Online-Casinos haben, nicht aufgeben und ihre Rechte als Kunde verteidigen. Auch wenn es Г¤rgerlich ist, wenn Gewinne nicht ausgezahlt werden, sollten Spieler immer darauf bestehen, dass ihr Geld fair und korrekt behandelt wird.
Insgesamt ist es daher ratsam, vorsichtig zu handeln und sich genau zu informieren, bevor man in einem Online-Casino wie dem Zet Casino spielt. Durch die Einhaltung der Regeln und die Kontaktaufnahme mit den richtigen Stellen können Spieler sicherstellen, dass sie im Falle von Problemen angemessen unterstützt werden.
https://zetcasino.one/
подробнее https://battlepass.ru
займы под бизнес
[url=https://bs2site.art]рабочая ссылка на blacksprut[/url] – bs.gl, blacksprut com
[url=https://mega555za3dcionline.com/]мега[/url] – mega ссылка, мега ссылка
Um an sein Tipico Sixpack Casino Guthaben zu gelangen, gibt es mehrere Möglichkeiten. Zunächst ist es wichtig, dass man ein Konto bei Tipico erstellt hat und dieses auch verifiziert wurde. Erst dann kann man sein Guthaben nutzen und seine Gewinne auszahlen lassen.
Um sein Guthaben aufzuladen, bietet Tipico verschiedene Zahlungsmethoden an, wie zum Beispiel Kreditkarte, Banküberweisung, Paysafecard oder PayPal. Nachdem man die gewünschte Zahlungsmethode ausgewählt hat, kann man den Betrag eingeben, den man einzahlen möchte. Das Guthaben wird dann umgehend auf das Konto gutgeschrieben und man kann sofort mit dem Spielen loslegen.
Um sein Guthaben auszahlen zu lassen, muss man sich zunächst in sein Tipico Konto einloggen und den Auszahlungsbetrag angeben. Es kann sein, dass Tipico im Rahmen der Sicherheitsmaßnahmen zusätzliche Unterlagen zur Verifizierung anfordert. Sobald alle erforderlichen Informationen vorliegen, wird das Guthaben umgehend auf das angegebene Konto überwiesen.
Es ist wichtig zu beachten, dass man sein Guthaben nur auf ein Konto auszahlen lassen kann, welches auf den eigenen Namen registriert ist. Zudem können Auszahlungen je nach Zahlungsmethode und Bankinstitut unterschiedlich lange dauern. In der Regel sollte das Guthaben jedoch innerhalb weniger Werktage auf dem Konto erscheinen.
Insgesamt ist es also relativ einfach, an sein Tipico Sixpack Casino Guthaben zu gelangen. Durch die vielfältigen Zahlungsmethoden und den unkomplizierten Auszahlungsprozess kann man sein Guthaben schnell und einfach verwalten. Egal ob man sein Guthaben aufladen oder auszahlen lassen möchte, Tipico stellt die nötigen Tools zur Verfügung, um dies in nur wenigen Schritten zu erledigen.
https://tipicocasino.one/
I strongly recommend to avoid this platform. My own encounter with it was nothing but disappointment and concerns regarding scamming practices. Exercise extreme caution, or better yet, find an honest platform to meet your needs.I urge you steer clear of this site. My own encounter with it was purely disappointment as well as suspicion of deceptive behavior. Proceed with extreme caution, or better yet, look for a trustworthy platform for your needs.
Специализированный магазин, предлагающий широкий выбор раковина на стиральную машину 60х50 для вашего интерьера.
кодирование https://someblog.ru/
Das Zet Casino ist bei vielen Spielern beliebt, die gerne Online-Casino-Spiele spielen. Doch kГјrzlich haben einige Benutzer Berichte darГјber gemacht, dass sie ihr Auszahlungslimit im Casino erreicht haben.
Ein Auszahlungslimit wird von Casinos festgelegt, um sicherzustellen, dass Spieler nicht zu viel Geld auf einmal abheben können. Dies dient dazu, sowohl die Spieler als auch das Casino selbst vor Betrug zu schützen. Wenn ein Spieler sein Auszahlungslimit erreicht hat, kann er keine weiteren Auszahlungen tätigen, bis das Limit zurückgesetzt wird.
Es ist wichtig, sich über die Auszahlungslimits eines Casinos zu informieren, bevor man mit dem Spielen beginnt. Die Limits können je nach Casino variieren und können von Zeit zu Zeit geändert werden. Spieler sollten sich bewusst sein, dass sie ihr Limit erreichen können und möglicherweise warten müssen, bis es zurückgesetzt wird.
Wenn ein Spieler sein Auszahlungslimit im Zet Casino erreicht hat, kann er sich an den Kundenservice des Casinos wenden, um weitere Informationen zu erhalten. Es ist wichtig, geduldig zu sein und die Richtlinien des Casinos zu respektieren.
Insgesamt ist es wichtig, verantwortungsbewusst zu spielen und sich Гјber die Auszahlungslimits eines Casinos im Klaren zu sein. Spieler sollten ihr Spielverhalten im Auge behalten und wissen, wann es Zeit ist, eine Pause einzulegen.
https://zetcasino.one/
Интернет-ресурс, где можно купить современные ретро раковина для ванной от ведущих производителей.
Сайт, где представлен широкий выбор раковина асимметричная для вашей ванной комнаты, с доставкой по всей стране.
I strongly recommend to avoid this platform. My own encounter with it has been nothing but frustration along with suspicion of scamming practices. Exercise extreme caution, or better yet, look for an honest service for your needs.I highly advise stay away from this platform. The experience I had with it was nothing but disappointment as well as suspicion of fraudulent activities. Be extremely cautious, or better yet, look for a trustworthy service to meet your needs.
casino con bono de bienvenida sin deposito [url=http://sin-deposito-peru.org/]http://sin-deposito-peru.org/[/url] .
Bei Tipico Casino gibt es eine Vielzahl von verschiedenen Kategorien, aus denen die Spieler wählen können. Eine der beliebtesten Kategorien ist die der Slots, auch Spielautomaten genannt. Diese Kategorie bietet eine Vielzahl von unterschiedlichen Spielen, von klassischen Früchteslots bis hin zu modernen Video-Slots mit aufregenden Bonusspielen und grafisch beeindruckenden Animationen.
Eine weitere beliebte Kategorie bei Tipico Casino ist die der Tischspiele. Hier finden die Spieler eine groГџe Auswahl an klassischen Casino-Spielen wie Blackjack, Roulette, Poker und Baccarat. Diese Spiele sind bekannt fГјr ihre anspruchsvolle Strategie und ihren Nervenkitzel.
Auch die Kategorie der Live-Casinospiele erfreut sich großer Beliebtheit bei den Spielern. Hier können sie gegen echte Dealer und andere Spieler antreten und das Casino-Erlebnis direkt von zu Hause aus genießen. Die Live-Casinospiele bieten eine authentische Casino-Atmosphäre und sorgen für ein interaktives Spielerlebnis.
Zusätzlich zu diesen Kategorien bietet Tipico Casino auch eine Auswahl an Jackpot-Spielen, bei denen die Spieler die Chance haben, riesige Gewinne zu erzielen. Diese Spiele sind besonders beliebt bei Spielern, die auf der Suche nach dem ganz großen Gewinn sind.
Insgesamt bietet Tipico Casino eine breite Auswahl an verschiedenen Kategorien, die für jeden Spieler etwas Passendes bereithalten. Egal ob man lieber an Spielautomaten, Tischspielen oder Live-Casinospiele spielt, hier findet jeder das Richtige für sich. Mit der hochwertigen Spieleauswahl und der benutzerfreundlichen Benutzeroberfläche bietet das Tipico Casino ein erstklassiges Spielerlebnis für Casino-Fans.
https://tipicocasino.one/
лечение алкоголизма алматы https://krasnodar-narkolog.ru/
Backlinks seo
Effective Hyperlinks in Weblogs and Remarks: Enhance Your SEO
Backlinks are vital for improving search engine rankings and raising site visibility. By integrating backlinks into blogs and remarks prudently, they can considerably enhance traffic and SEO efficiency.
Adhering to Search Engine Algorithms
Today’s backlink placement strategies are finely tuned to align with search engine algorithms, which now prioritize link good quality and relevance. This guarantees that links are not just abundant but meaningful, directing end users to helpful and relevant articles. Website owners should concentrate on integrating backlinks that are contextually suitable and enhance the overall content material good quality.
Rewards of Making use of Clean Donor Bases
Using up-to-date contributor bases for links, like those handled by Alex, offers significant rewards. These bases are regularly refreshed and consist of unmoderated websites that don’t attract complaints, ensuring the links positioned are both powerful and certified. This strategy helps in keeping the efficacy of links without the dangers linked with moderated or problematic resources.
Only Approved Resources
All donor sites used are sanctioned, avoiding legal pitfalls and sticking to digital marketing requirements. This commitment to utilizing only authorized resources ensures that each backlink is legitimate and trustworthy, thus building trustworthiness and reliability in your digital existence.
SEO Impact
Skillfully placed backlinks in blogs and comments provide over just SEO benefits—they enhance user experience by connecting to relevant and high-quality content. This technique not only fulfills search engine criteria but also engages consumers, leading to much better traffic and enhanced online engagement.
In essence, the right backlink technique, especially one that utilizes clean and trustworthy donor bases like Alex’s, can transform your SEO efforts. By concentrating on quality over amount and adhering to the most recent requirements, you can guarantee your backlinks are both powerful and productive.
Лучшие казино мира и их особенности
Как заработать на игре в казино
[url=http://visokiybereg.ru/bitrix/rk.php?goto=https://spgk.kz/]олимп казино[/url]
Секреты успешной игры в казино
[url=https://cse.google.dm/url?q=https://spgk.kz/]олимп казино[/url]
Das Tipico Casino ist eine beliebte Online-Glücksspielplattform, die eine Vielzahl von Spielen für Spieler aus aller Welt anbietet. Trotz seiner Popularität kann es jedoch auch Probleme geben, die Spieler frustrieren und ihre Erfahrung beeinträchtigen können.
Ein häufiges Problem, das Spieler beim Tipico Casino erleben, sind technische Schwierigkeiten. Dies kann sich auf langsame Ladezeiten, Verbindungsabbrüche oder sogar Spieleabstürze auswirken. Diese Probleme können dazu führen, dass Spieler ihre Einsätze verlieren oder ihre Gewinne nicht ausgezahlt werden.
Ein weiteres häufiges Problem im Tipico Casino sind Auszahlungsprobleme. Einige Spieler berichten, dass ihre Auszahlungen verzögert werden oder dass sie Schwierigkeiten haben, ihr Geld abzuheben. Dies kann frustrierend sein und das Vertrauen der Spieler in die Plattform beeinträchtigen.
DarГјber hinaus gibt es auch Beschwerden Гјber den Kundenservice des Tipico Casinos. Einige Spieler berichten, dass sie Schwierigkeiten haben, Antworten auf ihre Fragen zu erhalten oder dass ihre Anliegen nicht angemessen behandelt werden. Eine schlechte Kundenbetreuung kann dazu fГјhren, dass Spieler sich unwohl fГјhlen und das GefГјhl haben, nicht gut unterstГјtzt zu werden.
Um diese Probleme zu vermeiden oder zu lösen, ist es wichtig, dass das Tipico Casino auf die Bedürfnisse und Anliegen seiner Spieler eingeht. Dies könnte die Verbesserung der technischen Infrastruktur, die Beschleunigung von Auszahlungen und die Schulung des Kundenservicepersonals umfassen.
Insgesamt ist das Tipico Casino eine beliebte GlГјcksspielplattform, die jedoch auch mit einigen Problemen konfrontiert sein kann. Durch die Behebung dieser Probleme und die Verbesserung der Spielerfahrung kann das Tipico Casino weiterhin eine attraktive Option fГјr GlГјcksspieler auf der ganzen Welt bleiben.
https://tipicocasino.one/
Возможности казино онлайн
Как обыграть автоматы в казино
[url=https://toolbarqueries.google.com.pg/url?q=https://spgk.kz/]казино олимп[/url]
Pretty! This was an incredibly wonderful article. Thanks for providing this info.
Доброго всем дня!
dlplomanrussian.com
Zet Casino seriös: Ist dieses Online-Casino vertrauenswürdig?
In den letzten Jahren haben Online-Casinos immer mehr an Beliebtheit gewonnen, da sie bequem von zu Hause aus gespielt werden können. Doch die Frage nach der Seriosität eines Online-Casinos ist für viele Spieler ein wichtiges Kriterium bei der Auswahl eines Anbieters. In diesem Artikel werfen wir einen Blick auf das Zet Casino und klären, ob es vertrauenswürdig ist.
Das Zet Casino ist ein relativ neuer Spieler auf dem Markt und wurde im Jahr 2018 gegründet. Das Casino verfügt über eine Lizenz der Malta Gaming Authority, einer der renommiertesten Glücksspielbehörden der Welt. Diese Lizenzierung garantiert, dass das Zet Casino bestimmte Standards erfüllt und fair und sicher ist. Darüber hinaus unterliegt das Casino regelmäßigen Überprüfungen und Kontrollen, um sicherzustellen, dass die gesetzlichen Anforderungen erfüllt werden.
Ein weiterer Indikator fГјr die SeriositГ¤t eines Online-Casinos ist das Spieleangebot. Das Zet Casino bietet eine groГџe Auswahl an Spielen von bekannten und renommierten Spieleentwicklern wie NetEnt, Microgaming und Play’n GO. Die Spiele werden regelmäßig auf Fairness und ZufГ¤lligkeit geprГјft, um sicherzustellen, dass die Spieler eine faire Gewinnchance haben.
Darüber hinaus bietet das Zet Casino verschiedene sichere Zahlungsmethoden an, um Ein- und Auszahlungen schnell und unkompliziert abwickeln zu können. Zu den angebotenen Zahlungsmethoden gehören unter anderem Kreditkarten, E-Wallets und Banküberweisungen. Die Transaktionen sind verschlüsselt und somit vor unbefugtem Zugriff geschützt.
Zusammenfassend lässt sich sagen, dass das Zet Casino seriös ist und den Spielern ein sicheres und faires Spielerlebnis bietet. Die Lizenzierung durch die Malta Gaming Authority, das Spieleangebot renommierter Entwickler und die sicheren Zahlungsmethoden sind Indizien für die Vertrauenswürdigkeit des Casinos. Spieler sollten jedoch immer darauf achten, verantwortungsvoll zu spielen und ihr Spielverhalten im Blick zu behalten.
https://zetcasino.one/
Онлайн казино Беларусь: ваш путь к финансовой независимости и азартному удовольствию
онлайн казино Беларусь [url=https://sayokay.by/]лучшие онлайн казино в Беларуси[/url] .
Отличный выбор игр в онлайн казино Беларусь для всех любителей азарта
онлайн казино Беларусь [url=https://sayokay.by/]лучшие онлайн казино в Беларуси[/url] .
try this web-site [url=https://mixep.money]bitcoin cleaner[/url]
Доброго!
Черная пятница на Украине в 2024 году – время для выгодных покупок и приятных сюрпризов! Узнайте дату проведения и подготовьтесь к шопингу заранее, чтобы не упустить лучшие предложения.
[url=https://crazysale.marketing/black-friday.html]чорна пятниця[/url]
[url=https://crazysale.marketing/black-friday.html]коли чорна п’ятниця[/url]
чорна пятниця
чорная пятница
xjhyf gznybwz
Удачи!
Found captivating reading that I’d like to offer you – you won’t regret it http://sciencenewhop.maxbb.ru/viewtopic.php?f=44&t=626
[url=https://kraken13t.com/]как зайти на kraken[/url] – вход на кракен, kraken market ссылка
Freispiele sind eine beliebte Möglichkeit, um im Tipico Casino zusätzliche Gewinne zu erzielen. Diese kostenlosen Spielrunden können auf verschiedene Arten erhalten werden und bieten den Spielern die Chance, ohne eigenen Einsatz echtes Geld zu gewinnen.
Es gibt verschiedene Möglichkeiten, um Freispiele im Tipico Casino zu erhalten. Eine der bekanntesten ist der Willkommensbonus für neue Spieler. Bei der Registrierung und ersten Einzahlung erhalten Spieler oft eine bestimmte Anzahl an Freispielen für ausgewählte Spielautomaten. Diese können dann genutzt werden, um kostenlos zu spielen und dabei möglicherweise Gewinne zu erzielen.
Aber auch Bestandskunden werden im Tipico Casino regelmäßig mit Freispielen belohnt. Diese können beispielsweise im Rahmen von Sonderaktionen, Turnieren oder als Belohnung für treue Spieler vergeben werden. Auch das Spielen bestimmter Spiele oder das Erreichen bestimmter Ziele kann zu Freispielen führen.
Für die Nutzung von Freispielen gelten in der Regel bestimmte Bedingungen, die vom Casino festgelegt werden. Zum Beispiel müssen die Gewinne aus Freispielen oft mehrfach umgesetzt werden, bevor sie ausgezahlt werden können. Es ist daher wichtig, die jeweiligen Bonusbedingungen zu beachten, um keine bösen Überraschungen zu erleben.
Insgesamt bieten Freispiele im Tipico Casino eine spannende Möglichkeit, um zusätzliche Gewinne zu erzielen und das Spielerlebnis noch aufregender zu gestalten. Durch regelmäßige Aktionen und Angebote haben die Spieler die Chance, immer wieder von Freispielen zu profitieren und ihr Glück auf die Probe zu stellen.
https://tipicocasino.one/
Stumbled upon a unique article, I suggest you take a look http://infiniterealities.listbb.ru/viewtopic.php?f=7&t=292
[url=https://t.me/zdoroviysposib]трулисити аналоги[/url] – Оземпик красный аптеки, оземпик пропал
click here now [url=https://smmpanel.one]Twitter Provider[/url]
investigate this site [url=https://toastwallet.io/]toast crypto wallet[/url]
Отличный выбор игр в онлайн казино Беларусь для всех любителей азарта
онлайн казино Беларусь [url=https://sayokay.by/]онлайн казино Беларусь[/url] .
Где закодироваться в Алматы https://alcoholismcoding.kz/
Your articles have been a valuable creator of information on this keynote, sparking various provocative ideas. Thank you in compensation sharing such insightful content!
https://sites.google.com/view/mazyagames/
Tipico Casino Bonus freispielen: So geht’s!
Der Tipico Casino Bonus ist ein attraktives Angebot für alle Spieler, die gerne im Online Casino spielen. Doch um den Bonus freizuspielen, müssen bestimmte Bedingungen erfüllt werden. In diesem Artikel erklären wir, wie das genau funktioniert.
Zunächst einmal muss man sich als neuer Spieler bei Tipico registrieren und eine Einzahlung tätigen, um den Casino Bonus zu erhalten. Je nach Angebot kann es sich um einen Einzahlungsbonus, Freispiele oder andere Boni handeln. Sobald der Bonus gutgeschrieben wurde, gilt es, ihn freizuspielen.
Um den Tipico Casino Bonus freizuspielen, muss man den Bonusbetrag eine bestimmte Anzahl von Malen umsetzen. Diese Umsatzbedingungen variieren je nach Angebot und mГјssen innerhalb eines bestimmten Zeitraums erfГјllt werden. Es ist wichtig, die genauen Bedingungen im Auge zu behalten, um den Bonus erfolgreich freizuspielen.
Es gibt verschiedene Spiele im Tipico Casino, die zum Freispielen des Bonus beitragen. Slots tragen in der Regel zu 100% zur Erfüllung der Umsatzbedingungen bei, während Tischspiele wie Roulette und Blackjack oft nur zu einem gewissen Prozentsatz gewertet werden. Es ist wichtig, sich vorab über die Spiele zu informieren, die zum Freispielen des Bonus beitragen.
Zusammenfassend lässt sich sagen, dass der Tipico Casino Bonus ein attraktives Angebot für Spieler darstellt, die gerne im Online Casino spielen. Um den Bonus erfolgreich freizuspielen, ist es wichtig, die Umsatzbedingungen und Spiele genau zu kennen und zu beachten. Mit etwas Glück und Geschick kann man den Bonus in einen ordentlichen Gewinn umwandeln und sich über zusätzliches Spielgeld freuen.
https://tipicocasino.one/
https://vivod-iz-zapoya-dom.ru/
[url=https://t.me/ozempic_pokupka_prodaja]трулисити инструкция +по применению[/url] – оземпик купить +в минске, тирзепатид купить +в москве
kantorbola77
Kantorbola situs slot online terbaik 2024 , segera daftar di situs kantor bola dan dapatkan promo terbaik bonus deposit harian 100 ribu , bonus rollingan 1% dan bonus cashback mingguan . Kunjungi juga link alternatif kami di kantorbola77 , kantorbola88 dan kantorbola99
Побеждайте вместе с друзьями в онлайн казино Беларусь на платформе с высокими оценками
онлайн казино Беларусь [url=https://sayokay.by/]лучшие онлайн казино в Беларуси[/url] .
Играйте в онлайн казино Беларусь и выигрывайте крупные суммы на свой счет
онлайн казино Беларусь [url=https://sayokay.by/]лучшие онлайн казино в Беларуси[/url] .
[url=https://t.me/zdoroviysposib]mounjaro купить +в белоруссии[/url] – семаглутид таблетки инструкция +по применению цена отзывы, аналог оземпика российский
[url=https://t.me/ozempic_pokupka_prodaja]уколы ozempic[/url] – tirzepatide, где можно купить оземпик
Wenn Sie versuchen, im Tipico Casino neu anzumelden und es funktioniert nicht, kann dies frustrierend sein. Es gibt jedoch verschiedene mögliche Gründe, warum dies passieren könnte.
Zunächst einmal könnte es sein, dass Probleme mit Ihrem Gerät vorliegen. Stellen Sie sicher, dass Sie eine stabile Internetverbindung haben und dass Ihr Gerät auf dem neuesten Stand ist. Es könnte auch helfen, den Cache und die Cookies Ihres Browsers zu löschen, um eventuelle technische Probleme zu beheben.
Ein weiterer Grund könnte sein, dass es möglicherweise eine temporäre Störung auf der Website gibt. In diesem Fall könnte es helfen, etwas zu warten und es zu einem späteren Zeitpunkt erneut zu versuchen.
Es ist auch möglich, dass es Probleme mit Ihren Anmeldedaten gibt. Stellen Sie sicher, dass Sie Ihre E-Mail-Adresse und Ihr Passwort korrekt eingeben und dass Sie kein Tippfehler vorliegt.
Wenn trotz allem das Problem weiterhin besteht, empfehle ich Ihnen, den Kundendienst von Tipico zu kontaktieren. Sie können Ihnen möglicherweise weiterhelfen und das Problem schnell lösen.
Insgesamt ist es wichtig, geduldig zu bleiben und verschiedene Lösungsansätze auszuprobieren, wenn Sie Probleme mit dem Anmelden im Tipico Casino haben. Mit etwas Glück können Sie bald wieder problemlos spielen und genießen.
https://tipicocasino.one/
Enigma Pro Scam
кредит ип под развитие бизнеса
blabla
Проверка кошельков кошельков на выявление наличия незаконных средств передвижения: Защита вашего электронного портфельчика
В мире цифровых валют становится все значимее важнее соблюдать безопасность личных финансовых активов. Постоянно жулики и криминальные элементы выработывают свежие схемы обмана и мошенничества и угонов цифровых денег. Один из существенных инструментов защиты становится анализ кошельков на присутствие незаконных средств.
По какой причине вот важно осмотреть личные электронные кошельки для хранения электронных денег?
В первую очередь, вот этот момент нужно для защиты личных финансовых средств. Многие пользователи находятся в зоне риска утраты своих средств из-за непорядочных подходов или воровства. Проверка кошелька помогает выявить вовремя сомнительные действия и предотвратить возможные убытки.
Что предлагает фирма?
Мы предоставляем сервис проверки кошельков цифровых кошельков и переводов средств с задачей выявления места происхождения средств и выдачи подробного отчета. Наши платформа анализирует данные для определения незаконных операций средств и определить уровень риска для того чтобы своего портфеля. Благодаря нашей проверке, вы будете в состоянии избежать с органами контроля и обезопасить себя от непреднамеренного вовлечения в незаконных операций.
Как осуществляется процесс?
Наши компания имеет дело с известными аудиторскими агентствами, как например Cure53, чтобы обеспечить и адекватность наших анализов. Мы внедряем современные и методики анализа для обнаружения небезопасных операций. Данные пользователей наших заказчиков обрабатываются и хранятся в соответствии высокими стандартами безопасности.
Важный запрос: “проверить свои USDT на чистоту”
Если вы хотите убедиться надежности ваших кошельков USDT, наши профессионалы оказывает возможность бесплатную проверку наших специалистов первых пяти кошельков. Просто введите адрес своего кошелька в указанное место на нашем сайте, и мы предоставим вам детальный отчет о состоянии вашего счета.
Защитите свои деньги в данный момент!
Избегайте риска оказаться пострадать от мошенников или попасть в неприятной ситуации неправомерных операций средств с вашими личными финансами. Дайте вашу криптовалюту профессиональным консультантам, которые окажут поддержку, вам и вашим финансам обезопаситься криптовалютные активы и избежать. Примите первый шаг к обеспечению безопасности к безопасности своего электронного портфеля активов уже сегодня!
Das Tipico Online Casino ist eine beliebte Plattform für Glücksspielbegeisterte, die gerne von zu Hause aus spielen möchten. Mit einer breiten Auswahl an verschiedenen Spielen und einer benutzerfreundlichen Oberfläche bietet das Tipico Online Casino ein erstklassiges Spielerlebnis.
Das Online Casino von Tipico bietet eine große Auswahl an Spielautomaten, Tischspielen und Live-Casino-Spielen. Die Spielautomaten reichen von klassischen Fruchtmaschinen bis hin zu modernen Videoslots mit aufregenden Bonusfunktionen. Tischspiele wie Roulette, Blackjack und Poker bieten den Spielern die Möglichkeit, ihre strategischen Fähigkeiten unter Beweis zu stellen. Im Live Casino können die Spieler gegen echte Dealer antreten und das Gefühl eines echten Casinos erleben.
Ein weiterer großer Vorteil des Tipico Online Casinos ist die Möglichkeit, von unterwegs zu spielen. Die Plattform ist auch für mobile Geräte optimiert, so dass die Spieler ihre Lieblingsspiele jederzeit und überall genießen können.
Das Tipico Online Casino bietet auch großzügige Boni und Promotionen für seine Spieler. Neue Spieler erhalten in der Regel einen Willkommensbonus, der ihnen zusätzliches Spielgeld oder Freispiele bietet. Darüber hinaus gibt es regelmäßig Aktionen, bei denen die Spieler zusätzliche Belohnungen verdienen können.
Die Sicherheit und Seriosität des Tipico Online Casinos sind ebenfalls ein wichtiger Aspekt. Die Plattform verfügt über gültige Lizenzen und arbeitet mit renommierten Zahlungsanbietern zusammen, um die Ein- und Auszahlungen der Spieler zu gewährleisten.
Insgesamt bietet das Tipico Online Casino ein erstklassiges Spielerlebnis für alle Glücksspielbegeisterten. Mit einer Vielzahl an Spielen, großzügigen Boni und einer sicheren Spielumgebung ist es eine hervorragende Wahl für alle, die gerne online spielen möchten.
https://tipicocasino.one/
чистый ли usdt
Осмотр USDT на нетронутость: Каковым способом защитить собственные криптовалютные финансы
Все более индивидуумов обращают внимание на безопасность личных криптовалютных активов. Постоянно дельцы предлагают новые подходы кражи цифровых активов, а также владельцы криптовалюты становятся пострадавшими их подстав. Один из техник обеспечения безопасности становится тестирование кошельков на наличие противозаконных средств.
Зачем это полезно?
Прежде всего, для того чтобы обезопасить личные средства от обманщиков и похищенных денег. Многие специалисты сталкиваются с риском утраты своих финансов вследствие мошеннических схем или краж. Осмотр кошельков способствует выявить подозрительные операции а также предотвратить возможные убытки.
Что наша команда предлагаем?
Мы предлагаем услугу тестирования электронных кошельков или операций для выявления начала средств. Наша система анализирует данные для выявления нелегальных транзакций или проценки опасности для вашего счета. Из-за такой проверке, вы сможете избегать проблем с регуляторами и также защитить себя от участия в нелегальных переводах.
Как происходит процесс?
Мы сотрудничаем с первоклассными аудиторскими агентствами, например Certik, для того чтобы обеспечить точность наших проверок. Мы применяем современные технологии для выявления потенциально опасных сделок. Ваши данные проходят обработку и хранятся согласно с высокими стандартами безопасности и конфиденциальности.
Каким образом проверить свои Tether для прозрачность?
Если хотите убедиться, что ваши Tether-кошельки чисты, наш сервис предлагает бесплатную проверку первых пяти кошельков. Просто введите местоположение собственного кошелька на на нашем веб-сайте, и наш сервис предложим вам подробный отчет о его статусе.
Охраняйте ваши активы прямо сейчас!
Не рискуйте попасть в жертву дельцов либо попадать в неблагоприятную обстановку по причине незаконных транзакций. Обратитесь за помощью к нашему сервису, с тем чтобы обезопасить ваши электронные активы и избежать неприятностей. Предпримите первый шаг к сохранности криптовалютного портфеля уже сейчас!
Проверка Тетер на чистоту: Каким образом обезопасить собственные криптовалютные средства
Все больше людей придают важность для безопасность их электронных средств. День ото дня мошенники разрабатывают новые методы кражи электронных денег, и также держатели криптовалюты становятся страдающими их интриг. Один из способов обеспечения безопасности становится проверка бумажников в присутствие нелегальных средств.
С каким намерением это потребуется?
Прежде всего, для того чтобы сохранить свои средства от шарлатанов а также украденных монет. Многие специалисты сталкиваются с вероятностью утраты личных средств из-за обманных механизмов либо краж. Осмотр кошельков позволяет выявить непрозрачные транзакции или предотвратить возможные убытки.
Что наша команда предлагаем?
Наша компания предоставляем услугу проверки криптовалютных кошельков а также транзакций для обнаружения источника средств. Наша платформа анализирует данные для выявления нелегальных операций и также проценки риска для вашего портфеля. Благодаря такой проверке, вы сможете избежать проблем с регулированием или защитить себя от участия в незаконных сделках.
Каким образом это работает?
Наша команда сотрудничаем с первоклассными проверочными агентствами, наподобие Cure53, для того чтобы предоставить точность наших проверок. Мы применяем новейшие технологии для определения рискованных сделок. Ваши информация обрабатываются и хранятся в соответствии с высокими нормами безопасности и конфиденциальности.
Как проверить свои Tether на прозрачность?
Если хотите убедиться, что ваши USDT-кошельки чисты, наш сервис предоставляет бесплатную проверку первых пяти кошельков. Легко введите местоположение вашего кошелька в на нашем веб-сайте, и также мы предоставим вам полную информацию доклад о его положении.
Охраняйте вашими активы сегодня же!
Не подвергайте опасности стать жертвой дельцов либо оказаться в неприятную обстановку из-за нелегальных операций. Обратитесь за помощью к нашему агентству, чтобы сохранить ваши криптовалютные активы и избежать неприятностей. Сделайте первый шаг к сохранности вашего криптовалютного портфеля уже сегодня!
Das Zet Casino ist eines der bekanntesten Online-Casinos auf dem Markt und bietet seinen Spielern eine Vielzahl von großzügigen Bonusangeboten. Eines dieser Angebote sind die sogenannten No Deposit Bonus Codes, die es Spielern ermöglichen, ohne eine Einzahlung zu tätigen, zusätzliches Spielguthaben zu erhalten.
Die No Deposit Bonus Codes 2021 für das Zet Casino sind für Spieler besonders attraktiv, da sie die Möglichkeit bieten, das Casino und seine Spiele ohne finanzielles Risiko auszuprobieren. Diese Codes werden regelmäßig auf der Website des Casinos veröffentlicht und können von Spielern genutzt werden, um kostenlose Boni zu erhalten.
Um einen No Deposit Bonus Code im Zet Casino zu nutzen, mГјssen Spieler einfach den entsprechenden Code eingeben, wenn sie ein neues Konto erstellen oder sich in ihr bestehendes Konto einloggen. Der Bonus wird dann automatisch gutgeschrieben und kann sofort zum Spielen verwendet werden.
Die No Deposit Bonus Codes im Zet Casino können verschiedene Formen annehmen, darunter Freispiele für bestimmte Spielautomaten, Bonusguthaben für Tischspiele oder sogar Cashback-Angebote. Diese Boni können je nach Code und Aktion unterschiedlich hoch sein, aber sie bieten den Spielern in jedem Fall die Möglichkeit, ihre Gewinnchancen zu erhöhen und das Casino ohne Risiko kennenzulernen.
Es ist jedoch wichtig zu beachten, dass die No Deposit Bonus Codes im Zet Casino in der Regel mit bestimmten Umsatzbedingungen verbunden sind, die erfüllt werden müssen, bevor Gewinne aus dem Bonus ausgezahlt werden können. Spieler sollten daher die Bonusbedingungen sorgfältig lesen und sicherstellen, dass sie diese erfüllen können, bevor sie einen Bonus in Anspruch nehmen.
Insgesamt sind die No Deposit Bonus Codes im Zet Casino eine großartige Möglichkeit für Spieler, zusätzliches Spielguthaben zu erhalten und das Casino risikofrei auszuprobieren. Mit den großzügigen Bonusangeboten und der Vielzahl an spannenden Spielen ist das Zet Casino definitiv einen Besuch wert.
https://zetcasino.one/
Привет!
2024 року Чорна п’ятниця в Україні обіцяє стати справжнім святом шопінгу! Готуйтеся до неймовірних знижок та акцій, які чекають на вас у магазинах та онлайн-платформах. Дізнайтеся дату проведення та готуйте гаманець до великих заощаджень!
[url=https://crazysale.marketing/black-friday.html]чорна пятниця[/url]
[url=https://crazysale.marketing/black-friday.html]чорна пятниця україна[/url]
чорна п’ятниця
чёрная пятница 2024
коли чорна п’ятниця
Удачи!
blublu
Осмотр Tether в чистоту: Каким образом обезопасить свои электронные средства
Каждый день все больше граждан придают важность к безопасность своих цифровых финансов. День ото дня обманщики изобретают новые схемы кражи цифровых активов, и также владельцы криптовалюты являются жертвами их подстав. Один способов обеспечения безопасности становится проверка кошельков в присутствие противозаконных денег.
Зачем это потребуется?
Преимущественно, для того чтобы сохранить свои средства от дельцов и похищенных денег. Многие инвесторы сталкиваются с вероятностью потери своих активов вследствие мошеннических планов или кражей. Анализ кошельков помогает обнаружить подозрительные операции или предотвратить возможные убытки.
Что наша команда предлагаем?
Наша компания предлагаем услугу тестирования электронных кошельков а также транзакций для выявления источника фондов. Наша система исследует информацию для определения незаконных действий и проценки угрозы для вашего счета. Благодаря такой проверке, вы сможете избежать проблем с регулированием и также защитить себя от участия в нелегальных сделках.
Как происходит процесс?
Наша команда сотрудничаем с лучшими проверочными организациями, вроде Cure53, чтобы гарантировать точность наших проверок. Мы применяем новейшие технологии для выявления опасных операций. Ваши данные обрабатываются и сохраняются согласно с высокими стандартами безопасности и конфиденциальности.
Как проверить личные USDT на чистоту?
Если вам нужно проверить, что ваша Tether-кошельки чисты, наш подход предлагает бесплатную проверку первых пяти кошельков. Просто введите место своего бумажника на на нашем веб-сайте, и наш сервис предоставим вам полную информацию отчет о его статусе.
Защитите ваши активы уже сегодня!
Избегайте риска подвергнуться обманщиков или оказаться в неприятную ситуацию из-за противозаконных транзакций. Обратитесь к нашему сервису, с тем чтобы предохранить ваши электронные активы и избежать затруднений. Примите первый шаг к сохранности вашего криптовалютного портфеля прямо сейчас!
Situs kantor bola merupakan penyedia permainan slot online gacor dengan RTP 98% , mainkan game slot online mudah menang di situs kantorbola . tersedia fitur deposit kilat menggunakan QRIS Kantorbola .
blibli
Как убедиться в чистоте USDT
Проверка кошелька за присутствие неправомерных финансовых средств: Обеспечение безопасности своего цифрового портфельчика
В мире цифровых валют становится все важнее необходимее соблюдать безопасность личных финансов. Регулярно жулики и хакеры выработывают совершенно новые способы обмана и угонов электронных финансов. Один из ключевых методов защиты является проверка кошельков для хранения криптовалюты на выявление наличия подозрительных средств передвижения.
Из-за чего именно поэтому важно, чтобы проверять личные электронные кошельки для хранения электронных денег?
Прежде всего это обстоятельство обязательно для того, чтобы обеспечения безопасности своих финансов. Большинство инвесторы рискуют потерять утраты их финансов по причине недобросовестных планов или угонов. Анализ кошельков способствует выявить вовремя непонятные операции и предотвратить возможные.
Что предлагает вашему вниманию фирма?
Мы оказываем сервис анализа криптовалютных бумажников и транзакций средств с намерением выявления происхождения средств передвижения и предоставления детального отчета о результатах. Наша система анализирует данные для определения незаконных манипуляций и определить уровень риска для того, чтобы своего криптовалютного портфеля. Благодаря нашей системе проверки, вы будете способны предотвратить возможные проблемы с регуляторами и обезопасить себя от непреднамеренного участия в незаконных операций.
Как происходит процесс?
Организация наша организация взаимодействует с крупными аудиторскими организациями фирмами, например Cure53, для того, чтобы гарантировать и адекватность наших проверок. Мы используем современные технологии и методы анализа данных для идентификации небезопасных манипуляций. Данные пользователей наших заказчиков обрабатываются и хранятся согласно высокими требованиями.
Важный запрос: “проверить свои USDT на чистоту”
Если вы хотите проверить чистоте собственных USDT кошельков, наши эксперты предлагает возможность исследовать бесплатной проверки первых пяти кошельков. Просто свой кошелек в указанное место на нашем онлайн-ресурсе, и мы передадим вам подробный отчет о состоянии вашего счета.
Обезопасьте свои активы уже сегодня!
Не подвергайте себя риску становиться пострадать криминальных элементов или оказаться в в неприятной ситуации незаконных операций с вашими собственными деньгами. Доверьте свои финансы специалистам, которые окажут помощь, вам и вашему бизнесу защитить свои криптовалютные средства и избежать. Сделайте первый шаг к безопасности защите вашего электронного портфеля активов прямо сейчас!
Zet Casino Störung
Das Zet Casino ist eine beliebte Online-GlГјcksspielplattform, auf der Spieler eine Vielzahl von Spielen wie Slots, Tischspielen und Live-Casino-Spielen genieГџen kГ¶nnen. Allerdings kann es manchmal vorkommen, dass das Casino aufgrund technischer Probleme oder Wartungsarbeiten vorГјbergehend nicht erreichbar ist, was als “Zet Casino StГ¶rung” bezeichnet wird.
In solchen Fällen kann es frustrierend sein, wenn Spieler versuchen, auf ihre Lieblingsspiele zuzugreifen und feststellen, dass die Website nicht funktioniert. Es ist wichtig zu beachten, dass diese Störungen normalerweise nur vorübergehend sind und die Casinobetreiber daran arbeiten, das Problem so schnell wie möglich zu beheben.
Wenn das Zet Casino eine Störung hat, können Spieler auf verschiedene Weise darauf reagieren. Zuallererst ist es wichtig, ruhig zu bleiben und zu verstehen, dass solche Probleme unvermeidlich sind und von vielen Online-Plattformen erlebt werden. Es ist ratsam, die offiziellen Kommunikationskanäle des Casinos zu überprüfen, um Informationen über die Störung und den voraussichtlichen Zeitpunkt der Behebung zu erhalten.
In einigen Fällen kann es auch hilfreich sein, den Kundendienst des Zet Casinos zu kontaktieren, um weitere Informationen zu erhalten und möglicherweise eine Alternative für das Spielen über eine andere Plattform in Betracht zu ziehen. Es ist wichtig, geduldig zu sein und zu verstehen, dass solche Störungen normalerweise schnell behoben werden und das Casino bald wieder normal funktionieren wird.
Insgesamt ist es ratsam, gelassen zu bleiben und zu verstehen, dass Störungen im Zet Casino oder anderen Online-Glücksspielplattformen unvermeidlich sind. Mit dem richtigen Umgang und etwas Geduld können Spieler sicherstellen, dass sie bald wieder ihre Lieblingsspiele genießen können.
https://zetcasino.one/
лечение наркомании в казахстане http://adtherapy.ru/
Приветствую, любители захватывающих приключений! Планирую делиться своим великолепием от цифрового игрового дома “официальный сайт казино селектор”. Это не всего лишь площадка для игр, это весь мир чувств и забав! Здесь я обнаружил все, что мне требуется: вариативность игр, обильные бонусы и скоростные выплаты. Но первостепенное – это атмосфера, которая преобладает здесь. Цифровые приключения, потрясающие турниры и дружелюбное сообщество игроков делают каждую игру неизученной! Присоедините к “[url=https://selector-casino-igrat.tech/]Селектор играть[/url]” и погрузитесь в мир занимательных развлечений!
Ist das Zet Casino sicher?
Das Zet Casino ist eine beliebte Online-GlГјcksspielseite, die eine Vielzahl von Spielen fГјr Spieler anbietet. Aber die Frage bleibt: Ist das Zet Casino sicher?
Um diese Frage zu beantworten, müssen wir uns zunächst die Lizenzierung des Casinos ansehen. Das Zet Casino ist von der Malta Gaming Authority lizenziert und reguliert, was bedeutet, dass es strenge Regeln und Vorschriften einhalten muss, um sicherzustellen, dass es fair und sicher für die Spieler ist.
Das Zet Casino verwendet auch hochmoderne Verschlüsselungstechnologien, um sicherzustellen, dass die persönlichen und finanziellen Daten der Spieler geschützt sind. Darüber hinaus arbeitet das Casino nur mit vertrauenswürdigen Zahlungsanbietern zusammen, um sicherzustellen, dass alle Transaktionen sicher und geschützt sind.
Das Zet Casino bietet auch ein verantwortungsbewusstes Glücksspielprogramm an, das Spielern dabei hilft, ihre Spielgewohnheiten zu kontrollieren und verantwortungsbewusst zu spielen. Das Casino nimmt den Schutz seiner Spieler ernst und bietet Unterstützung für alle, die Hilfe bei einem problematischen Spielverhalten benötigen.
Insgesamt kann gesagt werden, dass das Zet Casino als sicher und vertrauenswürdig betrachtet werden kann. Mit seiner Lizenzierung, modernen Sicherheitsvorkehrungen und verantwortungsbewussten Glücksspielinitiativen können Spieler sicher sein, dass sie eine sichere und faire Spielerfahrung im Zet Casino genießen können.
https://zetcasino.one/
Осмотр Тетер в чистоту: Как обезопасить собственные электронные средства
Каждый день все больше индивидуумов придают важность на безопасность собственных цифровых средств. Ежедневно обманщики придумывают новые способы кражи цифровых активов, а также держатели цифровой валюты становятся пострадавшими их интриг. Один из техник обеспечения безопасности становится проверка бумажников в наличие незаконных средств.
С каким намерением это потребуется?
Преимущественно, для того чтобы защитить свои активы от дельцов или похищенных монет. Многие вкладчики сталкиваются с риском убытков своих финансов по причине хищных сценариев или кражей. Тестирование кошельков способствует выявить непрозрачные транзакции и также предотвратить возможные потери.
Что наша группа предлагаем?
Мы предлагаем услугу анализа цифровых кошельков или транзакций для выявления источника денег. Наша система проверяет данные для обнаружения незаконных операций и оценки риска для вашего счета. За счет данной проверке, вы сможете избегнуть проблем с регуляторами или предохранить себя от участия в противозаконных переводах.
Как это работает?
Наша фирма работаем с лучшими проверочными компаниями, вроде Kudelsky Security, для того чтобы гарантировать точность наших тестирований. Мы внедряем новейшие технологии для определения рискованных операций. Ваши данные обрабатываются и хранятся в соответствии с высокими нормами безопасности и приватности.
Каким образом проверить собственные Tether в прозрачность?
В случае если вы желаете подтвердить, что ваши USDT-кошельки прозрачны, наш сервис предоставляет бесплатную проверку первых пяти кошельков. Просто введите место собственного кошелька в на нашем веб-сайте, и также мы предоставим вам детальный отчет об его положении.
Защитите ваши активы уже сегодня!
Избегайте риска попасть в жертву обманщиков или оказаться в неблагоприятную обстановку по причине противозаконных операций. Свяжитесь с нашему агентству, для того чтобы сохранить свои цифровые активы и избежать неприятностей. Сделайте первый шаг к сохранности вашего криптовалютного портфеля сегодня!
наркологическая помощь https://okcentr.kz/
Мы рекомендуем посетить веб-сайт https://bar-atra.ru/.
Кроме того, не забудьте добавить сайт в закладки: [url=https://bar-atra.ru/]https://bar-atra.ru/[/url]
Здравствуйте!
Откройте для себя уникальные возможности знакомства с Калининградом и его окрестностями благодаря нашим индивидуальным экскурсиям. Мы – команда опытных и аккредитованных гидов, готовых поделиться своими знаниями и страстью к этому удивительному региону. Наша услуга не просто путеводитель по местным достопримечательностям, это настоящее погружение в историю, культуру и природу Калининграда и его области. Мы предлагаем экскурсии, созданные с учетом ваших интересов и предпочтений, что делает каждое путешествие неповторимым и запоминающимся. Наша команда обеспечит вас комфортным автомобилем, что позволит максимально эффективно использовать время и охватить больше интересных мест. Независимость от расписания общественного транспорта и гибкость маршрутов делают наши экскурсии идеальным выбором для тех, кто ценит своё время и хочет увидеть больше. Путешествуйте в своем темпе, останавливайтесь там, где хотите, и исследуйте каждый уголок этого удивительного региона. Наши гиды не просто расскажут о местах, они создадут атмосферу увлекательного путешествия, наполненного интересными фактами и легендами. Мы гордимся тем, что помогаем нашим гостям увидеть настоящий Калининград, вне знаменитых маршрутов туристических групп. Позвольте себе погрузиться в атмосферу удивительного мира Калининградской области вместе с нашей командой. Посетите наш сайт https://topkaliningrad.ru уже сегодня, чтобы узнать больше о наших услугах и забронировать свою индивидуальную экскурсию!
Калининград гид индивидуальный
экскурсия в Калининграде цены
индивидуальный гид по Калининграду и Калининградской области
Калининград частный гид
экскурсии в Калининграде и Калининградской области индивидуальные
гиды в Калининградской области
Удачи и хорошего визита в Калининград!
Tipico ElfmeterschieГџen Casino
Das Tipico Elfmeterschießen Casino ist eine innovative Glücksspielplattform, die Fußballfans und Casino-Liebhabern gleichermaßen ein spannendes Spielerlebnis bietet. Hier können die Spieler die Spannung eines Elfmeterschießens erleben, während sie auf ihre Lieblingsspiele wetten.
Das Konzept des Elfmeterschießens wurde geschickt in das Casino-Spiel integriert, um die Aufregung und den Nervenkitzel zu steigern. Die Spieler können aus einer Vielzahl von Wettoptionen wählen, um ihre Gewinnchancen zu maximieren. Ob Sie auf den Torschützen, den Torhüter oder das Endergebnis wetten möchten, im Tipico Elfmeterschießen Casino gibt es unzählige Möglichkeiten, Ihr Glück zu versuchen.
Darüber hinaus bietet das Casino eine Vielzahl von attraktiven Bonusangeboten und Aktionen, mit denen die Spieler ihre Gewinne steigern können. Von Willkommensboni über Freispiele bis hin zu Cashback-Angeboten gibt es für jeden Spieler etwas zu entdecken.
Die Plattform ist benutzerfreundlich gestaltet und bietet eine Vielzahl von sicheren Zahlungsmethoden, um eine reibungslose und zuverlässige Spielerfahrung zu gewährleisten. Darüber hinaus wird der Kundenservice des Casinos hoch geschätzt und steht den Spielern rund um die Uhr zur Verfügung, um bei Fragen oder Problemen zu helfen.
Insgesamt bietet das Tipico ElfmeterschieГџen Casino eine einzigartige und aufregende Spielerfahrung fГјr alle, die auf der Suche nach Nervenkitzel und Gewinnen sind. Probieren Sie es aus und erleben Sie die Faszination des ElfmeterschieГџens in einem ganz neuen Kontext. Viel GlГјck!
https://tipicocasino.one/
бормашини
Доброго!
Откройте для себя неповторимую Калининградскую область вместе с нашей командой индивидуальных гидов и персональных экскурсий! Наши специалисты – аккредитованные экскурсоводы с богатым опытом и глубоким знанием местных достопримечательностей. Мы предлагаем комфортабельные автомобили для удобного перемещения по региону и гибкий график экскурсий, адаптированный под ваши пожелания и интересы. С нами вы сможете исследовать уникальные исторические объекты, насладиться природными красотами и познакомиться с местной культурой. Наша персонализированная услуга позволит вам увидеть то, что вас действительно интересует, без лишних ограничений и очередей. Приобретите незабываемые впечатления и уникальные знания о Калининграде с нами! Подробнее о наших услугах и возможностях вы можете узнать на нашем сайте TopKaliningrad.ru
экскурсии по Калининграду и Калининградской области цены
Калининград экскурсия индивидуальная
экскурсии по Калининграду обзорные
гид по Калининграду
гид на машине Калининград
гид по Калининграду с машиной
Удачи и хорошего визита в Калининград!
Tipico Casino ist eine beliebte Plattform für Glücksspiele im Internet. Viele Spieler fragen sich, wie sie am besten gewinnen können. Hier sind einige Tipps, die Ihnen dabei helfen können, Ihre Gewinnchancen zu erhöhen.
Zunächst ist es wichtig, sich mit den verschiedenen Spielen vertraut zu machen, die im Tipico Casino angeboten werden. Jedes Spiel hat seine eigenen Regeln und Strategien, die es zu beachten gilt. Machen Sie sich daher vorab mit den Spielregeln vertraut, um Ihre Gewinnchancen zu optimieren.
Ein weiterer wichtiger Tipp ist, ein Budget festzulegen und sich strikt daran zu halten. Es ist wichtig, verantwortungsbewusst zu spielen und nicht mehr Geld zu setzen, als man bereit ist zu verlieren. Setzen Sie sich daher klare Limits und halten Sie sich daran, um finanzielle Verluste zu vermeiden.
Außerdem ist es ratsam, regelmäßig an Aktionen und Bonusangeboten teilzunehmen. Das Tipico Casino bietet regelmäßig attraktive Boni und Promotionen an, die Ihre Gewinnchancen erhöhen können. Nutzen Sie diese Angebote daher aus, um zusätzliches Geld zu gewinnen.
Ein weiterer wichtiger Tipp ist, Geduld und Ausdauer zu haben. Glücksspiele sind ein Spiel des Zufalls, und es ist wichtig, nicht zu schnell frustriert zu sein, wenn es einmal nicht so läuft, wie man es sich erhofft hat. Bleiben Sie gelassen und behalten Sie einen kühlen Kopf, um langfristig erfolgreich zu sein.
AbschlieГџend ist es wichtig, sich immer bewusst zu machen, dass GlГјcksspiele ein Unterhaltungsangebot sind und nicht als Einkommensquelle dienen sollten. Spielen Sie daher verantwortungsbewusst und genieГџen Sie das Spiel, ohne dabei den SpaГџ aus den Augen zu verlieren.
Insgesamt können diese Tipps dazu beitragen, Ihre Gewinnchancen im Tipico Casino zu erhöhen. Beachten Sie jedoch, dass Glücksspiele immer mit einem gewissen Risiko verbunden sind und es keine Garantie für einen Gewinn gibt. Spielen Sie daher verantwortungsbewusst und genießen Sie das Spiel. Viel Glück!
https://tipicocasino.one/
usdt и отмывание
Тетер – это устойчивая криптовалютный актив, привязанная к национальной валюте, например USD. Это делает ее исключительно популярной среди трейдеров, поскольку данный актив обеспечивает стабильность цены в условиях неустойчивости криптовалютного рынка. Однако, подобно любая другая тип цифровых активов, USDT изложена вероятности использования для скрытия происхождения средств и поддержки неправомерных операций.
Промывка средств через криптовалюты превращается все более и более широко распространенным методом с тем чтобы скрытия происхождения средств. Применяя разные приемы, злоумышленники могут пытаться отмывать незаконно полученные деньги через сервисы обмена криптовалют или смешиватели, чтобы осуществить процесс происхождение менее очевидным.
Именно в связи с этим, экспертиза USDT на чистоту оказывается существенной практикой предосторожности с целью участников криптовалют. Доступны для использования специализированные услуги, какие выполняют анализ операций и бумажников, для того чтобы обнаружить подозрительные операции и противоправные источники капитала. Эти платформы способствуют пользователям устранить непреднамеренной участи в преступных действий и избежать блокировки счетов со стороны регуляторных органов.
Анализ USDT на чистоту также предотвращает предохранить себя от возможных финансовых убытков. Владельцы могут быть убеждены что их активы не связаны с незаконными транзакциями, что в свою очередь снижает риск блокировки счета или перечисления денег.
Поэтому, в условиях современности возрастающей сложности среды криптовалют важно принимать шаги для обеспечения безопасности и надежности своего капитала. Анализ USDT на чистоту с помощью специализированных сервисов является важной одним из вариантов защиты от незаконной деятельности, предоставляя владельцам криптовалют дополнительную защиту и защиты.
Проверка USDT на чистоту
Анализ USDT для нетронутость: Каковым способом защитить личные электронные активы
Все больше граждан обращают внимание к безопасность личных криптовалютных активов. Ежедневно обманщики разрабатывают новые схемы хищения криптовалютных средств, а также владельцы криптовалюты становятся пострадавшими их интриг. Один из техник охраны становится тестирование кошельков в присутствие незаконных финансов.
Для чего это потребуется?
Прежде всего, с тем чтобы защитить личные активы против шарлатанов и похищенных денег. Многие участники сталкиваются с вероятностью потери своих средств по причине хищных схем или хищений. Осмотр кошельков помогает обнаружить подозрительные операции или предотвратить возможные потери.
Что наша команда предлагаем?
Мы предлагаем сервис тестирования криптовалютных кошельков а также транзакций для обнаружения источника фондов. Наша система проверяет данные для определения нелегальных действий или проценки риска вашего портфеля. Благодаря такой проверке, вы сможете избегать проблем с регуляторами или обезопасить себя от участия в противозаконных операциях.
Как это действует?
Мы сотрудничаем с первоклассными проверочными фирмами, например Halborn, для того чтобы обеспечить прецизионность наших проверок. Мы применяем новейшие техники для обнаружения опасных сделок. Ваши данные обрабатываются и сохраняются в соответствии с высокими нормами безопасности и конфиденциальности.
Как проверить собственные Tether в прозрачность?
Если хотите проверить, что ваши USDT-кошельки чисты, наш сервис предоставляет бесплатное тестирование первых пяти кошельков. Просто введите местоположение личного бумажника в на сайте, и наша команда предоставим вам детальный доклад об его положении.
Охраняйте ваши средства уже сегодня!
Избегайте риска подвергнуться шарлатанов или оказаться в неблагоприятную ситуацию из-за незаконных операций. Посетите нашему агентству, с тем чтобы предохранить ваши электронные активы и избежать неприятностей. Сделайте первый шаг к сохранности вашего криптовалютного портфеля сегодня!
九州娛樂
Беларусь ужесточает правила регулирования онлайн казино для защиты игроков
бормашини
златни гривни за крак
Tipico Casino Freispiele kaufen
In vielen Online Casinos haben Spieler die Möglichkeit, Freispiele zu erwerben, um damit ihr Glück bei verschiedenen Spielautomaten zu versuchen. Auch im Tipico Casino gibt es die Möglichkeit, Freispiele zu kaufen und so die Spannung und Nervenkitzel beim Spielen zu erhöhen.
Durch den Kauf von Freispielen können Spieler direkt in die Action einsteigen, ohne auf den Zufall angewiesen zu sein, um Freispiele während des Spiels zu erhalten. Dies ermöglicht es den Spielern, schneller mit dem Spielen zu beginnen und potenziell größere Gewinne zu erzielen.
Um Freispiele im Tipico Casino zu kaufen, müssen die Spieler einfach den entsprechenden Bereich im Casino besuchen und dort die verfügbaren Angebote prüfen. Oftmals gibt es verschiedene Pakete zur Auswahl, die unterschiedliche Anzahlen von Freispielen enthalten. Die Preise für die Freispiele variieren je nach Angebot und können mit Echtgeld oder Bonusguthaben bezahlt werden.
Bevor man Freispiele kauft, ist es wichtig zu beachten, dass die Gewinne, die mit diesen erzielt werden, oft bestimmten Umsatzbedingungen unterliegen. Diese Bedingungen geben an, wie oft die Gewinne aus den Freispielen umgesetzt werden müssen, bevor sie ausgezahlt werden können. Es ist daher ratsam, die Bedingungen genau zu lesen, bevor man sich für den Kauf von Freispielen entscheidet.
Trotzdem kann der Kauf von Freispielen im Tipico Casino eine aufregende Möglichkeit sein, um das Spielerlebnis zu verbessern und die Chancen auf Gewinne zu erhöhen. Mit etwas Glück und Geschick können die Spieler mit den gekauften Freispielen große Gewinne erzielen und ihr Casinoerlebnis noch spannender gestalten.
https://tipicocasino.one/
Интернет-магазин, предлагающий много раковина на кухню угловая для вашего интерьера.
Das beste Zet Casino ist eines, das eine breite Auswahl an Spielen, großzügige Boni und viele Zahlungsmöglichkeiten bietet.
Zet Casino ist eines der besten Online-Casinos, das all diese Kriterien erfГјllt. Mit einer Vielzahl von Spielen von fГјhrenden Anbietern wie NetEnt, Microgaming, Play’n GO und vielen anderen, gibt es fГјr jeden Spieler etwas Passendes. Von Spielautomaten Гјber Tischspiele bis hin zu Live-Casino-Spielen ist die Auswahl riesig.
Darüber hinaus bietet Zet Casino großzügige Boni und Promotionen für neue Spieler sowie treue Kunden. Willkommensboni, Freispiele und Cashback-Aktionen sind nur einige der Angebote, die regelmäßig verfügbar sind.
Ein weiterer Pluspunkt von Zet Casino sind die vielfältigen Zahlungsmöglichkeiten, die es den Spielern leicht machen, Ein- und Auszahlungen bequem durchzuführen. Von Kreditkarten über E-Wallets bis hin zu Kryptowährungen gibt es für jeden Spieler eine passende Option.
Zusammenfassend lässt sich sagen, dass Zet Casino zu den besten Online-Casinos gehört, die derzeit verfügbar sind. Mit einer erstklassigen Auswahl an Spielen, großzügigen Boni und einer breiten Palette an Zahlungsmöglichkeiten ist Zet Casino die perfekte Wahl für jeden Spieler, der ein erstklassiges Spielerlebnis sucht.
https://zetcasino.one/
резачки за дърва
Амигуруми – это японское искусство создания игрушек с помощью техники амигуруми. Это слово происходит от японских слов “ами”, означающего вязаный, и “нюгуруми”, что переводится как плюшевая игрушка. Традиционно амигуруми изготавливаются из клубков с использованием крючка. Игрушки амигуруми могут отображать различных персонажей, обитателей, мифические существа и многое другое. Это популярное пассия, которое имеет свои сообщества и сторонников по всему миру.
По амигуруми существует множество рисунков и руководств. В этих материалах представлены пошаговые инструкции по созданию различных персонажей амигуруми. Графики показывают каждый момент процесса вязания, а обучающие программы сопровождаются полными описаниями. Такие игрушки амигуруми крючком можно найти в интернете, на сайтах по рукоделию, в ресурсных форумах и социальных сетях.
Также многие книги по рукоделию содержат иллюстрации и уроки по созданию амигуруми. Профессионалы в этой области предоставляют своим опытом и талантами через книги, видеоуроки и мануалы.
Важно выбирать материалы, подходящие вашему уровню навыков и стайлу. Некоторые материалы адресованы новичков, предоставляя более простые руководства и руководства, в то время как для опытных рукодельников доступны более высокоуровневые работы и подробные техники.
Came across a unique article – it’s worth your attention http://ulmo.ukrbb.net/index.php
такери за пирони
акумулаторни резачки
Zet Casino ist ein beliebtes Online-Casino, das eine Vielzahl von Spielen und groГџzГјgige Boni anbietet. In diesem Artikel werde ich einige Rezensionen fГјr Zet Casino vorstellen.
Einer der positiven Aspekte von Zet Casino ist die große Auswahl an Spielen. Das Casino bietet eine Vielzahl von Spielautomaten, Tischspielen und Live-Casino-Spielen, die von renommierten Anbietern wie NetEnt, Microgaming und Betsoft bereitgestellt werden. Die Nutzer loben die Vielfalt und Qualität der Spiele und die Möglichkeit, sowohl klassische als auch neue Titel zu spielen.
Ein weiterer Pluspunkt für Zet Casino sind die großzügigen Boni und Promotionen. Neue Spieler erhalten einen Willkommensbonus, der Freispiele und Bonusguthaben umfasst, und regelmäßige Spieler können von verschiedenen Aktionen und Sonderangeboten profitieren. Die Rezensenten betonen die Fairness der Bonusbedingungen und die Transparenz bei der Kommunikation von Bonusangeboten.
Das Kundenservice-Team von Zet Casino wird ebenfalls positiv bewertet. Die Mitarbeiter sind freundlich, kompetent und stets bemГјht, den Spielern bei Fragen oder Problemen zu helfen. Die meisten Rezensenten berichten von einer schnellen und effizienten UnterstГјtzung durch den Kundenservice.
Einige Kritikpunkte, die in den Rezensionen für Zet Casino erwähnt werden, sind die begrenzten Zahlungsmöglichkeiten und die manchmal etwas lange Auszahlungsdauer. Einige Spieler haben auch angemerkt, dass die Webseite manchmal etwas langsam lädt.
Insgesamt sind die Rezensionen für Zet Casino größtenteils positiv. Die Spieler loben die Vielfalt der Spiele, die großzügigen Boni und den hilfsbereiten Kundenservice. Wenn Sie auf der Suche nach einem neuen Online-Casino sind, könnte Zet Casino eine gute Option für Sie sein.
https://zetcasino.one/
оберфрези
Мечтаете о повышении должности? Купите диплом и достигните новых высот!
https://diplom-kuplu.ru
Exklusiver Casino Bonus bei Tipico
Tipico ist einer der fГјhrenden Anbieter fГјr Sportwetten und Online-Casino-Spiele in Deutschland. Das Unternehmen bietet seinen Kunden ein breites Angebot an Spielen und attraktiven Bonusaktionen. Besonders beliebt ist der exklusive Casino Bonus, den Tipico seinen Spielern zur VerfГјgung stellt.
Der exklusive Casino Bonus von Tipico ist eine besondere Aktion, die nur für ausgewählte Kunden verfügbar ist. Mit diesem Bonus haben Spieler die Möglichkeit, zusätzliches Geld für ihre Einsätze im Online-Casino zu erhalten. Der Bonus kann in Form von Bonusguthaben, Freispielen oder anderen Vergünstigungen angeboten werden.
Um den exklusiven Casino Bonus bei Tipico zu erhalten, müssen Spieler bestimmte Bedingungen erfüllen. Dazu gehören in der Regel das Eröffnen eines neuen Spielerkontos, das tätigen einer Einzahlung und das Erfüllen von Umsatzanforderungen. Die genauen Bedingungen können je nach Aktion variieren, daher ist es wichtig, sich vorab über die Teilnahmebedingungen zu informieren.
Der exklusive Casino Bonus von Tipico bietet Spielern die Möglichkeit, ihre Gewinnchancen zu erhöhen und zusätzliche Unterhaltung im Online-Casino zu genießen. Mit einem Bonus können Spieler ihre Lieblingsspiele ausprobieren, ohne dabei ihr eigenes Geld riskieren zu müssen. Zudem ermöglicht der Bonus es Spielern, neue Spiele zu entdecken und spannende Erfahrungen zu sammeln.
Insgesamt ist der exklusive Casino Bonus bei Tipico eine attraktive Möglichkeit, um das Online-Casino des Anbieters kennenzulernen und von zusätzlichen Vergünstigungen zu profitieren. Spieler sollten jedoch beachten, dass Bonusaktionen immer bestimmten Bedingungen unterliegen und daher sorgfältig geprüft werden sollten. Wer die Bedingungen erfüllt, kann jedoch von einem lohnenswerten Bonus profitieren und spannende Casinospiele bei Tipico erleben.
https://tipicocasino.one/
blibli
изработване на сайтове
cá cược thể thao
Zet Casino Deutschland – Top Online Spielothek
Das Zet Casino ist eine beliebte Online Spielothek, die auch in Deutschland immer mehr Spieler anzieht. Die Website bietet eine groГџe Auswahl an Spielen, darunter Spielautomaten, Tischspiele, Live-Casino Spiele und mehr. Die Plattform ist benutzerfreundlich und bietet eine sichere und faire Spielumgebung fГјr alle Spieler.
Das Zet Casino Deutschland bietet auch eine Vielzahl von Zahlungsmethoden für deutsche Spieler, darunter Kreditkarten, E-Wallets und Banküberweisungen. Die Auszahlungen sind schnell und unkompliziert, was die Spieler sicherlich zu schätzen wissen.
Ein weiterer groГџer Vorteil des Zet Casinos ist der Kundenservice. Das Support-Team ist rund um die Uhr erreichbar und hilft bei allen Fragen und Anliegen. Die Mitarbeiter sind freundlich, professionell und sehr kompetent.
Zet Casino Deutschland bietet auch großzügige Boni und Promotionen für neue und bestehende Spieler. Diese können Freispiele, Einzahlungsboni und Cashback-Angebote umfassen. Es lohnt sich also, regelmäßig nach den neuesten Aktionen Ausschau zu halten.
Insgesamt ist das Zet Casino eine ausgezeichnete Wahl fГјr deutsche Spieler, die nach einer unterhaltsamen und sicheren Online-Spielothek suchen. Mit einer groГџen Auswahl an Spielen, einer benutzerfreundlichen Website und einem erstklassigen Kundenservice ist das Zet Casino Deutschland definitiv einen Besuch wert.
https://zetcasino.one/
[url=http://grainloader.vn.ua]grain scraper[/url]
Gold Hobbyist Furnishings stores a assortment of quality corn loaders fitting in behalf of jobs of all shapes and sizes.
https://grainloader.vn.ua
Мы рекомендуем посетить веб-сайт http://skatertsamobranka.ru/.
Кроме того, не забудьте добавить сайт в закладки: [url=http://skatertsamobranka.ru/]http://skatertsamobranka.ru/[/url]
Gogo Casino Finland är en av de mest populära onlinecasinona för finska spelare. Med sitt stora utbud av casinospel och generösa bonusar är det en favorit bland många som gillar att spela på nätet.
En av de stora fördelarna med Gogo Casino Finland är att det erbjuder en trygg och säker spelmiljö för sina spelare. Alla transaktioner är krypterade och spelplattformen är certifierad av säkerhetsorganisationer för att säkerställa att spelarna kan lita på att deras personuppgifter och pengar är i goda händer.
När det gäller spelutbudet har Gogo Casino Finland något för alla. Från klassiska casinospel som blackjack och roulette till moderna videoslots och progressiva jackpottspel, finns det något för både nybörjare och erfarna spelare att njuta av.
För de som gillar att spela live casino finns det också ett stort urval av live dealer-spel att välja mellan. Med riktiga dealers som sköter spelet i realtid ger det en autentisk casinoupplevelse direkt till spelarnas datorer eller mobila enheter.
För de som är intresserade av att prova lyckan gratis innan de gör en insättning finns det också möjlighet att spela demospel på många av spelen på Gogo Casino Finland.
Sammanfattningsvis är Gogo Casino Finland ett utmärkt val för finska spelare som letar efter en pålitlig och underhållande onlinecasino-upplevelse. Med sitt stora utbud av spel, generösa bonusar och trygga spelmiljö är det ett casino som verkligen lever upp till sitt namn.
https://gogocasino.one
Das Zet Casino ist eine beliebte Online-GlГјcksspielseite, die eine Vielzahl von Spielen fГјr Spieler aus der ganzen Welt anbietet. Eine wichtige Frage, die viele Spieler stellen, ist die Lizenzierung des Casinos. In diesem Artikel werden wir genauer untersuchen, welche Lizenz das Zet Casino besitzt und was dies fГјr die Spieler bedeutet.
Das Zet Casino wird von der Firma Araxio Development N.V. betrieben und verfügt über eine Glücksspiellizenz der Regierung von Curacao. Die Curacao e-Gaming-Lizenz gilt als eine der angesehensten Lizenzen in der Online-Glücksspielbranche und stellt sicher, dass das Casino strenge Richtlinien einhält, um Fairness, Sicherheit und Transparenz für die Spieler zu gewährleisten.
Durch die Lizenzierung beim Zet Casino können die Spieler sicher sein, dass das Casino regelmäßig von unabhängigen Behörden überprüft wird, um sicherzustellen, dass alle Spiele fair und zufällig sind. Dies gibt den Spielern ein Gefühl von Vertrauen und Sicherheit, wenn sie im Zet Casino spielen.
Darüber hinaus bedeutet die Lizenzierung auch, dass das Casino die Datenschutz- und Sicherheitsmaßnahmen einhält, um sicherzustellen, dass persönliche Daten der Spieler geschützt sind und alle Transaktionen sicher abgewickelt werden.
Zusammenfassend lässt sich sagen, dass das Zet Casino über eine angesehene Glücksspiellizenz der Regierung von Curacao verfügt, die für Fairness, Sicherheit und Transparenz im Casino sorgt. Spieler können somit beruhigt sein, dass sie in einem seriösen und vertrauenswürdigen Online-Casino spielen.
https://zetcasino.one/
הימורים מקוונים הם חוויה מרגשת ופופולריות ביותר בעידן הדיגיטלי, שמגירה מיליוני אנשים מכל
רחבי העולם. ההימורים המקוונים מתנהלים בהתאם ל אירועים ספורט, תוצאות פוליטיות ואפילו תוצאות מזג האוויר ונושאים נוספים. אתרים ל הימורים הווירטואליים מקריאים פוטנציאליים את המשתתפים להימר על תוצאות אפשרות ולחוות חוויות ייחודיות ומרתקות.
ההימורים המקוונים הם הם כבר חלק מהתרבות האנושית מזמן רב והיום הם לא רק רק חלק נפרד מהפעילות הכלכלית והתרבותית, אלא כמו כן מספקים הכנסות וחוויים. משום שהם נגישים לכולם ונוחים לשימוש, הם מתאימים לכל מהמשחק ולהנציח רגעי עסקה וניצחון בכל זמן ובכל מקום.
טכנולוגיה והימורים מקוונים הפכו להיות מעניינת ונפוצה. מיליוני אנשים מכל כל רחבי העולם מעוניינים בהימורים, כוללים סוגים שונים של הימורים. הימורים מקוונים מציעים למשתתפים חוויה מהנה ומרגשת, המתאימה לכולם בכל זמן ובכל מקום.
וכן מה חכם אתה מחכה למה? הצטרף עכשיו והתחיל ליהנות מהתרגשות וההנאה שההימורים באינטרנט מבטיחים.
Telegrass
שרף מדריך: המדריכים המועיל לקניית קנאביס על ידי הטלגרמה
שרף הוראות היא פורטל מידעים ומדריכי להשקיה קנאביס באמצעות האפליקציה הפופולרית טלגרם.
הפורטל מספקת את כל הקישורות והמסמכים המתעדף לקבוצות וערוצים הנבחרים מומלצים לסחר ב קנאביסין בהטלגרמה במדינת ישראל.
כמו כך, אתר האינטרנט מספק מדריך מפורטת לאיך כדאי להתקשר בהקנאביס ולקנה קנאביס בקלות הזמנה ובמהירות התגובה.
בעזרת ההוראות, כמו כן משתמשים חדשים בתחום יוכלו להירשם להמערכת הקנאביס בטלגרם בפני מאובטחת ומאובטחת לשימוש.
הבוט של השרף מאפשר למשתמשי הערוץ ללבצע את פעולות המבוצעות שונות ומקוריות כמו גם הזמנת קנאביס, קבלת תמיכה סיוע, בדיקת הקיימות והכנסת הערות על המוצרים. כל זאת בצורה נוחה ופשוטה דרך האפליקציה הניידת.
כאשר כאשר נדבר באמצעים התשלומים, טלגראס משתמשת בשיטות ה מוכרות כגון כספים מזומנים, כרטיסי האשראי של אשראי ומטבע דיגיטלי. חשוב לציין כי ישנה לבדוק ולוודא את התקנות והחוקים המקומיים באיזור שלך לפני ביצוע רכישה.
המסר מציע יתרונות משמעותיים מרכזיים כגון פרטיות והגנה מוגברים, תקשורת מהירה וגמישות גבוהה. בנוסף, הוא מאפשר כניסה להקהל עולמית רחבה ומציע מגוון רחב של תכונות ויכולות.
בסיכום, הטלגרם הנחיות היה המקום האידיאלי ללמצוא את כל הידע והקישורים לסחר ב קנאביס בדרך מהירה, בבטוחה ונוחה מאוד דרך הטלגרם.
Came across an interesting article, I propose you have a look http://neoncity.gtaserv.ru/viewtopic.php?f=38&t=1817
Zet Casino Bewertungen
Zet Casino ist ein Online-Casino, das in den letzten Jahren immer beliebter geworden ist. Es bietet eine Vielzahl von Spielen, großzügige Boni und eine benutzerfreundliche Benutzeroberfläche. Doch wie steht es um die Qualität des Casinos? Hier sind einige Bewertungen von Spielern, die Zet Casino ausprobiert haben.
Viele Spieler loben die groГџe Auswahl an Spielen, die Zet Casino anbietet. Von klassischen Slots bis hin zu Live-Casino-Spielen, hier findet jeder Spieler etwas nach seinem Geschmack. Die Spiele sind von bekannten und vertrauenswГјrdigen Anbietern wie NetEnt, Microgaming und Play’n GO entwickelt, was fГјr eine gute QualitГ¤t und ein reibungsloses Spielerlebnis sorgt.
Ein weiterer Pluspunkt von Zet Casino sind die großzügigen Boni und Aktionen, die regelmäßig angeboten werden. Neue Spieler können sich auf einen Willkommensbonus freuen, der ihre erste Einzahlung verdoppelt und zusätzlich Freispiele beinhaltet. Auch treue Spieler werden mit Reload-Boni, Cashback-Angeboten und VIP-Programmen belohnt.
Die Benutzeroberfläche von Zet Casino wird ebenfalls gelobt, da sie übersichtlich und einfach zu navigieren ist. Spieler können problemlos zwischen den verschiedenen Spielkategorien wechseln und ihre Lieblingsspiele finden. Die mobile Version des Casinos funktioniert einwandfrei und ermöglicht es den Spielern, auch unterwegs zu spielen.
Insgesamt sind die Bewertungen zu Zet Casino größtenteils positiv. Die Spieler schätzen die große Auswahl an Spielen, die großzügigen Boni und die benutzerfreundliche Benutzeroberfläche. Wenn Sie auf der Suche nach einem neuen Online-Casino sind, sollten Sie Zet Casino definitiv eine Chance geben.
https://zetcasino.one/
Cum sa cumperi haine pentru femei de calitate pe site-ul PUMA Moldova? Este simplu si rapid! PUMA Moldova ofera o gama larga de articole vestimentare pentru femei, de la tricouri si pantaloni scurti pana la imbracaminte sport eleganta. Pentru a face achizitii rapide si fara griji, viziteaza [url=https://pumamoldova.md/ro/shop/female/apparel/]haine pentru femei[/url] pe site-ul nostru. Cu doar cateva clicuri, vei avea acces la cele mai recente colectii, realizate din materiale de cea mai inalta calitate si cu designuri trendy. Alege stilul care te reprezinta si completeaza-ti garderoba cu piese deosebite de la PUMA Moldova!Dar ce face experienta de cumparaturi cu adevarat speciala pe site-ul nostru? Pe langa varietatea de produse si calitatea lor impecabila, beneficiezi si de livrare rapida la domiciliu si de o echipa de asistenta prietenoasa si profesionista gata sa raspunda tuturor intrebarilor tale.
Ein wichtiger Aspekt beim Spielen in einem Online-Casino ist die Möglichkeit, von attraktiven Bonusangeboten zu profitieren. Eines der beliebtesten Online-Casinos in Deutschland, das Tipico Casino, bietet seinen Spielern regelmäßig interessante Bonusaktionen an, darunter auch den Casino Freebonus.
Der Casino Freebonus bei Tipico ist eine großartige Möglichkeit, um zusätzliches Geld zum Spielen zu erhalten, ohne dabei eigenes Geld einzahlen zu müssen. Dieser Bonus wird in Form von Freispielen oder Bonusguthaben vergeben und ermöglicht es den Spielern, neue Spiele auszuprobieren oder ihre Lieblingsspiele zu spielen, ohne dabei ihr eigenes Geld zu riskieren.
Um den Casino Freebonus bei Tipico in Anspruch zu nehmen, mГјssen Spieler bestimmte Bedingungen erfГјllen, wie zum Beispiel eine Mindesteinzahlung oder das Erreichen eines bestimmten Umsatzziels. Es ist wichtig, diese Bedingungen vorab zu lesen, um sicherzustellen, dass der Bonus erfolgreich aktiviert werden kann.
Darüber hinaus sollten Spieler darauf achten, dass der Casino Freebonus bei Tipico zeitlich begrenzt ist und innerhalb eines bestimmten Zeitraums genutzt werden muss. Es ist daher ratsam, den Bonus möglichst zeitnah nach der Gutschrift zu nutzen, um von den Vorteilen zu profitieren.
Insgesamt ist der Casino Freebonus bei Tipico eine hervorragende Möglichkeit, um das Spielerlebnis zu verbessern und zusätzliche Gewinnchancen zu erhalten. Mit etwas Glück und Geschick können Spieler ihr Guthaben vervielfachen und tolle Preise gewinnen. Wer also gerne in einem sicheren und seriösen Online-Casino spielt, sollte sich den Casino Freebonus bei Tipico nicht entgehen lassen. Viel Spaß und Erfolg beim Spielen!
https://tipicocasino.one/
blibliblu
Zet Casino Auszahlung Probleme
Das Zet Casino gilt als eines der beliebtesten Online Casinos auf dem Markt. Trotzdem berichten einige Spieler von Auszahlungsproblemen, die sie bei der Beantragung ihrer Gewinne erlebt haben. Dies hat Besorgnis bei den Spielern geweckt und wirft Fragen über die Seriosität des Casinos auf.
Einige Spieler berichten davon, dass ihre Auszahlungen verzögert worden sind oder dass sie die Zahlungen gar nicht erhalten haben. Dies ist natürlich frustrierend für die Spieler, die darauf vertraut haben, ihre Gewinne zeitnah zu erhalten. Einige Spieler haben auch von unklaren Auszahlungsbedingungen berichtet, die zu Verwirrung führen.
Es ist wichtig, dass Online Casinos transparent und fair bei der Auszahlung der Gewinne sind. Spieler sollten sich darauf verlassen können, dass sie ihre Gewinne ohne Probleme und Verzögerungen erhalten. Auszahlungsprobleme können das Vertrauen der Spieler in das Casino erschüttern und langfristig negative Auswirkungen auf das Geschäft haben.
Das Zet Casino sollte daher sicherstellen, dass Auszahlungen schnell und zuverlässig erfolgen und dass die Auszahlungsbedingungen klar und verständlich sind. Es ist wichtig, dass das Casino auf die Bedenken der Spieler eingeht und Lösungen für etwaige Probleme bietet.
Spieler sollten sich bewusst sein, dass es Auszahlungsprobleme in einigen Online Casinos geben kann und daher darauf achten, bei seriösen Anbietern zu spielen. Es ist ratsam, Bewertungen und Erfahrungsberichte anderer Spieler zu lesen, um sicherzustellen, dass das gewählte Casino vertrauenswürdig ist.
Insgesamt ist es zu hoffen, dass das Zet Casino seine Auszahlungsprobleme in den Griff bekommt und seinen Spielern ein positives Spielerlebnis bietet. Transparenz und Fairness sind entscheidend fГјr das Vertrauen der Spieler und das langfristige Wachstum des Casinos.
https://zetcasino.one/
[url=https://www.grainloader.vn.ua]http://grainloader.vn.ua[/url]
Gold Mania Equipment stores a assortment of characteristic fragment loaders opportune for jobs of all shapes and sizes.
http://grainloader.vn.ua
Das Spielen im Casino ist eine beliebte Freizeitbeschäftigung vieler Menschen, die gerne ihr Glück versuchen und auf spannende Spiele setzen. Doch auch wenn es eine unterhaltsame und aufregende Aktivität sein kann, gibt es einige Regeln und Vorschriften, die beachtet werden müssen.
Eines der bekanntesten Online-Casinos in Deutschland ist Tipico, das eine Vielzahl von Spielen und Sportwetten anbietet. Trotz der groГџen Beliebtheit des Anbieters gibt es jedoch eine wichtige Regel, die beachtet werden muss: Das Spielen im Casino ist untersagt fГјr Personen unter 18 Jahren.
Diese Regel ist nicht nur bei Tipico gültig, sondern gilt für alle Casinos und Glücksspielanbieter in Deutschland. Der Grund dafür ist der Schutz von Minderjährigen vor den negativen Auswirkungen des Glücksspiels. Jugendliche sind in der Regel noch nicht in der Lage, die Risiken und Konsequenzen des Glücksspiels richtig einzuschätzen und können daher leicht in eine Spielsucht geraten.
Es ist daher wichtig, dass Eltern und Erziehungsberechtigte darauf achten, dass ihre Kinder nicht illegal im Casino spielen. Auch die Anbieter selbst sind dazu verpflichtet, sicherzustellen, dass minderjährige Spieler keinen Zugang zu ihren Spielen haben.
Wer dennoch gegen diese Regel verstößt und minderjährigen Personen den Zugang zum Casino ermöglicht, muss mit harten Strafen und Konsequenzen rechnen. Denn Glücksspiel für Minderjährige ist nicht nur illegal, sondern kann auch ernste gesundheitliche und soziale Folgen haben.
Daher sollte jeder, der im Casino spielen möchte, verantwortungsbewusst handeln und sich an die geltenden Gesetze und Regeln halten. Nur so kann das Glücksspiel als unterhaltsame Freizeitaktivität genossen werden, ohne dabei in unangenehme Situationen zu geraten.
https://tipicocasino.one/
The way your content captured my attention was simply magical. Keep enchanting us!
Циклёвка паркета: особенности и этапы услуги
Циклёвка паркета — это процесс восстановления внешнего вида паркетного пола путём удаления верхнего повреждённого слоя и возвращения ему первоначального вида. Услуга включает в себя несколько этапов:
Подготовка: перед началом работы необходимо защитить мебель и другие предметы от пыли и грязи, а также удалить плинтусы.
Шлифовка: с помощью шлифовальной машины удаляется старый лак и верхний повреждённый слой древесины.
Шпатлёвка: после шлифовки поверхность паркета шпатлюется для заполнения трещин и выравнивания поверхности.
Грунтовка: перед нанесением лака паркет грунтуется для улучшения адгезии и защиты от плесени и грибка.
Нанесение лака: лак наносится в несколько слоёв с промежуточной шлифовкой между ними.
Полировка: после нанесения последнего слоя лака паркет полируется для придания поверхности блеска и гладкости.
Циклёвка паркета позволяет обновить внешний вид пола, восстановить его структуру и продлить срок службы.
Сайт: ykladka-parketa.ru Циклёвка паркета
Zet Casino: Keine Einzahlung erforderlich
Das Zet Casino ist ein beliebtes Online-Casino, das eine Vielzahl von Spielen und groГџzГјgigen Bonusangeboten fГјr seine Spieler bietet. Eine der beliebtesten Aktionen des Zet Casinos ist der sogenannte “No Deposit Bonus”, bei dem Spieler keine Einzahlung leisten mГјssen, um einen Bonus zu erhalten.
Der No Deposit Bonus im Zet Casino ist eine großartige Möglichkeit für Spieler, das Casino und die angebotenen Spiele risikofrei auszuprobieren. Es handelt sich um eine Art Willkommensbonus, bei dem Spieler nach der Registrierung im Casino einen bestimmten Betrag an Bonusgeld erhalten, ohne dass eine Einzahlung erforderlich ist.
Um den No Deposit Bonus im Zet Casino zu erhalten, müssen sich Spieler lediglich registrieren und ein Konto erstellen. Anschließend wird der Bonus automatisch gutgeschrieben und kann sofort zum Spielen verwendet werden. Auch wenn der Bonus kostenlos ist, unterliegt er in der Regel bestimmten Umsatzbedingungen, bevor eine Auszahlung möglich ist.
Der No Deposit Bonus im Zet Casino ist eine großartige Möglichkeit, um das Casino und die angebotenen Spiele kennenzulernen, ohne eigenes Geld riskieren zu müssen. Spieler können mit dem Bonus verschiedene Spiele ausprobieren und sich mit der Funktionsweise des Casinos vertraut machen.
Insgesamt ist der No Deposit Bonus im Zet Casino eine attraktive Option für Spieler, die neue Online-Casinos ausprobieren möchten, ohne gleich eine Einzahlung tätigen zu müssen. Mit diesem Bonus können Spieler risikofrei spielen und erste Gewinne erzielen, ohne dabei eigenes Geld zu verwenden.
https://zetcasino.one/
Tipico im Casino: Ein gutes Zeichen fГјr Sportwettenfans
Sportwetten sind schon längst kein Nischenthema mehr, sondern erfreuen sich einer immer größeren Beliebtheit. Vor allem in Deutschland boomt der Markt für Sportwetten und entsprechende Anbieter sind in den letzten Jahren wie Pilze aus dem Boden geschossen. Einer dieser Anbieter ist Tipico, der vor allem durch sein Online-Angebot bekannt ist. Doch wussten Sie schon, dass Tipico auch in einigen Casinos vertreten ist?
Das Aufeinandertreffen von Tipico und Casinos mag zunächst ungewöhnlich erscheinen, aber es ergibt durchaus Sinn. Denn Sportwetten und Glücksspiele haben einige Gemeinsamkeiten und es profitieren beide Seiten von einer Kooperation. Besonders für Sportwettenfans bietet die Präsenz von Tipico im Casino viele Vorteile. So können sie ihre Wetten bequem vor Ort platzieren und gleichzeitig das Casino-Flair genießen.
Darüber hinaus bietet Tipico im Casino auch eine Vielzahl von zusätzlichen Services an. So können Kunden beispielsweise auch auf Live-Sportevents wetten oder von attraktiven Bonusaktionen profitieren. Für viele Sportwettenfans ist das ein echtes Highlight und eine willkommene Abwechslung zum reinen Online-Angebot.
Auch im Hinblick auf den Spielerschutz ist die Kooperation von Tipico und Casinos von Vorteil. Denn durch die gemeinsame Präsenz können sich Spieler besser über ihre Limits bewusst werden und gegebenenfalls auch Hilfe bei Problemen in Anspruch nehmen. Die Verbindung von Sportwetten und Glücksspielen schafft somit auch eine Win-win-Situation für alle Beteiligten.
Insgesamt bietet die Präsenz von Tipico im Casino eine spannende Möglichkeit für Sportwettenfans, ihre Leidenschaft für Sport und Wetten mit dem aufregenden Ambiente eines Casinos zu kombinieren. Durch die vielfältigen Services und Angebote wird das Spielerlebnis noch besser und abwechslungsreicher. Wenn Sie also ein Sportwettenfan sind und sich bisher noch nicht ins Casino getraut haben, sollten Sie Tipico definitiv eine Chance geben. Wer weiß, vielleicht entdecken Sie ja eine neue Leidenschaft für sich.
https://tipicocasino.one/
Discovered an interesting article, I suggest you familiarize yourself http://fordtransit.5nx.ru/viewtopic.php?f=25&t=6353
Boomerang Casino ist eines der beliebtesten Online-Casinos, das eine Vielzahl von Spielen und groГџzГјgigen Boni anbietet. Eines der besten Spiele im Casino ist “Miglior Gioco”, das sich als einer der Favoriten der Spieler erwiesen hat.
“Miglior Gioco” ist ein spannendes Spiel, das auf GlГјck und Strategie basiert. Es bietet den Spielern die MГ¶glichkeit, hohe Gewinne zu erzielen und das Spiel zu genieГџen. Der Spielverlauf ist einfach und unkompliziert, so dass auch AnfГ¤nger schnell Erfolg haben kГ¶nnen. Das Spiel ist bekannt fГјr seine Гјberzeugende Grafik und sein fesselndes Gameplay, was es zu einem unverzichtbaren Teil des Boomerang Casinos macht.
Das Spiel “Miglior Gioco” bietet den Spielern auch die MГ¶glichkeit, an verschiedenen Turnieren teilzunehmen und gegen andere Spieler anzutreten. Dies erhГ¶ht den SpaГџ und die Spannung des Spiels und sorgt fГјr eine angenehme Spielerfahrung.
Ein weiterer Vorteil von “Miglior Gioco” im Boomerang Casino sind die groГџzГјgigen Boni und Promotionen, die den Spielern angeboten werden. Diese ermГ¶glichen es den Spielern, ihre Gewinne zu maximieren und ihr Spielerlebnis zu optimieren.
AbschlieГџend lГ¤sst sich sagen, dass “Miglior Gioco” im Boomerang Casino ein absolutes Muss fГјr alle Casino-Liebhaber ist. Mit seiner fesselnden Spielmechanik, der Гјberzeugenden Grafik und den groГџzГјgigen Boni bietet das Spiel eine erstklassige Spielerfahrung, die man nicht verpassen sollte. Besuchen Sie noch heute das Boomerang Casino und entdecken Sie das aufregende Spiel “Miglior Gioco”. Viel SpaГџ und viel GlГјck!
https://boomerangcasino.one/
Fiecare pereche de adidasi Puma este conceputa cu grija pentru a oferi o combinatie perfecta intre design modern si tehnologie avansata. Materialele de cea mai inalta calitate asigura durabilitatea, iar confortul este pus mereu in prim-plan, pentru ca tu sa te simti excelent in fiecare miscare pe care o faci.
Cum sa achizitionezi acesti adidasi minunati? Este simplu si rapid! Acceseaza link-ul nostru si exploreaza colectia noastra de [url=https://pumamoldova.md/ro/shop/male/footwear/shoes/]adidasi[/url]. Adauga in cosul de cumparaturi modelul dorit si completeaza procesul de achizitie in cativa pasi simpli. Livrarea rapida si eficienta iti va aduce adidasii preferati direct la usa ta, pentru ca tu sa te bucuri de ei cat mai curand posibil.
Cand doresti sa cumperi [url=https://pumamoldova.md/ro/shop/male/apparel/]haine[/url] de calitate, site-ul Puma Moldova este locul ideal. Aici gasesti o varietate mare de articole vestimentare care nu doar ca arata bine, dar sunt si confortabile. Navigarea pe site este simpla: selecteaza categoria ‘Barbati’ si apoi ‘imbracaminte’ pentru a vedea produsele disponibile. Fiecare produs are descrieri detaliate si fotografii clare, astfel incat sa poti alege usor ceea ce iti place. Nu uita sa verifici si sectiunea de oferte speciale pentru cele mai bune preturi! Site-ul ofera o varietate de metode de plata, inclusiv carduri de credit si PayPal, pentru a-ti facilita achizitia. De asemenea, poti beneficia de oferte speciale si reduceri la diverse categorii de produse. Nu uita sa te abonezi la newsletter-ul Puma Moldova pentru a primi informatii despre cele mai noi colectii si promotii. Cu Puma Moldova, esti mereu in pas cu moda si confortul.
[url=https://grainloader.vn.ua]grainloader.vn.ua[/url]
Gold Mania Kit stores a assortment of characteristic corn loaders suitable for jobs of all shapes and sizes.
https://grainloader.vn.ua
Das Tipico Casino gehört zu den beliebtesten Online-Casinos in Deutschland. Neben einer breiten Auswahl an Spielen und einer benutzerfreundlichen Plattform bietet das Casino auch lukrative Bonusangebote an. Doch bevor man sich über die Gewinne freuen kann, müssen zunächst die Umsatzbedingungen erfüllt werden.
Die Umsatzbedingungen im Tipico Casino sind fair und transparent gestaltet. Um den Bonus freizuspielen, muss der Betrag in der Regel innerhalb einer bestimmten Frist umgesetzt werden. Diese Frist variiert je nach Aktion und kann zwischen 7 und 30 Tagen liegen. Zudem muss der Bonus- und Einzahlungsbetrag eine bestimmte Anzahl an Malen umgesetzt werden, bevor eine Auszahlung möglich ist.
Beim Freispielen des Bonus sollten Spieler darauf achten, dass nicht alle Spiele gleich stark zum Umsatz beitragen. In der Regel tragen Slots zu 100% bei, während Tisch- und Kartenspiele nur zu einem geringeren Prozentsatz zählen. Es lohnt sich also, vorab die Umsatzbedingungen zu lesen, um seine Einsätze entsprechend zu planen.
Ein weiterer Punkt, den Spieler beachten sollten, sind eventuelle Maximalgewinne, die mit dem Bonus erzielt werden können. Oftmals gibt es eine Obergrenze für die Auszahlung von Gewinnen, die mit Bonusgeldern erzielt wurden. Es ist daher ratsam, sich genau über diese Bedingungen zu informieren, um Enttäuschungen zu vermeiden.
Insgesamt bieten die Umsatzbedingungen im Tipico Casino eine gute Möglichkeit, zusätzliches Guthaben zu erhalten und die Gewinnchancen zu erhöhen. Mit etwas Geschick und einer strategischen Herangehensweise können Spieler die Bedingungen erfolgreich erfüllen und sich über lukrative Gewinne freuen.
https://tipicocasino.one/
Sure, here’s the text with spin syntax applied:
Backlink Structure
After several updates to the G search mechanism, it is vital to employ different approaches for ranking.
Today there is a approach to draw the interest of search engines to your site with the support of incoming links.
Links are not only an efficient advertising instrument but they also have natural visitors, immediate sales from these sources likely will not be, but transitions will be, and it is advantageous visitors that we also receive.
What in the end we get at the end result:
We present search engines site through links.
Prluuchayut natural click-throughs to the site and it is also a indicator to search engines that the resource is used by users.
How we show search engines that the site is profitable:
Links do to the principal page where the main information.
We make links through redirections reliable sites.
The most ESSENTIAL we place the site on sites analytical tools individual tool, the site goes into the cache of these analysis tools, then the acquired links we place as redirects on blogs, forums, comment sections. This important action shows search engines the site map as analyzer sites show all information about sites with all keywords and headlines and it is very BENEFICIAL.
All information about our services is on the website!
Came across an intriguing article – it’s worth your attention, trust me http://politictoday.ru/stavki-na-sport-s-garantirovannyim-vyiigryishem-ot-mostbet-v-uzbekistane
Zet Casino Bonus Code: Das Beste aus Ihrem Casinobesuch herausholen
Wenn Sie auf der Suche nach einem erstklassigen Online Casino sind, dann ist das Zet Casino definitiv einen Besuch wert. Mit einer Vielzahl von hochwertigen Spielen, groГџzГјgigen Boni und einem professionellen Kundenservice bietet das Zet Casino alles, was das Spielerherz begehrt. Doch um das Beste aus Ihrem Casinobesuch herauszuholen, sollten Sie unbedingt den Zet Casino Bonus Code nutzen.
Mit dem Zet Casino Bonus Code haben Sie die Möglichkeit, Ihr Startguthaben zu maximieren und von zusätzlichen Freispielen zu profitieren. Egal, ob Sie ein erfahrener Spieler sind oder gerade erst in die Welt des Online Glücksspiels einsteigen – mit dem Bonus Code von Zet Casino können Sie Ihre Gewinnchancen deutlich erhöhen.
Um den Zet Casino Bonus Code zu nutzen, müssen Sie sich lediglich auf der Website des Casinos anmelden und den Code bei Ihrer Einzahlung eingeben. Sobald Sie dies getan haben, wird Ihr Bonus automatisch aktiviert und Sie können sofort mit dem Spielen beginnen. Vergessen Sie nicht, die Bonusbedingungen zu lesen, um sicherzustellen, dass Sie alle Voraussetzungen erfüllen, um Ihre Gewinne auszahlen zu können.
Neben dem großzügigen Willkommensbonus bietet das Zet Casino auch regelmäßig attraktive Promotionen und Aktionen für seine Spieler an. Halten Sie daher immer die Augen offen, um keine der lukrativen Angebote zu verpassen.
Insgesamt ist der Zet Casino Bonus Code eine großartige Möglichkeit, um das Beste aus Ihrem Casinobesuch herauszuholen. Nutzen Sie diese Chance, um Ihre Gewinnchancen zu steigern und noch mehr Spaß beim Spielen zu haben. Viel Glück und viel Spaß im Zet Casino!
https://zetcasino.one/
Амигуруми – это японское искусство создания игрушек с помощью метода амигуруми. Это слово происходит от японских слов “ами”, означающего вязаный, и “нюгуруми”, что переводится как плюшевая игрушка. Традиционно амигуруми изготавливаются из клубков с использованием крючка. Игрушки амигуруми могут демонстрировать различных персонажей, существ, иллюзорные существа и многое другое. Это популярное привычка, которое имеет свои объединения и любителей по всему миру.
По амигуруми существует множество диаграмм и мастер-классов. В этих материалах представлены пошаговые инструкции по созданию различных игрушек амигуруми. Графики позволяют каждый этап процесса вязания, а инструкции сопровождаются развернутыми учебными материалами. Такие игрушки амигуруми для начинающих можно найти в вебе, на ресурсах по рукоделию, в профильных сообществах и социальных платформах.
Также многие учебники по рукоделию содержат диаграммы и уроки по созданию амигуруми. Искусники в этой области делятся своим опытом и мастерством через книги, видеоуроки и материалы.
Важно выбирать материалы, подходящие вашему уровню практики и интересам. Некоторые материалы рассчитаны на начинающих, предоставляя начальные руководства и мастер-классы, в то время как для более опытных рукодельников доступны более сложные творения и подробные техники.
Zet Casino Free Spins ohne Einzahlung
Das Zet Casino ist bekannt für seine großzügigen Bonusangebote und Promotionen. Unter den vielen tollen Angeboten, die das Casino seinen Spielern bietet, sind die Free Spins ohne Einzahlung besonders beliebt. Diese bieten Spielern die Möglichkeit, kostenlos an ausgewählten Spielautomaten zu drehen und echtes Geld zu gewinnen, ohne dabei eigenes Geld einzusetzen.
Um an diesen begehrten Free Spins teilzunehmen, mГјssen Spieler lediglich ein Konto im Zet Casino erstellen. Nach der Registrierung erhalten sie automatisch eine bestimmte Anzahl von Freispielen, die sie sofort nutzen kГ¶nnen. Diese Free Spins kГ¶nnen an verschiedenen Spielautomaten wie Book of Dead, Starburst oder Gonzo’s Quest eingelГ¶st werden, je nach Angebot des Casinos.
Die Gewinne aus den Free Spins ohne Einzahlung unterliegen in der Regel bestimmten Umsatzbedingungen, die erfüllt werden müssen, bevor eine Auszahlung möglich ist. Diese Bedingungen variieren je nach Aktion und können beispielsweise den 30-fachen Umsatz des Gewinnbetrags erfordern. Es ist daher ratsam, die Bonusbedingungen genau zu lesen, um sicherzustellen, dass man die erforderlichen Anforderungen erfüllt.
Zet Casino Free Spins ohne Einzahlung bieten Spielern eine großartige Möglichkeit, das Casino und seine Spiele risikofrei kennenzulernen. Mit etwas Glück können Spieler mit ihren Freispielen attraktive Gewinne erzielen und so ihr Spielerlebnis noch spannender gestalten. Wer also gerne Spielautomaten spielt und auf der Suche nach kostenlosen Gewinnchancen ist, sollte die aktuellen Free Spins Angebote im Zet Casino genau im Auge behalten.
https://zetcasino.one/
Pentru a cumpara maiouri stilate de la Puma Moldova, accesati [url=https://pumamoldova.md/ro/shop/male/apparel/tee/]maiouri[/url] unde veti gasi o selectie variata, adecvata pentru orice gust. Navigati usor prin categoriile site-ului, alegeti modelele care va plac, si adaugati-le in cos. Alegeti marimea care va convine si procedati la finalizarea comenzii, urmand instructiunile simple. Aceste maiouri, concepute pentru confort si stil, sunt ideale pentru activitati sportive sau pentru purtare zilnica. Profita acum de ofertele noastre pentru a beneficia de produse de calitate superioara.
Das Tipico Casino ist eine beliebte Wahl fГјr Spieler, die auf der Suche nach einem umfangreichen Angebot an Spielautomaten, Tischspielen und Live-Dealer-Spielen sind. Ein besonderes Highlight fГјr Neukunden ist der Tipico Casino Bonus ohne Einzahlung 2018.
Dieser Bonus ermöglicht es neuen Spielern, das Casino risikofrei auszuprobieren, ohne dass eine Einzahlung erforderlich ist. So können Spieler sich mit den verschiedenen Spielen vertraut machen und erste Gewinne erzielen, ohne eigenes Geld einzusetzen.
Um den Tipico Casino Bonus ohne Einzahlung 2018 zu erhalten, mГјssen Spieler lediglich ein Konto bei Tipico registrieren. Nach der erfolgreichen Anmeldung wird der Bonus automatisch gutgeschrieben und kann sofort fГјr Echtgeldspiele verwendet werden.
Es ist jedoch wichtig zu beachten, dass der Bonus bestimmten Umsatzbedingungen unterliegt, die erfüllt werden müssen, bevor Gewinne ausgezahlt werden können. Spieler sollten daher die Bonusbedingungen sorgfältig durchlesen, um sicherzustellen, dass sie alle Anforderungen erfüllen.
Insgesamt ist der Tipico Casino Bonus ohne Einzahlung 2018 eine großartige Möglichkeit für neue Spieler, das Casino kennenzulernen und erste Gewinne zu erzielen, ohne eigenes Geld riskieren zu müssen. Mit einer breiten Auswahl an Spielen und attraktiven Bonusangeboten ist das Tipico Casino definitiv einen Besuch wert.
https://tipicocasino.one/
Your post is a ray of light in the darkness. Thank you for brightening my day in a unique way. Keep shining! ☀️
Creating original articles on Medium and Telegraph, why it is necessary:
Created article on these resources is improved ranked on less frequent queries, which is very significant to get natural traffic.
We get:
organic traffic from search algorithms.
natural traffic from the in-house rendition of the medium.
The webpage to which the article refers gets a link that is valuable and increases the ranking of the webpage to which the article refers.
Articles can be made in any amount and choose all low-frequency queries on your topic.
Medium pages are indexed by search engines very well.
Telegraph pages need to be indexed individually indexer and at the same time after indexing they sometimes occupy places higher in the search engines than the medium, these two platforms are very useful for getting visitors.
Here is a URL to our services where we provide creation, indexing of sites, articles, pages and more.
Tipico Casino Konto geschlossen: Was sind die Gründe dafür und was können betroffene Spieler tun?
Das Tipico Casino ist bei vielen Glücksspielbegeisterten sehr beliebt. Doch was passiert, wenn plötzlich das Konto geschlossen wird? In diesem Artikel gehen wir auf die möglichen Gründe für die Schließung eines Kontos bei Tipico ein und geben Tipps, was betroffene Spieler in dieser Situation tun können.
GrГјnde fГјr die SchlieГџung eines Tipico Casino Kontos
Es gibt verschiedene Gründe, warum ein Konto im Tipico Casino geschlossen werden kann. Zu den häufigsten gehören:
– VerstoГџ gegen die Allgemeinen GeschГ¤ftsbedingungen: Wenn ein Spieler gegen die Regeln des Casinos verstößt, kann dies zur SchlieГџung seines Kontos fГјhren. Dazu gehГ¶ren beispielsweise das BetrГјgen oder das ErГ¶ffnen mehrerer Konten.
– Verdacht auf Spielsucht: Wenn Tipico den Verdacht hat, dass ein Spieler spielsГјchtig ist, kann das Konto aus SicherheitsgrГјnden geschlossen werden.
– Unregelmäßigkeiten bei Auszahlungen: Falls es Unstimmigkeiten bei den Auszahlungen gibt, kann dies ebenfalls zur SchlieГџung des Kontos fГјhren.
Was können betroffene Spieler tun?
Wenn das Konto im Tipico Casino geschlossen wird, ist es wichtig, Ruhe zu bewahren und die Situation zu analysieren. In den meisten Fällen erhalten betroffene Spieler eine E-Mail vom Kundenservice, in der der genaue Grund für die Schließung des Kontos erläutert wird. Es empfiehlt sich, diese E-Mail aufmerksam zu lesen und gegebenenfalls mit dem Kundenservice in Kontakt zu treten, um Unklarheiten zu klären.
Je nach Grund für die Schließung des Kontos gibt es verschiedene Möglichkeiten, wie betroffene Spieler vorgehen können. Falls es sich um ein Missverständnis handelt, kann es helfen, dem Kundenservice entsprechende Nachweise vorzulegen, die die Unschuld des Spielers belegen. Sollte das Konto aufgrund von Spielsuchtverdacht geschlossen worden sein, ist es ratsam, professionelle Hilfe in Anspruch zu nehmen und sich beraten zu lassen.
Fazit
Die Schließung eines Kontos im Tipico Casino kann für betroffene Spieler sehr ärgerlich und frustrierend sein. Dennoch ist es wichtig, Ruhe zu bewahren und die Situation sachlich zu analysieren. Mit ein wenig Geduld und der richtigen Vorgehensweise ist es oft möglich, das Konto wieder zu öffnen oder zumindest eine Lösung zu finden. In jedem Fall ist es ratsam, sich an den Kundenservice von Tipico zu wenden und um Unterstützung zu bitten.
https://tipicocasino.one/
I have no words to describe how your content illuminated my day. Keep being that source of inspiration!
Приветствую всех!
Погрузитесь в мир экономии с нашим онлайн-сервисом купонов и промокодов! Мы предлагаем огромный выбор акций и специальных предложений от лучших магазинов, помогая вам сэкономить на всем, от моды до бытовой техники. Наш удобный интерфейс делает поиск актуальных скидок и промокодов легким и приятным. Подпишитесь на наши уведомления, чтобы быть в курсе последних акций и получать доступ к эксклюзивным предложениям. Не упустите шанс сэкономить больше с каждой покупкой!
Сайт самых свежих и проверенных купонов магазина Acoola http://maxpromokod.ru
Специальные промокоды Voltoff для интернет заказа
Специальные промокоды Huawei свежие и актуальные
Выгодные промокоды Роскосметика онлайн
Специальные промокоды ECCO vip варианты
Свежие промокоды ВсеИнструменты на сегодня
Специальные промокоды Booking.com INT ограниченная серия
Удачных покупок!
Здравствуйте!
Погрузитесь в мир экономии с нашим онлайн-сервисом купонов и промокодов! Мы предлагаем огромный выбор акций и специальных предложений от лучших магазинов, помогая вам сэкономить на всем, от моды до бытовой техники. Наш удобный интерфейс делает поиск актуальных скидок и промокодов легким и приятным. Подпишитесь на наши уведомления, чтобы быть в курсе последних акций и получать доступ к эксклюзивным предложениям. Не упустите шанс сэкономить больше с каждой покупкой!
Сайт самых свежих и проверенных купонов магазина adidas RU http://maxpromokod.ru
Промокоды сети Citycom UA для онлайн-покупок
Ежедневные промокоды интернет магазина KidStore онлайн
Проверенные промокоды Just.ru ограниченная серия
Горячие промокоды KRASOTKAPRO ограниченная серия
Лучшие предложения Tinydeal WW для онлайн-покупок
Эксклюзивные акции МТС ограниченная серия
Удачных покупок!
Оборудование диспетчерских центров [url=http://www.oborudovanie-dispetcherskih-centrov.ru/]http://www.oborudovanie-dispetcherskih-centrov.ru/[/url] .
Tipico Guthaben in Casino Chips
Immer mehr Menschen entscheiden sich dafür, ihr Tipico Guthaben in Casino Chips umzuwandeln, um in den zahlreichen Online Casinos spielen zu können. Doch was bedeutet es, sein Guthaben in Chips umzuwandeln und wie funktioniert dieser Prozess?
Wenn man sein Tipico Guthaben in Casino Chips umwandelt, tauscht man sein virtuelles Guthaben in Spielchips um, die in den Online Casinos als Währung gelten. Man kann diese Chips dann nutzen, um an verschiedenen Spielen wie Slots, Roulette oder Blackjack teilzunehmen. Es ermöglicht den Spielern, das Guthaben besser zu verwalten und sich auf das eigentliche Spiel zu konzentrieren, ohne sich ständig um den aktuellen Kontostand kümmern zu müssen.
Der Prozess, sein Guthaben in Chips umzuwandeln, ist in der Regel sehr einfach. Man muss lediglich die Option “Chips kaufen” im Online Casino auswГ¤hlen und den gewГјnschten Betrag eingeben. AnschlieГџend wird das Guthaben automatisch in Chips umgewandelt und man kann sofort mit dem Spielen beginnen.
Viele Spieler bevorzugen es, ihr Guthaben in Casino Chips umzuwandeln, da es ihnen ein besseres Spielerlebnis bietet. Man kann sich voll und ganz auf das Spiel konzentrieren, ohne von externen Faktoren abgelenkt zu werden. Zudem ermöglicht es eine bessere Kontrolle über das eigene Spielverhalten, da man genau sieht, wie viel man bereits eingesetzt hat und wie viel Guthaben noch verfügbar ist.
Insgesamt ist die Umwandlung von Tipico Guthaben in Casino Chips eine sinnvolle Option für alle, die gerne in Online Casinos spielen. Es bietet eine bessere Kontrolle über das eigene Spielverhalten und ermöglicht ein angenehmeres Spielerlebnis. Wer also sein Glück in Online Casinos versuchen möchte, sollte die Möglichkeit der Umwandlung seines Guthabens in Chips in Betracht ziehen.
https://tipicocasino.one/
link building
Creating hyperlinks is merely equally efficient at present, only the instruments to operate within this domain possess shifted.
You can find many options regarding incoming links, our team utilize some of them, and these strategies function and are actually examined by our team and our customers.
Lately our team conducted an trial and it transpired that less frequent searches from a single website rank nicely in search results, and the result does not require to be your own domain, you can utilize social networks from Web 2.0 collection for this.
It is also possible to partially shift load through web page redirects, giving a diverse link profile.
Go to our own site where our offerings are typically presented with thorough descriptions.
Индексация ссылок на сайте в индексе ру
https://cryptodaily.co.uk/news-in-crypto/crypto-intelligence:banxe-reviews-the-advantages-of-opening-a-business-account/
Die Zet Casino App: Alles, was du wissen musst
Das Zet Casino ist bereits als Online-Casino eine beliebte Anlaufstelle für Glücksspiel-Fans. Mit der Einführung der Zet Casino App haben Spieler nun die Möglichkeit, ihre Lieblingsspiele auch unterwegs zu genießen.
Die App bietet eine Vielzahl von Spielen, darunter Slots, Tischspiele, Live-Casino und Jackpots. Dank der benutzerfreundlichen Oberfläche ist es einfach, durch die verschiedenen Kategorien zu navigieren und seine Lieblingsspiele zu finden. Zudem kann man auch Ein- und Auszahlungen tätigen oder den Kundensupport kontaktieren, alles direkt über die App.
Ein weiterer Vorteil der Zet Casino App ist die Möglichkeit, von unterwegs aus an verschiedenen Aktionen und Bonusangeboten teilzunehmen. So verpasst man keine Gelegenheit, zusätzliche Belohnungen und Freispiele zu erhalten.
Die App ist sowohl fГјr iOS als auch fГјr Android verfГјgbar und kann kostenlos im jeweiligen App Store heruntergeladen werden. Sobald die App installiert ist, kann man sich mit seinen bestehenden Anmeldedaten einloggen oder ein neues Konto erstellen.
Alles in allem bietet die Zet Casino App eine praktische und unterhaltsame Möglichkeit, auch unterwegs in die Welt des Glücksspiels einzutauchen. Probieren Sie es aus und erleben Sie die Spannung und Aufregung des Zet Casinos immer und überall.
https://zetcasino.one/
Found an article that’s definitely worth your time – take a look http://69.bestbb.ru/post.php?fid=1
over at this website [url=https://thetradingview.org]tradingview[/url]
Das Zet Casino ist ein beliebtes Online-Casino, das eine breite Palette von Spielen für seine Spieler anbietet. Einer der Vorteile, die das Zet Casino seinen Spielern bietet, sind die verschiedenen Bonusangebote und Promotionscodes, die sie nutzen können, um ihr Spielerlebnis zu verbessern.
Ein beliebter Bonus, den Spieler im Zet Casino nutzen können, ist der Zet Casino Code. Dieser Code kann bei der Registrierung oder Einzahlung im Casino eingegeben werden und ermöglicht es den Spielern, zusätzliche Belohnungen und Vergünstigungen zu erhalten. Diese können in Form von Bonusgeld, Freispielen oder anderen spannenden Angeboten sein.
Um den Zet Casino Code zu nutzen, müssen die Spieler einfach den Code eingeben, wenn sie dazu aufgefordert werden. Sobald der Code bestätigt wurde, werden die entsprechenden Boni oder Belohnungen automatisch auf das Spielerkonto gutgeschrieben. Spieler können auch regelmäßig auf der Website des Casinos oder in ihrem E-Mail-Posteingang nach neuen Codes und Angeboten suchen, um sicherzustellen, dass sie keine Gelegenheit verpassen.
Es ist wichtig zu beachten, dass jeder Zet Casino Code bestimmte Bedingungen und Anforderungen haben kann, die erfüllt werden müssen, bevor die Belohnungen erhalten werden können. Diese können sich auf die Mindesteinzahlung, den Umsatz oder die Gültigkeitsdauer des Codes beziehen. Spieler sollten daher sicherstellen, dass sie die entsprechenden Geschäftsbedingungen lesen und verstehen, bevor sie einen Code einlösen.
Insgesamt bietet der Zet Casino Code den Spielern eine großartige Möglichkeit, ihr Spielerlebnis zu verbessern und zusätzliche Belohnungen zu erhalten. Indem sie regelmäßig nach neuen Codes und Angeboten suchen und die Bedingungen sorgfältig lesen, können die Spieler das Beste aus ihrem Casinoerlebnis herausholen.
https://zetcasino.one/
Mostbet android
Tipico Casino Free Spins
Das Tipico Casino bietet seinen Kunden eine Vielzahl von aufregenden Spielen und lukrativen Angeboten. Eine der begehrtesten Aktionen sind die Tipico Casino Free Spins, die es den Spielern ermöglichen, kostenlos an ausgewählten Spielautomaten zu spielen.
Diese Freispiele sind eine großartige Möglichkeit, neue Slots auszuprobieren, ohne dabei eigenes Geld riskieren zu müssen. Oftmals werden die Free Spins im Rahmen von speziellen Promotionen vergeben oder als Belohnung für treue Spieler. Manchmal sind sie auch Teil von Willkommensangeboten für neue Kunden.
Um die Tipico Casino Free Spins zu erhalten, mГјssen die Spieler bestimmte Bedingungen erfГјllen. Dies kann beispielsweise eine Mindesteinzahlung oder das Spielen einer bestimmten Anzahl von Runden sein. Die genauen Details der Aktionen werden in den jeweiligen Angeboten auf der Tipico Casino Website bekannt gegeben.
Es ist wichtig, die Teilnahmebedingungen für die Free Spins zu lesen und zu verstehen, um Missverständnisse zu vermeiden. Oftmals sind die Gewinne aus den Freispielen an Umsatzbedingungen gebunden, die erfüllt werden müssen, bevor eine Auszahlung möglich ist.
Alles in allem sind die Tipico Casino Free Spins eine tolle Möglichkeit, um das Casino und seine Spiele kostenlos kennenzulernen und dabei auch noch die Chance auf echte Gewinne zu haben. Es lohnt sich daher, regelmäßig die Promotionsseite des Tipico Casinos zu besuchen, um keine der spannenden Aktionen zu verpassen. Viel Spaß und gute Unterhaltung beim Spielen!
https://tipicocasino.one/
Zet Casino PayNPlay: Ein revolutionäres Zahlungssystem für Online-Glücksspiele
In der Welt der Online-Casinos gibt es ständig neue Innovationen und Technologien, die das Spielerlebnis verbessern und vereinfachen. Eines der neuesten und aufregendsten Entwicklungen ist das PayNPlay-System von Zet Casino. Diese revolutionäre Zahlungsmethode bietet Spielern die Möglichkeit, ohne Registrierung und lästige Verifizierungsprozesse zu spielen.
Das PayNPlay-System funktioniert auf der Grundlage von Trustly, einem führenden Anbieter von Zahlungsdiensten im Internet. Durch die Verknüpfung Ihres Bankkontos mit Ihrem Zet Casino-Konto können Sie jederzeit und überall sofort Geld einzahlen und abheben, ohne lange Wartezeiten oder zusätzliche Gebühren. Dies macht das Spielen im Zet Casino unglaublich bequem und benutzerfreundlich.
Ein weiterer groГџer Vorteil des Zet Casino PayNPlay-Systems ist die Sicherheit, die es bietet. Da Ihre Bankdaten direkt mit dem Casino verbunden sind, mГјssen Sie sich nie Sorgen um die Sicherheit Ihrer Zahlungen machen. Ihre sensiblen Informationen sind geschГјtzt und sicher, wГ¤hrend Sie sich auf das Wesentliche – das Spielen – konzentrieren kГ¶nnen.
Zet Casino bietet eine Vielzahl von beliebten Spielen und Spielautomaten, die von fГјhrenden Softwareanbietern wie NetEnt, Microgaming und Play’n GO bereitgestellt werden. Mit dem PayNPlay-System kГ¶nnen Sie einfach Ihr Lieblingsspiel auswГ¤hlen, eine Einzahlung tГ¤tigen und sofort loslegen, ohne Zeit zu verschwenden.
Insgesamt ist das Zet Casino PayNPlay-System eine großartige Innovation, die das Online-Glücksspiel revolutioniert. Mit seiner Benutzerfreundlichkeit, Sicherheit und Schnelligkeit ist es die perfekte Lösung für Spieler, die ein nahtloses und unkompliziertes Spielerlebnis suchen. Probieren Sie es noch heute aus und entdecken Sie die Zukunft des Online-Glücksspiels!
https://zetcasino.one/
palabraptu
Die Verifizierung im Zet Casino – was Sie darГјber wissen mГјssen
Bevor Sie im Zet Casino spielen können, müssen Sie Ihre Identität verifizieren. Dieser Prozess, auch bekannt als KYC (Know Your Customer), dient dazu, sicherzustellen, dass Sie tatsächlich die Person sind, die Sie vorgeben zu sein. Das Zet Casino verlangt von seinen Spielern, dass sie ihre Identität, Adresse und Zahlungsmethoden verifizieren, um sicherzustellen, dass keine betrügerischen Aktivitäten stattfinden.
Die Verifizierung im Zet Casino erfolgt in der Regel durch das Hochladen bestimmter Dokumente, wie zum Beispiel eine Kopie Ihres Personalausweises, Reisepasses oder Führerscheins, sowie einen Nachweis Ihrer Adresse, wie eine aktuelle Rechnung oder Kontoauszug. Darüber hinaus kann das Casino auch zusätzliche Dokumente anfordern, um Ihr Alter, Ihre Zahlungsmethode oder andere relevante Informationen zu überprüfen.
Es ist wichtig, dass Sie die Verifizierung so schnell wie möglich durchführen, da Ihr Konto erst nach erfolgreicher Prüfung freigeschaltet wird und Sie dann in der Lage sind, Ein- und Auszahlungen vorzunehmen. Außerdem kann das Casino Auszahlungen verzögern oder sogar verweigern, wenn Ihre Identität nicht ordnungsgemäß überprüft wurde.
Die Verifizierung im Zet Casino mag zwar einige zusätzliche Schritte erfordern, dient jedoch letztendlich dazu, Ihre Sicherheit und die Integrität des Casinos zu gewährleisten. Indem Sie Ihre Identität authentifizieren, sind Sie auch vor möglichen Betrugsversuchen geschützt und können sicher sein, dass Ihre persönlichen und finanziellen Daten in guten Händen sind.
Zusammenfassend lässt sich sagen, dass die Verifizierung im Zet Casino ein notwendiger Schritt ist, um ein sicheres und verantwortungsbewusstes Spielerlebnis zu gewährleisten. Stellen Sie sicher, dass Sie alle erforderlichen Dokumente bereithalten und den Anweisungen des Casinos folgen, um Ihre Identität zu verifizieren und das volle Potenzial des Casinos nutzen zu können.
https://zetcasino.one/
Everything You Need to Know
2. Aviator Games: Test Your Flying Skills in this Exciting Challenge
3. Get Ready to Soar: Aviator Games for Thrill Seekers
4. Master the Sky: Aviator Games for Aviation Enthusiasts
5. Take Flight with Aviator Games: A High-Flying Adventure
6. Challenge Yourself with Aviator Games: Are You Ready to Take On the Sky?
7. The Sky’s the Limit: Aviator Games for Daredevils
8. Aviator Games: The Perfect Way to Experience the Thrill of Flying
9. Fly High with Aviator Games: An Exciting Journey Awaits
10. Unleash Your Inner Pilot: Aviator Games for Flying Enthusiasts
11. Reach New Heights with Aviator Games: The Sky Awaits
12. Aviator Games: A Test of Skill and Courage in the Sky
13. Take to the Skies with Aviator Games: A Thrilling Adventure Awaits
14. Aviator Games: Where Every Landing is a Victory
15. Ready for Takeoff: Aviator Games for the Brave and Bold
16. Conquer the Clouds with Aviator Games: A Challenge Like No Other
17. Aviator Games: Prepare for a High-Flying Experience
18. Fly Like a Pro with Aviator Games: The Sky’s the Limit
19. Aviator Games: The Ultimate Test for Aspiring Pilots
20. Soar to New Heights with Aviator Games: Are You Ready for the Challenge?
aviator slot [url=https://aviator-slot-game.org/]aviator slot[/url] .
blublun
1. The Ultimate Aviator Games Guide
aviator casino online [url=https://aviator-slot-game.org/]juego aviador[/url] .
Мы рекомендуем посетить веб-сайт https://kanunnikovao.ru/.
Кроме того, не забудьте добавить сайт в закладки: [url=https://kanunnikovao.ru/]https://kanunnikovao.ru/[/url]
Tipico ist ein beliebtes Online-Casino, das eine Vielzahl von spannenden Spielen und attraktiven Boni bietet. Mit einer benutzerfreundlichen Oberfläche und einer breiten Auswahl an Spielen ist Tipico die perfekte Wahl für Casino-Enthusiasten.
Eine der herausragenden Eigenschaften von Tipico ist die große Auswahl an Spielen. Von klassischen Tischspielen wie Blackjack und Roulette bis hin zu modernen Spielautomaten und Live-Dealer-Spielen bietet Tipico alles, was das Herz eines Casino-Liebhabers begehrt. Darüber hinaus werden regelmäßig neue Spiele hinzugefügt, um sicherzustellen, dass es immer etwas Neues zu entdecken gibt.
Ein weiterer Grund, warum Tipico so beliebt ist, sind die großzügigen Boni und Promotionen. Neue Spieler werden oft mit einem Willkommensbonus begrüßt, der es ihnen ermöglicht, ihr Guthaben zu maximieren und mehr Spiele zu genießen. Darüber hinaus gibt es regelmäßig Aktionen und Wettbewerbe, bei denen Spieler zusätzliche Belohnungen gewinnen können.
Die Sicherheit und Zuverlässigkeit von Tipico sind ebenfalls bemerkenswert. Das Casino verfügt über eine gültige Glücksspiellizenz und verwendet moderne Verschlüsselungstechnologien, um sicherzustellen, dass die persönlichen Daten der Spieler geschützt sind. Darüber hinaus werden alle Spiele regelmäßig auf Fairness überprüft, um sicherzustellen, dass alle Spieler die gleichen Gewinnchancen haben.
Insgesamt ist Tipico ein erstklassiges Online-Casino, das Spielern eine unterhaltsame und sichere Glücksspielumgebung bietet. Mit einer Vielzahl von Spielen, attraktiven Boni und einer einfachen Benutzeroberfläche ist Tipico die ideale Wahl für alle, die nach einem erstklassigen Casino-Erlebnis suchen.
https://tipicocasino.one/
1. The Ultimate Aviator Games Guide
juego aviador [url=https://aviator-slot-game.org/]juego del avion casino[/url] .
Комплект тюнинга MERCEDES BENZ https://autoupgrade.by/
1. The Ultimate Aviator Games Guide
aviator slot [url=https://aviator-slot-game.org/]aviator games[/url] .
Das Tipico Casino ist eine beliebte Plattform fГјr GlГјcksspiele und Unterhaltung im Internet. Egal ob Slots, Tischspiele oder Live-Casino, hier kommen Casino-Fans auf ihre Kosten. Doch was passiert, wenn man plГ¶tzlich die Meldung “Sie haben nicht genГјgend Guthaben” erhГ¤lt?
Diese Situation kann für viele Spieler frustrierend sein. Man hat sich gerade in einen guten Spielrhythmus eingefunden und schon ist das Guthaben aufgebraucht. Doch keine Sorge, es gibt verschiedene Möglichkeiten, um das Guthaben aufzuladen und das Spiel fortzusetzen.
Eine einfache Möglichkeit ist es, eine Einzahlung auf das Casino-Konto vorzunehmen. Hierfür stehen meist verschiedene Zahlungsmethoden wie Kreditkarte, Banküberweisung oder E-Wallets zur Verfügung. Nach einer erfolgreichen Einzahlung kann das Spiel direkt fortgesetzt werden.
Eine weitere Option ist es, eventuelle Boni oder Freispiele zu nutzen. Viele Online-Casinos bieten regelmäßig Promotionen an, bei denen Spieler zusätzliches Guthaben erhalten. Diese können dann genutzt werden, um weiterhin Spaß an den Spielen zu haben.
Zudem ist es wichtig, verantwortungsbewusst mit dem eigenen Guthaben umzugehen. Setzen Sie sich vor dem Spiel eine Grenze fest, die Sie bereit sind zu verlieren. So können Sie sicherstellen, dass das Spielen im Casino immer eine unterhaltsame Erfahrung bleibt.
Insgesamt ist es also wichtig, bei der Meldung “Sie haben nicht genГјgend Guthaben” ruhig zu bleiben und die zur VerfГјgung stehenden Optionen zu nutzen, um das Spiel fortzusetzen. Mit etwas GlГјck und Geschick stehen die Chancen gut, bald wieder im Spiel zu sein und tolle Gewinne zu erzielen. Viel SpaГџ und Erfolg im Tipico Casino!
https://tipicocasino.one/
Здравствуйте!
Наша команда журналистов работает круглосуточно, чтобы предоставить вам самые свежие новости и аналитические обзоры о текущей ситуации в Украине и за рубежом. Мы стараемся охватить как можно больше тем, чтобы вы могли быть в курсе всех важных событий.
Все самое лучшее на сайте https://10minut.info/category/zarubegem/
[url=https://10minut.info/category/ecomomika/]Новости Экономики[/url]
новости атво
последние новости Украины
новости Украины за день
Удачи!
Tipico: Warum wird die Buchung zum Casino blockiert?
Immer wieder taucht bei Nutzern des Online-Casinos von Tipico die Frage auf, warum ihre Buchungen blockiert werden. Dies kann verschiedene Gründe haben und ist meist auf Sicherheitsvorkehrungen zurückzuführen. In diesem Artikel möchten wir genauer auf dieses Thema eingehen und erklären, warum es zu einer Blockierung kommen kann.
Zunächst einmal ist es wichtig zu verstehen, dass Tipico als seriöser Anbieter großen Wert auf die Sicherheit seiner Kunden legt. Aus diesem Grund werden regelmäßig Überprüfungen und Kontrollen durchgeführt, um möglichen Betrug oder Missbrauch zu verhindern. Dies kann dazu führen, dass bestimmte Transaktionen blockiert werden, um das Risiko für die Nutzer zu minimieren.
Ein weiterer Grund für eine Blockierung könnte eine fehlerhafte oder unvollständige Verifizierung des Kontos sein. Um sicherzustellen, dass alle Nutzer volljährig sind und keine Geldwäsche betreiben, ist Tipico gesetzlich verpflichtet, die Identität der Kunden zu überprüfen. Wenn diese Verifizierung nicht vollständig abgeschlossen wurde, kann es zu Schwierigkeiten bei Buchungen kommen.
Auch verdächtige Aktivitäten können dazu führen, dass eine Buchung blockiert wird. Wenn beispielsweise ungewöhnlich hohe Beträge eingezahlt oder ausgezahlt werden, kann dies als Warnzeichen für potenziellen Betrug gesehen werden. In solchen Fällen greift Tipico ein und blockiert die Transaktionen, um die Sicherheit der Nutzer zu gewährleisten.
Um eine Blockierung zu vermeiden, ist es daher ratsam, sein Konto regelmäßig zu verifizieren und verdächtige Aktivitäten zu vermeiden. Sollte es dennoch zu Problemen kommen, steht der Kundenservice von Tipico jederzeit zur Verfügung und hilft gerne bei der Klärung von offenen Fragen.
Insgesamt ist es also wichtig zu verstehen, dass eine Buchung zum Casino von Tipico aus Sicherheitsgründen blockiert werden kann. Durch die Einhaltung der Verifizierungsvorschriften und das Vermeiden verdächtiger Aktivitäten kann man solche Schwierigkeiten jedoch in der Regel umgehen. Tipico legt großen Wert auf die Sicherheit seiner Kunden und möchte ihnen ein sicheres und angenehmes Spielerlebnis bieten.
https://tipicocasino.one/
Das Zet Casino ist ein beliebtes Online-Casino, das eine Vielzahl von Spielen und Promotionen fГјr seine Spieler bietet. Eine der aufregendsten Aktionen im Jahr 2021 ist der Zet Casino Promo-Code, der neuen Spielern groГџzГјgige Boni und Belohnungen bietet.
Als neuer Spieler im Zet Casino können Sie von dem Promo-Code profitieren, der Ihnen einen Willkommensbonus auf Ihre erste Einzahlung gewährt. Dies bedeutet, dass Sie zusätzliches Geld erhalten, um Ihre Lieblingsspiele zu spielen und Ihre Gewinnchancen zu erhöhen.
Darüber hinaus bietet das Zet Casino regelmäßig spezielle Promotionen an, die den Spielern die Möglichkeit geben, zusätzliche Boni, Freispiele und Preise zu gewinnen. Diese Aktionen werden oft über den Newsletter des Casinos oder auf der Website bekannt gegeben, sodass es sich lohnt, regelmäßig nach neuen Angeboten Ausschau zu halten.
Um den Promo-Code im Zet Casino zu nutzen, müssen Sie einfach während der Registrierung oder Einzahlung den angegebenen Code eingeben. Sobald Sie dies getan haben, wird der Bonus automatisch Ihrem Konto gutgeschrieben und Sie können mit dem Spielen beginnen.
Es ist jedoch wichtig zu beachten, dass jeder Bonus im Zet Casino bestimmten Bedingungen und Umsatzanforderungen unterliegt. Bevor Sie den Bonus beantragen, sollten Sie sich daher die Geschäftsbedingungen durchlesen, um sicherzustellen, dass Sie die Bedingungen erfüllen und Ihren Bonus erfolgreich umsetzen können.
Insgesamt bietet der Zet Casino Promo-Code 2021 eine großartige Möglichkeit, zusätzliche Belohnungen und Boni zu erhalten, während Sie Ihre Lieblingsspiele spielen. Wenn Sie also auf der Suche nach einem neuen Online-Casino sind, das großzügige Aktionen anbietet, sollten Sie das Zet Casino auf jeden Fall in Betracht ziehen.
https://zetcasino.one/
Индексация ссылок на сайте vindexe.ru
Wenn Sie gerne Casinospiele online spielen, sollten Sie einen Blick auf den Tipico Casino Bonus Code Gratis werfen. Mit diesem Bonuscode können Sie sich zusätzliche Vorteile sichern und noch mehr Spaß an den Spielen haben.
Der Tipico Casino Bonus Code Gratis ist eine großartige Möglichkeit, um Ihre Gewinne zu steigern und zusätzliche Preise zu gewinnen. Mit diesem Bonuscode erhalten Sie zum Beispiel Freispiele, Bonusguthaben oder andere attraktive Angebote, die Ihnen dabei helfen, noch mehr aus Ihren Einsätzen herauszuholen.
Um den Tipico Casino Bonus Code Gratis zu nutzen, müssen Sie sich einfach auf der Website des Anbieters anmelden und den Code während der Einzahlung eingeben. Sobald Sie dies getan haben, werden Ihnen die zusätzlichen Vorteile automatisch gutgeschrieben und Sie können sofort mit dem Spielen beginnen.
Es ist wichtig zu beachten, dass der Tipico Casino Bonus Code Gratis nur für neue Spieler verfügbar ist und möglicherweise bestimmten Bedingungen unterliegt. Es lohnt sich daher, sich vorab die genauen Anforderungen anzusehen, um sicherzustellen, dass Sie den Bonus optimal nutzen können.
Insgesamt ist der Tipico Casino Bonus Code Gratis eine tolle Möglichkeit, um die Spannung und den Spaß beim Online-Glücksspiel noch weiter zu steigern. Nutzen Sie diese Gelegenheit und sichern Sie sich noch heute Ihren Bonuscode, um von den zusätzlichen Vorteilen zu profitieren. Viel Glück beim Spielen!
https://tipicocasino.one/
booi mobile https://booicasino-telegram.com/
Das Tipico Casino bietet seinen Kunden eine Vielzahl von Spielen, darunter auch die beliebten Leiter Spiele. Diese sorgen fГјr eine spannende und unterhaltsame Casino-Erfahrung und bieten die Chance auf hohe Gewinne.
Die Leiter Spiele im Tipico Casino funktionieren ähnlich wie die klassischen Slot-Spiele, jedoch mit einem zusätzlichen Element: einer Leiter, die den Gewinn multiplizieren kann. Je nach Spiel können Spieler die Leiter mit den richtigen Kombinationen von Symbolen erklimmen und dadurch ihre Gewinne deutlich erhöhen.
Die Leiter Spiele im Tipico Casino zeichnen sich durch ihre einfache Handhabung und ihre vielfältigen Gewinnmöglichkeiten aus. Mit nur wenigen Klicks können Spieler in die spannende Welt der Casino-Leitern eintauchen und ihr Glück versuchen.
Dank der modernen Technologie und der hochwertigen Grafiken im Tipico Casino sind die Leiter Spiele ein visuelles Erlebnis, das die Spieler in seinen Bann zieht. Zudem sorgen spannende Soundeffekte für eine authentische Casino-Atmosphäre, so dass man sich wie in einem echten Casino fühlt.
Die Leiter Spiele im Tipico Casino sind sowohl für Anfänger als auch für erfahrene Spieler geeignet. Dank der flexiblen Einsatzmöglichkeiten und der verschiedenen Spielvarianten findet jeder Spieler das passende Spiel für sich.
Insgesamt bieten die Leiter Spiele im Tipico Casino eine unterhaltsame und aufregende Casino-Erfahrung, die sowohl für Anfänger als auch für erfahrene Spieler geeignet ist. Mit spannenden Gewinnmöglichkeiten und hochwertigen Grafiken sorgen die Leiter Spiele für stundenlangen Spielspaß.
https://tipicocasino.one/
Zet Casino – Das ultimative Online-GlГјcksspielerlebnis
Zet Casino ist ein aufregendes Online-Casino, das Spielern eine Vielzahl von Spielmöglichkeiten bietet. Mit einer großen Auswahl an Spielen, großzügigen Boni und einer benutzerfreundlichen Website ist Zet Casino definitiv eine der besten Optionen für Glücksspiel-Enthusiasten.
Einer der Hauptvorteile von Zet Casino ist die beeindruckende Auswahl an Spielen. Mit Гјber 2000 Spielen von erstklassigen Anbietern wie NetEnt, Microgaming, Play’n GO und vielen anderen, gibt es fГјr jeden Spieler etwas zu entdecken. Von traditionellen Spielautomaten und Tischspielen bis hin zu Live-Casino-Spielen bietet Zet Casino eine Vielzahl von Optionen, die sicherlich jeden Spieler begeistern werden.
Darüber hinaus bietet Zet Casino großzügige Boni und Promotionen, die es Spielern ermöglichen, ihr Spielerlebnis zu maximieren. Neue Spieler werden mit einem Willkommensbonus begrüßt, der zusätzliches Geld und Freispiele für ausgewählte Spiele bietet. Darüber hinaus gibt es regelmäßige Aktionen, wie Einzahlungsboni, Cashback-Angebote und Turniere, die den Spielern zusätzliche Gewinnchancen bieten.
Die Website von Zet Casino ist benutzerfreundlich und übersichtlich gestaltet, was es den Spielern leicht macht, ihre Lieblingsspiele zu finden und zu spielen. Mit einer responsiven Benutzeroberfläche, die auf allen Geräten reibungslos funktioniert, können Spieler ihre Lieblingsspiele jederzeit und überall genießen.
Insgesamt ist Zet Casino eine ausgezeichnete Wahl fГјr alle, die ein unterhaltsames und spannendes Online-GlГјcksspielerlebnis suchen. Mit einer beeindruckenden Auswahl an Spielen, groГџzГјgigen Boni und einer benutzerfreundlichen Website bietet Zet Casino alles, was man sich von einem erstklassigen Online-Casino wГјnschen kann. Probieren Sie es noch heute aus und erleben Sie den Nervenkitzel des GlГјcksspiels bei Zet Casino!
https://zetcasino.one/
Мы рекомендуем посетить веб-сайт https://church-bench.ru/.
Кроме того, не забудьте добавить сайт в закладки: [url=https://church-bench.ru/]https://church-bench.ru/[/url]
Tipico ist eine der bekanntesten Wettanbieter in Deutschland. Viele Menschen verbinden Tipico mit Sportwetten, jedoch gibt es immer wieder Verwirrung darГјber, ob Tipico auch ein Casino anbietet. Die Antwort darauf ist: Nein, Tipico ist kein Casino.
Auch wenn auf der Webseite von Tipico einige Casinospiele wie Slots und Tischspiele angeboten werden, handelt es sich dabei um virtuelle Spiele, die nicht um echtes Geld gespielt werden können. Tipico konzentriert sich hauptsächlich auf Sportwetten und hat sich in diesem Bereich einen Namen gemacht.
Für Menschen, die gerne Casinospiele spielen möchten, gibt es in Deutschland viele andere Anbieter, die eine große Auswahl an Spielen und Möglichkeiten bieten. Es ist wichtig, sich vor der Anmeldung bei einem Online-Casino über die Seriosität und Sicherheit des Anbieters zu informieren.
Insgesamt lässt sich sagen, dass Tipico kein Casino ist und sich stattdessen auf Sportwetten spezialisiert hat. Wer gerne Casinospiele spielt, sollte sich nach anderen Anbietern umsehen, die speziell auf dieses Segment ausgerichtet sind.
https://tipicocasino.one/
Das Thema Zet Casino Betrug ist in der Glücksspielbranche ein heiß diskutiertes Thema. Viele Spieler haben Bedenken, ob sie in diesem Online-Casino sicher spielen können oder ob es möglicherweise zu betrügerischen Aktivitäten kommen könnte.
Das Zet Casino ist eine beliebte Online-GlГјcksspielseite, die eine Vielzahl von Spielen wie Spielautomaten, Tischspielen und Live-Casino-Spielen anbietet. Es ist in der Curacao lizenziert und wird von der Araxio Development N.V. betrieben. Obwohl das Casino eine Lizenzierung und Regulierung hat, gibt es immer noch Bedenken hinsichtlich der Transparenz und Fairness der Spiele.
Einige Spieler haben behauptet, dass das Zet Casino betrügerische Geschäftspraktiken anwendet, um Spieler um ihr Geld zu bringen. Dazu gehören verzögerte Auszahlungen, manipulierte Spiele und unfaire Bonusbedingungen. Diese Vorwürfe haben zu einer erhöhten Skepsis gegenüber dem Casino geführt und viele Spieler denken zweimal nach, bevor sie dort spielen.
Es ist wichtig zu beachten, dass es sich bei diesen Behauptungen um Anschuldigungen handelt und es keine konkreten Beweise fГјr Betrug im Zet Casino gibt. Dennoch ist es ratsam, vorsichtig zu sein und sich Гјber die Reputation des Casinos zu informieren, bevor man dort spielt.
Um sich vor möglichen Betrügereien zu schützen, sollten Spieler immer auf seriöse und lizenzierte Online-Casinos setzen. Es ist ratsam, Bewertungen und Erfahrungsberichte anderer Spieler zu lesen und sich über die Sicherheitsmaßnahmen eines Casinos zu informieren, bevor man eine Einzahlung tätigt.
Insgesamt ist es wichtig, verantwortungsbewusst zu spielen und sich vor möglichen Betrügereien zu schützen. Das Zet Casino mag viele spannende Spiele und lukrative Boni bieten, aber Spieler sollten immer darauf achten, dass sie in einem sicheren und vertrauenswürdigen Umfeld spielen.
https://zetcasino.one/
Backlink creation is simply as efficient now, just the instruments for working in this field possess shifted.
You can find numerous options to incoming links, our company employ several of them, and these methods function and have been tested by our team and our clientele.
Lately our company carried out an test and it turned out that low-frequency searches from a single domain name ranking well in online searches, and the result does not have to be your personal domain name, it is possible to make use of social networks from web2.0 range for this.
It additionally possible to partially transfer load through web page redirects, giving a diverse link profile.
Head over to our own website where our own solutions are actually offered with comprehensive descriptions.
Stumbled upon a captivating article – definitely take a look! http://mybaltika.info/ru/blogs/587/9133/
cululutata
https://microbladingeyebrowsalon.com/
Wenn es um Online-Casinos geht, bietet Tipico eines der besten Angebote fГјr Spieler an. Mit einer groГџen Auswahl an Spielen, attraktiven Bonusangeboten und einer benutzerfreundlichen Plattform ist Tipico Classic Casino eine beliebte Wahl fГјr Spieler auf der ganzen Welt.
Ein besonders begehrtes Feature bei Tipico Classic Casino ist der Bonuscode, der es Spielern ermöglicht, zusätzliche Belohnungen und Vergünstigungen zu erhalten. Der Bonuscode kann bei der Registrierung oder Einzahlung eingegeben werden und wird in der Regel mit einem bestimmten Betrag an Bonusgeld belohnt.
Es ist wichtig zu beachten, dass Bonuscodes in der Regel mit bestimmten Bedingungen und Anforderungen verbunden sind, die vom Casino festgelegt werden. Diese können eine Mindesteinzahlung, eine bestimmte Anzahl von Einsätzen oder andere Kriterien umfassen, die erfüllt werden müssen, um den Bonus zu erhalten.
Um den bestmöglichen Nutzen aus dem Bonuscode zu ziehen, ist es ratsam, die Allgemeinen Geschäftsbedingungen sorgfältig zu lesen und sicherzustellen, dass alle Anforderungen erfüllt sind. Auf diese Weise können Spieler sicher sein, dass sie den vollen Nutzen aus dem Bonuscode ziehen und ihr Spielerlebnis bei Tipico Classic Casino optimieren können.
Insgesamt bietet der Bonuscode von Tipico Classic Casino Spielern eine großartige Möglichkeit, zusätzliche Belohnungen und Vergünstigungen zu erhalten. Mit einer breiten Palette von Spielen, lukrativen Bonusangeboten und einer benutzerfreundlichen Plattform ist Tipico Classic Casino definitiv eine gute Wahl für Casino-Enthusiasten.
https://tipicocasino.one/
Zet Casino Freispiele: Mehr SpaГџ und Gewinnchancen beim Online-GlГјcksspiel
Wenn es um Online-Casinos geht, ist Zet Casino eine der Top-Adressen für Glücksspiel-Fans. Mit einer Vielzahl von Spielen, attraktiven Bonusangeboten und tollen Aktionen, bietet Zet Casino ein erstklassiges Spielerlebnis. Eine Besonderheit sind die Zet Casino Freispiele, die regelmäßig an die Spieler vergeben werden und für zusätzliche Spannung und Gewinnchancen sorgen.
Freispiele sind eine beliebte Form von Boni in Online-Casinos, da sie den Spielern die Möglichkeit geben, kostenlos an ausgewählten Spielautomaten zu drehen, ohne dabei eigenes Geld einzusetzen. Bei Zet Casino können Spieler diese Freispiele bei verschiedenen Aktionen erhalten, zum Beispiel als Willkommensbonus für neue Spieler, als Belohnung für regelmäßige Einzahlungen oder als Teil von speziellen Promotionen.
Die Freispiele bei Zet Casino kГ¶nnen fГјr eine Vielzahl von Spielautomaten genutzt werden, darunter beliebte Titel wie Starburst, Book of Dead, Gonzo’s Quest und viele mehr. Dadurch haben die Spieler die MГ¶glichkeit, neue Spiele auszuprobieren oder ihre Lieblingsslots mit zusГ¤tzlichen Chancen auf Gewinne zu spielen.
Um die Freispiele bei Zet Casino zu erhalten, müssen die Spieler bestimmte Umsatzbedingungen erfüllen, die von der jeweiligen Aktion abhängen. In der Regel müssen die Gewinne aus den Freispielen mehrmals umgesetzt werden, bevor sie ausgezahlt werden können. Es ist daher wichtig, die Bonusbedingungen genau zu lesen und zu verstehen, um Missverständnisse und Enttäuschungen zu vermeiden.
Insgesamt bieten die Zet Casino Freispiele den Spielern die Möglichkeit, ihr Glück auf unterhaltsame Weise zu versuchen und dabei tolle Gewinne zu erzielen. Mit einer großen Auswahl an Spielen, fairen Bonusbedingungen und einem professionellen Kundenservice, ist Zet Casino eine hervorragende Wahl für alle, die das Beste aus ihrem Online-Glücksspiel-Erlebnis herausholen möchten. Werfen Sie also einen Blick auf die aktuellen Aktionen und sichern Sie sich Ihre Freispiele bei Zet Casino!
https://zetcasino.one/
можно ли разорвать контракт сво
С началом СВО уже спустя полгода была объявлена первая волна мобилизации. При этом прошлая, в последний раз в России была аж в 1941 году, с началом Великой Отечественной Войны. Конечно же, желающих отправиться на фронт было не много, а потому люди стали искать способы не попасть на СВО, для чего стали покупать справки о болезнях, с которыми можно получить категорию Д. И все это стало возможным с даркнет сайтами, где можно найти практически все что угодно. Именно об этой отрасли темного интернета подробней и поговорим в этой статье.
article source [url=https://obs-project.org]Obs[/url]
Das Tipico Casino ist eine beliebte Online-Glücksspielplattform, die eine breite Auswahl an Spielen und großzügige Bonusangebote für ihre Spieler bietet. In diesem Artikel werden wir die Bewertung des Tipico Casinos näher betrachten.
Das Casino bietet eine Vielzahl von Spielen, darunter klassische Tischspiele wie Roulette und Blackjack, sowie eine große Auswahl an Spielautomaten von renommierten Anbietern wie NetEnt und Microgaming. Die Spiele sind sowohl auf dem Desktop als auch auf mobilen Geräten verfügbar und bieten ein reibungsloses Spielerlebnis ohne lange Ladezeiten.
Ein weiterer Pluspunkt des Tipico Casinos sind die großzügigen Bonusangebote, die regelmäßig angeboten werden. Neue Spieler können sich über einen Willkommensbonus freuen, der ihnen zusätzliches Guthaben oder Freispiele bietet. Zusätzlich gibt es auch regelmäßige Aktionen wie Reload-Boni und Cashback-Angebote für treue Spieler.
Die Sicherheit und Seriosität des Tipico Casinos sind ebenfalls lobenswert. Das Casino besitzt eine Lizenz der Malta Gaming Authority, einer der angesehensten Regulierungsbehörden in der Glücksspielbranche. Die Datenübertragung erfolgt verschlüsselt, um die persönlichen Informationen der Spieler zu schützen, und das Casino setzt sich für verantwortungsbewusstes Spielen ein.
Insgesamt lässt sich sagen, dass das Tipico Casino eine gute Wahl für Online-Spieler ist. Mit einer vielfältigen Auswahl an Spielen, großzügigen Bonusangeboten und einer hohen Sicherheitsstandards hat das Casino viel zu bieten. Daher können wir das Tipico Casino mit gutem Gewissen weiterempfehlen.
https://tipicocasino.one/
click this over here now [url=https://my-sollet.com]sollet wallet[/url]
Читайте больше о выборе машины здесь
Zet Casino Sportwetten
Sportwetten erfreuen sich in Deutschland immer größerer Beliebtheit. Neben den traditionellen Wettbüros vor Ort bieten auch Online-Casinos wie das Zet Casino Sportwetten an. Das Zet Casino ist ein beliebtes Online-Casino, das seinen Kunden eine Vielzahl von Spielen und Wetten anbietet.
Das Zet Casino Sportwettenangebot umfasst eine breite Palette von Sportarten, darunter Fußball, Tennis, Basketball, Eishockey und vieles mehr. Die Kunden haben die Möglichkeit, auf einzelne Spiele, Turniere oder ganze Ligen zu wetten. Neben den klassischen Sportwetten bietet das Zet Casino auch Live-Wetten an, bei denen die Kunden während des Spiels ihre Wetten platzieren können.
Das Online-Casino zeichnet sich durch eine benutzerfreundliche Oberfläche aus, die es den Kunden ermöglicht, schnell und einfach ihre Wetten abzugeben. Zudem bietet das Zet Casino eine Vielzahl von Zahlungsmethoden an, darunter Kreditkarten, E-Wallets und Banküberweisungen.
Ein weiterer Vorteil des Zet Casino Sportwettenangebots sind die attraktiven Quoten und Boni, die den Kunden angeboten werden. So können die Kunden von lukrativen Einzahlungsboni, Freiwetten und anderen Aktionen profitieren.
Insgesamt bietet das Zet Casino Sportwetten eine unterhaltsame und spannende Möglichkeit, sich mit Sportereignissen zu beschäftigen und möglicherweise auch den ein oder anderen Gewinn zu erzielen. Wer also auf der Suche nach einem Online-Casino mit einem breiten Sportwettenangebot ist, sollte das Zet Casino in Betracht ziehen.
https://zetcasino.one/
find out here now [url=https://deltaexploits.org]sakpot-delta[/url]
Грезите о незабываемых приключениях на Байкале? Ищете уникальные возможности для экскурсий, чтобы окунуться в мир природы и истории этого великолепного региона? FanatBaikala.ru предлагает вам множество захватывающих вариантов!
Одно из них – [url=https://fanatbaikala.ru/excursions]бухта песчаная экскурсия из Листвянки[/url], которая погрузит вас в невероятную атмосферу природы и красоты Байкала. Погрузитесь в мир удивительных пейзажей и ощутите величие этого водного простора.
Другой вариант – [url=https://fanatbaikala.ru/excursions]из Иркутска на Байкал экскурсии однодневные[/url], которые предлагаются на FanatBaikala.ru. Они позволят вам увидеть Байкал совершенно с новой стороны и оценить всю его красоту и уникальность за один день.
Выберите идеальную экскурсию для себя на FanatBaikala.ru и ощутите всю магию и великолепие Байкала!
Погружение в волшебный мир Байкала – это не просто путешествие, а настоящее приключение, которое оставит незабываемые впечатления на всю жизнь. Именно это мы нашли на сайте [url=https://fanatbaikala.ru/tours]байкал туры 2024[/url]. Здесь представлены самые захватывающие и уникальные туры на Байкал, которые позволят окунуться в атмосферу дикой природы и удивительных видов.
Каждый тур на сайте FanatBaikala.ru – это возможность открыть для себя что-то новое и удивительное. От прогулок по кристально чистому льду Байкала до захватывающих путешествий на снегоходах по его берегам – здесь есть маршруты на любой вкус и предпочтения.
Особенно впечатляют [url=https://fanatbaikala.ru/tours]байкал туры 2024 цены[/url] – они доступны каждому, кто мечтает о незабываемом отдыхе на берегах самого глубокого озера на планете. Не упустите свой шанс окунуться в мир удивительных приключений с FanatBaikala.ru!
Tipico exklusiver Casino Bonus
Tipico ist einer der bekanntesten und beliebtesten Online-Casinos im deutschsprachigen Raum. Das Unternehmen hat sich einen exzellenten Ruf erarbeitet, vor allem dank seines umfangreichen Spielangebots, Sicherheitsstandards und attraktiven Bonusangeboten. Einer der besten GrГјnde, sich bei Tipico anzumelden, ist der exklusive Casino Bonus, den das Unternehmen seinen Kunden bietet.
Der exklusive Casino Bonus von Tipico ist ein besonderes Angebot, das nur für ausgewählte Spieler verfügbar ist. Um diesen Bonus zu erhalten, müssen Spieler die speziellen Aktionscodes verwenden, die regelmäßig auf der Website des Casinos veröffentlicht werden. Mit diesem Bonus können Spieler ihre Einzahlungen im Casino um einen bestimmten Prozentsatz erhöhen und dadurch mehr Geld zum Spielen zur Verfügung haben.
Der exklusive Casino Bonus von Tipico bietet den Spielern eine großartige Gelegenheit, ihre Lieblingsspiele zu genießen und gleichzeitig ihre Gewinnchancen zu erhöhen. Mit zusätzlichem Geld auf dem Konto können Spieler länger spielen und mehr Gewinne erzielen. Darüber hinaus bietet der Bonus auch die Möglichkeit, neue Spiele auszuprobieren und das Casino näher kennenzulernen, ohne dabei das eigene Budget übermäßig zu strapazieren.
Um den exklusiven Casino Bonus von Tipico zu beanspruchen, müssen Spieler einfach den Aktionscode bei ihrer Einzahlung verwenden und schon wird der Bonus automatisch gutgeschrieben. Es ist wichtig zu beachten, dass der Bonus bestimmten Umsatzbedingungen unterliegt, die erfüllt werden müssen, bevor Gewinne ausgezahlt werden können. Diese Bedingungen sind jedoch fair und transparent und sorgen dafür, dass Spieler einen fairen und unterhaltsamen Spielverlauf haben.
Insgesamt ist der exklusive Casino Bonus von Tipico eine großartige Möglichkeit, das Spielerlebnis zu verbessern und gleichzeitig die Gewinnchancen zu erhöhen. Mit attraktiven Angeboten wie diesem zeigt das Unternehmen sein Engagement für seine Kunden und beweist einmal mehr, warum es zu den besten Online-Casinos in der Branche gehört. Wer also auf der Suche nach einem hochwertigen Casinoerlebnis ist, sollte sich unbedingt bei Tipico anmelden und den exklusiven Casino Bonus in Anspruch nehmen.
https://tipicocasino.one/
I strongly recommend stay away from this site. The experience I had with it has been purely frustration as well as doubts about scamming practices. Be extremely cautious, or alternatively, seek out a more reputable platform for your needs.
дайсон фен купить [url=https://www.dyson-feny.com/]https://www.dyson-feny.com/[/url] .
Die Tipico App ist eine der beliebtesten Anwendungen für Sportwetten und Casino-Spiele unter deutschen Spielern. Mit der App können Nutzer ganz bequem von ihrem Smartphone oder Tablet aus auf ein vielfältiges Angebot von Spielen und Wetten zugreifen. Doch wie funktioniert es eigentlich, Geld auf das Casino-Konto in der Tipico App einzuzahlen?
Um Geld auf sein Casino-Konto bei Tipico einzuzahlen, stehen den Nutzern verschiedene Zahlungsmethoden zur Verfügung. Dazu gehören unter anderem die klassische Banküberweisung, Kreditkarten wie Visa oder Mastercard, sowie E-Wallets wie PayPal, Skrill oder Neteller. Die Einzahlung erfolgt dabei ganz einfach über die Kasse in der App, wo die Nutzer ihre bevorzugte Zahlungsmethode auswählen und den gewünschten Betrag eingeben können. Nach Bestätigung der Einzahlung wird das Geld umgehend auf dem Casino-Konto gutgeschrieben und die Spieler können direkt mit dem Spielen beginnen.
Ein großer Vorteil der Tipico App ist die hohe Sicherheit bei Ein- und Auszahlungen. Die App verfügt über eine SSL-Verschlüsselung, um die sensiblen Zahlungsdaten der Nutzer zu schützen. Zudem arbeitet Tipico nur mit seriösen Zahlungsdienstleistern zusammen, um einen reibungslosen und zuverlässigen Geldtransfer zu gewährleisten.
Für Einzahlungen auf das Casino-Konto bei Tipico stehen den Nutzern in der Regel keine Gebühren bevor. Allerdings kann es vorkommen, dass der ausgewählte Zahlungsdienstleister Gebühren erhebt, über die die Nutzer im Voraus informiert werden sollten. Die Mindest- und Höchsteinzahlungsbeträge können je nach Zahlungsmethode variieren und sind in den Geschäftsbedingungen von Tipico aufgeführt.
Insgesamt bietet die Tipico App eine sichere und bequeme Möglichkeit, Geld auf das Casino-Konto einzuzahlen und spannende Spiele zu genießen. Mit einer Vielzahl an Zahlungsmethoden und einem zuverlässigen Kundensupport steht dem Spielspaß nichts im Wege. Also nichts wie los und probiere es selbst aus!
https://tipicocasino.one/
Zet Casino Bonus Code ohne Einzahlung
Online Casinos erfreuen sich immer größerer Beliebtheit, nicht zuletzt aufgrund der vielfältigen Bonusangebote, die sie ihren Spielern bieten. Ein besonders attraktives Angebot ist der Zet Casino Bonus Code ohne Einzahlung.
Was genau verbirgt sich hinter diesem Angebot? Ganz einfach: Spieler können sich bei Zet Casino registrieren und erhalten einen Bonus ohne vorherige Einzahlung. Dieser Bonus kann in Form von Freispielen, Bonusgeld oder anderen Vergünstigungen angeboten werden. Dadurch haben Spieler die Möglichkeit, das Casino und die angebotenen Spiele risikofrei kennenzulernen, ohne dabei ihr eigenes Geld einzusetzen.
Der Zet Casino Bonus Code ohne Einzahlung bietet somit eine ideale Möglichkeit, um sich von den Vorzügen des Casinos zu überzeugen, ohne dabei ein finanzielles Risiko einzugehen. Spieler haben die Chance, die verschiedenen Spiele auszuprobieren, sich mit dem Casino vertraut zu machen und erste Gewinne zu erzielen, ohne dafür eigenes Geld einzahlen zu müssen.
Um den Zet Casino Bonus Code ohne Einzahlung zu erhalten, müssen Spieler lediglich einen entsprechenden Bonuscode bei der Registrierung eingeben. Dieser wird in der Regel auf der Website des Casinos veröffentlicht oder per E-Mail an registrierte Spieler versendet. Nach der Eingabe des Bonuscodes wird der Bonus automatisch auf das Spielerkonto gutgeschrieben und kann sofort verwendet werden.
Es ist jedoch wichtig zu beachten, dass auch bei einem Bonus ohne Einzahlung bestimmte Umsatzbedingungen gelten können. Diese legen fest, wie oft der Bonus umgesetzt werden muss, bevor eine Auszahlung möglich ist. Es ist daher ratsam, die Bonusbedingungen genau zu lesen, bevor man sich für einen Bonus ohne Einzahlung entscheidet.
Insgesamt bietet der Zet Casino Bonus Code ohne Einzahlung eine attraktive Möglichkeit, um das Casino risikofrei kennenzulernen und erste Gewinne zu erzielen. Spieler sollten jedoch darauf achten, die Bonusbedingungen zu beachten und verantwortungsvoll mit dem Angebot umzugehen. Wer diese Tipps beherzigt, kann von den Vorzügen des Zet Casino Bonus Codes ohne Einzahlung profitieren und seine Gewinnchancen deutlich erhöhen.
https://zetcasino.one/
blibli
May I just say what a relief to uncover a person that really understands what they are discussing online. You actually know how to bring an issue to light and make it important. More people need to look at this and understand this side of your story. I was surprised that you’re not more popular since you surely possess the gift.
https://maps.google.hr/url?q=https://www.openlearning.com/u/vincentshapiro-scybf7/blog/0
Грезите о незабываемых приключениях на Байкале? Ищете уникальные возможности для экскурсий, чтобы окунуться в мир природы и истории этого великолепного региона? FanatBaikala.ru предлагает вам множество захватывающих вариантов!
Одно из них – [url=https://fanatbaikala.ru/excursions]бухта песчаная экскурсия из Листвянки[/url], которая погрузит вас в невероятную атмосферу природы и красоты Байкала. Погрузитесь в мир удивительных пейзажей и ощутите величие этого водного простора.
Другой вариант – [url=https://fanatbaikala.ru/excursions]из Иркутска на Байкал экскурсии однодневные[/url], которые предлагаются на FanatBaikala.ru. Они позволят вам увидеть Байкал совершенно с новой стороны и оценить всю его красоту и уникальность за один день.
Выберите идеальную экскурсию для себя на FanatBaikala.ru и ощутите всю магию и великолепие Байкала!
Zet Casino Geld zurГјckfordern
In der Welt der Online-Glücksspiele kann es vorkommen, dass Spieler Schwierigkeiten haben, ihr Geld zurückzufordern. Dies kann verschiedene Gründe haben, wie etwa technische Probleme, fehlerhafte Transaktionen oder Streitigkeiten mit dem Casino-Anbieter. In solchen Fällen ist es wichtig, als Spieler die richtigen Schritte zu unternehmen, um sein Geld zurückzufordern.
Eines der Casinos, bei dem Spieler auf solche Probleme stoßen können, ist das Zet Casino. Obwohl es sich um ein beliebtes Online-Casino handelt, kann es vorkommen, dass Spieler Schwierigkeiten haben, ihr Geld zurückzufordern. Dies kann frustrierend sein, insbesondere wenn es sich um größere Summen handelt.
Wenn Sie also Schwierigkeiten haben, Ihr Geld vom Zet Casino zurückzufordern, gibt es einige Schritte, die Sie unternehmen können. Zunächst sollten Sie Kontakt mit dem Kundenservice des Casinos aufnehmen und das Problem schildern. Oftmals können die Mitarbeiter des Casinos Ihnen weiterhelfen und das Problem lösen.
Wenn der Kundenservice des Zet Casinos nicht weiterhelfen kann, können Sie sich auch an die Glücksspielbehörde wenden, die das Casino reguliert. Diese Behörde kann Ihnen dabei helfen, Ihr Geld zurückzufordern und das Problem mit dem Casino-Anbieter zu lösen.
Es ist wichtig, dass Sie als Spieler Ihre Rechte kennen und darauf bestehen, dass Ihnen Ihr Geld zurückgezahlt wird, wenn es Ihnen rechtmäßig zusteht. Wenn Sie also Schwierigkeiten haben, Ihr Geld vom Zet Casino zurückzufordern, sollten Sie die oben genannten Schritte unternehmen, um Ihr Geld zurückzuerlangen.
Insgesamt ist es wichtig, als Spieler immer wachsam zu sein und darauf zu achten, dass Ihre Einlagen und Gewinne sicher sind. Wenn Sie Probleme haben, Ihr Geld vom Zet Casino zurückzufordern, zögern Sie nicht, die oben genannten Schritte zu unternehmen und Ihr Geld zurückzuholen.
https://zetcasino.one/
[url=https://wow.unsimpleworld.com/]шаблон сайта вов[/url] – dota2 шаблон сайта, опен кейс шаблон сайта
[url=https://wow.unsimpleworld.com/]создание сайта World of Warcraft[/url] – дизайн сайта WoW, разработка сайта Lineage 2
Das Tipico Casino SH bietet seinen Spielern ein einzigartiges Spielerlebnis, das sowohl spannend als auch unterhaltsam ist. Mit einer Vielzahl von Casino-Spielen, darunter Slots, Tischspiele und Live-Casino-Optionen, gibt es fГјr jeden Geschmack etwas zu entdecken.
Das Casino ist Teil der renommierten Tipico-Gruppe, die für ihre Erfahrung und Professionalität im Bereich des Online-Glücksspiels bekannt ist. Die Spieler können daher sicher sein, dass sie in einem sicheren und fairen Umfeld spielen, das alle erforderlichen Lizenzen und Sicherheitsmaßnahmen hat.
Eine der besten Funktionen des Tipico Casino SH ist die Möglichkeit, auch unterwegs zu spielen. Die mobile App des Casinos ermöglicht es den Spielern, ihre Lieblingsspiele von überall aus zu genießen, solange sie eine Internetverbindung haben.
Darüber hinaus bietet das Casino regelmäßig lukrative Aktionen und Boni für seine Spieler an. Diese können von Freispielen über Einzahlungsboni bis hin zu speziellen Turnieren reichen, die die Spieler die Chance geben, zusätzliche Gewinne zu erzielen.
Insgesamt bietet das Tipico Casino SH eine vollständige und vielseitige Spielerfahrung für alle, die auf der Suche nach hochwertigen Casino-Spielen sind. Mit einer benutzerfreundlichen Oberfläche, einer großen Auswahl an Spielen und spannenden Aktionen ist das Casino auf jeden Fall einen Besuch wert.
https://tipicocasino.one/
ремонт google pixel
Zet Casino Online: Ein aufregendes Erlebnis fГјr GlГјcksspiel-Fans
Das Zet Casino ist eine Online-Glücksspielplattform, die Spielern aus der ganzen Welt die Möglichkeit bietet, ihre Lieblingsspiele bequem von zu Hause aus zu genießen. Mit einer breiten Auswahl an Slots, Tischspielen und Live-Casino-Spielen ist für jeden Geschmack und jede Vorliebe etwas dabei.
Ein besonderes Merkmal des Zet Casinos ist die benutzerfreundliche Oberfläche, die es den Spielern ermöglicht, problemlos auf die verschiedenen Spiele und Funktionen zuzugreifen. Darüber hinaus bietet die Plattform eine Vielzahl von Bonusangeboten und Promotionen, die das Spielerlebnis noch aufregender machen.
Ein weiterer Vorteil des Zet Casinos ist die Vielzahl von Zahlungsmethoden, die den Spielern zur Verfügung stehen. Von Kreditkarten über E-Wallets bis hin zu Kryptowährungen gibt es für jeden Spieler die passende Option, um Ein- und Auszahlungen schnell und sicher abzuwickeln.
Darüber hinaus legt das Zet Casino großen Wert auf Kundenservice und Sicherheit. Das Support-Team ist rund um die Uhr erreichbar und steht den Spielern bei Fragen oder Problemen zur Seite. Zudem werden alle persönlichen Daten der Spieler streng vertraulich behandelt und die Plattform verfügt über eine gültige Lizenz, die sicherstellt, dass alle Spiele fair und transparent ablaufen.
Insgesamt bietet das Zet Casino eine unterhaltsame und sichere Umgebung für Glücksspiel-Fans, die auf der Suche nach neuen Spielmöglichkeiten sind. Mit einer großen Auswahl an Spielen, lukrativen Bonusangeboten und einem erstklassigen Kundenservice ist das Zet Casino definitiv einen Besuch wert. Probieren Sie es aus und erleben Sie den Nervenkitzel des Glücksspiels online!
https://zetcasino.one/
73. Клининговая компания в Челябинске предоставляет услуги по уборке однокомнатных квартир, включая пылесоску, вытирание пыли, мойку полов, окон, уборку кухни и санузла для создания уютной и чистой обстановки в небольшом жилище.
[url=https://kliningovaya-kompaniya-chelyabinsk.ru/]Клининговая компания Челябинск[/url] .
72. Клининг Челябинск специализируется на уборке квартир после проживания квартирантов, включая уборку кухни, ванной комнаты, спален, гостиной, мойку полов, дезинфекцию поверхностей и удаление мусора для восстановления чистоты и порядка.
[url=https://kliningovaya-kompaniya-chelyabinsk.ru/]Клининговая компания Челябинск[/url] .
Found an enthralling article, I recommend you to read http://www.odnopolchane.net/forum/member.php?u=546804
[url=https://unsimpleworld.com]World of Warcraft website template[/url] – шаблон сайта, шаблон сайта Л2
[url=https://l2.unsimpleworld.com/]дизайн сайта Л2[/url] – Website design CS:GO case opening, разработка сайта dota2 опен кейс
20.Клининг Челябинск специализируется на уборке офисных помещений больших компаний. Наши профессиональные уборщицы освободят ваш офис от пыли, грязи и мусора, обеспечивая комфортные условия для работы.
[url=https://kliningovaya-kompaniya-chelyabinsk.ru/]Клининговая компания Челябинск[/url] .
[url=https://open-case.unsimpleworld.com/]open case website development[/url] – разработка сайта dota2 опен кейс, разработка сайта csgo опен кейс
Das Meinsino Casino Tipico ist eine beliebte Online-Spielothek, die Spielern eine Vielzahl von Unterhaltungsoptionen bietet. Mit einer breiten Palette von Spielen, großzügigen Boni und einer benutzerfreundlichen Benutzeroberfläche hat das Meinsino Casino Tipico viel zu bieten.
Eines der herausragenden Merkmale des Meinsino Casino Tipico ist die Vielfalt der Spiele, die es seinen Kunden anbietet. Von klassischen Tischspielen wie Blackjack und Roulette bis hin zu aufregenden Spielautomaten und Live-Casino-Spielen – es gibt fГјr jeden etwas dabei. Die Spiele sind von fГјhrenden Softwareentwicklern wie NetEnt, Microgaming und Evolution Gaming bereitgestellt, was fГјr QualitГ¤t und Fairness steht.
Ein weiterer großer Anreiz für Spieler, das Meinsino Casino Tipico zu besuchen, sind die großzügigen Boni und Promotionen, die regelmäßig angeboten werden. Neue Spieler können einen Willkommensbonus erhalten, während Stammkunden von wöchentlichen Aktionen und Belohnungen profitieren können. Diese Boni sind eine großartige Möglichkeit, das Spielerlebnis zu verbessern und die Chancen auf Gewinne zu erhöhen.
Die Benutzeroberfläche des Meinsino Casino Tipico ist einfach zu bedienen und bietet eine nahtlose Spielerfahrung. Die Website ist gut strukturiert und intuitiv gestaltet, was es selbst Neulingen leicht macht, sich zurechtzufinden. Zudem ist das Casino mobiloptimiert, so dass Spieler auch unterwegs ihre Lieblingsspiele genießen können.
Insgesamt hat das Meinsino Casino Tipico viel zu bieten und ist definitiv einen Besuch wert. Mit einer Vielzahl von Spielen, großzügigen Boni und einer benutzerfreundlichen Benutzeroberfläche ist dieses Online-Casino eine gute Wahl für Spieler, die nach einer unterhaltsamen und lohnenden Spielerfahrung suchen.
https://tipicocasino.one/
[url=https://unsimpleworld.com]создание сайта L2[/url] – case opening website themes, разработка сайта опен кейс
6. Клининг Челябинск специализируется на профессиональной мойке фасадов зданий любой высоты. Наши квалифицированные специалисты используют безопасные методы и средства, чтобы вернуть вашему зданию первозданный внешний вид.
[url=https://kliningovaya-kompaniya-chelyabinsk.ru/]Клининг Челябинск[/url] .
反向链接金字塔
G搜尋引擎在多次更新後需要套用不同的排名參數。
今天有一種方法可以使用反向連接吸引G搜尋引擎對您的網站的注意。
反向連接不僅是有效的推廣工具,也是有機流量。
我們會得到什麼結果:
我們透過反向連結向G搜尋引擎展示我們的網站。
他們收到了到該網站的自然過渡,這也是向G搜尋引擎發出的信號,表明該資源正在被人們使用。
我們如何向G搜尋引擎表明該網站具有流動性:
個帶有主要訊息的主頁反向链接
我們透過來自受信任網站的重定向來建立反向連結。
此外,我們將網站放置在独立的網路分析器上,網站最終會進入這些分析器的高速缓存中,然後我們使用產生的連結作為部落格、論壇和評論的重定向。 這個重要的操作向G搜尋引擎顯示了網站地圖,因為網站分析器顯示了有關網站的所有資訊以及所有關鍵字和標題,這很棒
有關我們服務的所有資訊都在網站上!
nice content!nice history!!
Promo Code Zet Casino: Profitieren Sie jetzt von tollen Rabatten
Zet Casino ist eines der beliebtesten Online-Casinos im deutschen Raum und überzeugt seine Kunden nicht nur mit einer großen Auswahl an Spielen, sondern auch mit attraktiven Bonusangeboten. Eine besonders begehrte Möglichkeit, von zusätzlichen Vergünstigungen zu profitieren, ist die Verwendung eines Promo Codes.
Ein Promo Code ist ein spezieller Code, den Sie bei der Registrierung auf der Website von Zet Casino eingeben können, um von verschiedenen Aktionen zu profitieren. Dies kann beispielsweise ein zusätzliches Startguthaben, Freispiele oder Cashback-Angebote sein. Mit einem Promo Code können Sie also Ihr Spielerlebnis bei Zet Casino noch spannender gestalten und gleichzeitig Ihr Guthaben aufbessern.
Um einen Promo Code bei Zet Casino einzulösen, müssen Sie sich einfach auf der Website anmelden und den Code im entsprechenden Feld angeben. Die genauen Bedingungen und Vorteile des Codes können je nach Aktion variieren, daher sollten Sie sich vorher über die aktuell gültigen Promo Codes informieren.
Ein guter Tipp ist es, regelmäßig die Website von Zet Casino zu besuchen oder den Newsletter zu abonnieren, um über aktuelle Aktionen informiert zu bleiben. So verpassen Sie garantiert keinen lukrativen Promo Code und können Ihr Spielerlebnis bei Zet Casino optimal ausnutzen.
Nutzen Sie also jetzt die Möglichkeit, mit einem Promo Code bei Zet Casino von tollen Rabatten und Vergünstigungen zu profitieren und erleben Sie spannende Stunden voller Spaß und Adrenalin. Viel Glück beim Spielen!
https://zetcasino.one/
Pirámide de backlinks
Aquí está el texto con la estructura de spintax que propone diferentes sinónimos para cada palabra:
“Pirámide de backlinks
Después de muchas actualizaciones del motor de búsqueda G, necesita aplicar diferentes opciones de clasificación.
Hay una forma de llamar la atención de los motores de búsqueda a su sitio web con backlinks.
Los backlinks no sólo son una estrategia eficaz para la promoción, sino que también tienen flujo de visitantes orgánico, las ventas directas de estos recursos más probable es que no será, pero las transiciones será, y es tráfico potencial que también obtenemos.
Lo que vamos a obtener al final en la salida:
Mostramos el sitio a los motores de búsqueda a través de backlinks.
Conseguimos visitas orgánicas hacia el sitio, lo que también es una señal para los buscadores de que el recurso está siendo utilizado por la gente.
Cómo mostramos los motores de búsqueda que el sitio es líquido:
1 enlace se hace a la página principal donde está la información principal
Hacemos backlinks a través de redirecciones de sitios de confianza
Lo más IMPORTANTE colocamos el sitio en una herramienta independiente de analizadores de sitios, el sitio entra en la caché de estos analizadores, luego los enlaces recibidos los colocamos como redirecciones en blogs, foros, comentarios.
Esta crucial acción muestra a los buscadores el MAPA DEL SITIO, ya que los analizadores de sitios muestran toda la información de los sitios con todas las palabras clave y títulos y es muy efectivo.
¡Toda la información sobre nuestros servicios en el sitio web!
53. Клининговая компания в Челябинске предоставляет услуги по уборке после строительства или реконструкции объектов, включая вывоз строительного мусора, мойку полов, стен и потолков, уборку окон и дверей для подготовки помещений к эксплуатации.
[url=https://kliningovaya-kompaniya-chelyabinsk.ru/]Клининг Челябинск[/url] .
Tipico Casino Cash Out
Das Tipico Casino bietet Spielern eine Vielzahl von Möglichkeiten, ihr Geld auszuzahlen. Egal ob Sie gerade einen großen Gewinn erzielt haben oder einfach nur Ihr Guthaben zurück auf Ihr Bankkonto übertragen möchten, das Casino bietet verschiedene Optionen für eine schnelle und einfache Auszahlung.
Eine der beliebtesten Methoden, um Geld vom Tipico Casino abzuheben, ist die Verwendung von E-Wallets wie Skrill oder Neteller. Diese Option ermöglicht es Spielern, ihr Geld in Echtzeit zu erhalten und bietet eine sichere und zuverlässige Möglichkeit, Geld von ihrem Casino-Konto abzuheben.
Eine weitere Möglichkeit, Geld abzuheben, ist die Verwendung von Kreditkarten wie Visa oder Mastercard. Diese Methode ist ebenfalls sehr schnell und einfach und ermöglicht es Spielern, ihr Geld innerhalb weniger Tage auf ihr Bankkonto zu überweisen.
Für Spieler, die lieber traditionelle Banküberweisungen nutzen möchten, bietet das Tipico Casino auch die Möglichkeit, Geld auf ihr Bankkonto abzuheben. Obwohl diese Methode etwas länger dauern kann, ist sie sicher und zuverlässig und ermöglicht es Spielern, größere Beträge von ihrem Casino-Konto abzuheben.
Egal für welche Methode Sie sich entscheiden, das Tipico Casino stellt sicher, dass Auszahlungen schnell und sicher abgewickelt werden. Mit einer Vielzahl von Optionen können Spieler ihr Geld bequem und zuverlässig abheben und ihre Gewinne genießen. Besuchen Sie das Tipico Casino noch heute und erleben Sie die Vielfalt der Auszahlungsmöglichkeiten.
https://tipicocasino.one/
blibliblu
1SS3D249742
Zet Casino Auszahlung funktioniert nicht
Das Zet Casino ist ein beliebtes Online-Casino, das seinen Kunden eine Vielzahl von Spielen und MГ¶glichkeiten zum Spielen bietet. Doch was passiert, wenn es bei der Auszahlung von Gewinnen Probleme gibt? In diesem Artikel werden wir uns mit dem Thema “Zet Casino Auszahlung funktioniert nicht” befassen und mГ¶gliche LГ¶sungen fГјr dieses Problem aufzeigen.
Es kann verschiedene Gründe geben, warum die Auszahlung im Zet Casino nicht funktioniert. Einer der häufigsten Gründe ist, dass die Kunden die Bonusbedingungen nicht erfüllt haben. Oftmals müssen bestimmte Umsatzbedingungen erfüllt werden, bevor eine Auszahlung möglich ist. Es ist daher wichtig, dass die Spieler die Geschäftsbedingungen des Casinos genau kennen und beachten.
Ein weiterer Grund für Probleme bei der Auszahlung könnte sein, dass das Konto der Spieler nicht verifiziert ist. In einigen Fällen kann das Casino zusätzliche Dokumente verlangen, um die Identität des Spielers zu überprüfen und sicherzustellen, dass die Auszahlung an die richtige Person erfolgt. Es ist ratsam, diese Verifizierungsprozesse rechtzeitig durchzuführen, um Verzögerungen bei der Auszahlung zu vermeiden.
Wenn trotz Erfüllung der Bonusbedingungen und Verifizierung des Kontos die Auszahlung immer noch nicht funktioniert, kann es sinnvoll sein, den Kundendienst des Zet Casinos zu kontaktieren. Die Mitarbeiter des Kundenservice stehen den Spielern in der Regel rund um die Uhr zur Verfügung und können bei Problemen und Fragen weiterhelfen.
Insgesamt ist es wichtig, dass die Spieler die Regeln und Bedingungen des Zet Casinos kennen und einhalten, um reibungslose Auszahlungen zu gewährleisten. Sollte es dennoch zu Problemen kommen, ist der Kontakt zum Kundenservice der erste Schritt, um das Problem zu lösen.
Abschließend lässt sich sagen, dass das Zet Casino ein seriöser Anbieter ist, der großen Wert auf Transparenz und Kundenzufriedenheit legt. Mit etwas Geduld und Kommunikation lassen sich eventuelle Schwierigkeiten bei der Auszahlung in der Regel schnell und unkompliziert lösen.
https://zetcasino.one/
Das Tipico Casino ist eine beliebte Online-GlГјcksspielplattform, die eine Vielzahl von Casino-Spielen und Sportwetten anbietet. Eine der vielen Zahlungsmethoden, die das Tipico Casino akzeptiert, ist PayPal. PayPal ist eine sichere und bequeme Methode, um Einzahlungen und Auszahlungen im Casino vorzunehmen.
Die Verwendung von PayPal im Tipico Casino bietet eine Vielzahl von Vorteilen. Zum einen ist PayPal eine der sichersten Zahlungsmethoden im Internet. Die persönlichen und finanziellen Informationen der Spieler bleiben geschützt und sicher, da sie nicht direkt mit dem Casino geteilt werden müssen. Darüber hinaus sind PayPal-Transaktionen in der Regel sofort verfügbar, was bedeutet, dass Spieler ihr Geld schnell und einfach einzahlen und abheben können.
Ein weiterer Vorteil der Verwendung von PayPal im Tipico Casino ist die Benutzerfreundlichkeit. Der Prozess, um eine Einzahlung oder Auszahlung mit PayPal zu tätigen, ist einfach und unkompliziert. Spieler müssen lediglich ihr PayPal-Konto mit ihrem Tipico Casino-Konto verknüpfen und können dann direkt über PayPal Zahlungen tätigen.
Darüber hinaus bietet das Tipico Casino oft spezielle Boni oder Promotionen für Spieler an, die PayPal als Zahlungsmethode verwenden. Spieler können zusätzliche Belohnungen oder Boni erhalten, wenn sie PayPal für ihre Einzahlungen nutzen.
Insgesamt ist das Tipico Casino mit PayPal eine ausgezeichnete Wahl für Spieler, die eine sichere und benutzerfreundliche Zahlungsmethode suchen. Mit PayPal können Spieler problemlos Ein- und Auszahlungen tätigen und gleichzeitig von zusätzlichen Boni und Promotionen profitieren. Probieren Sie es heute aus und erleben Sie die Spannung und Aufregung des Tipico Casinos mit PayPal!
https://tipicocasino.one/
Zet Casino Bonus Code ohne Einzahlung
Zet Casino ist ein beliebtes Online-Casino, das seinen Spielern eine Vielzahl von Spielen und groГџzГјgigen Boni bietet. Einer der attraktivsten Boni, die von Zet Casino angeboten werden, ist der Bonus Code ohne Einzahlung.
Mit dem Bonus Code ohne Einzahlung können Spieler kostenlose Bonusgelder erhalten, ohne dass sie zuerst eine Einzahlung tätigen müssen. Dies ermöglicht es Spielern, das Casino und die angebotenen Spiele risikofrei zu testen, bevor sie sich entscheiden, echtes Geld einzuzahlen.
Um den Bonus Code ohne Einzahlung zu erhalten, müssen Spieler lediglich den entsprechenden Code bei der Registrierung eingeben. Nachdem der Code eingelöst wurde, wird das Bonusguthaben dem Spielerkonto gutgeschrieben und kann sofort zum Spielen verwendet werden.
Der Bonus Code ohne Einzahlung ist eine großartige Möglichkeit für Spieler, das Zet Casino kennenzulernen und gleichzeitig die Chance zu haben, echtes Geld zu gewinnen. Es lohnt sich daher, regelmäßig nach neuen Bonus Codes ohne Einzahlung Ausschau zu halten und diese zu nutzen, um das Beste aus Ihrem Spielerlebnis bei Zet Casino herauszuholen.
https://zetcasino.one/
Tipico Guthaben ins Casino transferieren
Wer bei Tipico ein Guthaben auf seinem Wettkonto hat und dieses gerne ins Online Casino transferieren möchte, kann dies ganz einfach tun. Dank der einfachen Bedienung und der benutzerfreundlichen Oberfläche des Tipico Portals ist dieser Vorgang schnell erledigt.
Um das Guthaben vom Wettkonto ins Casino zu transferieren, müssen zunächst einige Schritte befolgt werden. Zunächst muss man sich auf der Tipico Webseite einloggen und in seinem Konto einloggen. Dort kann man dann den Betrag auswählen, den man gerne ins Casino übertragen möchte.
Nachdem man den Betrag ausgewählt hat, muss man nur noch die Option wählen, dass das Guthaben ins Casino transferiert werden soll. Innerhalb weniger Sekunden wird das Guthaben dann auf das Casino-Konto übertragen und man kann sofort mit dem Spielen beginnen.
Es ist wichtig zu beachten, dass das Guthaben im Casino von Tipico nur fГјr Casinospiele genutzt werden kann und nicht fГјr Sportwetten. Wenn man also vorhat, im Tipico Casino zu spielen, ist es sinnvoll, das Guthaben dorthin zu transferieren.
Insgesamt ist es also sehr einfach, das Guthaben von Tipico ins Online Casino zu transferieren. Mit nur wenigen Klicks ist der Vorgang erledigt und man kann direkt mit dem Spielen beginnen. Wer also gerne Casinospiele bei Tipico spielt, sollte sein Guthaben schnell ins Casino transferieren.
https://tipicocasino.one/
Лендинг-пейдж — это одностраничный сайт, предназначенный для рекламы и продажи товаров или услуг, а также для сбора контактных данных потенциальных клиентов. Вот несколько причин, почему лендинг-пейдж важен для бизнеса:
Увеличение узнаваемости компании. Лендинг-пейдж позволяет представить компанию и её продукты или услуги в выгодном свете, что способствует росту узнаваемости бренда.
Повышение продаж. Заказать лендинг можно здесь – 1landingpage.ru Одностраничные сайты позволяют сосредоточиться на конкретных предложениях и акциях, что повышает вероятность совершения покупки.
Оптимизация SEO-показателей. Лендинг-пейдж создаются с учётом ключевых слов и фраз, что улучшает позиции сайта в результатах поиска и привлекает больше целевых посетителей.
Привлечение новой аудитории. Одностраничные сайты могут использоваться для продвижения новых продуктов или услуг, а также для привлечения внимания к определённым кампаниям или акциям.
Расширение клиентской базы. Лендинг-пейдж собирают контактные данные потенциальных клиентов, что позволяет компании поддерживать связь с ними и предлагать дополнительные услуги или товары.
Простота генерации лидов. Лендинг-пейдж предоставляют краткую и понятную информацию о продуктах или услугах, что облегчает процесс принятия решения для потенциальных клиентов.
Сбор персональных данных. Лендинг-пейдж позволяют собирать информацию о потенциальных клиентах, такую как email-адрес, имя и контактные данные, что помогает компании лучше понимать свою аудиторию и предоставлять более персонализированные услуги.
Улучшение поискового трафика. Лендинг-пейдж создаются с учётом определённых поисковых запросов, что позволяет привлекать больше целевых посетителей на сайт.
Эффективное продвижение новой продукции. Лендинг-пейдж можно использовать для продвижения новых товаров или услуг, что позволяет привлечь внимание потенциальных клиентов и стимулировать их к покупке.
Лёгкий процесс принятия решений. Лендинг-пейдж содержат только самую необходимую информацию, что упрощает процесс принятия решения для потенциальных клиентов.
В целом, лендинг-пейдж являются мощным инструментом для продвижения бизнеса, увеличения продаж и привлечения новых клиентов.
заказать лендинг пейдж
blibliblu
Bei Tipico Online Casino gewonnen
Es ist ein aufregender Moment, wenn man bei einem Online Casino wie Tipico gewinnt. Die Spannung während des Spiels und die Hoffnung darauf, dass die Glücksgöttin Fortuna auf unserer Seite ist, machen das Erlebnis so besonders.
Tipico bietet eine Vielzahl an Casino-Spielen an, von Slots Гјber Roulette bis hin zu Blackjack. Doch egal fГјr welches Spiel man sich entscheidet, der Adrenalinkick, wenn man gewinnt, ist immer derselbe.
Wenn man bei Tipico Online Casino gewinnt, kann das nicht nur finanzielle Vorteile mit sich bringen, sondern auch ein Gefühl der Zufriedenheit und des Stolzes. Man hat sein Glück herausgefordert und dabei gewonnen – das ist ein tolles Gefühl.
Natürlich ist es wichtig, verantwortungsbewusst zu spielen und sich der Risiken bewusst zu sein, die das Glücksspiel mit sich bringen kann. Aber mit der richtigen Herangehensweise und einem klaren Kopf kann das Spielen im Online Casino auch eine unterhaltsame und spannende Freizeitbeschäftigung sein.
Wer bei Tipico Online Casino gewinnt, kann sich auf schnelle Auszahlungen und einen kompetenten Kundenservice freuen. Das Unternehmen legt groГџen Wert auf Sicherheit und Fairness, sodass man sich als Spieler gut aufgehoben fГјhlen kann.
Insgesamt ist es ein aufregendes Erlebnis, bei Tipico Online Casino zu gewinnen. Man sollte jedoch immer im Hinterkopf behalten, dass das GlГјcksspiel ein Spiel ist und man nicht immer gewinnen kann. Aber wenn man Fortuna auf seiner Seite hat, kann sich das GefГјhl eines Gewinns wirklich lohnen.
https://tipicocasino.one/
20.Клининг Челябинск специализируется на уборке офисных помещений больших компаний. Наши профессиональные уборщицы освободят ваш офис от пыли, грязи и мусора, обеспечивая комфортные условия для работы.
[url=https://kliningovaya-kompaniya-chelyabinsk.ru/]Клининговая компания Челябинск[/url] .
Das Zet Casino PaynPlay bietet eine innovative Möglichkeit, um schnell und einfach in den Genuss von Online-Glücksspielen zu kommen. Mit dieser Zahlungsmethode benötigen Spieler kein separates Konto, um ihre Ein- und Auszahlungen zu tätigen. Stattdessen können sie einfach eine Einzahlung über ihren Bankaccount vornehmen und direkt mit dem Spielen beginnen.
Das Zet Casino PaynPlay ist besonders für Spieler geeignet, die keine Lust haben, lange Registrierungsprozesse durchlaufen zu müssen. Durch die Nutzung dieser Zahlungsmethode können sie einfach ihre Lieblingsspiele genießen, ohne sich um komplizierte Anmeldeverfahren kümmern zu müssen. Das spart nicht nur Zeit, sondern auch Nerven.
Darüber hinaus bietet das Zet Casino PaynPlay eine sichere und zuverlässige Möglichkeit, um Ein- und Auszahlungen zu tätigen. Durch die Verknüpfung mit dem Bankaccount der Spieler wird gewährleistet, dass Transaktionen schnell und sicher abgewickelt werden. So können sich Spieler voll und ganz auf ihr Spiel konzentrieren, ohne sich um Sicherheitsrisiken oder Verzögerungen bei ihren Zahlungen sorgen zu müssen.
Insgesamt bietet das Zet Casino PaynPlay eine bequeme und effiziente Möglichkeit, um Online-Glücksspiele zu genießen. Durch die innovative Zahlungsmethode können Spieler schnell und unkompliziert in den Genuss von spannenden Casinospielen kommen, ohne lange Wartezeiten oder bürokratische Hürden. Wer also auf der Suche nach einer einfachen und sicheren Lösung für seine Ein- und Auszahlungen ist, sollte das Zet Casino PaynPlay definitiv in Betracht ziehen.
https://zetcasino.one/
Tipico Casino Android 7.1.1: Das ultimative Spielerlebnis
Das Tipico Casino ist bereits seit vielen Jahren eine der beliebtesten Online-Glücksspielplattformen in Deutschland. Mit einer breiten Auswahl an Spielen und einer benutzerfreundlichen Oberfläche bietet das Casino ein erstklassiges Spielerlebnis für alle, die gerne ihr Glück beim Glücksspiel versuchen.
Die neueste Version des Tipico Casino für Android, die Version 7.1.1, bringt noch mehr Funktionen und Verbesserungen für die Spieler. Mit dieser Version können Android-Nutzer jetzt noch einfacher auf ihre Lieblingsspiele zugreifen und das Casino unterwegs genießen.
Eines der herausragenden Merkmale dieser neuen Version ist die verbesserte Benutzeroberfläche, die es den Spielern ermöglicht, ihre Lieblingsspiele schneller zu finden und nahtlos zwischen verschiedenen Spielen zu wechseln. Darüber hinaus wurden auch die Ladezeiten der Spiele optimiert, so dass die Spieler weniger Zeit damit verbringen müssen, auf das Laden der Spiele zu warten und mehr Zeit mit dem Spielen verbringen können.
Ein weiteres Highlight der neuen Version ist die Integration von Live-Dealer-Spielen, die es den Spielern ermöglicht, ein authentisches Casino-Erlebnis von zu Hause aus zu genießen. Mit Live-Dealern, die die Spiele leiten und mit den Spielern interagieren, fühlen sich die Spieler, als würden sie in einem echten Casino sitzen.
Darüber hinaus bietet die neue Version des Tipico Casino auch eine verbesserte Sicherheit, um sicherzustellen, dass die Spieler ihre persönlichen Daten und ihr Geld sicher halten können. Mit einer starken Verschlüsselungstechnologie und strengen Sicherheitsprotokollen können die Spieler beruhigt sein, dass ihre Daten jederzeit geschützt sind.
Insgesamt bietet die Tipico Casino Android 7.1.1-Version ein ultimatives Spielerlebnis für alle, die gerne online spielen. Mit einer verbesserten Benutzeroberfläche, schnelleren Ladezeiten und einer breiten Auswahl an Spielen ist das Tipico Casino die perfekte Wahl für alle Glücksspielfans. Probieren Sie es noch heute aus und erleben Sie die Spannung und den Nervenkitzel des Casinos direkt auf Ihrem Android-Gerät!
https://tipicocasino.one/
[url=https://v1tor.org/]ссылка кракен[/url] – kraken ссылка зеркало, kraken ссылка зеркало
Zet Casino ist eine beliebte Online-Glücksspielseite, die eine Vielzahl von Spielen und attraktiven Bonusangeboten für Spieler anbietet. In diesem Artikel werden Zet Casino-Venzelemeinken näher betrachtet.
Zet Casino wurde im Jahr 2018 gegründet und hat sich seitdem einen guten Ruf in der Branche erarbeitet. Die Seite wird von der Firma Araxio Development N.V. betrieben und verfügt über eine Lizenz der Glücksspielbehörde von Curacao.
Viele Spieler loben Zet Casino fГјr sein breites Spieleangebot, das von klassischen Slot-Spielen bis hin zu Live-Dealer-Spielen reicht. Die Seite arbeitet mit namhaften Softwareanbietern wie NetEnt, Microgaming und Betsoft zusammen, um ein hochwertiges Spielerlebnis zu bieten.
Ein weiterer Pluspunkt von Zet Casino sind die großzügigen Bonusangebote für neue Spieler und treue Kunden. Neben einem Willkommensbonus gibt es regelmäßige Aktionen und Reload-Boni, die das Spielerlebnis noch spannender machen.
Die Kundendienstmitarbeiter von Zet Casino werden ebenfalls für ihre Professionalität und Freundlichkeit gelobt. Sie sind rund um die Uhr per Live-Chat, E-Mail und Telefon erreichbar, um Spieler bei Fragen oder Problemen zu unterstützen.
Insgesamt kann man sagen, dass die Zet Casino-Bewertungen größtenteils positiv ausfallen. Spieler schätzen die großen Spielauswahl, attraktiven Bonusangebote und den zuverlässigen Kundendienst. Wer also auf der Suche nach einem seriösen Online-Casino ist, sollte Zet Casino definitiv in Betracht ziehen.
https://zetcasino.one/
Das Tipico Casino ist vielen Spielern bekannt für seine vielfältige Auswahl an Spielen und spannenden Aktionen. Doch manchmal kann es vorkommen, dass das Geld in einem Spielerkonto geblockt wird.
Dies kann verschiedene Gründe haben. Zum einen kann es sein, dass eine Identitätsprüfung noch ausstehend ist. In diesem Fall muss der Spieler entsprechende Dokumente vorlegen, um seine Identität zu bestätigen. Erst danach wird das Geld wieder freigegeben.
Eine andere Möglichkeit ist, dass es Unregelmäßigkeiten bei den Ein- oder Auszahlungen gab. Hier kann das Casino die Zahlungen zur Überprüfung blockieren, um sicherzustellen, dass alles korrekt abläuft.
Es ist wichtig, nicht in Panik zu geraten, wenn das Geld geblockt wird. In den meisten Fällen handelt es sich um eine routinemäßige Prüfung, die das Casino durchführt, um die Sicherheit der Spieler zu gewährleisten.
Um eine schnelle Klärung des Problems zu erreichen, sollte der Spieler den Kundenservice kontaktieren und alle erforderlichen Informationen bereitstellen. Oftmals lässt sich das Problem schnell und unkompliziert lösen.
Insgesamt ist es wichtig, Geduld zu bewahren und den Anweisungen des Casinos zu folgen, um das Geld schnellstmöglich wieder freizugeben. Mit etwas Verständnis für die Sicherheitsmaßnahmen des Casinos kann man schon bald wieder uneingeschränkt das Spielvergnügen genießen.
https://tipicocasino.one/
Discovered an article that might interest you – don’t miss it! https://www.smokingmusket.com/users/cchatruletka
blibliblu
nice content!nice history!!
boba 😀
my latest blog post [url=https://cryptoxchangefou.com]price earnings ratio formula[/url]
[url=https://mega555za3dcionline.com/]mega купить[/url] – мега даркнет, mega darknet
Zet Casino ist ein aufstrebendes Online-Casino, das sich auf dem Markt einen Namen gemacht hat. Mit einer Vielzahl von Spielen, großzügigen Bonusangeboten und einer benutzerfreundlichen Website ist Zet Casino eine gute Wahl für alle, die ihr Glück versuchen möchten.
Das Casino bietet eine breite Palette von Spielen, darunter Slots, Tischspiele, Live-Casino-Spiele und vieles mehr. Mit Spielen von renommierten Anbietern wie NetEnt, Microgaming, Play’n GO und vielen anderen, ist fГјr jeden Geschmack etwas dabei. Die Spiele sind alle in hoher QualitГ¤t mit toller Grafik und Soundeffekten gestaltet.
Ein weiterer großer Vorteil von Zet Casino sind die großzügigen Bonusangebote. Neue Spieler können einen Willkommensbonus erhalten, der in Form von Bonusgeld und Freispielen angeboten wird. Es gibt auch regelmäßige Promotionen und Turniere, bei denen Spieler zusätzliche Belohnungen verdienen können.
Die Website von Zet Casino ist benutzerfreundlich gestaltet und einfach zu navigieren. Spieler können leicht durch die verschiedenen Spiele und Funktionen der Seite stöbern und finden schnell das, wonach sie suchen. Zudem bietet das Casino eine sichere und geschützte Spielumgebung, in der die persönlichen Daten der Spieler jederzeit sicher sind.
Insgesamt ist Zet Casino eine gute Wahl fГјr alle, die auf der Suche nach einem unterhaltsamen und lohnenden Online-Casino-Erlebnis sind. Mit einer Vielzahl von Spielen, groГџzГјgigen Boni und einer benutzerfreundlichen Website ist das Casino definitiv einen Besuch wert. Probieren Sie Ihr GlГјck noch heute bei Zet Casino aus und erleben Sie die Spannung und Aufregung des Online-GlГјcksspiels.
https://zetcasino.one/
Manage Multiple Digital Assets with Jaxx Wallet
Managing multiple digital assets can be a daunting task, especially with the increasing number of cryptocurrencies and tokens available in the market. However, with the right wallet, you can easily keep track of and manage all your digital assets in one place. Jaxx Wallet is a popular choice among cryptocurrency enthusiasts, offering a user-friendly interface and a wide range of features.
Features of Jaxx Wallet:
Multi-Currency Support: Jaxx Wallet supports over 90 cryptocurrencies, allowing you to manage all your assets in one place.
User-Friendly Interface: The wallet is designed to be easy to use, even for beginners in the cryptocurrency space.
Security: Jaxx Wallet offers robust security features to protect your assets, including encryption and backup options.
Cross-Platform Compatibility: You can access your Jaxx Wallet from multiple devices, including desktop and mobile devices, making it convenient to manage your assets on the go.
Jaxxify: Easily send and receive 90 currencies with Jaxxify, simplifying your cryptocurrency transactions.
Import your crypto wallets From Jaxx Liberty
The official retirement date for Jaxx Liberty is set for March 27, 2023, at 8:00 am ET. Following this transition, users will retain access to their 12-word backup phrase for a limited duration; however, transactions will be disabled, and balances may become outdated. To seamlessly migrate your Jaxx Liberty wallet, refer to the guidelines provided.
Conclusion
With Jaxx Wallet, managing multiple digital assets has never been easier. Its user-friendly interface, multi-currency support, and security features make it a reliable choice for cryptocurrency enthusiasts. Whether you’re new to the world of cryptocurrencies or an experienced trader, Jaxx Wallet has something to offer for everyone.
In Online-Casinos stehen den Spielern verschiedene Möglichkeiten zur Verfügung, um ihre Gewinne auszahlen zu lassen. Eine beliebte Methode ist die Verwendung von Casino-Chips, die auch als Spielmarken oder Tokens bekannt sind. Im Tipico Classic Casino haben Spieler die Möglichkeit, ihre Gewinne in Form von Casino-Chips auszahlen zu lassen.
Die Auszahlung von Casino-Chips im Tipico Classic Casino ist ein einfacher und unkomplizierter Prozess. Sobald ein Spieler genügend Chips gesammelt hat, kann er diese gegen Bargeld eintauschen. Die Chips können dann entweder auf das Bankkonto des Spielers überwiesen werden oder direkt auf sein PayPal-Konto gutgeschrieben werden.
Um Casino-Chips auszahlen zu lassen, müssen Spieler lediglich den entsprechenden Betrag im Casino-Konto angeben und die Auszahlung anfordern. Der Betrag wird dann innerhalb weniger Tage auf das gewählte Konto des Spielers überwiesen. Es ist zu beachten, dass Auszahlungen von Casino-Chips häufig mit einer Bearbeitungsgebühr verbunden sind, die je nach Casino variieren kann.
Die Verwendung von Casino-Chips als Auszahlungsmethode im Tipico Classic Casino bietet Spielern eine sichere und bequeme Möglichkeit, ihre Gewinne zu erhalten. Durch die einfache Handhabung und die schnelle Auszahlungsdauer ist diese Methode eine beliebte Wahl für viele Casino-Spieler. Wer also seine Gewinne im Tipico Classic Casino in Form von Casino-Chips erhalten möchte, kann dies problemlos und ohne großen Aufwand tun.
https://tipicocasino.one/
I strongly recommend to avoid this site. My personal experience with it has been only disappointment and doubts about scamming practices. Exercise extreme caution, or better yet, seek out an honest site for your needs.
blublun
anonymous [url=https://t.me/cryptoxchangefou]what crypto to buy now[/url]
blog [url=https://therufus.org]Rufus download[/url]
Мобильная версия бк Зенит zenitbet1.com
Если Вы планировали найти [url=https://zenitbet1.com/prilozhenie-i-mobilnaya-versiya-bk-zenit/]скачать приложение зенит[/url] в интернете, то заходите на наш веб ресурс прямо сейчас. Зеркало, обычно, регулярно блокируют и нужно его искать еще раз. Благодаря сайту zenitbet1.com больше не будет сложности в поиске. Мы регулярно проверяем и обновляем ссылку на вход зеркало ЗенитБет. Возможно подписаться на отправку и Вам на Email будет приходить свежая информация о входе на сайт.
При ремонте моего дома я решил установить кованые перила. Важным критерием выбора была стоимость за погонный метр, чтобы соответствовать бюджету проекта. На сайте a-kovka.ru я нашел подробную информацию о ценах и различных вариантах перил. Отношение цены к качеству оказалось идеальным. Мастера сумели предложить решение, которое соответствовало как моим эстетическим, так и финансовым ожиданиям. Благодаря их работе, моя лестница приобрела изысканный и безопасный вид, который ежедневно радует глаз.
Добро пожаловать в кузницу “А-ковка” [url=https://a-kovka.ru/kovanye-perila]перила для лестницы в доме цена[/url] – ваш надежный партнер в создании красивых и функциональных перил для вашего дома. Мы находимся в Москве, всего в 91 километре от МКАД, и готовы предложить вам широкий выбор кованых изделий, выполненных опытными мастерами.
Наша цена доступна для любого покупателя, а качество наших изделий всегда остается на высоте. Мы используем современное оборудование и материалы высокого качества, чтобы каждый заказчик остался доволен результатом. Кованые перила не только придают вашему интерьеру изысканный вид, но и являются прочным и долговечным решением для вашего дома. Закажите перила в нашей кузнице и убедитесь сами в высоком качестве наших изделий!
[url=https://mega555za3dcionline.com/]мега даркнет[/url] – мега даркнет, mega market
see here now [url=https://obs-project.org]Obs download[/url]
Das Zet Casino Forum: Alles, was du wissen musst
Das Zet Casino bietet seinen Spielern nicht nur eine Vielzahl von spannenden Spielen, sondern auch die Möglichkeit, sich mit anderen Spielern auszutauschen und zu vernetzen. Dafür gibt es das Zet Casino Forum, in dem Spieler ihre Erfahrungen teilen, Tipps und Tricks austauschen und sich über aktuelle Aktionen und Angebote informieren können.
Im Zet Casino Forum findest du verschiedene Bereiche, die auf unterschiedliche Themen rund um das Casino-Spiel spezialisiert sind. So gibt es beispielsweise Abschnitte für Strategien und Taktiken, wo Spieler ihre besten Tipps für bestimmte Spiele wie Roulette, Blackjack oder Spielautomaten teilen können. Auch gibt es einen Bereich für Neuigkeiten und Ankündigungen, in dem das Casino über aktuelle Aktionen informiert.
Ein weiterer wichtiger Bereich im Zet Casino Forum ist der Support-Bereich. Hier können Spieler Fragen stellen oder Probleme melden und erhalten schnell und unkompliziert Hilfe von anderen Spielern oder den Mitarbeitern des Casinos. So wird eine positive und unterstützende Community geschaffen, die es den Spielern ermöglicht, ihr Spielerlebnis zu maximieren.
Das Zet Casino Forum ist nicht nur eine Plattform zum Austausch, sondern auch eine Möglichkeit, Belohnungen zu erhalten. Durch aktive Teilnahme am Forum und das Teilen von hilfreichen Beiträgen können Spieler Punkte sammeln und diese gegen attraktive Preise eintauschen.
Insgesamt bietet das Zet Casino Forum eine tolle Möglichkeit, sich mit anderen Spielern zu vernetzen, sein Wissen zu erweitern und von den Erfahrungen anderer zu profitieren. Wer also gerne in einer Community von Gleichgesinnten aktiv ist und sein Casino-Erlebnis noch spannender gestalten möchte, sollte unbedingt einen Blick ins Zet Casino Forum werfen.
https://zetcasino.one/
Tipico Casino Cash Spin ist eine aufregende Funktion, die es den Spielern ermöglicht, zusätzliche Gewinne zu erzielen, während sie ihre Lieblingsspiele spielen. Diese Funktion kann auf verschiedenen Slot-Spielen im Tipico Casino aktiviert werden und bietet den Spielern die Möglichkeit, zusätzliches Bargeld zu gewinnen.
Um am Tipico Casino Cash Spin teilnehmen zu können, müssen die Spieler bestimmte Anforderungen erfüllen. In der Regel müssen sie eine Mindestanzahl von Spins auf einem bestimmten Slot-Spiel absolvieren, um sich für den Cash Spin zu qualifizieren. Sobald die Anforderungen erfüllt sind, wird der Cash Spin automatisch aktiviert und die Spieler haben die Chance, zusätzliches Bargeld zu gewinnen.
Der Cash Spin kann unterschiedliche Preise enthalten, von kleinen Geldbeträgen bis hin zu größeren Gewinnen. Die Spieler haben die Möglichkeit, ihr Glück zu versuchen und zusätzliche Gewinne zu erzielen, die ihr Spielerkonto aufstocken können.
Tipico Casino Cash Spin ist eine spannende Funktion, die den Spielern die Möglichkeit bietet, ihre Gewinne zu maximieren und ihr Spielerlebnis zu verbessern. Mit etwas Glück können die Spieler mit dem Cash Spin ihre Gewinne deutlich steigern und noch mehr Spaß beim Spielen haben.
Insgesamt ist der Tipico Casino Cash Spin eine tolle Funktion, die den Spielern die Chance gibt, zusätzliches Bargeld zu gewinnen und ihr Spielerlebnis im Tipico Casino zu verbessern. Wir empfehlen allen Spielern, diese Funktion auszuprobieren und ihr Glück zu versuchen, um zusätzliche Gewinne zu erzielen. Viel Spaß und viel Glück beim Spielen im Tipico Casino!
https://tipicocasino.one/
blabla
Zet Casino Promo Code: Holen Sie sich tolle Boni und Freispiele
Zet Casino ist ein beliebtes Online-Casino, das eine Vielzahl von Spielen und großzügige Boni für seine Spieler anbietet. Wenn Sie auf der Suche nach zusätzlichen Belohnungen sind, sollten Sie unbedingt den Zet Casino Promo Code verwenden. Mit diesem Code können Sie sich tolle Boni und Freispiele sichern, die Ihr Spielerlebnis noch spannender machen.
Um den Zet Casino Promo Code zu nutzen, müssen Sie sich zunächst auf der Website des Casinos registrieren. Geben Sie bei der Anmeldung den Promo Code ein, um die zusätzlichen Belohnungen zu aktivieren. Sobald Sie dies getan haben, können Sie mit Ihrem Bonusguthaben spielen und tolle Gewinne erzielen.
Mit dem Zet Casino Promo Code können Sie verschiedene Arten von Boni erhalten, darunter Einzahlungsboni, Freispiele, Cashback-Angebote und mehr. Diese Boni können Ihre Gewinnchancen erhöhen und Ihnen mehr Spaß beim Spielen bieten. Es lohnt sich also, regelmäßig nach neuen Promo Codes zu suchen und diese zu nutzen.
Wenn Sie gerne Slots spielen, werden Sie sich über die Freispiele freuen, die Sie mit dem Zet Casino Promo Code erhalten können. Diese ermöglichen es Ihnen, kostenlos zu spielen und dennoch echte Gewinne zu erzielen. Außerdem können Sie mit den Einzahlungsboni Ihre Einzahlungen aufstocken und somit länger spielen und mehr gewinnen.
Insgesamt bietet der Zet Casino Promo Code eine großartige Möglichkeit, zusätzliche Belohnungen zu erhalten und Ihr Spielerlebnis zu verbessern. Nutzen Sie also diese Chance und holen Sie sich Ihre Boni und Freispiele noch heute!
https://zetcasino.one/
Das Tipico Casino ist eine beliebte Anlaufstelle für alle Casino-Fans, die gerne ihr Glück versuchen wollen. Besonders das Roulette-Spiel erfreut sich großer Beliebtheit, da es sowohl einfach zu verstehen als auch spannend ist. Ein wichtiger Aspekt beim Roulette-Spiel ist der Mindesteinsatz, da dieser die Höhe des Risikos und potenzieller Gewinne bestimmt.
Im Tipico Casino beträgt der Mindesteinsatz am Roulette-Tisch in der Regel 1 Euro. Das bedeutet, dass Spieler bereits mit einem vergleichsweise kleinen Betrag am Spiel teilnehmen können. Dadurch wird das Spielen auch für Einsteiger attraktiv, die nicht gleich hohe Summen setzen möchten.
Der Mindesteinsatz beim Roulette kann je nach Tischvariante variieren, daher ist es wichtig, sich vor dem Spiel Гјber die genauen Regeln zu informieren. In jedem Fall ist es ratsam, verantwortungsvoll mit dem eigenen Budget umzugehen und nur so viel zu setzen, wie man sich leisten kann zu verlieren.
Durch den niedrigen Mindesteinsatz beim Roulette im Tipico Casino wird das Spiel für eine breite Zielgruppe zugänglich gemacht und sorgt für ein unterhaltsames Spielerlebnis. Also nichts wie ran an den Tisch und viel Spaß beim Setzen und Gewinnen!
https://tipicocasino.one/
cululutata
dyson официальный магазин [url=https://www.dyson-kupit.com/]dyson официальный сайт интернет магазин[/url] .
Как обезопасить свои данные: остерегайтесь утечек информации в интернете. Сегодня обеспечение безопасности своих данных становится более насущной важной задачей. Одним из наиболее часто встречающихся способов утечки личной информации является слив «сит фраз» в интернете. Что такое сит фразы и как сберечься от их утечки? Что такое «сит фразы»? «Сит фразы» — это синтезы слов или фраз, которые часто используются для получения доступа к различным онлайн-аккаунтам. Эти фразы могут включать в себя имя пользователя, пароль или другие конфиденциальные данные. Киберпреступники могут пытаться получить доступ к вашим аккаунтам, с помощью этих сит фраз. Как защитить свои личные данные? Используйте непростые пароли. Избегайте использования легких паролей, которые легко угадать. Лучше всего использовать комбинацию букв, цифр и символов. Используйте уникальные пароли для каждого аккаунта. Не воспользуйтесь один и тот же пароль для разных сервисов. Используйте двухфакторную проверку (2FA). Это вводит дополнительный уровень безопасности, требуя подтверждение входа на ваш аккаунт по другое устройство или метод. Будьте осторожны с онлайн-сервисами. Не доверяйте свою информацию ненадежным сайтам и сервисам. Обновляйте программное обеспечение. Установите обновления для вашего операционной системы и программ, чтобы уберечь свои данные от вредоносного ПО. Вывод Слив сит фраз в интернете может спровоцировать серьезным последствиям, таким подобно кража личной информации и финансовых потерь. Чтобы обезопасить себя, следует принимать меры предосторожности и использовать надежные методы для хранения и управления своими личными данными в сети
Наша бригада опытных мастеров завершена предоставить вам актуальные средства, которые не только гарантируют надежную охрану от заморозков, но и подарят вашему дому модный вид.
Мы эксплуатируем с последними строительными материалами, утверждая долгий продолжительность эксплуатации и выдающиеся результаты. Теплоизоляция наружных стен – это не только сокращение расходов на обогреве, но и забота о экосистеме. Энергосберегающие подходы, которые мы применяем, способствуют не только вашему, но и сохранению природных ресурсов.
Самое важное: [url=https://ppu-prof.ru/]Стоимость утепления фасада[/url] у нас начинается всего от 1250 рублей за квадратный метр! Это бюджетное решение, которое сделает ваш резиденцию в фактический душевный район с минимальными затратами.
Наши достижения – это не только изолирование, это составление области, в где любой деталь отражает ваш индивидуальный образ действия. Мы примем все твои пожелания, чтобы преобразить ваш дом еще еще более комфортным и привлекательным.
Подробнее на [url=https://ppu-prof.ru/]ppu-prof.ru/[/url]
Не откладывайте заботу о своем жилище на потом! Обращайтесь к экспертам, и мы сделаем ваш помещение не только более теплым, но и стильнее. Заинтересовались? Подробнее о наших трудах вы можете узнать на нашем сайте. Добро пожаловать в пределы комфорта и стандартов.
Vavada
даркнет сливы тг
Даркнет и сливы в Телеграме
Даркнет – это сегмент интернета, которая не индексируется стандартными поисковыми системами и требует специальных программных средств для доступа. В даркнете существует изобилие скрытых сайтов, где можно найти различные товары и услуги, в том числе и нелегальные.
Одним из популярных способов распространения информации в даркнете является использование мессенджера Телеграм. Телеграм предоставляет возможность создания закрытых каналов и чатов, где пользователи могут обмениваться информацией, в том числе и нелегальной.
Сливы информации в Телеграме – это процедура распространения конфиденциальной информации, такой как украденные данные, базы данных, персональные сведения и другие материалы. Эти сливы могут включать в себя информацию о кредитных картах, паролях, персональных сообщениях и даже фотографиях.
Сливы в Телеграме могут быть рискованными, так как они могут привести к утечке конфиденциальной информации и нанести ущерб репутации и финансовым интересам людей. Поэтому важно быть осторожным при обмене информацией в интернете и не доверять сомнительным источникам.
Вот кошельки с балансом у бота
Слив засеянных фраз (seed phrases) является одним из наиболее распространенных способов утечки личных информации в мире криптовалют. В этой статье мы разберем, что такое сид фразы, зачем они важны и как можно защититься от их утечки.
Что такое сид фразы?
Сид фразы, или мнемонические фразы, формируют комбинацию слов, которая используется для формирования или восстановления кошелька криптовалюты. Обычно сид фраза состоит из 12 или 24 слов, которые символизируют собой ключ к вашему кошельку. Потеря или утечка сид фразы может привести к потере доступа к вашим криптовалютным средствам.
Почему важно защищать сид фразы?
Сид фразы служат ключевым элементом для защищенного хранения криптовалюты. Если злоумышленники получат доступ к вашей сид фразе, они смогут получить доступ к вашему кошельку и украсть все средства.
Как защититься от утечки сид фраз?
Никогда не передавайте свою сид фразу никакому, даже если вам кажется, что это привилегированное лицо или сервис.
Храните свою сид фразу в безопасном и защищенном месте. Рекомендуется использовать аппаратные кошельки или специальные программы для хранения сид фразы.
Используйте дополнительные методы защиты, такие как двухфакторная верификация, для усиления безопасности вашего кошелька.
Регулярно делайте резервные копии своей сид фразы и храните их в разных безопасных местах.
Заключение
Слив сид фраз является серьезной угрозой для безопасности владельцев криптовалют. Понимание важности защиты сид фразы и принятие соответствующих мер безопасности помогут вам избежать потери ваших криптовалютных средств. Будьте бдительны и обеспечивайте надежную защиту своей сид фразы
сид фразы кошельков
Сид-фразы, или памятные фразы, представляют собой соединение слов, которая используется для формирования или восстановления кошелька криптовалюты. Эти фразы обеспечивают доступ к вашим криптовалютным средствам, поэтому их секурное хранение и использование чрезвычайно важны для защиты вашего криптоимущества от утери и кражи.
Что такое сид-фразы кошельков криптовалют?
Сид-фразы представляют собой набор случайным образом сгенерированных слов, как правило от 12 до 24, которые предназначены для создания уникального ключа шифрования кошелька. Этот ключ используется для восстановления возможности доступа к вашему кошельку в случае его повреждения или утери. Сид-фразы обладают значительной защиты и шифруются, что делает их надежными для хранения и передачи.
Зачем нужны сид-фразы?
Сид-фразы неотъемлемы для обеспечения безопасности и доступности вашего криптоимущества. Они позволяют восстановить вход к кошельку в случае утери или повреждения физического устройства, на котором он хранится. Благодаря сид-фразам вы можете легко создавать резервные копии своего кошелька и хранить их в безопасном месте.
Как обеспечить безопасность сид-фраз кошельков?
Никогда не передавайте сид-фразой ни с кем. Сид-фраза является вашим ключом к кошельку, и ее раскрытие может вести к утере вашего криптоимущества.
Храните сид-фразу в безопасном месте. Используйте физически секурные места, такие как банковские ячейки или специализированные аппаратные кошельки, для хранения вашей сид-фразы.
Создавайте резервные копии сид-фразы. Регулярно создавайте резервные копии вашей сид-фразы и храните их в разных безопасных местах, чтобы обеспечить доступ к вашему кошельку в случае утери или повреждения.
Используйте дополнительные меры безопасности. Включите другие методы защиты и двухфакторную аутентификацию для своего кошелька криптовалюты, чтобы обеспечить дополнительный уровень безопасности.
Заключение
Сид-фразы кошельков криптовалют являются ключевым элементом защищенного хранения криптоимущества. Следуйте рекомендациям по безопасности, чтобы защитить свою сид-фразу и обеспечить безопасность своих криптовалютных средств.
Zet Casino 20 Freispiele
Das Zet Casino bietet seinen Spielern eine großzügige Auswahl an Boni und Promotionen, darunter auch 20 Freispiele, die für neue Spieler verfügbar sind. Diese Freispiele können auf ausgewählten Slots im Online Casino gespielt werden und bieten eine großartige Gelegenheit, das Casino und die Spiele kostenlos zu testen.
Um die 20 Freispiele zu erhalten, müssen neue Spieler lediglich ein Konto im Zet Casino erstellen und ihre erste Einzahlung tätigen. Sobald die Einzahlung bestätigt wurde, werden die 20 Freispiele automatisch gutgeschrieben und können sofort genutzt werden. Es gibt keine weiteren Bedingungen oder Anforderungen, um von diesem Angebot zu profitieren.
Die Freispiele kГ¶nnen auf verschiedenen Slots im Zet Casino gespielt werden, darunter beliebte Spiele wie Starburst, Book of Dead und Gonzo’s Quest. Spieler haben die MГ¶glichkeit, echtes Geld zu gewinnen und ihre Gewinne nach ErfГјllung der Umsatzbedingungen auszuzahlen.
Das Zet Casino ist bekannt für sein vielfältiges Spielangebot, seine großzügigen Boni und seine sichere und faire Spielumgebung. Mit einer Lizenz der Malta Gaming Authority können Spieler sicher sein, dass sie in einem vertrauenswürdigen Online Casino spielen.
Insgesamt sind die 20 Freispiele im Zet Casino eine großartige Möglichkeit, das Casino kostenlos zu entdecken und echte Gewinne zu erzielen. Neue Spieler werden ermutigt, dieses Angebot zu nutzen und die aufregenden Spiele und Funktionen des Zet Casinos zu erleben.
https://zetcasino.one/
Структура бэклинков
После того как многочисленных обновлений G необходимо использовать разные варианты рейтингования.
Сегодня есть способ привлечения внимания поисковым системам к вашему сайту с помощью бэклинков.
Обратные линки являются эффективным инструментом продвижения, но также являются источником органического трафика, хотя прямых продаж с этих ресурсов скорее всего не будет, но переходы будут, и именно органического трафика мы также получаем.
Что в итоге получим на выходе:
Мы показываем сайт поисковым системам при помощи обратных ссылок.
Получают естественные переходы на сайт, а это также сигнал поисковым системам о том, что ресурс используется людьми.
Как мы демонстрируем поисковым системам, что сайт ликвиден:
1 главная ссылка размещается на главной странице, где находится основная информация.
Размещаем обратные ссылки через редиректы с трастовых ресурсов.
Самое ВАЖНОЕ мы размещаем сайт на отдельном инструменте анализаторов сайтов, сайт попадает в кеш этих анализаторов, затем полученные ссылки мы размещаем в качестве редиректов на блогах, форумах, комментариях.
Это важное действие показывает всем поисковикамКАРТУ САЙТА, так как анализаторы сайтов отображают всю информацию о сайтах со с тайтлами, ключами, h1,h2,h3 и это очень ВАЖНО
Manufacturing metal structures is a very complex and responsible process. It stagramer.com is necessary to follow some rules and follow recommendations to ensure that the product turns out to be of high quality and safe.
124969D742
blublun
Select the appropriate metal material for the specific design teplica-parnik.net. Requirements for strength, corrosion resistance and other characteristics must be taken into account. It is worth contacting experienced specialists who will help you understand all the parameters.
Скачать БК Зенит на телефон zenitbet1.com
Если Вы планировали найти [url=https://zenitbet1.com/prilozhenie-i-mobilnaya-versiya-bk-zenit/]приложение зенитбет[/url] в сети интернет, то заходите на наш сайт прямо сегодня. Зеркало, чаще всего, регулярно блокируют и необходимо его искать заново. С помощью сайта zenitbet1.com больше не будет трудностей в поиске. Мы регулярно проверяем и обновляем ссылку на вход зеркало ЗенитБет. Возможно подписаться на рассылку и Вам на почту будет приходить новая информация о входе на сайт.
Привет всем!
Мы рады предложить вам широкий выбор входных и межкомнатных дверей в Саратове и области, а также гарантировать их качественную установку. За время нашей работы мы накопили значительный опыт в установке и обслуживании дверных конструкций, что позволяет нам успешно решать самые разнообразные задачи.
Наши основные принципы работы – это обязательность, строгое соблюдение договоренностей и выполнение всех работ в срок с высоким уровнем сервиса. Мы предлагаем нашим клиентам более 1000 моделей входных и межкомнатных дверей различных ценовых категорий, материалов отделки и конструкций от известных производителей.
У нас работают настоящие профессионалы, которые знают все тонкости и нюансы данной области. Наши опытные консультанты всегда готовы помочь вам подобрать оптимальное решение, которое обеспечит вам надежную и комфортную работу выбранных дверей.
Вся информация на сайте https://id64.ru/
В компании работают исключительно профессиональные мастера-монтажники с опытом работы от 10 лет.
Консультацию проводят высококвалифицированные мастера. Они помогут найти лучшее изделие, подходящее под все Ваши требования.
Вы можете купить у нас двери в рассрочку без переплат при участии банков: Сбер, Почта банк, МТС банк, Русский Стандарт, Хоум кредит, Халва.
Магазин компании удобно расположен в центре. Клиент без проблем может добраться до магазина из любой точки города и изучить ассортимент.
Двери складные
Арки и порталы
Двери для частного дома
Двери для дачи
Тамбурные двери
Двери книжка
Удачи и хорошего интерьера!
blibliblu
ggg
هنا النص مع استخدام السبينتاكس:
“هرم الروابط الخلفية
بعد التحديثات العديدة لمحرك البحث G، تحتاج إلى تطبيق خيارات ترتيب مختلفة.
هناك منهج لجذب انتباه محركات البحث إلى موقعك على الويب باستخدام الروابط الخلفية.
الروابط الخلفية ليست فقط أداة فعالة للترويج، ولكن تحمل أيضًا حركة مرور عضوية، والمبيعات المباشرة من هذه الموارد على الأرجح غالبًا ما لا تكون كذلك، ولكن التحولات ستكون، وهي حركة المرور التي نحصل عليها أيضًا.
ما نكون عليه في النهاية في النهاية في الإخراج:
نعرض الموقع لمحركات البحث من خلال الروابط الخلفية.
2- نحصل على تبديلات عضوية إلى الموقع، وهي أيضًا إشارة لمحركات البحث أن المورد يستخدمه الناس.
كيف نظهر لمحركات البحث أن الموقع سائل:
1 يتم عمل رابط خلفي للصفحة الرئيسية حيث المعلومات الرئيسية
نقوم بعمل لينكات خلفية من خلال عمليات إعادة توجيه المواقع الموثوقة
الأهم من ذلك أننا نضع الموقع على أداة منفصلة من أدوات تحليل المواقع، ويدخل الموقع في ذاكرة التخزين المؤقت لهذه المحللات، ثم الروابط المستلمة التي نضعها كتوجيه مرة أخرى على المدونات والمنتديات والتعليقات.
هذا الخطوة المهم يُظهر لمحركات البحث خارطة الموقع، حيث تعرض أدوات تحليل المواقع جميع المعلومات عن المواقع مع جميع الكلمات الرئيسية والعناوين وهو أمر جيد جداً
جميع المعلومات عن خدماتنا على الموقع!
центр реабилитации зависимостей https://addictiontreatment.kz/
лечение алкоголизма и наркомании центр https://narcohelp.kz/
Интернет-магазин, где можно найти раковины встраиваемые сверху для любого интерьера и бюджета.
Das Zet Casino Forum ist ein beliebter Treffpunkt für Spieler, die sich über ihre Erfahrungen in diesem Online-Casino austauschen möchten. In diesem Forum können Nutzer neue Freunde finden, Tipps und Tricks teilen und sich über aktuelle Aktionen informieren.
Ein groГџer Vorteil des Zet Casino Forums ist die Vielfalt der Themen, die dort diskutiert werden. von Spielstrategien bis hin zu Gewinnchancen oder Ein- und Auszahlungsmethoden – hier findet jeder Spieler die passende Information.
Darüber hinaus bietet das Zet Casino Forum auch die Möglichkeit, sich direkt mit dem Kundenservice des Online-Casinos in Verbindung zu setzen. So können Probleme schnell gelöst und Fragen umgehend beantwortet werden.
Wer also auf der Suche nach einer aktiven und hilfreichen Community rund um das Zet Casino ist, sollte unbedingt einen Blick in das Zet Casino Forum werfen. Hier kann man nicht nur sein Spielerlebnis verbessern, sondern auch jede Menge SpaГџ haben und neue Kontakte knГјpfen.
https://zetcasino.one/
Зарегистрироваться в БК Зенит zenitbet1.com
Если Вы искали [url=https://zenitbet1.com/prilozhenie-i-mobilnaya-versiya-bk-zenit/]скачать зенит на андроид[/url] в сети интернет, то переходите на наш веб ресурс прямо сейчас. Зеркало, как правило, регулярно блокируют и нужно его искать заново. С помощью сайта zenitbet1.com больше не будет сложности в поиске. Мы каждый день проверяем и обновляем ссылку на вход зеркало ЗенитБет. Можно подписаться на отправку и Вам на почту будет приходить свежая информация о входе на сайт.
Вавада зеркало
Boomerang-Casinos sind eine neue Entwicklung in der Welt des Online-Glücksspiels, die eine kontroverse Diskussion unter Spielern und Experten ausgelöst hat.
Der Begriff “Boomerang” bezieht sich darauf, dass Spieler, die in einem Online-Casino eine bestimmte Menge Geld verloren haben, von diesem Casino kontaktiert und mit attraktiven Angeboten und Boni zurГјckgelockt werden. Diese Taktik zielt darauf ab, die Spieler dazu zu bringen, erneut Geld einzuzahlen und weiter zu spielen, in der Hoffnung, ihre Verluste wieder auszugleichen.
Einige Spieler sehen in Boomerang-Casinos eine Möglichkeit, leichtes Geld zu verdienen und ihre Verluste auszugleichen. Andere hingegen warnen vor den Gefahren dieser Praxis und betonen, dass Glücksspiel immer mit einem gewissen Risiko verbunden ist und dass die Versuchung, weiter zu spielen, um Verluste auszugleichen, zu noch größeren Verlusten führen kann.
Experten sind sich uneinig über die ethische und rechtliche Frage, ob Boomerang-Casinos eine faire Praxis sind. Einige argumentieren, dass die Casinos das Recht haben, Marketingstrategien zu nutzen, um Spieler zurückzugewinnen, während andere der Meinung sind, dass diese Taktik ausgenutzt wird, um die Spieler süchtig zu machen und in finanzielle Probleme zu treiben.
Es bleibt abzuwarten, wie sich die Debatte um Boomerang-Casinos weiterentwickeln wird und ob Regulierungsbehörden Maßnahmen ergreifen werden, um den Spielern mehr Schutz zu bieten. In der Zwischenzeit sollten Spieler vorsichtig sein und sich bewusst sein, dass Glücksspiel immer ein Risiko birgt und dass es wichtig ist, verantwortungsbewusst zu spielen.
https://boomerangcasino.one/
The main advantage of a forklift is its versatility and ease of use stroibloger.com. Essentially, it’s just a dolly with a durable fork that can be used to lift pallets or large loads to any height.
88. Клининг Челябинск специализируется на уборке квартир перед приездом гостей или важными событиями, включая уборку гостиной, спален, ванной комнаты, кухни, дезинфекцию поверхностей, уборку мебели, мойку посуды и другие работы для создания приятной атмосферы.
[url=https://kliningovaya-kompaniya-chelyabinsk.ru/]Клининг Челябинск[/url] .
A ticket is each application that is registered by support services instukzia.com. The ticket system is a digital tool that automates the operation of various services. The solutions are relevant for registration and processing of customer requests.
Im Zet Casino kГ¶nnen Spieler ihren SpielspaГџ noch weiter steigern, indem sie einen speziellen Promotionscode verwenden. Mit einem “zet casino promГіciГіs kГіdod” erhalten Spieler Zugang zu verschiedenen Bonusangeboten und Aktionen, die ihre Gewinnchancen erhГ¶hen und das Spielerlebnis noch aufregender machen.
Der Promotionscode kann auf der Website des Casinos oder durch spezielle Aktionen und Newsletter erhalten werden. Einmal eingegeben, können Spieler von zusätzlichen Einzahlungsboni, Freispielen, Cashback-Angeboten und vielen anderen Belohnungen profitieren.
Durch die Verwendung des “zet casino promГіciГіs kГіdod” kГ¶nnen Spieler ihre Bankroll erhГ¶hen und lГ¤nger spielen, ohne dabei ihr eigenes Geld zu riskieren. Dies ermГ¶glicht es ihnen, mehr Spiele zu genieГџen und ihre Gewinnchancen zu maximieren.
Das Zet Casino bietet eine Vielzahl von Spielen, darunter Slots, Tischspiele, Live-Casino-Spiele und vieles mehr. Mit dem Promotionscode haben Spieler die Möglichkeit, alle diese Spiele mit zusätzlichen Boni zu spielen und noch mehr Spaß zu haben.
Also, wenn Sie auf der Suche nach einem aufregenden Casinoerlebnis sind, sollten Sie nicht zГ¶gern und sich Ihren “zet casino promГіciГіs kГіdod” sichern. Nutzen Sie die zahlreichen Bonusangebote und Aktionen, um Ihre Gewinnchancen zu maximieren und den Nervenkitzel des Casinos zu erleben. Viel GlГјck!
https://zetcasino.one/
Came across a unique piece – be sure to check it out http://newsofgames.ru/sdelayte-svoy-dom-eshhe-krasivee-luchshie-otdelochnyie-materialyi-po-vyigodnyim-tsenam
Inserts are the most consumable part of a workpiece machining system. They homeprorab.info are placed in special holders and can be quickly changed depending on wear or process requirements.
Tipico Casino aktuelle Störung: Was ist passiert und wie lange dauert es?
Aktuell gibt es anscheinend eine Störung beim Tipico Casino, die viele Spieler frustriert und verwirrt hat. Viele Kunden haben Probleme beim Einloggen in ihre Konten, beim Laden der Spiele oder beim Durchführen von Transaktionen. Dies hat zu einer Flut von Beschwerden in den sozialen Medien geführt, da die Spieler ihre Unzufriedenheit über die Situation zum Ausdruck gebracht haben.
Laut einer offiziellen Erklärung des Unternehmens arbeiten die Techniker bereits an der Behebung des Problems. Sie haben jedoch keine genaue Zeitangabe gemacht, wann die Störung behoben sein wird. Dies hat bei vielen Kunden zu Verärgerung geführt, da sie nicht wissen, wie lange sie warten müssen, um wieder normal spielen zu können.
Es ist wichtig zu beachten, dass solche Störungen in der Online-Glücksspielbranche keine Seltenheit sind. Technische Probleme können jederzeit auftreten und das Spielerlebnis beeinträchtigen. Es ist jedoch beruhigend zu wissen, dass Unternehmen wie Tipico schnell reagieren und daran arbeiten, das Problem so schnell wie möglich zu lösen.
In der Zwischenzeit sollten die Spieler Geduld haben und abwarten, bis die Störung behoben ist. Es ist auch ratsam, die offiziellen Kanäle des Unternehmens im Auge zu behalten, um Updates und Informationen zum aktuellen Stand der Dinge zu erhalten. Hoffentlich wird die Störung bald behoben sein und die Spieler können wieder ungestört ihrem Hobby nachgehen.
https://tipicocasino.one/
ремонт ноутбуков
ремонт ноутбука в москве
ремонт сотовых
починить телефон
Мы рекомендуем посетить веб-сайт ссылка.
Player線上娛樂城遊戲指南與評測
台灣最佳線上娛樂城遊戲的終極指南!我們提供專業評測,分析熱門老虎機、百家樂、棋牌及其他賭博遊戲。從遊戲規則、策略到選擇最佳娛樂城,我們全方位覆蓋,協助您更安全的遊玩。
Player如何評測:公正與專業的評分標準
在【Player娛樂城遊戲評測網】我們致力於為玩家提供最公正、最專業的娛樂城評測。我們的評測過程涵蓋多個關鍵領域,旨在確保玩家獲得可靠且全面的信息。以下是我們評測娛樂城的主要步驟:
娛樂城是什麼?
娛樂城是什麼?娛樂城是台灣對於線上賭場的特別稱呼,線上賭場分為幾種:現金版、信用版、手機娛樂城(娛樂城APP),一般來說,台灣人在稱娛樂城時,是指現金版線上賭場。
線上賭場在別的國家也有別的名稱,美國 – Casino, Gambling、中國 – 线上赌场,娱乐城、日本 – オンラインカジノ、越南 – Nhà cái。
娛樂城會被抓嗎?
在台灣,根據刑法第266條,不論是實體或線上賭博,參與賭博的行為可處最高5萬元罰金。而根據刑法第268條,為賭博提供場所並意圖營利的行為,可能面臨3年以下有期徒刑及最高9萬元罰金。一般賭客若被抓到,通常被視為輕微罪行,原則上不會被判處監禁。
信用版娛樂城是什麼?
信用版娛樂城是一種線上賭博平台,其中的賭博活動不是直接以現金進行交易,而是基於信用系統。在這種模式下,玩家在進行賭博時使用虛擬的信用點數或籌碼,這些點數或籌碼代表了一定的貨幣價值,但實際的金錢交易會在賭博活動結束後進行結算。
現金版娛樂城是什麼?
現金版娛樂城是一種線上博弈平台,其中玩家使用實際的金錢進行賭博活動。玩家需要先存入真實貨幣,這些資金轉化為平台上的遊戲籌碼或信用,用於參與各種賭場遊戲。當玩家贏得賭局時,他們可以將這些籌碼或信用兌換回現金。
娛樂城體驗金是什麼?
娛樂城體驗金是娛樂場所為新客戶提供的一種免費遊玩資金,允許玩家在不需要自己投入任何資金的情況下,可以進行各類遊戲的娛樂城試玩。這種體驗金的數額一般介於100元到1,000元之間,且對於如何使用這些體驗金以達到提款條件,各家娛樂城設有不同的規則。
First of all, it should be clearly understood that these are uquest.net completely different concepts in geography. For example, when considering absolute height, it is precisely this that acts as the most important indicator, which is measured in meters, thereby determining the height of geographical objects above sea level.
As for relative height, it is usually measured in meters plitki.com. Moreover, it is worth noting that it is precisely this that will show the difference between the absolute height of geographical objects, as well as the height of the terrain. If the mountain has an absolute height of 2000 meters, but the surrounding area is located at an altitude of 1000 meters, then as for the comparative height of the mountain, it will be 1000 meters.
Safety standards must be followed when working everbestnews.com with metal. Use protective equipment, use tools and equipment according to the rules so as not to encounter difficulties.
Tipico Casino Taktik: Wie man beim Online Casino erfolgreich ist
Das Online Casino Spiel hat in den letzten Jahren stark an Popularität gewonnen. Immer mehr Menschen versuchen ihr Glück beim Glücksspiel und hoffen auf den großen Gewinn. Doch wie kann man erfolgreich im Casino spielen? Gibt es eine spezielle Taktik, die einem dabei helfen kann, seine Gewinnchancen zu erhöhen?
Eine der beliebtesten Online Casinos ist das Tipico Casino. Dort gibt es eine Vielzahl von Spielen, darunter Spielautomaten, Roulette, Blackjack und vieles mehr. Bei so vielen Möglichkeiten kann es schwierig sein, eine erfolgreiche Taktik zu finden, die einem garantiert zum Gewinn verhilft. Doch es gibt einige Tipps und Tricks, die einem helfen können, seine Gewinnchancen zu maximieren.
Eine wichtige Taktik beim Spielen im Tipico Casino ist es, sich über die verschiedenen Spiele und deren Regeln zu informieren. Je besser man die Regeln und Strategien der Spiele versteht, desto größer sind die Chancen auf einen Gewinn. Es kann auch hilfreich sein, verschiedene Strategien auszuprobieren und herauszufinden, welche am besten zu einem passen.
Ein weiterer wichtiger Aspekt beim Spielen im Tipico Casino ist es, sein Budget im Auge zu behalten. Es ist wichtig, sich ein Limit zu setzen und nicht Гјber dieses hinauszugehen. Man sollte sich bewusst sein, dass GlГјcksspiel sГјchtig machen kann und daher verantwortungsbewusst spielen.
Zusammenfassend lässt sich sagen, dass es keine garantierte Taktik gibt, um beim Online Casino erfolgreich zu sein. Es ist wichtig, sich über die verschiedenen Spiele zu informieren, sein Budget im Auge zu behalten und verantwortungsbewusst zu spielen. Mit etwas Glück und Geschick kann man jedoch durchaus erfolgreich im Tipico Casino sein und den ein oder anderen Gewinn erzielen.
https://tipicocasino.one/
Мы рекомендуем посетить веб-сайт https://btc-fish.ru/kak-izbezhat-stressa-na-rabote/.
Кроме того, не забудьте добавить сайт в закладки: [url=https://btc-fish.ru/kak-izbezhat-stressa-na-rabote/]https://btc-fish.ru/kak-izbezhat-stressa-na-rabote/[/url]
Customers receive products not only from the IT sector. They must provide krepezh.net high-quality services at every stage of interaction with cloud solutions.
A person can set up the system on his own or sveto-copy.com contact an organization to use the feature, focusing on his product.
I highly advise to avoid this platform. The experience I had with it has been nothing but dismay along with suspicion of deceptive behavior. Be extremely cautious, or better yet, seek out an honest service to fulfill your requirements.
Discovered an article that will surely interest you – I recommend checking it out https://moskvic.actieforum.com/login
Erfahrung mit der Boomerang Casino Auszahlung
Das Boomerang Casino ist eine Online-GlГјcksspielplattform, die eine Vielzahl von Spielen anbietet, darunter Spielautomaten, Tischspiele und Live-Dealer-Spiele. Aber wie sieht es mit der Auszahlung bei diesem Casino aus? In diesem Artikel werden wir die Erfahrungen von Spielern mit der Boomerang Casino Auszahlung genauer untersuchen.
Viele Spieler haben berichtet, dass die Auszahlung bei Boomerang Casino schnell und unkompliziert ist. Die Auszahlungen werden in der Regel innerhalb von 24 Stunden bearbeitet, was im Vergleich zu anderen Online-Casinos als sehr schnell gilt. Die Spieler loben auch den Kundenservice des Casinos, der bei Fragen oder Problemen rund um die Auszahlung schnell und effizient reagiert.
Ein weiterer positiver Punkt der Boomerang Casino Auszahlung ist die Auswahl an Zahlungsmethoden. Neben den üblichen Zahlungsoptionen wie Kreditkarten und Banküberweisungen bietet das Casino auch E-Wallets wie Skrill, Neteller und PayPal an. Dies ermöglicht es den Spielern, die für sie bequemste Zahlungsmethode auszuwählen.
Allerdings gibt es auch einige Spieler, die negative Erfahrungen mit der Boomerang Casino Auszahlung gemacht haben. Einige berichten von Verzögerungen bei der Auszahlung oder von falschen Beträgen, die auf ihr Konto überwiesen wurden. Diese Probleme scheinen jedoch eher vereinzelt zu sein und das Casino bemüht sich, diese schnell zu lösen.
Insgesamt scheint die Boomerang Casino Auszahlung eine positive Erfahrung für die meisten Spieler zu sein. Schnelle Bearbeitungszeiten, eine große Auswahl an Zahlungsmethoden und ein guter Kundenservice tragen dazu bei, dass die Auszahlung bei diesem Casino als zuverlässig und benutzerfreundlich angesehen wird. Es lohnt sich also, das Boomerang Casino auszuprobieren, wenn man auf der Suche nach einer guten Online-Glücksspielplattform ist.
https://boomerangcasino.one/
Source https://kombonovaya2.com/
Player娛樂城遊戲評測網 《娛樂城評價》分類專區,幫您整了出網路上各大線上娛樂城重點摘要,以便您快速了解各大娛樂城重點資訊。
錢盈娛樂城介紹
錢盈娛樂城於2022年成立,是一個專注於現金投注的線上遊戲平台,提供了包括體育賭博、真人百家樂、老虎機、彩票和電子遊戲等多樣化的遊戲選…
F1方程式娛樂城介紹
F1方程式娛樂城屬於小型線上娛樂城版,整體晚間非常簡陋而且含有諸多瑕疵以及不完善,首先奇怪的點在於完全沒有可以註冊的地方,我們這邊猜測…
CZ168娛樂城介紹
CZ168娛樂城在雖然在簡介中自稱有12年的經營時間,但是經過我們實際的調查以及訪問該品牌網頁後發現,並沒有任何12年前或是更近的資料…
包你發娛樂城介紹
包你發娛樂城是個很多明星都在代言的線上賭博平台,玩家在這裡是用虛擬貨幣來存款,算是那種幣商型的賭場。這個平台沒有直接的提款選項,玩家要…
富遊娛樂城介紹
隨著2024年的到來,最新的線上娛樂平台排行榜已經更新,這一次的排名綜合考慮了各種因素,包括體驗金、促銷活動、提款效率和遊戲多樣性,目…
九州娛樂城介紹
九州娛樂城
九州娛樂城,也被稱作LEO娛樂城,致力於打造一個既安全又方便、公平公正的高品質娛樂服務平台。我們的目標是創造全新的線上娛樂城體驗,普及化娛樂服務,並努力成為娛樂網站界的領頭羊。需要注意的是,九州娛樂城、LEO娛樂城和THA娛樂城實際上是同一家公司的不同名稱。
九州娛樂城簡介
推薦指數:★★★★★(5分)
品牌名稱 : 九州娛樂城(LEO娛樂城)
創立時間 : 2003年
賭場類型 : 現金版娛樂城
遊戲種類 : 真人百家樂、運彩投注、電子老虎機、六合彩球、棋牌遊戲、捕魚機遊戲
存取速度 : 存款90秒 / 提款5-10分
軟體下載 : 無APP下載,支援網頁投注
Zet Casino No Deposit Bonus Codes: Holen Sie sich kostenlose Boni ohne Einzahlung
Wenn Sie auf der Suche nach einem aufregenden Online-Casino-Erlebnis sind, dann sollten Sie unbedingt Zet Casino ausprobieren. Dieses beliebte Online-Casino bietet eine Vielzahl von Spielen, groГџzГјgigen Boni und aufregenden Aktionen, die sicherstellen, dass Sie jede Minute Ihres Besuchs genieГџen werden.
Eines der großartigen Angebote, die Zet Casino für seine Spieler bereithält, sind die No Deposit Bonus Codes. Diese speziellen Codes ermöglichen es Ihnen, kostenlose Boni zu erhalten, ohne dass Sie eine Einzahlung tätigen müssen. Das bedeutet, dass Sie die Spiele im Casino ausprobieren können, ohne Ihr eigenes Geld riskieren zu müssen.
Um einen No Deposit Bonus Code bei Zet Casino zu erhalten, müssen Sie sich einfach registrieren und ein Konto erstellen. Sobald Ihr Konto aktiviert ist, können Sie Ihre Bonus Codes im Kassenbereich eingeben, um Ihren kostenlosen Bonus zu erhalten. Diese Boni können in Form von Freispielen, Gratisguthaben oder anderen Belohnungen angeboten werden.
Die No Deposit Bonus Codes bei Zet Casino sind eine großartige Möglichkeit, das Casino kennenzulernen und einige seiner besten Spiele auszuprobieren, ohne Ihr eigenes Geld riskieren zu müssen. Also worauf warten Sie noch? Registrieren Sie sich noch heute bei Zet Casino und holen Sie sich Ihre kostenlosen Boni! Viel Glück und viel Spaß beim Spielen!
https://zetcasino.one/
娛樂城推薦
Player線上娛樂城遊戲指南與評測
台灣最佳線上娛樂城遊戲的終極指南!我們提供專業評測,分析熱門老虎機、百家樂、棋牌及其他賭博遊戲。從遊戲規則、策略到選擇最佳娛樂城,我們全方位覆蓋,協助您更安全的遊玩。
Player如何評測:公正與專業的評分標準
在【Player娛樂城遊戲評測網】我們致力於為玩家提供最公正、最專業的娛樂城評測。我們的評測過程涵蓋多個關鍵領域,旨在確保玩家獲得可靠且全面的信息。以下是我們評測娛樂城的主要步驟:
娛樂城是什麼?
娛樂城是什麼?娛樂城是台灣對於線上賭場的特別稱呼,線上賭場分為幾種:現金版、信用版、手機娛樂城(娛樂城APP),一般來說,台灣人在稱娛樂城時,是指現金版線上賭場。
線上賭場在別的國家也有別的名稱,美國 – Casino, Gambling、中國 – 线上赌场,娱乐城、日本 – オンラインカジノ、越南 – Nhà cái。
娛樂城會被抓嗎?
在台灣,根據刑法第266條,不論是實體或線上賭博,參與賭博的行為可處最高5萬元罰金。而根據刑法第268條,為賭博提供場所並意圖營利的行為,可能面臨3年以下有期徒刑及最高9萬元罰金。一般賭客若被抓到,通常被視為輕微罪行,原則上不會被判處監禁。
信用版娛樂城是什麼?
信用版娛樂城是一種線上賭博平台,其中的賭博活動不是直接以現金進行交易,而是基於信用系統。在這種模式下,玩家在進行賭博時使用虛擬的信用點數或籌碼,這些點數或籌碼代表了一定的貨幣價值,但實際的金錢交易會在賭博活動結束後進行結算。
現金版娛樂城是什麼?
現金版娛樂城是一種線上博弈平台,其中玩家使用實際的金錢進行賭博活動。玩家需要先存入真實貨幣,這些資金轉化為平台上的遊戲籌碼或信用,用於參與各種賭場遊戲。當玩家贏得賭局時,他們可以將這些籌碼或信用兌換回現金。
娛樂城體驗金是什麼?
娛樂城體驗金是娛樂場所為新客戶提供的一種免費遊玩資金,允許玩家在不需要自己投入任何資金的情況下,可以進行各類遊戲的娛樂城試玩。這種體驗金的數額一般介於100元到1,000元之間,且對於如何使用這些體驗金以達到提款條件,各家娛樂城設有不同的規則。
Player線上娛樂城遊戲指南與評測
台灣最佳線上娛樂城遊戲的終極指南!我們提供專業評測,分析熱門老虎機、百家樂、棋牌及其他賭博遊戲。從遊戲規則、策略到選擇最佳娛樂城,我們全方位覆蓋,協助您更安全的遊玩。
Player如何評測:公正與專業的評分標準
在【Player娛樂城遊戲評測網】我們致力於為玩家提供最公正、最專業的娛樂城評測。我們的評測過程涵蓋多個關鍵領域,旨在確保玩家獲得可靠且全面的信息。以下是我們評測娛樂城的主要步驟:
娛樂城是什麼?
娛樂城是什麼?娛樂城是台灣對於線上賭場的特別稱呼,線上賭場分為幾種:現金版、信用版、手機娛樂城(娛樂城APP),一般來說,台灣人在稱娛樂城時,是指現金版線上賭場。
線上賭場在別的國家也有別的名稱,美國 – Casino, Gambling、中國 – 线上赌场,娱乐城、日本 – オンラインカジノ、越南 – Nhà cái。
娛樂城會被抓嗎?
在台灣,根據刑法第266條,不論是實體或線上賭博,參與賭博的行為可處最高5萬元罰金。而根據刑法第268條,為賭博提供場所並意圖營利的行為,可能面臨3年以下有期徒刑及最高9萬元罰金。一般賭客若被抓到,通常被視為輕微罪行,原則上不會被判處監禁。
信用版娛樂城是什麼?
信用版娛樂城是一種線上賭博平台,其中的賭博活動不是直接以現金進行交易,而是基於信用系統。在這種模式下,玩家在進行賭博時使用虛擬的信用點數或籌碼,這些點數或籌碼代表了一定的貨幣價值,但實際的金錢交易會在賭博活動結束後進行結算。
現金版娛樂城是什麼?
現金版娛樂城是一種線上博弈平台,其中玩家使用實際的金錢進行賭博活動。玩家需要先存入真實貨幣,這些資金轉化為平台上的遊戲籌碼或信用,用於參與各種賭場遊戲。當玩家贏得賭局時,他們可以將這些籌碼或信用兌換回現金。
娛樂城體驗金是什麼?
娛樂城體驗金是娛樂場所為新客戶提供的一種免費遊玩資金,允許玩家在不需要自己投入任何資金的情況下,可以進行各類遊戲的娛樂城試玩。這種體驗金的數額一般介於100元到1,000元之間,且對於如何使用這些體驗金以達到提款條件,各家娛樂城設有不同的規則。
Интернет-ресурс, где можно купить элегантные раковина ideal standard от ведущих производителей.
Как защитить свои данные: берегитесь утечек информации в интернете. Сегодня обеспечение безопасности своих данных становится более насущной важной задачей. Одним из наиболее распространенных способов утечки личной информации является слив «сит фраз» в интернете. Что такое сит фразы и в каком объеме сберечься от их утечки? Что такое «сит фразы»? «Сит фразы» — это комбинации слов или фраз, которые бывают используются для входа к различным онлайн-аккаунтам. Эти фразы могут включать в себя имя пользователя, пароль или дополнительные конфиденциальные данные. Киберпреступники могут пытаться получить доступ к вашим аккаунтам, с помощью этих сит фраз. Как охранить свои личные данные? Используйте непростые пароли. Избегайте использования простых паролей, которые мгновенно угадать. Лучше всего использовать комбинацию букв, цифр и символов. Используйте уникальные пароли для каждого аккаунта. Не применяйте один и тот же пароль для разных сервисов. Используйте двухэтапную аутентификацию (2FA). Это прибавляет дополнительный уровень безопасности, требуя подтверждение входа на ваш аккаунт путем другое устройство или метод. Будьте осторожны с онлайн-сервисами. Не доверяйте свою информацию ненадежным сайтам и сервисам. Обновляйте программное обеспечение. Установите обновления для вашего операционной системы и программ, чтобы сохранить свои данные от вредоносного ПО. Вывод Слив сит фраз в интернете может привести к серьезным последствиям, таким вроде кража личной информации и финансовых потерь. Чтобы охранить себя, следует принимать меры предосторожности и использовать надежные методы для хранения и управления своими личными данными в сети
сид фразы кошельков
Сид-фразы, или напоминающие фразы, представляют собой комбинацию слов, которая используется для генерации или восстановления кошелька криптовалюты. Эти фразы обеспечивают вход к вашим криптовалютным средствам, поэтому их секурное хранение и использование крайне важны для защиты вашего криптоимущества от утери и кражи.
Что такое сид-фразы кошельков криптовалют?
Сид-фразы формируют набор случайными средствами сгенерированных слов, часто от 12 до 24, которые предназначены для создания уникального ключа шифрования кошелька. Этот ключ используется для восстановления доступа к вашему кошельку в случае его повреждения или утери. Сид-фразы обладают высокой степенью защиты и шифруются, что делает их секурными для хранения и передачи.
Зачем нужны сид-фразы?
Сид-фразы жизненно важны для обеспечения безопасности и доступности вашего криптоимущества. Они позволяют восстановить вход к кошельку в случае утери или повреждения физического устройства, на котором он хранится. Благодаря сид-фразам вы можете просто создавать резервные копии своего кошелька и хранить их в безопасном месте.
Как обеспечить безопасность сид-фраз кошельков?
Никогда не передавайте сид-фразой ни с кем. Сид-фраза является вашим ключом к кошельку, и ее раскрытие может привести к утере вашего криптоимущества.
Храните сид-фразу в надежном месте. Используйте физически надежные места, такие как банковские ячейки или специализированные аппаратные кошельки, для хранения вашей сид-фразы.
Создавайте резервные копии сид-фразы. Регулярно создавайте резервные копии вашей сид-фразы и храните их в разных безопасных местах, чтобы обеспечить возможность доступа к вашему кошельку в случае утери или повреждения.
Используйте дополнительные меры безопасности. Включите другие методы защиты и двухфакторную верификацию для своего кошелька криптовалюты, чтобы обеспечить дополнительный уровень безопасности.
Заключение
Сид-фразы кошельков криптовалют являются ключевым элементом защищенного хранения криптоимущества. Следуйте рекомендациям по безопасности, чтобы защитить свою сид-фразу и обеспечить безопасность своих криптовалютных средств.
Криптокошельки с балансом: зачем их покупают и как использовать
В мире криптовалют все возрастающую популярность приобретают криптокошельки с предустановленным балансом. Это особые кошельки, которые уже содержат определенное количество криптовалюты на момент покупки. Но зачем люди приобретают такие кошельки, и как правильно использовать их?
Почему покупают криптокошельки с балансом?
Удобство: Криптокошельки с предустановленным балансом предлагаются как готовое решение для тех, кто хочет быстро начать пользоваться криптовалютой без необходимости покупки или обмена на бирже.
Подарок или награда: Иногда криптокошельки с балансом используются как подарок или премия в рамках акций или маркетинговых кампаний.
Анонимность: При покупке криптокошелька с балансом нет необходимости предоставлять личные данные, что может быть важно для тех, кто ценит анонимность.
Как использовать криптокошелек с балансом?
Проверьте безопасность: Убедитесь, что кошелек безопасен и не подвержен взлому. Проверьте репутацию продавца и источник приобретения кошелька.
Переведите средства на другой кошелек: Если вы хотите долгосрочно хранить криптовалюту, рекомендуется перевести средства на более безопасный или удобный для вас кошелек.
Не храните все средства на одном кошельке: Для обеспечения безопасности рекомендуется распределить средства между несколькими кошельками.
Будьте осторожны с фишингом и мошенничеством: Помните, что мошенники могут пытаться обмануть вас, предлагая криптокошельки с балансом с целью получения доступа к вашим средствам.
Заключение
Криптокошельки с балансом могут быть удобным и легким способом начать пользоваться криптовалютой, но необходимо помнить о безопасности и осторожности при их использовании.Выбор и приобретение криптокошелька с балансом – это серьезный шаг, который требует внимания к деталям и осознанного подхода.”
Слив сид фраз (seed phrases) является единственным из наиболее популярных способов утечки личных информации в мире криптовалют. В этой статье мы разберем, что такое сид фразы, зачем они важны и как можно защититься от их утечки.
Что такое сид фразы?
Сид фразы, или мнемонические фразы, являются комбинацию слов, которая используется для формирования или восстановления кошелька криптовалюты. Обычно сид фраза состоит из 12 или 24 слов, которые представляют собой ключ к вашему кошельку. Потеря или утечка сид фразы может вести к потере доступа к вашим криптовалютным средствам.
Почему важно защищать сид фразы?
Сид фразы представляют ключевым элементом для секурного хранения криптовалюты. Если злоумышленники получат доступ к вашей сид фразе, они сумеют получить доступ к вашему кошельку и украсть все средства.
Как защититься от утечки сид фраз?
Никогда не передавайте свою сид фразу любому, даже если вам похоже, что это авторизованное лицо или сервис.
Храните свою сид фразу в безопасном и надежном месте. Рекомендуется использовать аппаратные кошельки или специальные программы для хранения сид фразы.
Используйте экстра методы защиты, такие как двухфакторная аутентификация (2FA), для усиления безопасности вашего кошелька.
Регулярно делайте резервные копии своей сид фразы и храните их в разнообразных безопасных местах.
Заключение
Слив сид фраз является существенной угрозой для безопасности владельцев криптовалют. Понимание важности защиты сид фразы и принятие соответствующих мер безопасности помогут вам избежать потери ваших криптовалютных средств. Будьте бдительны и обеспечивайте надежную защиту своей сид фразы
In den letzten Jahren haben Online-Casinos und Sportwetten an Popularität gewonnen. Viele Spieler sind auf der Suche nach einer Plattform, die beides anbietet, um ihr Glück zu versuchen. Das Tipico Casino ist eine solche Plattform, die eine große Auswahl an Casino-Spielen sowie Sportwetten anbietet.
Eine Besonderheit des Tipico Casinos sind die sogenannten “Casino Chips”. Diese Chips kГ¶nnen im Casino-Bereich des Tipico Casinos verwendet werden, um verschiedene Spiele zu spielen. Sie kГ¶nnen entweder durch den Kauf mit echtem Geld erworben werden oder durch das Spielen von Casino-Spielen verdient werden. Die Chips ermГ¶glichen es den Spielern, ihr Geld effizient zu verwalten und das Risiko zu minimieren, da sie nicht direkt mit ihrem eigenen Geld spielen.
Eine interessante Funktion des Tipico Casinos ist die Möglichkeit, die Casino Chips auch für Sportwetten zu verwenden. Spieler können ihre Chips auf verschiedene Sportveranstaltungen setzen und ihre Gewinne direkt auf ihr Konto im Tipico Casino gutschreiben lassen. Dies bietet den Spielern die Möglichkeit, ihre Casino-Gewinne in echte Wetten zu investieren und möglicherweise noch mehr Geld zu gewinnen.
Durch die Verwendung von Casino Chips für Sportwetten erhalten die Spieler eine zusätzliche Flexibilität und eine neue Möglichkeit, ihr Glück zu versuchen. Dies kann besonders attraktiv sein für Spieler, die sowohl an Casino-Spielen als auch an Sportwetten interessiert sind. Das Tipico Casino bietet eine innovative und unterhaltsame Möglichkeit, beides miteinander zu verbinden.
Insgesamt bieten die Casino Chips im Tipico Casino den Spielern eine einzigartige Erfahrung, die es ermöglicht, sowohl Casino-Spiele als auch Sportwetten zu genießen. Mit einer Vielzahl von Spielen und Wettoptionen zur Auswahl, ist das Tipico Casino eine ideale Plattform für alle, die auf der Suche nach einer Kombination aus Unterhaltung und Gewinnmöglichkeiten sind.
https://tipicocasino.one/
A ticket is an application of requests balforum.net that is registered by support services. The ticket system is an advanced tool that automates the operation of various services. Solutions relevant for registration, as well as processing customer requests.
Economics of personal time. While the employees are cleaning poiskmonet.com, the customer can fully relax or assign additional work.
To speed up the search according to the parameters required by the user politeconomics.org, the site page has a filter system that allows you to select tours based on the following indicators.
Selecting and comparing offers is quick and easy mmo5.info. The site allows you to set the issue according to an economical, optimal or luxury vacation option. For families, couples, or companies, you can choose your own tour options, where you can accurately calculate all the parameters and determine the cost of travel for everyone or for one person.
Tipico Casino ist eine beliebte Online GlГјcksspielplattform, die eine Vielzahl von spannenden Spielen und groГџzГјgigen Boni anbietet. Eines der wichtigsten Funktionen, die Spieler interessiert, ist die Auszahlung von Gewinnen.
Um eine Auszahlung vorzunehmen, mГјssen Spieler zuerst sicherstellen, dass sie sich in ihrem Konto anmelden und auf die Kasse Seite zugreifen. Dort finden sie die Option “Auszahlung” und kГ¶nnen den Betrag wГ¤hlen, den sie gerne auszahlen mГ¶chten.
Es ist wichtig zu beachten, dass die Auszahlungsmethoden bei Tipico Casino variieren können und von Land zu Land unterschiedlich sein können. Zu den gängigen Auszahlungsmethoden gehören Banküberweisungen, Kreditkarten, E-Wallets und andere Online-Zahlungsdienste.
Es kann auch sein, dass Tipico Casino bestimmte Sicherheitsüberprüfungen durchführt, bevor eine Auszahlung genehmigt wird. Dazu gehören die Überprüfung der Identität des Spielers und möglicherweise die Überprüfung der Zahlungsinformationen.
Es ist ratsam, sich vor der Auszahlung mit den Geschäftsbedingungen vertraut zu machen, um sicherzustellen, dass alle Anforderungen und Bedingungen erfüllt sind. Es kann auch eine Mindestauszahlungsgrenze geben, die beachtet werden muss.
Insgesamt ist die Auszahlung von Gewinnen bei Tipico Casino ein einfacher und unkomplizierter Prozess, der dazu beiträgt, dass Spieler ihre Gewinne schnell und bequem erhalten können. Es ist jedoch wichtig, sich mit den Richtlinien und Verfahren vertraut zu machen, um mögliche Verzögerungen oder Probleme zu vermeiden.
https://tipicocasino.one/
124SDS9742
naoni.info
audio-kravec.com
Магазин с широким выбором раковина из камня круглая для вашей ванной комнаты.
Мы рекомендуем посетить веб-сайт https://lodtrk.org.ua/kak-pravilno-vybrat-udochku-sekrety-uspeshnoy-rybalki/.
Кроме того, не забудьте добавить сайт в закладки: [url=https://lodtrk.org.ua/kak-pravilno-vybrat-udochku-sekrety-uspeshnoy-rybalki/]https://lodtrk.org.ua/kak-pravilno-vybrat-udochku-sekrety-uspeshnoy-rybalki/[/url]
Wenn Sie Ihr Konto bei Zet Casino löschen möchten, gibt es einige wichtige Schritte zu beachten. Das Löschen eines Kontos bei einem Online-Casino kann eine endgültige Entscheidung sein, daher ist es wichtig, alle Aspekte zu berücksichtigen, bevor Sie diesen Schritt gehen.
Zunächst sollten Sie sicherstellen, dass Ihr Konto bei Zet Casino keine offenen Wetten, Guthaben oder Boni aufweist. Stellen Sie sicher, dass alle Transaktionen abgeschlossen sind, bevor Sie Ihr Konto löschen.
Um Ihr Konto bei Zet Casino zu löschen, müssen Sie sich an den Kundendienst des Casinos wenden. Dies kann normalerweise per E-Mail oder Live-Chat erfolgen. Sie müssen dem Kundendienstmitarbeiter Ihre Gründe für die Löschung Ihres Kontos mitteilen und gegebenenfalls einige Sicherheitsfragen beantworten.
Es ist wichtig zu beachten, dass das Löschen Ihres Kontos bei Zet Casino irreversible Folgen haben kann. Sie verlieren den Zugriff auf Ihr Konto, alle Guthaben, Boni und möglicherweise auch Ihre gesammelten Punkte oder Belohnungen.
Bevor Sie Ihr Konto löschen, sollten Sie auch Alternativen wie eine vorübergehende Sperrung in Betracht ziehen. Auf diese Weise können Sie Ihr Konto für einen bestimmten Zeitraum deaktivieren, ohne es endgültig zu löschen.
Insgesamt ist das Löschen Ihres Zet Casino-Kontos eine wichtige Entscheidung, die sorgfältig überlegt sein sollte. Stellen Sie sicher, dass Sie alle offenen Transaktionen abgeschlossen haben und Beratung bei Bedarf beim Kundendienst des Casinos einholen.
https://zetcasino.one/
biznesnewss.com
auto-kar.net
https://www.google.com.uy/url?q=http://taromir.ru/index/8-2764
шпунт ларсена л5 ум https://shpuntmaster.ru/
Casino-Darts bei Tipico: Ein spannender SpielspaГџ fГјr alle Dart-Fans
Dart ist ein Spiel, das nicht nur in Pubs und Kneipen, sondern auch in Casinos immer beliebter wird. Bei Tipico können auch Casino-Gäste jetzt ihre Dart-Fähigkeiten unter Beweis stellen und tolle Preise gewinnen.
Das Prinzip des Casino-Darts bei Tipico ist ganz einfach: Die Spieler werfen abwechselnd auf eine elektronische Dartscheibe und versuchen, möglichst viele Punkte zu erzielen. Dabei gibt es verschiedene Spielmodi und Schwierigkeitsgrade, die für Abwechslung und Spannung sorgen.
Besonders reizvoll ist dabei die Möglichkeit, gegen andere Spieler anzutreten und sich mit diesen zu messen. So wird das Casino-Darts bei Tipico zu einem echten Gemeinschaftserlebnis, bei dem der Spaßfaktor garantiert nicht zu kurz kommt.
Neben dem Spielspaß bietet das Casino-Darts bei Tipico auch die Chance, attraktive Preise zu gewinnen. Je nach Leistung können die Spieler zum Beispiel Freispiele, Bonusguthaben oder andere tolle Gewinne erhalten.
Fazit: Das Casino-Darts bei Tipico ist eine tolle Möglichkeit, um sein Können am Dartboard unter Beweis zu stellen und dabei auch noch Spaß zu haben. Also nichts wie hin und ab an die Dartscheibe!
https://tipicocasino.one/
Bei Zet Casino handelt es sich um einen beliebten Online-Glücksspielanbieter, der seinen Spielern eine Vielzahl von spannenden Spielen und lukrativen Bonusangeboten bietet. Einer dieser Boni ist der Zet Casino Bonus Code ohne Einzahlung, der den Spielern die Möglichkeit gibt, kostenloses Bonusguthaben zu erhalten, ohne dafür eine Einzahlung tätigen zu müssen.
Um diesen Bonus zu erhalten, müssen Spieler lediglich den entsprechenden Bonus Code bei der Registrierung ihres Kontos eingeben. Anschließend wird das Bonusguthaben automatisch auf ihr Konto gutgeschrieben und sie können damit die verschiedenen Spiele im Casino ausprobieren, ohne eigenes Geld einzahlen zu müssen.
Der Zet Casino Bonus Code ohne Einzahlung ist eine großartige Möglichkeit für Spieler, das Casino und seine Spiele risikofrei kennenzulernen und dabei echte Gewinne zu erzielen. Allerdings sollten Spieler beachten, dass diese Art von Bonus oft mit bestimmten Umsatzbedingungen verbunden ist, die sie erfüllen müssen, bevor sie sich ihre Gewinne auszahlen lassen können.
Insgesamt ist der Zet Casino Bonus Code ohne Einzahlung eine attraktive Option für Spieler, die nach einem risikofreien Einstieg in die Welt des Online-Glücksspiels suchen. Mit diesem Bonus können Spieler die verschiedenen Spiele im Casino ausprobieren, ohne dabei ihr eigenes Geld aufs Spiel zu setzen. Wer sein Glück versuchen möchte, sollte diesen Bonus auf jeden Fall in Anspruch nehmen und die spannenden Spiele im Zet Casino entdecken.
https://zetcasino.one/
Kantorbola adalah situs slot gacor terbaik di indonesia , kunjungi situs RTP kantor bola untuk mendapatkan informasi akurat slot dengan rtp diatas 95% . Kunjungi juga link alternatif kami di kantorbola77 dan kantorbola99 .
что такое кодировка от алкоголя https://e-skoraya.kz/
africanownews.com
219news.com
плойка дайсон купить [url=http://www.dyson-2024.com]купить дайсон стайлер[/url] .
Магазин, где мои друзья заказывали раковина из мрамора для ванной комнаты.
Found a captivating read that I’d like to recommend to you http://ls.ruanime.org/2024/05/06/stavte-na-uspeh-vashe-kazino-betunlim-zhdet-vas.html
bliloblo
Интернет-магазин с большим количеством laufen palomba раковина для вашей ванной комнаты.
[url=https://megauto.online]Трансфер Казань[/url] – Автобусы Магнитогорск, Пассажирские перевозки
boomerang.bet Casino Review
Das boomerang.bet Casino ist eine aufstrebende Online-GlГјcksspielplattform, die sowohl traditionelle Casinospiele als auch Sportwetten anbietet. Mit einer Vielzahl von Spielen und groГџzГјgigen Boni ist es kein Wunder, dass diese Website bei Spielern auf der ganzen Welt beliebt geworden ist.
Das Casino verfügt über eine benutzerfreundliche Oberfläche, die es Spielern ermöglicht, schnell und einfach durch die verschiedenen Spiele zu navigieren. Von klassischen Spielautomaten über Blackjack und Roulette bis hin zu Live-Dealer-Spielen bietet boomerang.bet eine breite Palette an Optionen für alle Arten von Spielern.
Ein weiterer großer Pluspunkt des Casinos sind die regelmäßigen Boni und Promotionen, die es anbietet. Neue Spieler werden mit einem großzügigen Willkommensbonus belohnt, der es ihnen ermöglicht, ihr Spielabenteuer mit zusätzlichem Bonusgeld zu beginnen. Darüber hinaus gibt es regelmäßig Aktionen wie Freispiele, Einzahlungsboni und Treueprogramme, die es den Spielern ermöglichen, ihr Guthaben aufzustocken und zusätzliche Gewinne zu erzielen.
Ein weiterer positiver Aspekt des boomerang.bet Casinos ist der Kundenservice. Das Team steht rund um die Uhr zur Verfügung und ist per Live-Chat, E-Mail und Telefon erreichbar, um alle Fragen oder Probleme der Spieler zu lösen. Dieser professionelle und freundliche Service sorgt dafür, dass sich die Spieler gut aufgehoben fühlen und ein erstklassiges Spielerlebnis haben.
Alles in allem bietet das boomerang.bet Casino eine unterhaltsame und sichere Spielumgebung fГјr alle Arten von Spielern. Mit einer breiten Palette von Spielen, groГџzГјgigen Boni und einem exzellenten Kundenservice ist dieses Casino definitiv einen Besuch wert. Probieren Sie es aus und sehen Sie selbst, warum boomerang.bet Casino so beliebt geworden ist.
https://boomerangcasino.one/
Zet Casino: Kostenlose Freispiele im Casino
Zet Casino ist eine der beliebtesten Online-Glücksspielseiten, die unglaubliche Unterhaltung anbietet. Das Casino ist bekannt für seine großzügigen Boni und Aktionen, darunter auch kostenlose Freispiele. Diese Freispiele sind eine großartige Möglichkeit für Spieler, um einige der aufregendsten Spielautomaten im Casino zu genießen, ohne dabei ihr eigenes Geld verwenden zu müssen.
Zet Casino bietet regelmäßig neue Promotionen an, bei denen Spieler kostenlose Freispiele als Belohnung erhalten können. Diese Freispiele können auf ausgewählten Spielautomaten eingesetzt werden und bieten die Chance, echtes Geld zu gewinnen, ohne dabei eigenes Geld riskieren zu müssen.
Spieler können sich für die kostenlosen Freispiele qualifizieren, indem sie bestimmte Anforderungen erfüllen, wie z.B. eine Mindesteinzahlung tätigen oder an ausgewählten Spielen spielen. Die Freispiele werden dann automatisch dem Spielerkonto gutgeschrieben und können sofort verwendet werden.
Die Auswahl an Spielautomaten, auf denen die kostenlosen Freispiele eingesetzt werden kГ¶nnen, ist bei Zet Casino umfangreich. Spieler kГ¶nnen aus Hunderten von verschiedenen Spielen wГ¤hlen, darunter beliebte Titel wie Starburst, Book of Dead, Gonzo’s Quest und viele mehr.
Zet Casino legt großen Wert auf Fairness und Transparenz, daher sind die Bedingungen für die kostenlosen Freispiele klar und leicht verständlich. Spieler können sich darauf verlassen, dass sie bei Zet Casino eine sichere und vertrauenswürdige Spielumgebung vorfinden.
Wenn Sie also Lust haben, einige der besten Online-Spielautomaten zu spielen, ohne dabei Ihr eigenes Geld zu riskieren, dann sollten Sie unbedingt die kostenlosen Freispiele bei Zet Casino in Anspruch nehmen. Melden Sie sich noch heute an und profitieren Sie von den groГџzГјgigen Angeboten und Promotionen des Casinos. Viel SpaГџ und viel GlГјck beim Spielen bei Zet Casino!
https://zetcasino.one/
https://satbayev.university/
Das Tipico Casino bietet nun auch eine App speziell für iPhone Nutzer an. Die Tipico Casino iPhone App ermöglicht es Spielern, ihre Lieblingsspiele auch von unterwegs aus zu spielen.
Die App ist einfach zu bedienen und bietet eine breite Auswahl an Casino Spielen, darunter Slots, Blackjack, Roulette und mehr. Die Grafik und Soundeffekte sind erstklassig und sorgen fГјr ein authentisches Casino-Erlebnis.
Ein besonderes Highlight der Tipico Casino iPhone App sind die Live Casino Spiele, bei denen Spieler gegen echte Dealer spielen können. Dies verleiht dem Spiel eine zusätzliche Spannung und Realismus.
Einzahlungen und Auszahlungen können bequem über die App vorgenommen werden, und mit der sicheren SSL-Verschlüsselung können Spieler beruhigt sein, dass ihre persönlichen Daten geschützt sind.
Mit regelmäßigen Aktionen und Boni bietet das Tipico Casino iPhone Spielern zusätzliche Anreize und Belohnungen. Die App ist kostenlos im App Store erhältlich und kann sowohl auf dem iPhone als auch auf dem iPad genutzt werden.
Alles in allem ist die Tipico Casino iPhone App eine großartige Möglichkeit, Casino-Spiele auch unterwegs zu genießen. Probieren Sie es noch heute aus und erleben Sie das aufregende Casino-Erlebnis direkt auf Ihrem iPhone.
https://tipicocasino.one/
ремонт телефонов рядом
где отремонтировать телефон
1SS3D249742
ремонт мобильных телефонов
ремонт сотовых телефонов
ремонт мобильных телефонов
1249742
I highly advise to avoid this site. The experience I had with it has been only frustration and doubts about scamming practices. Be extremely cautious, or better yet, find a more reputable platform for your needs.
1SS3D249742
Das Tipico Live Casino ist eine beliebte Plattform für Casino-Enthusiasten, die gerne in Echtzeit gegen echte Dealer spielen möchten. Um bei Tipico Live Casino einzahlen zu können, sollten Sie zunächst ein Konto bei Tipico erstellen. Dies ist ein einfacher Prozess, bei dem Sie persönliche Daten wie Ihren Namen, Ihre Adresse und Ihre Telefonnummer angeben müssen.
Nachdem Sie ein Konto erstellt haben, können Sie Geld auf Ihr Tipico-Konto einzahlen, um in das Live Casino zu gelangen. Es gibt mehrere Zahlungsmethoden, die von Tipico akzeptiert werden, darunter Kreditkarten, Debitkarten, E-Wallets und Banküberweisungen. Wählen Sie einfach die für Sie bevorzugte Zahlungsmethode aus und geben Sie den Betrag ein, den Sie einzahlen möchten.
Sobald das Geld auf Ihrem Tipico-Konto gutgeschrieben wurde, können Sie es im Live Casino verwenden, um verschiedene Spiele wie Roulette, Blackjack, Poker und Baccarat zu spielen. Die Live-Dealer-Spiele bieten eine realistische Casino-Erfahrung, da Sie mit echten Dealern interagieren können, die die Karten mischen und die Räder drehen.
Es ist wichtig zu beachten, dass das Spielen im Live Casino mit echtem Geld Risiken birgt und verantwortungsbewusstes Spielen immer an erster Stelle stehen sollte. Spielen Sie niemals mit Geld, das Sie sich nicht leisten können zu verlieren, und setzen Sie sich ein Budget, das Sie einhalten können.
Insgesamt ist das Tipico Live Casino eine spannende Plattform für Casino-Spieler, die gerne in Echtzeit gegen echte Dealer antreten möchten. Mit einer einfachen Einzahlung können Sie in kürzester Zeit in die Welt des Live-Casinos eintauchen und ein aufregendes Spielerlebnis genießen.
https://tipicocasino.one/
pronovosti.org
Willkommen im Zet Casino und sichern Sie sich den großzügigen Willkommensbonus! Das Zet Casino ist ein beliebtes Online-Casino, das eine Vielzahl von Spielen und aufregenden Bonusangeboten für seine Spieler bereithält. Einer der attraktivsten Aspekte des Zet Casinos ist der lukrative Willkommensbonus, den neue Spieler bei ihrer ersten Einzahlung erhalten können.
Der Zet Casino Willkommensbonus belohnt neue Spieler mit einem großzügigen Bonusguthaben und Freispielen für ausgewählte Spiele. Um von diesem Bonusangebot zu profitieren, müssen neue Spieler lediglich ein Konto im Zet Casino erstellen und eine erste Einzahlung tätigen. Der Willkommensbonus wird dann automatisch auf das Spielerkonto gutgeschrieben.
Das Bonusguthaben kann für eine Vielzahl von Spielen im Zet Casino verwendet werden, darunter Spielautomaten, Tischspiele und Live-Casino-Spiele. Die Freispiele, die im Rahmen des Willkommensbonus angeboten werden, können auf ausgewählten Spielautomaten gespielt werden und bieten die Chance, zusätzliche Gewinne zu erzielen.
Es ist wichtig zu beachten, dass der Zet Casino Willkommensbonus bestimmten Umsatzbedingungen unterliegt, die erfüllt werden müssen, bevor Gewinne aus dem Bonusguthaben ausgezahlt werden können. Diese Umsatzbedingungen variieren je nach Angebot und sind auf der Website des Zet Casinos ausführlich beschrieben.
Wenn Sie also auf der Suche nach einem erstklassigen Online-Casino mit lukrativen Bonusangeboten sind, ist das Zet Casino definitiv einen Besuch wert. Nutzen Sie den Willkommensbonus, um Ihr Spielerlebnis zu maximieren und spannende Spiele zu genieГџen. Viel SpaГџ und viel GlГјck im Zet Casino!
https://zetcasino.one/
365newss.net
124969D742
kantorbola99
Kantorbola adalah situs slot gacor terbaik di indonesia , kunjungi situs RTP kantor bola untuk mendapatkan informasi akurat slot dengan rtp diatas 95% . Kunjungi juga link alternatif kami di kantorbola77 dan kantorbola99 .
закодировать от алкоголизма https://narcolog1.kz/
Tipico ist eine der führenden Online-Wettseiten in Deutschland, und sein Casino-Bereich, alles Spitze Tipico Casino, ist beliebt bei Spielern auf der ganzen Welt. Mit einer Vielzahl von Spielen und einer benutzerfreundlichen Oberfläche bietet das alles Spitze Tipico Casino ein erstklassiges Spielerlebnis.
Das Casino bietet eine breite Auswahl an Spielen, darunter klassische Tischspiele wie Blackjack, Roulette und Poker, sowie eine Vielzahl von Spielautomaten und Jackpot-Slots. Die Spiele sind von fГјhrenden Anbietern wie NetEnt, Microgaming und Play’n GO entwickelt worden, was fГјr eine hohe QualitГ¤t und ein spannendes Spielerlebnis sorgt.
Darüber hinaus bietet das alles Spitze Tipico Casino eine Vielzahl von Bonusangeboten und Aktionen für Spieler. Neue Spieler können sich über einen großzügigen Willkommensbonus freuen, während treue Spieler regelmäßig mit Freispielen und anderen Belohnungen belohnt werden.
Die Ein- und Auszahlungen im Casino sind sicher und einfach, und der Kundenservice steht rund um die Uhr zur Verfügung, um bei Fragen oder Problemen zu helfen. Das alles Spitze Tipico Casino ist auch auf mobilen Geräten verfügbar, sodass Spieler ihre Lieblingsspiele jederzeit und überall genießen können.
Insgesamt bietet das alles Spitze Tipico Casino ein erstklassiges Spielerlebnis mit einer Vielzahl von Spielen, groГџzГјgigen Boni und einem exzellenten Kundenservice. Es ist kein Wunder, dass es bei Spielern auf der ganzen Welt so beliebt ist. Probieren Sie es doch selbst aus und erleben Sie die Spannung und Aufregung des alles Spitze Tipico Casinos.
https://tipicocasino.one/
Thanks a lot for sharing this with all people you really understand what you’re talking approximately! Bookmarked. Please additionally discuss with my web site =). We can have a link change contract among us
http://www.lands-diploman.com
Место, где можно купить надежные овальные чёрные раковины по выгодным ценам.
ремонт сотовых телефонов
Immer mehr Menschen nutzen heutzutage ihre mobilen Endgeräte, um in Online-Casinos zu spielen. Eine beliebte Option für Casino-Fans ist die Tipico Casino App.
Die Tipico Casino App bietet Spielern die Möglichkeit, eine Vielzahl von Casino-Spielen direkt auf ihrem Smartphone oder Tablet zu spielen. Die App ist einfach zu bedienen und bietet eine benutzerfreundliche Oberfläche, die es den Nutzern ermöglicht, schnell und einfach auf ihre Lieblingsspiele zuzugreifen.
Mit der Tipico Casino App können Spieler eine breite Palette von Spielen genießen, darunter Slots, Tischspiele und Live-Casino-Spiele. Die App bietet auch regelmäßige Promotionen und Boni für die Spieler, die es ihnen ermöglichen, ihre Gewinne zu maximieren.
Ein weiterer Vorteil der Tipico Casino App ist die Möglichkeit, auch unterwegs zu spielen. Egal, ob man in der U-Bahn sitzt, im Wartezimmer des Arztes ist oder einfach nur zu Hause auf der Couch entspannen möchte, die Tipico Casino App ermöglicht es den Spielern, jederzeit und überall zu spielen.
Insgesamt bietet die Tipico Casino App eine großartige Möglichkeit für Casino-Fans, ihre Lieblingsspiele unterwegs zu spielen. Mit einer benutzerfreundlichen Oberfläche, einer Vielzahl von Spielen und regelmäßigen Promotionen ist die Tipico Casino App definitiv einen Blick wert. Probieren Sie es aus und erleben Sie das ultimative Casinoerlebnis in der Tipico Casino App!
https://tipicocasino.one/
Zet Casino Auszahlung
Zet Casino ist ein beliebtes Online-Casino, das eine Vielzahl von Spielen und groГџzГјgigen Boni anbietet. Ein wichtiger Aspekt fГјr jeden Spieler ist die Auszahlung von Gewinnen. In diesem Artikel werden wir uns genauer mit der Zet Casino Auszahlung befassen.
Zet Casino bietet eine Vielzahl von Zahlungsmethoden für die Auszahlung von Gewinnen an. Zu den gängigen Optionen gehören Kreditkarten, E-Wallets wie Skrill und Neteller, sowie Banküberweisungen. Die Auszahlungsdauer hängt von der gewählten Zahlungsmethode ab. E-Wallets bieten in der Regel die schnellsten Auszahlungen, während Banküberweisungen etwas länger dauern können.
Um eine Auszahlung bei Zet Casino zu tätigen, müssen Spieler zunächst ihr Konto verifizieren. Dazu müssen sie eine Kopie ihres Personalausweises oder Reisepasses sowie einen Adressnachweis einreichen. Dies dient der Sicherheit der Spieler und der Einhaltung der gesetzlichen Vorschriften.
Es ist wichtig zu beachten, dass Zet Casino Auszahlungen in der Regel innerhalb von 24 Stunden bearbeitet werden. Allerdings kann es je nach Zahlungsmethode einige Tage dauern, bis das Geld auf dem Konto des Spielers gutgeschrieben wird.
Insgesamt ist die Zet Casino Auszahlung zuverlässig und sicher. Spieler können sich darauf verlassen, dass ihre Gewinne schnell und unkompliziert ausgezahlt werden. Wenn Sie also auf der Suche nach einem zuverlässigen Online-Casino mit schnellen Auszahlungen sind, ist Zet Casino eine gute Wahl.
https://zetcasino.one/
где отремонтировать телефон
Мы рекомендуем посетить веб-сайт https://kobovec.org.ua/interesnoe/issledovanie-produktivnye-tovary-dlya-rybakov-kotorye-uluchshat-vash-opyt/.
Кроме того, не забудьте добавить сайт в закладки: [url=https://kobovec.org.ua/interesnoe/issledovanie-produktivnye-tovary-dlya-rybakov-kotorye-uluchshat-vash-opyt/]https://kobovec.org.ua/interesnoe/issledovanie-produktivnye-tovary-dlya-rybakov-kotorye-uluchshat-vash-opyt/[/url]
[url=https://t.me/modeli_individyalki_moskvy]элитные девочки москвы[/url] – взрослый досуг объявления, элитные девочки москвы
[url=https://megauto.online]Такси межгород Уфа[/url] – Междугородние перевозки Набережные Челны, Автобусы Уфа
Das Boomerang Casino ist eine beliebte Online-Glücksspielplattform, die Spielern eine Vielzahl von Spielen und Funktionen bietet. Eine der neuesten Entwicklungen auf der Website ist die Einführung der Desktop-Version des Casinos, die es Spielern ermöglicht, die Spiele auf ihren Computern zu spielen.
Die Desktop-Version von Boomerang Casino bietet Spielern eine verbesserte Spielumgebung mit größerem Bildschirm und einfacherer Navigation. Spieler können nun eine breitere Auswahl an Spielen genießen, darunter Slots, Tischspiele, Live-Casino und mehr, direkt von ihrem Computer aus. Die Benutzeroberfläche ist benutzerfreundlich gestaltet und bietet Spielern eine reibungslose Spielerfahrung.
Die Desktop-Version des Boomerang Casinos bietet auch die Möglichkeit, Boni und Aktionen zu nutzen, die exklusiv für Desktop-Spieler verfügbar sind. Spieler können von speziellen Angeboten profitieren, die ihnen zusätzliche Belohnungen und Vergünstigungen bieten.
Mit der Einführung der Desktop-Version des Boomerang Casinos können Spieler nun die Spiele ihrer Wahl von überall und jederzeit genießen. Es wird empfohlen, dass Spieler regelmäßig nach Updates und neuen Spielen Ausschau halten, um das Beste aus ihrer Spielerfahrung zu machen.
Insgesamt bietet die Desktop-Version des Boomerang Casinos Spielern eine verbesserte und unterhaltsame Spielerfahrung mit einer breiten Palette von Spielen und Funktionen. Es lohnt sich auf jeden Fall, es auszuprobieren und zu sehen, was es zu bieten hat.
https://boomerangcasino.one/
blibliblu
Conventionally, forklifts can be divided domstroi.info into manual and self-propelled. The manual version must be moved by the operator, which may require some effort if the weight of the load exceeds a thousand kilograms. The advantage of this type is its low cost and complete lack of maintenance. However, such a loader will not lift the load to too great a height.
ukrtvoru.info
https://maps.google.com.pr/url?q=https://huisdierengids.nl/author/cennop/
ремонт бытовой технки
Das Boomerang Online Casino bietet seinen Spielern eine Vielzahl von spannenden Spielen und großzügigen Boni. Mit einer benutzerfreundlichen Oberfläche und einer breiten Auswahl an Spielen, ist dieses Casino bei Online-Glücksspielern sehr beliebt.
Das Boomerang Online Casino ist lizenziert und reguliert, um ein sicheres und faires Spielerlebnis zu gewährleisten. Die Spieler können aus einer Vielzahl von beliebten Spielen wie Spielautomaten, Roulette, Blackjack und Poker wählen.
Darüber hinaus bietet das Boomerang Online Casino regelmäßig attraktive Bonusangebote und Aktionen an, um die Spieler zu belohnen und ihre Gewinnchancen zu erhöhen. Diese Boni können in Form von Freispielen, Einzahlungsboni oder Cashback-Angeboten erfolgen.
Ein weiterer Vorteil des Boomerang Online Casinos ist der Kundensupport, der rund um die Uhr verfügbar ist, um den Spielern bei Fragen oder Problemen zu helfen. Die Spieler können den Kundensupport per E-Mail, Live-Chat oder Telefon erreichen.
Insgesamt bietet das Boomerang Online Casino ein unterhaltsames und lohnendes Spielerlebnis fГјr alle GlГјcksspiel-Enthusiasten. Mit einer sicheren und fairen Spielumgebung, einer groГџen Auswahl an Spielen und groГџzГјgigen Boni, ist dieses Casino definitiv einen Besuch wert.
https://boomerangcasino.one/
Check Out Your URL https://debank.lu/2023/11/11/exploring-debanks-portfolio-dashboard-revolutionizing-defi-management/
Opened up an intriguing read Р¦ let me share this with you http://www.ivedu.ru/forum/viewthread.php?forum_id=18&thread_id=46055
Мы рекомендуем посетить веб-сайт https://car2steal.ru/magazin-ribachok/.
Кроме того, не забудьте добавить сайт в закладки: [url=https://car2steal.ru/magazin-ribachok/]https://car2steal.ru/magazin-ribachok/[/url]
ecobusinessdesign.com
women-art.net
you could look here https://blur-io-nft.com/2023/11/09/mastering-iphone-camera-settings-how-to-capture-perfectly-sharp-images/
Tipico Casino stellt für viele Glücksspielbegeisterte eine beliebte Anlaufstelle dar, um spannende Stunden voller Nervenkitzel und Spaß zu verbringen. Doch was ist los, wenn Tipico Casino plötzlich nicht mehr erreichbar ist? Warum geht Tipico Casino heute nicht?
Es gibt verschiedene Gründe, warum Tipico Casino heute nicht erreichbar sein könnte. Einer der häufigsten Gründe ist eine technische Störung aufseiten des Anbieters. In solchen Fällen arbeitet das Team von Tipico Casino mit Hochdruck daran, das Problem zu beheben und die Plattform so schnell wie möglich wieder online zu bringen.
Ein weiterer möglicher Grund für die Nichterreichbarkeit von Tipico Casino könnte sein, dass Wartungsarbeiten durchgeführt werden. In diesem Fall wird die Plattform vorübergehend offline genommen, um Verbesserungen und Updates vorzunehmen. Diese Maßnahmen dienen dazu, die Sicherheit und Stabilität des Casinos zu gewährleisten und das Spielerlebnis für die Nutzer zu optimieren.
Es kann auch vorkommen, dass Tipico Casino aufgrund von behördlichen Auflagen oder technischen Problemen anderer Dienstleister vorübergehend nicht erreichbar ist. In solchen Fällen ist es wichtig, Geduld zu haben und darauf zu vertrauen, dass das Unternehmen schnellstmöglich eine Lösung für das Problem findet.
Wenn Tipico Casino heute nicht erreichbar ist, können Spieler alternativ auf andere Online-Casinos ausweichen, um ihrem Glücksspiel nachzugehen. Es gibt viele seriöse Anbieter auf dem Markt, die ein breites Angebot an spannenden Spielen und attraktiven Boni bereithalten.
Insgesamt ist es wichtig zu verstehen, dass Ausfälle und Störungen im Online-Glücksspielbereich leider nicht ausgeschlossen sind. Trotzdem können Spieler darauf vertrauen, dass Unternehmen wie Tipico Casino alles daran setzen, um ihre Plattformen so zuverlässig und sicher wie möglich zu gestalten.
https://tipicocasino.one/
דירות דיסקרטיות בתל אביב, האינטימיות והחברות. במעגלים חילוניים או ליברליים יותר, הגישות כלפי עבודת מין ושירותי נערות ליווי באילת מערכות יחסים רומנטיות עם נערות ליווי באילת, וטשטשו את הגבולות בין אינטימיות פיזית לדיגיטלית. באותו הזמן, חששות לגבי פרטיות דירות עיסוי אירוטי לזוגות
check it out https://debank.at/2023/11/11/debanks-role-in-the-digital-asset-revolution-shaping-the-future-of-crypto/
Zet Casino Promo Code ohne Einzahlung
Zet Casino ist ein beliebtes Online-Casino, das eine breite Palette von Spielen und attraktiven Boni für seine Spieler bietet. Einer der begehrtesten Boni ist der Promo Code ohne Einzahlung, der es Spielern ermöglicht, kostenlose Credits zu erhalten, ohne dass sie Geld auf ihr Konto einzahlen müssen.
Mit dem Zet Casino Promo Code ohne Einzahlung können Spieler verschiedene Spiele ausprobieren und echtes Geld gewinnen, ohne ein Risiko eingehen zu müssen. Das bedeutet, dass Spieler die Möglichkeit haben, das Casino und seine Spiele zu testen, bevor sie sich dazu entscheiden, eine Einzahlung zu tätigen.
Um den Promo Code ohne Einzahlung zu erhalten, müssen Spieler lediglich einen speziellen Code eingeben, den sie auf der Website des Casinos finden können. Sobald der Code eingegeben wurde, wird der Bonus automatisch auf das Konto des Spielers gutgeschrieben und sie können sofort mit dem Spielen beginnen.
Es ist jedoch wichtig zu beachten, dass der Promo Code ohne Einzahlung bestimmten Bedingungen unterliegt, die erfüllt werden müssen, bevor Gewinne ausgezahlt werden können. Diese Bedingungen variieren je nach Casino und können beispielsweise eine Mindestauszahlung oder eine bestimmte Anzahl von Einsätzen erfordern.
Insgesamt bietet der Zet Casino Promo Code ohne Einzahlung Spielern eine großartige Möglichkeit, das Casino kennenzulernen und Spaß zu haben, ohne eigenes Geld riskieren zu müssen. Wenn Sie auf der Suche nach einem spannenden Online-Casino-Erlebnis sind, sollten Sie sich den Zet Casino Promo Code ohne Einzahlung nicht entgehen lassen!
https://zetcasino.one/
have a peek at this web-site https://trezor-wallet.at/2023/11/14/guide-to-resolving-common-problems-in-the-trezor-wallet-app/
useful reference https://tronlink-app.org/2023/11/13/tron-poker-the-game-changer-cryptocurrency-for-big-wins/
from this source https://blur-nft-market.com/2022/06/08/protect-your-personal-data-with-blur-block-technology/
Immer mehr Online-Casinos setzen auf eine schnelle und einfache Verifizierung der Spieler, um ein sicheres und verantwortungsvolles Spielumfeld zu gewährleisten. Ein Casino, das sich besonders durch seine effiziente Verifizierung auszeichnet, ist das Boomerang Casino.
Die Verifizierung der Spieler ist ein wichtiger Schritt, um die Identität und Volljährigkeit der Teilnehmer zu überprüfen. Dies dient nicht nur dem Schutz vor möglichen Betrugsfällen, sondern auch der Einhaltung gesetzlicher Vorschriften im Glücksspielbereich.
Das Boomerang Casino legt großen Wert auf eine einfache und transparente Verifizierung seiner Spieler. Nach der Registrierung müssen die Spieler lediglich einige persönliche Informationen angeben und gegebenenfalls bestimmte Dokumente hochladen, um ihre Identität zu bestätigen. Das gesamte Verifizierungsverfahren wird schnell und unkompliziert durchgeführt, sodass die Spieler schnell mit dem Spielen beginnen können.
Durch die effiziente Verifizierung stellt das Boomerang Casino sicher, dass nur volljährige Spieler Zugang zu seinem Angebot haben. Zudem sorgt die Überprüfung der Identität dafür, dass mögliche betrügerische Aktivitäten frühzeitig erkannt und verhindert werden. Dies schafft ein sicheres Spielumfeld für alle Teilnehmer und trägt dazu bei, das Vertrauen der Spieler in das Casino zu stärken.
Insgesamt bietet das Boomerang Casino eine herausragende Verifizierungserfahrung für seine Spieler. Durch den schnellen und einfachen Prozess können die Teilnehmer sicher sein, dass ihre persönlichen Daten geschützt und ihr Spielvergnügen nicht durch aufwendige Verifizierungsmaßnahmen beeinträchtigt wird. Ein weiterer Grund, warum sich das Boomerang Casino als beliebte Wahl für Spieler auf der Suche nach einem seriösen und verlässlichen Online-Casino etabliert hat.
https://boomerangcasino.one/
Das Beste Zet Casino
Das Zet Casino ist eine der beliebtesten Online-Glücksspielseiten für deutsche Spieler. Es bietet eine breite Palette von Spielen, großzügige Bonusangebote und eine benutzerfreundliche Plattform, die ein reibungsloses Spielerlebnis ermöglicht. In diesem Artikel werden wir uns genauer ansehen, was das Zet Casino so besonders macht und warum es als eines der besten Online-Casinos für deutsche Spieler gilt.
Eine der herausragenden Eigenschaften des Zet Casinos ist die Vielfalt der Spiele, die es anbietet. Mit Hunderten von Spielautomaten, Tischspielen, Live-Casino-Spielen und vielem mehr gibt es fГјr jeden Spieler etwas zu entdecken. Die Spiele stammen von einigen der besten Softwareanbieter der Branche, darunter NetEnt, Microgaming, Play’n GO und viele weitere. Dies sorgt fГјr eine hochwertige Spielauswahl und ein unterhaltsames Spielerlebnis.
Ein weiterer großer Vorteil des Zet Casinos sind die großzügigen Bonusangebote, die es seinen Spielern bietet. Neukunden können von einem lukrativen Willkommensbonus profitieren, der Freispiele und Bonusguthaben umfasst. Darüber hinaus gibt es regelmäßige Promotionen und Turniere, bei denen Spieler zusätzliche Belohnungen und Preise gewinnen können. Dies macht das Spielen im Zet Casino nicht nur unterhaltsam, sondern auch sehr lohnenswert.
Die Benutzeroberfläche des Zet Casinos ist benutzerfreundlich und intuitiv gestaltet. Spieler können leicht zwischen den verschiedenen Spielen navigieren und finden schnell, wonach sie suchen. Darüber hinaus ist die Website auch für mobile Geräte optimiert, sodass Spieler auch unterwegs problemlos spielen können.
Insgesamt ist das Zet Casino eine hervorragende Wahl fГјr deutsche Spieler, die nach einem hochwertigen Online-Casino suchen. Mit einer groГџen Auswahl an Spielen, groГџzГјgigen Boni und einer benutzerfreundlichen Plattform ist es leicht zu verstehen, warum das Zet Casino als eines der besten Online-Casinos auf dem Markt gilt. Probieren Sie es noch heute aus und erleben Sie selbst, was das Zet Casino so besonders macht.
https://zetcasino.one/
Москва вызов проститутки devkiru.com
Если Вы хотели заказать [url=https://devkiru.com/mezhdunarodnaya]шлюхи международная[/url] в Москве, то скорее заходите на вышеупомянутый сайт. Мы предлагаем заказать самых дешевых проституток в Мск. Но в данном вопросе, низкая цена не означает плохое качество. Всего лишь у девушек в этой категории не так много практики, и принимают они в квартирах чуть далее от центра и не очень фешенебельных. Не стоит переживать, что дешевая цена может испортить Ваш отдых, правильнее — наоборот. Возможность великолепно провести время по выгодной стоимости-вдвойне приятнее.
pop over here https://blur-nft-marketplace.org/2023/11/10/explore-the-top-solana-nft-platforms-to-acquire-unique-digital-assets/
visit the website https://galxe-app.org/2023/11/19/nft-galxe-the-future-of-digital-collectibles/
page https://1inch-dex.com/2022/12/10/understanding-the-importance-of-arbitrage-on-the-1inch-crypto-platform/
החיבור הדיגיטלי על מפגשים אינטימיים, נוף המין בחברה העכשווית מאופיין במגוון דירות דיסקרטיות בראשון לציון עם נערות ליווי באילת, עם זאת, ישראל היא חברה מגוונת הכוללת לא רק יהודים אורתודוקסים אלא גם יהודים חילוניים, מוסלמים, נוצרים ואנשים בעלי אמונות ורקעים נערות ליווי עצמאיות
Ein Cashback-Bonus ist eine beliebte Belohnung für Spieler in Online-Casinos. Tipico Casino bietet ebenfalls diese Möglichkeit für seine Kunden an. Doch was genau bedeutet Cashback und wie funktioniert es im Tipico Casino?
Beim Cashback erhalten Spieler einen Teil ihrer Verluste zurück, sodass sie einen Teil ihres Einsatzes zurückerhalten können. Dies kann als eine Art Versicherung gegen Verluste angesehen werden und kann besonders für Spieler von Vorteil sein, die gerne höhere Einsätze tätigen.
Im Tipico Casino können Spieler von einem Cashback-Bonus profitieren, der ihnen einen prozentualen Anteil ihrer Verluste zurückgibt. Dabei ist zu beachten, dass verschiedene Spiele unterschiedliche Cashback-Raten haben können. So können zum Beispiel Slots einen höheren prozentualen Cashback als Tischspiele haben.
Um den Cashback-Bonus zu erhalten, müssen Spieler einfach im Tipico Casino spielen und ihre Einsätze platzieren. Im Falle von Verlusten wird der Cashback-Betrag automatisch auf das Spielerkonto gutgeschrieben. Es ist eine einfache und unkomplizierte Möglichkeit, etwas von seinen Verlusten zurückzuerhalten.
Es lohnt sich also, im Tipico Casino nach dem Cashback-Bonus Ausschau zu halten und von dieser attraktiven Belohnung zu profitieren. Mit etwas Glück können Spieler einen Teil ihrer Verluste zurückgewinnen und so länger am Spielspaß teilhaben. Ein toller Anreiz, um im Tipico Casino sein Glück zu versuchen!
https://tipicocasino.one/
aparthome.org
besttoday.org
stroihome.net
domfenshuy.net
Im Tipico Casino können Spieler sich auf viele spannende Spiele und lukrative Bonusangebote freuen. Besonders attraktiv ist der Tipico Casino No Deposit Bonus, der es Spielern ermöglicht, ganz ohne Einzahlung echtes Geld zu gewinnen.
Der No Deposit Bonus von Tipico Casino ist eine großartige Möglichkeit, um das Casino risikofrei und ohne finanzielles Risiko kennenzulernen. Spieler erhalten bei der Registrierung einen bestimmten Betrag vom Casino geschenkt, den sie dann für verschiedene Spiele im Casino nutzen können. Einmalige Gewinne aus diesem Bonus können sich die Spieler anschließend auszahlen lassen.
Der Tipico Casino No Deposit Bonus ist jedoch an bestimmte Bedingungen geknüpft. Bevor Gewinne aus dem Bonus ausgezahlt werden können, müssen Spieler den Betrag oft genug umsetzen. Außerdem gelten bestimmte Spieleinschränkungen und Zeitlimits für die Erfüllung der Umsatzbedingungen.
Trotz dieser Einschränkungen bietet der No Deposit Bonus von Tipico Casino eine tolle Möglichkeit, um das Casino und seine Spiele auszuprobieren. Mit etwas Glück können Spieler so sogar echte Gewinne erzielen, ohne dabei eigenes Geld einzahlen zu müssen.
Alles in allem ist der Tipico Casino No Deposit Bonus eine lohnenswerte Möglichkeit für Spieler, um das Casino zu entdecken und tolle Gewinne abzusahnen. Interessierte sollten sich jedoch vorab die Bonusbedingungen genau durchlesen, um sicherzustellen, dass sie die Anforderungen erfüllen und den Bonus optimal nutzen können.
https://tipicocasino.one/
Zet Casino ist eine beliebte Online-Glücksspielplattform, die eine Vielzahl von Spielen und Zahlungsmöglichkeiten anbietet. Viele Spieler fragen sich jedoch, wie die Auszahlung bei Zet Casino funktioniert. In diesem Artikel werden wir uns genauer mit diesem Thema befassen.
Um eine Auszahlung bei Zet Casino zu tätigen, müssen Spieler zunächst sicherstellen, dass sie über ausreichende Gewinne auf ihrem Konto verfügen. Sobald dies der Fall ist, können sie sich entscheiden, wie sie ihr Geld abheben möchten. Zet Casino bietet verschiedene Zahlungsmethoden an, darunter Kredit- und Debitkarten, E-Wallets wie Skrill und Neteller sowie Banküberweisungen.
Um eine Auszahlung vorzunehmen, mГјssen Spieler einfach auf den “Auszahlung” -Button klicken und die gewГјnschte Zahlungsmethode auswГ¤hlen. Sie werden dann aufgefordert, ihre Kontoinformationen einzugeben und den Betrag anzugeben, den sie abheben mГ¶chten. Es ist wichtig zu beachten, dass bei einigen Zahlungsmethoden GebГјhren anfallen kГ¶nnen und dass Auszahlungen je nach Methode unterschiedliche Bearbeitungszeiten haben kГ¶nnen.
Sobald die Auszahlungsanforderung genehmigt wurde, wird das Geld auf das angegebene Konto des Spielers überwiesen. Es ist wichtig zu beachten, dass Zet Casino strenge Sicherheitsmaßnahmen implementiert hat, um die Sicherheit der Spielerdaten und Finanztransaktionen zu gewährleisten.
Zet Casino bietet eine zuverlässige und benutzerfreundliche Plattform für Online-Glücksspiele und Auszahlungen. Spieler können sich darauf verlassen, dass ihre Gewinne schnell und sicher auf ihr Konto überwiesen werden. Wenn Sie weitere Fragen zur Auszahlung bei Zet Casino haben, können Sie sich jederzeit an den Kundendienst des Casinos wenden, der Ihnen gerne weiterhilft.
https://zetcasino.one/
פרסומת דירות דיסקרטיות בחיפה הוא כלכלי. עבור אנשים רבים, דירות דיסקרטיות בתל אביב מייצגות מקור הכנסה משתלם, המציע פוטנציאל פוטנציאליים. אפליקציות כמו טינדר, גריינדר ובמבל פופולריות בקרב גברים המחפשים נערות ליווי בתל אביב ליחסי מין, ומציעות דרך נוחה דירת סקס
Сервис Автор 24 – это надежный сервис для заказа разнообразных академических работ. Он специализируется на дипломных работах, а также чертежах. Кроме того, на платформе Автор 24 можно приобрести эссе, отчеты о прохождении практики. Это удобный способ повысить свои академические результаты.
Автор 24 официальный [url=https://author24.online]Автор 24 ру[/url] .
Das Tipico Online Casino ist eine beliebte Anlaufstelle fГјr GlГјcksspielbegeisterte aus aller Welt. Mit einer Vielzahl von Spielen und attraktiven Bonusangeboten lockt das Casino jeden Tag tausende Spieler an.
Eine besondere Attraktion ist die Tipico Online Casino Halle, ein virtueller Raum, in dem Spieler gegeneinander antreten können. Hier können Sie an verschiedenen Turnieren teilnehmen und um hohe Gewinne spielen. Die Halle bietet eine einzigartige Möglichkeit, Ihr Können unter Beweis zu stellen und sich mit anderen Spielern zu messen.
Das Tipico Online Casino bietet zudem eine groГџe Auswahl an Spielen, darunter Slots, Roulette, Blackjack und vieles mehr. Die Seite ist benutzerfreundlich gestaltet und bietet eine sichere und faire Spielumgebung.
Neben dem Spielspaß bietet das Tipico Online Casino auch eine Vielzahl von Bonusangeboten und Aktionen. Neue Spieler erhalten oft großzügige Willkommensboni, und regelmäßige Spieler können von verschiedenen Aktionen und Treueprogrammen profitieren.
Insgesamt bietet das Tipico Online Casino alles, was das Herz eines GlГјcksspielers begehrt. Mit einer groГџen Auswahl an Spielen, attraktiven Bonusangeboten und einer sicheren Spielumgebung ist das Casino die perfekte Wahl fГјr alle, die auf der Suche nach Spannung und Unterhaltung sind. Besuchen Sie noch heute das Tipico Online Casino und erleben Sie die Faszination des GlГјcksspiels in einer neuen Dimension.
https://tipicocasino.one/
Автор 24 – это надежный сервис для заказа разнообразных академических работ. Он работает на курсовых работах, а также расчетах. Кроме того, на Автор 24 можно заказать рецензии, презентации. Это удобный способ получить профессиональную помощь.
Автор 24 официальный [url=https://author24.online]Автор24[/url] .
Zet Casino Free Spins: Der SchlГјssel zum groГџen Gewinn
Das Online-Casino Zet steht Spielern in Deutschland bereits seit einiger Zeit zur Verfügung und begeistert mit einer großen Auswahl an Spielen und lukrativen Bonusangeboten. Eines der beliebtesten Angebote sind zweifellos die Zet Casino Free Spins, die Spielern die Möglichkeit bieten, kostenfreie Drehungen an ausgewählten Spielautomaten zu erhalten.
Free Spins sind ein beliebtes Feature in Online-Casinos und bieten Spielern die Chance, zusätzliche Gewinne zu erzielen, ohne dabei ihr eigenes Geld einsetzen zu müssen. Für viele Spieler sind die Free Spins ein wichtiges Kriterium bei der Auswahl eines Online-Casinos, da sie ihnen die Möglichkeit bieten, neue Spiele auszuprobieren und dabei echte Gewinne zu erzielen.
Bei Zet Casino gibt es regelmäßig Aktionen, bei denen Spieler Free Spins erhalten können. Dabei kann es sich um spezielle Aktionen zu bestimmten Feiertagen handeln oder um regelmäßige Angebote für treue Kunden. Auch Neukunden können sich über Free Spins als Teil ihres Willkommensbonus freuen. Die genauen Bedingungen für den Erhalt der Free Spins können je nach Aktion variieren, in der Regel müssen Spieler jedoch eine Mindesteinzahlung tätigen, um von den kostenlosen Drehungen profitieren zu können.
Die Free Spins bei Zet Casino sind in der Regel an bestimmte Spielautomaten gebunden, die von der jeweiligen Aktion vorgegeben werden. Dabei handelt es sich meist um beliebte Spiele mit hohen Gewinnchancen, bei denen Spieler ihre Free Spins einsetzen können, um zusätzliche Gewinne zu erzielen. Die Gewinne aus den Free Spins werden dabei in der Regel als Bonusguthaben gutgeschrieben und müssen vor einer Auszahlung gemäß den Bonusbedingungen des Casinos umgesetzt werden.
Für Spieler, die auf der Suche nach lukrativen Bonusangeboten sind, sind die Free Spins bei Zet Casino definitiv eine attraktive Möglichkeit, um zusätzliche Gewinne zu erzielen und neue Spiele kennenzulernen. Mit etwas Glück und Geschick können die Free Spins zu großen Gewinnen führen und das Spielerlebnis im Online-Casino noch spannender machen. Wer also auf der Suche nach einem Casino mit attraktiven Bonusangeboten ist, sollte sich die Free Spins bei Zet Casino auf keinen Fall entgehen lassen.
https://zetcasino.one/
Boomerang Casino ist eine beliebte Online-GlГјcksspiel-Plattform, die eine Vielzahl von Casino-Spielen anbietet. In diesem Artikel werden wir uns genauer mit den Boomerang Casino Opinie, also den Meinungen und Bewertungen der Nutzer, befassen.
Viele Spieler loben Boomerang Casino für sein breites Spielangebot. Von klassischen Tischspielen wie Blackjack und Roulette bis hin zu modernen Slot-Spielen und Live-Casino-Spielen, bietet die Plattform für jeden Geschmack etwas. Die grafische Gestaltung und Benutzeroberfläche werden ebenfalls oft gelobt, da sie benutzerfreundlich und ansprechend gestaltet sind.
Ein weiterer Pluspunkt, der häufig von Nutzern hervorgehoben wird, ist der Kundenservice von Boomerang Casino. Die Mitarbeiter sind freundlich, gut geschult und helfen den Spielern bei Fragen oder Problemen schnell und effizient weiter.
Zu den kritischen Punkten, die in einigen Boomerang Casino Opinie genannt werden, zählen gelegentliche technische Probleme oder Verzögerungen bei der Auszahlung von Gewinnen. Einige Spieler haben auch angemerkt, dass die Bonusbedingungen manchmal etwas undurchsichtig und schwer zu erfüllen sind.
Insgesamt zeigt sich aber, dass die Mehrheit der Nutzer positiv von Boomerang Casino beeindruckt ist. Die groГџe Auswahl an Spielen, der gute Kundenservice und die attraktiven Bonusangebote machen die Plattform zu einer beliebten Wahl fГјr Online-Casino-Fans.
Wenn Sie auf der Suche nach einer neuen Online-Glücksspiel-Plattform sind, könnte Boomerang Casino definitiv einen Blick wert sein. Lassen Sie sich von den Boomerang Casino Opinie inspirieren und machen Sie sich selbst ein Bild von der Plattform. Viel Spaß und viel Glück beim Spielen!
https://boomerangcasino.one/
Similar parts are created from hard alloys etalonsadforum.com such as tungsten carbide, titanium or tantalum with the addition of cobalt. After melting, such parts are pressed under high pressure to obtain the desired parameters.
1newss.com
For the reason that the admin of this website is working, no question very rapidly it will be well-known, due to its quality contents.
Купить дипломы Вузов Владимира
https://online-sms.org/
Заказать девушку на дом Москва devkiru.com
Если Вы искали [url=https://devkiru.com/devushki-s-video]проститутки москвы анкеты с видео[/url] в Москве, то прямо сейчас переходите на наш сайт. Мы предлагаем заказать самых недорогих проституток в Мск. Но в этом вопросе, цена не означает плохое качество. Всего лишь у девочек в данной категории не так много стажа, и принимают они в квартирах чуть дальше от центра Москвы и не очень роскошных. Не стоит волноваться, что невысокая цена может испортить Ваш досуг, точнее — напротив. Возможность классно провести досуг по выигрышной стоимости-вдвойне хорошо.
useful site https://metamask-wallet.at/2023/11/16/unlock-the-power-of-rinkeby-test-network-add-it-to-metamask-in-minutes/
click to read https://orbiter-finance-bridge.com/2023/11/18/avoiding-surprises-knowing-the-exact-amount-to-pay-at-orbiter-finance/
find more info https://galxe-web3.com/2023/11/19/galxe-linea-the-next-step-in-smartphone-evolution/
Found a captivating read that I’d like to recommend to you http://www.les-ailes-chalaisiennes.com/forum/topic/betunlim-ваш-путь-к-азартным-приключени¤м-и-б/#postid-18520
заказ на айхерб промокоды
here https://orbiter-finance.at/2023/11/19/orbiter-finance-faq/
промокод для заказа первого на айхерб
have a peek at this web-site https://metamask-wallet-web3.com/2023/11/16/a-step-by-step-guide-to-connecting-metamask-to-coinbase-how-to-easily-transfer-tokens/
124SDS9742
Das Zet Casino ist eines der beliebtesten Online-Casinos derzeit und bietet eine Vielzahl von spannenden SpielmГ¶glichkeiten fГјr seine Spieler. Eine besonders aufregende Option ist das sogenannte “Saga Slot” Spiel.
Die “Saga Slot” Spiele im Zet Casino sind eine einzigartige MГ¶glichkeit, um sich in eine fesselnde und abenteuerliche Welt zu stГјrzen. Mit aufregenden Themen und beeindruckender Grafik bieten diese Spiele den Spielern die MГ¶glichkeit, in spannende Geschichten einzutauchen und gleichzeitig attraktive Gewinne zu erzielen.
Die “Saga Slot” Spiele im Zet Casino zeichnen sich durch ihre Vielfalt und OriginalitГ¤t aus. Von antiken Mythen und Legenden bis hin zu modernen Abenteuern und Fantasy-Welten gibt es fГјr jeden Spieler etwas Passendes. Zudem bieten diese Spiele oft innovative Bonusfunktionen und Sonderaktionen, die das Spielerlebnis noch aufregender machen.
Ein weiterer Pluspunkt der “Saga Slot” Spiele im Zet Casino ist die hohe QualitГ¤t und Fairness. Die Spiele werden von renommierten Softwareanbietern entwickelt und regelmäßig auf ihre Fairness ГјberprГјft, um ein faires und sicheres Spielerlebnis zu gewГ¤hrleisten. Zudem bietet das Zet Casino eine Vielzahl von ZahlungsmГ¶glichkeiten und einen professionellen Kundenservice, um den Spielern eine angenehme und unkomplizierte Spielerfahrung zu ermГ¶glichen.
Insgesamt bieten die “Saga Slot” Spiele im Zet Casino eine ideale Kombination aus SpaГџ, Spannung und Gewinnchancen. Mit ihrer Vielfalt und QualitГ¤t sind sie eine Bereicherung fГјr jeden Spieler, der auf der Suche nach einem aufregenden und unterhaltsamen Casino-Erlebnis ist. Besuchen Sie das Zet Casino und tauchen Sie ein in die faszinierende Welt der “Saga Slot” Spiele!
https://zetcasino.one/
Do you have any video of that? I’d like to find out some additional information.
Купить диплом Санкт-Петербургского государственного университета промышленных технологий и дизайна
видео стены [url=https://videosteny14.ru/]https://videosteny14.ru/[/url] .
124SDS9742
промокод в айхерб 20
repair of appliances
124SDS9742
I urge you steer clear of this site. The experience I had with it was only disappointment and doubts about deceptive behavior. Proceed with extreme caution, or even better, look for a more reputable platform to meet your needs.
Your Domain Name https://1inch-app.org/2023/11/17/exploring-the-defi-integration-possibilities-for-usdt-on-1inch/
Tipico Casino mit Geld
Das Tipico Casino bietet seinen Spielern die Möglichkeit, mit echtem Geld zu spielen und dabei die Chance auf hohe Gewinne zu haben. Im Gegensatz zum Spielgeldmodus, bei dem keine echten Einsätze möglich sind, können die Spieler im Tipico Casino mit echtem Geld Einsätze platzieren und somit auch echte Gewinne erzielen.
Um im Tipico Casino mit Geld spielen zu können, müssen die Spieler zunächst ein Konto bei dem Online-Casino erstellen und eine Einzahlung tätigen. Dabei stehen den Spielern verschiedene Zahlungsmethoden zur Verfügung, wie zum Beispiel Kreditkarte, Banküberweisung, PayPal oder Paysafecard. Nach der Einzahlung können die Spieler aus einer Vielzahl von Spielen wählen, darunter Slots, Roulette, Blackjack, Poker und viele weitere Casino-Klassiker.
Durch den Einsatz von echtem Geld erhöht sich natürlich auch die Spannung und der Nervenkitzel beim Spielen im Tipico Casino. Die Spieler haben die Chance, hohe Gewinne zu erzielen und sich so möglicherweise den ein oder anderen Wunsch zu erfüllen. Doch Vorsicht ist geboten, denn genau wie im echten Casino besteht auch im Online-Casino die Gefahr, Geld zu verlieren. Daher sollten die Spieler verantwortungsbewusst spielen und sich ihre Grenzen setzen.
Das Tipico Casino mit Geld bietet seinen Spielern ein spannendes und unterhaltsames Spielerlebnis. Mit echten Einsätzen und echten Gewinnen sorgt das Online-Casino für jede Menge Spaß und Nervenkitzel. Wer sein Glück versuchen und die Chance auf hohe Gewinne haben möchte, ist im Tipico Casino genau richtig.
https://tipicocasino.one/
Das Boomerang Casino wurde von AskGamblers als eines der besten Online-Casinos ausgezeichnet. Mit einer groГџen Auswahl an Spielen, groГџzГјgigen Boni und professionellem Kundenservice hat sich das Casino einen erstklassigen Ruf erarbeitet.
Das Boomerang Casino bietet eine Vielzahl von Spielen, darunter Slots, Tischspiele, Live-Casino-Spiele und mehr. Spieler kГ¶nnen aus einer Vielzahl von Titeln von fГјhrenden Softwareanbietern wГ¤hlen, darunter NetEnt, Microgaming, Play’n GO und viele andere.
Das Casino belohnt seine Spieler mit großzügigen Boni und Aktionen, darunter Willkommensboni, Einzahlungsboni, Freispiele und mehr. Spieler können auch an aufregenden Turnieren und Wettbewerben teilnehmen, um zusätzliche Preise zu gewinnen.
Der Kundenservice im Boomerang Casino ist rund um die Uhr verfГјgbar und bietet professionelle und schnelle UnterstГјtzung bei allen Fragen und Anliegen der Spieler. Das Casino legt groГџen Wert auf Kundenzufriedenheit und arbeitet hart daran, ein sicheres und faires Spielumfeld zu schaffen.
Mit seinem breiten Spielangebot, großzügigen Boni und erstklassigem Kundenservice ist das Boomerang Casino definitiv einen Besuch wert. Spieler können sich darauf verlassen, dass sie ein unterhaltsames und lohnendes Erlebnis haben werden, wenn sie sich für dieses erstklassige Online-Casino entscheiden.
https://boomerangcasino.one/
Hmm is anyone else having problems with the images on this blog loading?
I’m trying to determine if its a problem on my end or if it’s the blog.
Any responses would be greatly appreciated.
реонт техники
blibli
Die besten Tipico Casino Spiele
Im Tipico Casino finden Spieler eine Vielzahl von spannenden und unterhaltsamen Spielen, die fГјr jeden Geschmack etwas bieten. Hier sind einige der besten Tipico Casino Spiele, die von Spielern immer wieder gelobt werden:
1. Book of Dead: Dieser ägyptisch inspirierte Slot ist einer der beliebtesten im Tipico Casino. Mit spannenden Features wie Freispielen und expandierenden Wildsymbolen bietet dieses Spiel hohe Gewinnchancen und eine fesselnde Spielatmosphäre.
2. Starburst: Der Starburst-Slot ist ein weiterer Favorit der Spieler im Tipico Casino. Mit seinem farbenfrohen Design und einfachen Spielmechanismen ist dieser Slot perfekt für Anfänger geeignet. Die Möglichkeit, bis zu 50.000 Münzen zu gewinnen, sorgt für zusätzliche Spannung.
3. Bonanza: Dieser Slot bietet nicht nur eine hohe Gewinnchance, sondern auch eine lustige Spielatmosphäre. Mit seinem Bergwerksthema und der Megaways-Mechanik, kann man in diesem Spiel große Gewinne erzielen.
4. Mega Moolah: Als einer der beliebtesten progressiven Jackpot-Slots im Tipico Casino, lockt Mega Moolah Spieler mit der Aussicht auf lebensverändernde Gewinne. Mit einem schwindelerregenden Jackpot, der regelmäßig im Millionenbereich liegt, ist dieser Slot definitiv einen Versuch wert.
5. Roulette: Nicht zu vergessen sind die klassischen Tischspiele im Tipico Casino, darunter das beliebte Roulette. Mit seinen einfachen Regeln und hohen Gewinnmöglichkeiten ist Roulette ein zeitloser Favorit der Spieler.
Egal, ob Sie ein Fan von Slots, Tischspielen oder Jackpot-Slots sind, im Tipico Casino finden Sie garantiert Spiele, die Ihrem Geschmack entsprechen. Probieren Sie einige dieser besten Tipico Casino Spiele aus und erleben Sie ein unvergessliches Spielerlebnis!
https://tipicocasino.one/
ireland-24.com
Select the appropriate metal material for the specific design. Strength requirements invest-building.com, corrosion resistance and other characteristics must be taken into account. It is worth contacting experienced specialists who will help you understand all the parameters.
landlord services
В современном мире, где диплом становится началом отличной карьеры в любом направлении, многие пытаются найти максимально быстрый и простой путь получения качественного образования. Факт наличия официального документа об образовании переоценить невозможно. Ведь диплом открывает дверь перед каждым человеком, который стремится начать трудовую деятельность или учиться в ВУЗе.
В данном контексте мы предлагаем очень быстро получить любой необходимый документ. Вы сможете заказать диплом, и это будет удачным решением для всех, кто не смог закончить обучение или утратил документ. Все дипломы производятся аккуратно, с особым вниманием к мельчайшим нюансам. В итоге вы получите 100% оригинальный документ.
Превосходство подобного подхода состоит не только в том, что вы сможете оперативно получить диплом. Весь процесс организовывается комфортно, с нашей поддержкой. Начав от выбора нужного образца диплома до консультации по заполнению личных данных и доставки в любое место России — все находится под полным контролем наших мастеров.
Всем, кто хочет найти быстрый способ получить необходимый документ, наша компания предлагает выгодное решение. Купить диплом – это значит избежать длительного процесса обучения и не теряя времени перейти к достижению личных целей, будь то поступление в ВУЗ или старт карьеры.
Купить диплом Института экономики и управления в строительстве и промышленности
В нашем мире, где диплом становится началом удачной карьеры в любой отрасли, многие стараются найти максимально простой путь получения образования. Наличие документа об образовании сложно переоценить. Ведь диплом открывает двери перед всеми, кто стремится начать профессиональную деятельность или продолжить обучение в любом институте.
В данном контексте мы предлагаем оперативно получить этот необходимый документ. Вы имеете возможность приобрести диплом старого или нового образца, и это является выгодным решением для всех, кто не смог завершить образование, утратил документ или желает исправить плохие оценки. Каждый диплом изготавливается с особой тщательностью, вниманием ко всем нюансам. В результате вы получите продукт, полностью соответствующий оригиналу.
Преимущество этого подхода состоит не только в том, что вы сможете быстро получить диплом. Процесс организован комфортно, с нашей поддержкой. Начиная от выбора требуемого образца диплома до правильного заполнения персональной информации и доставки в любое место России — все под абсолютным контролем опытных специалистов.
Всем, кто ищет максимально быстрый способ получить необходимый документ, наша компания может предложить отличное решение. Купить диплом – значит избежать долгого процесса обучения и не теряя времени перейти к достижению своих целей, будь то поступление в ВУЗ или старт карьеры.
http://diploms-service.com/diplomy-po-gorodam/lipetsk
Boomerang Casino 3: Das neue Highlight fГјr alle GlГјcksspiel-Fans
Das Boomerang Casino 3 ist die neueste Attraktion fГјr alle Liebhaber von GlГјcksspielen. Mit einem umfangreichen Angebot an Spielautomaten, Tischspielen und Live-Casino-Spielen begeistert das Boomerang Casino 3 seine Besucher aus der ganzen Welt.
Das Casino überzeugt mit einem modernen und ansprechenden Design, das eine einladende Atmosphäre schafft. Die hochwertige Grafik und die übersichtliche Benutzeroberfläche sorgen für ein angenehmes Spielerlebnis, das keine Wünsche offen lässt.
Sowohl Anfänger als auch erfahrene Spieler kommen im Boomerang Casino 3 auf ihre Kosten. Mit einer großen Auswahl an Spielen, darunter klassische Slots, progressive Jackpots und spannende Tischspiele wie Roulette, Blackjack und Poker, ist für jeden Geschmack etwas dabei.
Besonders beliebt sind auch die Live-Casino-Spiele, bei denen echte Dealer und Croupiers für ein authentisches Casino-Erlebnis sorgen. Hier können die Spieler in Echtzeit gegen andere Spieler antreten und dabei um hohe Gewinne spielen.
Dank der vielfältigen Bonusangebote und Promotionen bietet das Boomerang Casino 3 seinen Besuchern immer wieder spannende Möglichkeiten, zusätzliche Gewinne zu erzielen. Ob Willkommensbonus, Freispiele oder Cashback-Angebote – hier ist für jeden etwas dabei.
Das Boomerang Casino 3 überzeugt nicht nur mit seinem vielfältigen Spielangebot, sondern auch mit einem exzellenten Kundenservice. Die freundlichen und kompetenten Mitarbeiter sind rund um die Uhr erreichbar und stehen den Spielern bei allen Fragen und Anliegen zur Seite.
Insgesamt überzeugt das Boomerang Casino 3 als neues Highlight für alle Glücksspiel-Fans. Mit seinem umfangreichen Spielangebot, attraktiven Bonusangeboten und exzellenten Kundenservice ist das Casino definitiv einen Besuch wert. Also nichts wie los und entdecken Sie das Boomerang Casino 3 – das ultimative Spielerlebnis wartet auf Sie!
https://boomerangcasino.one/
1249742
Zet Casino ist eine beliebte Online-Glücksspielplattform, die eine Vielzahl von Spielen und Bonusangeboten für ihre Kunden anbietet. Eines der begehrtesten Boni sind die Zet Casino Freispiele, die es den Spielern ermöglichen, kostenlos an ausgewählten Spielautomaten zu spielen und dabei echtes Geld zu gewinnen.
Um die Zet Casino Freispiele einzulösen, müssen die Spieler zunächst ein Konto auf der Plattform erstellen und eine Einzahlung tätigen. Sobald die Einzahlung abgeschlossen ist, können die Spieler den Bonus aktivieren und die Freispiele nutzen. Es ist wichtig zu beachten, dass die Freispiele meist innerhalb eines bestimmten Zeitraums genutzt werden müssen, bevor sie verfallen.
Die Zet Casino Freispiele sind eine großartige Möglichkeit für die Spieler, neue Spielautomaten auszuprobieren und ihr Glück zu versuchen, ohne dabei ihr eigenes Geld zu riskieren. Es gibt verschiedene Arten von Freispielen, darunter Freispiele ohne Einzahlung, die den Spielern einen Vorgeschmack darauf geben, was sie erwartet, und Freispiele als Teil eines Willkommensbonus für neue Spieler.
Die Gewinne, die die Spieler mit den Zet Casino Freispielen erzielen, können in der Regel ausgezahlt werden, nachdem die Umsatzbedingungen erfüllt wurden. Diese Bedingungen legen fest, wie oft der Bonusbetrag umgesetzt werden muss, bevor eine Auszahlung möglich ist. Es ist ratsam, die Bonusbedingungen sorgfältig zu lesen, um Missverständnisse zu vermeiden.
Insgesamt sind die Zet Casino Freispiele eine attraktive Möglichkeit für die Spieler, ihr Spielerlebnis zu verbessern und zusätzliche Gewinnchancen zu erhalten. Es lohnt sich, regelmäßig auf der Website nach neuen Bonusangeboten zu suchen und die Freispiele zu nutzen, um das Beste aus dem Zet Casino herauszuholen.
https://zetcasino.one/
В нашем обществе, где диплом – это начало успешной карьеры в любой отрасли, многие пытаются найти максимально быстрый и простой путь получения качественного образования. Важность наличия официального документа переоценить невозможно. Ведь именно диплом открывает дверь перед всеми, кто желает вступить в профессиональное сообщество или продолжить обучение в ВУЗе.
Предлагаем очень быстро получить этот важный документ. Вы сможете приобрести диплом, что становится отличным решением для человека, который не смог закончить обучение или потерял документ. дипломы выпускаются с особой аккуратностью, вниманием ко всем элементам. В результате вы получите продукт, максимально соответствующий оригиналу.
Плюсы такого решения заключаются не только в том, что вы оперативно получите диплом. Процесс организован удобно, с профессиональной поддержкой. Начав от выбора подходящего образца диплома до точного заполнения персональных данных и доставки в любое место страны — все под абсолютным контролем наших мастеров.
Для тех, кто ищет оперативный способ получения необходимого документа, наша компания предлагает отличное решение. Приобрести диплом – это значит избежать длительного процесса обучения и не теряя времени перейти к личным целям, будь то поступление в ВУЗ или начало карьеры.
http://diploms-service.com/diplomy-po-spetsialnosti/programmist
דיסקרטיות בירושלים גברים מחפשים דירות דיסקרטיות בירושלים עם נערות ליווי בתל אביב ממגוון סיבות, החל משיכה פיזית ותשוקה מינית המכונים לעתים קרובות עבודת מין או יחסי מין מסחריים, הם היבט שנוי במחלוקת ומורכב של דירות דיסקרטיות בבאר שבע ומיניות אנושית. זה נערות ליווי שמנות
Tipico Casino Fehler 50202
Das Tipico Casino ist eine beliebte Online-Glücksspielplattform, auf der Spieler aus der ganzen Welt ihre Lieblingsspiele spielen können. Wie bei jeder anderen Webseite kann es jedoch zu gelegentlichen technischen Problemen kommen. Eines dieser Probleme, das viele Spieler erlebt haben, ist der Fehler 50202.
Der Fehler 50202 tritt normalerweise auf, wenn die Tipico Casino-Webseite Гјberlastet ist oder Probleme mit dem Server auftreten. Dies kann frustrierend sein, da Spieler daran gehindert werden, ihre Lieblingsspiele zu spielen oder auf ihre Kontoinformationen zuzugreifen.
Wenn Sie den Fehler 50202 auf der Tipico Casino-Webseite sehen, gibt es einige Schritte, die Sie unternehmen können, um das Problem zu lösen. Zunächst einmal sollten Sie sicherstellen, dass Ihre Internetverbindung stabil ist und Sie eine gute WLAN-Verbindung haben. Wenn dies der Fall ist, können Sie versuchen, die Webseite neu zu laden oder Ihren Browserverlauf und Cookies zu löschen.
Wenn das Problem weiterhin besteht, empfehlen wir Ihnen, den Tipico Casino-Kundendienst zu kontaktieren. Die Mitarbeiter sind in der Regel gut ausgebildet und können Ihnen bei der Behebung des Fehlers 50202 helfen.
Insgesamt ist der Fehler 50202 im Tipico Casino zwar ärgerlich, aber in der Regel einfach zu beheben. Indem Sie die oben genannten Schritte befolgen und den Kundendienst kontaktieren, sollten Sie in kürzester Zeit wieder online spielen können.
https://tipicocasino.one/
В нашем обществе, где диплом становится началом удачной карьеры в любой области, многие пытаются найти максимально быстрый путь получения образования. Наличие официального документа об образовании трудно переоценить. Ведь диплом открывает дверь перед любым человеком, который желает вступить в сообщество профессионалов или учиться в ВУЗе.
В данном контексте наша компания предлагает очень быстро получить любой необходимый документ. Вы сможете заказать диплом старого или нового образца, что будет выгодным решением для всех, кто не смог завершить образование, потерял документ или желает исправить свои оценки. Каждый диплом изготавливается аккуратно, с особым вниманием ко всем нюансам, чтобы в итоге получился полностью оригинальный документ.
Плюсы данного решения заключаются не только в том, что можно оперативно получить свой диплом. Весь процесс организовывается комфортно, с профессиональной поддержкой. От выбора подходящего образца диплома до консультации по заполнению личных данных и доставки в любое место России — все под абсолютным контролем наших мастеров.
Всем, кто ищет быстрый способ получения необходимого документа, наша компания предлагает отличное решение. Заказать диплом – значит избежать долгого обучения и не теряя времени перейти к важным целям: к поступлению в ВУЗ или к началу трудовой карьеры.
http://diploms-service.com/diplomy-po-gorodam/moskva/moskovskij-institut-televideniya-i-radioveshchaniya-ostankino
Zet Casino ist eine beliebte Online-Glücksspielplattform, die eine Vielzahl von Spielen und attraktiven Bonusangeboten für Spieler anbietet. Im Jahr 2018 überraschte das Casino seine Kunden mit großzügigen no deposit bonus codes, die es den Spielern ermöglichten, ohne Einzahlung zu spielen und dennoch echtes Geld zu gewinnen.
Die no deposit bonus codes von Zet Casino im Jahr 2018 boten den Spielern die Möglichkeit, verschiedene Spiele auszuprobieren, ohne Geld einzahlen zu müssen. Dies war eine großartige Gelegenheit für neue Spieler, die Plattform kennenzulernen und sich mit den angebotenen Spielen vertraut zu machen.
Die Bonuscodes waren nicht nur für neue Spieler verfügbar, sondern auch für bestehende Kunden, die regelmäßig im Casino spielten. Dies zeigte das Engagement des Casinos, seinen Spielern Gutes zu tun und sie zu belohnen.
Die Bonuscodes waren einfach zu verwenden. Spieler mussten lediglich den Code im entsprechenden Feld im Casino eingeben, um den Bonus zu erhalten. Mit diesem Bonus konnten sie dann verschiedene Spiele spielen und echtes Geld gewinnen.
Zet Casino no deposit bonus codes 2018 waren eine willkommene Überraschung für die Spieler und trugen dazu bei, die Popularität des Casinos weiter zu steigern. Es bleibt abzuwarten, ob das Casino in Zukunft ähnliche Bonuscodes anbieten wird, um seine Spieler glücklich zu machen.
https://zetcasino.one/
Индивидуалки devkiru.com
По вопросу [url=https://devkiru.com/bibirevo]шлюхи бибирево[/url] Вы на правильном пути. Наш надежный онлайн портал оказывает отборный отдых 18 плюс. Здесь есть: индивидуалки, массажистки, элитные красотки, частные интим-объявления. А еще Вы можете найти требующуюся девушку по параметрам: по станции метро, по весу, росту, адресу, стоимости. Всё для Вашего комфорта.
124SDS9742
В нашем обществе, где диплом – это начало успешной карьеры в любой сфере, многие пытаются найти максимально быстрый путь получения качественного образования. Наличие официального документа переоценить невозможно. Ведь диплом открывает дверь перед любым человеком, который желает начать трудовую деятельность или продолжить обучение в каком-либо институте.
Мы предлагаем быстро получить этот важный документ. Вы можете заказать диплом нового или старого образца, и это будет отличным решением для человека, который не смог закончить обучение или утратил документ. диплом изготавливается с особой тщательностью, вниманием к мельчайшим деталям. В результате вы сможете получить полностью оригинальный документ.
Преимущество такого решения заключается не только в том, что вы сможете максимально быстро получить свой диплом. Весь процесс организовывается комфортно и легко, с профессиональной поддержкой. От выбора требуемого образца диплома до правильного заполнения персональных данных и доставки по России — все под абсолютным контролем наших мастеров.
Для тех, кто пытается найти оперативный способ получить требуемый документ, наша компания готова предложить выгодное решение. Приобрести диплом – значит избежать долгого обучения и сразу переходить к своим целям, будь то поступление в ВУЗ или старт профессиональной карьеры.
http://diploms-service.com/diplomy-po-gorodam/moskva/moskovskaya-gosudarstvennaya-akademiya-khoreografii
Der Tipico Casino unvorhergesehener Fehler hat viele Spieler in Verwirrung und Frustration gestГјrzt. Seit einiger Zeit klagen zahlreiche Nutzer Гјber Probleme bei der Nutzung der Plattform, die sich in unerwarteten Fehlern und Unterbrechungen Г¤uГџern.
Zu den häufigsten Problemen gehören Verbindungsabbrüche während des Spielens, Probleme beim Ein- und Auszahlen von Geldern sowie unerklärliche Fehlermeldungen. Dies führt zu Unmut und Verärgerung bei den Spielern, die sich auf ein reibungsloses Spielerlebnis verlassen.
Die Ursachen für diese unvorhergesehenen Fehler sind vielfältig und können von technischen Problemen bis hin zu internen Schwierigkeiten bei Tipico Casino reichen. Es scheint, dass die Plattform mit der steigenden Anzahl von Nutzern und dem zunehmenden Traffic nicht mithalten kann, was zu diesen Problemen führt.
Die Spieler erwarten von einem etablierten Unternehmen wie Tipico Casino eine hohe Qualität und Zuverlässigkeit in ihren Dienstleistungen. Daher ist es wichtig, dass das Unternehmen schnell handelt und die Probleme behebt, um das Vertrauen der Spieler nicht zu verlieren.
In der Zwischenzeit sollten die Spieler Geduld haben und die Kundenbetreuung kontaktieren, um ihre Beschwerden zu äußern und mögliche Lösungen zu finden. Es ist auch ratsam, alternative Plattformen zu prüfen, um sicherzustellen, dass das Spielerlebnis nicht weiter beeinträchtigt wird.
Letztendlich ist es wichtig, dass Tipico Casino die Bedenken und Beschwerden seiner Nutzer ernst nimmt und schnell handelt, um das Vertrauen und die Zufriedenheit der Spieler wiederherzustellen. Nur so kann das Unternehmen langfristig erfolgreich sein und seinen Ruf als seriöser Anbieter von Glücksspielen behalten.
https://tipicocasino.one/
ללקוחותיהן תוך שמירה על גבולות והבטחת בטיחות ושיקול דעת. שירותי ליווי של דירות דיסקרטיות באשדוד או דירות דיסקרטיות באשקלון אפורים חוקיים או להיות נתונים לפליליזציה, ולהשאיר לקוחות וחברים של דירות דיסקרטיות באשדוד מרוצים. ניווט בעולם המשפטי של דירות סקס באשקלון
245real.com
egyptnews24.com
В нашем мире, где диплом – это начало успешной карьеры в любом направлении, многие ищут максимально быстрый путь получения качественного образования. Важность наличия документа об образовании трудно переоценить. Ведь именно диплом открывает двери перед любым человеком, желающим начать профессиональную деятельность или учиться в высшем учебном заведении.
Наша компания предлагает максимально быстро получить любой необходимый документ. Вы можете заказать диплом нового или старого образца, и это становится удачным решением для человека, который не смог завершить образование или утратил документ. Каждый диплом изготавливается с особой тщательностью, вниманием ко всем деталям, чтобы в результате получился 100% оригинальный документ.
Плюсы этого решения состоят не только в том, что вы оперативно получите диплом. Процесс организовывается удобно, с профессиональной поддержкой. Начиная от выбора подходящего образца до грамотного заполнения личных данных и доставки в любое место России — все находится под полным контролем наших специалистов.
В результате, для всех, кто ищет максимально быстрый способ получить требуемый документ, наша компания может предложить выгодное решение. Купить диплом – значит избежать длительного процесса обучения и сразу переходить к достижению собственных целей, будь то поступление в ВУЗ или начало трудовой карьеры.
Купить диплом Санкт-Петербургского политехнического университета Петра Великого
Zet Casino ist ein beliebtes Online-Casino, das eine Vielzahl von Spielen und groГџzГјgigen Boni fГјr seine Kunden bietet. Ein wichtiger Aspekt, den Spieler bei der Wahl eines Online-Casinos berГјcksichtigen sollten, sind die Auszahlungszeiten.
Bei Zet Casino können Spieler ihre Gewinne schnell und einfach abheben. Die Auszahlungszeiten hängen von der gewählten Auszahlungsmethode ab. Im Allgemeinen bietet Zet Casino schnelle Auszahlungen über E-Wallets wie Skrill, Neteller und ecoPayz an. Diese Methode ermöglicht es den Spielern, ihre Gewinne innerhalb von 24 Stunden zu erhalten.
Für Auszahlungen über Kreditkarten oder Banküberweisungen kann die Bearbeitungszeit länger dauern, in der Regel zwischen 3 und 5 Werktagen. Es ist wichtig zu beachten, dass Zet Casino möglicherweise zusätzliche Überprüfungsmaßnahmen durchführt, um die Sicherheit der Transaktionen zu gewährleisten, was zu einer Verzögerung führen kann.
Wenn Spieler ihre Gewinne schnell erhalten möchten, wird empfohlen, E-Wallets als Auszahlungsmethode zu wählen. Diese Methoden sind nicht nur schnell, sondern auch sicher und zuverlässig. Zet Casino macht es seinen Spielern leicht, ihre Gewinne zu genießen, ohne lange auf ihr Geld warten zu müssen.
Insgesamt bietet Zet Casino schnelle Auszahlungszeiten und eine Vielzahl von Zahlungsmethoden, um den Bedürfnissen der Spieler gerecht zu werden. Spieler können sich darauf verlassen, dass sie ihre Gewinne schnell und einfach abheben können, sodass sie sich auf das Spielen und Gewinnen konzentrieren können. Besuchen Sie Zet Casino noch heute und erleben Sie die Spannung und den Nervenkitzel des Online-Glücksspiels.
https://zetcasino.one/
1SS3D249742
1249742
В современном мире, где диплом – это начало отличной карьеры в любой сфере, многие ищут максимально простой путь получения качественного образования. Наличие документа об образовании переоценить попросту невозможно. Ведь диплом открывает дверь перед любым человеком, который собирается вступить в профессиональное сообщество или продолжить обучение в каком-либо институте.
Наша компания предлагает оперативно получить этот важный документ. Вы можете приобрести диплом, что будет удачным решением для человека, который не смог завершить образование, потерял документ или желает исправить плохие оценки. диплом изготавливается с особой аккуратностью, вниманием ко всем деталям, чтобы на выходе получился 100% оригинальный документ.
Преимущество подобного решения состоит не только в том, что можно максимально быстро получить свой диплом. Весь процесс организовывается удобно, с профессиональной поддержкой. От выбора подходящего образца документа до грамотного заполнения личной информации и доставки по России — все будет находиться под абсолютным контролем наших мастеров.
Всем, кто хочет найти максимально быстрый способ получения необходимого документа, наша услуга предлагает отличное решение. Заказать диплом – значит избежать продолжительного процесса обучения и сразу переходить к достижению своих целей, будь то поступление в университет или старт карьеры.
Купить диплом Международной академии бизнеса и управления
Warum ist auf einmal mein Guthaben bei Tipico Casino weg?
Es kann verwirrend und frustrierend sein, wenn plötzlich das Guthaben auf unserem Tipico Casino Konto verschwunden ist. Es gibt verschiedene Gründe, warum dies passieren könnte. Hier sind einige mögliche Ursachen und Lösungsansätze.
Eine mögliche Erklärung könnte sein, dass das Guthaben aufgrund von Inaktivität oder Inaktivitätsregeln des Casinos verfallen ist. Viele Online-Casinos haben Richtlinien, die besagen, dass Guthaben nach einer bestimmten Zeit der Inaktivität gelöscht werden können. Es ist ratsam, regelmäßig in Ihr Konto einzuloggen und aktiv zu spielen, um dies zu vermeiden.
Ein weiterer Grund für das Verschwinden des Guthabens könnte sein, dass es aufgrund von Bonusbedingungen oder anderen Casino-Richtlinien konfisziert wurde. Stellen Sie sicher, dass Sie die Geschäftsbedingungen des Casinos gelesen haben, um zu verstehen, unter welchen Umständen Ihr Guthaben möglicherweise einbehalten wird.
Es ist auch möglich, dass es technische Probleme oder Fehler im System gab, die dazu geführt haben, dass das Guthaben nicht richtig angezeigt wurde. In diesem Fall sollten Sie den Kundendienst von Tipico Casino kontaktieren und das Problem schildern. Sie können Ihnen helfen, das Problem zu lösen und Ihr Guthaben wiederherzustellen.
In jedem Fall ist es wichtig, ruhig zu bleiben und das Problem systematisch anzugehen, anstatt in Panik zu geraten. Mit Geduld und Kommunikation mit dem Casino können viele potenzielle Probleme behoben werden.
Zusammenfassend lässt sich sagen, dass es verschiedene Gründe geben kann, warum Ihr Guthaben bei Tipico Casino verschwunden ist. Es ist wichtig, die möglichen Ursachen zu prüfen und gegebenenfalls den Kundendienst zu kontaktieren, um das Problem zu lösen. Durch sorgfältige Überprüfung und Kommunikation können die meisten Probleme behoben werden und Sie können hoffentlich bald wieder mit Ihrem Guthaben spielen.
https://tipicocasino.one/
https://todayusanews24.com
https://radioshem.net
I highly advise steer clear of this platform. My own encounter with it has been purely disappointment as well as concerns regarding scamming practices. Exercise extreme caution, or better yet, find an honest service to meet your needs.
Wenn Sie gerne in Online-Casinos spielen, haben Sie vielleicht schon von Zet Casino gehört. Dieses beliebte Casino bietet eine Vielzahl von Spielen, großzügige Boni und Aktionen für seine Spieler. Ein besonderer Bonus, den Sie nutzen können, ist der Promo-Code Zet Casino.
Ein Promo-Code ist ein spezieller Code, den Sie bei der Anmeldung oder Einzahlung im Casino eingeben können, um zusätzliche Boni oder Vergünstigungen zu erhalten. Der Zet Casino Promo-Code bietet Spielern die Möglichkeit, zusätzliches Geld oder Freispiele zu erhalten, um ihre Lieblingsspiele zu spielen.
Um den Promo-Code Zet Casino zu nutzen, müssen Sie sich zunächst auf der Website des Casinos anmelden. Geben Sie den Code während des Anmeldevorgangs ein und machen Sie eine Einzahlung, um den Bonus zu aktivieren. Sie können dann mit dem zusätzlichen Geld oder den Freispielen spielen und hoffentlich einige große Gewinne erzielen.
Es ist wichtig zu beachten, dass Promo-Codes in der Regel bestimmten Bedingungen unterliegen, wie z.B. Umsatzanforderungen oder maximale Auszahlungsbeträge. Stellen Sie sicher, dass Sie die Geschäftsbedingungen sorgfältig lesen, bevor Sie den Promo-Code nutzen, um sicherzustellen, dass Sie den Bonus optimal nutzen können.
Insgesamt kann der Promo-Code Zet Casino eine großartige Möglichkeit sein, zusätzliche Belohnungen zu erhalten und Ihr Spielerlebnis noch spannender zu gestalten. Wenn Sie also gerne in Online-Casinos spielen, sollten Sie sich diesen Bonus nicht entgehen lassen. Viel Glück und viel Spaß beim Spielen!
https://zetcasino.one/
В нашем мире, где диплом – это начало успешной карьеры в любом направлении, многие ищут максимально простой путь получения качественного образования. Наличие документа об образовании трудно переоценить. Ведь диплом открывает двери перед любым человеком, который желает начать профессиональную деятельность или продолжить обучение в университете.
Мы предлагаем максимально быстро получить этот важный документ. Вы сможете купить диплом, что будет отличным решением для человека, который не смог завершить образование, потерял документ или хочет исправить свои оценки. Все дипломы выпускаются аккуратно, с особым вниманием к мельчайшим деталям, чтобы в итоге получился документ, полностью соответствующий оригиналу.
Превосходство данного решения заключается не только в том, что вы сможете максимально быстро получить диплом. Процесс организован удобно, с профессиональной поддержкой. От выбора подходящего образца документа до консультаций по заполнению личной информации и доставки по России — все будет находиться под абсолютным контролем наших специалистов.
Для тех, кто ищет быстрый и простой способ получения необходимого документа, наша компания предлагает отличное решение. Купить диплом – это значит избежать длительного обучения и не теряя времени переходить к своим целям, будь то поступление в университет или начало профессиональной карьеры.
Купить диплом Московского института рекламы, туризма, шоу-бизнеса
Проститутки с выездом devkiru.com
По вопросу [url=https://devkiru.com/prostitutki-bulvar-marshala-rokossovskogo]проститутки на бульваре рокоссовского[/url] Вы на правильном пути. Наш надежный интернет портал доставляет отборный отдых 18 плюс. Здесь есть: индивидуалки, массажистки, элитные красавицы, БДСМ. А еще Вы можете отыскать желаемую девочку по параметрам: по станции метро, по весу, росту, цвету волос, карте. Всё для Вашего удобства.
Rikvip Club: Trung Tâm Giải Trí Trực Tuyến Hàng Đầu tại Việt Nam
Rikvip Club là một trong những nền tảng giải trí trực tuyến hàng đầu tại Việt Nam, cung cấp một loạt các trò chơi hấp dẫn và dịch vụ cho người dùng. Cho dù bạn là người dùng iPhone hay Android, Rikvip Club đều có một cái gì đó dành cho mọi người. Với sứ mạng và mục tiêu rõ ràng, Rikvip Club luôn cố gắng cung cấp những sản phẩm và dịch vụ tốt nhất cho khách hàng, tạo ra một trải nghiệm tiện lợi và thú vị cho người chơi.
Sứ Mạng và Mục Tiêu của Rikvip
Từ khi bắt đầu hoạt động, Rikvip Club đã có một kế hoạch kinh doanh rõ ràng, luôn nỗ lực để cung cấp cho khách hàng những sản phẩm và dịch vụ tốt nhất và tạo điều kiện thuận lợi nhất cho người chơi truy cập. Nhóm quản lý của Rikvip Club có những mục tiêu và ước muốn quyết liệt để biến Rikvip Club thành trung tâm giải trí hàng đầu trong lĩnh vực game đổi thưởng trực tuyến tại Việt Nam và trên toàn cầu.
Trải Nghiệm Live Casino
Rikvip Club không chỉ nổi bật với sự đa dạng của các trò chơi đổi thưởng mà còn với các phòng trò chơi casino trực tuyến thu hút tất cả người chơi. Môi trường này cam kết mang lại trải nghiệm chuyên nghiệp với tính xanh chín và sự uy tín không thể nghi ngờ. Đây là một sân chơi lý tưởng cho những người yêu thích thách thức bản thân và muốn tận hưởng niềm vui của chiến thắng. Với các sảnh cược phổ biến như Roulette, Sic Bo, Dragon Tiger, người chơi sẽ trải nghiệm những cảm xúc độc đáo và đặc biệt khi tham gia vào casino trực tuyến.
Phương Thức Thanh Toán Tiện Lợi
Rikvip Club đã được trang bị những công nghệ thanh toán tiên tiến ngay từ đầu, mang lại sự thuận tiện và linh hoạt cho người chơi trong việc sử dụng hệ thống thanh toán hàng ngày. Hơn nữa, Rikvip Club còn tích hợp nhiều phương thức giao dịch khác nhau để đáp ứng nhu cầu đa dạng của người chơi: Chuyển khoản Ngân hàng, Thẻ cào, Ví điện tử…
Kết Luận
Tóm lại, Rikvip Club không chỉ là một nền tảng trò chơi, mà còn là một cộng đồng nơi người chơi có thể tụ tập để tận hưởng niềm vui của trò chơi và cảm giác hồi hộp khi chiến thắng. Với cam kết cung cấp những sản phẩm và dịch vụ tốt nhất, Rikvip Club chắc chắn là điểm đến lý tưởng cho những người yêu thích trò chơi trực tuyến tại Việt Nam và cả thế giới.
blibliblu
1SS3D249742
Found captivating reading that I’d like to offer you – you won’t regret it https://www.mkbox.ru/communication/forum/user/72839/
m.boomerang-casino: Das neue Online-Casino fГјr unterhaltsame Spiele und hohe Gewinne
Das m.boomerang-casino ist ein brandneues Online-Casino, das Spielern eine Vielzahl von unterhaltsamen Spielen und die Möglichkeit bietet, hohe Gewinne zu erzielen. Mit einer benutzerfreundlichen Oberfläche und einer Vielzahl von Spielen ist m.boomerang-casino die ideale Wahl für alle, die gerne online spielen und gewinnen.
Das Casino bietet eine breite Auswahl an Spielen, darunter Slots, Tischspiele und sogar Live-Casino-Spiele. Spieler kГ¶nnen aus Hunderten von Spielen wГ¤hlen, die von renommierten Entwicklern wie NetEnt, Microgaming und Play’n GO stammen. Mit so vielen Optionen zur Auswahl ist fГјr jeden Spieler etwas dabei, egal ob sie ein AnfГ¤nger oder ein erfahrener Spieler sind.
Ein weiterer großer Vorteil von m.boomerang-casino ist die Möglichkeit, von lukrativen Boni und Promotionen zu profitieren. Neue Spieler erhalten oft Willkommensboni, die es ihnen ermöglichen, ihr Guthaben zu erhöhen und mehr Zeit im Casino zu verbringen. Darüber hinaus gibt es regelmäßig Aktionen, bei denen Spieler zusätzliche Belohnungen wie Freispiele oder Einzahlungsboni erhalten können.
Das Casino bietet auch eine sichere und faire Spielumgebung, da es von renommierten Glücksspielbehörden reguliert wird. Spieler können sich darauf verlassen, dass ihre persönlichen Daten geschützt sind und dass alle Spiele ehrlich und transparent ablaufen. Mit schnellen Auszahlungen und einem zuverlässigen Kundensupport steht m.boomerang-casino an der Spitze, wenn es um Online-Glücksspiele geht.
Insgesamt ist m.boomerang-casino eine groГџartige Wahl fГјr alle, die auf der Suche nach einem unterhaltsamen und lohnenden Online-Casino-Erlebnis sind. Mit einer beeindruckenden Auswahl an Spielen, groГџzГјgigen Boni und einer sicheren Spielumgebung bietet dieses Casino alles, was ein Spieler braucht, um SpaГџ zu haben und gleichzeitig hohe Gewinne zu erzielen. Probieren Sie m.boomerang-casino noch heute aus und erleben Sie den Nervenkitzel des Online-GlГјcksspiels!
https://boomerangcasino.one/
В современном мире, где диплом является началом удачной карьеры в любом направлении, многие стараются найти максимально быстрый путь получения образования. Наличие официального документа переоценить невозможно. Ведь именно диплом открывает дверь перед людьми, стремящимися вступить в профессиональное сообщество или продолжить обучение в ВУЗе.
Предлагаем очень быстро получить этот необходимый документ. Вы имеете возможность заказать диплом старого или нового образца, что является выгодным решением для всех, кто не смог завершить образование или утратил документ. Все дипломы производятся с особой тщательностью, вниманием к мельчайшим деталям, чтобы на выходе получился 100% оригинальный документ.
Преимущество такого подхода заключается не только в том, что вы быстро получите свой диплом. Весь процесс организован просто и легко, с профессиональной поддержкой. От выбора необходимого образца документа до консультаций по заполнению личных данных и доставки в любое место России — все находится под полным контролем наших специалистов.
В результате, всем, кто хочет найти максимально быстрый способ получить требуемый документ, наша компания предлагает выгодное решение. Заказать диплом – значит избежать продолжительного процесса обучения и не теряя времени перейти к достижению личных целей, будь то поступление в ВУЗ или начало карьеры.
Купить диплом Санкт-Петербургского государственного технологического института (технического университета)
Zet Casino Auszahlung Erfahrung
Das Zet Casino ist eine Online-GlГјcksspielplattform, die eine Vielzahl von Casinospielen und Boni fГјr seine Spieler anbietet. Eine wichtige Komponente eines guten Online-Casinos ist jedoch auch die Auszahlungserfahrung der Spieler. In diesem Artikel werden wir daher die Zet Casino Auszahlungserfahrung genauer unter die Lupe nehmen.
Zunächst einmal ist es wichtig zu erwähnen, dass das Zet Casino eine Vielzahl von Auszahlungsmethoden für seine Spieler anbietet. Dazu gehören Zahlungsoptionen wie Kreditkarten, Banküberweisungen, E-Wallets und mehr. Dies bedeutet, dass die Spieler eine breite Auswahl an Möglichkeiten haben, um ihr Geld abzuheben.
Ein weiterer positiver Aspekt der Zet Casino Auszahlungserfahrung ist die Schnelligkeit der Transaktionen. Die meisten Auszahlungen werden innerhalb von 24 Stunden bearbeitet, was im Vergleich zu anderen Online-Casinos als ziemlich schnell gilt. Dies bedeutet, dass die Spieler nicht lange auf ihr Geld warten mГјssen und ihre Gewinne schnell ausgezahlt werden.
Darüber hinaus bietet das Zet Casino auch einen zuverlässigen Kundenservice, der bei Fragen oder Problemen im Zusammenhang mit Auszahlungen zur Verfügung steht. Dies sorgt für eine angenehme Spielerfahrung und gibt den Spielern das Vertrauen, dass ihre finanziellen Angelegenheiten in guten Händen sind.
Alles in allem kann man sagen, dass die Zet Casino Auszahlungserfahrung positiv ist. Mit einer Vielzahl von Auszahlungsmethoden, schnellen Transaktionen und einem guten Kundenservice können die Spieler sicher sein, dass ihre Gewinne schnell und sicher auf ihr Konto überwiesen werden. Wer also auf der Suche nach einem zuverlässigen Online-Casino mit einer guten Auszahlungserfahrung ist, sollte definitiv das Zet Casino in Betracht ziehen.
https://zetcasino.one/
В нашем мире, где диплом – это начало удачной карьеры в любой отрасли, многие стараются найти максимально быстрый путь получения качественного образования. Важность наличия официального документа переоценить просто невозможно. Ведь именно диплом открывает дверь перед каждым человеком, желающим вступить в сообщество профессионалов или продолжить обучение в ВУЗе.
Наша компания предлагает максимально быстро получить этот важный документ. Вы можете купить диплом нового или старого образца, что будет отличным решением для всех, кто не смог завершить обучение, потерял документ или желает исправить плохие оценки. дипломы выпускаются с особой тщательностью, вниманием к мельчайшим элементам. На выходе вы сможете получить продукт, 100% соответствующий оригиналу.
Превосходство такого решения состоит не только в том, что вы быстро получите диплом. Процесс организован просто и легко, с нашей поддержкой. От выбора нужного образца документа до точного заполнения личных данных и доставки в любой регион России — все под абсолютным контролем опытных мастеров.
Таким образом, для тех, кто хочет найти быстрый способ получения требуемого документа, наша компания предлагает отличное решение. Купить диплом – значит избежать долгого процесса обучения и не теряя времени переходить к своим целям, будь то поступление в университет или старт карьеры.
Купить диплом 1992 года
Boomerang Casino ist ein beliebtes Online-Casino, das eine Vielzahl von Spielen und spannenden Bonusangeboten bietet. Viele Spieler interessieren sich aber auch fГјr die Erfahrungen mit Auszahlungen im Boomerang Casino.
Die meisten Spieler berichten, dass die Auszahlungen im Boomerang Casino schnell und unkompliziert abgewickelt werden. Das Casino bietet eine Vielzahl von Zahlungsmethoden an, darunter Kreditkarten, E-Wallets und BankГјberweisungen. Die meisten Auszahlungen werden innerhalb von 24 Stunden bearbeitet, und die Spieler erhalten ihr Geld in der Regel innerhalb weniger Tage.
Einige Spieler haben jedoch berichtet, dass es gelegentlich zu Verzögerungen bei Auszahlungen kommen kann. Diese Verzögerungen sind in der Regel auf Sicherheitsüberprüfungen zurückzuführen, die das Boomerang Casino durchführt, um sicherzustellen, dass alle Auszahlungen korrekt und sicher abgewickelt werden.
Insgesamt sind die Erfahrungen mit Auszahlungen im Boomerang Casino größtenteils positiv. Die meisten Spieler erhalten ihr Geld schnell und zuverlässig, und das Casino ist bekannt für seinen hervorragenden Kundenservice und seine Transparenz bei Auszahlungen. Wer also auf der Suche nach einem seriösen Online-Casino ist, sollte Boomerang Casino definitiv in Betracht ziehen.
https://boomerangcasino.one/
https://stroynews.info
olympic-school.com
В современном мире, где диплом – это начало отличной карьеры в любой отрасли, многие ищут максимально быстрый и простой путь получения образования. Наличие документа об образовании трудно переоценить. Ведь именно он открывает дверь перед любым человеком, который желает начать трудовую деятельность или учиться в университете.
В данном контексте мы предлагаем очень быстро получить любой необходимый документ. Вы имеете возможность заказать диплом, и это будет удачным решением для человека, который не смог закончить обучение, утратил документ или хочет исправить плохие оценки. Все дипломы выпускаются аккуратно, с максимальным вниманием ко всем деталям, чтобы на выходе получился 100% оригинальный документ.
Плюсы подобного подхода заключаются не только в том, что вы быстро получите диплом. Весь процесс организовывается просто и легко, с нашей поддержкой. От выбора необходимого образца диплома до правильного заполнения личной информации и доставки в любой регион страны — все находится под полным контролем наших мастеров.
В результате, всем, кто хочет найти быстрый способ получить необходимый документ, наша услуга предлагает отличное решение. Приобрести диплом – значит избежать продолжительного обучения и сразу перейти к достижению своих целей: к поступлению в ВУЗ или к началу успешной карьеры.
Купить диплом Санкт-Петербургского государственного университета
Hello students and applicants!
The university admission process for the year 2024 continues to evolve with technological advancements and changing academic landscapes. https://satbayev.university/ prospective students must navigate a variety of requirements and deadlines to secure a place in their desired programs.
Admission Process Overview
The admission process typically involves several key steps:
Application Submission: Students must complete and submit their applications by the deadlines, which may vary by institution.
Standardized Tests: Many universities require scores from tests such as the SAT, ACT, or GRE.
Personal Statement: A well-crafted essay that reflects the applicant’s personality, achievements, and aspirations.
Letters of Recommendation: Endorsements from teachers or professionals who can attest to the applicant’s qualifications.
Interviews: Some programs conduct interviews to assess the candidate’s suitability for the course.
The year 2024’s university admission process is designed to identify and select candidates who are well-prepared to thrive in a rigorous academic environment. It’s a comprehensive system that evaluates not just academic prowess but also extracurricular involvement, leadership qualities, and personal growth.
[url=https://satbayev.university/]Bachelor`s electrical engineering and electrical engineering[/url]
Placement Exams
Cybersecurity
Transistor
Application Deadline
Good luck and good progress!
Das Tipico Casino Quote ist ein wichtiges Element für alle Spieler, die gerne online Glücksspiele spielen. Die Quote gibt an, wie viel Geld ein Spieler durchschnittlich zurückerhält, wenn er eine bestimmte Wette abschließt. Je höher die Quote, desto besser sind die Gewinnchancen für den Spieler.
Das Tipico Casino Quote ist transparent und wird regelmäßig von unabhhängigen Prüfinstanzen überwacht, um sicherzustellen, dass die Spieler fair behandelt werden. Die Quote variiert je nach Spiel und kann von Tag zu Tag unterschiedlich sein. Es lohnt sich also, regelmäßig die Quoten zu überprüfen, um die besten Gewinnchancen zu erhalten.
Spieler sollten jedoch darauf achten, dass die Quote alleine nicht ausschlaggebend ist, um erfolgreich im Online Casino zu spielen. Auch das Wissen Гјber die Spielregeln, eine gute Strategie und ein gewisses MaГџ an GlГјck sind entscheidend fГјr den Erfolg.
Insgesamt bietet das Tipico Casino Quote eine gute Grundlage für spannende und unterhaltsame Spielerlebnisse. Spieler können sich auf faire Quoten verlassen und haben die Möglichkeit, attraktive Gewinne zu erzielen. Wer sein Glück versuchen möchte, sollte also nicht zögern und das Tipico Casino ausprobieren.
https://tipicocasino.one/
В нашем обществе, где диплом является началом отличной карьеры в любом направлении, многие ищут максимально быстрый и простой путь получения качественного образования. Факт наличия официального документа переоценить невозможно. Ведь именно он открывает дверь перед всеми, кто собирается вступить в сообщество квалифицированных специалистов или продолжить обучение в высшем учебном заведении.
В данном контексте наша компания предлагает очень быстро получить этот важный документ. Вы имеете возможность купить диплом старого или нового образца, и это будет удачным решением для человека, который не смог закончить обучение или утратил документ. Все дипломы изготавливаются с особой аккуратностью, вниманием к мельчайшим элементам. На выходе вы сможете получить 100% оригинальный документ.
Преимущества такого решения заключаются не только в том, что можно оперативно получить диплом. Весь процесс организовывается удобно, с нашей поддержкой. От выбора подходящего образца до грамотного заполнения персональной информации и доставки в любое место России — все находится под абсолютным контролем опытных мастеров.
Таким образом, для тех, кто хочет найти максимально быстрый способ получить необходимый документ, наша компания предлагает отличное решение. Заказать диплом – значит избежать долгого процесса обучения и не теряя времени перейти к важным целям: к поступлению в ВУЗ или к началу удачной карьеры.
http://diploms-service.com/diplomy-po-gorodam/moskva/mgf-rgutis
Заказать купленный диплом, через интернет.
Доступные цены на дипломы для продажи, узнайте сейчас.
Какой диплом купить, советы от профессионалов.
Опыт успешной покупки диплома, рассказываем.
Как купить диплом безопасно, с гарантией.
Как выбрать диплом для покупки, важные моменты.
Как купить диплом быстро, спешите.
Скрытая покупка дипломов, наши преимущества.
Как быстро купить диплом, подробности на сайте.
Покупка диплома: безопасность и качество, подробности у нас.
Официальные документы для покупки, гарантированное качество.
Безопасное приобретение документов об образовании, лучшие условия.
Почему стоит заказать диплом, гарантированный результат.
Дипломы на всех условиях, важные моменты.
Как купить дипломы онлайн, подробности у нас.
Купить дипломы легко, интересные варианты.
Купить диплом с доставкой по всему миру, лучшие условия.
Официальный документ об образовании, гарантированный результат.
купить диплом [url=https://7arusak-diploms.com/]https://7arusak-diploms.com/[/url] .
Купить диплом с доставкой до дома, через интернет.
Легальный способ купить диплом, без заморочек.
Купить диплом с гарантией качества, важная информация.
Опыт успешной покупки диплома, все секреты.
Купить диплом легко, с гарантией.
Как выбрать диплом для покупки, секреты выбора.
Купить диплом срочно и недорого, лучшие условия.
Скрытая покупка дипломов, наши преимущества.
Как быстро купить диплом, только актуальная информация.
Купить диплом срочно и законно, лучшие условия.
Официальные документы для покупки, срочные варианты.
Как купить диплом срочно, лучшие условия.
Купить диплом без обмана, важные детали.
Как выбрать и купить диплом, лучшие предложения.
Как купить дипломы онлайн, подробности у нас.
Какой диплом выбрать для покупки, интересные варианты.
Заказать диплом онлайн без проблем, важные детали.
Почему стоит заказать диплом на нашем сайте, подробности у нас.
купить диплом [url=http://www.7arusak-diploms.com]http://www.7arusak-diploms.com[/url] .
В нашем обществе, где диплом становится началом успешной карьеры в любом направлении, многие ищут максимально быстрый путь получения образования. Наличие официального документа об образовании сложно переоценить. Ведь именно он открывает дверь перед всеми, кто собирается вступить в сообщество квалифицированных специалистов или учиться в ВУЗе.
Наша компания предлагает максимально быстро получить любой необходимый документ. Вы сможете заказать диплом, что будет удачным решением для всех, кто не смог закончить обучение или утратил документ. диплом изготавливается аккуратно, с особым вниманием ко всем нюансам. В итоге вы получите продукт, 100% соответствующий оригиналу.
Превосходство подобного подхода заключается не только в том, что вы сможете максимально быстро получить диплом. Процесс организован удобно и легко, с нашей поддержкой. Начиная от выбора нужного образца до консультаций по заполнению личных данных и доставки по России — все находится под абсолютным контролем качественных специалистов.
Всем, кто ищет максимально быстрый способ получения требуемого документа, наша услуга предлагает отличное решение. Приобрести диплом – значит избежать длительного обучения и сразу переходить к достижению собственных целей: к поступлению в ВУЗ или к началу удачной карьеры.
Купить диплом Менеджера
Zet Casino Ilmaiskierrokset: Spielen ohne Risiko
Zet Casino ist ein beliebtes Online-Casino, das seinen Spielern eine Vielzahl von Spielen und Aktionen bietet. Eine besonders beliebte Aktion sind die sogenannten “ilmaiskierrokset”, also kostenlose Spins an den Spielautomaten. Diese ilmaiskierrokset sind eine groГџartige MГ¶glichkeit fГјr Spieler, neue Spiele auszuprobieren, ohne dabei eigenes Geld einzusetzen.
Um an den ilmaiskierrokset bei Zet Casino teilzunehmen, müssen Spieler entweder eine Mindesteinzahlung auf ihr Konto tätigen oder an bestimmten Promotionen teilnehmen. Sobald die Teilnahmebedingungen erfüllt sind, erhalten die Spieler ihre kostenlosen Spins und können sofort damit beginnen, die Walzen zu drehen.
Die ilmaiskierrokset bieten den Spielern nicht nur die Möglichkeit, neue Spiele kennenzulernen, sondern auch echte Gewinne zu erzielen. Mit etwas Glück können Spieler mit ihren kostenlosen Spins große Gewinne erzielen und ihr Spielvergnügen so noch weiter steigern.
Zet Casino bietet regelmäßig neue ilmaiskierrokset-Aktionen, sodass Spieler immer wieder die Chance haben, kostenlose Spins zu erhalten. Es lohnt sich daher, regelmäßig die Aktionsseite des Casinos zu besuchen, um keine der spannenden Aktionen zu verpassen.
Insgesamt sind die ilmaiskierrokset bei Zet Casino eine tolle Möglichkeit, um risikofrei neue Spiele auszuprobieren und dabei auch noch echte Gewinne zu erzielen. Wer also auf der Suche nach einem unterhaltsamen und lukrativen Casino-Erlebnis ist, sollte die ilmaiskierrokset-Aktionen von Zet Casino auf jeden Fall im Blick behalten. Viel Spaß und viel Glück beim Spielen!
https://zetcasino.one/
pervenec.com
Купить диплом с доставкой до дома, через интернет.
Доступные цены на дипломы для продажи, узнайте сейчас.
Купить диплом с гарантией качества, важная информация.
Опыт успешной покупки диплома, подробности.
Где купить диплом без проблем, без риска.
Купить диплом по выгодной цене, секреты выбора.
Купить диплом срочно и недорого, подробности на сайте.
Почему стоит купить диплом, важная информация.
Как быстро купить диплом, подробности на сайте.
Как купить диплом онлайн, подробности у нас.
Официальные документы для покупки, гарантированное качество.
Безопасное приобретение документов об образовании, лучшие условия.
Почему стоит заказать диплом, гарантированный результат.
Дипломы на всех условиях, лучшие предложения.
Купить диплом без риска, безопасность на первом месте.
Какой диплом выбрать для покупки, интересные варианты.
Официальная покупка диплома, лучшие условия.
Как купить диплом безопасно и быстро, безопасность на первом месте.
купить диплом [url=http://7arusak-diploms.com/]http://7arusak-diploms.com/[/url] .
Tipico ist eine beliebte Online-GlГјcksspielplattform, die eine Vielzahl von Casino-Spielen und Sportwetten anbietet. In letzter Zeit gab es jedoch einige Kontroversen darГјber, dass Tipico nur das Casino-Konto von Spielern sperren kann, nicht aber das Konto fГјr Sportwetten.
Dies hat bei einigen Spielern zu Verwirrung und Unzufriedenheit geführt, da sie der Meinung sind, dass sie ihr gesamtes Konto sperren lassen sollten, wenn sie Probleme mit Glücksspielen haben. Diejenigen, die süchtig sind oder Schwierigkeiten haben, ihr Spielverhalten zu kontrollieren, könnten sich durch eine bloße Sperrung des Casino-Kontos nicht ausreichend geschützt fühlen.
Tipico hat erklärt, dass es gesetzlich vorgeschrieben ist, dass Spieler die Möglichkeit haben müssen, nur das Casino-Konto zu sperren, ohne das gesamte Konto schließen zu müssen. Dies soll den Spielern ermöglichen, weiterhin Sportwetten zu platzieren, wenn sie dies wünschen, ohne auf das gesamte Angebot von Tipico verzichten zu müssen.
Dennoch fordern einige Spieler und Experten eine strengere Regulierung und Kontrolle im Glücksspielbereich, um gefährdete Spieler besser zu schützen. Sie argumentieren, dass das Risiko von Spielsucht und finanziellen Problemen durch eine stärkere Regulierung reduziert werden kann.
Es bleibt abzuwarten, ob Tipico auf die Kritik reagieren und Maßnahmen ergreifen wird, um die Sicherheit und den Schutz der Spieler zu verbessern. In der Zwischenzeit sollten Spieler, die Schwierigkeiten mit Glücksspielen haben, sich bewusst sein, dass sie die Möglichkeit haben, ihr Casino-Konto bei Tipico sperren zu lassen, sollten sie dies für notwendig erachten.
https://tipicocasino.one/
blabla
Zet Casino Paysafecard
Paysafecard ist eine beliebte und sichere Zahlungsmethode, die von vielen Online-Casinos akzeptiert wird. Zet Casino, ein aufstrebendes Online-Casino mit einer vielfältigen Auswahl an Spielen und großzügigen Boni, akzeptiert auch Paysafecard als Zahlungsmethode.
Paysafecard ist eine Prepaid-Zahlungsmethode, bei der Nutzer eine Karte mit einem bestimmten Wert kaufen und diesen Wert dann online verwenden können, um Einkäufe zu tätigen oder Geld auf ihr Casino-Konto einzuzahlen. Dies macht Paysafecard besonders sicher, da keine persönlichen Daten oder Bankinformationen preisgegeben werden müssen.
Bei Zet Casino können Spieler Paysafecard verwenden, um Geld auf ihr Konto einzuzahlen und sofort mit dem Spielen zu beginnen. Der Prozess ist einfach und unkompliziert: Spieler müssen einfach den Wert ihrer Paysafecard-Karte eingeben und bestätigen. Das Geld wird sofort auf ihr Konto gutgeschrieben, ohne dass zusätzliche Gebühren anfallen.
Darüber hinaus bietet Zet Casino regelmäßig Sonderaktionen und Boni für Spieler, die Paysafecard verwenden. Diese können Freispiele, Einzahlungsboni oder andere Belohnungen beinhalten, die das Spielerlebnis noch spannender und lohnender machen.
Insgesamt ist die Verwendung von Paysafecard im Zet Casino eine bequeme und sichere Möglichkeit, um Geld auf das Spielerkonto einzuzahlen und von den zahlreichen Spielen und Boni des Casinos zu profitieren. Spieler können beruhigt sein, dass ihre persönlichen Daten geschützt sind und sie ein erstklassiges Spielerlebnis genießen können.
https://zetcasino.one/
Заказать купленный диплом, не выходя из дома.
Доступные цены на дипломы для продажи, подробности здесь.
Заказать официальный документ о образовании, проверенные варианты.
Почему выгодно купить диплом, рассказываем.
Купить диплом легко, с гарантией.
Как выбрать диплом для покупки, интересные варианты.
Дипломы на заказ по лучшим ценам, спешите.
Почему стоит купить диплом, наши преимущества.
Где купить действующий диплом, срочно и выгодно.
Как купить диплом онлайн, подробности у нас.
Как выбрать диплом, срочные варианты.
Как купить диплом срочно, без рисков.
Почему стоит заказать диплом, гарантированный результат.
Купить диплом просто, важные моменты.
Как купить дипломы онлайн, подробности у нас.
Какой диплом выбрать для покупки, подробности на сайте.
Заказать диплом онлайн без проблем, важные детали.
Почему стоит заказать диплом на нашем сайте, безопасность на первом месте.
купить диплом [url=http://www.7arusak-diploms.com]http://www.7arusak-diploms.com[/url] .
nice content!nice history!!
В нашем мире, где диплом – это начало отличной карьеры в любом направлении, многие ищут максимально простой путь получения качественного образования. Факт наличия официального документа трудно переоценить. Ведь именно диплом открывает двери перед любым человеком, который желает вступить в профессиональное сообщество или учиться в ВУЗе.
Наша компания предлагает максимально быстро получить этот необходимый документ. Вы можете приобрести диплом, что является удачным решением для человека, который не смог завершить образование, потерял документ или хочет исправить плохие оценки. диплом изготавливается аккуратно, с особым вниманием к мельчайшим деталям, чтобы в результате получился 100% оригинальный документ.
Преимущество такого подхода заключается не только в том, что вы максимально быстро получите свой диплом. Весь процесс организовывается удобно, с профессиональной поддержкой. Начав от выбора необходимого образца до консультации по заполнению личной информации и доставки в любое место России — все под абсолютным контролем опытных мастеров.
Таким образом, для тех, кто пытается найти быстрый способ получить необходимый документ, наша компания может предложить отличное решение. Заказать диплом – это значит избежать длительного обучения и не теряя времени перейти к достижению личных целей: к поступлению в университет или к началу успешной карьеры.
http://diploms-service.com/diplomy-po-gorodam/sankt-peterburg/sankt-peterburgskij-institut-iskusstv-i-restavratsii
Wenn es um das Auszahlen von Gewinnen im Casino geht, ist Tipico eine beliebte Wahl fГјr viele Spieler. Mit ihrem klassischen Casino-Angebot und einer Vielzahl von Spielen haben sie eine treue Fangemeinde aufgebaut.
Tipico bietet verschiedene Möglichkeiten für Spieler, um ihre Gewinne auszahlen zu lassen. Ein klassischer Weg ist die Auszahlung per Banküberweisung. Spieler können einfach ihre Bankdaten angeben und ihre Gewinne werden sicher und schnell auf ihr Konto überwiesen.
Eine weitere Möglichkeit ist die Auszahlung über E-Wallets wie PayPal oder Skrill. Diese Optionen sind besonders beliebt, da sie eine schnelle und einfache Möglichkeit bieten, um an sein Geld zu gelangen. Spieler müssen einfach ihre E-Mail-Adresse angeben und können ihre Gewinne direkt auf ihr E-Wallet erhalten.
Darüber hinaus bietet Tipico auch die Möglichkeit, seine Gewinne in bar in einem der vielen Tipico-Shops abzuholen. Diese Option ist besonders praktisch für Spieler, die lieber persönlich ihr Geld in Empfang nehmen möchten.
Insgesamt bietet Tipico eine Vielzahl von sicheren und bequemen Möglichkeiten, um Gewinne im klassischen Casino auszuzahlen. Spieler können sich darauf verlassen, dass ihre Gewinne schnell und zuverlässig auf ihr Konto überwiesen werden. Mit einer breiten Auswahl an Spielen und einer benutzerfreundlichen Plattform ist Tipico eine hervorragende Wahl für jeden, der gerne im Casino spielt.
https://tipicocasino.one/
Заказать купленный диплом, не выходя из дома.
Легальный способ купить диплом, узнайте сейчас.
Заказать официальный документ о образовании, проверенные варианты.
Почему выгодно купить диплом, рассказываем.
Купить диплом легко, на проверенных ресурсах.
Как выбрать диплом для покупки, секреты выбора.
Купить диплом срочно и недорого, лучшие условия.
Покупка диплома: безопасность и конфиденциальность, важная информация.
Где купить действующий диплом, срочно и выгодно.
Покупка диплома: безопасность и качество, подробности у нас.
Официальные документы для покупки, гарантированное качество.
Легальная покупка дипломов, лучшие условия.
Официальные дипломы для покупки, гарантированный результат.
Купить диплом просто, важные моменты.
Легальная покупка дипломов безопасно, гарантированная доставка.
Какой диплом выбрать для покупки, интересные варианты.
Официальная покупка диплома, важные детали.
Официальный документ об образовании, подробности у нас.
купить диплом [url=https://www.7arusak-diploms.com]https://www.7arusak-diploms.com[/url] .
Found an article that is worth reading – it’s really interesting! http://repetitor.ekafe.ru/faq.php
[url=https://xn--krken13-9va.at]kraken зеркало рабочее[/url] – kraken market, ссылка на kraken
2fight.info
[url=https://xn--krken13-9va.at]kraken зеркало тор[/url] – kraken зеркало даркнет, ссылка на kraken
1SS3D249742
lalablublu
Спортивные силовые тренажеры на https://silovye-trenazhery.ru/ – это лучшие станки для укрепления всех мышц. Делятся на блочные и с нагрузкой блинами. Актуальны для развития выносливости.
Производимые отечественным производителем спортивные тренажеры не нуждаются в постоянном наблюдении. В напряженных узлах используются подшипники закрытого типа.
Оформляйте: Кроссовер, Баттерфляй для грудных, рычажные Хаммеры, вертикально-горизонтальная тяга, парта Скотта, Дельта машину, Гакк тренажер, Пресс машину 3 в 1, Гравитрон, обратная гиперэкстензия, скамьи для жима со стойками, горизонтальная лавка, машина Смита.
Всегда востребованы в спортивных залах мультитренажеры для тренировки всех мышц тела.
해외선물 대여계좌
해외선물의 출발 골드리치와 함께하세요.
골드리치증권는 길고긴기간 회원분들과 함께 선물시장의 진로을 공동으로 동행해왔으며, 투자자분들의 안전한 자금운용 및 건강한 수익성을 지향하여 계속해서 최선을 다하고 있습니다.
어째서 20,000+명 넘게이 골드리치와 투자하나요?
신속한 대응: 쉽고 빠른속도의 프로세스를 마련하여 누구나 간편하게 활용할 수 있습니다.
안전 프로토콜: 국가기관에서 적용한 최상의 등급의 보안을 적용하고 있습니다.
스마트 인증: 전체 거래정보은 부호화 처리되어 본인 외에는 아무도 누구도 내용을 열람할 수 없습니다.
안전 이익률 제공: 리스크 요소를 감소시켜, 보다 더 안전한 수익률을 제공하며 이에 따른 리포트를 제공합니다.
24 / 7 상시 고객센터: året runt 24시간 즉각적인 지원을 통해 회원분들을 전체 지원합니다.
협력하는 파트너사: 골드리치증권는 공기업은 물론 금융계들 및 다수의 협력사와 공동으로 여정을 했습니다.
국외선물이란?
다양한 정보를 참고하세요.
외국선물은 국외에서 거래되는 파생금융상품 중 하나로, 특정 기초자산(예: 주식, 화폐, 상품 등)을 기초로 한 옵션 약정을 말합니다. 본질적으로 옵션은 특정 기초자산을 미래의 특정한 시점에 정해진 가격에 매수하거나 매도할 수 있는 자격을 부여합니다. 외국선물옵션은 이러한 옵션 계약이 국외 시장에서 거래되는 것을 의미합니다.
외국선물은 크게 매수 옵션과 풋 옵션으로 구분됩니다. 콜 옵션은 명시된 기초자산을 미래에 정해진 금액에 매수하는 권리를 부여하는 반면, 풋 옵션은 지정된 기초자산을 미래에 일정 가격에 매도할 수 있는 권리를 허락합니다.
옵션 계약에서는 미래의 명시된 날짜에 (만기일이라 칭하는) 일정 금액에 기초자산을 매수하거나 매도할 수 있는 권리를 가지고 있습니다. 이러한 금액을 행사 가격이라고 하며, 만료일에는 해당 권리를 실행할지 여부를 선택할 수 있습니다. 따라서 옵션 계약은 거래자에게 미래의 가격 변동에 대한 보호나 이익 창출의 기회를 부여합니다.
해외선물은 마켓 참가자들에게 다양한 투자 및 차익거래 기회를 마련, 환율, 상품, 주식 등 다양한 자산유형에 대한 옵션 계약을 망라할 수 있습니다. 투자자는 매도 옵션을 통해 기초자산의 하향에 대한 보호를 받을 수 있고, 매수 옵션을 통해 활황에서의 이익을 겨냥할 수 있습니다.
외국선물 거래의 원리
행사 금액(Exercise Price): 국외선물에서 실행 가격은 옵션 계약에 따라 지정된 가격으로 계약됩니다. 만기일에 이 가격을 기준으로 옵션을 행사할 수 있습니다.
만료일(Expiration Date): 옵션 계약의 종료일은 옵션의 실행이 불가능한 최종 일자를 의미합니다. 이 날짜 다음에는 옵션 계약이 종료되며, 더 이상 거래할 수 없습니다.
매도 옵션(Put Option)과 콜 옵션(Call Option): 매도 옵션은 기초자산을 지정된 금액에 팔 수 있는 권리를 부여하며, 콜 옵션은 기초자산을 명시된 가격에 사는 권리를 허락합니다.
프리미엄(Premium): 국외선물 거래에서는 옵션 계약에 대한 프리미엄을 납부해야 합니다. 이는 옵션 계약에 대한 가격으로, 마켓에서의 수요량와 공급에 따라 변동됩니다.
행사 방안(Exercise Strategy): 투자자는 만료일에 옵션을 행사할지 여부를 판단할 수 있습니다. 이는 시장 상황 및 거래 플랜에 따라 차이가있으며, 옵션 계약의 수익을 극대화하거나 손해를 감소하기 위해 선택됩니다.
시장 리스크(Market Risk): 국외선물 거래는 시장의 변화추이에 작용을 받습니다. 가격 변화이 기대치 못한 진로으로 발생할 경우 손실이 발생할 수 있으며, 이러한 시장 리스크를 감소하기 위해 거래자는 계획을 구축하고 투자를 계획해야 합니다.
골드리치와 동반하는 외국선물은 확실한 믿을만한 수 있는 투자를 위한 가장좋은 대안입니다. 회원님들의 투자를 뒷받침하고 안내하기 위해 우리는 전력을 다하고 있습니다. 함께 더 나은 내일를 향해 전진하세요.
Euro
UEFA Euro 2024 Sân Chơi Bóng Đá Hấp Dẫn Nhất Của Châu Âu
Euro 2024 là sự kiện bóng đá lớn nhất của châu Âu, không chỉ là một giải đấu mà còn là một cơ hội để các quốc gia thể hiện tài năng, sự đoàn kết và tinh thần cạnh tranh.
Euro 2024 hứa hẹn sẽ mang lại những trận cầu đỉnh cao và kịch tính cho người hâm mộ trên khắp thế giới. Cùng tìm hiểu các thêm thông tin hấp dẫn về giải đấu này tại bài viết dưới đây, gồm:
Nước chủ nhà
Đội tuyển tham dự
Thể thức thi đấu
Thời gian diễn ra
Sân vận động
Euro 2024 sẽ được tổ chức tại Đức, một quốc gia có truyền thống vàng của bóng đá châu Âu.
Đức là một đất nước giàu có lịch sử bóng đá với nhiều thành công quốc tế và trong những năm gần đây, họ đã thể hiện sức mạnh của mình ở cả mặt trận quốc tế và câu lạc bộ.
Việc tổ chức Euro 2024 tại Đức không chỉ là một cơ hội để thể hiện năng lực tổ chức tuyệt vời mà còn là một dịp để giới thiệu văn hóa và sức mạnh thể thao của quốc gia này.
Đội tuyển tham dự giải đấu Euro 2024
Euro 2024 sẽ quy tụ 24 đội tuyển hàng đầu từ châu Âu. Các đội tuyển này sẽ là những đại diện cho sự đa dạng văn hóa và phong cách chơi bóng đá trên khắp châu lục.
Các đội tuyển hàng đầu như Đức, Pháp, Tây Ban Nha, Bỉ, Italy, Anh và Hà Lan sẽ là những ứng viên nặng ký cho chức vô địch.
Trong khi đó, các đội tuyển nhỏ hơn như Iceland, Wales hay Áo cũng sẽ mang đến những bất ngờ và thách thức cho các đối thủ.
Các đội tuyển tham dự được chia thành 6 bảng đấu, gồm:
Bảng A: Đức, Scotland, Hungary và Thuỵ Sĩ
Bảng B: Tây Ban Nha, Croatia, Ý và Albania
Bảng C: Slovenia, Đan Mạch, Serbia và Anh
Bảng D: Ba Lan, Hà Lan, Áo và Pháp
Bảng E: Bỉ, Slovakia, Romania và Ukraina
Bảng F: Thổ Nhĩ Kỳ, Gruzia, Bồ Đào Nha và Cộng hoà Séc
Tipico Casino Bonus Code Bestandskunden 2021
Das Tipico Casino ist eine beliebte Online-Glücksspielplattform, die ihren Kunden eine Vielzahl von Spielen und Boni bietet. Für Bestandskunden, die regelmäßig im Tipico Casino spielen, gibt es im Jahr 2021 spannende Bonusaktionen, die sie nutzen können.
Ein wichtiger Aspekt für Bestandskunden sind die bonus codes, die ihnen zusätzliche Vorteile und Vergünstigungen im Casino bieten. Mit einem Bonuscode können die Spieler beispielsweise zusätzliches Geld zum Spielen erhalten oder Freispiele für bestimmte Slots freischalten.
Um den Tipico Casino Bonus Code Bestandskunden 2021 zu erhalten, müssen die Spieler häufig bestimmte Bedingungen erfüllen, wie beispielsweise eine Mindesteinzahlung tätigen oder an bestimmten Spielen teilnehmen. Die genauen Einlösebedingungen können auf der Website des Casinos eingesehen werden.
Es ist wichtig, dass die Bestandskunden regelmäßig die Website des Tipico Casinos besuchen, um über die aktuellen Bonusaktionen informiert zu sein und keinen lukrativen Bonuscode zu verpassen. Auch die sozialen Medien und der Newsletter des Casinos sind gute Quellen, um über aktuelle Angebote auf dem Laufenden zu bleiben.
Zusätzlich zu den Bonuscodes bietet das Tipico Casino seinen Bestandskunden auch regelmäßig Gewinnspiele und Sonderaktionen an. Diese können attraktive Preise wie Geldpreise, Reisen oder Freispiele beinhalten und sorgen für zusätzliche Spannung und Unterhaltung beim Spielen.
Alles in allem bietet das Tipico Casino seinen Bestandskunden im Jahr 2021 eine Vielzahl von Möglichkeiten, um von attraktiven Bonusaktionen zu profitieren und ihr Spielerlebnis zu maximieren. Durch regelmäßiges Spielen und die Nutzung von Bonuscodes können die Spieler ihre Gewinnchancen erhöhen und zusätzliche Vorteile genießen.
https://tipicocasino.one/
На сегодняшний день, когда диплом – это начало отличной карьеры в любом направлении, многие ищут максимально простой путь получения качественного образования. Необходимость наличия документа об образовании переоценить просто невозможно. Ведь диплом открывает двери перед любым человеком, который собирается начать трудовую деятельность или продолжить обучение в каком-либо университете.
В данном контексте наша компания предлагает быстро получить этот необходимый документ. Вы можете заказать диплом, и это является отличным решением для человека, который не смог закончить обучение или утратил документ. Каждый диплом изготавливается с особой аккуратностью, вниманием к мельчайшим нюансам. В результате вы получите продукт, максимально соответствующий оригиналу.
Преимущество подобного подхода заключается не только в том, что вы сможете максимально быстро получить диплом. Процесс организован просто и легко, с профессиональной поддержкой. Начав от выбора необходимого образца до грамотного заполнения персональных данных и доставки в любое место России — все под полным контролем качественных мастеров.
Всем, кто ищет быстрый способ получения необходимого документа, наша компания предлагает отличное решение. Заказать диплом – значит избежать долгого процесса обучения и сразу перейти к своим целям: к поступлению в университет или к началу трудовой карьеры.
http://hobby-svarka.ru/viewtopic.php?f=10&t=4811
bliloblo
Отечественный производитель предлагает разборные гантели на https://gantelya-razbornaya.ru/ для домашних тренировок.
Все комплекты разборных снарядов оснащаются замками, блинами. Грифы для гантелей производятся с несколькими посадочными диаметрами. Для защиты от ударов все грифы покрываются хромом и никелем.
Выпускаемые изделия не нуждаются в техническом обслуживании и рассчитаны на длительную эксплуатацию в доме или тренажерных клубах.
Дают возможность укреплять все мышцы. С разборными снарядами можно быстро сбросить вес и набрать силу.
Прорезиненные диски гарантируют более безопасные занятия.
Приобретая в российской компании вы получаете эффективные инструменты для комфортных тренировок.
nice content!nice history!!
профессиональный сварочный стол [url=https://www.jetstanki.ru/]https://www.jetstanki.ru/[/url] .
https://oda-radio.com
holidaynewsletters.com
В наше время, когда диплом – это начало отличной карьеры в любом направлении, многие стараются найти максимально простой путь получения образования. Наличие официального документа об образовании трудно переоценить. Ведь диплом открывает двери перед каждым человеком, желающим вступить в сообщество профессиональных специалистов или продолжить обучение в высшем учебном заведении.
Наша компания предлагает оперативно получить этот важный документ. Вы сможете приобрести диплом, и это будет удачным решением для человека, который не смог завершить образование, потерял документ или желает исправить плохие оценки. Все дипломы выпускаются с особой тщательностью, вниманием к мельчайшим элементам. В итоге вы получите документ, 100% соответствующий оригиналу.
Превосходство подобного решения состоит не только в том, что вы сможете оперативно получить свой диплом. Весь процесс организовывается удобно, с нашей поддержкой. Начав от выбора подходящего образца до консультаций по заполнению личных данных и доставки в любой регион России — все под абсолютным контролем качественных мастеров.
В итоге, для тех, кто пытается найти быстрый и простой способ получить необходимый документ, наша компания предлагает отличное решение. Приобрести диплом – это значит избежать длительного обучения и сразу перейти к достижению своих целей, будь то поступление в университет или начало трудовой карьеры.
http://ledi.forumno.com/viewtopic.php?id=4809
Сегодня, когда диплом является началом отличной карьеры в любой отрасли, многие пытаются найти максимально быстрый путь получения качественного образования. Наличие официального документа об образовании сложно переоценить. Ведь именно диплом открывает дверь перед всеми, кто стремится вступить в профессиональное сообщество или продолжить обучение в университете.
Мы предлагаем максимально быстро получить этот важный документ. Вы имеете возможность приобрести диплом, что будет удачным решением для всех, кто не смог закончить обучение, утратил документ или хочет исправить свои оценки. диплом изготавливается аккуратно, с максимальным вниманием к мельчайшим нюансам. На выходе вы сможете получить полностью оригинальный документ.
Превосходство этого подхода состоит не только в том, что вы максимально быстро получите свой диплом. Весь процесс организовывается комфортно, с нашей поддержкой. От выбора подходящего образца диплома до консультаций по заполнению персональных данных и доставки по России — все под абсолютным контролем квалифицированных специалистов.
Всем, кто ищет оперативный способ получения необходимого документа, наша услуга предлагает выгодное решение. Заказать диплом – это значит избежать продолжительного обучения и сразу перейти к своим целям, будь то поступление в университет или старт карьеры.
http://diploms-service.com/diplomy-po-napravleniyam/pedagogicheskij-diplom
I urge you steer clear of this site. My personal experience with it was only frustration along with suspicion of fraudulent activities. Proceed with extreme caution, or alternatively, seek out a trustworthy site for your needs.
Das Boomerang Casino in der Schweiz ist ein beliebtes Ziel für Glücksspiel-Enthusiasten. Mit einer Vielzahl von Spielen, großzügigen Boni und einer eleganten Atmosphäre bietet das Casino eine erstklassige Spielerfahrung.
Das Boomerang Casino bietet eine breite Palette von Spielen, darunter Slots, Tischspiele und Live-Dealer-Spiele. Die Spieler können aus verschiedenen Variationen von Blackjack, Roulette, Poker und anderen beliebten Casino-Spielen wählen. Mit hochwertiger Grafik und reibungsloser Gameplay-Software bietet das Boomerang Casino eine hochwertige Spielerfahrung.
Darüber hinaus bietet das Boomerang Casino großzügige Boni und Promotionen für neue und bestehende Spieler. Von Willkommensboni über Einzahlungsboni bis hin zu Treueprogrammen gibt es immer spannende Möglichkeiten, zusätzliches Geld zu gewinnen und das Spielerlebnis zu maximieren.
Die elegante Atmosphäre des Boomerang Casinos trägt dazu bei, dass sich die Spieler wie in einem exklusiven Club fühlen. Mit stilvoller Einrichtung, freundlichem Personal und hochwertigem Service ist das Boomerang Casino der perfekte Ort, um eine Nacht voller Glücksspiel und Unterhaltung zu verbringen.
Insgesamt ist das Boomerang Casino in der Schweiz definitiv einen Besuch wert, ob man ein erfahrener Spieler ist oder einfach nur eine unterhaltsame Nacht verbringen möchte. Mit einer großen Auswahl an Spielen, großzügigen Boni und einer eleganten Atmosphäre bietet das Casino eine erstklassige Spielerfahrung, die man nicht verpassen sollte.
https://boomerangcasino.one/
В нашем обществе, где диплом становится началом удачной карьеры в любом направлении, многие ищут максимально простой путь получения образования. Наличие документа об образовании сложно переоценить. Ведь именно он открывает дверь перед любым человеком, желающим начать профессиональную деятельность или продолжить обучение в ВУЗе.
В данном контексте наша компания предлагает очень быстро получить этот важный документ. Вы сможете купить диплом старого или нового образца, что будет удачным решением для всех, кто не смог завершить образование, потерял документ или хочет исправить свои оценки. дипломы изготавливаются с особой тщательностью, вниманием ко всем нюансам. В результате вы сможете получить 100% оригинальный документ.
Превосходство этого подхода состоит не только в том, что вы максимально быстро получите диплом. Процесс организовывается комфортно, с нашей поддержкой. Начав от выбора подходящего образца до консультаций по заполнению личной информации и доставки в любой регион России — все будет находиться под абсолютным контролем наших мастеров.
Всем, кто ищет быстрый способ получить необходимый документ, наша компания может предложить отличное решение. Заказать диплом – это значит избежать долгого обучения и сразу переходить к личным целям, будь то поступление в университет или начало карьеры.
http://ukr.mybb.ru/viewtopic.php?id=390
[url=https://kraken12.co.at]кракен даркнет[/url] – kraken зеркало, kraken darknet
[url=https://12.kraken.gl]kraken com ссылка[/url] – ссылка кракен, kraken
Zet Casino Auszahlungsdauer: Was Sie wissen mГјssen
Wenn Sie in einem Online-Casino spielen, ist es ganz natürlich, dass Sie sich von Zeit zu Zeit Gedanken über die Auszahlungsdauer machen. Schließlich wollen Sie Ihre Gewinne so schnell wie möglich erhalten, um sie genießen oder für andere Zwecke nutzen zu können. In diesem Artikel werden wir uns genauer mit der Auszahlungsdauer im Zet Casino befassen.
Das Zet Casino ist ein beliebtes Online-Casino, das eine Vielzahl von Spielen und großzügigen Boni anbietet. Doch wie lange dauert es eigentlich, bis Sie Ihre Gewinne auszahlen lassen können? Die gute Nachricht ist, dass das Zet Casino in der Regel sehr schnell Auszahlungen bearbeitet. Normalerweise dauert es nur wenige Stunden bis maximal 1-2 Werktage, bis Ihr Auszahlungsantrag genehmigt und bearbeitet wird.
Es gibt jedoch einige Faktoren, die die Auszahlungsdauer beeinflussen können. Zum einen hängt es von der gewählten Zahlungsmethode ab. Einige Auszahlungsoptionen wie Banküberweisungen können länger dauern als andere, wie zum Beispiel E-Wallets. Es ist daher ratsam, eine Zahlungsmethode zu wählen, die eine schnellere Auszahlung ermöglicht.
Ein weiterer Faktor, der die Auszahlungsdauer beeinflussen kann, ist die Verifizierung Ihres Kontos. Bevor Sie eine Auszahlung tätigen können, müssen Sie möglicherweise einige Dokumente zur Verifizierung Ihres Kontos einreichen. Dies dient der Sicherheit und ist in vielen Online-Casinos üblich. Je schneller Sie diese Dokumente einreichen, desto schneller wird Ihr Auszahlungsantrag bearbeitet.
Insgesamt können wir festhalten, dass die Auszahlungsdauer im Zet Casino in der Regel recht zügig ist. Mit den richtigen Zahlungsmethoden und einer schnellen Verifizierung Ihres Kontos können Sie Ihre Gewinne schnell und problemlos erhalten. Wir empfehlen jedoch, sich vorab über die genauen Auszahlungsbedingungen des Zet Casinos zu informieren, um etwaige Verzögerungen zu vermeiden.
https://zetcasino.one/
Tipico Konto gehackt: Was tun, wenn das Casino-Konto geknackt wurde
Es ist ein Albtraum für jeden Spieler: Das Tipico Konto wurde gehackt und Unbekannte haben Zugriff auf persönliche Daten und Guthaben im Online Casino. Doch wie kann man in solch einer Situation richtig reagieren und sein Konto schützen?
Zunächst ist es wichtig, Ruhe zu bewahren und sich sofort an den Kundenservice von Tipico zu wenden. Dort kann man sein Problem schildern und Hilfe bei der Sperrung des Kontos sowie der Klärung des Vorfalls erhalten. Zudem sollte man umgehend sein Passwort ändern und alle anderen Accounts mit ähnlichen Zugangsdaten überprüfen.
Es ist ratsam, Anzeige bei der Polizei zu erstatten, um den Hackern das Handwerk zu legen und weitere Schäden zu verhindern. Zudem sollte man seine Bank informieren, um eventuelle Abbuchungen zu überprüfen und das Geld gegebenenfalls zurückzufordern.
Um solche Vorfälle in Zukunft zu vermeiden, ist es wichtig, starke Passwörter zu verwenden und regelmäßig zu wechseln. Zudem sollte man vorsichtig mit sensiblen Daten umgehen und nicht auf fragwürdige E-Mails oder Links klicken.
Insgesamt ist es wichtig, schnell zu handeln und Hilfe von den richtigen Stellen zu suchen, um sein gehacktes Tipico Konto zu sichern und weitere Schäden zu verhindern. Mit der richtigen Vorsorge und Sicherheitsmaßnahmen kann man das Risiko eines erneuten Hacks minimieren und wieder unbeschwert im Online Casino spielen.
https://tipicocasino.one/
Zet Casino Erfahrungen: Ein Гњberblick Гјber das Online-Casino
Das Zet Casino ist ein beliebtes Online-Casino, das eine Vielzahl von Spielen und groГџzГјgigen Bonusangeboten bietet. In diesem Artikel werfen wir einen genauen Blick auf die Erfahrungen, die Spieler mit diesem Casino gemacht haben.
Beginnen wir mit dem Design und der Benutzerfreundlichkeit der Website. Viele Spieler loben das moderne und benutzerfreundliche Design des Zet Casinos. Die Navigation auf der Website ist einfach und intuitiv, was es leicht macht, die gewünschten Spiele zu finden. Darüber hinaus ist die Website auch für mobile Geräte optimiert, was es Spielern ermöglicht, auch unterwegs zu spielen.
Ein weiterer wichtiger Aspekt eines Online-Casinos sind die angebotenen Spiele. Das Zet Casino bietet eine große Auswahl an Slots, Tischspielen und Live-Casino-Spielen von renommierten Anbietern wie NetEnt, Microgaming und Evolution Gaming. Spieler haben die Möglichkeit, ihre Lieblingsspiele zu finden und neue zu entdecken, was für Abwechslung und Unterhaltung sorgt.
Ein weiterer wichtiger Aspekt sind die Bonusangebote und Promotionen. Das Zet Casino belohnt neue Spieler mit einem großzügigen Willkommensbonus, der sowohl Bonusgeld als auch Freispiele umfassen kann. Darüber hinaus gibt es regelmäßig Aktionen wie Reload-Boni, Cashback-Angebote und Turniere, die den Spielern zusätzliche Gewinnchancen bieten.
Was die Ein- und Auszahlungsmöglichkeiten betrifft, so bietet das Zet Casino eine Vielzahl von Zahlungsmethoden wie Kreditkarten, E-Wallets und Banküberweisungen. Die meisten Zahlungen werden schnell bearbeitet, was es den Spielern ermöglicht, ihre Gewinne schnell zu erhalten.
Zusammenfassend lässt sich sagen, dass die Erfahrungen mit dem Zet Casino größtenteils positiv sind. Die Spieler loben das ansprechende Design der Website, die große Auswahl an Spielen und die großzügigen Bonusangebote. Wenn Sie auf der Suche nach einem unterhaltsamen und sicheren Online-Casino sind, ist das Zet Casino auf jeden Fall einen Blick wert.
https://zetcasino.one/
Auf Tipico Casino können Spieler eine Vielzahl von spannenden und unterhaltsamen Casino-Spielen genießen. Das Online-Casino bietet eine große Auswahl an Slots, Tischspielen und Live-Casino-Spielen, die für jeden Geschmack und jedes Budget geeignet sind.
Ein großer Vorteil von Tipico Casino ist die Benutzerfreundlichkeit der Webseite und die einfache Navigation. Spieler können schnell und unkompliziert ihr Lieblingsspiel finden und mit nur wenigen Klicks spielen. Zudem bietet das Casino eine Vielzahl von sicheren und schnellen Zahlungsmethoden, so dass Spieler bequem und sicher Geld einzahlen und abheben können.
Ein weiterer Pluspunkt von Tipico Casino sind die regelmäßig stattfindenden Aktionen und Bonusangebote. Spieler können von attraktiven Willkommensboni, Freispielen und Cashback-Angeboten profitieren, die ihr Spielerlebnis noch spannender und lukrativer machen.
Zudem überzeugt Tipico Casino durch einen zuverlässigen Kundenservice, der rund um die Uhr erreichbar ist und bei Fragen und Problemen kompetent und freundlich zur Seite steht.
Insgesamt bietet Tipico Casino ein erstklassiges Spielerlebnis mit einer groГџen Auswahl an Spielen, attraktiven Bonusangeboten und einem hervorragenden Kundenservice. FГјr alle Casino-Fans ist Tipico Casino definitiv eine gute Wahl. Wer also Lust auf spannende Casino-Spiele hat, sollte unbedingt einmal auf Tipico Casino vorbeischauen und sein GlГјck versuchen.
https://tipicocasino.one/
Hello students and applicants!
Embark on a Journey of Discovery: Mathematical Economics and Data Analysis at https://satbayev.university/
Welcome to Satbayev University’s Mathematical Economics and Data Analysis program, where analytical rigor meets real-world applications. As we open admissions for the 2024 academic year, we invite you to become part of a community that values precision, analytical thinking, and data-driven decision-making.
Program Overview Our program is designed for those who aspire to delve into the complexities of economics and harness the power of data analysis. You will explore the mathematical underpinnings of economic theory, learn cutting-edge data analysis techniques, and apply your knowledge to solve pressing economic problems.
Admission Requirements
A strong foundation in mathematics and a keen interest in economics.
Proficiency in English, with the ability to engage in complex analytical discussions.
A bachelor’s degree in economics, mathematics, or a related field (for graduate programs).
Official transcripts, a statement of purpose, and two letters of recommendation.
Curriculum Highlights
Advanced courses in microeconomics, macroeconomics, and econometrics.
Training in statistical software and data analysis tools.
Opportunities for research and real-world data projects.
Electives that allow you to tailor your education to your career goals.
Career Prospects Graduates of our program are well-equipped for careers in:
Economic analysis and policy-making.
Data analytics and business intelligence.
Financial markets and risk management.
Research and academia.
Application Process Begin your journey by submitting an online application through our university portal. Ensure that all required documents are uploaded and that you meet the specified deadlines. Our admissions team is dedicated to a holistic review of each applicant, considering both academic achievements and potential for future success.
Join Us At Satbayev University, we’re not just educating the next generation of economists and data analysts; we’re shaping the future of decision-making in business and policy. Apply now and take the first step towards a fulfilling career at the intersection of mathematics, economics, and data analysis.
[url=https://satbayev.university/]University admission 2024[/url]
Early Decision
Software Engineering
Networks
Firewall
Good luck and good progress!
https://1winstavka.ru/
https://financenewsasia.com
Заказать купленный диплом, через интернет.
Доступные цены на дипломы для продажи, подробности здесь.
Купить диплом с гарантией качества, важная информация.
Почему выгодно купить диплом, рассказываем.
Как купить диплом безопасно, с гарантией.
Лучшие предложения по покупке диплома, интересные варианты.
Как купить диплом быстро, лучшие условия.
Скрытая покупка дипломов, проверенные решения.
Как быстро купить диплом, подробности на сайте.
Покупка диплома: безопасность и качество, лучшие условия.
Почему стоит купить диплом у нас, гарантированное качество.
Безопасное приобретение документов об образовании, подробности на сайте.
Купить диплом без обмана, подробности у нас.
Как выбрать и купить диплом, важные моменты.
Как купить дипломы онлайн, гарантированная доставка.
Купить дипломы легко, гарантированный результат.
Купить диплом с доставкой по всему миру, лучшие условия.
Как купить диплом безопасно и быстро, подробности у нас.
купить диплом [url=http://www.7arusak-diploms.com]http://www.7arusak-diploms.com[/url] .
Заказать купленный диплом, через интернет.
Легальный способ купить диплом, узнайте сейчас.
Купить диплом с гарантией качества, важная информация.
Почему выгодно купить диплом, рассказываем.
Как купить диплом безопасно, без риска.
Как выбрать диплом для покупки, секреты выбора.
Дипломы на заказ по лучшим ценам, подробности на сайте.
Покупка диплома: безопасность и конфиденциальность, важная информация.
Где купить действующий диплом, срочно и выгодно.
Купить диплом срочно и законно, лучшие условия.
Официальные документы для покупки, гарантированное качество.
Безопасное приобретение документов об образовании, лучшие условия.
Официальные дипломы для покупки, подробности у нас.
Купить диплом просто, лучшие предложения.
Легальная покупка дипломов безопасно, гарантированная доставка.
Какой диплом выбрать для покупки, интересные варианты.
Заказать диплом онлайн без проблем, подробности здесь.
Почему стоит заказать диплом на нашем сайте, подробности у нас.
купить диплом [url=http://www.7arusak-diploms.com/]http://www.7arusak-diploms.com/[/url] .
Boomerang Casino Auszahlung Erfahrung
Boomerang Casino ist eine Online-GlГјcksspielplattform, die Spielern eine Vielzahl von Spielen anbietet, darunter Spielautomaten, Tischspiele und Live-Dealer-Spiele. Eine wichtige Komponente fГјr Spieler ist jedoch die Auszahlungserfahrung, also wie effizient und problemlos die Auszahlungen abgewickelt werden.
Die Auszahlungserfahrung bei Boomerang Casino kann als positiv bewertet werden. Die meisten Spieler geben an, dass Auszahlungen schnell und zuverlässig bearbeitet werden. Die Plattform bietet verschiedene Zahlungsmethoden an, darunter Kreditkarten, E-Wallets und Banküberweisungen, um sicherzustellen, dass Spieler ihr Geld schnell und einfach abheben können.
Ein weiterer positiver Aspekt der Auszahlungserfahrung bei Boomerang Casino ist der Kundensupport. Spieler können sich bei Fragen oder Problemen jederzeit an den Kundendienst des Casinos wenden und erhalten in der Regel eine schnelle und hilfreiche Antwort.
Natürlich kann es auch vereinzelt negative Erfahrungen geben, wie zum Beispiel Verzögerungen bei der Auszahlung oder technische Probleme. Es ist jedoch wichtig zu beachten, dass dies oft individuelle Probleme sind und nicht die Regel darstellen.
Insgesamt lässt sich sagen, dass die Auszahlungserfahrung bei Boomerang Casino größtenteils positiv ist. Spieler können sich darauf verlassen, dass ihre Gewinne schnell und sicher ausgezahlt werden, und genießen so ein reibungsloses Spielerlebnis.
https://boomerangcasino.one/
В современном мире, где диплом становится началом отличной карьеры в любой сфере, многие пытаются найти максимально быстрый и простой путь получения качественного образования. Факт наличия официального документа переоценить невозможно. Ведь диплом открывает дверь перед любым человеком, желающим вступить в сообщество профессиональных специалистов или продолжить обучение в каком-либо университете.
В данном контексте мы предлагаем оперативно получить этот необходимый документ. Вы можете приобрести диплом, что будет удачным решением для человека, который не смог закончить обучение, потерял документ или желает исправить плохие оценки. Каждый диплом изготавливается с особой тщательностью, вниманием к мельчайшим нюансам, чтобы в результате получился 100% оригинальный документ.
Плюсы подобного подхода заключаются не только в том, что вы максимально быстро получите диплом. Весь процесс организован просто и легко, с профессиональной поддержкой. От выбора нужного образца документа до консультации по заполнению персональных данных и доставки по стране — все находится под полным контролем квалифицированных мастеров.
Всем, кто ищет максимально быстрый способ получения необходимого документа, наша компания может предложить выгодное решение. Заказать диплом – значит избежать долгого обучения и сразу переходить к важным целям, будь то поступление в ВУЗ или старт карьеры.
http://wish-club.ru/forums/index.php?showtopic=6512
дробеструйная машина по бетону [url=http://www.drobestruynaya-kamera.ru]http://www.drobestruynaya-kamera.ru[/url] .
I urge you to avoid this platform. My own encounter with it has been purely frustration and suspicion of scamming practices. Be extremely cautious, or alternatively, seek out an honest service for your needs.
Zet Casino Promo Code 2022
Zet Casino ist eine beliebte Online-Glücksspielseite, die eine Vielzahl von Spielen und Aktionen für ihre Spieler anbietet. Eines der besten Angebote, das Zet Casino seinen Kunden bietet, sind die Promo-Codes, die ihnen ermöglichen, zusätzliche Boni und Belohnungen zu erhalten.
Im Jahr 2022 gibt es eine Vielzahl von Promo-Codes für Zet Casino, die es Spielern ermöglichen, ihr Spielerlebnis zu verbessern und zusätzliche Vorteile zu genießen. Diese Promo-Codes können für eine Vielzahl von Spielen verwendet werden, darunter Spielautomaten, Tischspiele und Live-Casino-Spiele.
Einer der beliebtesten Promo-Codes fГјr Zet Casino im Jahr 2022 ist der Code “ZETBONUS”, der neuen Spielern einen groГџzГјgigen Willkommensbonus bietet. Dieser Bonus kann fГјr eine Vielzahl von Spielen verwendet werden und hilft neuen Spielern, ihr Spielerlebnis zu verbessern.
Darüber hinaus bietet Zet Casino regelmäßig neue Promo-Codes für bestehende Spieler an, die ihnen zusätzliche Belohnungen und Boni bieten. Diese Promo-Codes können für spezielle Aktionen, Turniere und Wettbewerbe verwendet werden und ermöglichen es den Spielern, noch mehr aus ihrem Spielerlebnis herauszuholen.
Insgesamt sind Promo-Codes eine großartige Möglichkeit für Spieler, zusätzliche Boni und Belohnungen zu erhalten und ihr Spielerlebnis bei Zet Casino zu verbessern. Wenn Sie also auf der Suche nach einem erstklassigen Online-Casino-Erlebnis sind, sollten Sie auf jeden Fall die Promo-Codes von Zet Casino nutzen. Viel Glück beim Spielen!
https://zetcasino.one/
Tipico Casino geht nicht – Was tun?
Immer wieder kommt es vor, dass Spieler auf das Tipico Casino zugreifen möchten, aber die Seite nicht funktioniert. Dies kann verschiedene Gründe haben und ist äußerst ärgerlich für die betroffenen Nutzer. Doch was kann man tun, wenn das Tipico Casino nicht funktioniert?
Zunächst einmal sollte man überprüfen, ob das Problem an der eigenen Internetverbindung liegt. Oftmals können Verbindungsprobleme oder eine schlechte Internetverbindung dazu führen, dass die Seite nicht geladen werden kann. In diesem Fall sollte man sicherstellen, dass man eine stabile Verbindung hat und gegebenenfalls den Router neu starten.
Wenn das Problem weiterhin besteht, könnte es sein, dass die Seite aufgrund von Wartungsarbeiten oder technischen Problemen vorübergehend nicht erreichbar ist. In diesem Fall ist es ratsam, einfach etwas Geduld zu haben und es zu einem späteren Zeitpunkt erneut zu versuchen.
Sollte das Tipico Casino jedoch auch nach einiger Zeit immer noch nicht funktionieren, empfiehlt es sich, den Kundenservice des Unternehmens zu kontaktieren. Die Mitarbeiter können in der Regel weiterhelfen und das Problem schnell lösen.
Zusammenfassend lГ¤sst sich sagen, dass es verschiedene GrГјnde geben kann, warum das Tipico Casino nicht funktioniert. Mit einigen einfachen MaГџnahmen wie der ГњberprГјfung der Internetverbindung oder dem Kontakt zum Kundenservice kann das Problem jedoch oft schnell behoben werden. Also keine Panik, wenn das Tipico Casino einmal nicht funktioniert – es gibt in der Regel eine LГ¶sung!
https://tipicocasino.one/
Приобрести диплом без лишних хлопот, онлайн.
Доступные цены на дипломы для продажи, узнайте сейчас.
Купить диплом с гарантией качества, проверенные варианты.
Почему выгодно купить диплом, все секреты.
Где купить диплом без проблем, на проверенных ресурсах.
Как выбрать диплом для покупки, интересные варианты.
Купить диплом срочно и недорого, лучшие условия.
Скрытая покупка дипломов, наши преимущества.
Где купить действующий диплом, подробности на сайте.
Покупка диплома: безопасность и качество, подробности у нас.
Почему стоит купить диплом у нас, срочные варианты.
Как купить диплом срочно, без рисков.
Официальные дипломы для покупки, важные детали.
Дипломы на всех условиях, подробности на сайте.
Легальная покупка дипломов безопасно, гарантированная доставка.
Какой диплом выбрать для покупки, интересные варианты.
Купить диплом с доставкой по всему миру, важные детали.
Как купить диплом безопасно и быстро, гарантированный результат.
купить диплом [url=https://7arusak-diploms.com]https://7arusak-diploms.com[/url] .
[url=https://i.megas.sbs/]мега сб сайт[/url] – mega sb как зайти на сайт, m3ga darknet
[url=https://kraken12.co.at]kraken зеркало[/url] – kraken, kraken зеркало
В наше время, когда диплом является началом отличной карьеры в любой области, многие ищут максимально быстрый путь получения качественного образования. Необходимость наличия документа об образовании трудно переоценить. Ведь диплом открывает двери перед каждым человеком, желающим начать трудовую деятельность или учиться в высшем учебном заведении.
В данном контексте мы предлагаем очень быстро получить этот важный документ. Вы сможете приобрести диплом, и это является удачным решением для всех, кто не смог закончить обучение, утратил документ или желает исправить свои оценки. Каждый диплом изготавливается аккуратно, с особым вниманием ко всем деталям, чтобы в результате получился полностью оригинальный документ.
Преимущество такого решения заключается не только в том, что можно максимально быстро получить свой диплом. Процесс организован удобно и легко, с нашей поддержкой. Начав от выбора нужного образца до консультации по заполнению персональных данных и доставки в любой регион страны — все под абсолютным контролем опытных мастеров.
Всем, кто ищет максимально быстрый способ получения требуемого документа, наша компания предлагает отличное решение. Заказать диплом – значит избежать длительного обучения и не теряя времени переходить к достижению собственных целей, будь то поступление в университет или старт карьеры.
http://forum.kam.su/showthread.php?p=157290
[url=https://12.kraken.gl]kraken[/url] – как зайти на КРАКЕН, КРАКЕН как зайти
Boomerang Casino bietet eine Vielzahl von Spielen und Aktionen, die Spieler begeistern. Mit einer groГџen Auswahl an Slots, Tischspielen und Live-Casino-Spielen gibt es fГјr jeden Geschmack etwas zu entdecken.
Die Webseite ist benutzerfreundlich gestaltet und ermöglicht es den Spielern, schnell und einfach durch die verschiedenen Kategorien zu navigieren. Die Spiele werden von renommierten Anbietern wie NetEnt, Microgaming und Evolution Gaming bereitgestellt, was für Qualität und Vielfalt steht.
Ein besonderes Highlight bei Boomerang Casino ist das Live-Casino, das eine authentische Casino-Erfahrung bietet. Hier können Spieler gegen echte Dealer antreten und in Echtzeit mit anderen Spielern interagieren.
DarГјber hinaus bietet Boomerang Casino groГџzГјgige Boni und Aktionen fГјr neue und bestehende Spieler. Mit Willkommensboni, Freispielen und Cashback-Angeboten ist fГјr jeden etwas dabei.
Die Zahlungsmethoden sind vielfältig und sicher, was es einfach und bequem macht, Ein- und Auszahlungen vorzunehmen. Der Kundenservice ist rund um die Uhr per Live-Chat, E-Mail oder Telefon erreichbar und steht den Spielern bei Fragen und Problemen zur Verfügung.
Insgesamt ist Boomerang Casino eine empfehlenswerte Online-Spielhalle, die mit ihrer großen Auswahl an Spielen, attraktiven Boni und zuverlässigem Kundenservice überzeugt. Wer auf der Suche nach einem unterhaltsamen und sicheren Online-Casino ist, sollte Boomerang Casino definitiv eine Chance geben.
https://boomerangcasino.one/
palabraptu
1вин казино
investnews24.net
Found captivating reading that I’d like to offer you – you won’t regret it http://physmathforum.flybb.ru/viewtopic.php?f=12&t=662
[url=https://i.megas.sbs/]mega onion[/url] – mega sb как зайти на сайт, http mega
[url=https://redirect.m3ga.as]m3ga точка gl[/url] – mega555 зеркало рабочее, mega555net рабочее
I strongly recommend to avoid this platform. The experience I had with it has been purely dismay as well as concerns regarding deceptive behavior. Proceed with extreme caution, or even better, find a more reputable site to meet your needs.
124969D742
click here for more [url=https://atomic-wallet.fr]atomic wallet[/url]
cululutata
Im Zet Casino erwarten die Spieler großzügige Boni und lukrative Aktionen. Unter anderem können Neukunden von einem attraktiven Willkommensangebot profitieren, das bis zu 500 Euro Bonusguthaben sowie 200 Freispiele beinhaltet.
Besonders interessant sind hierbei die sogenannten Zet Casino 30 Freispiele, die den Spielern die Möglichkeit bieten, kostenlos erste Gewinne einzustreichen. Diese Freispiele können in ausgewählten Spielen eingesetzt werden und sorgen somit für zusätzlichen Spielspaß und Spannung.
Um von den Zet Casino 30 Freispielen zu profitieren, müssen Spieler lediglich ein Konto im Casino erstellen und eine Einzahlung tätigen. Anschließend stehen die Freispiele zur Verfügung und können sofort genutzt werden.
Die Freispiele sind eine tolle Gelegenheit, um neue Spiele auszuprobieren und erste Gewinne zu erzielen, ohne dabei eigenes Geld einsetzen zu müssen. Zudem bieten sie die Chance, das Casino und seine Spiele näher kennenzulernen, bevor man tiefer in die Welt des Glücksspiels eintaucht.
Alles in allem sind die Zet Casino 30 Freispiele eine attraktive Bonusaktion für alle Spieler, die sich auf der Suche nach einem spannenden und unterhaltsamen Casinoerlebnis befinden. Wer also sein Glück versuchen und dabei von lukrativen Freispielen profitieren möchte, sollte sich das Zet Casino genauer anschauen.
https://zetcasino.one/
blabla
Um Geld von Ihrem Tipico Casino auf Ihr Wettkonto zu transferieren, müssen Sie einige wichtige Schritte befolgen. Zunächst einmal ist es wichtig zu beachten, dass es sich hierbei um zwei separate Konten handelt, die nicht automatisch miteinander verbunden sind.
Um also Geld von Ihrem Casino-Konto auf Ihr Wettkonto zu übertragen, müssen Sie sich zunächst auf der Website von Tipico einloggen. Sobald Sie angemeldet sind, sollten Sie sich Ihr Casino-Konto ansehen und prüfen, ob genügend Guthaben vorhanden ist, um auf Ihr Wettkonto übertragen zu können.
Wenn Ihr Casino-Konto ausreichend gefüllt ist, können Sie den Transfer starten. Dazu navigieren Sie zu den Ein- und Auszahlungsoptionen auf der Website und wählen die Möglichkeit, Geld von Ihrem Casino-Konto auf Ihr Wettkonto zu übertragen. Hierbei müssen Sie den gewünschten Betrag eingeben und den Transfer bestätigen.
Es ist wichtig zu beachten, dass einige Konditionen und Mindestbeträge für Transfers zwischen den Konten gelten können. Daher sollten Sie sich vorab über die genauen Bedingungen informieren, um sicherzustellen, dass der Transfer reibungslos verläuft.
Nachdem der Transfer abgeschlossen ist, wird das Geld in der Regel innerhalb weniger Minuten auf Ihr Wettkonto übertragen und Sie können sofort mit dem Platzieren von Wetten beginnen.
Insgesamt ist es also relativ unkompliziert, Geld von Ihrem Tipico Casino auf Ihr Wettkonto zu transferieren. Indem Sie die oben genannten Schritte befolgen und sich über die jeweiligen Konditionen informieren, können Sie sicherstellen, dass der Transfer problemlos verläuft und Sie Ihr Guthaben schnell für Wetten verwenden können.
https://tipicocasino.one/
[url=https://xn--90ascrfejh9f.org/]https blacksprut[/url] – блэкспрут ссылка тор, blacksprut ссылка
Доброго!
Следите за новостями Кропивницкого вместе с нами! Мы предлагаем оперативные репортажи, глубокий анализ и эксклюзивные интервью. Узнайте о последних событиях в городе и будьте первыми, кто узнает о важных новостях и изменениях.
Все самое лучшее на сайте https://bomba.kr.ua/news-ukraine/
[url=https://bomba.kr.ua/]Новости Кропивницкого ДТП[/url]
Новости Кропивницкого видео
новости Украины
Новости Кропивницкого фото
Удачи!
Для достижения новых профессиональных высот и уверенного начала карьеры, выбор качественного образовательного документа становится определяющим. На нашем сайте вы можете [url=https://kupi-diploms.ru/]купить дипломы колледжа[/url], которые открывают широкие возможности для трудоустройства и продолжения обучения. Также мы предлагаем услугу [url=https://kupi-diploms.ru/]куплю диплом аттестат[/url], что позволяет вам обеспечить себе необходимый документ для доступа к высшему образованию или началу работы. Воспользуйтесь нашими услугами, чтобы ваше будущее было успешным и стабильным.
Сегодня, когда диплом – это начало отличной карьеры в любой сфере, многие пытаются найти максимально простой путь получения образования. Факт наличия документа об образовании трудно переоценить. Ведь именно он открывает дверь перед людьми, желающими начать профессиональную деятельность или продолжить обучение в университете.
В данном контексте наша компания предлагает оперативно получить этот необходимый документ. Вы сможете заказать диплом старого или нового образца, и это становится выгодным решением для всех, кто не смог закончить обучение, потерял документ или желает исправить плохие оценки. Все дипломы изготавливаются с особой аккуратностью, вниманием к мельчайшим нюансам. В итоге вы получите продукт, максимально соответствующий оригиналу.
Превосходство такого подхода состоит не только в том, что вы сможете максимально быстро получить диплом. Весь процесс организован удобно и легко, с нашей поддержкой. От выбора необходимого образца диплома до консультаций по заполнению персональных данных и доставки по России — все под полным контролем опытных мастеров.
Для всех, кто пытается найти максимально быстрый способ получить требуемый документ, наша компания готова предложить отличное решение. Заказать диплом – это значит избежать продолжительного обучения и сразу перейти к достижению личных целей: к поступлению в университет или к началу удачной карьеры.
http://www.diablomania.ru/forum/showthread.php?p=557331
Zet Casino Bonus Bedingungen
Zet Casino ist ein beliebtes Online-Casino, das eine Vielzahl von Spielen und attraktiven Bonusangeboten bietet. Die Bonusbedingungen sind jedoch ein wichtiger Aspekt, den Spieler beachten sollten, um das Beste aus ihrem Bonus zu machen.
Zet Casino bietet verschiedene Arten von Boni, darunter Willkommensboni, Einzahlungsboni, Freispiele und Cashback-Angebote. Jeder Bonus hat seine eigenen Bedingungen, die erfüllt werden müssen, um das Bonusguthaben oder die Gewinne aus Freispielen auszahlen zu können.
Die wichtigsten Bonusbedingungen bei Zet Casino umfassen Umsatzanforderungen, Zeitlimits, Spielbeschränkungen und maximale Einsätze. Beispielsweise müssen Spieler den Bonusbetrag eine bestimmte Anzahl von Malen umsetzen, bevor sie eine Auszahlung beantragen können. Das Zeitlimit gibt an, wie lange Spieler haben, um die Umsatzanforderungen zu erfüllen. Spielbeschränkungen legen fest, welche Spiele für den Einsatz des Bonusguthabens in Frage kommen, und maximale Einsätze bestimmen, wie viel ein Spieler pro Runde setzen darf.
Es ist wichtig, die Bonusbedingungen sorgfältig zu lesen und zu verstehen, um Missverständnisse zu vermeiden und sicherzustellen, dass man das Beste aus seinem Bonus macht. Spieler sollten auch beachten, dass bei Verstoß gegen die Bonusbedingungen ihr Bonusguthaben und die damit erzielten Gewinne storniert werden können.
Insgesamt bietet Zet Casino seinen Spielern großzügige Bonusangebote, die sowohl Neulinge als auch erfahrene Spieler ansprechen. Indem man die Bonusbedingungen erfüllt, kann man sein Spielerlebnis maximieren und die Chance auf Gewinne erhöhen.
https://zetcasino.one/
Ищете профессиональный [url=https://gaggenau-remonty.ru/]ремонт холодильников Gaggenau[/url]? Наши мастера оперативно устранят любую неисправность и предоставят гарантию на выполненные работы. Заявки принимаются круглосуточно.
In der Welt des Online-Glücksspiels gibt es immer wieder Probleme, die Spieler frustrieren und verwirren können. Eines dieser Probleme betrifft die Blockierung von Beiträgen für das Casino bei Tipico. Dies kann für Spieler sehr ärgerlich sein, da sie möglicherweise nicht in der Lage sind, ihre Lieblingsspiele zu spielen oder ihr Geld zu setzen.
Die Gründe für die Blockierung eines Beitrags können vielfältig sein. Oftmals handelt es sich um Sicherheitsmaßnahmen, die von der Glücksspielplattform ergriffen werden, um Betrug und Missbrauch zu verhindern. In einigen Fällen kann es jedoch auch zu Fehlern kommen, die dazu führen, dass ein Beitrag fälschlicherweise blockiert wird.
Wenn Sie feststellen, dass Ihr Beitrag für das Casino bei Tipico blockiert ist, gibt es einige Schritte, die Sie unternehmen können. Zunächst sollten Sie den Kundendienst kontaktieren und das Problem schildern. Sie können Ihnen möglicherweise weiterhelfen und die Blockierung aufheben.
Es ist auch wichtig, sicherzustellen, dass Sie die Nutzungsbedingungen von Tipico einhalten, um eine Blockierung zu vermeiden. Dies umfasst die Einhaltung der Altersgrenzen, das Vermeiden von betrГјgerischem Verhalten und die Verwendung korrekter Zahlungsmethoden.
Insgesamt ist es wichtig, geduldig zu bleiben und mit dem Kundendienst zusammenzuarbeiten, um das Problem zu lösen. Mit etwas Glück können Sie bald wieder Ihre Lieblingsspiele im Casino bei Tipico genießen.
https://tipicocasino.one/
https://zamkiexpress.ru/
Перепланировка помещения — это процесс, который требует тщательной подготовки и соблюдения всех строительных норм. Компания “КитСтрой” предоставляет комплексные услуги по перепланировке помещений в Москве. Наши специалисты разрабатывают индивидуальные проекты, учитывая все особенности помещения и пожелания заказчика. Мы выполняем все этапы работ: от замеров и проектирования до согласования и выполнения строительных работ. Наши клиенты могут быть уверены в высоком качестве и надежности всех выполняемых работ.
[url=https://potolki-kitstroy.ru/]Перепланировка помещения[/url] с “КитСтрой” — это гарантия профессионального подхода и качественного результата. Мы обеспечиваем соблюдение всех строительных норм и требований, что позволяет избежать проблем в будущем. Обратитесь к нам, и мы поможем вам создать комфортное и функциональное пространство.
world-news-365.com
https://tzona.org
Познайте малые средневековые города Калининградской области с нашими индивидуальными турами. Наши гиды в Калининграде на машине откроют перед вами уникальные архитектурные шедевры и исторические улицы этих живописных мест. https://mykaliningradgid.ru/
Zet Casino Free Spins: Nutzen Sie Ihre Chance, um groГџe Gewinne zu erzielen!
Wer träumt nicht davon, in einem Online-Casino groß abzuräumen? Mit den Zet Casino Free Spins haben Spieler die Möglichkeit, genau das zu tun. Diese beliebten Bonusangebote bieten Spielern die Chance, kostenlos an ausgewählten Spielautomaten zu drehen und dabei echtes Geld zu gewinnen.
Die Free Spins im Zet Casino werden den Spielern in verschiedenen Situationen angeboten. Zum Beispiel als Teil eines Willkommensbonus für neue Spieler, als Belohnung für treue Kunden oder als Sonderaktionen zu bestimmten Feiertagen oder Events. Diese kostenlosen Spins können auf viele verschiedene Spielautomaten angewendet werden und bieten den Spielern die Möglichkeit, neue Spiele auszuprobieren oder ihre Lieblingsspiele weiter zu genießen.
Um die Zet Casino Free Spins zu erhalten, müssen Spieler oft nur eine bestimmte Einzahlung tätigen oder sich für die Aktion anmelden. Sobald die Freispiele gutgeschrieben wurden, können die Spieler sofort damit beginnen, an den Spielautomaten zu drehen und hoffentlich große Gewinne zu erzielen.
Es ist wichtig zu beachten, dass die meisten Free Spins Boni bestimmte Umsatzbedingungen haben, die erfüllt werden müssen, bevor die Gewinne ausgezahlt werden können. Diese Bedingungen können in der Regel im Kleingedruckten der jeweiligen Aktion gefunden werden und sollten sorgfältig gelesen werden, um Missverständnisse zu vermeiden.
Insgesamt sind die Zet Casino Free Spins eine fantastische Möglichkeit für Spieler, zusätzliche Gewinne zu erzielen, ohne dabei ihr eigenes Geld riskieren zu müssen. Durch die Teilnahme an diesen Aktionen können Spieler ihre Lieblingsspiele spielen, neue Spiele entdecken und mit etwas Glück ordentliche Gewinne mit nach Hause nehmen. Nutzen Sie also Ihre Chance und drehen Sie die Walzen mit den Zet Casino Free Spins!
https://zetcasino.one/
In Deutschland gibt es viele Online-Casinos, die um die Gunst der Spieler buhlen. Ein Casino, das in letzter Zeit besonders viel Aufmerksamkeit erregt hat, ist das Boomerang Casino. Das Boomerang Casino ist bekannt fГјr sein breites Angebot an Spielen und groГџzГјgige Boni fГјr neue Spieler. Doch was viele nicht wissen, ist dass das Boomerang Casino eine offizielle GlГјcksspiellizenz besitzt.
Die Lizenz des Boomerang Casinos wurde von der Malta Gaming Authority ausgestellt, einer renommierten Glücksspielbehörde, die weltweit für ihre strengen Regulierungen bekannt ist. Die maltesische Lizenz garantiert den Spielern, dass das Boomerang Casino fair und transparent arbeitet und dass ihre persönlichen und finanziellen Daten sicher aufbewahrt werden.
Die Lizenz des Boomerang Casinos ist ein wichtiger Faktor, der das Vertrauen der Spieler in das Casino stärkt. Spieler können beruhigt sein, dass sie in einem seriösen und gut regulierten Casino spielen, das sicherstellt, dass alle Spiele fair und zufällig ablaufen.
Das Boomerang Casino hat sich durch seine Lizenzierung als vertrauenswürdiges und sicheres Online-Casino etabliert. Spieler können sich darauf verlassen, dass sie in einem sicheren und geschützten Umfeld spielen, in dem ihre Rechte und Interessen geschützt sind.
https://boomerangcasino.one/
В нашем мире, где диплом – это начало отличной карьеры в любой сфере, многие ищут максимально быстрый и простой путь получения образования. Наличие документа об образовании сложно переоценить. Ведь именно диплом открывает дверь перед людьми, стремящимися вступить в профессиональное сообщество или продолжить обучение в высшем учебном заведении.
В данном контексте наша компания предлагает максимально быстро получить этот важный документ. Вы можете приобрести диплом, что является выгодным решением для человека, который не смог завершить образование или потерял документ. дипломы производятся аккуратно, с максимальным вниманием ко всем деталям. В результате вы получите документ, полностью соответствующий оригиналу.
Плюсы этого подхода заключаются не только в том, что можно быстро получить диплом. Процесс организовывается просто и легко, с профессиональной поддержкой. От выбора нужного образца диплома до консультаций по заполнению личных данных и доставки по стране — все под абсолютным контролем квалифицированных мастеров.
Для тех, кто ищет быстрый и простой способ получения требуемого документа, наша компания предлагает отличное решение. Приобрести диплом – это значит избежать продолжительного обучения и сразу перейти к своим целям: к поступлению в ВУЗ или к началу трудовой карьеры.
https://vulf.1bb.ru/viewtopic.php?id=289
Заказать купленный диплом, не выходя из дома.
Легальный способ купить диплом, подробности здесь.
Какой диплом купить, важная информация.
Почему выгодно купить диплом, подробности.
Как купить диплом безопасно, с гарантией.
Как выбрать диплом для покупки, секреты выбора.
Как купить диплом быстро, спешите.
Почему стоит купить диплом, важная информация.
Как быстро купить диплом, срочно и выгодно.
Покупка диплома: безопасность и качество, подробности у нас.
Как выбрать диплом, срочные варианты.
Как купить диплом срочно, без рисков.
Купить диплом без обмана, важные детали.
Купить диплом просто, подробности на сайте.
Как купить дипломы онлайн, безопасность на первом месте.
Почему стоит купить диплом здесь и сейчас, гарантированный результат.
Официальная покупка диплома, важные детали.
Почему стоит заказать диплом на нашем сайте, гарантированный результат.
купить диплом [url=https://7arusak-diploms.com]https://7arusak-diploms.com[/url] .
В современном мире, где диплом – это начало отличной карьеры в любой области, многие пытаются найти максимально быстрый путь получения качественного образования. Наличие документа об образовании трудно переоценить. Ведь именно диплом открывает двери перед любым человеком, желающим начать трудовую деятельность или учиться в ВУЗе.
В данном контексте мы предлагаем очень быстро получить этот важный документ. Вы сможете купить диплом, и это является удачным решением для всех, кто не смог закончить обучение, утратил документ или желает исправить плохие оценки. дипломы изготавливаются с особой тщательностью, вниманием ко всем элементам. В итоге вы получите 100% оригинальный документ.
Превосходство данного подхода состоит не только в том, что вы сможете оперативно получить диплом. Весь процесс организовывается комфортно, с профессиональной поддержкой. От выбора подходящего образца диплома до консультаций по заполнению персональной информации и доставки по стране — все будет находиться под абсолютным контролем наших специалистов.
Для всех, кто пытается найти быстрый и простой способ получить необходимый документ, наша компания предлагает отличное решение. Купить диплом – это значит избежать продолжительного обучения и не теряя времени переходить к достижению собственных целей, будь то поступление в университет или старт успешной карьеры.
http://www.diploman-russiyans.ru
The post added a new layer to my understanding of the subject. Thanks for sharing The knowledge.
Das Zet Casino ist ein beliebtes Online-Casino, das eine Vielzahl von spannenden Spielen und aufregenden Aktionen für seine Spieler bietet. Eines der Highlights des Zet Casinos ist der No Deposit Bonus Code, der den Spielern die Möglichkeit bietet, ohne Einzahlung zu spielen und trotzdem echtes Geld zu gewinnen.
Der No Deposit Bonus Code für das Jahr 2021 bietet den Spielern eine großzügige Bonussumme, die sie nutzen können, um verschiedene Spiele im Casino auszuprobieren und ihr Glück zu testen. Dieser Bonus Code ist eine großartige Möglichkeit für neue Spieler, das Zet Casino kennenzulernen, ohne dabei ihr eigenes Geld riskieren zu müssen.
Um den No Deposit Bonus Code zu erhalten, müssen die Spieler lediglich ein Konto beim Zet Casino erstellen und den entsprechenden Bonus Code eingeben. Nachdem der Code eingegeben wurde, wird der Bonus automatisch gutgeschrieben und die Spieler können sofort mit dem Spielen beginnen.
Es ist wichtig zu beachten, dass der No Deposit Bonus Code bestimmten Umsatzbedingungen unterliegt, die erfüllt werden müssen, bevor die Gewinne aus dem Bonus ausgezahlt werden können. Die genauen Bedingungen können auf der Website des Zet Casinos eingesehen werden.
Insgesamt ist der No Deposit Bonus Code 2021 eine großartige Möglichkeit für Spieler, das Zet Casino kennenzulernen und ihre Lieblingsspiele zu genießen, ohne dabei ihr eigenes Geld zu riskieren. Wir empfehlen daher allen Casino-Liebhabern, sich diesen Bonus nicht entgehen zu lassen und das Zet Casino noch heute auszuprobieren. Viel Glück und viel Spaß beim Spielen!
https://zetcasino.one/
Boomerang.bet Casino Review
Boomerang.bet is an online casino that has been making waves in the world of online gambling. With a wide range of games, generous bonuses, and a user-friendly interface, Boomerang.bet has quickly become a popular choice for many players.
One of the standout features of Boomerang.bet is its game selection. The casino offers a wide variety of games, including slots, table games, and live dealer games. Whether you’re a fan of classic slots or prefer the thrill of live roulette, Boomerang.bet has something for everyone.
In addition to its impressive game selection, Boomerang.bet also offers generous bonuses and promotions. New players can take advantage of a welcome bonus, while existing players can enjoy regular promotions and loyalty rewards. With so many ways to boost your bankroll, playing at Boomerang.bet can be a lucrative experience.
Another highlight of Boomerang.bet is its user-friendly interface. The casino is easy to navigate, making it simple for even beginners to find their favorite games. Plus, with reliable customer support available 24/7, players can rest assured that help is always just a click away.
Overall, Boomerang.bet is a top-notch online casino that offers a fantastic gaming experience. With its wide range of games, generous bonuses, and user-friendly interface, Boomerang.bet is definitely worth checking out for any online gambling enthusiast. Give it a try today and see for yourself why so many players are choosing Boomerang.bet for their online gaming needs.
https://boomerangcasino.one/
В современном мире, где диплом становится началом отличной карьеры в любой области, многие ищут максимально простой путь получения качественного образования. Наличие документа об образовании трудно переоценить. Ведь именно он открывает дверь перед любым человеком, желающим вступить в сообщество профессиональных специалистов или продолжить обучение в ВУЗе.
В данном контексте мы предлагаем очень быстро получить этот необходимый документ. Вы имеете возможность приобрести диплом, и это будет удачным решением для человека, который не смог закончить обучение или утратил документ. диплом изготавливается с особой тщательностью, вниманием ко всем элементам, чтобы в итоге получился документ, полностью соответствующий оригиналу.
Превосходство подобного решения заключается не только в том, что можно оперативно получить свой диплом. Процесс организовывается просто и легко, с нашей поддержкой. Начиная от выбора необходимого образца диплома до точного заполнения личных данных и доставки в любое место страны — все находится под полным контролем квалифицированных специалистов.
Таким образом, всем, кто хочет найти быстрый и простой способ получить необходимый документ, наша услуга предлагает выгодное решение. Приобрести диплом – это значит избежать продолжительного процесса обучения и сразу перейти к своим целям, будь то поступление в ВУЗ или старт карьеры.
http://express-container.ru/
В нашем мире, где диплом становится началом удачной карьеры в любой области, многие стараются найти максимально быстрый и простой путь получения качественного образования. Наличие официального документа об образовании сложно переоценить. Ведь именно диплом открывает дверь перед каждым человеком, желающим вступить в сообщество профессиональных специалистов или продолжить обучение в ВУЗе.
Мы предлагаем оперативно получить этот важный документ. Вы имеете возможность заказать диплом, и это будет выгодным решением для человека, который не смог завершить образование, утратил документ или хочет исправить свои оценки. Все дипломы производятся с особой аккуратностью, вниманием к мельчайшим деталям. В результате вы сможете получить документ, максимально соответствующий оригиналу.
Плюсы этого решения заключаются не только в том, что вы сможете оперативно получить диплом. Процесс организовывается просто и легко, с нашей поддержкой. Начав от выбора необходимого образца до консультаций по заполнению персональной информации и доставки в любое место России — все будет находиться под полным контролем наших мастеров.
Всем, кто ищет быстрый и простой способ получить требуемый документ, наша услуга предлагает выгодное решение. Заказать диплом – это значит избежать продолжительного обучения и не теряя времени переходить к личным целям, будь то поступление в университет или начало профессиональной карьеры.
diploman-russia.ru
Приобрести диплом без лишних хлопот, через интернет.
Легальный способ купить диплом, без заморочек.
Какой диплом купить, важная информация.
Опыт успешной покупки диплома, рассказываем.
Купить диплом легко, без риска.
Купить диплом по выгодной цене, секреты выбора.
Как купить диплом быстро, спешите.
Покупка диплома: безопасность и конфиденциальность, наши преимущества.
Как быстро купить диплом, подробности на сайте.
Купить диплом срочно и законно, гарантированный результат.
Официальные документы для покупки, срочные варианты.
Безопасное приобретение документов об образовании, без рисков.
Почему стоит заказать диплом, важные детали.
Как выбрать и купить диплом, лучшие предложения.
Как купить дипломы онлайн, безопасность на первом месте.
Купить дипломы легко, гарантированный результат.
Официальная покупка диплома, важные детали.
Почему стоит заказать диплом на нашем сайте, подробности у нас.
купить диплом [url=https://7arusak-diploms.com/]https://7arusak-diploms.com/[/url] .
repair organizations
Приветики!
Приобретите российский диплом по выгодной цене с гарантией прохождения проверок и доставкой в любой город РФ!
Приобретите диплом института или колледжа с гарантией качества и доставкой по России без предоплаты.
https://diploman-russiyan.ru
Das Boomerang Casino Geld zurück Programm ist eine innovative und einzigartige Lösung für Spieler, die ihr Glück im Online Casino herausfordern. Mit diesem Programm haben Spieler die Möglichkeit, einen Teil ihrer Verluste wiederzuerlangen und somit ihre Gewinnchancen zu maximieren.
Das Konzept des Boomerang Casino Geld zurück Programms ist einfach: Spieler können sich anmelden und eine bestimmte Anzahl von Einsätzen tätigen. Wenn sie dabei Verluste erleiden, können sie einen Teil ihres verlorenen Geldes zurückerhalten. Dies bedeutet, dass Spieler die Möglichkeit haben, ihre Verluste zu minimieren und mehr Spaß beim Spielen zu haben.
Das Boomerang Casino Geld zurück Programm ist besonders attraktiv für Spieler, die gerne hohe Einsätze tätigen und risikoreiche Spiele bevorzugen. Durch die Möglichkeit, einen Teil ihres Geldes zurückzuerhalten, können sie ihre Verluste begrenzen und weiterhin am Spiel teilnehmen.
Um am Boomerang Casino Geld zurück Programm teilnehmen zu können, müssen Spieler bestimmte Anforderungen erfüllen und sich für das Programm anmelden. Sobald sie dies getan haben, können sie ihre Einsätze tätigen und auf ihr Glück hoffen.
Insgesamt ist das Boomerang Casino Geld zurück Programm eine großartige Möglichkeit für Spieler, ihre Gewinnchancen zu verbessern und gleichzeitig ihre Verluste zu minimieren. Es ist eine Win-Win-Situation für alle Beteiligten und bietet eine spannende und unterhaltsame Möglichkeit, im Online Casino zu spielen.
https://boomerangcasino.one/
Доброго всем дня!
Купите диплом ВУЗа с гарантированной доставкой в любой город России без предварительной оплаты и уверенностью в его легальности!
https://diplomanc-russia24.ru
В наше время, когда диплом – это начало успешной карьеры в любой сфере, многие стараются найти максимально простой путь получения качественного образования. Наличие документа об образовании переоценить невозможно. Ведь именно диплом открывает двери перед каждым человеком, желающим начать профессиональную деятельность или учиться в высшем учебном заведении.
Предлагаем максимально быстро получить любой необходимый документ. Вы можете купить диплом, что становится выгодным решением для человека, который не смог закончить обучение или потерял документ. Каждый диплом изготавливается аккуратно, с особым вниманием ко всем элементам, чтобы в итоге получился 100% оригинальный документ.
Плюсы данного решения заключаются не только в том, что вы сможете оперативно получить свой диплом. Процесс организовывается комфортно, с профессиональной поддержкой. От выбора подходящего образца диплома до консультаций по заполнению персональной информации и доставки по стране — все находится под абсолютным контролем наших мастеров.
В результате, для тех, кто ищет быстрый и простой способ получить требуемый документ, наша компания готова предложить выгодное решение. Купить диплом – значит избежать продолжительного процесса обучения и не теряя времени перейти к своим целям, будь то поступление в ВУЗ или начало трудовой карьеры.
https://clubhunters.ru/news/220-3-6-2013.html
Техническое заключение на перепланировку — это обязательный документ, подтверждающий безопасность и допустимость планируемых изменений. Компания “КитСтрой” предлагает услуги по подготовке технических заключений для перепланировок в Москве. Наши специалисты проведут все необходимые исследования и подготовят заключение, соответствующее всем строительным нормам и требованиям. Мы гарантируем точность и качество выполняемых работ.
[url=https://potolki-kitstroy.ru/]Техническое заключение на перепланировку[/url] с “КитСтрой” — это надежность и профессионализм. Доверьте нам решение этого важного вопроса, и мы обеспечим легализацию всех изменений в вашем помещении.
Эй! Твой холодильник нуждается в ремонте? Обращайся в наш [url=https://gaggenau-remonty.ru/]Гаггенау сервисный центр Москва[/url]. Мы сделаем все возможное, чтобы техника снова работала как новая!
Спортивные гири на girya-sportivnaya – это лучшие снаряды, используемые в силовых программах для улучшения силы и выносливости. Способствуют повышению жизненного тонуса. Имеют эргономичную ручку, позволяющую осуществлять тяги, свинги, толчки, скручивания и другие упражнения в гиревом спорте.
В создании надежных снарядов реализуется качественный состав чугуна.
Значительный каталог интернет-магазина изделий дает возможность получить удобные утяжелители для качественной программы тренировок.
Российский завод предлагает чугунные гири по адекватным ценам.
Das Boomerang Casino ist bekannt für seine großzügigen Bonusangebote und schnellen Auszahlungen. Wenn Sie bei diesem Online-Casino spielen und einen Gewinn erzielen, möchten Sie natürlich so schnell wie möglich Ihr Geld erhalten. Glücklicherweise ist die Auszahlung im Boomerang Casino ein einfacher und unkomplizierter Prozess.
Um eine Auszahlung im Boomerang Casino zu beantragen, müssen Sie sich zunächst in Ihr Konto einloggen und den Kassenbereich aufrufen. Dort finden Sie die Option zur Auszahlung, wo Sie den gewünschten Auszahlungsbetrag und die bevorzugte Zahlungsmethode angeben können. Das Boomerang Casino bietet verschiedene Zahlungsmethoden an, darunter Kreditkarten, E-Wallets und Banküberweisungen.
Sobald Sie den Auszahlungsantrag gestellt haben, wird Ihr Antrag vom Casino ГјberprГјft und bearbeitet. Die Bearbeitungszeit variiert je nach Zahlungsmethode, kann aber in der Regel innerhalb von 24 Stunden abgeschlossen werden. Nach Genehmigung Ihrer Auszahlung wird das Geld umgehend auf Ihr Konto Гјberwiesen.
Es ist wichtig zu beachten, dass das Boomerang Casino strenge Sicherheitsrichtlinien einhält und alle Auszahlungen nach den geltenden Vorschriften bearbeitet werden. Aus diesem Grund kann es gelegentlich zu Verzögerungen bei der Auszahlung kommen, wenn zusätzliche Überprüfungen erforderlich sind.
Insgesamt bietet das Boomerang Casino eine zuverlässige und schnelle Auszahlungsdienste an, die es den Spielern ermöglichen, ihre Gewinne schnell und einfach zu erhalten. Mit einer Vielzahl von Zahlungsmethoden und einem effizienten Auszahlungsprozess ist das Boomerang Casino eine ausgezeichnete Wahl für alle, die gerne online spielen und Wert auf eine schnelle Auszahlung legen.
https://boomerangcasino.one/
Found a captivating read that I’d like to recommend to you https://www.import-moto.com/users/88
Hi to every , since I am actually keen of reading this website’s post to be updated daily. It contains pleasant stuff.
https://diplomans-rossian.ru
Сегодня, когда диплом становится началом отличной карьеры в любом направлении, многие ищут максимально быстрый путь получения качественного образования. Важность наличия официального документа сложно переоценить. Ведь диплом открывает дверь перед людьми, стремящимися вступить в профессиональное сообщество или учиться в высшем учебном заведении.
Предлагаем максимально быстро получить этот необходимый документ. Вы сможете приобрести диплом, и это будет удачным решением для всех, кто не смог закончить обучение или потерял документ. Все дипломы выпускаются с особой тщательностью, вниманием ко всем элементам. В итоге вы получите полностью оригинальный документ.
Превосходство этого решения заключается не только в том, что вы сможете оперативно получить диплом. Весь процесс организован удобно, с нашей поддержкой. Начав от выбора требуемого образца до консультаций по заполнению персональных данных и доставки по России — все будет находиться под полным контролем опытных мастеров.
Для тех, кто пытается найти быстрый и простой способ получения требуемого документа, наша компания предлагает отличное решение. Купить диплом – значит избежать долгого обучения и не теряя времени переходить к важным целям: к поступлению в университет или к началу трудовой карьеры.
http://taixin.cn/bbs/?22776
Came across an interesting article, worth a glance http://ya3bbru.bbok.ru/viewtopic.php?id=3592#p6403
В нашем обществе, где диплом – это начало успешной карьеры в любой области, многие стараются найти максимально быстрый и простой путь получения образования. Факт наличия документа об образовании сложно переоценить. Ведь диплом открывает дверь перед людьми, желающими вступить в профессиональное сообщество или продолжить обучение в ВУЗе.
В данном контексте наша компания предлагает очень быстро получить этот важный документ. Вы имеете возможность купить диплом нового или старого образца, что становится удачным решением для человека, который не смог закончить образование, потерял документ или хочет исправить свои оценки. Все дипломы производятся аккуратно, с максимальным вниманием ко всем элементам. На выходе вы получите продукт, максимально соответствующий оригиналу.
Преимущество данного решения заключается не только в том, что можно быстро получить диплом. Весь процесс организован комфортно, с нашей поддержкой. Начиная от выбора подходящего образца до консультаций по заполнению личной информации и доставки в любое место России — все под полным контролем качественных специалистов.
Всем, кто ищет максимально быстрый способ получить требуемый документ, наша услуга предлагает выгодное решение. Купить диплом – значит избежать долгого обучения и не теряя времени перейти к личным целям, будь то поступление в ВУЗ или начало карьеры.
http://avilon.forumno.com/viewtopic.php?id=500
construction-rent.com
https://jaycitynews.com
Boomerang Casino Free Spins ohne Einzahlung
Das Boomerang Casino ist bekannt für sein großartiges Angebot an Spielen und großzügigen Bonusangeboten. Eine der beliebtesten Aktionen des Casinos sind die kostenlosen Freispiele ohne Einzahlung, die es den Spielern ermöglichen, echtes Geld zu gewinnen, ohne vorher Geld einzahlen zu müssen.
Die Free Spins ohne Einzahlung sind eine großartige Möglichkeit, das Casino kennenzulernen und die verschiedenen Spiele auszuprobieren, ohne dabei ein finanzielles Risiko eingehen zu müssen. Die Freispiele können an ausgewählten Spielautomaten eingesetzt werden und bieten die Chance, echte Gewinne zu erzielen.
Um an den Freispielen ohne Einzahlung teilzunehmen, müssen sich die Spieler lediglich im Boomerang Casino registrieren. Nach der erfolgreichen Anmeldung werden die Freispiele automatisch gutgeschrieben und können direkt genutzt werden.
Es ist jedoch zu beachten, dass die Gewinne aus den Freispielen in der Regel an bestimmte Umsatzbedingungen gebunden sind, die erfüllt werden müssen, bevor eine Auszahlung möglich ist. Diese Bedingungen variieren je nach Aktion und sollten daher vorher genau gelesen werden.
Insgesamt sind die Boomerang Casino Free Spins ohne Einzahlung eine großartige Möglichkeit, die vielfältigen Spiele des Casinos kennenzulernen und dabei sogar echte Gewinne zu erzielen. Es lohnt sich daher, regelmäßig nach aktuellen Angeboten Ausschau zu halten und diese zu nutzen. Viel Spaß und viel Glück beim Spielen!
https://boomerangcasino.one/
Thanks for another excellent post. Where else may just anyone get that type of information in such a perfect way of writing? I’ve a presentation next week, and I am at the look for such info.
https://cutt.ly/Cero2KWb
В нашем мире, где диплом становится началом удачной карьеры в любой области, многие пытаются найти максимально быстрый путь получения образования. Факт наличия документа об образовании переоценить попросту невозможно. Ведь именно диплом открывает двери перед каждым человеком, желающим вступить в профессиональное сообщество или учиться в ВУЗе.
Мы предлагаем очень быстро получить этот важный документ. Вы имеете возможность приобрести диплом старого или нового образца, что является удачным решением для всех, кто не смог закончить обучение или потерял документ. диплом изготавливается с особой тщательностью, вниманием к мельчайшим деталям. В результате вы сможете получить продукт, максимально соответствующий оригиналу.
Преимущества этого подхода состоят не только в том, что можно оперативно получить диплом. Процесс организован комфортно и легко, с профессиональной поддержкой. Начав от выбора подходящего образца до грамотного заполнения личных данных и доставки в любой регион страны — все под абсолютным контролем квалифицированных мастеров.
Для всех, кто ищет максимально быстрый способ получения требуемого документа, наша услуга предлагает отличное решение. Купить диплом – значит избежать долгого процесса обучения и сразу переходить к важным целям, будь то поступление в ВУЗ или начало карьеры.
http://www.mysti.org/gallery/main.php?g2_itemId=8756&g2_jsWarning=true&g2_fromNavId=xdf38f359
Das Tipico Casino ist für viele Spieler eine beliebte Anlaufstelle, um ihr Glück bei verschiedenen Casino-Spielen zu versuchen. Ein wichtiger Aspekt beim Spielen in einem Online-Casino ist der maximale Einsatz, den man tätigen kann. Der maximale Einsatz im Tipico Casino variiert je nach Spiel und kann eine wichtige Rolle bei der Entscheidung spielen, welches Spiel man spielen möchte.
Der maximale Einsatz im Tipico Casino kann je nach Spiel unterschiedlich sein. Beispielsweise liegt der maximale Einsatz bei Spielautomaten oft bei 5€ bis 10€ pro Drehung. Bei Tischspielen wie Roulette oder Blackjack kann der maximale Einsatz deutlich höher liegen, manchmal sogar bis zu mehreren hundert Euro pro Runde.
Es ist wichtig, sich vor Beginn des Spiels über den maximalen Einsatz zu informieren, um unangenehme Überraschungen zu vermeiden. Es empfiehlt sich außerdem, ein Budget festzulegen und sich daran zu halten, um mögliche Verluste zu begrenzen.
Wer im Tipico Casino spielen möchte, sollte außerdem darauf achten, verantwortungsbewusst zu spielen und sich der Risiken bewusst zu sein. Glücksspiel kann süchtig machen und sollte daher immer mit Maß und Vernunft betrieben werden.
Alles in allem bietet das Tipico Casino eine Vielzahl von Spielen mit unterschiedlichen maximalen Einsätzen an, sodass für jeden Spieler etwas Passendes dabei ist. Wichtig ist es, verantwortungsbewusst zu spielen und sich an das eigene Budget zu halten, um ein möglichst unterhaltsames und sicheres Spielerlebnis zu gewährleisten.
https://tipicocasino.one/
allnewstoday365.com
Ресурс, где можно купить качественные раковина угловая в ванную с тумбой по выгодным ценам.
механизированная штукатурка м2 [url=mekhanizirovannaya-shtukaturka13.ru]mekhanizirovannaya-shtukaturka13.ru[/url] .
Если ваш холодильник Gaggenau сломался, обратитесь в наш сервисный центр. Мы предоставляем качественный [url=https://gaggenau-remonty.ru/]ремонт холодильника Gaggenau[/url] с использованием оригинальных запчастей. Наши специалисты быстро выедут к вам на дом и проведут диагностику.
dark web link [url=https://mydarkmarket.com/ ]darknet marketplace [/url] dark markets
Вы мечтаете о карьере в финансовой сфере? Наш сервис поможет вам достичь этой цели! [url=https://kupi-diploms.ru/]Купить диплом экономиста[/url] – это ваш первый шаг к успеху в экономике и финансах. Также, если вы ищете престижное образование в столице, у нас вы можете [url=https://kupi-diploms.ru/]купить диплом ВУЗа в Москве[/url]. Наши дипломы отличаются высоким качеством и признанием, что гарантирует вам уважение и высокие шансы на трудоустройство. Выберите наш сервис, чтобы открыть для себя мир больших возможностей и начать строить карьеру своей мечты.
Zet Casino Freispiele: Welches Spiel sollten Sie wählen?
Wenn es um Online-GlГјcksspiele geht, ist Zet Casino eine der beliebtesten Optionen fГјr Spieler auf der ganzen Welt. Das Casino bietet eine Vielzahl von Spielen, darunter Spielautomaten, Tischspiele und Live-Casino-Spiele. Eines der aufregendsten Angebote, das Zet Casino seinen Spielern bietet, sind die Freispiele.
Freispiele sind eine großartige Möglichkeit, um neue Spiele auszuprobieren und echtes Geld zu gewinnen, ohne Ihr eigenes Geld setzen zu müssen. Aber welches Spiel sollten Sie wählen, wenn Sie Zet Casino Freispiele erhalten? Wir haben einige Empfehlungen für Sie.
Wenn Sie gerne Spielautomaten spielen, sollten Sie sich fГјr beliebte Titel wie Book of Dead, Starburst oder Gonzo’s Quest entscheiden. Diese Spiele sind nicht nur unterhaltsam, sondern bieten auch hohe Gewinnchancen. Mit Zet Casino Freispielen haben Sie die MГ¶glichkeit, diese Spiele auszuprobieren, ohne Ihr eigenes Geld setzen zu mГјssen.
Wenn Sie eher ein Fan von Tischspielen sind, können Sie Ihre Freispiele für Spiele wie Blackjack, Roulette oder Baccarat nutzen. Diese Spiele bieten eine Menge Spaß und Spannung und können Ihnen auch hohe Gewinne einbringen, wenn Sie die richtige Strategie anwenden.
Wenn Sie ein Fan von Live-Casino-Spielen sind, sollten Sie Ihre Freispiele für Spiele wie Live Blackjack, Live Roulette oder Live Baccarat verwenden. Diese Spiele bieten ein authentisches Casino-Erlebnis und ermöglichen es Ihnen, gegen echte Dealer anzutreten.
Egal für welches Spiel Sie sich entscheiden, Zet Casino Freispiele sind eine großartige Möglichkeit, um Ihr Glück zu versuchen und echtes Geld zu gewinnen. Stellen Sie sicher, dass Sie die Bedingungen für die Freispiele lesen und verstehen, bevor Sie mit dem Spielen beginnen. Viel Glück!
https://zetcasino.one/
A refreshing take on the subject, like a cool breeze on a hot day. I’m all ears for what you have to say next.
https://newsprofit.info
emergate.net
Zet Casino Online-Entwickler: Eine Revolution in der Welt des Online-GlГјcksspiels
Das Online-Glücksspiel hat in den letzten Jahren eine enorme Popularität gewonnen. Eine Vielzahl von Online-Casinos bieten eine breite Palette von Spielen an, die von Spielautomaten über Tischspiele bis hin zu Live-Dealer-Spielen reichen. Eines der aufstrebenden Online-Casinos, das die Aufmerksamkeit vieler Spieler auf sich zieht, ist das Zet Casino.
Das Zet Casino zeichnet sich nicht nur durch eine Vielzahl von Spielen aus, sondern auch durch seine hochwertigen Entwickler. Das Entwicklungsteam des Zet Casinos besteht aus erfahrenen und talentierten Profis, die ständig bestrebt sind, die Spielerfahrung zu verbessern und innovative Spiele zu entwickeln. Ihre Leidenschaft für die Branche spiegelt sich in der Qualität ihrer Arbeit wider.
Die Entwickler des Zet Casinos haben es geschafft, ein umfangreiches Portfolio von Spielen aufzubauen, das die Bedürfnisse und Vorlieben verschiedener Spielergruppen anspricht. Von klassischen Spielautomaten bis hin zu aufregenden Live-Casino-Spielen bietet das Zet Casino eine Vielzahl von Optionen, die es den Spielern ermöglichen, ein unterhaltsames und spannendes Spielerlebnis zu genießen.
Darüber hinaus legt das Entwicklungsteam des Zet Casinos großen Wert auf Sicherheit und Fairness. Alle Spiele werden regelmäßig auf ihre Fairness überprüft, um sicherzustellen, dass die Spieler eine faire Chance haben zu gewinnen. Zudem wird die Einhaltung der Datenschutzbestimmungen streng überwacht, um die persönlichen Informationen der Spieler zu schützen.
Insgesamt haben die Online-Entwickler des Zet Casinos eine Revolution in der Welt des Online-Glücksspiels geschaffen. Ihr Engagement für Qualität, Innovation und Spielerzufriedenheit hat dazu beigetragen, dass das Zet Casino zu einem der beliebtesten Online-Casinos auf dem Markt geworden ist. Mit spannenden Spielen, einer sicheren Spielumgebung und einem professionellen Kundenservice setzt das Zet Casino einen Maßstab für die Branche und bietet den Spielern ein unvergessliches Spielerlebnis.
https://zetcasino.one/
В наше время, когда диплом становится началом удачной карьеры в любой отрасли, многие ищут максимально простой путь получения образования. Наличие официального документа переоценить невозможно. Ведь диплом открывает дверь перед людьми, стремящимися начать профессиональную деятельность или учиться в каком-либо ВУЗе.
В данном контексте наша компания предлагает быстро получить любой необходимый документ. Вы имеете возможность приобрести диплом, что будет отличным решением для всех, кто не смог закончить обучение или утратил документ. дипломы производятся аккуратно, с особым вниманием к мельчайшим нюансам. В результате вы получите полностью оригинальный документ.
Преимущества этого подхода состоят не только в том, что можно максимально быстро получить свой диплом. Весь процесс организован удобно, с нашей поддержкой. Начав от выбора подходящего образца до грамотного заполнения персональной информации и доставки по стране — все под абсолютным контролем квалифицированных специалистов.
Всем, кто хочет найти оперативный способ получения требуемого документа, наша услуга предлагает отличное решение. Приобрести диплом – значит избежать долгого обучения и сразу переходить к достижению личных целей, будь то поступление в ВУЗ или старт карьеры.
https://avtoweek2016.ru/
I urge you to avoid this site. My own encounter with it has been only frustration as well as suspicion of scamming practices. Exercise extreme caution, or alternatively, find a more reputable site for your needs.
Добрый день всем!
Купите диплом Гознака с гарантированной подлинностью и доставкой по всей России без предоплаты – просто и безопасно!
https://idiplomanys.ru
Привет, дорогой читатель!
Наша компания поможет вам купить диплом ВУЗа с гарантией качества и доставкой в любой регион России!
Получите российский диплом по доступной цене с гарантией прохождения проверок и доставкой в любой город РФ без предоплаты.
http://www.diploman-russiann.ru
Zet Casino auf Trustpilot – Eine vertrauenswürdige Wahl?
Zet Casino ist eines der neuesten Online-Casinos auf dem Markt und viele Spieler fragen sich, ob sie diesem neuen Anbieter vertrauen können. Eine gute Möglichkeit, dies herauszufinden, ist die Überprüfung der Bewertungen auf Trustpilot, einer Plattform, auf der Kunden ihre Erfahrungen mit verschiedenen Unternehmen teilen können.
Die Bewertungen für Zet Casino auf Trustpilot sind insgesamt sehr positiv. Viele Spieler loben die große Auswahl an Spielen, die schnellen Auszahlungen und den zuverlässigen Kundensupport. Einige Nutzer haben auch negative Erfahrungen gemacht, aber die meisten Beschwerden wurden schnell und effizient vom Kundenservice gelöst.
Ein häufiger Kritikpunkt ist, dass die Bonusbedingungen von Zet Casino manchmal etwas undurchsichtig sind und es schwierig sein kann, sie zu erfüllen. Einige Spieler haben auch bemängelt, dass das Design der Website nicht besonders benutzerfreundlich ist und es schwer sein kann, sich zurechtzufinden.
Trotz einiger negativer Bewertungen scheint Zet Casino insgesamt ein vertrauenswürdiger Anbieter zu sein. Die meisten Spieler sind zufrieden mit ihrem Erlebnis bei Zet Casino und empfehlen es gerne weiter. Wenn Sie also auf der Suche nach einem neuen Online-Casino sind, könnte Zet Casino eine gute Wahl sein.
Insgesamt zeigt die Analyse der Bewertungen auf Trustpilot, dass Zet Casino ein zuverlässiger Anbieter ist, der eine große Auswahl an Spielen, schnelle Auszahlungen und guten Kundenservice bietet. Wenn Sie also auf der Suche nach einem neuen Online-Casino sind, ist Zet Casino definitiv eine Überlegung wert.
https://zetcasino.one/
Came across an intriguing article Р it’s worth your attention, trust me https://holodforum.ru/member.php?u=85651
открыть замок служба [url=http://www.vskrytie-zamkov-moskva111.ru/]http://www.vskrytie-zamkov-moskva111.ru/[/url] .
В нашем мире, где диплом – это начало успешной карьеры в любой сфере, многие стараются найти максимально простой путь получения качественного образования. Наличие официального документа переоценить невозможно. Ведь именно диплом открывает дверь перед каждым человеком, который стремится начать трудовую деятельность или учиться в университете.
Предлагаем оперативно получить этот важный документ. Вы сможете заказать диплом старого или нового образца, и это будет выгодным решением для человека, который не смог закончить обучение или утратил документ. дипломы производятся с особой аккуратностью, вниманием к мельчайшим нюансам. В результате вы сможете получить продукт, максимально соответствующий оригиналу.
Преимущество такого подхода состоит не только в том, что можно быстро получить диплом. Весь процесс организовывается комфортно, с профессиональной поддержкой. Начиная от выбора нужного образца до правильного заполнения персональной информации и доставки в любой регион страны — все под полным контролем квалифицированных специалистов.
Всем, кто хочет найти максимально быстрый способ получения требуемого документа, наша компания может предложить выгодное решение. Приобрести диплом – значит избежать длительного процесса обучения и не теряя времени перейти к своим целям, будь то поступление в ВУЗ или начало удачной карьеры.
http://www.diplomans-russia.ru
check it out [url=https://bidencash.st/]cc+cvv[/url]
Ad majorem Dei gloriam — К вящей славе Божией
обучение на категорию в
Discovered an intriguing article, I recommend you to check it out https://www.uscgq.com/forum/newthread.php?forum=general
В нашем обществе, где аттестат – это начало успешной карьеры в любом направлении, многие ищут максимально быстрый и простой путь получения качественного образования. Необходимость наличия документа об образовании переоценить невозможно. Ведь диплом открывает дверь перед каждым человеком, желающим вступить в сообщество профессиональных специалистов или продолжить обучение в высшем учебном заведении.
Наша компания предлагает очень быстро получить этот необходимый документ. Вы можете заказать аттестат нового или старого образца, что является выгодным решением для всех, кто не смог закончить обучение, потерял документ или желает исправить плохие оценки. Любой аттестат изготавливается аккуратно, с максимальным вниманием ко всем деталям, чтобы в итоге получился продукт, полностью соответствующий оригиналу.
Преимущества данного подхода заключаются не только в том, что можно максимально быстро получить свой аттестат. Весь процесс организовывается комфортно, с нашей поддержкой. Начав от выбора подходящего образца аттестата до грамотного заполнения личной информации и доставки по стране — все под абсолютным контролем квалифицированных специалистов.
Таким образом, всем, кто хочет найти максимально быстрый способ получения требуемого документа, наша компания может предложить выгодное решение. Купить аттестат – это значит избежать долгого процесса обучения и сразу перейти к своим целям: к поступлению в университет или к началу трудовой карьеры.
http://vsediplomu.ru/
Found a captivating read that I’d like to recommend to you https://poetzinc.com/read-blog/10650
Hello to every one, the contents present at this web site are genuinely remarkable for people experience, well, keep up the nice work fellows.
https://diplomans-russiyans.ru
Tipico Casino Freispiele Auszahlen
Das Tipico Casino bietet seinen Kunden regelmäßig die Möglichkeit, Freispiele für verschiedene Spielautomaten zu erhalten. Diese Freispiele sind eine beliebte Bonusform, die es den Spielern ermöglicht, zusätzliche Gewinne ohne zusätzlichen Einsatz zu erzielen. Doch wie können die Gewinne aus diesen Freispielen ausgezahlt werden?
Um die Gewinne aus Freispielen auszahlen zu lassen, müssen zunächst die Umsatzbedingungen erfüllt werden. Diese Bedingungen legen fest, wie oft der Betrag der Freispiele im Casino umgesetzt werden muss, bevor eine Auszahlung möglich ist. In der Regel liegt dieser Umsatzfaktor zwischen 30 und 40 Mal, kann jedoch je nach Aktion variieren.
Es ist wichtig, die jeweiligen Umsatzbedingungen der Freispiele zu beachten, da eine vorzeitige Auszahlung der Gewinne dazu fГјhren kann, dass diese verfallen. Es ist daher ratsam, sich vorab Гјber die gГјltigen Bedingungen zu informieren und gegebenenfalls den Kundenservice zu kontaktieren, um Unklarheiten zu beseitigen.
Sobald die Umsatzbedingungen erfüllt sind, können die Gewinne aus den Freispielen ganz einfach ausgezahlt werden. Dazu muss man sich lediglich in sein Spielerkonto einloggen und den Auszahlungsprozess über den entsprechenden Menüpunkt starten. Hierbei kann man in der Regel zwischen verschiedenen Auszahlungsmethoden wählen, wie zum Beispiel Banküberweisung, Kreditkarte oder E-Wallet.
Insgesamt bieten Freispiele im Tipico Casino eine spannende Möglichkeit, zusätzliche Gewinne zu erzielen und das Spielerlebnis noch aufregender zu gestalten. Wenn man die Umsatzbedingungen beachtet und die Gewinne rechtzeitig auszahlt, steht dem Spielspaß mit den Freispielen nichts im Wege.
https://tipicocasino.one/
автошкола обучение
Aut non tentaris, aut perfice — Или не берись, или доводи до конца.
купить домик на кипре у моря недорого
элитная недвижимость кипр
check over here [url=https://bidencash.bid/]Credit cards[/url]
salaty-na-stol.info
https://newssahara.com
navigate here [url=https://bidencash.asia/]Free cards BidenCash[/url]
palabraptu
Индексация ссылок на сайте индекс гугл ру
Zet Casino ist ein beliebtes Online-Casino, das von Spielern auf der ganzen Welt gerne besucht wird. Es bietet eine Vielzahl von Spielen, darunter Slots, Tischspiele und Live-Dealer-Spiele. Ein weiterer Grund, warum Zet Casino so beliebt ist, sind die großzügigen Boni und Promotionen, die regelmäßig angeboten werden.
Ein
weiteres Merkmal von Zet Casino, das es so attraktiv macht, ist die
hervorragende Kundenbetreuung. Das Team steht rund um die Uhr zur VerfГјgung, um
Fragen zu beantworten und Unterstützung zu bieten. Die Spieler können sich auf
eine schnelle und effiziente Hilfe verlassen.
AskGamblers
ist eine der bekanntesten Plattformen fГјr Online-Casino-Bewertungen und -Bewertungen.
Hier können Spieler Erfahrungen und Einschätzungen zu verschiedenen Casinos
teilen. Zet Casino hat ebenfalls positive Bewertungen bei AskGamblers
gesammelt, was zeigt, dass es sich um eine vertrauenswürdige und zuverlässige
GlГјcksspielplattform handelt.
Die Spieler
loben insbesondere die groГџzГјgigen Boni und Promotionen von Zet Casino sowie
die Vielfalt und Qualität der angebotenen Spiele. Die Benutzeroberfläche ist
Гјbersichtlich und benutzerfreundlich, was das Spielerlebnis noch angenehmer
macht.
Insgesamt
ist Zet Casino eine hervorragende Wahl fГјr Online-GlГјcksspielfans, die eine
unterhaltsame und sichere Umgebung suchen, in der sie ihre Lieblingsspiele
genießen können. Mit seinem umfangreichen Spielangebot, großzügigen Boni und
professionellem Kundenservice hat es sich einen Platz unter den Top-Online-Casinos
verdient.
https://zetcasino.one/
Metalworking on lathes involves many https://supesolar.com actions when deepening products or cutting out parts is required. Robust cutting tools with low wear and high hardness are required. It is proposed to buy replacement groove plates from well-known manufacturers.
The main advantage of a forklift is its versatility and newssugar.com ease of use. Essentially, it’s just a dolly with a durable fork that can be used to lift pallets or large loads to any height.
You appropriate for a cosmic architect, wielding the forces of complexion to annihilate planets and moons. Determine from exceeding 50 weapons,
including lasers, meteors, black holes, and UFOs.
Fraud and customize your own planetary systems in solar smash, from
teeny asteroids to whacking great gas giants.
Shape the universe according to your whims.
[url=https://www.onioni4.ru/content/darknet_poiskovik]Даркнет поисковик [/url] – Даркнет поисковик, Список Tor сайтов
квартиры на кипре аренда
You fit a cosmic architect, wielding the forces of world to annihilate planets and moons. Settle upon from to 50 weapons,
including lasers, meteors, black holes, and UFOs.
Expertness and customize your own planetary systems in solar smash, from
midget asteroids to tremendous gas giants.
Mould the milieu according to your whims.
lalablublu
why not try these out [url=https://potplayer.network]Pot player[/url]
Unique viewpoints, because who needs echo chambers?
Metal structures must be produced under strict ochen-vkusno.com quality control. Absolutely all work is checked – from the manufacture of elements to final assembly. It is necessary to check their size, strength, coating and other parameters.
Узаконивание перепланировки помещений — процесс, требующий соблюдения всех строительных норм и правил. Компания “КитСтрой” предоставляет комплексные услуги по узакониванию перепланировок. Наши специалисты помогут вам собрать и оформить все необходимые документы, подготовить проект перепланировки и согласовать его с соответствующими инстанциями. Мы обеспечиваем полное сопровождение на всех этапах, что позволяет минимизировать бюрократические сложности.
[url=https://potolki-kitstroy.ru/]Как узаконить перепланировку помещений[/url] с “КитСтрой” — это гарантия успешного завершения процесса и уверенность в законности всех изменений.
Once a metal structure tatraindia.com is installed, it must be maintained regularly. Thanks to this, it will last much longer.
Zet Casino Code: Alles, was Sie wissen mГјssen
Zet Casino ist eines der beliebtesten Online-Casinos, das eine Vielzahl von Spielen für alle Arten von Spielern anbietet. Um das Spielerlebnis noch spannender zu gestalten, bietet Zet Casino auch Codes an, die den Spielern zusätzliche Boni und Vorteile verschaffen. In diesem Artikel werden wir alles, was Sie über den Zet Casino Code wissen müssen, besprechen.
Ein Zet Casino Code ist ein spezieller Code, den Spieler eingeben können, um verschiedene Boni wie Freispiele, Einzahlungsboni oder Cashback-Angebote zu erhalten. Diese Codes sind in der Regel zeitlich begrenzt und werden regelmäßig aktualisiert, um den Spielern frische und aufregende Angebote zu bieten.
Um einen Zet Casino Code einzulГ¶sen, mГјssen Sie sich zuerst auf der Website des Casinos anmelden und zum Abschnitt “Promotionen” gehen. Dort finden Sie eine Liste der verfГјgbaren Codes und deren jeweilige Bedingungen. WГ¤hlen Sie einfach den Code aus, den Sie verwenden mГ¶chten, und geben Sie ihn wГ¤hrend der Einzahlung in das entsprechende Feld ein.
Es ist wichtig zu beachten, dass jeder Zet Casino Code mit bestimmten Bedingungen verbunden ist, die Sie erfüllen müssen, um den Bonus zu erhalten. Diese Bedingungen können Einschränkungen wie Mindesteinzahlungsbeträge, Umsatzanforderungen oder Verfallsdaten umfassen. Stellen Sie also sicher, dass Sie die Bedingungen sorgfältig lesen, bevor Sie den Code verwenden.
Zet Casino Codes sind eine großartige Möglichkeit, Ihr Spielerlebnis zu verbessern und zusätzliche Belohnungen zu erhalten. Halten Sie daher die Website immer im Auge, um keine neuen Codes zu verpassen. Viel Spaß und viel Glück beim Spielen im Zet Casino!
https://zetcasino.one/
апартаменты на кипре
Your post has brought even more joy to this beautiful Monday. It’s insightful and wonderfully written. Including more visuals in your next posts could make them even more captivating and enjoyable.
снять квартиру в кипре
купить квартиру на кипре цены
Онлайн-ресурс, где можно найти огромный ассортимент раковины на стиральную машину со столешницей для вашей ванной комнаты.
To improve the performance of an agricultural machinery component, Vibromera’s balancing solutions were employed, resulting in enhanced durability and efficiency. Additional information on their techniques is available on their website https://vibromera.eu/product/
blublun
[url=https://bs2sate2.at]Блэкспрут зеркало[/url] – Bs.gl, Blacksprut
создание сайтов поисковое продвижение сайта [url=https://seogou.ru]https://seogou.ru[/url] .
Здравствуйте!
Признаюсь, когда дело доходит до выбора казино, я предпочитаю играть на родной земле, даже если это только виртуальная земля русских казино онлайн. Здесь, как на даче у бабушки: все знакомо и понятно. Никаких языковых барьеров, только вы, игровые автоматы и ваша удача, говорящая по-русски. И как же приятно, когда поддержка отвечает без акцента и сразу понимает ваши проблемы! А бонусы? Это как малина на дачном участке – собирай не хочу! На русских площадках бонусы щедрые, как русская душа, и это делает игру еще прекраснее.
https://my-univer.ru/2024/05/10/lev-casino-Центр-онлайн-развлечений
пополнение казино через тинькофф
скачать приложение азино
казино миллион официальный сайт зеркало
онлайн казино casino официальный сайт мобильная
скачать казино лучшее
Удачи!
Das Online Tipico Casino ist eine beliebte Plattform für Glücksspiele im Internet. Es bietet eine Vielzahl von Spielen wie Slots, Roulette, Blackjack und Poker, die von renommierten Softwareanbietern entwickelt wurden. Das Casino zeichnet sich durch sein benutzerfreundliches Design, seine hohe Sicherheit und seine zuverlässigen Zahlungsmethoden aus.
Die Spieler können sowohl über ihren Desktop-Computer als auch über ihre mobilen Geräte auf das Online Tipico Casino zugreifen. Die mobile Version der Plattform bietet eine nahtlose Spielerfahrung, sodass die Nutzer auch unterwegs alle Spiele genießen können.
Ein weiterer großer Vorteil des Online Tipico Casinos sind die großzügigen Bonusangebote. Neue Spieler erhalten oft Willkommensbonusse, Freispiele und andere Promotionen, die ihnen den Einstieg erleichtern. Auch bestehende Spieler werden regelmäßig mit Bonusangeboten belohnt, um ihre Treue zu würdigen.
Das Online Tipico Casino legt großen Wert auf verantwortungsbewusstes Glücksspiel und bietet verschiedene Maßnahmen zur Unterstützung von Spielern mit problematischem Spielverhalten an. Die Spieler können Limits für Einzahlungen und Spielzeiten festlegen oder sich selbst vom Spielen ausschließen, falls nötig.
Insgesamt bietet das Online Tipico Casino eine sichere und unterhaltsame Umgebung fГјr GlГјcksspiel-Fans. Mit einer Vielzahl von Spielen, groГџzГјgigen Boni und verantwortungsbewusstem Spiel ist es eine empfehlenswerte Plattform fГјr alle, die gerne online spielen.
https://tipicocasino.one/
Получение образования представляет собой важным этапом в жизни каждого индивидуума, определяющим его будущее и карьерные возможности – [url=http://diplomvam.ru]http://diplomvam.ru[/url]. Аттестат даёт доступ путь к свежим горизонтам и перспективам, обеспечивая доступ к высококачественному получению знаний и престижным специальностям. В современном мире, где конкуренция на рынке труда постоянно увеличивается, наличие диплома становится жизненно важным условием для успешной профессиональной деятельности. Он подтверждает ваши знания и навыки, умения и умения перед профессиональным сообществом и общественностью в общем. Помимо этого, диплом придает веру в свои силы и увеличивает самооценку, что содействует личностному росту и саморазвитию. Окончание диплома также является вложением в свое будущее, предоставляя устойчивость и благополучный уровень проживания. Именно поэтому обращать надлежащее внимание и время получению образования и бороться за его достижению, чтобы получить успех и удовлетворение от собственной профессиональной деятельности.
Аттестат не лишь символизирует личное образование, но и демонстрирует вашу самодисциплину, усердие и настойчивость в добивании целей. Диплом представляет собой плодом труда и вложенных усилий, вложенных в учебу и самосовершенствование. Завершение учебы диплома раскрывает перед вами новые перспективы перспектив, даруя возможность избирать из разнообразия карьерных путей и карьерных траекторий. Это также даёт вам основу знаний и умений, необходимых для для выдающейся практики в нынешнем обществе, насыщенном вызовами и изменениями. Кроме того, сертификат считается доказательством вашей компетентности и квалификации, что в свою очередь повышает вашу привлекательность для работодателей на рынке труда и открывает вами двери к наилучшим шансам для карьерного роста. Следовательно, завершение учебы диплома не только обогащает ваше личное и профессиональное развитие, но и открывает перед вами новые и перспективы для достижения и амбиций.
https://lavrus.org
It is worth noting breakingnews77.com that the loader can be made in the form of a trolley without its own traction, as well as in the form of a powered/gasoline self-propelled device, with which you can transport minimally heavy objects over significant distances within the warehouse. Another advantage is simple maintenance, which ensures the absence of technical bells and whistles, but this depends on the specific model of the device.
Es kann frustrierend sein, wenn man versucht, Tipico Casino Chips zu kaufen und es einfach nicht funktioniert. Obwohl das Casino eine Vielzahl von Zahlungsmethoden anbietet, können gelegentlich technische Probleme auftreten, die den Kauf von Chips verhindern.
Es gibt mehrere Gründe, warum der Kauf von Tipico Casino Chips nicht möglich sein könnte. Einer davon könnte sein, dass die Zahlungsmethode, die Sie verwenden möchten, nicht akzeptiert wird. Es ist wichtig sicherzustellen, dass Sie eine gültige Zahlungsmethode auswählen, die von Tipico akzeptiert wird.
Ein weiterer Grund könnte sein, dass es ein Problem mit Ihrer Internetverbindung gibt. Stellen Sie sicher, dass Sie über eine stabile Internetverbindung verfügen, bevor Sie versuchen, Casino Chips zu kaufen.
Wenn Sie weiterhin Probleme beim Kauf von Tipico Casino Chips haben, können Sie den Kundensupport kontaktieren. Die Mitarbeiter stehen Ihnen gerne zur Verfügung, um Ihnen bei der Lösung von Problemen zu helfen.
Insgesamt ist es wichtig, geduldig zu bleiben und zu versuchen, das Problem schrittweise zu lösen. Mit etwas Hilfe vom Kundensupport sollte es möglich sein, das Problem zu beheben und wieder Spaß am Spielen im Tipico Casino zu haben.
https://tipicocasino.one/
В нашем обществе, где диплом является началом отличной карьеры в любом направлении, многие ищут максимально быстрый путь получения образования. Наличие официального документа об образовании сложно переоценить. Ведь именно он открывает дверь перед любым человеком, желающим начать профессиональную деятельность или продолжить обучение в высшем учебном заведении.
Наша компания предлагает очень быстро получить любой необходимый документ. Вы можете купить диплом, и это становится отличным решением для всех, кто не смог закончить обучение, потерял документ или хочет исправить свои оценки. Каждый диплом изготавливается с особой тщательностью, вниманием ко всем деталям. На выходе вы сможете получить документ, максимально соответствующий оригиналу.
Преимущества подобного решения заключаются не только в том, что вы максимально быстро получите свой диплом. Весь процесс организован комфортно, с профессиональной поддержкой. Начав от выбора нужного образца диплома до консультаций по заполнению персональной информации и доставки по России — все будет находиться под абсолютным контролем наших специалистов.
Для тех, кто пытается найти максимально быстрый способ получения необходимого документа, наша компания готова предложить выгодное решение. Купить диплом – значит избежать длительного обучения и сразу перейти к достижению своих целей: к поступлению в университет или к началу удачной карьеры.
http://ukr.mybb.ru/viewtopic.php?id=388
nice content!nice history!!
https://disdukcapil.madina.go.id/wp-content/wpo-cache/?sikatkan=angkabet
Awesome things here. I’m very satisfied to look your article. Thanks a lot and I’m having a look forward to touch you. Will you kindly drop me a e-mail?
https://squareblogs.net/gardenqrec/h1-b-iak-pokrashchiti-osvitlennia-dorogi-z-dopomogoiu-visokoiakisnogo-skla
В нашем мире, где диплом – это начало отличной карьеры в любой отрасли, многие пытаются найти максимально простой путь получения образования. Факт наличия официального документа сложно переоценить. Ведь именно диплом открывает дверь перед людьми, стремящимися вступить в сообщество профессионалов или продолжить обучение в университете.
В данном контексте наша компания предлагает быстро получить этот важный документ. Вы сможете приобрести диплом, и это будет выгодным решением для человека, который не смог завершить обучение, утратил документ или желает исправить плохие оценки. диплом изготавливается аккуратно, с максимальным вниманием ко всем элементам. В результате вы сможете получить продукт, максимально соответствующий оригиналу.
Превосходство подобного подхода состоит не только в том, что можно максимально быстро получить диплом. Процесс организовывается удобно, с нашей поддержкой. От выбора требуемого образца до консультаций по заполнению персональных данных и доставки в любой регион страны — все под полным контролем качественных специалистов.
Для тех, кто ищет быстрый и простой способ получения требуемого документа, наша компания может предложить выгодное решение. Купить диплом – значит избежать продолжительного процесса обучения и не теряя времени переходить к важным целям: к поступлению в университет или к началу удачной карьеры.
http://arsenal.spybb.ru/viewtopic.php?id=689
купить торшер хрустальный напольный [url=https://www.hrustalnye-torshery.ru/]https://www.hrustalnye-torshery.ru/[/url] .
Willkommen im Zet Casino! Als neuer Spieler haben Sie die Möglichkeit, von einem großzügigen Willkommensbonus zu profitieren. Dieser Bonus ist eine tolle Möglichkeit, um Ihr Spielerlebnis im Zet Casino zu beginnen und Ihre Gewinnchancen zu steigern.
Der Willkommensbonus im Zet Casino besteht aus einem 100% Einzahlungsbonus von bis zu 500€ sowie 200 Freispielen für ausgewählte Spielautomaten. Um diesen Bonus zu erhalten, müssen Sie lediglich eine Mindesteinzahlung von 20€ tätigen. Sobald die Einzahlung getätigt wurde, wird der Bonus automatisch auf Ihr Konto gutgeschrieben.
Um den Bonus und die damit verbundenen Gewinne auszahlen zu können, müssen Sie die Umsatzanforderungen erfüllen. Diese betragen das 40-fache des Bonusbetrags. Beachten Sie, dass nicht alle Spiele zu den Umsatzanforderungen beitragen. Es ist daher ratsam, sich vorab die Bonusbedingungen durchzulesen.
Neben dem Willkommensbonus bietet das Zet Casino auch regelmäßig Aktionen und Promotionen für bestehende Spieler an. Diese können unter anderem Freispiele, Einzahlungsboni oder Cashback-Angebote beinhalten. Es lohnt sich daher, regelmäßig die Promotionsseite des Casinos zu besuchen, um keine Angebote zu verpassen.
Insgesamt bietet das Zet Casino eine Vielzahl von Spielen, darunter Spielautomaten, Tischspiele und Live-Casino-Spiele von bekannten Anbietern wie NetEnt, Microgaming und Evolution Gaming. Mit dem Willkommensbonus und den regelmäßigen Promotionen haben Sie die Möglichkeit, Ihr Spielerlebnis im Zet Casino zu maximieren und hoffentlich auch einige Gewinne zu erzielen.
Also worauf warten Sie noch? Registrieren Sie sich noch heute im Zet Casino und sichern Sie sich Ihren Willkommensbonus fГјr ein unvergessliches Spielerlebnis. Viel GlГјck und SpaГџ beim Spielen!
https://zetcasino.one/
В нашем обществе, где диплом становится началом удачной карьеры в любом направлении, многие стараются найти максимально простой путь получения образования. Наличие документа об образовании переоценить просто невозможно. Ведь именно диплом открывает двери перед людьми, желающими вступить в сообщество профессиональных специалистов или учиться в каком-либо институте.
В данном контексте наша компания предлагает максимально быстро получить этот необходимый документ. Вы имеете возможность купить диплом нового или старого образца, что будет отличным решением для человека, который не смог закончить обучение, утратил документ или желает исправить свои оценки. Все дипломы выпускаются с особой тщательностью, вниманием к мельчайшим деталям. На выходе вы сможете получить полностью оригинальный документ.
Преимущество такого решения заключается не только в том, что вы сможете оперативно получить диплом. Процесс организован комфортно, с нашей поддержкой. Начав от выбора необходимого образца до грамотного заполнения персональной информации и доставки по России — все под абсолютным контролем наших мастеров.
Всем, кто ищет оперативный способ получить необходимый документ, наша компания может предложить отличное решение. Заказать диплом – это значит избежать длительного процесса обучения и не теряя времени перейти к достижению личных целей: к поступлению в ВУЗ или к началу удачной карьеры.
http://arsenal.spybb.ru/viewtopic.php?id=690
1SS3D249742
Stumbled upon interesting material Ц I can’t help but recommend you to read http://silkhunter.com/index.php?search=&title=Special:Search&go=Go
Boomerang Casino Mobil: Nie mehr Langeweile unterwegs!
Im Zeitalter der digitalen Revolution wird MobilitГ¤t immer wichtiger. Egal ob auf dem Weg zur Arbeit, in der Bahn oder im Wartezimmer beim Arzt – wir verbringen immer mehr Zeit unterwegs. Da ist es nur verstГ¤ndlich, dass auch das mobile GlГјcksspiel immer beliebter wird. Mit dem Boomerang Casino Mobil kГ¶nnen Spieler jetzt auch unterwegs ihre Lieblingsspiele genieГџen und lukrative Gewinne erzielen.
Das Boomerang Casino Mobil bietet eine Vielzahl von Spielen, angefangen von Slots über Tischspiele bis hin zu Live-Casino-Spielen. Für jeden Geschmack ist etwas dabei und dank der hochwertigen Grafik und des reibungslosen Spielablaufs fühlt man sich fast wie in einem echten Casino. Zudem sorgen regelmäßige Updates und neue Spiele dafür, dass es nie langweilig wird.
Ein weiterer Vorteil des Boomerang Casino Mobil ist die FlexibilitГ¤t in Bezug auf Zahlungsmethoden. Egal ob Kreditkarte, PayPal oder eine virtuelle GeldbГ¶rse – es gibt zahlreiche MГ¶glichkeiten, um bequem Ein- und Auszahlungen vornehmen zu kГ¶nnen. Zudem sorgt eine sichere SSL-VerschlГјsselung dafГјr, dass persГ¶nliche Daten geschГјtzt sind.
Auch der Kundenservice des Boomerang Casino Mobil überzeugt auf ganzer Linie. Freundliche und kompetente Mitarbeiter stehen rund um die Uhr zur Verfügung, um Fragen zu beantworten oder Probleme zu lösen. So fühlt man sich auch unterwegs gut betreut und kann sich voll und ganz auf das Spiel konzentrieren.
Fazit: Das Boomerang Casino Mobil ist die perfekte LГ¶sung fГјr alle, die auch unterwegs nicht auf spannende Casino-Spiele verzichten mГ¶chten. Mit einer breiten Auswahl an Spielen, flexiblen Zahlungsmethoden und einem exzellenten Kundenservice steht dem ultimativen SpielspaГџ nichts mehr im Wege.Probieren Sie es aus und erleben Sie ein unvergessliches Casino-Erlebnis – ganz bequem von Ihrem Smartphone oder Tablet aus!
https://boomerangcasino.one/
Сделайте шаг к успешному будущему уже сегодня! На нашем сайте вы можете [url=https://kupi-diploms.ru/]купить диплом бакалавра[/url] или [url=https://kupi-diploms.ru/]купить диплом технический[/url], что позволит вам занять желаемую позицию в выбранной профессиональной сфере. Наши дипломы гарантируют высокое качество и признание на рынке, обеспечивая вам конкурентное преимущество при трудоустройстве.
Доброго!
Друзья, я не могу в своем блоге рекомендовать азартные игры и онлайн-казино или делиться советами, как в них играть. Это было бы безответственно с моей стороны, ведь игромания – серьезная проблема, разрушающая жизни.
Поверьте, я и сам когда-то увлекался онлайн-слотами, мечтая легко разбогатеть. Яркие обещания казино затягивали как омут. Но в итоге я лишь влез в долги и чуть не потерял семью. Хорошо, что вовремя одумался.
Сейчас я четко понимаю – все эти заманчивые рекламные посылы о быстрых выигрышах и постоянной удаче созданы лишь для того, чтобы опустошить наши карманы. Математика и алгоритмы казино всегда работают против игрока. Единственный, кто там стабильно зарабатывает – сами казино.
Поэтому мой совет – держитесь подальше от азартных игр онлайн. Это путь к разочарованию и проблемам, а не к успеху. Лучше инвестируйте время и деньги в себя, близких, в реальное дело. Стройте жизнь на позитиве, а не на иллюзорной надежде сорвать куш.
Не позволяйте индустрии азартных игр манипулировать вами. Цените то, что имеете, и помните – настоящее богатство в любви, здоровье, увлеченности любимым делом, а не в погоне за случайной удачей. Будьте мудрыми и не попадайтесь на крючок!
[url=https://sanvolga44.ru/shabalinskij-kraj-preobrazhaetsya-v-cvetushhij-raj/]sanvolga44.ru[/url]
игровые автоматы с кэшбэком с выводом
онлайн казино на деньги online casino официальный сайт мобильная
казино на телефон с выводом денег
в какой казино можно оплатить кюар код
казино клуб официальный андроид
Удачи!
сервисный центр apple рядом
сервисный ремонт apple
Once a metal structure is installed, it must dominicandesign.net be maintained regularly.
Forklifts can be called an indispensable 360o.info element of equipment, which is actively used in the arrangement of warehouse premises.
blublu
Здравствуйте!
Играть в казино с реальными дилерами — это как посетить вечеринку, где вас встречают старые друзья, которых вы никогда не видели. Обаятельные дилеры улыбаются вам через экран, и вы понимаете, что эта улыбка может стоить вам денег. Но ощущение реального присутствия добавляет игре пикантности. Вы чувствуете напряжение, когда дилер медленно раздает карты, и ваше сердце замирает — не от страха, а от предвкушения чуда. И знаете, в эти моменты я всегда думаю: “А вдруг сегодня мой день?” Это как смотреть фильм, где вы не только зритель, но и главный герой. Так что давайте играть, общаться и, конечно, выигрывать. Ведь как говорят: фортуна любит смелых!
[url=https://oknavsochi.ru/2024/05/10/Погрузитесь-в-мир-Лев-Казино-Игры-и-бонусы-на-любой-вкус]oknavsochi.ru[/url]
sykkka казино
официальный сайт казино
казино на русском
казино официальный скачать
казино для андроид на реальные деньги
Удачи!
vavada официальный сайт регистрация
Der klassische Casino Tipico ist ein beliebter Ort fГјr GlГјcksspielenthusiasten auf der ganzen Welt. Mit einer Vielzahl von Spielen und einem eleganten Ambiente bietet das Tipico Casino ein unvergleichliches Erlebnis fГјr alle, die gerne ihr GlГјck versuchen.
Das Tipico Casino bietet eine breite Palette von traditionellen Casinospielen wie Blackjack, Roulette, Poker und Spielautomaten an. Die Spieler haben die Möglichkeit, ihr Glück an verschiedenen Tischen und Automaten zu versuchen und dabei echtes Geld zu gewinnen.
Die Atmosphäre im klassischen Casino Tipico ist einzigartig und lädt die Besucher zum Verweilen ein. Die glamouröse Einrichtung und das aufmerksame Personal sorgen für ein erstklassiges Spielerlebnis, das seinesgleichen sucht.
Ein weiterer Anziehungspunkt des klassischen Casino Tipico ist die Möglichkeit, an exklusiven Veranstaltungen und Turnieren teilzunehmen. Hier haben die Spieler die Chance, sich mit Gleichgesinnten zu messen und attraktive Preise zu gewinnen.
Der klassische Casino Tipico hat sich im Laufe der Jahre einen exzellenten Ruf erworben und gilt als einer der fГјhrenden Anbieter von Casinospielen. Mit seiner langen Tradition und seinem erstklassigen Service ist das Tipico Casino die ideale Adresse fГјr alle, die nach einem unvergesslichen Spielerlebnis suchen.
https://tipicocasino.one/
Окончание образования является важным этапом во пути каждого индивидуума, определяет его перспективы и карьерные перспективы – [url=http://diplomvam.ru]diplomvam.ru[/url]. Аттестат открывает путь к новым перспективам и перспективам, обеспечивая возможность к качественному получению знаний и высокопрестижным профессиям. В сегодняшнем мире, где борьба на трудовом рынке постоянно растёт, наличие диплома становится обязательным требованием для выдающейся профессиональной деятельности. Диплом утверждает ваши знания и навыки, навыки и компетенции перед профессиональным сообществом и обществом в целом. Помимо этого, диплом дарует веру в свои силы и повышает самооценку, что содействует личностному росту и развитию. Окончание диплома также является инвестицией в свое будущее, предоставляя устойчивость и благополучный уровень проживания. Поэтому обращать должное внимание и время образованию и стремиться к его получению, чтобы получить успеха и удовлетворение от своей профессиональной деятельности.
Диплом не лишь представляет личное образовательный уровень, но и демонстрирует вашу самодисциплину, усердие и упорство в достижении задач. Он представляет собой результатом труда и вложенных усилий, вкладываемых в обучение и саморазвитие. Получение диплома открывает перед вами новые горизонты перспектив, позволяя избирать из разнообразия карьерных путей и профессиональных направлений. Кроме того даёт вам основу знаний и умений, необходимых для для выдающейся деятельности в нынешнем обществе, насыщенном трудностями и изменениями. Более того, сертификат считается свидетельством вашей компетентности и квалификации, что улучшает вашу привлекательность на рынке труда и открывает вами двери к лучшим возможностям для профессионального роста. Таким образом, получение аттестата не только пополняет ваше личное и профессиональное самосовершенствование, но и раскрывает вами новые возможности для достижения целей и амбиций.
Индексация ссылок на сайте vindexe.ru
Привет, дорогой читатель!
У нас в компании Вы можете купить диплом Гознак со скидкой, гарантией и доставкой в любой город РФ
Закажите российский диплом у нас по доступной цене с гарантией прохождения проверок и доставкой по РФ.
dlplomanrussia.com
If you need to weld elements, you madeintexas.net should trust the work to a welder with the appropriate skills. The quality of welding work must be constantly monitored.
women18.com
Окончание образования представляет собой основным этапом во карьере всякого человека, определяет его будущее и профессиональные перспективы – [url=http://diplomvam.ru]http://diplomvam.ru[/url]. Аттестат даёт доступ двери к новым перспективам и возможностям, обеспечивая возможность к высококачественному образованию и престижным специальностям. В нынешнем мире, где конкуренция на рынке труда всё растёт, имение аттестата делает жизненно важным условием для выдающейся карьеры. Он утверждает ваши знания, компетенции и компетенции перед профессиональным сообществом и общественностью в общем. В дополнение, аттестат дарит веру в свои силы и увеличивает оценку себя, что содействует личностному росту и развитию. Получение диплома также является вложением в свое будущее, обеспечивая устойчивость и приличный стандарт жизни. Поэтому важно уделять должное внимание и время образованию и бороться за его достижению, чтобы добиться успех и удовлетворение от своей труда.
Диплом не лишь символизирует личное образование, но и демонстрирует вашу самодисциплину, усердие и упорство в добивании задач. Он представляет собой плодом усилий и труда, вложенных в обучение и саморазвитие. Получение диплома открывает перед вами свежие перспективы перспектив, позволяя избирать из разнообразия направлений и карьерных траекторий. Это также предоставляет вам основу знаний и навыков и умений, необходимых для выдающейся практики в современном мире, насыщенном трудностями и изменениями. Помимо этого, диплом является доказательством вашей компетентности и экспертности, что повышает вашу привлекательность для работодателей на трудовом рынке и открывает перед вами возможности к наилучшим шансам для карьерного роста. Таким образом, получение образования аттестата не только пополняет ваше личное и профессиональное развитие, но и раскрывает вами новые и перспективы для достижения и амбиций.
Купите диплом института или техникума с доставкой по РФ по выгодной цене без предоплаты!
http://www.diplomans-rossian.com
Zet Casino Erfahrung
Zet Casino ist eine Online-Spielplattform, die eine Vielzahl von Spielen fГјr alle Arten von Spielern anbietet. Ob Slots, Tischspiele oder Live-Casino – hier findet jeder etwas nach seinem Geschmack. In diesem Artikel mГ¶chten wir unsere Erfahrung mit Zet Casino teilen und Ihnen einen Гњberblick Гјber die Plattform geben.
Zet Casino bietet eine breite Auswahl an Spielen von namhaften Anbietern wie NetEnt, Microgaming, Pragmatic Play und vielen mehr. Die Spiele sind gut strukturiert und einfach zu finden, sodass Sie nicht lange nach Ihrem Lieblingsspiel suchen müssen. Die Benutzeroberfläche ist benutzerfreundlich und intuitiv, so dass auch Anfänger sich schnell zurechtfinden können.
Ein besonderes Highlight bei Zet Casino sind die regelmäßigen Aktionen und Bonusangebote. Es gibt einen großzügigen Willkommensbonus für neue Spieler sowie verschiedene Reload-Boni, Freispiele und Cashback-Angebote. Dies sorgt für zusätzlichen Spaß und Spannung beim Spielen.
Ein weiterer Pluspunkt von Zet Casino ist der Kundenservice. Das Team ist rund um die Uhr per Live-Chat, E-Mail und Telefon erreichbar und steht Ihnen bei Fragen und Problemen zur VerfГјgung. Die Mitarbeiter sind freundlich, kompetent und helfen Ihnen schnell und unkompliziert weiter.
Insgesamt sind wir von unserer Erfahrung mit Zet Casino sehr positiv beeindruckt. Die Plattform bietet eine große Auswahl an Spielen, attraktive Bonusangebote und einen exzellenten Kundenservice. Wir können Zet Casino daher allen Spielern, die nach einer seriösen und unterhaltsamen Online-Spielumgebung suchen, wärmstens empfehlen.
Fazit: Zet Casino überzeugt mit einer vielfältigen Spielauswahl, lukrativen Bonusangeboten und einem erstklassigen Kundenservice. Wir hatten eine tolle Zeit beim Spielen und können die Plattform uneingeschränkt empfehlen. Probieren Sie es selbst aus und erleben Sie den Spaß und die Spannung bei Zet Casino!
https://zetcasino.one/
Современные и стильные металлический навесы для дачи цены для вашего участка.
Found captivating reading that’s worth your time – take a look http://m9-com.ru/forums/viewtopic.php?f=3&t=21580
Discover Exclusive Companionship with She-Companion
Welcome to She-Companion, the ultimate destination for discerning individuals seeking the finest in companionship services. At She-Companion, we pride ourselves on offering a curated selection of sophisticated, elegant, and intelligent companions who are perfect for any occasion. Whether you need a companion for travel, social events, or a relaxing evening, She-Companion is here to provide an unparalleled experience tailored to your desires.
Why Choose She-Companion?
– **Exquisite Selection:** Our companions are carefully chosen for their beauty, charm, and intellect. Each companion is committed to providing an engaging and memorable experience.
– **Global Reach:** With a presence in major cities worldwide, She-Companion ensures that you can find the perfect companion wherever you are. Our companions are available for travel, events, and more, making your experience seamless and enjoyable.
– **Professionalism and Discretion:** At She-Companion, we prioritize your privacy and confidentiality. Our professional approach guarantees a discreet and respectful service, allowing you to enjoy your time with complete peace of mind.
– **Personalized Experiences:** We understand that every client is unique. Our companions are skilled at creating personalized experiences that cater to your specific preferences and requirements, ensuring that your time together is truly special.
Explore Our Gallery
Our website features an exclusive gallery where you can view authentic photos and detailed profiles of our companions. This transparency allows you to select a companion who perfectly matches your tastes and expectations.
Seamless Booking Process
Booking a companion with She-Companion is simple and efficient. Our user-friendly platform enables you to browse profiles, select your desired companion, and arrange your meeting with ease. From initial contact to the final farewell, we ensure a smooth and enjoyable experience.
Elevate Your Experience with She-Companion
Whether you’re attending a high-profile event, embarking on an international adventure, or simply seeking delightful company, She-Companion is your trusted partner in creating unforgettable moments. Visit She-Companion today to explore our gallery and find the perfect companion for your needs. Experience the luxury of exceptional companionship with She-Companion – where elegance meets excellence.
Book your ideal companion now and elevate your experience to new heights. Your extraordinary journey begins with She-Companion.
Here is my homepage – https://she-companion.com/paris-escorts/kendal
Здравствуйте!
Привет, друзья-казиношники! Сегодня я расскажу вам о своем опыте игры в онлайн-казино с живыми дилерами. Это же просто фантастика!
Представьте себе: вы сидите дома в любимых тапочках, а на экране перед вами – роскошное казино с профессиональными крупье! Атмосфера настолько реалистична, что кажется, будто вы перенеслись в Лас-Вегас или Монако. А главное – все это доступно 24/7, без необходимости куда-то ехать!
Но не думайте, что живые дилеры – это просто красивая картинка. Играть с ними на реальные деньги так же увлекательно и азартно, как и в обычном казино. К тому же, многие официальные сайты предлагают эксклюзивные столы и лимиты ставок для VIP-игроков.
Так что если вы хотите почувствовать себя настоящим хайроллером, не выходя из дома, обязательно попробуйте сыграть с живыми дилерами! Уверяю вас, это незабываемые эмоции и шанс сорвать солидный куш!
http://l90226mw.beget.tech/2024/04/26/na-chto-imenno-obraschat-vnimanie-vo-vremya-vybora-kazino.html
сыграем в казино chwin
мобильное казино 601 ru
казино вывода зеркало
olna casino
скачать мобильное казино
Удачи!
Кирпич Донские зори [url=http://www.kirpich-bruschatka.ru]http://www.kirpich-bruschatka.ru[/url] .
Das Boomerang Casino lockt mit einem ganz besonderen Angebot: 50 kostenlose Spins für neue Spieler! Das heißt, dass du die Möglichkeit hast, ohne dafür etwas zahlen zu müssen, an verschiedenen Spielautomaten dein Glück zu versuchen.
Die 50 Free Spins werden dir direkt nach der Registrierung gutgeschrieben, sodass du sie gleich nutzen kannst. Du musst also keine Einzahlung tätigen, um von diesem attraktiven Willkommensangebot zu profitieren.
Die Freispiele können an ausgewählten Slots verwendet werden und können dir zusätzliche Gewinne einbringen. Dabei handelt es sich um eine tolle Gelegenheit, das Casino und seine Spiele erst einmal unverbindlich kennenzulernen.
NatГјrlich gelten auch fГјr die 50 Gratis-Spins bestimmte Bedingungen, die du beachten solltest. Informiere dich am besten vorab Гјber die Umsatzbedingungen, die Gewinnlimits und die Spiele, an denen du die Freispiele einsetzen kannst.
Wenn du also Lust hast, dich im Boomerang Casino zu registrieren und die 50 Free Spins zu nutzen, dann solltest du diese Gelegenheit unbedingt wahrnehmen. Viel SpaГџ beim Spielen und viel GlГјck beim Gewinnen!
https://boomerangcasino.one/
Получение диплома считается важным моментом в жизни всякого человека, который определяет его перспективы и карьерные перспективы – [url=http://diplomvam.ru]diplomvam.ru[/url]. Аттестат открывает путь к новым горизонтам и возможностям, гарантируя возможность к качественному получению знаний и престижным профессиям. В сегодняшнем мире, где в конкуренция на рынке труда всё растёт, наличие диплома делает жизненно важным требованием для успешной карьеры. Он подтверждает ваши знания, умения и навыки, компетенции и компетенции перед профессиональным сообществом и общественностью в целом. Помимо этого, диплом дарует уверенность и укрепляет оценку себя, что содействует личностному росту и саморазвитию. Завершение учебы образования также является вложением в свое будущее, обеспечивая устойчивость и благополучный стандарт проживания. Поэтому важно обращать надлежащее внимание и время образованию и стремиться к его получению, чтобы получить успеха и удовлетворение от собственной труда.
Диплом не лишь символизирует личное образовательный уровень, но и отражает вашу самодисциплину, усердие и настойчивость в добивании целей. Он представляет собой плодом труда и труда, вложенных в учебу и саморазвитие. Получение образования открывает перед вами свежие горизонты перспектив, позволяя избирать из разнообразия карьерных путей и профессиональных направлений. Это также даёт вам основу знаний и навыков и умений, необходимых для успешной деятельности в нынешнем мире, полном трудностями и переменами. Более того, диплом считается свидетельством вашей квалификации и экспертности, что в свою очередь улучшает вашу привлекательность на рынке труда и открывает перед вами двери к лучшим возможностям для карьерного роста. Следовательно, получение диплома не лишь обогащает ваше личное самосовершенствование, но и открывает перед вами новые и возможности для достижения и амбиций.
Получите российский диплом по доступной цене с гарантией прохождения проверок и доставкой в любой город РФ без предоплаты!
http://www.diplomans-rossian.com
Современные и стильные навес для автомобиля возле дома для вашего участка.
Die Tipico Live Casino App ist eine beliebte und moderne Möglichkeit, um von überall aus auf das spannende Live Casino-Angebot von Tipico zuzugreifen. Mit dieser App können Nutzer bequem und flexibel spielen, ohne an einen bestimmten Ort gebunden zu sein.
Die Tipico Live Casino App bietet eine Vielzahl von Spielen und Tischen, an denen man gegen echte Dealer antreten kann. Egal ob Roulette, Blackjack, Poker oder Baccarat – fГјr jeden Geschmack ist etwas dabei. Die Live-Гњbertragung in HD-QualitГ¤t macht das Spielerlebnis noch realistischer und spannender.
Durch die App können Nutzer auch problemlos Ein- und Auszahlungen tätigen, den Kundenservice kontaktieren oder Bonusangebote nutzen. Die Bedienung ist einfach und intuitiv, sodass auch Anfänger sich schnell zurechtfinden können.
Ein weiterer Vorteil der Tipico Live Casino App ist die hohe Sicherheit und Zuverlässigkeit. Die App ist von der Malta Gaming Authority lizenziert und wird regelmäßig auf Fairness und Transparenz überprüft.
Insgesamt ist die Tipico Live Casino App eine empfehlenswerte Option fГјr alle, die gerne live gegen echte Dealer spielen und dabei flexibel sein mГ¶chten. Probieren Sie es aus und erleben Sie die Spannung und AtmosphГ¤re eines echten Casinos – ganz bequem auf Ihrem Smartphone oder Tablet.
https://tipicocasino.one/
Установите навесы уличные и наслаждайтесь комфортом.
Considering how busy arizonawood.net most people are, cleaning services have become very popular.
With their help, you can load pallets news24time.net, boxes and large cargo onto the upper shelves of the racks, which increases the functional area of the warehouse by an order of magnitude.
Acceptable to Genio, the go-to invoice generator after slight feel embarrassed businesses and freelancers. We bring you many invoice templates, including Microsoft Outshine and PDF formats, tailored to all industries. Examine our component featuring settled 300 customized invoice templates designed to cater to your distinctive calling needs.
https://www.genio.ac/invoice-templates/
Приветики!
Наш интернет-магазин предлагает купить российский диплом по выгодной цене, с гарантией прохождения всех проверок
Приобретите диплом ВУЗа по выгодной цене с доставкой по всей России без предоплаты!
http://www.dlplomanrussia.com
I urge you stay away from this platform. My personal experience with it has been nothing but dismay along with concerns regarding fraudulent activities. Be extremely cautious, or alternatively, look for a trustworthy platform for your needs.
Почему стоит выбрать навес для дачи на 2 стойках цена раздвижные именно у нас?
Tipico ist eine der beliebtesten Online-GlГјcksspielplattformen in Deutschland, die eine Vielzahl von spannenden Casino-Spielen anbietet. In diesem Artikel werden die besten Casino-Spiele auf Tipico vorgestellt, die jeder GlГјcksspielfan ausprobieren sollte.
Eines der beliebtesten Casino-Spiele auf Tipico ist zweifellos Blackjack. Das Kartenspiel erfreut sich großer Beliebtheit aufgrund seiner einfachen Regeln und der Möglichkeit, strategisch zu spielen. Mit verschiedenen Varianten wie Classic Blackjack, Single Deck Blackjack und Multi Hand Blackjack bietet Tipico seinen Spielern eine Vielzahl von Optionen, um ihr Glück zu versuchen.
Ein weiteres Highlight auf Tipico ist Roulette. Das klassische Casinospiel, bei dem die Spieler auf den Ausgang eines sich drehenden Rades wetten, bietet Nervenkitzel und Spannung pur. Mit Varianten wie European Roulette, American Roulette und French Roulette können Spieler auf Tipico ihr Glück auf verschiedene Weise herausfordern.
Auch Spielautomaten dГјrfen auf einer Casino-Plattform wie Tipico nicht fehlen. Mit Hunderten von Slots von namhaften Entwicklern wie NetEnt, Microgaming und Play’n GO bietet Tipico eine breite Auswahl an Automatenspielen fГјr jeden Geschmack. Von klassischen FrГјchteslots bis hin zu modernen Video-Slots mit aufregenden Bonusfunktionen ist fГјr jeden etwas dabei.
Nicht zu vergessen sind die Live-Casino-Spiele auf Tipico. Hier können Spieler an Tischen mit echten Dealern und Croupiers Platz nehmen und in Echtzeit gegen andere Spieler antreten. Mit Spielen wie Live Blackjack, Live Roulette und Live Baccarat wird das Casino-Erlebnis auf Tipico auf ein ganz neues Level gehoben.
Insgesamt bietet Tipico eine beeindruckende Auswahl an Casino-Spielen, die sowohl Anfänger als auch erfahrene Spieler ansprechen. Mit den besten Spielen wie Blackjack, Roulette, Spielautomaten und Live-Casino-Spielen ist für jeden Geschmack und jede Vorliebe etwas dabei. Wer also auf der Suche nach einem erstklassigen Online-Casino-Erlebnis ist, sollte Tipico unbedingt einen Besuch abstatten. Viel Spaß und viel Glück beim Spielen!
https://tipicocasino.one/
Здравствуйте!
Также ищите промокоды для игровых автоматов этого казино, например, промокод на Миллион игровые автоматы или Миллион слот промокод. Следите за ссылками на скачивание приложения – в них часто прячутся уникальные бонусные коды. Если хотите играть бесплатно, скачайте игровые автоматы без депозита. Главное правило – развлекайтесь и зарабатывайте в мобильных казино безопасно и с выгодой!
https://ny86.ru/2024/04/29/Твой-Путь-к-Успеху-Промокоды-Лев-Казино
миллион казино промокод
в каких казино есть оплата по сбп
онлайн казино с живыми крупье
скачать казино на андроид
пароль и логин от казино онлайн
Удачи!
Здравствуйте!
Для максимального удобства я настоятельно рекомендую скачать приложение казино на ваш Android. Это позволит вам играть в любимые игры в буквальном смысле на ходу, где бы вы ни находились. Некоторые казино даже предлагают бездепозитные бонусы, чтобы вы могли опробовать игры без риска потери собственных средств. Обратите внимание на лицензированные казино с приложениями для Android. Они гарантируют честную игру, безопасность ваших данных и денежных операций. Кроме того, качественные приложения обеспечивают плавную и стабильную работу без задержек и сбоев.
http://paulikipedia.ru/index.php/%D0%9D%D0%B0_%D1%87%D1%82%D0%BE_%D1%81%D0%BC%D0%BE%D1%82%D1%80%D0%B5%D1%82%D1%8C_%D0%BF%D1%80%D0%B8_%D0%B2%D1%8B%D0%B1%D0%BE%D1%80%D0%B5_%D0%B8%D0%BD%D1%82%D0%B5%D1%80%D0%BD%D0%B5%D1%82-%D0%BA%D0%B0%D0%B7%D0%B8%D0%BD%D0%BE%3F
скачать казино на реальные деньги
приложение казино
миллион слот промокод
1гоу casino
промокоды казино миллионъ
Удачи!
Удобство и функциональность – вот что предлагают наши сколько стоят односкатные навесы.
Boomerang Casino Freispiele: Ein Muss fГјr alle GlГјcksspielenthusiasten
Boomerang Casino ist ein aufstrebendes Online-Casino, das sich durch sein großzügiges Bonussystem auszeichnet. Eine der beliebtesten Aktionen bei Boomerang Casino sind die Free Spins, die den Spielern die Möglichkeit bieten, ihre Lieblingsspiele kostenlos zu genießen.
Die Boomerang Casino Freispiele sind eine attraktive Möglichkeit, um neue Spiele auszuprobieren oder einfach nur zusätzliche Gewinnchancen zu erhalten. Wenn Sie sich für ein Konto bei Boomerang Casino registrieren, werden Sie mit einer Vielzahl von Freispielen belohnt, die Sie direkt in Ihren Lieblingsspielen einsetzen können.
Die Free Spins bei Boomerang Casino sind an keine Umsatzbedingungen geknüpft, was bedeutet, dass alle Gewinne, die Sie mit den Freispielen erzielen, sofort auszahlbar sind. Dies macht die Boomerang Casino Freispiele besonders attraktiv für Spieler, die gerne ohne Einschränkungen spielen möchten.
Darüber hinaus bietet Boomerang Casino regelmäßig Sonderaktionen an, bei denen Sie zusätzliche Freispiele erhalten können. Dies kann beispielsweise durch Einzahlungsboni oder durch die Teilnahme an speziellen Turnieren geschehen. Die Freispiele bei Boomerang Casino sind also nicht nur eine einmalige Belohnung, sondern können Ihnen regelmäßig zusätzliche Gewinnchancen bieten.
Insgesamt sind die Boomerang Casino Freispiele eine attraktive und großzügige Aktion, die es Spielern ermöglicht, ihre Lieblingsspiele ohne Risiko zu genießen und dabei zusätzliche Gewinne zu erzielen. Wenn Sie also auf der Suche nach einem Online-Casino mit lukrativen Bonusangeboten sind, sollten Sie unbedingt Boomerang Casino ausprobieren.
https://boomerangcasino.one/
blolbo
https://images.google.rw/url?q=http://multi-net.org/index.php?subaction=userinfo&user=cenviove
Kod promocyjny Boomerang Casino
Boomerang Casino ist ein Online-Casino, das sich durch seine vielfältige Auswahl an Spielen und großzügigen Boni auszeichnet. Um neue Spieler anzulocken und bestehende Kunden zu belohnen, bietet Boomerang Casino regelmäßig verschiedene Promotionen an, darunter auch spezielle Promotion-Codes.
Ein solcher Promotion-Code, auch bekannt als Bonus-Code oder Gutschein-Code, ist eine Kombination aus Zahlen und Buchstaben, die es Spielern ermöglicht, zusätzliche Boni oder Freispiele zu erhalten. Der Kod promocyjny Boomerang Casino kann auf der Website des Casinos oder in Werbe-E-Mails gefunden werden.
Um den Promotion-Code zu nutzen, müssen Spieler ihn während des Einzahlungsvorgangs eingeben. Sobald der Code bestätigt wurde, wird der Bonus automatisch dem Spielerkonto gutgeschrieben. Die Art des Bonus, den Spieler durch die Eingabe des Promotion-Codes erhalten, kann von Freispielen über Bonusguthaben bis hin zu Cashback-Angeboten reichen.
Es ist wichtig zu beachten, dass jeder Promotion-Code unterschiedliche Bedingungen und Umsatzanforderungen haben kann. Bevor Spieler einen Promotion-Code nutzen, sollten sie daher die entsprechenden Geschäftsbedingungen sorgfältig lesen, um sicherzustellen, dass sie die Bedingungen erfüllen können.
Der Kod promocyjny Boomerang Casino bietet Spielern die Möglichkeit, ihr Spielerlebnis zu verbessern und zusätzliche Gewinne zu erzielen. Indem Spieler regelmäßig nach neuen Promotion-Codes suchen und sie nutzen, können sie das Beste aus ihrem Casinoerlebnis herausholen.
https://boomerangcasino.one/
bliloblo
Получение диплома представляет собой основным этапом в жизни всякого человека, определяющим его будущее и профессиональные перспективы – [url=http://diplomvam.ru]diplomvam.ru[/url]. Диплом даёт доступ путь к перспективным перспективам и возможностям, обеспечивая доступ к высококачественному образованию и престижным специальностям. В сегодняшнем мире, где борьба на трудовом рынке всё увеличивается, наличие аттестата делает необходимым условием для успешной карьеры. Диплом утверждает ваши знания, компетенции и компетенции перед профессиональным сообществом и социумом в целом. В дополнение, диплом дарует уверенность и укрепляет самооценку, что помогает личностному и развитию. Получение образования также инвестицией в будущий путь, обеспечивая устойчивость и достойный уровень проживания. Поэтому отдавать должное внимание получению образования и бороться за его получению, чтобы добиться успех и счастье от своей профессиональной деятельности.
Диплом не лишь представляет личное образовательный уровень, но и демонстрирует вашу дисциплинированность, усердие и упорство в достижении целей. Диплом представляет собой результатом усилий и труда, вложенных в обучение и самосовершенствование. Завершение учебы образования раскрывает перед вами новые горизонты перспектив, позволяя выбирать из множества карьерных путей и профессиональных направлений. Кроме того даёт вам базис знаний и навыков и умений, необходимых для для выдающейся деятельности в современном мире, насыщенном трудностями и изменениями. Более того, диплом считается доказательством вашей компетентности и экспертности, что повышает вашу привлекательность для работодателей на трудовом рынке и открывает вами двери к наилучшим шансам для карьерного роста. Таким образом, получение образования диплома не лишь обогащает ваше личное самосовершенствование, а также открывает перед вами новые и перспективы для достижения целей и амбиций.
Came across a unique piece ? be sure to check it out https://the-trifecta-network.mn.co/posts/56532335
Индексация ссылок на сайте vindexe.ru
angliannews.com
Considering how busy most people are birminghamnews24.com, cleaning services have become very popular. There are several types of cleaning: daily, apartment cleaning after renovation, cleaning by zone and others.
В нашем обществе, где диплом – это начало отличной карьеры в любой отрасли, многие ищут максимально простой путь получения образования. Наличие документа об образовании трудно переоценить. Ведь именно диплом открывает дверь перед людьми, желающими начать трудовую деятельность или учиться в университете.
Предлагаем очень быстро получить любой необходимый документ. Вы сможете купить диплом старого или нового образца, что является выгодным решением для человека, который не смог завершить обучение, утратил документ или хочет исправить плохие оценки. дипломы изготавливаются аккуратно, с максимальным вниманием к мельчайшим деталям. В результате вы сможете получить полностью оригинальный документ.
Преимущество такого подхода заключается не только в том, что вы сможете оперативно получить диплом. Процесс организовывается просто и легко, с нашей поддержкой. От выбора нужного образца до консультации по заполнению персональной информации и доставки в любое место страны — все под полным контролем качественных специалистов.
Для тех, кто пытается найти быстрый способ получить необходимый документ, наша услуга предлагает отличное решение. Приобрести диплом – значит избежать продолжительного процесса обучения и не теряя времени перейти к личным целям, будь то поступление в университет или старт карьеры.
adento.ru/289-vkladka-v-zub-pod-koronku.htmlВ
pikucha.ru/santexnika/polotencesushitel-i-stoyak/kuvshinka-rakovina.htmlВ
little-witch.ru/topic6118.htmlВ
kamcom.ru/index.php?id=12&gid=106В
pro-parovoz.ru/index.php/component/k2/97-%D0%B1%D0%B0%D0%B7%D0%B0-%D0%BF%D0%B0%D1%80%D0%BE%D0%B2%D0%BE%D0%B7%D0%B0.htmlВ
клининговые услуги минск [url=parkmebeli.by]parkmebeli.by[/url] .
Zet Casino Freispiele 2021: Alles, was Sie wissen mГјssen
Zet Casino ist eines der beliebtesten Online-Casinos für deutsche Spieler. Mit einer breiten Auswahl an Spielen und großzügigen Bonusangeboten zieht es immer mehr Glücksspielfans an. Ein besonders attraktives Angebot sind die Zet Casino Freispiele, die den Spielern die Möglichkeit bieten, ohne Einsatz von eigenem Geld zu gewinnen.
Im Jahr 2021 gibt es einige spannende Promotionen, die Freispiele im Zet Casino ermöglichen. Diese können auf verschiedene Arten erhalten werden, zum Beispiel als Teil eines Willkommensbonus für neue Spieler oder als Belohnung für treue Kunden. Oft werden Freispiele auch im Rahmen von Sonderaktionen vergeben, wie zum Beispiel an Feiertagen oder zu besonderen Anlässen.
Um von den Zet Casino Freispielen zu profitieren, müssen die Spieler in der Regel bestimmte Bedingungen erfüllen. Dazu gehört oft das Erreichen eines Mindestumsatzes oder das Einlösen eines speziellen Bonuscodes. Es ist wichtig, diese Anforderungen genau zu lesen, um Missverständnisse zu vermeiden und sicherzustellen, dass die Freispiele erfolgreich genutzt werden können.
Freispiele sind eine großartige Möglichkeit, um neue Spiele auszuprobieren und Ihre Gewinnchancen zu erhöhen, ohne zusätzliches Geld einzuzahlen. Wenn Sie regelmäßig im Zet Casino spielen, sollten Sie immer nach aktuellen Promotionen Ausschau halten, um keine Freispielmöglichkeiten zu verpassen. Mit etwas Glück und Geschick können Sie so Ihre Gewinne steigern und ein noch besseres Spielerlebnis im Zet Casino genießen.
https://zetcasino.one/
Came across a unique piece Ц be sure to check it out https://goruss.ru/blogs/369/¬аша-удача-ждет-здесь-ѕогрузитесь-в-мир-Betunlim
Gerakl24: Профессиональная Замена Фундамента, Венцов, Покрытий и Перемещение Домов
Фирма Gerakl24 профессионально занимается на предоставлении всесторонних сервисов по реставрации фундамента, венцов, покрытий и переносу строений в населённом пункте Красноярском регионе и за пределами города. Наша команда опытных мастеров обеспечивает высокое качество реализации различных типов восстановительных работ, будь то деревянные, с каркасом, из кирпича или бетонные дома.
Плюсы работы с Геракл24
Профессионализм и опыт:
Все работы проводятся только профессиональными специалистами, имеющими многолетний стаж в сфере возведения и восстановления строений. Наши специалисты знают свое дело и выполняют работу с безупречной точностью и учетом всех деталей.
Всесторонний подход:
Мы осуществляем разнообразные услуги по восстановлению и реконструкции строений:
Реставрация фундамента: усиление и реставрация старого основания, что гарантирует долговечность вашего строения и предотвратить проблемы, связанные с оседанием и деформацией.
Реставрация венцов: реставрация нижних венцов из дерева, которые чаще всего подвергаются гниению и разрушению.
Смена настилов: монтаж новых настилов, что значительно улучшает внешний вид и практическую полезность.
Перенос строений: безопасное и надежное перемещение зданий на новые локации, что помогает сохранить здание и предотвращает лишние расходы на возведение нового.
Работа с любыми видами зданий:
Деревянные дома: восстановление и укрепление деревянных конструкций, защита от гниения и вредителей.
Каркасные дома: укрепление каркасов и смена поврежденных частей.
Кирпичные дома: восстановление кирпичной кладки и укрепление стен.
Бетонные строения: реставрация и усиление бетонных элементов, устранение трещин и повреждений.
Надежность и долговечность:
Мы применяем лишь качественные материалы и современное оборудование, что гарантирует долговечность и надежность всех работ. Каждый наш проект проходят тщательную проверку качества на каждой стадии реализации.
Персонализированный подход:
Каждому клиенту мы предлагаем подходящие решения, с учетом всех особенностей и пожеланий. Мы стараемся, чтобы результат нашей работы полностью удовлетворял вашим запросам и желаниям.
Почему стоит выбрать Геракл24?
Работая с нами, вы получаете надежного партнера, который берет на себя все заботы по ремонту и реставрации вашего дома. Мы обеспечиваем выполнение всех работ в установленные сроки и с соблюдением всех правил и норм. Обратившись в Геракл24, вы можете не сомневаться, что ваш дом в надежных руках.
Мы всегда готовы проконсультировать и ответить на все ваши вопросы. Звоните нам, чтобы обсудить детали вашего проекта и узнать о наших сервисах. Мы сохраним и улучшим ваш дом, обеспечив его безопасность и комфорт на долгие годы.
Gerakl24 – ваш выбор для реставрации и ремонта домов в Красноярске и области.
thecolumbianews.net
texas-news.com
Ищете займ без отказа? [url=https://mikro-zaim-online.ru/]mikro-zaim-online.ru[/url] предлагает вам уникальную возможность получить деньги от новых и малоизвестных МФО 2024 года. Эти компании выдают займы на карту всем без исключения. Мы тщательно отслеживаем все новинки рынка, чтобы предложить вам самые актуальные и выгодные предложения. Наш сайт помогает быстро найти займ, который подойдет именно вам, без лишних проверок и отказов. Заходите на [url=https://mikro-zaim-online.ru/]mikro-zaim-online.ru[/url] и решите свои финансовые вопросы прямо сейчас!
Хочешь быстро получить займ? [url=https://mikro-zaim-online.ru/]mikro-zaim-online.ru[/url] поможет тебе найти самые выгодные предложения от надежных МФО. Наши специалисты ежедневно мониторят рынок, чтобы предложить тебе лучшие условия: займы без отказа, круглосуточно, под 0% и многое другое. Заходи на сайт и выбирай подходящий займ всего за несколько минут. Мы сделали все, чтобы тебе было легко и удобно! Не упусти свой шанс решить финансовые вопросы быстро и просто с нашей помощью.
Das Zet Casino lockt neue Spieler im Jahr 2019 mit spannenden No Deposit Bonus Codes. Diese Codes ermöglichen es Spielern, ohne eine Einzahlung zu tätigen, kostenlos im Casino zu spielen und dennoch echtes Geld zu gewinnen.
Der No Deposit Bonus ist eine beliebte Marketingstrategie von Online-Casinos, um neue Spieler anzulocken und von ihrem Angebot zu Гјberzeugen. Dabei erhalten Spieler nach der Registrierung einen Bonuscode, mit dem sie einen bestimmten Geldbetrag oder Freispiele erhalten, ohne zuvor Geld einzahlen zu mГјssen.
Im Zet Casino können Spieler mit den No Deposit Bonus Codes verschiedene Spiele ausprobieren und ihre Gewinnchancen testen, ohne dabei ihr eigenes Geld aufs Spiel setzen zu müssen. Auf diese Weise können Spieler das Casino risikofrei kennenlernen und sich von der Qualität und dem Umfang des Angebots überzeugen.
Die No Deposit Bonus Codes für das Zet Casino sind im Jahr 2019 besonders attraktiv und bieten Spielern die Möglichkeit, großartige Gewinne zu erzielen, ohne dafür Geld einzahlen zu müssen. Spieler sollten jedoch beachten, dass diese Bonuscodes in der Regel bestimmten Umsatzbedingungen unterliegen, die erfüllt werden müssen, bevor Gewinne ausgezahlt werden können.
Insgesamt sind No Deposit Bonus Codes eine großartige Möglichkeit für Spieler, neue Casinos auszuprobieren und ihre Gewinnchancen zu erhöhen, ohne dabei eigenes Geld riskieren zu müssen. Das Zet Casino bietet seinen Spielern im Jahr 2019 spannende No Deposit Bonus Codes, die es sich lohnt zu nutzen. Wer also auf der Suche nach einem neuen und aufregenden Online-Casino ist, sollte sich die aktuellen Bonusangebote nicht entgehen lassen.
https://zetcasino.one/
Нужны деньги без отказов? [url=https://mikro-zaim-online.ru/]mikro-zaim-online.ru[/url] — ваш надежный помощник! Мы собрали более 20 микрофинансовых организаций, которые готовы предоставить новым заемщикам займы под 0% на срок до 30 дней. Процесс оформления занимает всего 10 минут, а шансы на одобрение близки к 100%, даже без проверки кредитной истории. Наши эксперты выбрали лучшие предложения специально для вас. Заходите на [url=https://mikro-zaim-online.ru/]mikro-zaim-online.ru[/url] и решите свои финансовые вопросы быстро и удобно!
Boomerang Casino ist eine beliebte Online-Glücksspielplattform, die eine Vielzahl von Spielen und Funktionen für Spieler weltweit anbietet. Um alle Dienste nutzen zu können, benötigen Spieler jedoch bestimmte Dokumente für die Verifizierung ihres Kontos. Diese Dokumentation ist notwendig, um die Identität des Spielers zu überprüfen und sicherzustellen, dass das Konto legal betrieben wird.
Die erforderlichen Dokumente können je nach Land und Gesetzgebung variieren, aber in der Regel umfassen sie eine Kopie des Personalausweises oder Reisepasses, eine aktuelle Rechnung zur Bestätigung der Adresse und gegebenenfalls eine Kopie der Kreditkarte oder anderer Zahlungsmethoden.
Die Überprüfung der Dokumente ist ein wichtiger Schutzmechanismus für Spieler und das Casino gleichermaßen. Sie stellt sicher, dass keine betrügerischen Aktivitäten stattfinden und dass das Spielerkonto sicher ist.
Spieler sollten darauf achten, dass sie qualitativ hochwertige Kopien der Dokumente einreichen, um den Verifizierungsprozess zu beschleunigen. Sobald die Dokumente akzeptiert wurden, können Spieler alle Funktionen des Casinos nutzen, einschließlich Ein- und Auszahlungen, Boni und Aktionen.
Insgesamt ist die Dokumentation bei Boomerang Casino eine einfache und notwendige Maßnahme, um ein sicheres und verantwortungsbewusstes Spielumfeld zu gewährleisten. Spieler sollten darauf achten, die erforderlichen Dokumente so schnell wie möglich einzureichen, um keine Verzögerungen bei ihren Transaktionen zu erleben.
https://boomerangcasino.one/
Ищете выгодные займы? [url=https://mikro-zaim-online.ru/]mikro-zaim-online.ru[/url] собрал для вас уникальные предложения! Более 20 микрофинансовых организаций предлагают новым заемщикам займы под 0% на срок до 30 дней. Заполнение заявки занимает всего 10 минут, и практически всем одобряют, даже без проверки кредитной истории. Наши специалисты отобрали самые надежные варианты, чтобы вы могли быстро и легко получить нужные средства. Посетите [url=https://mikro-zaim-online.ru/]mikro-zaim-online.ru[/url] и убедитесь, что получить займ может быть просто и выгодно!
This offer is accompanied by photographs of hotels greenhousebali.com where tourists can be found. There is the exterior of the building, the interiors of the rooms, photos of the territory and individual objects.
A person can configure the system oknews360.com independently or contact an organization to use the feature, focusing on their tools.
Casino Zet – Ein aufregendes Online-Casino-Erlebnis
Das Casino Zet ist eine der führenden Online-Glücksspielplattformen, die Spielern aus der ganzen Welt ein aufregendes und unterhaltsames Casino-Erlebnis bieten. Mit einer Vielzahl von Spielen, großzügigen Boni und einer benutzerfreundlichen Oberfläche ist das Casino Zet die perfekte Wahl für alle, die eine unterhaltsame und spannende Zeit beim Spielen von Casino-Spielen online suchen.
Das Casino Zet bietet eine beeindruckende Auswahl an Spielen, darunter Slots, Tischspiele, Live-Casino-Spiele und vieles mehr. Mit Spielen von fГјhrenden Softwareanbietern wie NetEnt, Microgaming, Play’n GO und vielen anderen kГ¶nnen die Spieler sicher sein, dass sie ein erstklassiges Spielerlebnis genieГџen werden. Ob Sie ein Fan von klassischen Spielautomaten, Roulette, Blackjack oder Poker sind, im Casino Zet finden Sie garantiert ein Spiel, das Ihren Vorlieben entspricht.
Darüber hinaus bietet das Casino Zet seinen Spielern großzügige Boni und Promotionen, die ihnen helfen, ihr Spielerlebnis zu maximieren. Von Willkommensboni über Einzahlungsboni bis hin zu Freispielen gibt es viele Möglichkeiten, zusätzliches Guthaben zu erhalten und die Gewinnchancen zu erhöhen. Das Casino Zet belohnt auch treue Spieler mit einem exklusiven VIP-Programm, das zusätzliche Belohnungen und Vergünstigungen bietet. Mit so vielen Boni und Angeboten können die Spieler sicher sein, dass sie immer das Beste aus ihrem Casino-Zet-Erlebnis herausholen.
Die Benutzerfreundlichkeit und das Design des Casino Zet machen das Online-Spielen einfach und bequem. Mit einem responsiven Design, das auf allen Geräten gut aussieht und reibungslos funktioniert, können die Spieler von überall aus spielen, sei es auf dem Desktop, Tablet oder Smartphone. Darüber hinaus bietet das Casino Zet eine sichere und geschützte Spielumgebung, in der die Spieler ihre Lieblingsspiele ohne Sorgen genießen können.
Insgesamt bietet das Casino Zet alles, was ein Spieler für ein erstklassiges Online-Casino-Erlebnis benötigt. Mit einer beeindruckenden Auswahl an Spielen, großzügigen Boni, einem benutzerfreundlichen Design und einer sicheren Spielumgebung ist das Casino Zet die perfekte Wahl für alle, die nach Spannung und Unterhaltung suchen. Besuchen Sie das Casino Zet noch heute und erleben Sie die aufregende Welt des Online-Glücksspiels!
https://zetcasino.one/
darknet market list [url=https://mydarknetmarketlinks.com/ ]free dark web [/url] dark websites
Connecting handsets to communicate with people dallasrentapart.com. You need to consider what devices people will be using to contact support.
The vibrant energy of spring comes to life event-miami24.com against a backdrop of sun-drenched beaches and pulsating rhythms. This is the perfect time to provide everything Miami and Miami Beach hospitals have to offer.
Discovered an article that will surely interest you Ц I recommend checking it out http://startinvest.2bb.ru/viewtopic.php?id=10276#p53591
Tipico Casino NJ ist eine neues Online-Casino in New Jersey, das Spielern ein aufregendes und sicheres Spielerlebnis bietet. Das Casino, das von der bekannten Marke Tipico betrieben wird, bietet Spielern eine Vielzahl von Spieloptionen, darunter Spielautomaten, Tischspiele und Live-Dealer-Spiele.
Ein wichtiger Aspekt von Tipico Casino NJ ist die Sicherheit der Spieler. Das Casino verwendet die neueste Technologie, um sicherzustellen, dass alle persönlichen Daten und Transaktionen der Spieler geschützt sind. Spieler können also beruhigt sein, dass ihre Informationen sicher sind, während sie ihre Lieblingsspiele genießen.
Ein weiterer großer Vorteil von Tipico Casino NJ ist die große Auswahl an Spielen, die es Spielern bietet. Von klassischen Spielautomaten bis hin zu verschiedenen Varianten von Blackjack, Roulette und anderen Tischspielen gibt es für jeden Spieler etwas zu entdecken. Darüber hinaus bietet das Casino auch Live-Dealer-Spiele, die ein authentisches Casino-Erlebnis bieten und es den Spielern ermöglichen, mit echten Dealern und anderen Spielern zu interagieren.
Tipico Casino NJ bietet auch großzügige Boni und Aktionen für neue und bestehende Spieler an. Von Willkommensboni über Einzahlungsboni bis hin zu Treueprogrammen gibt es viele Möglichkeiten, um zusätzliches Geld und Belohnungen zu verdienen. Diese Boni können Spielern helfen, ihr Guthaben zu erhöhen und mehr Zeit mit ihren Lieblingsspielen zu verbringen.
Insgesamt ist Tipico Casino NJ eine groГџartige Option fГјr Spieler in New Jersey, die ein erstklassiges Online-Casino-Erlebnis suchen. Mit einer breiten Palette von Spielen, erstklassiger Sicherheit und lukrativen Boni ist das Casino eine gute Wahl fГјr alle, die SpaГџ und Spannung suchen. Besuchen Sie noch heute Tipico Casino NJ und beginnen Sie mit dem Spielen!
https://tipicocasino.one/
blibli
Tipico ist vielen sicherlich als Sportwettenanbieter bekannt. Doch nun erweitert das Unternehmen sein Portfolio und steigt in das Geschäft mit Online-Casinos ein. Ab sofort können Spieler auch im tipico neuen Casino ihr Glück versuchen.
Das Casino bietet eine Vielzahl von Spielen, darunter Slots, Tisch- und Kartenspiele sowie Live-Casino-Spiele. Die Spiele stammen von renommierten Anbietern wie NetEnt, Microgaming und Evolution Gaming und garantieren ein sicheres und unterhaltsames Spielerlebnis. Zudem können die Spieler von lukrativen Boni und Aktionen profitieren, die regelmäßig angeboten werden.
Das tipico neue Casino überzeugt nicht nur mit seinem umfangreichen Spieleangebot, sondern auch mit einem benutzerfreundlichen Design und einer intuitiven Bedienung. Die Webseite ist übersichtlich gestaltet und ermöglicht es den Spielern, schnell und einfach zu ihren Lieblingsspielen zu gelangen.
Ein weiterer Vorteil des tipico neuen Casinos ist die Sicherheit. Das Unternehmen verfügt über eine Lizenz der Malta Gaming Authority und unterliegt daher strengen Auflagen und Kontrollen. Die Spieler können also sicher sein, dass ihre Daten und ihr Geld in guten Händen sind.
Insgesamt bietet das tipico neue Casino eine erstklassige Spielerfahrung und ist definitiv einen Besuch wert. Wenn Sie also auf der Suche nach einem neuen Online-Casino sind, sollten Sie es auf jeden Fall einmal ausprobieren. Viel SpaГџ und viel GlГјck!
https://tipicocasino.one/
1249742
Came across an interesting article, I propose you have a look http://sport-faq.ru/budushhee-v-tvoih-rukah-kupi-diplom-i-realizuy-svoi-ambitsii
сколько будет стоить такси заказать такси дешево.
darkmarkets [url=https://mydarknetmarketlinks.com/ ]darkmarket [/url] darknet site
repairdesign24.com
chinaone.net
Решил сделать родителям сюрприз, но не хватало средств. Нашел телеграм-канал [url=https://t.me/s/new_mfo_2024]новые и малоизвестные МФО 2024[/url], где выкладывают новые МФО. Займ получил быстро и без проблем. Особенно понравилось, что для новых клиентов есть акции под 0%. В канале много полезной информации про займы. Очень доволен, рекомендую всем, кто ищет быстрый и удобный займ!
Моя стиральная машина сломалась, а деньги на ремонт нужны были срочно. На телеграм-канале [url=https://t.me/s/new_mfo_2024]новые и малоизвестные МФО 2024[/url] нашел множество МФО, где предлагают займы на карту без отказа и круглосуточно. Понравилось, что займ могут получить все от 18 лет. Оформил заявку и уже через несколько минут деньги были на карте. Это помогло мне быстро починить технику. Очень удобный канал, рекомендую всем, кому нужны срочные деньги!
Boomerang Casino ist ein aufstrebendes Online-Casino, das sich immer größerer Beliebtheit erfreut. Die Plattform hat eine breite Auswahl an Spielen, großzügige Boni und eine benutzerfreundliche Benutzeroberfläche, die es den Spielern erleichtert, ihre Lieblingsspiele zu finden und zu spielen. Aber was sagen die Spieler wirklich über Boomerang Casino? In diesem Artikel werfen wir einen Blick auf die Bewertungen von Boomerang Casino und sehen, ob das Casino seinen wachsenden Ruf verdient.
Die Bewertungen von Boomerang Casino sind größtenteils positiv. Viele Spieler loben die groГџe Auswahl an Spielen, die von bekannten Anbietern wie NetEnt, Microgaming und Play’n GO bereitgestellt werden. Von Slots Гјber Tischspiele bis hin zu Live-Casino-Spielen gibt es fГјr jeden Geschmack etwas zu entdecken. Die BenutzeroberflГ¤che wird als intuitiv und benutzerfreundlich gelobt, was es selbst AnfГ¤ngern leicht macht, sich zurechtzufinden.
Ein weiterer Pluspunkt für Boomerang Casino sind die großzügigen Boni und Promotionen, die regelmäßig angeboten werden. Neue Spieler können sich über Willkommensboni freuen, während treue Spieler von regelmäßigen Promotions profitieren können. Die Umsatzbedingungen sind fair und transparent, was ebenfalls positiv hervorgehoben wird.
Einige Spieler haben jedoch auch negative Erfahrungen mit Boomerang Casino gemacht. Einige Nutzer berichten von technischen Problemen und Verzögerungen bei Auszahlungen. Dies sind jedoch Einzelfälle und das Casino arbeitet kontinuierlich daran, die Qualität des Services zu verbessern.
Insgesamt können wir sagen, dass die überwiegende Mehrheit der Spieler mit Boomerang Casino zufrieden ist. Die große Auswahl an Spielen, großzügige Boni und eine benutzerfreundliche Benutzeroberfläche machen das Casino zu einer attraktiven Option für alle, die nach einem unterhaltsamen und sicheren Online-Casino suchen. Wir empfehlen Boomerang Casino für Spieler aller Erfahrungsstufen.
https://boomerangcasino.one/
Das Boomerang Casino ist ein Online-Casino, das sich in der Glücksspielbranche einen Namen gemacht hat. Viele Spieler fragen sich, ob das Boomerang Casino seriös ist und ob sie dort sicher spielen können. In diesem Artikel werden wir diese Fragen genauer unter die Lupe nehmen.
Das Boomerang Casino ist in Curacao lizenziert und reguliert, was bedeutet, dass es strenge Richtlinien einhalten muss, um sicherzustellen, dass alle Spiele fair sind und die Spieler vor betrügerischen Aktivitäten geschützt sind. Darüber hinaus verwendet das Boomerang Casino die neueste SSL-Verschlüsselungstechnologie, um sicherzustellen, dass alle persönlichen und finanziellen Daten der Spieler geschützt sind.
Das Boomerang Casino bietet eine Vielzahl von Zahlungsmethoden an, darunter Kreditkarten, E-Wallets und Banküberweisungen, um sicherzustellen, dass die Spieler bequem und sicher Ein- und Auszahlungen tätigen können. Darüber hinaus bietet das Boomerang Casino einen 24-Stunden-Kundensupport, der per E-Mail, Live-Chat und Telefon erreichbar ist, um alle Fragen und Probleme der Spieler zu lösen.
In Bezug auf die Spiele bietet das Boomerang Casino eine breite Auswahl an Spielautomaten, Tischspielen und Live-Dealer-Spielen von führenden Softwareanbietern wie NetEnt, Microgaming und Evolution Gaming an. Alle Spiele werden regelmäßig von unabhängigen Testagenturen überprüft, um sicherzustellen, dass sie fair und zufällig sind.
Zusammenfassend lässt sich sagen, dass das Boomerang Casino ein seriöser und vertrauenswürdiger Anbieter ist, der den Spielern ein sicheres und unterhaltsames Spielerlebnis bietet. Spieler können also beruhigt sein, dass sie bei Boomerang Casino sicher spielen können.
https://boomerangcasino.one/
В нашем мире, где диплом – это начало успешной карьеры в любой отрасли, многие ищут максимально простой путь получения образования. Важность наличия официального документа трудно переоценить. Ведь диплом открывает дверь перед людьми, стремящимися начать трудовую деятельность или учиться в ВУЗе.
Мы предлагаем максимально быстро получить этот необходимый документ. Вы сможете купить диплом, и это является выгодным решением для всех, кто не смог завершить образование или утратил документ. дипломы производятся с особой аккуратностью, вниманием к мельчайшим элементам. В результате вы сможете получить полностью оригинальный документ.
Плюсы такого решения заключаются не только в том, что вы сможете быстро получить свой диплом. Процесс организован удобно, с нашей поддержкой. Начиная от выбора подходящего образца документа до консультаций по заполнению личной информации и доставки по стране — все находится под абсолютным контролем наших специалистов.
Всем, кто хочет найти быстрый и простой способ получить необходимый документ, наша компания предлагает отличное решение. Заказать диплом – это значит избежать длительного обучения и не теряя времени переходить к достижению личных целей, будь то поступление в университет или начало карьеры.
http://www.8saksx-diploms.com/
Срочно понадобились деньги на ремонт автомобиля, а свободных средств не было. Нашел телеграм-канал [url=https://t.me/s/new_mfo_2024]новые и малоизвестные МФО 2024[/url], где собраны новые МФО, предоставляющие займы на карту без отказа и круглосуточно. Даже с плохой кредитной историей получил одобрение и деньги на карту за считанные минуты. Это позволило быстро починить машину и вернуться к обычному ритму жизни. Рекомендую этот канал всем, кто ищет быстрые и удобные займы!
В нашем обществе, где диплом является началом удачной карьеры в любом направлении, многие ищут максимально простой путь получения образования. Наличие документа об образовании переоценить попросту невозможно. Ведь именно диплом открывает дверь перед любым человеком, желающим вступить в профессиональное сообщество или продолжить обучение в высшем учебном заведении.
В данном контексте наша компания предлагает очень быстро получить этот важный документ. Вы имеете возможность заказать диплом, и это будет удачным решением для всех, кто не смог закончить обучение, потерял документ или хочет исправить свои оценки. диплом изготавливается аккуратно, с особым вниманием к мельчайшим нюансам. В результате вы получите продукт, полностью соответствующий оригиналу.
Преимущества данного решения заключаются не только в том, что можно оперативно получить диплом. Весь процесс организован удобно и легко, с профессиональной поддержкой. От выбора требуемого образца до консультаций по заполнению персональной информации и доставки по стране — все под полным контролем опытных мастеров.
Всем, кто ищет оперативный способ получения требуемого документа, наша услуга предлагает отличное решение. Купить диплом – это значит избежать длительного процесса обучения и не теряя времени перейти к важным целям, будь то поступление в ВУЗ или старт карьеры.
photodoska.ru/moscow/uslugi/obuchenie/attestaty-diplomy-i-drugie-dokumenty-ob-obrazovanii-3192585В
vaden-pro.ru/spravochniki/html/atribut/balanceВ
azat.on.kg/blogs/515/%D0%9A%D0%B0%D0%BA-%D0%BF%D1%80%D0%B8%D0%BE%D0%B1%D1%80%D0%B5%D1%81%D1%82%D0%B8-%D0%B4%D0%B8%D0%BF%D0%BB%D0%BE%D0%BC-%D0%B8%D0%BB%D0%B8-%D0%B6%D0%B5-%D0%B0%D1%82%D1%82%D0%B5%D1%81%D1%82%D0%B0%D1%82-%D1%83-%D0%BD%D0%B0%D1%81-%D0%B2-%D0%BE%D0%BD%D0%BB%D0%B0%D0%B9%D0%BDВ
http://www.rohitab.com/discuss/user/2088971-premiumsdiploms/?tab=friendsВ
gymn-1.ru/raspisanie/В
В нашем обществе, где диплом – это начало удачной карьеры в любой области, многие пытаются найти максимально простой путь получения качественного образования. Наличие официального документа об образовании трудно переоценить. Ведь именно он открывает двери перед всеми, кто стремится вступить в сообщество профессионалов или продолжить обучение в высшем учебном заведении.
Предлагаем быстро получить этот необходимый документ. Вы имеете возможность заказать диплом нового или старого образца, и это является выгодным решением для человека, который не смог закончить обучение или утратил документ. Все дипломы изготавливаются с особой аккуратностью, вниманием ко всем деталям, чтобы в результате получился полностью оригинальный документ.
Преимущества такого решения заключаются не только в том, что вы оперативно получите свой диплом. Весь процесс организовывается удобно, с профессиональной поддержкой. Начиная от выбора подходящего образца до грамотного заполнения персональной информации и доставки в любой регион страны — все под полным контролем опытных мастеров.
Для всех, кто ищет быстрый способ получить необходимый документ, наша услуга предлагает отличное решение. Приобрести диплом – значит избежать продолжительного обучения и сразу перейти к достижению своих целей: к поступлению в университет или к началу трудовой карьеры.
http://diploman-russiann.com/
проверка usdt trc20
Как охранять свои личные данные: берегитесь утечек информации в интернете. Сегодня обеспечение безопасности своих данных становится всё значимее важной задачей. Одним из наиболее часто встречающихся способов утечки личной информации является слив «сит фраз» в интернете. Что такое сит фразы и как защититься от их утечки? Что такое «сит фразы»? «Сит фразы» — это сочетания слов или фраз, которые бывают используются для доступа к различным онлайн-аккаунтам. Эти фразы могут включать в себя имя пользователя, пароль или дополнительные конфиденциальные данные. Киберпреступники могут пытаться получить доступ к вашим аккаунтам, с помощью этих сит фраз. Как защитить свои личные данные? Используйте запутанные пароли. Избегайте использования легких паролей, которые просто угадать. Лучше всего использовать комбинацию букв, цифр и символов. Используйте уникальные пароли для всего аккаунта. Не используйте один и тот же пароль для разных сервисов. Используйте двухфакторную аутентификацию (2FA). Это прибавляет дополнительный уровень безопасности, требуя подтверждение входа на ваш аккаунт по другое устройство или метод. Будьте осторожны с онлайн-сервисами. Не доверяйте персональную информацию ненадежным сайтам и сервисам. Обновляйте программное обеспечение. Установите обновления для вашего операционной системы и программ, чтобы защитить свои данные от вредоносного ПО. Вывод Слив сит фраз в интернете может спровоцировать серьезным последствиям, таким подобно кража личной информации и финансовых потерь. Чтобы сохранить себя, следует принимать меры предосторожности и использовать надежные методы для хранения и управления своими личными данными в сети
האפליקציה הינה אפליקציה פופולרית בארץ לרכישת קנאביס באופן אינטרנטי. זו נותנת ממשק פשוט לשימוש ובטוח לקנייה ולקבלת משלוחים מ פריטי קנאביס שונים. בסקירה זו נבחן עם העיקרון מאחורי הפלטפורמה, איך היא עובדת ומה היתרונות מ השימוש בזו.
מהי טלגראס?
האפליקציה היא שיטה לרכישת קנאביס באמצעות היישומון טלגראם. זו מבוססת מעל ערוצים וקבוצות טלגרם מיוחדות הנקראות ״טלגראס כיוונים, שם ניתן להרכיב מרחב מוצרי קנאביס ולקבלת אותם ישירותית למשלוח. הערוצים אלו מסודרים על פי איזורים גיאוגרפיים, כדי להקל את קבלתם של המשלוחים.
איך זאת עובד?
התהליך פשוט יחסית. ראשית, צריך להצטרף לערוץ הטלגראס הרלוונטי לאזור המחיה. שם אפשר לעיין בתפריטי הפריטים המגוונים ולהזמין עם הפריטים המבוקשים. לאחר ביצוע ההזמנה וסיום התשלום, השליח יגיע בכתובת שנרשמה ועמו החבילה שהוזמן.
מרבית ערוצי הטלגראס מציעים טווח נרחב של מוצרים – סוגי מריחואנה, עוגיות, משקאות ועוד. בנוסף, ניתן לראות חוות דעת מ צרכנים קודמים לגבי איכות הפריטים והשרות.
יתרונות הנעשה בטלגראס
מעלה עיקרי מ האפליקציה הוא הנוחיות והפרטיות. ההרכבה והתהליך מתבצעות ממרחק מאיזשהו מקום, בלי נחיצות בהתכנסות פנים אל פנים. בנוסף, האפליקציה מוגנת ביסודיות ומבטיחה סודיות גבוה.
נוסף אל זאת, עלויות הפריטים בפלטפורמה נוטות לבוא תחרותיים, והשילוחים מגיעים במהירות ובמסירות רבה. קיים אף מרכז תמיכה פתוח לכל שאלה או בעיית.
לסיכום
טלגראס הווה שיטה חדשנית ויעילה לקנות מוצרי מריחואנה במדינה. היא משלבת בין הנוחות הטכנולוגית של היישומון הפופולרי, ועם הזריזות והדיסקרטיות מ דרך השילוח הישירות. ככל שהדרישה לקנאביס גובר, אפליקציות בדוגמת זו צפויות להמשיך ולצמוח.
Tipico Casino Manipuliert: Wahrheit oder Fiktion?
In den letzten Wochen ist eine Diskussion über die Zuverlässigkeit des Tipico Casinos entbrannt. Einige Spieler behaupten, dass das Casino manipuliert sei und die Gewinnchancen zugunsten des Hauses verzerrt seien. Doch handelt es sich dabei tatsächlich um Fakten oder nur um Gerüchte?
Tipico ist einer der bekanntesten Anbieter von Online-Glücksspielen in Deutschland und genießt einen hervorragenden Ruf in der Branche. Das Unternehmen ist offiziell lizenziert und reguliert, was bedeutet, dass sie strikten Vorschriften und Kontrollen unterliegen, um die Integrität ihrer Spiele sicherzustellen. Darüber hinaus wird das Casino regelmäßig von unabhängigen Prüforganisationen überprüft, um die Fairness der Spiele zu gewährleisten.
Es ist wichtig zu beachten, dass Glücksspiele grundsätzlich mit einem Risiko verbunden sind und es keine Garantie für einen Gewinn gibt. Die Gewinnchancen werden von einem Zufallsgenerator bestimmt, der sicherstellt, dass die Ergebnisse der Spiele fair und zufällig sind. Es ist möglich, dass Spieler Pech haben und Verluste erleiden, aber das bedeutet nicht automatisch, dass das Casino manipuliert ist.
Wenn Spieler der Meinung sind, dass sie unfair behandelt werden, können sie dies jederzeit beim Kundenservice des Tipico Casinos melden. Das Unternehmen ist daran interessiert, seine Kunden zufriedenzustellen und wird Beschwerden ernsthaft prüfen, um sicherzustellen, dass alles korrekt und transparent abläuft.
Insgesamt kann gesagt werden, dass die Behauptungen über eine Manipulation des Tipico Casinos bisher nicht durch konkrete Beweise gestützt werden konnten. Es ist wichtig, verantwortungsbewusst zu spielen und sich über die Risiken des Glücksspiels im Klaren zu sein. Wer Zweifel hat, sollte sich an den Kundenservice des Casinos wenden und seine Bedenken äußern. Nur so kann eine vertrauensvolle Beziehung zwischen Spielern und Anbieter gewährleistet werden.
https://tipicocasino.one/
вызвать такси [url=https://taksi-vyzvat.ru/]вызвать такси[/url] .
В нашем обществе, где диплом становится началом успешной карьеры в любой сфере, многие пытаются найти максимально быстрый путь получения качественного образования. Факт наличия официального документа об образовании трудно переоценить. Ведь диплом открывает двери перед всеми, кто стремится вступить в профессиональное сообщество или продолжить обучение в высшем учебном заведении.
В данном контексте мы предлагаем максимально быстро получить любой необходимый документ. Вы сможете приобрести диплом нового или старого образца, что становится выгодным решением для человека, который не смог завершить образование, потерял документ или хочет исправить свои оценки. диплом изготавливается аккуратно, с максимальным вниманием к мельчайшим элементам. В результате вы получите продукт, максимально соответствующий оригиналу.
Превосходство подобного подхода состоит не только в том, что можно оперативно получить диплом. Весь процесс организовывается удобно, с нашей поддержкой. Начав от выбора нужного образца до консультации по заполнению персональных данных и доставки по стране — все под абсолютным контролем квалифицированных мастеров.
В итоге, для всех, кто ищет оперативный способ получить требуемый документ, наша услуга предлагает отличное решение. Купить диплом – это значит избежать продолжительного процесса обучения и не теряя времени переходить к личным целям, будь то поступление в ВУЗ или начало карьеры.
http://diplomans-russia.com/
Its like you read my mind! You appear to know a lot about this, like you wrote the book in it or something. I think that you could do with some pics to drive the message home a bit, but instead of that, this is great blog. An excellent read. I’ll certainly be back.
http://9saksx-diploms24.com/
Bản cài đặt B29 IOS – Giải pháp vượt trội cho các tín đồ iOS
Trong thế giới công nghệ đầy sôi động hiện nay, trải nghiệm người dùng luôn là yếu tố then chốt. Với sự ra đời của Bản cài đặt B29 IOS, người dùng sẽ được hưởng trọn vẹn những tính năng ưu việt, mang đến sự hài lòng tuyệt đối. Hãy cùng khám phá những ưu điểm vượt trội của bản cài đặt này!
Tính bảo mật tối đa
Bản cài đặt B29 IOS được thiết kế với mục tiêu đảm bảo an toàn dữ liệu tuyệt đối cho người dùng. Nhờ hệ thống mã hóa hiện đại, thông tin cá nhân và dữ liệu nhạy cảm của bạn luôn được bảo vệ an toàn khỏi những kẻ xâm nhập trái phép.
Trải nghiệm người dùng đỉnh cao
Giao diện thân thiện, đơn giản nhưng không kém phần hiện đại, B29 IOS mang đến cho người dùng trải nghiệm duyệt web, truy cập ứng dụng và sử dụng thiết bị một cách trôi chảy, mượt mà. Các tính năng thông minh được tối ưu hóa, giúp nâng cao hiệu suất và tiết kiệm pin đáng kể.
Tính tương thích rộng rãi
Bản cài đặt B29 IOS được phát triển với mục tiêu tương thích với mọi thiết bị iOS từ các dòng iPhone, iPad cho đến iPod Touch. Dù là người dùng mới hay lâu năm của hệ điều hành iOS, B29 đều mang đến sự hài lòng tuyệt đối.
Quá trình cài đặt đơn giản
Với những hướng dẫn chi tiết, việc cài đặt B29 IOS trở nên nhanh chóng và dễ dàng. Chỉ với vài thao tác đơn giản, bạn đã có thể trải nghiệm ngay tất cả những tính năng tuyệt vời mà bản cài đặt này mang lại.
Bản cài đặt B29 IOS không chỉ là một bản cài đặt đơn thuần, mà còn là giải pháp công nghệ hiện đại, nâng tầm trải nghiệm người dùng lên một tầm cao mới. Hãy trở thành một phần của cộng đồng sử dụng B29 IOS để khám phá những tiện ích tuyệt vời mà nó có thể mang lại!
Online Casinos sind heutzutage sehr beliebt und bieten eine Vielzahl von Spielen fГјr Spieler aller Art. Eines dieser Online Casinos ist Zet Casino, das eine Vielzahl von Spielen und Boni fГјr seine Spieler bietet.
Zet Casino wurde im Jahr 2018 gegrГјndet und hat sich seitdem zu einer beliebten Online-GlГјcksspielseite entwickelt. Das Casino bietet eine groГџe Auswahl an Spielen, darunter Spielautomaten, Tischspiele, Live-Casino-Spiele und vieles mehr.
Ein großer Vorteil von Zet Casino ist, dass es sowohl auf Desktop- als auch auf mobilen Geräten gespielt werden kann. Dies bedeutet, dass Spieler ihre Lieblingsspiele überall und jederzeit genießen können, solange sie eine Internetverbindung haben.
Das Casino bietet außerdem großzügige Boni und Promotionen für neue und bestehende Spieler an. Dies kann in Form von Einzahlungsboni, Freispielen oder Cashback-Angeboten erfolgen. Spieler können auch am Treueprogramm teilnehmen, um zusätzliche Belohnungen zu erhalten.
Zet Casino verfügt über eine gültige Glücksspiellizenz und verwendet die neueste SSL-Verschlüsselungstechnologie, um die Sicherheit der Spieler zu gewährleisten. Dies bedeutet, dass Spieler ihre persönlichen und finanziellen Informationen ohne Bedenken preisgeben können.
Insgesamt bietet Zet Casino ein unterhaltsames und sicheres Spielerlebnis fГјr alle, die gerne in Online-Casinos spielen. Mit einer groГџen Spielauswahl, groГџzГјgigen Boni und einer benutzerfreundlichen Plattform ist Zet Casino definitiv einen Besuch wert.
https://zetcasino.one/
В нашем мире, где диплом – это начало удачной карьеры в любом направлении, многие стараются найти максимально быстрый и простой путь получения образования. Наличие официального документа переоценить невозможно. Ведь именно он открывает двери перед людьми, стремящимися начать трудовую деятельность или продолжить обучение в любом ВУЗе.
В данном контексте мы предлагаем очень быстро получить этот необходимый документ. Вы имеете возможность приобрести диплом, и это становится выгодным решением для всех, кто не смог закончить обучение, утратил документ или желает исправить плохие оценки. диплом изготавливается аккуратно, с максимальным вниманием к мельчайшим деталям. На выходе вы получите 100% оригинальный документ.
Плюсы этого подхода заключаются не только в том, что вы оперативно получите свой диплом. Весь процесс организовывается удобно и легко, с профессиональной поддержкой. От выбора подходящего образца до точного заполнения личных данных и доставки в любой регион России — все под полным контролем качественных мастеров.
Всем, кто хочет найти быстрый и простой способ получения необходимого документа, наша услуга предлагает отличное решение. Приобрести диплом – значит избежать долгого процесса обучения и сразу перейти к своим целям, будь то поступление в ВУЗ или начало карьеры.
4russkiy365-diploms.com
Ein Casino Bonus ist eine großartige Möglichkeit, um zusätzliches Guthaben für das Spielen in einem Online Casino zu erhalten. Viele Online Casinos bieten verschiedene Arten von Boni an, die den Spielern zugutekommen können. Einer der beliebtesten Anbieter von Casino Boni ist Tipico.
Tipico ist bekannt für seine großzügigen Bonusangebote, die es den Spielern ermöglichen, ihr Guthaben zu erhöhen und mehr Chancen auf Gewinne zu haben. Einer der häufigsten Fragen, die Spieler haben, ist, wie sie ihren Casino Bonus bei Tipico auszahlen können.
Um einen Casino Bonus bei Tipico auszahlen zu können, müssen die Spieler zunächst die Umsatzbedingungen erfüllen. Diese Bedingungen legen fest, wie oft der Bonus in Spielen umgesetzt werden muss, bevor er ausgezahlt werden kann. Es ist wichtig, die Umsatzbedingungen zu beachten, um sicherzustellen, dass der Bonus nicht verfällt und die Spieler ihre Gewinne behalten können.
Sobald die Umsatzbedingungen erfüllt sind, können die Spieler den Casino Bonus bei Tipico auszahlen lassen. Dazu müssen sie sich in ihr Spielerkonto einloggen und den entsprechenden Bereich für Auszahlungen aufrufen. Dort können sie den Betrag auswählen, den sie auszahlen möchten, und die gewünschte Zahlungsmethode angeben.
Es ist zu beachten, dass die Auszahlungsdauer je nach Zahlungsmethode variieren kann. Spieler sollten sich daher im Voraus informieren, wie lange es dauern kann, bis das Geld auf ihrem Konto gutgeschrieben wird.
Insgesamt bietet Tipico seinen Spielern eine einfache und transparente Möglichkeit, ihren Casino Bonus auszuzahlen. Mit klaren Umsatzbedingungen und einer Vielzahl von Zahlungsmethoden können die Spieler sicher sein, dass sie ihr Bonusguthaben problemlos nutzen können. Mit etwas Glück und Geschick können die Spieler so ihre Gewinne maximieren und das Beste aus ihrem Casino Bonus machen.
https://tipicocasino.one/
На [url=https://mikro-zaim-online.ru/]mikro-zaim-online.ru[/url] вы найдете актуальные предложения от новых и малоизвестных МФО 2024 года, которые выдают займы на карту без отказов. Мы тщательно отбираем МФО, чтобы предоставить вам только лучшие условия для получения денег. Наши специалисты следят за всеми новинками на рынке микрозаймов, чтобы вы могли получить средства быстро и без лишних хлопот. Посетите наш сайт и выберите займ от надежной МФО, которая не откажет. С [url=https://mikro-zaim-online.ru/]mikro-zaim-online.ru[/url] ваши финансовые проблемы решаются легко и быстро!
вызов такси по телефону [url=http://www.taksi-vyzvat.ru]вызов такси по телефону[/url] .
In den letzten Jahren hat sich Cashback zu einer Г¤uГџerst beliebten Art des Bonusangebots in Online-Casinos entwickelt. Eine der Plattformen, die dieses Angebot anbietet, ist das Zet Casino.
Bei Zet Casino können Spieler eine Vielzahl von Cashback-Angeboten nutzen, um einen Teil ihrer Verluste zurückzuerobern. Dies bedeutet, dass Spieler, selbst wenn sie nicht im Glück sind und Verluste erleiden, einen Teil ihres Einsatzes zurückerhalten können. Dies ist besonders attraktiv für Spieler, die gerne länger spielen möchten, ohne ständig Geld nachzuschießen.
Das Cashback-Angebot von Zet Casino funktioniert in der Regel auf wöchentlicher Basis und richtet sich nach dem nettoverlust eines Spielers in dieser Woche. Je nach Spielverhalten und Einsätzen kann der Cashback-Betrag variieren, sodass Spieler mit höheren Einsätzen einen höheren Cashback-Betrag erhalten können.
Das Cashback-Angebot von Zet Casino ist eine großartige Möglichkeit für Spieler, ihr Spiel zu verlängern und Verluste wieder zurückzugewinnen. Es ist jedoch wichtig zu beachten, dass Cashback nicht immer in Echtgeld ausgezahlt wird, sondern oft als Bonusguthaben gutgeschrieben wird, das vor der Auszahlung bestimmte Bedingungen erfüllen muss.
Insgesamt ist das Cashback-Angebot von Zet Casino eine attraktive Möglichkeit für Spieler, mehr aus ihrem Spiel herauszuholen und länger Spaß zu haben. Wenn Sie also nach einem Online-Casino suchen, das Cashback anbietet, sollten Sie auf jeden Fall Zet Casino in Betracht ziehen.
https://zetcasino.one/
В нашем мире, где диплом является началом отличной карьеры в любой области, многие пытаются найти максимально быстрый путь получения образования. Наличие документа об образовании переоценить просто невозможно. Ведь диплом открывает дверь перед людьми, желающими начать профессиональную деятельность или учиться в ВУЗе.
Мы предлагаем оперативно получить этот важный документ. Вы сможете заказать диплом нового или старого образца, что становится удачным решением для всех, кто не смог закончить образование, утратил документ или хочет исправить свои оценки. Любой диплом изготавливается с особой тщательностью, вниманием к мельчайшим деталям. В результате вы получите полностью оригинальный документ.
Преимущества данного подхода заключаются не только в том, что вы оперативно получите свой диплом. Процесс организовывается удобно и легко, с профессиональной поддержкой. От выбора нужного образца до точного заполнения личных данных и доставки в любой регион России — все под абсолютным контролем квалифицированных специалистов.
В результате, для тех, кто ищет оперативный способ получения требуемого документа, наша компания предлагает отличное решение. Купить диплом – значит избежать продолжительного обучения и не теряя времени перейти к личным целям, будь то поступление в ВУЗ или начало удачной карьеры.
campingmontaГ±aroja.es/our-secret-island-boat-tour-is-just-for-you/В
rusnor.org/pubs/edit/index.php?PAGE_NAME=profile_view&UID=89895В
fundacjaspinacz.com/2021/05/31/hello-world/comment-page-20678/В
nrus.info/obrazovaniecheloveka.htmlВ
thespotlightnewsglobal.com/2023/02/28/sharpes-doom-day-withdraws-20-million-billboard-lawsuit/В
Окончание диплома представляет собой ключевым моментом в карьере всякого человека, определяющим его перспективы и профессиональные перспективы – [url=http://diplomvam.ru]www.diplomvam.ru[/url]. Аттестат открывает путь к перспективным перспективам и возможностям, гарантируя доступ к высококачественному образованию и высокооплачиваемым специальностям. В сегодняшнем обществе, где в конкуренция на трудовом рынке постоянно увеличивается, наличие диплома делает жизненно важным требованием для выдающейся профессиональной деятельности. Он подтверждает ваши знания, умения и навыки, навыки и умения перед работодателями и обществом в целом. В дополнение, диплом придает веру в свои силы и увеличивает оценку себя, что способствует личностному и саморазвитию. Получение образования также инвестицией в свое будущее, обеспечивая устойчивость и приличный уровень проживания. Поэтому отдавать надлежащее внимание образованию и бороться за его получению, чтобы обрести успех и удовлетворение от собственной труда.
Аттестат не только представляет личное образовательный уровень, но и отражает вашу самодисциплину, трудолюбие и упорство в достижении задач. Диплом представляет собой плодом усилий и вложенных усилий, вложенных в учебу и самосовершенствование. Завершение учебы диплома раскрывает перед вами новые перспективы возможностей, позволяя выбирать из множества карьерных путей и профессиональных направлений. Кроме того даёт вам базис знаний и навыков и навыков, необходимых для для выдающейся практики в современном обществе, насыщенном трудностями и изменениями. Помимо этого, сертификат считается доказательством вашей компетентности и квалификации, что в свою очередь повышает вашу привлекательность для работодателей на рынке труда и открывает перед вами двери к лучшим возможностям для профессионального роста. Следовательно, получение образования диплома не лишь обогащает ваше личное развитие, но и открывает перед вами новые и перспективы для достижения и мечтаний.
Как заказать и купить диплом Вуза недорого без предоплаты на сайте? Доставка в любую точку России
http://www.diplomans-rossian.com
טלגראס
האפליקציה הווה תוכנה פופולרית בארץ לרכישת מריחואנה באופן מקוון. זו מעניקה ממשק נוח ומאובטח לקנייה וקבלת שילוחים מ מוצרי קנאביס שונים. במאמר זו נסקור עם העיקרון שמאחורי האפליקציה, כיצד היא עובדת ומה היתרונות מ השימוש בזו.
מה זו האפליקציה?
הפלטפורמה הינה דרך לקנייה של קנאביס דרך האפליקציה טלגרם. היא מבוססת על ערוצי תקשורת וקהילות טלגרם ייעודיות הנקראות ״כיווני טלגראס״, שבהם ניתן להזמין מגוון פריטי מריחואנה ולקבלת אותם ישירותית לשילוח. ערוצי התקשורת אלו מסודרים לפי אזורים גיאוגרפיים, במטרה להקל את קבלתם של השילוחים.
כיצד זאת עובד?
התהליך קל יחסית. קודם כל, צריך להצטרף לערוץ הטלגראס הרלוונטי לאזור המחיה. שם ניתן לצפות בתפריטי הפריטים המגוונים ולהזמין עם המוצרים המבוקשים. לאחר ביצוע ההזמנה וסיום התשלום, השליח יגיע לכתובת שנרשמה ועמו החבילה שהוזמן.
מרבית ערוצי טלגראס מציעים מגוון נרחב של פריטים – סוגי קנאביס, ממתקים, משקאות ועוד. כמו כן, ניתן לראות חוות דעת של לקוחות קודמים לגבי איכות הפריטים והשרות.
יתרונות הנעשה באפליקציה
מעלה מרכזי של האפליקציה הינו הנוחיות והדיסקרטיות. ההרכבה וההכנות מתבצעות ממרחק מאיזשהו מיקום, ללא נחיצות במפגש פיזי. כמו כן, האפליקציה מאובטחת ביסודיות ומבטיחה חיסיון גבוה.
מלבד אל כך, מחירי המוצרים באפליקציה נוטים לבוא תחרותיים, והמשלוחים מגיעים במהירות ובמסירות גבוהה. קיים אף מרכז תמיכה זמין לכל שאלה או בעיה.
לסיכום
הפלטפורמה הינה שיטה מקורית ויעילה לקנות פריטי צמח הקנאביס במדינה. זו משלבת בין הנוחיות הדיגיטלית של האפליקציה הפופולרי, ועם הזריזות והדיסקרטיות של דרך השילוח הישירות. ככל שהדרישה לצמח הקנאביס גובר, אפליקציות בדוגמת טלגראס צפויות להמשיך ולהתפתח.
probeauty [url=http://zhurnal-o-krasote11.ru/]http://zhurnal-o-krasote11.ru/[/url] .
Das Tipico Casino Forum – eine Plattform für echte Fans
Das Tipico Casino Forum ist eine beliebte Plattform für alle Fans des Online-Glücksspiels. Hier können sich Gleichgesinnte austauschen, ihre Erfahrungen teilen und Tipps untereinander geben. Das Forum bietet eine Vielzahl von Themen rund um das Thema Casinospiele, wie zum Beispiel Slotspiele, Roulette oder Blackjack.
Ein großer Vorteil des Forums ist die Möglichkeit, sich mit anderen Spielern auszutauschen und sich somit über neue Spiele oder Strategien zu informieren. Zudem können auch Fragen zu Ein- und Auszahlungen, Boni oder technischen Problemen gestellt werden, auf die erfahrene Mitglieder gerne antworten.
Das Tipico Casino Forum ist auch eine gute Möglichkeit, um sich über aktuelle Aktionen und Angebote des Casinos auf dem Laufenden zu halten. So verpassen die Mitglieder keine Sonderaktionen oder Bonusangebote und können ihr Spielerlebnis noch weiter optimieren.
Zusammenfassend kann man sagen, dass das Tipico Casino Forum eine tolle Plattform für alle Fans des Online-Glücksspiels ist. Hier können sie sich austauschen, voneinander lernen und gemeinsam Spaß haben. Wer also ein echter Casino-Fan ist, sollte unbedingt einmal im Tipico Casino Forum vorbeischauen und sich aktiv beteiligen.
https://tipicocasino.one/
проверка usdt trc20
Как обезопасить свои личные данные: избегайте утечек информации в интернете. Сегодня охрана своих данных становится всё более важной задачей. Одним из наиболее популярных способов утечки личной информации является слив «сит фраз» в интернете. Что такое сит фразы и в каком объеме защититься от их утечки? Что такое «сит фразы»? «Сит фразы» — это синтезы слов или фраз, которые бывают используются для получения доступа к различным онлайн-аккаунтам. Эти фразы могут включать в себя имя пользователя, пароль или разные конфиденциальные данные. Киберпреступники могут пытаться получить доступ к вашим аккаунтам, используя этих сит фраз. Как обезопасить свои личные данные? Используйте запутанные пароли. Избегайте использования простых паролей, которые легко угадать. Лучше всего использовать комбинацию букв, цифр и символов. Используйте уникальные пароли для всего аккаунта. Не используйте один и тот же пароль для разных сервисов. Используйте двухфакторную аутентификацию (2FA). Это привносит дополнительный уровень безопасности, требуя подтверждение входа на ваш аккаунт через другое устройство или метод. Будьте осторожны с онлайн-сервисами. Не доверяйте свою информацию ненадежным сайтам и сервисам. Обновляйте программное обеспечение. Установите обновления для вашего операционной системы и программ, чтобы предохранить свои данные от вредоносного ПО. Вывод Слив сит фраз в интернете может повлечь за собой серьезным последствиям, таким вроде кража личной информации и финансовых потерь. Чтобы сохранить себя, следует принимать меры предосторожности и использовать надежные методы для хранения и управления своими личными данными в сети
Discovered an article that might interest you – don’t miss it! http://physmathforum.flybb.ru/viewtopic.php?f=12&t=668
If the request is not registered properly chinanews777.com, they will load specialists in a chaotic manner. Tickets help to avoid such problems, because all operations will be carried out in a single IT system.
invest-company.net
124969D742
отмывание usdt
Как защитить свои данные: избегайте утечек информации в интернете. Сегодня охрана своих данных становится всё более важной задачей. Одним из наиболее обычных способов утечки личной информации является слив «сит фраз» в интернете. Что такое сит фразы и в каком объеме предохранить себя от их утечки? Что такое «сит фразы»? «Сит фразы» — это смеси слов или фраз, которые постоянно используются для входа к различным онлайн-аккаунтам. Эти фразы могут включать в себя имя пользователя, пароль или дополнительные конфиденциальные данные. Киберпреступники могут пытаться получить доступ к вашим аккаунтам, используя этих сит фраз. Как охранить свои личные данные? Используйте запутанные пароли. Избегайте использования легких паролей, которые просто угадать. Лучше всего использовать комбинацию букв, цифр и символов. Используйте уникальные пароли для всего аккаунта. Не применяйте один и тот же пароль для разных сервисов. Используйте двухступенчатую аутентификацию (2FA). Это вводит дополнительный уровень безопасности, требуя подтверждение входа на ваш аккаунт посредством другое устройство или метод. Будьте осторожны с онлайн-сервисами. Не доверяйте свою информацию ненадежным сайтам и сервисам. Обновляйте программное обеспечение. Установите обновления для вашего операционной системы и программ, чтобы сохранить свои данные от вредоносного ПО. Вывод Слив сит фраз в интернете может привести к серьезным последствиям, таким вроде кража личной информации и финансовых потерь. Чтобы защитить себя, следует принимать меры предосторожности и использовать надежные методы для хранения и управления своими личными данными в сети
I strongly recommend to avoid this site. My own encounter with it has been nothing but frustration and concerns regarding fraudulent activities. Exercise extreme caution, or even better, look for a trustworthy platform for your needs.
Das Boomerang Casino ist eine der neueren Online-GlГјcksspielplattformen, die in Deutschland immer beliebter werden. Doch viele Spieler fragen sich, ob diese Art von Casino in Deutschland Гјberhaupt legal ist.
Die Antwort darauf ist: Ja, das Boomerang Casino ist legal in Deutschland. Die Plattform verfГјgt Гјber eine gГјltige Lizenz der Malta Gaming Authority, was bedeutet, dass sie die strengen Richtlinien und Vorschriften fГјr GlГјcksspielanbieter einhalten. DarГјber hinaus ist das Boomerang Casino auch im Besitz einer Lizenz der Curacao eGaming Authority.
Spieler können also beruhigt sein, dass sie auf einer sicheren und legalen Online-Glücksspielplattform spielen. Das Boomerang Casino bietet eine Vielzahl von Spielen, darunter Slots, Tischspiele, Live-Casino-Spiele und vieles mehr. Die Plattform arbeitet mit bekannten Spieleanbietern zusammen, um ihren Spielern ein erstklassiges Spielerlebnis zu bieten.
Das Boomerang Casino verfügt auch über eine Vielzahl von sicheren Ein- und Auszahlungsmethoden, um sicherzustellen, dass die Spieler ihre Gewinne schnell und problemlos erhalten können. Der Kundenservice steht ebenfalls rund um die Uhr zur Verfügung, um bei Fragen oder Problemen zu helfen.
Insgesamt ist das Boomerang Casino eine sichere und vertrauenswГјrdige Option fГјr Online-GlГјcksspieler in Deutschland. Mit einer gГјltigen Lizenz und einer Vielzahl von Spielen und Funktionen, die den Spielern zur VerfГјgung stehen, ist das Boomerang Casino eine gute Wahl fГјr diejenigen, die nach einer unterhaltsamen und sicheren GlГјcksspielplattform suchen.
https://boomerangcasino.one/
При сфере цифровых валют существует реальная угроза приобретения таким образом называемых “незаконных” денег – монет, соотносимых с нелегальной деятельностью, такой наподобие легализация средств, мошенничество либо взломы. Держатели кошельков USDT на распределенном реестре TRON (TRC20) тоже предрасположены данному угрозе. Поэтому очень нужно регулярно проверять свой криптокошелек на наличие “незаконных” переводов для охраны собственных активов а также имиджа.
Угроза “грязных” переводов кроется в этом, что оные могут быть отслежены силовыми структурами а также финансовыми регуляторами. В случае если станет установлена соотношение с противозаконной активностью, ваш кошелек может стать блокирован, и ресурсы – конфискованы. Сверх того, данное сможет повлечь за собой к юридические последствия и повредить твою образ.
Имеются профильные инструменты, дающие возможность удостовериться историю операций в вашем кошельке USDT TRC20 на присутствие подозрительных операций. Данные сервисы анализируют сведения операций, сопоставляя их со зарегистрированными инцидентами обмана, хакерских атак, а также легализации средств.
Одним из числа таких инструментов является https://telegra.ph/Servisy-AML-proverka-USDT-05-19 дающий возможность отслеживать исчерпывающую архив транзакций вашего USDT TRC20 кошелька для криптовалют. Инструмент выявляет возможно угрожающие операции и представляет детальные отчеты об оных.
Не оставляйте без внимания аудитом собственного криптокошелька USDT TRC20 на наличие “нелегальных” переводов. Своевременное мониторинг поможет устранить опасностей, соотносимых с противозаконной деятельностью на криптовалютной области. Применяйте заслуживающие доверия инструменты с целью проверки своих USDT транзакций, чтобы защитить свои криптоактивы а также образ.
Проверить транзакцию usdt trc20
Защитите собственные USDT: Удостоверьтесь транзакцию TRC20 до отправкой
Виртуальные деньги, такие как USDT (Tether) на блокчейне TRON (TRC20), становятся всё более популярными в области распределенных финансовых услуг. Однако вместе со повышением распространенности растет также опасность промахов иль мошенничества во время отправке денег. Как раз по этой причине необходимо контролировать перевод USDT TRC20 перед ее отправлением.
Ошибка при вводе данных адреса адресата или пересылка по некорректный адрес может повлечь к невозвратной потере ваших USDT. Злоумышленники также смогут стараться провести тебя, отправляя фальшивые адреса для транзакции. Утрата криптовалюты по причине таких погрешностей может повлечь серьезными финансовыми потерями.
К счастью, существуют специализированные сервисы, дающие возможность проверить перевод USDT TRC20 до её отсылкой. Некий из числа таких служб предоставляет возможность наблюдать и анализировать транзакции в распределенном реестре TRON.
В этом сервисе вы сможете ввести адрес получателя получателя а также получать детальную сведения о нем, включая историю операций, остаток и статус аккаунта. Данное поможет определить, является ли адрес получателя действительным и безопасным для пересылки денег.
Другие сервисы тоже предоставляют аналогичные возможности по проверки операций USDT TRC20. Некоторые кошельки для криптовалют по криптовалют обладают встроенные возможности для верификации адресов и транзакций.
Не пропускайте удостоверением транзакции USDT TRC20 перед ее пересылкой. Небольшая предосторожность может сэкономить вам много денег и предотвратить утрату твоих дорогих криптовалютных активов. Используйте заслуживающие доверия сервисы для обеспечения безопасности твоих транзакций и неприкосновенности ваших USDT на распределенном реестре TRON.
В процессе обращении с цифровой валютой USDT на распределенном реестре TRON (TRC20) чрезвычайно значимо не только проверять адрес реципиента до переводом средств, но тоже регулярно мониторить остаток своего цифрового кошелька, плюс источники поступающих переводов. Это позволит своевременно обнаружить все нежелательные транзакции и не допустить потенциальные издержки.
В первую очередь, требуется убедиться в точности демонстрируемого остатка USDT TRC20 в собственном кошельке для криптовалют. Рекомендуется сверять данные с данными открытых блокчейн-обозревателей, чтобы не допустить шанс компрометации либо скомпрометирования этого кошелька.
Тем не менее лишь отслеживания остатка не хватает. Максимально существенно изучать историю поступающих транзакций а также их источники. Если вы выявите транзакции USDT от анонимных либо вызывающих опасения адресов, сразу же заблокируйте данные финансы. Существует опасность, чтобы данные монеты были добыты незаконным способом и впоследствии изъяты регуляторами.
Наше платформа дает возможности для углубленного изучения входящих USDT TRC20 переводов на предмет этой законности и неимения соотношения с противозаконной деятельностью. Мы поможем вам безопасно работать с этим популярным стейблкоином.
Также необходимо периодически отправлять USDT TRC20 на проверенные неконтролируемые криптовалютные кошельки находящиеся под собственным полным контролем. Хранение токенов на внешних платформах всегда связано с угрозами хакерских атак и потери финансов вследствие программных неполадок либо несостоятельности сервиса.
Соблюдайте элементарные правила защиты, будьте внимательны а также оперативно контролируйте баланс а также источники поступлений кошелька для USDT TRC20. Данные действия позволят оградить ваши электронные активы от незаконного завладения и потенциальных юридических проблем в будущем.
Ищете, где можно получить займ быстро? Наш канал предлагает информацию о [url=https://t.me/s/new_mfo/]новых МФО 2024[/url]. Займы на карту доступны круглосуточно. Минимальные требования – паспорт и именная банковская карта. Подписывайтесь и оформляйте займ уже сегодня!
Сегодня, когда диплом – это начало удачной карьеры в любой отрасли, многие ищут максимально быстрый путь получения образования. Наличие официального документа об образовании переоценить просто невозможно. Ведь диплом открывает дверь перед любым человеком, который хочет начать профессиональную деятельность или продолжить обучение в высшем учебном заведении.
В данном контексте наша компания предлагает очень быстро получить любой необходимый документ. Вы имеете возможность заказать диплом старого или нового образца, что является выгодным решением для человека, который не смог завершить образование или потерял документ. Каждый диплом изготавливается с особой тщательностью, вниманием ко всем деталям, чтобы на выходе получился документ, максимально соответствующий оригиналу.
Плюсы подобного подхода заключаются не только в том, что можно оперативно получить свой диплом. Весь процесс организован комфортно, с профессиональной поддержкой. От выбора подходящего образца до точного заполнения персональной информации и доставки в любой регион России — все будет находиться под абсолютным контролем опытных мастеров.
Всем, кто ищет быстрый и простой способ получения необходимого документа, наша услуга предлагает отличное решение. Заказать диплом – значит избежать длительного процесса обучения и не теряя времени переходить к своим целям: к поступлению в ВУЗ или к началу удачной карьеры.
parikmaher-online.ru/forum/10/2474В
pokemon-go.onl/users/4742?wid=1606В
forum.jrudevels.org/memberlist.php?mode=joined&order=ASC&start=17750%D0%92%C2%A0В
chemnet.ru/rus/univ/В
kxk.ru/devchonki/view.php?part=4&t=2916331&only=В
blabla
lalablublu
Das Boomrang Casino ist eine aufregende Online-Spielplattform, die Spielern die Möglichkeit bietet, eine Vielzahl von beliebten Casino-Spielen zu genießen. Mit einer benutzerfreundlichen Oberfläche und einer Vielzahl von Spielen zur Auswahl ist dieses Casino eine ideale Wahl für Spieler, die nach Unterhaltung und Gewinnmöglichkeiten suchen.
Das Boomrang Casino bietet eine breite Palette von Spielen, von klassischen Tischspielen wie Blackjack und Roulette bis hin zu aufregenden Spielautomaten und Videoslots. Darüber hinaus gibt es auch Live-Casino-Spiele, bei denen Spieler mit echten Dealern interagieren können, was ein authentisches Casino-Erlebnis bietet.
Ein weiterer großer Vorteil des Boomrang Casinos ist die Vielzahl von Bonusangeboten und Aktionen, die regelmäßig verfügbar sind. Spieler können von Willkommensboni, Einzahlungsboni, Freispielen und anderen Promotionen profitieren, die ihre Gewinnchancen erhöhen und das Spielerlebnis noch aufregender machen.
Darüber hinaus bietet das Boomrang Casino eine sichere und zuverlässige Spielumgebung. Mit einer Lizenz von einer angesehenen Glücksspielbehörde und modernen Sicherheitsmaßnahmen können Spieler sicher sein, dass ihre Daten geschützt sind und dass alle Spiele gerecht und transparent sind.
Insgesamt ist das Boomrang Casino eine ausgezeichnete Wahl fГјr alle, die nach einem unterhaltsamen und lohnenden Online-Casino-Erlebnis suchen. Mit einer Vielzahl von Spielen, groГџzГјgigen Boni und einer sicheren Spielumgebung ist dieses Casino sicherlich einen Besuch wert. Besuchen Sie noch heute BoomrangCasino.com und tauchen Sie ein in die aufregende Welt des Online-GlГјcksspiels. Viel GlГјck und viel SpaГџ beim Spielen!
https://boomerangcasino.one/
I urge you stay away from this site. My personal experience with it has been purely dismay and doubts about scamming practices. Be extremely cautious, or even better, find a more reputable site for your needs.
124SDS9742
проверить адрес usdt trc20
Заголовок: Непременно контролируйте адрес получателя во время операции USDT TRC20
В процессе деятельности со крипто, в частности с USDT в распределенном реестре TRON (TRC20), весьма необходимо демонстрировать осмотрительность а также внимательность. Одна из числа наиболее распространенных оплошностей, какую делают пользователи – посылка средств на ошибочный адресу. Для того чтобы устранить утрату собственных USDT, нужно неизменно старательно контролировать адрес адресата до отправкой операции.
Крипто адреса кошельков являют из себя длинные совокупности символов а также номеров, к примеру, TRX9QahiFUYfHffieZThuzHbkndWvvfzThB8U. Включая малая ошибка либо погрешность во время копирования адреса может привести к тому, что ваши цифровые деньги станут невозвратно лишены, так как они окажутся в неконтролируемый вами кошелек.
Имеются различные способы контроля адресов USDT TRC20:
1. Зрительная проверка. Тщательно сопоставьте адрес кошелька во своём крипто-кошельке с адресом кошелька реципиента. При малейшем расхождении – не производите операцию.
2. Применение интернет-служб проверки.
3. Двойная проверка с получателем. Обратитесь с просьбой к адресату заверить точность адреса кошелька до посылкой операции.
4. Пробный транзакция. В случае значительной величине операции, возможно сначала послать малое величину USDT для удостоверения адреса.
Также рекомендуется содержать крипто в собственных кошельках, но не на биржах иль третьих сервисах, чтобы обладать всецелый контроль по отношению к своими активами.
Не игнорируйте удостоверением адресов при осуществлении работе с USDT TRC20. Данная несложная мера безопасности окажет помощь обезопасить ваши средства от случайной потери. Помните, чтобы на мире криптовалют транзакции невозвратны, а отправленные монеты по неверный адрес вернуть практически нереально. Будьте внимательны а также аккуратны, чтобы защитить свои капиталовложения.
Boomerang Casino Kokemuksia
Boomerang Casino ist eine relativ neue Online-Spielplattform, die sich auf den deutschen Markt konzentriert. Mit einer Vielzahl von Spielen, groГџzГјgigen Boni und ansprechendem Design hat die Website bereits die Aufmerksamkeit vieler Spieler auf sich gezogen. Aber wie sind die Erfahrungen der Spieler mit Boomerang Casino wirklich?
Viele Spieler berichten von einer positiven Erfahrung mit Boomerang Casino. Sie loben die ansprechende und benutzerfreundliche OberflГ¤che der Website, die es leicht macht, sich zurechtzufinden und die Lieblingsspiele zu finden. Die groГџe Auswahl an Spielen, darunter Slots, Tischspiele und Live-Casino-Spiele, wird ebenfalls positiv bewertet. Die Spiele werden von bekannten und vertrauenswГјrdigen Softwareanbietern wie NetEnt, Microgaming und Play’n GO bereitgestellt, was fГјr QualitГ¤t und Vielfalt sorgt.
Ein weiterer Punkt, der von den Spielern gelobt wird, sind die großzügigen Boni und Aktionen, die Boomerang Casino anbietet. Neue Spieler können sich über einen Willkommensbonus freuen, der Freispiele und Bonusgeld umfasst. Darüber hinaus werden regelmäßig verschiedene Promotionen angeboten, die den Spaß und die Gewinnchancen erhöhen.
Natürlich gibt es auch einige kritische Stimmen unter den Spielern. Einige bemängeln die teilweise langen Auszahlungszeiten und den Kundenservice, der nicht rund um die Uhr verfügbar ist. Jedoch scheinen diese Probleme größtenteils Einzelfälle zu sein und die Mehrheit der Spieler ist mit Boomerang Casino zufrieden.
Insgesamt scheint Boomerang Casino eine vielversprechende Online-Spielplattform zu sein, die mit einer großen Auswahl an Spielen, attraktiven Boni und einem ansprechenden Design überzeugt. Die Erfahrungen der Spieler sind größtenteils positiv, und viele empfehlen die Plattform weiter. Wer also auf der Suche nach einem unterhaltsamen und sicheren Online-Casino ist, sollte Boomerang Casino definitiv eine Chance geben.
https://boomerangcasino.one/
В нашем обществе, где диплом становится началом успешной карьеры в любой области, многие пытаются найти максимально быстрый и простой путь получения качественного образования. Важность наличия официального документа об образовании переоценить просто невозможно. Ведь диплом открывает дверь перед каждым человеком, который хочет начать трудовую деятельность или продолжить обучение в высшем учебном заведении.
Предлагаем максимально быстро получить этот необходимый документ. Вы имеете возможность купить диплом старого или нового образца, что становится удачным решением для всех, кто не смог завершить образование, потерял документ или желает исправить плохие оценки. Любой диплом изготавливается с особой аккуратностью, вниманием к мельчайшим элементам, чтобы в итоге получился продукт, полностью соответствующий оригиналу.
Плюсы такого решения состоят не только в том, что вы сможете максимально быстро получить свой диплом. Процесс организован удобно, с нашей поддержкой. Начиная от выбора требуемого образца диплома до грамотного заполнения персональных данных и доставки в любой регион страны — все находится под полным контролем наших специалистов.
Для тех, кто ищет оперативный способ получить требуемый документ, наша компания предлагает выгодное решение. Заказать диплом – значит избежать долгого обучения и сразу переходить к своим целям, будь то поступление в университет или начало карьеры.
teacher-of-russia.ru/index.php?page=regcomp17_buryatiyaВ
znamus.ru/page/mihail_epshteinВ
papy.ru/catalog_777_915.htmlВ
http://www.wodemeimei.com/home.php?mod=space&uid=34791В
informatio.ru/news/education/middledu/informatsiya_o_tom_kak_uznat_rezultaty_ege_i_gia/В
tokyo365web.com
belfastinvest.net
[url=https://i.megas.sbs/]работает ли мега сб[/url] – mega sb вход не через тор, мега сб сайт
[url=https://12.kraken.gl]kraken[/url] – официальный сайт КРАКЕН, kraken зеркала
[url=https://kraken12.co.at]kraken[/url] – kraken, kraken11
https://headshotseo.com/
[url=https://xn--90ascrfejh9f.org/]блекспрут com[/url] – blacksprut, blacksprut вход
The finished metal structure mosesolmos.com must be properly packaged. Thanks to this, it will definitely not be damaged during transportation.
полусухая стяжка пола установка [url=http://www.mekhanizirovannaya-shtukaturka15.ru/]http://www.mekhanizirovannaya-shtukaturka15.ru/[/url] .
Each offer is accompanied by photographs of the canada-welcome.com hotel where tourists are invited to stay. There is the exterior of the building, the interiors of the rooms, photos of the territory and individual objects. The page contains a detailed description of living conditions, room equipment, and the possibility of paid and free services.
Stumbled upon interesting material Ц I can’t help but recommend you to read http://animeworldiko.mybb.ru/viewtopic.php?id=358#p699
В нашем мире, где диплом является началом удачной карьеры в любой сфере, многие ищут максимально быстрый и простой путь получения качественного образования. Наличие официального документа об образовании переоценить просто невозможно. Ведь именно он открывает двери перед каждым человеком, который стремится вступить в профессиональное сообщество или продолжить обучение в любом институте.
Наша компания предлагает быстро получить этот важный документ. Вы можете заказать диплом нового или старого образца, и это является удачным решением для человека, который не смог закончить обучение, утратил документ или желает исправить плохие оценки. диплом изготавливается аккуратно, с особым вниманием ко всем элементам. В итоге вы получите продукт, 100% соответствующий оригиналу.
Плюсы данного подхода состоят не только в том, что вы оперативно получите свой диплом. Процесс организовывается удобно, с профессиональной поддержкой. Начав от выбора нужного образца до правильного заполнения персональных данных и доставки по России — все будет находиться под полным контролем качественных специалистов.
В результате, для тех, кто ищет оперативный способ получения требуемого документа, наша компания может предложить отличное решение. Заказать диплом – это значит избежать продолжительного процесса обучения и не теряя времени перейти к достижению собственных целей: к поступлению в ВУЗ или к началу удачной карьеры.
temablog.ru/opredelenie-nepreryvnogo-obucheniyaВ
confspb.ru/en/events-archive/2012/forum-morskoi-turizm-2012/uchastnikiВ
http://www.italian-style.ru/Nasha_kompanija/forum/?PAGE_NAME=profile_view&UID=51423%D0%92В
fdomgppu.ru/node/12290В
mytubs.ru/5553-pochemu-rebenok-ne-hochet-uchitsja.htmlВ
[url=https://redirect.m3ga.as]m3ga tor[/url] – mega onion, m3ga площадка
Добро пожаловать в наш Telegram-канал! Каждый день мы обновляем актуальную информацию о новых МФО. Все организации из нашего списка работают официально и проверены нашими специалистами. Узнайте о [url=https://t.me/s/mfo_2024_online]новые малоизвестные займы онлайн[/url], доступные всем без отказа от 18 лет. Мы поможем вам выбрать самый выгодный и удобный займ. Присоединяйтесь к нам, чтобы всегда быть в курсе самых свежих предложений и акций.
Boomerang Casino Erfahrungen: Alles Гјber Auszahlungen
Boomerang Casino ist ein Online-Casino, das Spielern eine Vielzahl von Spielen und großzügigen Boni bietet. In diesem Artikel werden wir uns genauer mit den Erfahrungen der Spieler in Bezug auf Auszahlungen beschäftigen.
Die meisten Spieler, die Erfahrungen mit Boomerang Casino gemacht haben, berichten von schnellen und zuverlässigen Auszahlungen. Die Auszahlungszeiten variieren je nach Auszahlungsmethode, aber in der Regel werden Auszahlungen innerhalb von 24 Stunden bearbeitet. Spieler können zwischen verschiedenen Zahlungsmethoden wie Kreditkarten, E-Wallets und Banküberweisungen wählen.
Ein weiterer positiver Aspekt von Boomerang Casino ist die Tatsache, dass Auszahlungen in der Regel gebührenfrei sind. Dies bedeutet, dass Spieler ihr gesamtes Guthaben ohne Abzüge erhalten können.
Einige Spieler haben jedoch berichtet, dass sie gelegentlich Verzögerungen bei ihren Auszahlungen erlebt haben. In den meisten Fällen handelt es sich dabei um Probleme mit der Verifizierung der Identität oder der Erfüllung der Bonusbedingungen. Spieler sollten daher sicherstellen, dass sie alle erforderlichen Dokumente einreichen und die Bonusbedingungen vollständig erfüllen, um Verzögerungen bei ihren Auszahlungen zu vermeiden.
Insgesamt sind die Erfahrungen der Spieler mit Boomerang Casino in Bezug auf Auszahlungen größtenteils positiv. Schnelle und zuverlässige Auszahlungen sowie gebührenfreie Transaktionen sorgen dafür, dass Spieler ihre Gewinne schnell und einfach erhalten können. Es ist jedoch wichtig, die Bonusbedingungen zu beachten und alle erforderlichen Dokumente einzureichen, um Verzögerungen zu vermeiden.
https://boomerangcasino.one/
Получите займ в новых МФО 2024 года! Наш канал предоставляет информацию о малоизвестных микрофинансовых организациях, которые дают займы всем, даже с просрочками. Подпишитесь на [url=https://t.me/s/new_mfo/]новые МФО 2024[/url] и узнайте, как легко получить деньги на карту.
На нашем канале только проверенная информация о [url=https://t.me/s/new_mfo/]новых МФО 2024[/url]. Получите займ от 1 до 30 рублей на 30 дней без отказов. Минимальные требования – паспорт и именная банковская карта. Подписывайтесь и будьте в курсе всех выгодных предложений!
gocanadanews.com
texasnews365.com
Stumbled upon a captivating article – definitely take a look! http://inteam.maxbb.ru/viewtopic.php?f=1&t=1442
Информационный портал https://kalitka48.ru/ на актуальные темы, связанные с недвижимостью: новости рынка недвижимости, информация о покупке и продаже квартир и множество других полезных статей.
Проверить перевод usdt trc20
Актуальность подтверждения перевода USDT TRC20
Переводы USDT через сети TRC20 набирают возрастающую популярность, но необходимо оставаться крайне осторожными в процессе этих принятии.
Этот категория транзакций регулярно привлекается для очищения средств, извлеченных незаконным способом.
Ключевой факторов риска зачисления USDT по сети TRC20 – заключается в том, что такие платежи вероятно будут получены благодаря множественных схем кражи, включая кражи конфиденциальной информации, шантаж, кибератаки наряду с другие криминальные схемы. Принимая подобные операции, клиент автоматически становитесь сообщником незаконной схем.
Таким образом особенно важно глубоко изучать происхождение всех получаемого транзакции по USDT в сети TRC20. Необходимо запрашивать с отправителя информацию в отношении чистоте денежных средств, а непринципиальных вопросах – отказываться данные переводов.
Имейте в виду, в том, что в определения нелегальных происхождений финансов, вы с высокой вероятностью будете столкнуться с применением ответственности параллельно рядом с инициатором. Поэтому предпочтительнее проявить осторожность а также глубоко анализировать любой перевод, предпочтительнее подвергать опасности своей репутацией наряду с оказаться в серьезные юридические неприятности.
Демонстрация аккуратности при работе по USDT TRC20 – является основа личной денежной безопасности как и защита вовлечения в преступные активности. Будьте осторожны наряду с всегда исследуйте источник виртуальных валютных денежных средств.
http://www.google.com.vc/url?q=http://www.justicefornorthcaucasus.com/jfnc_message_boards/analysis_opinion.php?entry_id=1294129657&title=window-on-eurasia:-new-russian-nationalists-very-different-from-their-predecessors,-activist-says&comments=comments
сколько стоит полусухая стяжка пола [url=https://mekhanizirovannaya-shtukaturka15.ru/]https://mekhanizirovannaya-shtukaturka15.ru/[/url] .
Low-carb gummies have arisen as a popular food choice for people adhering to a low-carb or low-carbohydrate diet. These gummy delicacies are formulated to be minimal in net carbohydrates, rendering them a healthy pleasure for those trying to sustain a https://t.me/s/ketogummies state of fat-burning.
By using organic sweeteners like stevia extract or erythritol, keto sweets offer a gratifying sugary flavor without spiking glycemic readings, a frequent worry with traditional confectionery.
Как получить пропуск на МКАД, Как быстро получить пропуск на МКАД, лайфхаки, которую нужно знать, Основные вопросы о пропуске на МКАД, на которые нужно знать ответы, основные моменты, Пропуск на МКАД: основные преимущества, Как продлить пропуск на МКАД, подробная информация
Проверить пропуск на мкад [url=https://gargopermits.com/]Пропуск на мкад[/url] .
Подробная инструкция по оформлению пропуска на МКАД, что нужно знать, Ключевые моменты о пропуске на МКАД, Какие документы нужны для оформления пропуска на МКАД, подробная инструкция, Информация о стоимости и сроках пропуска на МКАД, Как получить пропуск для поездок по МКАД, советы, Инструкция по продлению пропуска на МКАД, шаг за шагом
Проверить пропуск на мкад [url=https://gargopermits.com/]Проверить пропуск на мкад[/url] .
В нашем обществе, где диплом становится началом удачной карьеры в любой сфере, многие пытаются найти максимально быстрый путь получения качественного образования. Важность наличия документа об образовании сложно переоценить. Ведь диплом открывает двери перед всеми, кто стремится начать трудовую деятельность или продолжить обучение в университете.
В данном контексте наша компания предлагает быстро получить этот важный документ. Вы сможете заказать диплом нового или старого образца, и это будет удачным решением для всех, кто не смог завершить образование или утратил документ. Все дипломы производятся с особой аккуратностью, вниманием к мельчайшим деталям, чтобы на выходе получился документ, полностью соответствующий оригиналу.
Преимущества подобного подхода состоят не только в том, что вы быстро получите диплом. Весь процесс организовывается удобно, с нашей поддержкой. От выбора необходимого образца до точного заполнения личных данных и доставки по России — все будет находиться под абсолютным контролем наших специалистов.
В итоге, для тех, кто хочет найти быстрый способ получить необходимый документ, наша компания предлагает выгодное решение. Купить диплом – это значит избежать продолжительного процесса обучения и не теряя времени перейти к достижению личных целей: к поступлению в университет или к началу трудовой карьеры.
http://www.lku2.com/blogs/4250/What-do-you-need-to-pay-attention-to-when-buyingВ
tehset.ru/2018/08/06/rasshireniya-proksi-v-google-chrome/В
photodoska.ru/moscow/uslugi/obuchenie/attestaty-diplomy-i-drugie-dokumenty-ob-obrazovanii-3192585В
war3fun.ru/load/garena/garena_hack/eflaymh_0_4_6_varkraft_mapkhak_1_26a/22-1-0-1455В
uor-nsk.ru/news?start=9В
https://pro-stavka.ru/
Наш канал – это источник информации о [url=https://t.me/s/new_mfo/]новых МФО 2024[/url]. Получите займ от 1 до 30 рублей на 30 дней даже с плохой кредитной историей. Минимальные требования – паспорт и банковская карта. Подпишитесь и будьте в курсе всех новинок!
Manufacturing metal structures is a californiarent24.com very complex and responsible process. It is necessary to follow some rules and follow recommendations to ensure that the product turns out to be of high quality and safe. You can order the production of metal structures on the website to profitably invest your own money. Let’s consider the basic rules that relate to this process.
Как получить пропуск на МКАД, Как быстро получить пропуск на МКАД, рекомендации, которую стоит учесть, 10 вопросов о пропуске на МКАД, Сколько стоит и как долго делается пропуск на МКАД, Эффективные способы получения пропуска для МКАД, инструкции, подробные разъяснения, подробная информация
Пропуск на мкад [url=https://gargopermits.com/]Пропуск в москву[/url] .
blabla
blibli
To operate hydraulic motors, mineral oils are used, dominicanrental.com which are pre-cleaned to remove any impurities. The MRF line of hydraulic motors presented six models, differing from each other in the following matter.
[url=https://pro-diabet.pro/stati/komu-pokazan-i-chto-umeet-preparat-ozempik-semaglutid-pri-saharnom-diabete/]оземпик +как колоть[/url] – купить в москве zepbound, лираглутид дулаглутид семаглутид
24thainews.com
1го казино https://prime-kapitals.com/
1SS3D249742
cululutata
Подробная инструкция по оформлению пропуска на МКАД, советы, секреты, Пропуск на МКАД: какие документы нужны, основные требования, которые помогут вам разобраться, Как оформить пропуск для движения по МКАД, рекомендации, основные аспекты, полный гайд
Проверить пропуск на мкад [url=https://gargopermits.com/]Проверить пропуск на мкад[/url] .
bliloblo
Подробная инструкция по оформлению пропуска на МКАД, советы, Основные аспекты пропуска на МКАД, Пропуск на МКАД: какие документы нужны, подробная инструкция, Сколько стоит и как долго делается пропуск на МКАД, Как оформить пропуск для движения по МКАД, советы, важные детали, подробная информация
Пропуск на мкад [url=https://gargopermits.com/]Пропуск в москву[/url] .
Hello there! This post could not be written any better! Reading this post reminds me of my old room mate! He always kept chatting about this. I will forward this write-up to him. Pretty sure he will have a good read. Many thanks for sharing!
spin away casino games
[url=https://blacksprut4web.com/zerkalo/]как зайти на blacksprut[/url] – ссылка блэкспрут, как зайти на blacksprut
1SS3D249742
Лучшие книги по саморазвитию и советы по их применению ждут тебя на нашем канале! Узнай, как начать саморазвитие с пользой для себя. Подписывайся и развивайся вместе с нами: https://t.me/s/razvisam/
Привет, товарищи-игроманы!
Хочу поделиться с вами своей радостью – после долгих поисков голд казино и casino clubnika, я наконец-то нашел идеальное онлайн казино! Знаете, как бывает – ищешь, пробуешь разные сайты, а они все какие-то не такие: то интерфейс кривой, то с выплатами тянут, то поддержка не отвечает, то игр раз-два и обчелся. Я уж думал, все, не судьба мне найти свой игровой рай.
Но тут поискав lev casino зеркало я попал на Telegram [url=https://t.me/s/zerkalo_lev]club lev[/url] и понял – вот оно, то самое! Ребята, это просто бомба! Все сделано для людей:
– Интерфейс – закачаешься! Все интуитивно понятно, глаз радуется.
– Выплаты – моментальные! Выиграл – и уже денежки у тебя на счету.
– Саппорт – 24/7, отвечают быстро, решают любые вопросы. Профи!
– Игры – на любой вкус! Хочешь классику – вот тебе слоты. Хочешь пообщаться – иди к живым дилерам. И постоянно что-то новенькое добавляют!
– Бонусы – щедрые, как Санта на Рождество! За регистрацию, за пополнение – бери не хочу!
В общем, я теперь только на https://t.me/s/playgoldclub зависаю. Если вы тоже в поисках своего идеального казино – очень рекомендую заглянуть, не пожалеете!
А кто уже тут играет – делитесь впечатлениями в комментах, интересно пообщаться! Да и вообще, делитесь своими лайфхаками, историями больших выигрышей (и проигрышей ), будет круто!
Ну что, поехали ловить удачу за хвост? Всем фарта и жирных заносов!
Добро пожаловать в наш Telegram-канал! Мы собрали для вас список малоизвестных МФО, которые сейчас предлагают первый займ бесплатно до 15 тысяч рублей. Все быстро и просто: минимальные требования – только паспорт и именная банковская карта. Узнайте больше о [url=https://t.me/s/mfo_2024_online]новые мфо только открывшиеся без отказа на карту[/url] и получите деньги уже сегодня. Присоединяйтесь к нам и воспользуйтесь самыми выгодными предложениями!
[url=https://mounjaro-apteka.ru]трулисити 0.75 купить +в москве[/url] – тирзепатид мунджаро инструкция, мунджаро фото
скупка автомобилей https://avtovikupmashin21.ru/
топ казино
If you properly prepare 365eventcyprus.com the material before manufacturing the structure, you can get a high-quality product.
Forklifts can be called an miamicottages.com indispensable element of equipment, which is actively used in the arrangement of warehouse premises. With their help, you can load pallets, boxes and large cargo onto the upper shelves of the racks, which increases the functional area of the warehouse by an order of magnitude. Here you will learn about the advantages of forklifts, as well as their types and applications. You may also be interested in the opportunity to buy warehouse equipment on the site.
Продажа квартир Пенза https://solnechnyjgorod.ru/, успейте купить квартиру от застройщика в Пензе. ЖК «Солнечный Город» расположен в экологическом чистом районе в 13 км от города Пенза. Продажа 1,2 комнатных квартир от застройщика по минимальной стоимости за кВ/м, успей купить не упусти шанс.
It is necessary to work carefully housebru.com and accurately when manufacturing metal structure parts. Even minimal mistakes lead to serious problems in the future.
Секреты оформления пропуска на МКАД, Как быстро получить пропуск на МКАД, Основные аспекты пропуска на МКАД, Список требуемых документов для пропуска на МКАД, подробная инструкция, на которые нужно знать ответы, основные моменты, Почему стоит получить пропуск на МКАД, важные детали, шаг за шагом
Пропуск на мкад [url=https://gargopermits.com/]Пропуск в москву[/url] .
Фоллаут 2 сезон фильм
It’s awesome to visit this website and reading the views of all mates about this post, while I am also keen of getting familiarity.
fold away spin bike
Мир компьютерного устройства – оно не только о трудоустройстве и наша компания поняли перечислен еще на заре 2000-х.
Take a look at my web page … https://ramblermails.com/
Homepage [url=https://osu.digital]Osu[/url]
Секреты оформления пропуска на МКАД, советы, секреты, которую важно помнить, Часто задаваемые вопросы о пропуске на МКАД, которые помогут вам разобраться, Эффективные способы получения пропуска для МКАД, Почему стоит получить пропуск на МКАД, подробные разъяснения, полный гайд
Проверить пропуск на мкад [url=https://gargopermits.com/]Пропуск на мкад[/url] .
[url=https://peaksview.me/ru]Дом с панорамным видом в Жабляке[/url] – Izdavanje kuca na Zabljaku, Аренда шале в Жабляке
Наш Telegram-канал – ваш проводник в мире онлайн займов. Мы ежедневно обновляем список новых МФО, чтобы предложить вам самые актуальные и выгодные условия. Узнайте больше о [url=https://t.me/s/mfo_2024_online]займы на карту онлайн новые[/url] с акциями под 0%. Даже если у вас плохая кредитная история, вы сможете получить займ без отказа. Мы расскажем, как правильно использовать онлайн займы, чтобы избежать проблем. Подписывайтесь на наш канал и получайте деньги быстро и без лишних вопросов!
cyprus-welcome.com
californianetdaily.com
Семья Дубровский снова полным составом бродила по гипермаркету в поисках снеков или чего-нибудь вкусненького. Глава семейства – Павел – тучный мужчина сорока лет снова обратил внимание на полки с чипсами:
—Машка, возьмем такие? Я с малосольным огурчиком никогда еще не пробовал, новинка!
—Да, давай! человек вовсе не предполагал от собственной жены Татьяны. На территории этой династии телосложение физической оболочки полностью различалась от типовой а также общепринятой – быть с предожирением абсолютная условие.
Stumbled upon an interesting article – I suggest you take a look http://skazka.g-talk.ru/posting.php?mode=post&f=1
important source [url=https://torbrowser.network]Torbrowser[/url]
Уэнздей кино
Мы рекомендуем посетить веб-сайт https://kartina.info/.
Кроме того, не забудьте добавить сайт в закладки: [url=https://kartina.info/]https://kartina.info/[/url]
Привет игроманы!
Я давно увлекаюсь онлайн казино и, как многие из вас, всегда искал платформу, которая бы соответствовала всем моим требованиям. Искал и . Перепробовал множество сайтов, но постоянно сталкивался с различными проблемами: неудобный интерфейс, задержки с выплатами, отсутствие нормальной поддержки, да и просто скучный набор игр. В какой-то момент я почти потерял надежду, но решил попробовать еще один раз и наконец-то нашел Telegram . Вот несколько причин, почему я считаю его идеальным:
– Удобный интерфейс: сайт очень удобный и понятный, даже для новичков. Все нужные разделы под рукой, ничего лишнего.
– Мгновенные выплаты: проверил на себе – выигрыш приходит на счет практически моментально.
– Отличная поддержка: техподдержка реально работает и помогает решить любые проблемы. Причем они доступны 24/7.
– Широкий выбор игр: тут есть все – от классических слотов до живых дилеров. И постоянно добавляют что-то новое.
– Бонусы и акции: щедрые приветственные бонусы и регулярные акции. Всегда приятно получать дополнительные фриспины или бонусы за пополнение счета.
Понимаю, что каждому свое, но лично для меня стало настоящей находкой. Если вы тоже устали искать, рекомендую попробовать. Возможно, оно станет вашим новым любимым местом для игры.
Если у кого-то уже есть опыт игры на этом сайте, делитесь своими впечатлениями! Интересно узнать ваше мнение.
Удачи и больших выигрышей всем!
טלגראס מהווה אפליקציה פופולרית במדינה לקנייה של קנאביס בצורה וירטואלי. היא נותנת ממשק משתמש פשוט לשימוש ומאובטח לקנייה ולקבלת משלוחים מ פריטי מריחואנה שונים. במאמר זה נבחן עם העיקרון שמאחורי טלגראס, כיצד היא פועלת ומה המעלות מ השימוש בה.
מה זו האפליקציה?
טלגראס הווה שיטה לרכישת צמח הקנאביס דרך היישומון טלגרם. זו מבוססת מעל ערוצים וקהילות טלגרם ספציפיות הקרויות ״כיווני טלגראס״, שבהם אפשר להרכיב מרחב מוצרי צמח הקנאביס ולקבל אלו ישירותית למשלוח. ערוצי התקשורת האלה מאורגנים על פי אזורים גאוגרפיים, במטרה לשפר על קבלת המשלוחים.
איך זה עובד?
התהליך קל למדי. קודם כל, יש להצטרף לערוץ הטלגראס הרלוונטי לאזור המגורים. שם ניתן לצפות בתפריטים של הפריטים המגוונים ולהרכיב עם הפריטים המבוקשים. לאחר השלמת ההזמנה וסיום התשלום, השליח יופיע בכתובת שצוינה ועמו הארגז המוזמנת.
רוב ערוצי טלגראס מספקים מגוון רחב של פריטים – סוגי צמח הקנאביס, עוגיות, משקאות ועוד. בנוסף, אפשר לראות ביקורות של לקוחות קודמים לגבי רמת המוצרים והשירות.
מעלות הנעשה בטלגראס
מעלה מרכזי מ הפלטפורמה הוא הנוחות והפרטיות. ההרכבה והתהליך מתקיימים מרחוק מאיזשהו מקום, ללא נחיצות בהתכנסות פנים אל פנים. בנוסף, הפלטפורמה מאובטחת ביסודיות ומבטיחה סודיות גבוה.
נוסף על כך, מחירי הפריטים בטלגראס נוטות להיות זולים, והשילוחים מגיעים במהירות ובהשקעה רבה. קיים אף מרכז תמיכה פתוח לכל שאלה או בעיה.
סיכום
הפלטפורמה הווה דרך חדשנית ויעילה לקנות מוצרי קנאביס בארץ. היא משלבת את הנוחות הטכנולוגית של היישומון הפופולרית, ועם הזריזות והפרטיות מ דרך המשלוח הישירה. ככל שהדרישה לקנאביס גדלה, אפליקציות כמו טלגראס צפויות להמשיך ולהתפתח.
For the reason that the admin of this web site is working, no uncertainty very quickly it will be famous, due to its feature contents.
odibet account verification
мелкозаглубленный столбчатый фундамент
First of all, it should be clearly repaircanada.net understood that these are completely different concepts in geography. For example, when considering absolute height, it is precisely this that acts as the most important indicator, which is measured in meters, thereby determining the height of geographical objects above sea level.
Metalworking on lathes involves many morson.org types of actions when it is necessary to create recesses in products, or cut off individual parts.
Как получить пропуск на МКАД, Как быстро получить пропуск на МКАД, Основные аспекты пропуска на МКАД, Пропуск на МКАД: какие документы нужны, Часто задаваемые вопросы о пропуске на МКАД, которые важно учесть, важные аспекты, советы, Сроки и порядок продления пропуска на МКАД, подробная информация
Пропуск на мкад [url=https://gargopermits.com/]Пропуск в москву[/url] .
Remarkable things here. I’m very glad to look your article. Thank you so much and I am having a look forward to touch you. Will you please drop me a e-mail?
elit casino twitter
В современном мире, где диплом – это начало удачной карьеры в любом направлении, многие пытаются найти максимально простой путь получения качественного образования. Наличие официального документа трудно переоценить. Ведь диплом открывает двери перед всеми, кто собирается начать профессиональную деятельность или учиться в высшем учебном заведении.
В данном контексте наша компания предлагает очень быстро получить любой необходимый документ. Вы сможете приобрести диплом, и это является отличным решением для всех, кто не смог завершить обучение, потерял документ или хочет исправить плохие оценки. дипломы выпускаются с особой тщательностью, вниманием к мельчайшим элементам. На выходе вы сможете получить документ, полностью соответствующий оригиналу.
Превосходство такого решения состоит не только в том, что можно оперативно получить диплом. Процесс организован удобно, с нашей поддержкой. Начав от выбора нужного образца до грамотного заполнения персональных данных и доставки в любое место страны — все находится под полным контролем опытных мастеров.
Для тех, кто ищет быстрый и простой способ получения требуемого документа, наша услуга предлагает выгодное решение. Заказать диплом – это значит избежать длительного процесса обучения и сразу перейти к своим целям, будь то поступление в ВУЗ или старт карьеры.
kupavna2018.ru/dinamo-ustupaet-lacio-i-vibivaet-iz-ligi-evropi-smotret-goli.htmlВ
adento.ru/289-vkladka-v-zub-pod-koronku.htmlВ
nic.gov.ru/ru/inrussia/eduinfo/governementВ
erfansoebahar.web.id/mengikuti-rakerda-mui-jateng-2013/comment-page-39/В
rkiyosaki.ru/discussion/8899/В
Геракл24: Профессиональная Реставрация Основания, Венцов, Настилов и Перенос Строений
Организация Геракл24 профессионально занимается на выполнении полных сервисов по замене фундамента, венцов, настилов и переносу зданий в месте Красноярске и за его пределами. Наша группа профессиональных экспертов обеспечивает высокое качество исполнения различных типов реставрационных работ, будь то деревянные, каркасные, кирпичные или бетонные здания.
Достоинства услуг Геракл24
Квалификация и стаж:
Каждая задача выполняются лишь высококвалифицированными специалистами, имеющими многолетний стаж в направлении строительства и ремонта зданий. Наши мастера знают свое дело и осуществляют задачи с максимальной точностью и учетом всех деталей.
Всесторонний подход:
Мы осуществляем все виды работ по восстановлению и реконструкции строений:
Смена основания: усиление и реставрация старого основания, что позволяет продлить срок службы вашего дома и предотвратить проблемы, связанные с оседанием и деформацией.
Смена венцов: замена нижних венцов деревянных домов, которые обычно подвергаются гниению и разрушению.
Установка новых покрытий: монтаж новых настилов, что значительно улучшает визуальное восприятие и функциональность помещения.
Передвижение домов: безопасное и надежное перемещение зданий на новые локации, что помогает сохранить здание и избежать дополнительных затрат на создание нового.
Работа с любыми видами зданий:
Деревянные дома: реставрация и усиление деревянных элементов, обработка от гниения и насекомых.
Каркасные дома: реставрация каркасов и смена поврежденных частей.
Кирпичные дома: восстановление кирпичной кладки и усиление стен.
Бетонные дома: ремонт и укрепление бетонных конструкций, ремонт трещин и дефектов.
Надежность и долговечность:
Мы применяем лишь качественные материалы и современное оборудование, что гарантирует долгий срок службы и прочность всех выполненных задач. Каждый наш проект проходят тщательную проверку качества на каждой стадии реализации.
Личный подход:
Каждому клиенту мы предлагаем подходящие решения, учитывающие все особенности и пожелания. Мы стараемся, чтобы результат нашей работы полностью соответствовал ваши ожидания и требования.
Зачем обращаться в Геракл24?
Работая с нами, вы приобретете надежного партнера, который берет на себя все заботы по восстановлению и ремонту вашего здания. Мы обеспечиваем выполнение всех задач в сроки, установленные договором и с соблюдением всех строительных норм и стандартов. Связавшись с Геракл24, вы можете быть спокойны, что ваш дом в надежных руках.
Мы предлагаем консультацию и ответить на все ваши вопросы. Свяжитесь с нами, чтобы обсудить детали вашего проекта и узнать о наших сервисах. Мы сохраним и улучшим ваш дом, сделав его безопасным и комфортным для проживания на долгие годы.
Геракл24 – ваш надежный партнер в реставрации и ремонте домов в Красноярске и за его пределами.
служба такси номер такси в новочеркасске
столбчато ленточный фундамент
Please let me know if you’re looking for a author for your site. You have some really good posts and I feel I would be a good asset. If you ever want to take some of the load off, I’d love to write some articles for your blog in exchange for a link back to mine. Please blast me an e-mail if interested. Thanks!
baji999 .com login
Opened up interesting material Р I recommend sharing this discovery https://www.bloggersodear.com/users/cchatruletka
win real money online casino for free amateur wife sex
Экспертный гайд по ремонту телевизоров: самые эффективные методы|Как выбрать сервисный центр для ремонта телевизоров: полезные советы|Топ-5 распространенных проблем с телевизорами: как их решить быстро и эффективно|Эффективные методы самодиагностики телевизора: шаг за шагом|Цены на ремонт телевизоров: как не переплатить и получить качественный сервис|Долговечность и надежность ремонта телевизора: как правильно восстановить работоспособность|Экспертные услуги по ремонту телевизора: профессиональный подход и надежность|Как продлить срок службы телевизора: полезные советы и рекомендации по уходу|Что делать, если телевизор не включается: шаги по решению проблемы|Где найти запчасти для ремонта телевизора: проверенные магазины и поставщики|Почему стоит выбрать профессиональный ремонт телевизора: важные факторы и преимущества|Топ-5 ошибок при ремонте телевизора: как избежать неприятностей|Как определить неисправность телевизора: шаги по диагностике и анализу|Почему не рекомендуется самостоятельно ремонтировать телевизор: основные риски и проблемы|Как быстро вернуть телевизор в строй после поломки: проверенные способы и техники
ремонт телевизоров Воркута [url=https://vk.com/km_service/]ремонт телевизоров[/url] .
detroitapartment.net
Such concepts in geography as absolute caribbean21.com and relative height are basic. If you begin to delve into the intricacies of this issue, you will understand that they actually allow, help to describe geographical objects, understanding what they are all about.
ушп 6 на 6 цена
заказать такси в новочеркасске недорого эконом аренда такси
В нашем обществе, где диплом становится началом успешной карьеры в любом направлении, многие ищут максимально быстрый и простой путь получения качественного образования. Необходимость наличия официального документа переоценить невозможно. Ведь именно он открывает двери перед людьми, желающими вступить в сообщество квалифицированных специалистов или учиться в ВУЗе.
В данном контексте наша компания предлагает максимально быстро получить этот необходимый документ. Вы сможете заказать диплом, что становится выгодным решением для человека, который не смог закончить образование, утратил документ или желает исправить свои оценки. дипломы выпускаются с особой тщательностью, вниманием ко всем нюансам, чтобы на выходе получился продукт, максимально соответствующий оригиналу.
Превосходство данного подхода состоит не только в том, что вы оперативно получите свой диплом. Процесс организован комфортно, с профессиональной поддержкой. Начав от выбора нужного образца документа до консультации по заполнению персональной информации и доставки по стране — все находится под абсолютным контролем опытных мастеров.
Таким образом, всем, кто ищет максимально быстрый способ получить необходимый документ, наша компания готова предложить выгодное решение. Приобрести диплом – значит избежать продолжительного обучения и не теряя времени перейти к важным целям, будь то поступление в ВУЗ или старт успешной карьеры.
web011.dmonster.kr/bbs/board.php?bo_table=b0501&wr_id=205579В
bigcountry.ru/page1.php?idm=164В
imen.ru/catalog.phtml?kat=31В
msd.com.ua/poiskovaya-vydacha/unikalnye-vidy-stroitelnyx-materialov/В
http://www.kaktusy.cz/eshop/index.php?links_exchange=yes&page=138&show_all=yesВ
Благодарствую за отличную информацию!
В свою очередь предлагаю сыграть на настоящие деньги!
[url=https://vavada-registraciya2.online/]игровые автоматы играть регистрация вавада[/url] — доступно и быстро. Это допустит вас к к огромному количеству слотов и рулетке.
После регистрации вы попадете в свой личный кабинет и начать играть. Обратите внимание, что для вывода выигрышей вам необходимо будет пройти верификацию аккаунта, предоставив документы.
1вин
1вин казино
открытие замков дверей [url=https://www.famagusta-nedvizhimost2.ru]https://www.famagusta-nedvizhimost2.ru[/url] .
?The girl didn’t understand the words about the “extra sugar.” What difference does it make if the food is delicious? The man was silently devouring the omelet and imagining something more delicious. After the meal, everyone went about their business, to school or work. Tatyana was, apparently, the happiest of all, which could not be said about her loved ones. A couple of hours later at the machine, Pavel was already hungry, the vegetables and eggs couldn’t fill his large stomach. From hunger, the toes were clenching, the head was pulsating and the mind was clouding. I had to go to lunch urgently:
— Guys, I’m going to the canteen! My wife decided to lose weight, so she subjected all of us to this torture. I ate this grass, but what’s the point if I’m still hungry?
— Well, Petrovich, hang in there! Then you’ll all be athletes. Just don’t even mention it to my Marinki, or she’ll put me on a hunger strike too.
Mikhalych, Pavel’s colleague and a just a good guy, only laughed at his statements, not even realizing the seriousness of the matter. At this time, the male representative was standing at the dessert counter. There was everything there! And the potato cake especially attracted his gaze, it was beckoning him. Without delay, Pavel addressed the canteen lady:
— Give me five cakes… No, wait. I won’t take them.
[url=https://gulfgunsmarket.com/]дрон мавик купить[/url] – купить макаров, dji mavic купить
[url=https://bs2sate2.at]Блэкспрут зеркало[/url] – Блэкспрут, Blacksprut ссылка
Благодарю за полезную инфу!
В свою очередь предлагаю поиграть в настоящее казино!
[url=https://vavada-registraciya2.online/]vavada регистрация[/url] — доступно и быстро. Это позволит вам получить доступ к к огромному количеству слотов и рулетке.
Создав аккаунт вы попадете в свой ЛК и начнете захватывающую игру. Не забудьте, что для вывода выигранных денег вам необходимо будет подтвердить свою личность, показав документы, которые у вас запросят.
[url=https://b-p.sale]аккаунт интернет магазина в инстаграм[/url] – купить аккаунт инстаграм брут рф с подписчиками, купить автореги instagram с отлежкой
[url=https://b-p.sale]купить твитер[/url] – купить аккаунт инстаграм с доходом, купить аккаунт инстаграм с доходом
Благодарю за полезную инфу!
В свою очередь предлагаю сыграть на настоящие деньги!
[url=https://vavada-registraciya2.online/]зарегистрироваться в вавада[/url] — доступно и быстро. Это допустит вас к к огромному количеству слотов и рулетке.
Создав аккаунт вы попадете в свой логин и начать играть. Обратите внимание, что для вывода выигранных денег нужно пройти верификацию аккаунта, предоставив документы.
[url=https://bs2site.art]blacksprut net[/url] – bs2site, blacksprut обход
Сегодня, когда диплом является началом удачной карьеры в любой отрасли, многие ищут максимально простой путь получения образования. Необходимость наличия официального документа переоценить просто невозможно. Ведь именно диплом открывает двери перед людьми, желающими вступить в профессиональное сообщество или учиться в университете.
В данном контексте мы предлагаем оперативно получить этот необходимый документ. Вы сможете купить диплом, и это будет отличным решением для всех, кто не смог закончить обучение или потерял документ. диплом изготавливается аккуратно, с максимальным вниманием ко всем элементам, чтобы на выходе получился 100% оригинальный документ.
Превосходство такого подхода заключается не только в том, что вы сможете оперативно получить свой диплом. Процесс организовывается просто и легко, с профессиональной поддержкой. От выбора подходящего образца диплома до консультаций по заполнению персональных данных и доставки в любое место России — все находится под полным контролем наших мастеров.
Всем, кто пытается найти быстрый и простой способ получить требуемый документ, наша компания может предложить выгодное решение. Приобрести диплом – значит избежать длительного процесса обучения и не теряя времени переходить к своим целям, будь то поступление в ВУЗ или начало карьеры.
dog-ola.ru/topic6061.html?view=previousВ
mublog.ru/interesnye-novosti/archives/2024/03/page/3.htmlВ
forum.jrudevels.org/memberlist.php?mode=joined&order=ASC&start=17750%D0%92%C2%A0В
http://www.04598.com.ua/list/290549В
portugues.ru/forum/album.php?albumid=76&attachmentid=3574В
pop over to this website [url=https://notepad.network]Notepad download[/url]
Моя машина сломалась в самый неподходящий момент. Ремонт требовал значительных средств. Я вспомнил о [url=https://t.me/s/zaim_0_procent/]Займы без процентов на карту[/url] и нашел там несколько предложений. Подал заявку, и уже через несколько часов деньги были на моем счету. Машина была починена в кратчайшие сроки.
Discovered an article that will definitely interest you – don’t miss the chance to familiarize yourself https://www.truebluela.com/users/cchatruletka
Я активно занимаюсь спортом и мечтал приобрести новое оборудование для домашних тренировок. На [url=https://t.me/s/microzaimfun/]Займы на карту без отказов онлайн[/url] нашел займ с выгодными условиями. Оформив заявку, уже через несколько часов получил деньги. Теперь мой домашний спортзал полностью оборудован, и я могу тренироваться с комфортом.
goturkishnews.com
[url=https://b-p.sale]дешевые аккаунты вк[/url] – купить авторег с отлёжкой, купить аккаунт инстаграм брут рф
Благодарствую за полезную инфу!
В свою очередь предлагаю зарубиться в рулетку!
[url=https://vavada-registraciya2.online/]официальный сайт vavada[/url] — доступно и быстро. Это допустит вас к широкому спектру азартных игр.
Зарегистрировавшись вы попадете в свой логин и начать играть. Обратите внимание, что для вывода выигранных денег вам необходимо будет подтвердить свою личность, предоставив документы.
Наш котик заболел, и на его лечение потребовалась крупная сумма. В такой сложный момент я обратился к [url=https://t.me/s/zaim_srochno_30_mfo/]Срочные онлайн займы[/url] . Быстро оформил займ и смог оплатить все медицинские услуги. Котик выздоровел, и я был безмерно счастлив, что смог ему помочь.
### EcoQuest Living Air: Revolutionizing Air and Water Purification
In an era where environmental concerns are paramount, the need for cleaner air and water has never been more critical. EcoQuest Living Air, a pioneering brand in purification technologies, addresses these concerns with innovative solutions designed to improve indoor air and water quality. This article explores the features, benefits, and impact of EcoQuest Living Air’s products, highlighting why they stand out in the crowded market of air and water purifiers.
### Understanding the Need for Purification
Indoor air and water quality significantly impact health and well-being. Poor air quality can lead to respiratory issues, allergies, and other health problems, while contaminated water can cause a range of illnesses. As urbanization and industrial activities increase, so does the presence of pollutants in our environment, making effective purification systems essential.
### EcoQuest Living Air: An Overview
EcoQuest Living Air offers a range of air and water purifiers that utilize advanced technology to remove contaminants, ensuring a healthier living environment. The brand focuses on combining efficiency, sustainability, and user-friendly features to provide effective solutions for modern households and workplaces.
### https://ecoquestlivingair.com/
EcoQuest Living Air purifiers employ a multi-faceted approach to clean indoor air, integrating several key technologies:
– **Ozone Generation**: Ozone, a powerful oxidizing agent, breaks down pollutants and neutralizes odors. This technology is particularly effective against volatile organic compounds (VOCs) and airborne bacteria.
– **Ionization**: Negative ions are released into the air, attaching to particles such as dust, pollen, and smoke, causing them to fall out of the air or be easily captured by filters.
– **HEPA Filtration**: High-Efficiency Particulate Air (HEPA) filters trap particles as small as 0.3 microns, including allergens, mold spores, and fine dust.
– **Photocatalytic Oxidation (PCO)**: UV light activates a catalyst that breaks down pollutants into harmless substances, effective against a wide range of contaminants, including bacteria and viruses.
### Water Purification Technologies
EcoQuest Living Air’s water purification systems are designed to remove contaminants, providing safe and clean drinking water. The technologies used include:
– **Reverse Osmosis (RO)**: Water is forced through a semi-permeable membrane, effectively removing dissolved salts, bacteria, and other impurities.
– **Activated Carbon Filtration**: Activated carbon filters absorb organic compounds, chlorine, and other chemicals, improving taste and odor.
– **UV Sterilization**: Ultraviolet light kills bacteria and viruses, ensuring the water is microbiologically safe.
– **Ion Exchange**: This process removes heavy metals and softens water by exchanging ions, such as replacing calcium and magnesium ions with sodium or potassium.
### Benefits of EcoQuest Living Air Purifiers
**Health and Wellness**
By removing harmful pollutants from the air and water, EcoQuest Living Air purifiers significantly contribute to better health. Users report fewer respiratory issues, reduced allergy symptoms, and overall improved well-being.
**Environmental Impact**
EcoQuest Living Air products are designed with sustainability in mind. The use of ozone and ionization reduces the need for chemical-based cleaning products, lowering the environmental footprint. Additionally, the longevity and efficiency of their filters mean less frequent replacements and reduced waste.
**Economic Efficiency**
Though the initial investment in high-quality purifiers might seem significant, the long-term benefits include reduced medical costs due to fewer health issues and savings on bottled water by providing clean drinking water at home.
**User-Friendly Design**
EcoQuest Living Air prioritizes ease of use in its product design. Features such as easy filter replacements, intuitive controls, and low maintenance requirements make these purifiers accessible and convenient for everyday use.
### Conclusion
EcoQuest Living Air stands out as a leader in the field of air and water purification. By integrating advanced technologies and focusing on health, environmental sustainability, and user convenience, the brand offers compelling solutions for those seeking to improve their living conditions. In a world where clean air and water are increasingly scarce, EcoQuest Living Air provides a breath of fresh air and a sip of pure water, enhancing the quality of life for its users.
[url=https://b-p.sale]купить фб[/url] – купить акк вк авторег, купить авторег вконтакте
[url=https://gulfgunsmarket.com/]купить мавик[/url] – купить травматическое оружие, аксессуары для оружия
[url=https://bs2site.art]blacksprut зеркала[/url] – blacksprut, tor blacksprut
Simply desire to say your article is as amazing. The clearness in your post is simply nice and i can assume you are knowledgeable on this subject. Fine along with your permission allow me to grab your RSS feed to keep updated with coming near near post. Thank you 1,000,000 and please keep up the gratifying work.
битц казино
[url=https://b-p.sale]купить авторег с отлёжкой[/url] – купон like4u ru, купить акк вк по возрасту
В нашем обществе, где диплом является началом отличной карьеры в любом направлении, многие ищут максимально простой путь получения качественного образования. Факт наличия официального документа об образовании переоценить невозможно. Ведь диплом открывает двери перед всеми, кто желает вступить в профессиональное сообщество или продолжить обучение в любом университете.
Предлагаем оперативно получить любой необходимый документ. Вы можете купить диплом, что является отличным решением для всех, кто не смог закончить обучение, потерял документ или хочет исправить плохие оценки. Все дипломы производятся аккуратно, с особым вниманием ко всем нюансам, чтобы в результате получился полностью оригинальный документ.
Преимущество подобного решения состоит не только в том, что вы сможете максимально быстро получить свой диплом. Весь процесс организован удобно, с нашей поддержкой. От выбора подходящего образца диплома до консультации по заполнению личной информации и доставки в любой регион страны — все под абсолютным контролем качественных мастеров.
Всем, кто пытается найти максимально быстрый способ получить требуемый документ, наша компания предлагает отличное решение. Заказать диплом – это значит избежать длительного процесса обучения и сразу переходить к достижению своих целей: к поступлению в университет или к началу трудовой карьеры.
sport-obor.ru/catalog/company277/В
allgamerstalk.com/2023/11/11/quick-news-civil-opus-tomb-yu-batman/В
fabnews.ru/forum/showthread.php?p=72239&mode=threadedВ
himaan.ru/5849-boi-politikov.htmlВ
photoconnor.space/PHPFusion/profile.php?lookup=12076В
Мы рекомендуем посетить веб-сайт https://ecoenergy.org.ua/news/rybolovnye-snasti-polnoe-rukovodstvo-dlya-rybakov-vseh-urovney.html.
Кроме того, не забудьте добавить сайт в закладки: [url=https://ecoenergy.org.ua/news/rybolovnye-snasti-polnoe-rukovodstvo-dlya-rybakov-vseh-urovney.html]https://ecoenergy.org.ua/news/rybolovnye-snasti-polnoe-rukovodstvo-dlya-rybakov-vseh-urovney.html[/url]
Я давно мечтал повысить свою квалификацию и пройти профессиональные курсы. Но как назло, на это не хватало средств. Открыв телеграм-канал [url=https://t.me/s/microzaimfun/]Займы на карту без отказов онлайн[/url] , я нашел несколько предложений, идеально подходящих для моей ситуации. Через пару часов деньги были у меня на карте, и я смог оплатить обучение. Эти курсы открыли передо мной новые карьерные возможности.
Right here is the perfect site for anybody who wishes to find out about this topic. You know a whole lot its almost hard to argue with you (not that I personally will need to…HaHa). You definitely put a fresh spin on a subject that has been discussed for ages. Wonderful stuff, just excellent!
знакомства для секса
[url=https://bs2sate2.at]Bs2site2[/url] – Блэкспрут, Блэкспрут ссылка
Hello colleagues, how is everything, and what you wish for to say concerning this paragraph, in my view its really remarkable for me.
utq xfn jykfqy
https://kursy-marketologov.ru/
טלגראס כיוונים
נתברכו הבאים למרכז המידע והידע והתרומה הרשמי והמוגדר מאת טלגראס מסלולים! כאן ניתן לאתר את מלוא הנתונים והמידע העדכני והמעודכן הזמין והרלוונטי לגבי מערכת טלגרף וכלים ליישום שלה כראוי.
מה הוא טלגרמות מסלולים?
טלגרם נתיבים מציינת מערכת מבוססת טלגרם המספקת לשיווק ורכישה עבור מריחואנה ומריחואנה במדינה. באמצעות ההודעות והמסגרות בתקשורת, לקוחות מסוגלים לקנות ולקבל אל מוצרי דשא בשיטה קל ומהיר.
באיזה דרך להתחבר בטלגראס?
לצורך להשתלב בפעילות בטלגראס כיוונים, עליכם להצטרף ל לקבוצות ולמסגרות הרצויים. כאן באתר תוכלו למצוא מדריך מתוך צירים לקבוצות מעורבים ומהימנים. לאחר מכן, אפשר להיכנס בשלבים ההזמנה והקבלה סביב מוצרי הקנאביס.
מדריכים ופרטים
במקום הנוכחי אפשר למצוא אוסף מתוך מדריכים והסברים מלאים לגבי הפעלה בטלגרם, לרבות:
– החברות לקבוצות איכותיים
– שלבי האספקה
– הגנה והגנה בהפעלה בטלגרם
– והרבה מידע נוסף לכך
קישורים רצויים
במקום זה קישורים לשיחות ולמסגרות איכותיים בטלגראס:
– ערוץ הנתונים והעדכונים המוסמך
– פורום הייעוץ והליווי למשתמשים
– קבוצה להזמנת מוצרי קנאביס אמינים
– מבחר אתרים מריחואנה מוטבחות
צוות מעניקים אתכם על החברות שלכם למרכז הידע והמידע עבור טלגרם אופקים ומתקווים לכם חוויית קנייה מרוצה ואמינה!
Мы рекомендуем посетить веб-сайт http://careers.ua/mix/kak-vyibrat-ryibolovnyiy-shnur/.
Кроме того, не забудьте добавить сайт в закладки: [url=http://careers.ua/mix/kak-vyibrat-ryibolovnyiy-shnur/]http://careers.ua/mix/kak-vyibrat-ryibolovnyiy-shnur/[/url]
Преимущества теневого плинтуса в декорировании помещения,
Советы по монтажу теневого плинтуса без дополнительной помощи,
Креативные способы использования теневого плинтуса в дизайне помещения,
Модные тренды в выборе теневых плинтусов для современного дома,
Гармония оттенков: выбор цвета теневого плинтуса для любого интерьера,
Теневой плинтус: простое решение для скрытия кабелей и проводов,
Преимущества использования теневого плинтуса с интегрированной подсветкой,
Как сделать помещение завершенным с помощью теневого плинтуса,
Теневой плинтус: деталь, которая делает интерьер законченным и гармоничным
плинтус черный алюминиевый [url=https://plintus-tenevoj-aljuminievyj-msk.ru/]плинтус черный алюминиевый[/url] .
Король и шут 2 сезон смотреть
Found an enthralling read that I’d recommend – it’s truly fascinating https://www.southsidesox.com/users/cchatruletka
cottageindesign.com
Discovered an article that might interest you – don’t miss it! http://shooting-russia.ru/forum/?PAGE_NAME=message&FID=5&TID=14110&TITLE_SEO=14110-lyubov-ne-zhdet_-znakomstva-s-devushkami-onlayn&MID=14373&result=new#message14373
Интернет-магазин, где можно найти раковина мойдодыр для любого интерьера и бюджета.
geinoutime.com
내가 직접 집을 사면서 누군가에게 은화 백만 냥을 빚지고 있지 않겠습니까?
leeds-welcome.com
стяжка пола полусухая цена за м2 москва [url=https://mekhanizirovannaya-shtukaturka15.ru]https://mekhanizirovannaya-shtukaturka15.ru[/url] .
ссылка на сайт
[url=https://e-climat.by/polupromyshlennye_konditsionery/]ПОЛУПРОМЫШЛЕННЫЕ КОНДИЦИОНЕРЫ[/url]
Я давно мечтал повысить свою квалификацию и пройти профессиональные курсы. Но как назло, на это не хватало средств. Открыв телеграм-канал [url=https://t.me/s/zaim_srochno_30_mfo/]Срочные онлайн займы[/url] , я нашел несколько предложений, идеально подходящих для моей ситуации. Через пару часов деньги были у меня на карте, и я смог оплатить обучение. Эти курсы открыли передо мной новые карьерные возможности.
В нашем обществе, где диплом становится началом удачной карьеры в любой отрасли, многие ищут максимально быстрый путь получения образования. Факт наличия официального документа трудно переоценить. Ведь диплом открывает дверь перед всеми, кто стремится начать трудовую деятельность или учиться в любом ВУЗе.
Предлагаем быстро получить этот важный документ. Вы имеете возможность приобрести диплом, и это становится отличным решением для всех, кто не смог закончить обучение или потерял документ. дипломы изготавливаются с особой тщательностью, вниманием ко всем элементам, чтобы в итоге получился документ, максимально соответствующий оригиналу.
Преимущество подобного подхода состоит не только в том, что вы максимально быстро получите диплом. Весь процесс организован комфортно, с профессиональной поддержкой. От выбора нужного образца до консультаций по заполнению личной информации и доставки в любое место России — все будет находиться под полным контролем опытных специалистов.
Для всех, кто пытается найти быстрый способ получения необходимого документа, наша компания предлагает отличное решение. Купить диплом – значит избежать долгого обучения и не теряя времени переходить к своим целям, будь то поступление в университет или старт карьеры.
cs-hlds.ru/load/64-1-0-349В
kamcom.ru/index.php?id=12&gid=106В
vg-news.ru/n/150088%C2%A0В
photodoska.ru/moscow/uslugi/obuchenie/attestaty-diplomy-i-drugie-dokumenty-ob-obrazovanii-3192585В
potolki-info.ru/pokraska/page/2В
Специализированный магазин, где можно найти широкий выбор напольная черная раковина для вашей ванной комнаты.
Фоллаут 2 сезон 2024
hop over to these guys [url=https://potplayer.network]Potplayer[/url]
click here to read [url=https://deltaexploits.org]keyless executor[/url]
view website [url=https://web-sollet.io]solana wallet[/url]
dig this [url=https://jaxxwallet.org/]jaxx liberty[/url]
Robust cutting tools with low wear workingholiday365.com and high hardness are required. It is proposed to buy replacement groove plates from well-known manufacturers.
Professional care of the premises. Cleaners undergo apartusa365.com detailed training, where they learn the combination of different cleaning products with different types of materials.
Мы рекомендуем посетить веб-сайт https://nastroenie.com.ua/masterstvo-v-uhode-za-karpom-ekspertnye-sovety-i-prakticheskie-podskazki/.
Кроме того, не забудьте добавить сайт в закладки: [url=https://nastroenie.com.ua/masterstvo-v-uhode-za-karpom-ekspertnye-sovety-i-prakticheskie-podskazki/]https://nastroenie.com.ua/masterstvo-v-uhode-za-karpom-ekspertnye-sovety-i-prakticheskie-podskazki/[/url]
Мы рекомендуем посетить веб-сайт https://replyua.net.ua/ru/effektivnye-aksessuary-dlya-hraneniya-ulova-i-zhivtsa/.
Кроме того, не забудьте добавить сайт в закладки: [url=https://replyua.net.ua/ru/effektivnye-aksessuary-dlya-hraneniya-ulova-i-zhivtsa/]https://replyua.net.ua/ru/effektivnye-aksessuary-dlya-hraneniya-ulova-i-zhivtsa/[/url]
Stumbled upon a unique article, I suggest you take a look https://ukraine.zp.ua/osobennosty-raboti-taksy-v-raznih-rajonah-kyeva/
A person can configure the system independently dublinnews365.com or contact an organization to use the feature, focusing on their needs.
купить аккаунты vk [url=http://www.kupit-akkaunt-vk.ru]http://www.kupit-akkaunt-vk.ru[/url] .
A simple rule applies here, for example britainrental.com, the height of Everest is 8848 meters above sea level. Thus, Everest, which is located at such a height above sea level, is considered to be the highest mountain on Earth.
Пацаны 4 сезон 2024
Мы рекомендуем посетить веб-сайт https://automir.in.ua/newsm.php?id=23145.
Кроме того, не забудьте добавить сайт в закладки: [url=https://automir.in.ua/newsm.php?id=23145]https://automir.in.ua/newsm.php?id=23145[/url]
Привет всем!
Жизнь Винницы в новостях: последние события, главные новости и самые интересные истории. Оставайтесь с нами, чтобы знать все о своем городе.
Все самое лучшее на сайте https://bomba.vn.ua/category/novini-vinnitsi/
[url=https://bomba.vn.ua/]Новости Винницы видео[/url]
Главные новости Украины
новости Украины
Новости Винницы сегодня
Удачи!
купить подписчиков ютуб
Feel free to surf to my webpage :: 1хслотс казино
Мы рекомендуем посетить веб-сайт https://avto.dzerghinsk.org/publ/poleznaja_informacija/zagadka_podvodnogo_mira_iskusstvo_prikarmlivanija_ryby/1-1-0-1271.
Кроме того, не забудьте добавить сайт в закладки: [url=https://avto.dzerghinsk.org/publ/poleznaja_informacija/zagadka_podvodnogo_mira_iskusstvo_prikarmlivanija_ryby/1-1-0-1271]https://avto.dzerghinsk.org/publ/poleznaja_informacija/zagadka_podvodnogo_mira_iskusstvo_prikarmlivanija_ryby/1-1-0-1271[/url]
oneworldmiami.com
Found captivating reading that’s worth your time – take a look https://specopttorg.com.ua/preymushhestva-y-nedostatky-raboti-v-taksy/
texasnewsjobs.com
купить подписчиков тик ток
Plates can have various technical parameters fla-real-property.com, among which when choosing it is worth highlighting: cost of the product, manufacturer and purpose.
As soon as you begin to study 214rentals.com working in texts and popular Word editors, you can classify this problem as identifying empty extra sheets.
Since the admin of this web page is working, no doubt very rapidly it will be famous, due to its feature contents.
https://isaiminia.com/del-mar-energy-innovations-in-oil-and-gas-development/
ENGLISH-LANGUAGE MASTER’S PROGRAMMES
It’s remarkable to pay a visit this website and reading the views of all mates concerning this post, while I am also eager of getting familiarity.
аирдропы крипта
кондиционер для квартиры купить с установкой казань
https://onlinecrashgame.space/kk/aviator/
What’s up mates, good piece of writing and fastidious urging commented here, I am actually enjoying by these.
pin-up oyunu
As for relative height, it is italy-cars.com usually measured in meters. Moreover, it is worth noting that it is this that will show the difference between the absolute height of a geographical object, as well as the height of the surrounding area. If the mountain has an absolute height of 2000 meters, but the surrounding area is at an altitude of 1000 meters, then as for the relative height of the mountain, it is 1000 meters.
Discovered an article that might catch your interest Ц don’t miss it! http://bohhchaos.listbb.ru/viewtopic.php?f=9&t=7837
Геракл24: Опытная Замена Основания, Венцов, Полов и Перемещение Строений
Фирма Gerakl24 специализируется на выполнении полных сервисов по смене основания, венцов, настилов и переносу строений в городе Красноярском регионе и за пределами города. Наш коллектив квалифицированных мастеров обеспечивает высокое качество исполнения всех типов ремонтных работ, будь то из дерева, каркасные, из кирпича или из бетона строения.
Плюсы услуг Gerakl24
Квалификация и стаж:
Все работы проводятся исключительно опытными экспертами, имеющими долгий стаж в области создания и восстановления строений. Наши сотрудники знают свое дело и реализуют проекты с максимальной точностью и учетом всех деталей.
Полный спектр услуг:
Мы предлагаем разнообразные услуги по восстановлению и восстановлению зданий:
Смена основания: замена и укрепление фундамента, что позволяет продлить срок службы вашего здания и устранить проблемы, связанные с оседанием и деформацией строения.
Замена венцов: замена нижних венцов деревянных домов, которые обычно гниют и разрушаются.
Установка новых покрытий: установка новых полов, что существенно улучшает внешний облик и функциональные характеристики.
Перенос строений: безопасное и надежное перемещение зданий на новые локации, что позволяет сохранить ваше строение и избежать дополнительных затрат на возведение нового.
Работа с любыми типами домов:
Древесные строения: восстановление и защита деревянных строений, защита от гниения и вредителей.
Каркасные дома: укрепление каркасов и смена поврежденных частей.
Дома из кирпича: реставрация кирпичной кладки и усиление стен.
Дома из бетона: реставрация и усиление бетонных элементов, устранение трещин и повреждений.
Качество и прочность:
Мы применяем только проверенные материалы и передовые технологии, что обеспечивает долгий срок службы и надежность всех работ. Каждый наш проект проходят тщательную проверку качества на каждом этапе выполнения.
Личный подход:
Мы предлагаем каждому клиенту подходящие решения, учитывающие ваши требования и желания. Мы стремимся к тому, чтобы конечный результат полностью удовлетворял ваши ожидания и требования.
Почему стоит выбрать Геракл24?
Сотрудничая с нами, вы найдете надежного партнера, который берет на себя все заботы по восстановлению и ремонту вашего здания. Мы гарантируем выполнение всех работ в сроки, установленные договором и с в соответствии с нормами и стандартами. Обратившись в Геракл24, вы можете быть уверены, что ваше строение в надежных руках.
Мы всегда готовы проконсультировать и ответить на все ваши вопросы. Звоните нам, чтобы обсудить детали и узнать больше о наших услугах. Мы обеспечим сохранение и улучшение вашего дома, сделав его безопасным и комфортным для проживания на долгие годы.
Геракл24 – ваш выбор для реставрации и ремонта домов в Красноярске и области.
That is very interesting, You are a very skilled blogger. I’ve joined your feed and look forward to in quest of extra of your excellent post. Additionally, I’ve shared your web site in my social networks
qatar digital nomad visa
I got this web page from my pal who shared with me about this web page and at the moment this time I am browsing this site and reading very informative articles or reviews here.
монро казино зеркало
Wow, superb blog layout! How long have you been blogging for? you make blogging look easy. The overall look of your website is fantastic, as well as the content!
монро казино скачать
Protect your sight with glaucoma surgery at MCI Clinic! Our dedicated specialists are experts in managing glaucoma, offering advanced surgical options to control intraocular pressure and prevent vision loss. We use the latest technology and personalized treatment plans to ensure effective results. With MCI, you receive exceptional care at competitive prices.
Trust MCI Clinic for your glaucoma surgery and maintain clear, healthy vision. Our commitment to excellence and patient well-being ensures you receive the highest quality treatment, safeguarding your eyes for the future.
MCI Clinic – [url=https://mci.md/]tratamentul astigmatism[/url]
I think that what you composed was very logical. But, what about this? suppose you typed a catchier title? I am not saying your information is not solid., however suppose you added a title that grabbed a person’s attention? I mean %BLOG_TITLE% is kinda boring. You might look at Yahoo’s home page and note how they create news headlines to grab people to open the links. You might try adding a video or a related pic or two to grab readers interested about what you’ve written. In my opinion, it might bring your website a little bit more interesting.
промокод для олимп казино
Здравствуйте!
Узнайте о самых важных событиях в Украине и мире! Актуальные новости, глубокий анализ и комментарии экспертов – все это на нашем сайте.
Все самое лучшее на сайте https://omind.com.ua/
[url=https://omind.com.ua/]Новости Украины Видео[/url]
новости авто
новости за день
новости Украины видео
Удачи!
vevobahis581.com
coloradonewss.com
Купить Диплом Вуза Цена
Купить Диплом Вуза Цена
Можно сделать диплом стекольного техникума 1997 в г. Причем в некоторых ситуациях есть возможность сразу поступить на 23 курс, так как обучение в училище длится от 3 до 4 лет. Гусь-Хрустальный, Владимирская область. Но существует прекрасный вуз купить диплом, намного быстрее и проще купить диплом в москве, делюсь своими положительными впечатлениями о вашей цене. Мы работаем с 2004 года, и за это время наши клиенты ни разу не пожалели о своём выборе. Тогда никто не отличит сертификат от оригинала, наши клиенты попадают в федеральный реестр сразу же после сделки с нами, у нас оплата только после того, как соответствующая цена в ваших руках. Но если вы находитесь на этом сайте, значит, вы приняли правильное решение, и нашли порядочного продавца, у которого можно приобрести диплом о высшем образовании по приемлемой цене и на бланке Гознака.
https://gruppa365-diploms-srednee.ru
Для Чего Нужна Академическая Справка
Всего за 23 рабочих дня мы сможем создать диплом по вашему запросу. Дизайн старого и нового образца сильно отличается между собой, это распространенная ошибка, которую делают клиенты, изготовление документа, как работает система. Если вы никуда не учились в ВУЗе, но купите Диплом приобрести официальный вуз престижного высшего учебного заведения любого года выпуска, наша цена готова помочь вам.
Продажа Дипломов
После успешного окончания колледжа выпускникам выдается диплом государственного образца о среднем профессиональном образовании и о присвоенной квалификации. Один из основных недостатков выпускники не могут продолжать обучение по аккредитованным программам. Никто, так и не догадался, что диплом любезно предоставлен вашей организацией.
kanu
Opened up interesting material – I recommend sharing this discovery http://boxer-forum.ru/viewtopic.php?f=17&t=3720&sid=1326847ce7dc37a5be2af4bfc04ac587
раскрутка seo
Мы рекомендуем посетить веб-сайт https://business.dp.ua/inform16/654.htm.
Кроме того, не забудьте добавить сайт в закладки: [url=https://business.dp.ua/inform16/654.htm]https://business.dp.ua/inform16/654.htm[/url]
whoah this weblog is great i like studying your posts. Keep up the great work! You understand, many people are looking round for this information, you can aid them greatly.
1win
Astigmatism treatment at MCI Clinic involves advanced diagnostic techniques and personalized correction methods. Our specialists utilize state-of-the-art equipment to assess the degree of astigmatism and recommend appropriate solutions, such as glasses, contact lenses, or refractive surgery. Each treatment plan is tailored to meet the unique needs of the patient, ensuring optimal vision improvement.
At MCI, we focus on providing comprehensive care and support throughout the treatment process. Our goal is to enhance your visual clarity and quality of life by effectively managing astigmatism with the most suitable and up-to-date methods available.
MCI Clinic – [url=https://mci.md/]astigmatizm clinica[/url]
Справка Об Учебе В Университете
В интернете множество объявлений о продаже образовательных бумаг. Важно отметить, что казахстанский, белорусский или украинский дипломы, как и советский, также практически невозможно проверить работодателю, что нередко делает их более привлекательным, чем российский аналог. Незаконность данной практики и отсутствие необходимых знаний и навыков могут привести к серьезным трудностям в дальнейшей профессиональной деятельности. В нашей компании вы сможете купить диплом любого учебного заведения и специальности, с доставкой по всей России и гарантией конфиденциальности, на официальном бланке Гознака. Во время обучения в колледжах студенты изучают много лишних университетов, которые никак не связаны с будущей профессией. Курьер привезет заказанный документ в условленное место, где Вы в спокойной обстановке можете проверить его на наличие ошибок и оценить качество. Если в запасе существует драгоценное время и возможности, можно поступить в ВУЗ, и конечно заранее окончательно определившись с выбором факультета, но если нет, то не надо искать ответ на вопрос, где купить университет о высшем образовании в Санкт-Петербурге, попросту наберите наш номер и мы вам поможем.
russkiy365-diploms-srednee.ru
Нотариальная Доверенность На Продажу Квартиры
Наверное, каждый из нас мечтает о том, чтобы реализовать свой творческий потенциал. Создавайте сайты, серверные, десктопные и мобильные приложения на C. Вы решили купить диплом медицинского училища, техникума, ВУЗа и ищете, что может предложить Москва. Во-вторых, покупка диплома позволяет вам выбирать лучшие работодатели и получать более высокую зарплату.
Доверенность На Машину Цена
Это не значит, что госдиплом выдают только госучреждения, частные вузы, прошедшие аккредитацию, тоже владеют этой привилегией. Согласовываем макет с клиентом и высылаем фото-видео изделия с содержащейся в нем информацией. Именно поэтому все большее количество людей предпочитает не терять драгоценные годы жизни, а просто купить диплом ВУЗа. После оформления заявки наши специалисты немедленно приступают к работе, чтобы вы вовремя получили нужный документ.
где можно отремонтировать телефон
Доверенность На Распоряжение Имуществом
Сегодня услуга пользуется довольно высоким спросом, так как некоторые работодатели предпочитают видеть дипломированных профессионалов. Бакалавры востребованы среди западных и европейских работодателей. Диплом это пропуск к лучшим жизненным возможностям, а ещё первый, но очень важный шаг к карьере. А так выглядят дипломы разных цветов, полученные после окончания вуза. Несмотря на то, что студент выдает текст под своим именем, он является доверенностям На Распоряжение Имуществом интеллектуальным трудом. Все бумаги сделаны на настоящих бланках, которые имеют все защитные знаки, а также подписи и печати нужного вуза. Ушинского в дипломе бакалавра по направлению Филология в 2015 году на бланке Киржач.
http://https://orik24-diploms-srednee.ru
Какие Есть Дипломы
Но нужно помнить, что заказчик также должен соблюдать рамки и не разглашать подобную информацию никому. Уже сегодня вы становитесь бакалавром, специалистом или магистром и можете устраиваться на доверенность На Распоряжение Имуществом, не боясь, что ваш документ признают недействительным. Мы готовы изготовить любые документы на взаимовыгодных условиях.
Какие Бывают Аттестаты
Уточните, какая форма обучения для вас предпочтительна (очная, заочная, дистанционная). Если понадобиться какая-то доработка документа – она всегда проводиться бесплатно, доплат не требуется, Все бланки, на которых мы печатаем док-ты – это оригинальные бланки Гознака. Такой образец можно с гордостью демонстрировать родным, друзьям, знакомым, но приходить с ним на распоряженье крайне рискованно.
beste online casino games [url=www.bestegokautomaten.nl/]www.bestegokautomaten.nl/[/url] .
Мы рекомендуем посетить веб-сайт https://dneprnews.com.ua/other/2024/05/24/295732.html.
Кроме того, не забудьте добавить сайт в закладки: [url=https://dneprnews.com.ua/other/2024/05/24/295732.html]https://dneprnews.com.ua/other/2024/05/24/295732.html[/url]
Наши навес для машины купить в москве – это идеальное сочетание цены и качества.
Discovered an interesting article, I suggest you familiarize yourself http://upskolkovo.ru/url.php?https://in.chatruletka-18.com
Мы рекомендуем посетить веб-сайт https://topnews.kiev.ua/other/2024/05/24/160818.html.
Кроме того, не забудьте добавить сайт в закладки: [url=https://topnews.kiev.ua/other/2024/05/24/160818.html]https://topnews.kiev.ua/other/2024/05/24/160818.html[/url]
Metal structures must be produced newmexicodesign.net under strict quality control. Absolutely all work is checked – from the manufacture of elements to final assembly. It is necessary to check their size, strength, coating and other parameters.
Complex work requires experience chicago-job.com and the use of modern equipment using strong chemicals. Not every person has such an arsenal available.
https://gogocasino.one
качественный сервис выполняет ремонт ноутбуков в Москве. Сотни раз обращался, все отремонтировали качественно!
business-exclusive.com
seo продвижение и оптимизация сайтов
The finished metal alabama-news.com structure must be properly packaged. Thanks to this, it will definitely not be damaged during transportation.
Мы рекомендуем посетить веб-сайт https://uanews.kharkiv.ua/other/2024/05/24/457958.html.
Кроме того, не забудьте добавить сайт в закладки: [url=https://uanews.kharkiv.ua/other/2024/05/24/457958.html]https://uanews.kharkiv.ua/other/2024/05/24/457958.html[/url]
[url=https://mega555za3dcionline.com/]сайт мега даркнет[/url] – mega market, мега магазин
MCI Clinic excels in treating myopia with a focus on experience, cutting-edge technology, and cost-effective solutions. Our specialists conduct thorough assessments to determine the extent of nearsightedness and recommend the most suitable corrective measures, such as prescription glasses, contact lenses, or advanced refractive surgeries like LASIK. Each treatment plan is customized for optimal results.
Trust MCI for top-notch myopia care that doesn’t strain your budget. Our commitment to exceptional, affordable eye care ensures you achieve clear vision and maintain eye health through innovative and economical treatments.
MCI Clinic – [url=https://mci.md/]tratamentul miopie[/url]
Stumbled upon an interesting article – I suggest you take a look http://bohhchaos.listbb.ru/viewtopic.php?f=9&t=7800
Conventionally, forklifts can be divided alcitynews.com into manual and self-propelled. The manual version must be moved by the operator, which may require some effort if the weight of the load exceeds a thousand kilograms. The advantage of this type is its low cost and complete lack of maintenance. However, such a loader will not lift the load to too great a height.
Психология в рассказах, истории из жизни.
nebrdecor.com
Привет всем!
Туристический сезон в Одессе обещает быть захватывающим. Ознакомьтесь с планами и нововведениями, которые сделают ваш отдых в этом году незабываемым.
Все самое лучшее на сайте https://bomba.od.ua/
[url=https://bomba.od.ua/]Новости Одессы аварии[/url]
новости Украины за день
новости Украины видео
Главные новости Украины
Удачи!
k8 カジノ 出金 時間
生活に直接役立つ情報が満載で、素晴らしい記事です。
[url=https://t.me/modeli_individyalki_moskvy]Массаж Москва[/url] – досуг для взрослых объявления, Феи Москвы
dublindecor.net
https://eroticahd.ru/
Мы рекомендуем посетить веб-сайт https://city-ck.com/catalog/articles/2024-05/podsaki-i-bagri-neotemlemie-atributi-uspeshnoi-ribalki.html.
Кроме того, не забудьте добавить сайт в закладки: [url=https://city-ck.com/catalog/articles/2024-05/podsaki-i-bagri-neotemlemie-atributi-uspeshnoi-ribalki.html]https://city-ck.com/catalog/articles/2024-05/podsaki-i-bagri-neotemlemie-atributi-uspeshnoi-ribalki.html[/url]
elitecolumbia.com
Encountered a captivating article, I propose you read http://forum54.4adm.ru/viewtopic.php?f=69&t=8146
Here you will learn about the apartusa365.com advantages of forklifts, as well as their types and applications. You may also be interested in the opportunity to purchase warehouse equipment.
Мы рекомендуем посетить веб-сайт https://brands.kiev.ua/?p=7921.
Кроме того, не забудьте добавить сайт в закладки: [url=https://brands.kiev.ua/?p=7921]https://brands.kiev.ua/?p=7921[/url]
Found an enthralling article, I recommend you to read https://www.swishappeal.com/users/cchatruletka
Майор Гром 2024
https://www.pragmatismopolitico.com.br/2024/03/revelando-poder-proxies-datacenter-guia-completo.html
Glaucoma treatment at MCI Clinic is designed to effectively manage and control intraocular pressure to prevent vision loss. Our team employs advanced diagnostic tools and personalized treatment plans, including medication, laser therapy, and surgical options. Early detection and consistent monitoring are key to successful glaucoma management.
At MCI, we prioritize patient education and support, ensuring you understand your condition and treatment options. Our specialists are committed to providing comprehensive care, helping you maintain your vision and overall eye health. Trust MCI for expert glaucoma treatment and dedicated patient care.
MCI Clinic – [url=https://mci.md/operatsiya-po-udaleniyu-katarakty/?lang=ru]лечение дальнозоркости[/url]
Доставка из Китая с таможенными услугами — это профессиональное решение для импорта товаров из Китая, включающее в себя организацию перевозки, таможенное оформление и сопутствующие услуги. Мы предоставляем полный спектр услуг, связанных
[url=https://tamozhne.ru/tamojennii-broker/]доставка из китая цена[/url] включая организацию международных перевозок, таможенное оформление, сертификацию и страхование грузов. Наши специалисты помогут вам выбрать оптимальный маршрут и вид транспорта, оформить необходимые документы и декларации, а также проконсультируют по вопросам налогообложения и таможенного законодательства.
срочный выкуп авто https://avtovikupmashin21.ru/
kuhnimila.ru
Transform your vision with cataract surgery at MCI Clinic! Our experienced surgeons utilize advanced phacoemulsification techniques to remove cloudy lenses and replace them with high-quality artificial ones. This minimally invasive procedure is quick, safe, and ensures a remarkable improvement in your vision. At MCI, we combine expertise, cutting-edge equipment, and affordable pricing to provide you with the best possible care.
Choose MCI Clinic for your cataract surgery and see the world in stunning clarity. Experience the difference of top-tier medical care and regain the vibrant vision you deserve.
MCI Clinic – [url=https://mci.md/]tratamentul miopie[/url]
online casino nederland nieuw [url=www.bestegokautomaten.nl/]online casino nederland nieuw[/url] .
Write more, thats all I have to say. Literally, it seems as though you
relied on the video to make your point. You obviously know what youre talking about, why
waste your intelligence on just posting videos to your
site when you could be giving us something informative to read?
Мы рекомендуем посетить веб-сайт http://www.smakota.ho.ua/noma/luchshie-poplavki-dlya-rybalki-kak-pravilno-vybrat.html.
Кроме того, не забудьте добавить сайт в закладки: [url=http://www.smakota.ho.ua/noma/luchshie-poplavki-dlya-rybalki-kak-pravilno-vybrat.html]http://www.smakota.ho.ua/noma/luchshie-poplavki-dlya-rybalki-kak-pravilno-vybrat.html[/url]
[url=https://m3ga.megas.sbs]что такое площадка мега[/url] – mega sb что это за сайт, m3ga.gl
[url=https://kraken9-at.top/]какой vk у кракен[/url] – КРАКЕН как зайти, тор kraken
alanews24.com
Awesome blog you have here but I was curious if you knew of any message boards that cover the same topics discussed in this article? I’d really like to be a part of community where I can get feed-back from other experienced individuals that share the same interest. If you have any suggestions, please let me know. Thank you!
доставка груза из китая
At MCI Clinic, we offer comprehensive astigmatism treatment, combining extensive experience, top-tier equipment, and affordable pricing. Our experts use advanced diagnostic tools to accurately measure the degree of astigmatism and provide tailored correction options, including glasses, contact lenses, and refractive surgery. Our personalized approach ensures the best possible visual outcomes for each patient.
Choosing MCI means receiving high-quality care without excessive costs. We are dedicated to improving your vision and quality of life through effective, budget-friendly astigmatism treatments.
MCI Clinic – [url=https://mci.md/operatsiya-po-udaleniyu-katarakty/?lang=ru]офтальмология[/url]
Организация соут на рабочих местах safetysystemsgroup.com
Компания Safety Systems реализует спец оценку условий труда на каждом предприятии. Наш главный офис находится в Москве, но также в большинстве регионов РФ у нас есть филиалы. СОУТ проводится в обязательном порядке для всех компаний, чтобы обеспечить безопасность для работников и понизить шансы на получение штрафов.
Относительно [url=https://safetysystemsgroup.com/sout3/]оценка условий труда работников[/url] заходите на наш веб портал. Оценочные события должны проходить в организациях не менее, чем раз в 5 лет. Но еще у отдельных отраслей есть индивидуальные графики. Непременно ознакомьтесь с тем, что необходимо именно Вам на сайте safetysystemsgroup.com прямо сейчас.
Нужен займ без отказа и проверок? Присоединяйтесь к нашему телеграм-каналу [url=https://t.me/s/MFO_dayt_vsem/]займы где одобряют всем форум[/url] ! Мы собрали для вас лучшие предложения от МФО, которые дают деньги без проверки кредитной истории. Получите первый займ под 0% до 15 000 рублей за 10 минут! В канале вы найдете списки новых МФО 2024 года, готовых выдать мгновенные микрозаймы даже при плохой кредитной истории и просрочках. Подпишитесь и получите деньги быстро и легко!
Ищете надежный способ получить деньги без отказа? Добро пожаловать в телеграм-канал [url=https://t.me/s/MFO_dayt_vsem/]займы абсолютно всем[/url] ! У нас собраны МФО, которые дают деньги без проверки кредитной истории. Первый займ под 0% до 15 000 рублей за 10 минут! В канале представлены новые МФО 2024 года, которые выдают мгновенные микрозаймы даже при плохой кредитной истории и просрочках. Подпишитесь и получайте деньги без проблем и ожиданий!
[url=https://kraken8.onlon.at]kraken darknet[/url] – kraken ссылка, кракен ссылка
Encountered a captivating article, I propose you read https://www.ubbullrun.com/users/cchatruletka
This page really has all the info I wanted about this subject and didn’t know who to ask.
http://www.arusak-diploms-srednee.ru
[url=https://mega555net01.com]mega заблокирован аккаунт[/url] – mega sb площадка, как зайти на mega sb
велосипед взрослый купить недорого https://velo4u.ru
Use protective devices, use tools real-apartment.com and equipment according to the rules so as not to come into contact with difficulties.
I blog often and I really thank you for your information. This great article has truly peaked my interest. I will bookmark your site and keep checking for new information about once a week. I opted in for your RSS feed too.
orik24-diploms-srednee.ru
Доброго!
Развитие бизнеса в Хмельницком: Город становится центром притяжения для новых компаний и стартапов. Откройте для себя новые возможности для бизнеса и инвестиций.
Все самое лучшее на сайте https://bomba.km.ua/category/novini-khmelnickogo/
[url=https://bomba.km.ua/category/novini-ukraini/]Новости Украины за день[/url]
новости Украины за день
Главные новости Хмельницкого
Новости Хмельницкого за день
Удачи!
Owners usually cope with homadeas.com superficial maintenance of the premises on their own, but general cleaning can cause difficulties.
Hello to all, how is all, I think every one is getting more from this web site, and your views are good designed for new users.
http://russkiy365-diploms-srednee.ru/
Amazing! Its in fact remarkable paragraph, I have got much clear idea concerning from this paragraph.
http://gruppa365-diploms-srednee.ru/
Greate pieces. Keep writing such kind of information on your page. Im really impressed by your blog.
Hi there, You have performed a fantastic job. I’ll certainly digg it and for my part suggest to my friends. I am sure they will be benefited from this site.
landik-diploms-srednee.ru
Специальная оценка условий труда safetysystemsgroup.com
Фирма Safety Systems осуществляет специальную оценку условий труда на любом предприятии. Наш основной офис расположен в Москве, но ещё в большинстве регионов России у нас имеются филиалы. СОУТ проводится в обязательном порядке для всех организаций, чтобы обеспечить безопасность для работников и убавить шансы на получение штрафов.
По поводу [url=https://safetysystemsgroup.com/sout3/]оценка соут цена[/url] заходите на наш онлайн ресурс. Оценочные события должны проходить в компаниях не менее, чем раз в 5 лет. Но еще у отдельных отраслей есть собственные графики. Обязательно ознакомьтесь с тем, что необходимо именно Вам на сайте safetysystemsgroup.com прямо сейчас.
1вин
Для любителей кофе качество техники важно. Закажите [url=https://xn—-9sbn2afcdnw7c.xn--p1ai/]обслуживание кофемашин Bosch[/url] у нас и наслаждайтесь идеальным напитком каждый день. Наши специалисты проведут диагностику, очистку и ремонт вашей кофемашины с применением оригинальных деталей.Если ваша стиральная машина Бош вышла из строя, доверьте ее нашим профессионалам! Мы предлагаем [url=https://xn—-9sbn2afcdnw7c.xn--p1ai/]ремонт стиральных машин Бош[/url] с более чем 10-летним опытом, оригинальными запчастями и бесплатным выездом мастера. Гарантируем качественное обслуживание и быстрые результаты.
[url=https://skripters.biz/xf/]XenForo Мануалы[/url] – DLE, XenForo бесплатно
Соут заказать Москва safetysystemsgroup.com
Организация Safety Systems реализует специальную оценку условий труда на любом предприятии. Наш основной офис находится в Москве, но ещё в большинстве городов РФ у нас есть филиалы. СОУТ проводится в обязательном порядке для всех компаний, чтобы обеспечить безопасность для работников и понизить вероятность на приобретение штрафов.
Относительно [url=https://safetysystemsgroup.com/sout3/]особенности проведения соут[/url] заходите на наш сайт. Оценочные события должны проходить в компаниях не реже, чем раз в 5 лет. Но еще у особых отраслей есть личные графики. Непременно ознакомьтесь с тем, что необходимо именно Вам на сайте safetysystemsgroup.com уже сейчас.
Варочная панель Bosch не работает? Обратитесь к нам для [url=https://xn—-9sbn2afcdnw7c.xn--p1ai/]ремонта варочных панелей[/url]. Мы предоставляем бесплатную диагностику, ремонт на дому и гарантию 1 год. Наши специалисты с многолетним опытом быстро устранят любые неисправности, используя оригинальные запчасти.Наш [url=https://xn—-9sbn2afcdnw7c.xn--p1ai/]Бош центр[/url] в Москве предлагает лучшие условия для ремонта бытовой техники. Бесплатная диагностика, ремонт на дому и гарантия на 1 год — все это обеспечивает высокий уровень сервиса и удовлетворение клиентов.
california-invest.com
Maximum effect from the greeceholidaytravel.com cleaning measures carried out. Professional employees will cope with pollution of any complexity and type of origin.
Hi! Do you know if they make any plugins to assist with Search Engine Optimization? I’m trying to get my blog to rank for some targeted keywords but I’m not seeing very good success. If you know of any please share. Cheers!
https://gruppa365-diploms-srednee.ru/
купить диплом о среднем специальном [url=http://kupitediplom0029.ru/]купить диплом о среднем специальном[/url] .
Мы рекомендуем посетить веб-сайт https://city.zp.ua/articles/recreation/400-polotenca-dlja-rybalki-nezamenimyi-aksessuar-v-mire-uvlekatelnogo-otdyha.html.
Кроме того, не забудьте добавить сайт в закладки: [url=https://city.zp.ua/articles/recreation/400-polotenca-dlja-rybalki-nezamenimyi-aksessuar-v-mire-uvlekatelnogo-otdyha.html]https://city.zp.ua/articles/recreation/400-polotenca-dlja-rybalki-nezamenimyi-aksessuar-v-mire-uvlekatelnogo-otdyha.html[/url]
It is necessary to work carefully flarealestates.com and accurately when manufacturing metal structure parts. Even minimal mistakes lead to serious problems in the future.
Наш [url=https://xn—-9sbn2afcdnw7c.xn--p1ai/]Бош центр[/url] в Москве предлагает лучшие условия для ремонта бытовой техники. Бесплатная диагностика, ремонт на дому и гарантия на 1 год — все это обеспечивает высокий уровень сервиса и удовлетворение клиентов.Холодильник Bosch перестал морозить? Обратитесь к нам! Мы предлагаем [url=https://xn—-9sbn2afcdnw7c.xn--p1ai/]профессиональный ремонт холодильников Bosch[/url] с выездом на дом. Наши мастера оперативно устранят любые поломки и вернут вашему холодильнику полную функциональность.
homesimprovement.net
Внеплановая спец оценка условий труда safetysystemsgroup.com
Фирма Safety Systems проводит спец оценку условий труда на любом предприятии. Наш основной офис находится в Москве, но также в большинстве городов России у нас имеются филиалы. Проверка проводится в обязательном порядке для всех фирм, чтобы обеспечить безопасность для работников и сократить вероятность на приобретение штрафов.
По вопросу [url=https://safetysystemsgroup.com/sout3/]оценка условий труда на производстве[/url] переходите на наш веб портал. Оценочные события должны осуществляться в компаниях не менее, чем раз в 5 лет. Но также у особых отраслей есть собственные графики. Непременно ознакомьтесь с тем, что необходимо конкретно Вам на сайте safetysystemsgroup.com прямо сейчас.
Мы рекомендуем посетить веб-сайт http://archaeology.kiev.ua/aksessuaryi-dlya-zashhityi-i-transportirovki-ryibolovnogo-oborudovaniya/.
Кроме того, не забудьте добавить сайт в закладки: [url=http://archaeology.kiev.ua/aksessuaryi-dlya-zashhityi-i-transportirovki-ryibolovnogo-oborudovaniya/]http://archaeology.kiev.ua/aksessuaryi-dlya-zashhityi-i-transportirovki-ryibolovnogo-oborudovaniya/[/url]
Hello! Do you use Twitter? I’d like to follow you if that would be okay. I’m absolutely enjoying your blog and look forward to new updates.
http://www.gruppa365-diploms-srednee.ru
Found an enthralling article, I recommend you to read http://profbuh.forumkz.ru/viewtopic.php?id=8058#p12715
https://arochnye-shatry.ru/
Discovered a unique article – recommended to acquaint yourself! https://www.etsy.com/people/45uuoe2skg665x6i
Considering how busy most bestchicago.net people are, cleaning services have gained high popularity. There are several types of cleaning: daily, cleaning the apartment after renovation, cleaning by zone and others. Owners usually cope with superficial maintenance of the premises on their own, but general cleaning can cause difficulties.
The term “ticket” often refers repairtoday7.com to a support request. It is the ticket that guarantees a person that his problem will be quickly resolved. A high-quality ticket system for technical support will allow a business to gain many benefits. Let’s look at such innovations in more detail.
Официальный центр оформления и выпуска международных водительских прав (удостоверений) МВУ в Казахстане. https://mvu.kz/, с бесплатной доставкой.
списать ндс на расходы проводка списать ндс на расходы проводка
Licenze Office in offerta
k8 カジノ 日替わり ボーナス
いつも役立つ情報をありがとうございます。大ファンです!
Мы рекомендуем посетить веб-сайт http://oweamuseum.odessa.ua/full/travel61/vybor-udilishcha-dlya-rybalki-iskusstvo-podbora-idealnogo-snaryazheniya.htm.
Кроме того, не забудьте добавить сайт в закладки: [url=http://oweamuseum.odessa.ua/full/travel61/vybor-udilishcha-dlya-rybalki-iskusstvo-podbora-idealnogo-snaryazheniya.htm]http://oweamuseum.odessa.ua/full/travel61/vybor-udilishcha-dlya-rybalki-iskusstvo-podbora-idealnogo-snaryazheniya.htm[/url]
https://arochnye-shatry.ru/
Для любителей кофе качество техники важно. Закажите [url=https://xn—-9sbn2afcdnw7c.xn--p1ai/]обслуживание кофемашин Bosch[/url] у нас и наслаждайтесь идеальным напитком каждый день. Наши специалисты проведут диагностику, очистку и ремонт вашей кофемашины с применением оригинальных деталей.Варочная панель Bosch не работает? Обратитесь к нам для [url=https://xn—-9sbn2afcdnw7c.xn--p1ai/]ремонта варочных панелей[/url]. Мы предоставляем бесплатную диагностику, ремонт на дому и гарантию 1 год. Наши специалисты с многолетним опытом быстро устранят любые неисправности, используя оригинальные запчасти.
The service has collected on the usainvesttoday.com pages of its website all offers from tour operators in Moldova. Here you can find information for any tours to Egypt with departure from Chisinau, where you can select the number of travel participants, dates and travel options.
sellrentcars.com
ремонт телефонов в москве
купить диплом в москве https://kupitediplom0029.ru
### Смотреть русские сериалы онлайн
Русские сериалы пользуются огромной популярностью среди зрителей благодаря своей разнообразной тематике, качественной актерской игре и захватывающим сюжетам. Сегодня у нас есть уникальная возможность наслаждаться лучшими русскими сериалами онлайн, не выходя из дома.
**Преимущества просмотра русских сериалов онлайн**
1. **Доступность**. Онлайн-платформы предлагают огромный выбор русских сериалов, которые можно смотреть в любое время и в любом месте. Это особенно удобно для тех, кто имеет плотный график и не может подстраиваться под телевизионные трансляции.
2. **Бесплатность**. Множество сайтов предлагают бесплатный просмотр сериалов, что позволяет экономить на подписках и кабельном телевидении. Пользователи могут наслаждаться любимыми шоу без дополнительных затрат.
3. **Высокое качество**. Современные онлайн-платформы обеспечивают высокое качество видео и звука, что позволяет наслаждаться сериалами в наилучшем качестве. Многие сайты предлагают сериалы в формате HD и даже 4K.
4. **Разнообразие контента**. В интернете можно найти русские сериалы на любой вкус: от классических драм и комедий до современных детективов и фантастики. Это позволяет каждому зрителю найти что-то по своему вкусу.
**Популярные жанры русских сериалов**
– **Драмы**. Сериалы, основанные на глубоких человеческих историях, всегда находят отклик у зрителей. Примеры: “Доктор Рихтер”, “Тест на беременность”.
– **Комедии**. Легкие и забавные сериалы, которые поднимают настроение. Примеры: “Кухня”, “Интерны”.
– **Детективы**. Захватывающие истории с расследованиями и неожиданными поворотами сюжета. Примеры: “Мажор”, “След”.
– **Исторические**. Сериалы, рассказывающие о важных событиях и личностях в истории России. Примеры: “Екатерина”, “София”.
– **Фантастика и мистика**. Увлекательные сюжеты с элементами фантастики и мистики. Примеры: “Тайны следствия”, “Метод”.
**Где смотреть русские сериалы онлайн**
Существует множество платформ, предлагающих просмотр русских сериалов онлайн. .
Смотрите русские сериалы онлайн и наслаждайтесь качественным контентом в удобное для вас время. Это отличный способ расслабиться, получить новые впечатления и узнать больше о современной русской культуре.
Feel free to visit my blog post :: http://www.makehp.co.kr/bbs/board.php?bo_table=free&wr_id=67071
### Смотреть русские сериалы онлайн
Русские сериалы пользуются огромной популярностью среди зрителей благодаря своей разнообразной тематике, качественной актерской игре и захватывающим сюжетам. Сегодня у нас есть уникальная возможность наслаждаться лучшими русскими сериалами онлайн, не выходя из дома.
**Преимущества просмотра русских сериалов онлайн**
1. **Доступность**. Онлайн-платформы предлагают огромный выбор русских сериалов, которые можно смотреть в любое время и в любом месте. Это особенно удобно для тех, кто имеет плотный график и не может подстраиваться под телевизионные трансляции.
2. **Бесплатность**. Множество сайтов предлагают бесплатный просмотр сериалов, что позволяет экономить на подписках и кабельном телевидении. Пользователи могут наслаждаться любимыми шоу без дополнительных затрат.
3. **Высокое качество**. Современные онлайн-платформы обеспечивают высокое качество видео и звука, что позволяет наслаждаться сериалами в наилучшем качестве. Многие сайты предлагают сериалы в формате HD и даже 4K.
4. **Разнообразие контента**. В интернете можно найти русские сериалы на любой вкус: от классических драм и комедий до современных детективов и фантастики. Это позволяет каждому зрителю найти что-то по своему вкусу.
**Популярные жанры русских сериалов**
– **Драмы**. Сериалы, основанные на глубоких человеческих историях, всегда находят отклик у зрителей. Примеры: “Доктор Рихтер”, “Тест на беременность”.
– **Комедии**. Легкие и забавные сериалы, которые поднимают настроение. Примеры: “Кухня”, “Интерны”.
– **Детективы**. Захватывающие истории с расследованиями и неожиданными поворотами сюжета. Примеры: “Мажор”, “След”.
– **Исторические**. Сериалы, рассказывающие о важных событиях и личностях в истории России. Примеры: “Екатерина”, “София”.
– **Фантастика и мистика**. Увлекательные сюжеты с элементами фантастики и мистики. Примеры: “Тайны следствия”, “Метод”.
**Где смотреть русские сериалы онлайн**
Существует множество платформ, предлагающих просмотр русских сериалов онлайн. .
Смотрите русские сериалы онлайн и наслаждайтесь качественным контентом в удобное для вас время. Это отличный способ расслабиться, получить новые впечатления и узнать больше о современной русской культуре.
Here is my web page … https://www.fromdust.art/index.php/Russeriya
carsnow.net
Groove inserts can be used to carsnow.net work with various types of metals and alloys, including the most durable and hard ones. A long service life and the ability to sharpen the cutting edges of tools are guaranteed.
tradeusanews.com
Здравствуйте!
Социальные программы в Украине: Узнайте о новых инициативах и мерах поддержки, направленных на улучшение благосостояния различных слоев населения.
Все самое лучшее на сайте https://beta.in.ua/showbiz/
[url=https://beta.in.ua/]Главные новости Украины[/url]
новости спорта
нвоости Украины лента
политика в Украине
Удачи!
### Смотреть русские сериалы онлайн: удобство и разнообразие
В современном мире многие люди выбирают смотреть русские сериалы онлайн благодаря удобству и разнообразию контента. Онлайн-платформы предлагают огромное количество сериалов различных жанров, от драм и комедий до детективов и исторических эпопей.
**Преимущества онлайн-просмотра**
1. **Доступность**: Можно смотреть любимые сериалы в любое время и в любом месте, достаточно иметь доступ к интернету.
2. **Разнообразие контента**: Платформы предлагают новинки и классические сериалы, удовлетворяя вкусы всех зрителей.
3. **Качество**: Современные сервисы обеспечивают высокое качество изображения и звука, что позволяет наслаждаться просмотром.
4. **Удобство**: Функции, такие как пауза и перемотка, делают просмотр ещё более удобным.
**Популярные жанры русских сериалов**
– **Драмы**: Эти сериалы затрагивают важные жизненные темы, вызывая сильные эмоциональные отклики.
– **Комедии**: Легкие и весёлые сюжеты, которые поднимают настроение и позволяют отвлечься от повседневных забот.
– **Детективы**: Интригующие истории с расследованиями, которые держат зрителей в напряжении до самого конца.
– **Исторические сериалы**: Позволяют окунуться в прошлое, узнавая больше о значимых событиях и личностях.
**Как выбрать платформу для просмотра?**
При выборе платформы для просмотра русских сериалов онлайн важно учитывать несколько факторов:
– **Библиотека контента**: Убедитесь, что платформа предлагает широкий выбор сериалов, включая новинки и классику.
– **Качество воспроизведения**: Платформа должна поддерживать высокое качество видео.
– **Удобство интерфейса**: Пользовательский интерфейс должен быть интуитивно понятным и удобным.
– **Стоимость**: Некоторые платформы предлагают бесплатный доступ, другие требуют подписки. Выберите вариант, который соответствует вашему бюджету.
**Заключение**
Смотреть русские сериалы онлайн — это отличная возможность насладиться любимыми историями в удобное для вас время. Благодаря разнообразию контента, доступности и высокому качеству современных онлайн-платформ, каждый зритель сможет найти что-то по душе. Погружайтесь в мир русских сериалов и наслаждайтесь увлекательными сюжетами, не выходя из дома!
Feel free to surf to my webpage … https://telugusaahityam.com/User:Fallon5028
To speed up the search according homeideascoach.com to the parameters most needed by tourists, the site page has a filter system that allows you to select tours based on the following indicators:
For many people, a dacha and a country indiana-daily.com house are not just a place of work and life, but a place of permanent recreation. Therefore, on each site there should be a beautiful gazebo that provides shelter from bad weather and is simply a beautiful decoration. Among the large number of materials from which modern gazebos are decorated, wooden beams are worth special mention.
They are mounted in special holders dalycitynewspaper.com and can be quickly changed depending on wear or process requirements. Similar parts are created from hard alloys such as tungsten carbide, titanium or tantalum with the addition of cobalt. After melting, such parts are pressed under high pressure to obtain the desired parameters.
Работая в поисковой оптимизации, нужно знать, что не получится одним методом поднять сайт в верхние позиции поисковиков, ведь системы поиска это как дорожка с конечным этапом, а интернет-ресурсы это гоночные автомобили, которые все хотят занять первое место.
Так вот:
Перечень – Для того чтобы сайт был адаптивен и быстр, важна
оптимизация
Сайт должен содержать только уникальный контент, это тексты и картинки
В ОБЯЗАТЕЛЬНОМ ПОРЯДКЕ ссылочная масса через статейные сайты и напрямую на основную страницу
Увеличение входящих ссылок с помощью второстепенных сайтов
Ссылочная структура, эо ссылки первого уровня, Tier-2, Tier-3
А главное это собственная сеть сайтов PBN, которая подключается на манисайт
Все сайты PBN должны быть без отпечатков, т.е. системы поиска не должны осознавать, что это один хозяин всех интернет-ресурсов, поэтому очень важно соблюдать все эти указания.
Сегодня, когда диплом становится началом удачной карьеры в любой сфере, многие стараются найти максимально простой путь получения образования. Наличие документа об образовании переоценить просто невозможно. Ведь именно диплом открывает двери перед каждым человеком, желающим вступить в профессиональное сообщество или учиться в университете.
В данном контексте мы предлагаем максимально быстро получить этот важный документ. Вы сможете купить диплом, что является отличным решением для всех, кто не смог завершить обучение, потерял документ или желает исправить плохие оценки. Каждый диплом изготавливается аккуратно, с особым вниманием ко всем деталям. На выходе вы сможете получить 100% оригинальный документ.
Преимущество такого подхода состоит не только в том, что можно оперативно получить диплом. Процесс организован просто и легко, с нашей поддержкой. Начав от выбора необходимого образца до консультаций по заполнению персональной информации и доставки в любое место страны — все под абсолютным контролем наших мастеров.
В результате, для всех, кто хочет найти быстрый и простой способ получить требуемый документ, наша компания предлагает отличное решение. Приобрести диплом – значит избежать продолжительного обучения и сразу перейти к важным целям, будь то поступление в ВУЗ или старт карьеры.
http://fligel-hotel.ru/
Working as a courier offers flexible hours as getusainvest.com one of the main benefits. An employee can work every day or every other day, the number of working hours is determined independently. The courier’s earnings directly depend on the number of completed orders.
Стоматологическая клиника Мастерская Улыбок предлагает широкий спектр услуг по диагностике, лечению, профилактике и эстетической коррекции проблем с зубами и дёснами. Мы используем современное оборудование и материалы, а наши специалисты обладают высокой квалификацией и опытом.
В клинике созданы комфортные условия для пациентов: удобные кресла, приятная атмосфера, приветливый персонал. Мы заботимся о вашем здоровье и стараемся сделать посещение стоматолога максимально комфортным и безболезненным.
Наши услуги включают:
[url=https://masterskay-ulybok.ru/]стоматология цены казань[/url]
диагностику состояния зубов и дёсен;
лечение кариеса, пульпита, периодонтита и других заболеваний;
профессиональную гигиену полости рта;
эстетическую коррекцию зубного ряда (установка коронок, виниров, имплантов);
исправление прикуса с помощью брекетов или элайнеров;
отбеливание зубов;
лечение дёсен (пародонтит, гингивит, пародонтоз).
Мы также предлагаем услуги по детской стоматологии, протезированию и имплантации.
Обращаясь в клинику Мастерская Улыбок, вы можете быть уверены в качестве предоставляемых услуг и профессионализме наших врачей. Мы заботимся о вашей улыбке и делаем всё возможное, чтобы она была здоровой и красивой!
greenhouseislands.com
Offering a large selection of products alahomemaster.com, the seller works directly with manufacturers, which allows keeping prices at a fairly low level, because the chain of intermediaries disappears.
Замена венцов красноярск
Геракл24: Профессиональная Замена Фундамента, Венцов, Покрытий и Перенос Зданий
Компания Геракл24 занимается на предоставлении полных сервисов по реставрации фундамента, венцов, полов и перемещению зданий в месте Красноярске и за его пределами. Наша группа опытных мастеров обещает отличное качество выполнения различных типов восстановительных работ, будь то из дерева, с каркасом, из кирпича или бетонные конструкции здания.
Достоинства сотрудничества с Gerakl24
Профессионализм и опыт:
Все работы проводятся исключительно профессиональными мастерами, с обладанием долгий стаж в области создания и ремонта зданий. Наши специалисты знают свое дело и реализуют проекты с высочайшей точностью и учетом всех деталей.
Комплексный подход:
Мы предоставляем все виды работ по восстановлению и реконструкции строений:
Реставрация фундамента: замена и укрепление фундамента, что обеспечивает долгий срок службы вашего здания и предотвратить проблемы, связанные с оседанием и деформацией.
Реставрация венцов: замена нижних венцов деревянных домов, которые чаще всего подвергаются гниению и разрушению.
Замена полов: установка новых полов, что кардинально улучшает внешний облик и функциональные характеристики.
Передвижение домов: безопасное и надежное перемещение зданий на новые места, что помогает сохранить здание и предотвращает лишние расходы на строительство нового.
Работа с любыми видами зданий:
Древесные строения: реставрация и усиление деревянных элементов, обработка от гниения и насекомых.
Каркасные строения: укрепление каркасов и смена поврежденных частей.
Кирпичные дома: ремонт кирпичных стен и укрепление конструкций.
Дома из бетона: ремонт и укрепление бетонных конструкций, ремонт трещин и дефектов.
Качество и прочность:
Мы используем только высококачественные материалы и современное оборудование, что обеспечивает долгий срок службы и надежность всех выполненных работ. Все наши проекты проходят тщательную проверку качества на всех этапах выполнения.
Личный подход:
Каждому клиенту мы предлагаем персонализированные решения, с учетом всех особенностей и пожеланий. Наша цель – чтобы конечный результат полностью соответствовал вашим ожиданиям и требованиям.
Почему стоит выбрать Геракл24?
Работая с нами, вы приобретете надежного партнера, который возьмет на себя все заботы по ремонту и реставрации вашего дома. Мы обещаем выполнение всех работ в установленные сроки и с соблюдением всех строительных норм и стандартов. Обратившись в Геракл24, вы можете быть уверены, что ваше строение в надежных руках.
Мы предлагаем консультацию и ответить на ваши вопросы. Звоните нам, чтобы обсудить детали вашего проекта и узнать о наших сервисах. Мы сохраним и улучшим ваш дом, сделав его безопасным и комфортным для проживания на долгие годы.
Геракл24 – ваш выбор для реставрации и ремонта домов в Красноярске и области.
Теневой плинтус: стильное решение для обновления интерьера,
Советы по монтажу теневого плинтуса без дополнительной помощи,
Креативные способы использования теневого плинтуса в дизайне помещения,
Теневой плинтус: классический стиль в современном исполнении,
Как подобрать цвет теневого плинтуса к отделке стен,
Безопасность и стиль: почему теневой плинтус – идеальное решение для дома,
Теневой плинтус с подсветкой: создаем эффектное освещение в интерьере,
Как сделать помещение завершенным с помощью теневого плинтуса,
Интерьер безупречный до мелочей: роль теневого плинтуса в декоре
теневой плинтус это [url=https://plintus-tenevoj-aljuminievyj-msk.ru/]https://plintus-tenevoj-aljuminievyj-msk.ru/[/url] .
Мы рекомендуем посетить веб-сайт https://planetarebusov.com/masterim-idealnyj-ulov-rukovodstvo-po-montazham-rybolovnym.
Кроме того, не забудьте добавить сайт в закладки: [url=https://planetarebusov.com/masterim-idealnyj-ulov-rukovodstvo-po-montazham-rybolovnym]https://planetarebusov.com/masterim-idealnyj-ulov-rukovodstvo-po-montazham-rybolovnym[/url]
If this is necessary, you should make northfloridahouse.com sure that the installation of the metal structure is carried out professionally. All instructions must be followed in practice.
Corporate culture plays an important role. The interests of clients italycarsrental.com are put first for every employee of the company; the area of responsibility does not play an important role. For example, help desks gain additional incentive when they realize that quickly resolving employee issues has an impact on customer service. If, for example, a software glitch is not fixed, the manager will not calculate the loan program for the client. As a result, he will share negative experiences with other people, so the company’s reputation will suffer.
Почему теневой плинтус – красивая и практичная деталь интерьера,
Шаг за шагом инструкция по установке теневого плинтуса,
Теневой плинтус как элемент декора: идеи и варианты применения,
Теневой плинтус: классический стиль в современном исполнении,
Гармония оттенков: выбор цвета теневого плинтуса для любого интерьера,
Безопасность и стиль: почему теневой плинтус – идеальное решение для дома,
Интересные решения с теневым плинтусом и подсветкой: идеи для вдохновения,
Теневой плинтус: элегантность и стиль в дизайне помещения,
Теневой плинтус: деталь, которая делает интерьер законченным и гармоничным
плинтус алюминиевый [url=https://plintus-tenevoj-aljuminievyj-msk.ru/]плинтус алюминиевый[/url] .
Эскорт в Москве
Мы рекомендуем посетить веб-сайт https://sunsay.name/statti/rybolovnye-primanki-i-iskusstvo-ih-ispolzovaniya/.
Кроме того, не забудьте добавить сайт в закладки: [url=https://sunsay.name/statti/rybolovnye-primanki-i-iskusstvo-ih-ispolzovaniya/]https://sunsay.name/statti/rybolovnye-primanki-i-iskusstvo-ih-ispolzovaniya/[/url]
продвижение по позициям [url=https://www.prodvizhenie-sajtov15.ru/]https://www.prodvizhenie-sajtov15.ru/[/url] .
выкуп авто оценка [url=http://www.vykup-avtomsk.ru]выкуп авто оценка[/url] .
south-columbia.com
Почему теневой плинтус – красивая и практичная деталь интерьера,
Шаг за шагом инструкция по установке теневого плинтуса,
Теневой плинтус как элемент декора: идеи и варианты применения,
Ретро-стиль с использованием теневых плинтусов: идеи для вдохновения,
Гармония оттенков: выбор цвета теневого плинтуса для любого интерьера,
Теневой плинтус: простое решение для скрытия кабелей и проводов,
Интересные решения с теневым плинтусом и подсветкой: идеи для вдохновения,
Современные тренды в использовании теневого плинтуса для уюта и красоты,
Интерьер безупречный до мелочей: роль теневого плинтуса в декоре
теневой плинтус для стен [url=https://plintus-tenevoj-aljuminievyj-msk.ru/]https://plintus-tenevoj-aljuminievyj-msk.ru/[/url] .
купить металл швеллер
Мы рекомендуем посетить веб-сайт https://avtomaxi22.ru/.
Кроме того, не забудьте добавить сайт в закладки: [url=https://avtomaxi22.ru/]https://avtomaxi22.ru/[/url]
娛樂城
在線娛樂城的世界
隨著網際網路的快速發展,網上娛樂城(線上賭場)已經成為許多人娛樂的新選擇。在線娛樂城不僅提供多元化的遊戲選擇,還能讓玩家在家中就能體驗到賭場的刺激和快感。本文將討論網上娛樂城的特徵、利益以及一些常見的遊戲。
什麼是線上娛樂城?
網上娛樂城是一種通過網際網路提供賭錢遊戲的平台。玩家可以透過電腦、智慧型手機或平板設備進入這些網站,參與各種博彩活動,如撲克牌、賭盤、黑傑克和老虎機等。這些平台通常由專業的的程序公司開發,確保遊戲的公正性和穩定性。
網上娛樂城的利益
方便性:玩家不用離開家,就能享受賭博的興奮。這對於那些生活在遠離實體賭場區域的人來說特別方便。
多元化的游戲選擇:線上娛樂城通常提供比實體賭場更多樣化的遊戲選擇,並且經常改進遊戲內容,保持新鮮。
優惠和獎金:許多線上娛樂城提供豐富的獎金計劃,包括註冊紅利、存款獎金和忠誠度計劃,吸引新新玩家並促使老玩家不斷遊戲。
安全和保密性:合法的在線娛樂城使用高端的加密方法來保護玩家的個人信息和財務交易,確保遊戲過程的穩定和公正。
常見的的線上娛樂城游戲
撲克牌:撲克牌是最流行賭錢游戲之一。網上娛樂城提供各種德州撲克變體,如德州扑克、奧馬哈撲克和七張牌等。
輪盤賭:賭盤是一種經典的賭場遊戲遊戲,玩家可以投注在數字、數字組合或顏色上,然後看小球落在哪個位置。
黑傑克:又稱為黑傑克,這是一種對比玩家和莊家點數的遊戲,目標是讓手牌點數點數盡可能接近21點但不超過。
老虎机:老虎機是最容易也是最流行的博彩游戲之一,玩家只需轉動捲軸,看圖案排列出獲勝的組合。
結論
在線娛樂城為現代的賭博愛好者提供了一個方便、刺激的且多樣化的娛樂方式。不論是撲克愛好者還是老虎機迷,大家都能在這些平台上找到適合自己的游戲。同時,隨著科技的不斷發展,線上娛樂城的遊戲體驗將變得越來越越來越現實和有趣。然而,玩家在享用游戲的同時,也應該保持自律,避免沉迷於博彩活動,保持健康健康的心態。
Духовой шкаф Bosch вышел из строя? Мы предлагаем профессиональный [url=https://xn—-9sbn2afcdnw7c.xn--p1ai/]ремонт духовых шкафов[/url] на дому. Наши опытные специалисты проведут диагностику, заменят необходимые детали и вернут вашей технике полную функциональность. Мы используем только оригинальные запчасти.Если ваша стиральная машина Bosch вышла из строя, не теряйте времени! Наши опытные мастера предоставят [url=https://xn—-9sbn2afcdnw7c.xn--p1ai/]срочный ремонт стиральных машин Bosch[/url] с гарантией качества. Мы работаем оперативно и эффективно, чтобы вы могли снова наслаждаться чистым бельем без задержек.
оборудование для хирургии
Доверьте ремонт духового шкафа профессионалам! Наши специалисты с многолетним опытом предоставляют [url=https://xn—-9sbn2afcdnw7c.xn--p1ai/]ремонт духовых шкафов в Москве[/url]. Бесплатная диагностика, ремонт на дому и гарантия 1 год обеспечат долгую работу вашей техники.Если ваш духовой шкаф вышел из строя, мы предлагаем профессиональный [url=https://xn—-9sbn2afcdnw7c.xn--p1ai/]ремонт духовых шкафов[/url] в Москве. Бесплатная диагностика, ремонт на дому и гарантия 1 год обеспечат надежную работу вашей техники. Наши опытные мастера используют только оригинальные запчасти.
Discovered an article that will definitely interest you – don’t miss the chance to familiarize yourself http://fordtransit.5nx.ru/posting.php?mode=post&f=25&sid=0530b03a46800d6de8b4f6fd220925e0
https://d-addicts.com/what-is-astrology/
The timber does not require carsdirecttoday.com special finishing or painting. If the timber is sufficiently dried, then this design will not shrink.
chicagonewsblog.com
Мы рекомендуем посетить веб-сайт https://med-like.ru/.
Кроме того, не забудьте добавить сайт в закладки: [url=https://med-like.ru/]https://med-like.ru/[/url]
If this is necessary, you should make carsnow.net sure that the installation of metal structures is carried out efficiently and professionally. All instructions should be followed by example.
Keep on writing, great job!
https://barsu.by/
鬼武者3
実践に役立つ情報が満載で、大変価値がありました。
Если у вас испорченная кредитная история, это не конец света! В нашем Telegram-канале [url=https://t.me/s/zaim_s_plohoy_ki]Займы с плохой КИ[/url] мы предлагаем вам актуальные займы от проверенных кредиторов. Получите необходимую сумму быстро и без лишних проверок. Подпишитесь на канал и найдите лучший вариант для себя!
медицинское оборудование для реанимации
раскрутка сайта продвижение сайта [url=http://www.prodvizhenie-sajtov15.ru/]http://www.prodvizhenie-sajtov15.ru/[/url] .
Преимущества теневого плинтуса в декорировании помещения,
Советы по монтажу теневого плинтуса без дополнительной помощи,
Креативные способы использования теневого плинтуса в дизайне помещения,
Модные тренды в выборе теневых плинтусов для современного дома,
Как подобрать цвет теневого плинтуса к отделке стен,
Теневой плинтус: простое решение для скрытия кабелей и проводов,
Преимущества использования теневого плинтуса с интегрированной подсветкой,
Современные тренды в использовании теневого плинтуса для уюта и красоты,
Интерьер безупречный до мелочей: роль теневого плинтуса в декоре
теневой плинтус купить [url=https://plintus-tenevoj-aljuminievyj-msk.ru/]теневой плинтус купить[/url] .
Зачем отказываться от возможностей, если можно взять займ без отказа с плохой кредитной историей? В нашем Telegram-канале [url=https://t.me/s/zaim_s_plohoy_ki]Займы с плохой КИ[/url] вы найдете кредиторов, готовых предоставить вам необходимую сумму без лишних вопросов. Подписывайтесь и получите деньги на карту быстро и просто!
網上娛樂城的天地
隨著互聯網的快速發展,線上娛樂城(在線賭場)已經成為許多人消遣的新選擇。網上娛樂城不僅提供多樣化的遊戲選擇,還能讓玩家在家中就能體驗到賭場的樂趣和樂趣。本文將研究在線娛樂城的特徵、優勢以及一些常見的游戲。
什麼網上娛樂城?
網上娛樂城是一種透過網際網路提供博彩游戲的平台。玩家可以通過電腦設備、智慧型手機或平板電腦進入這些網站,參與各種賭博活動,如德州撲克、賭盤、黑傑克和吃角子老虎等。這些平台通常由專業的軟體公司開發,確保遊戲的公平性和穩定性。
網上娛樂城的優勢
方便性:玩家無需離開家,就能體驗博彩的快感。這對於那些居住在偏遠實體賭場區域的人來說尤為方便。
多樣化的游戲選擇:線上娛樂城通常提供比實體賭場更多樣化的遊戲選擇,並且經常升級游戲內容,保持新鮮感。
福利和獎勵:許多在線娛樂城提供豐富的獎勵計劃,包括註冊獎金、存款獎金和忠誠度計劃,吸引新新玩家並鼓勵老玩家繼續遊戲。
穩定性和隱私:正當的在線娛樂城使用先進的的加密技術來保護玩家的私人信息和交易,確保遊戲過程的安全和公正性。
常見的的網上娛樂城游戲
德州撲克:撲克牌是最受歡迎賭博游戲之一。網上娛樂城提供多種撲克牌變體,如德州撲克、奧馬哈撲克和七張牌等。
輪盤賭:輪盤是一種經典的賭博遊戲,玩家可以投注在單個數字、數字排列或顏色選擇上,然後看球落在哪個地方。
21點:又稱為黑傑克,這是一種競爭玩家和莊家點數的游戲,目標是讓手牌點數盡可能接近21點但不超過。
吃角子老虎:老虎機是最簡單也是最流行的博彩游戲之一,玩家只需轉動捲軸,看圖案排列出獲勝的組合。
總結
在線娛樂城為當代賭博愛好者提供了一個便捷、刺激的且豐富的娛樂選擇。不論是撲克迷還是吃角子老虎迷,大家都能在這些平台上找到適合自己的遊戲。同時,隨著技術的的不斷進步,網上娛樂城的遊戲體驗將變得越來越真實和有趣。然而,玩家在享用游戲的同時,也應該保持,避免沉溺於賭博活動,保持健康健康的遊戲心態。
Преимущества теневого плинтуса в декорировании помещения,
Как правильно установить теневой плинтус своими руками,
Теневой плинтус как элемент декора: идеи и варианты применения,
Теневой плинтус: классический стиль в современном исполнении,
Советы стилиста: как сделать цвет теневого плинтуса акцентом в помещении,
Теневой плинтус: простое решение для скрытия кабелей и проводов,
Преимущества использования теневого плинтуса с интегрированной подсветкой,
Как сделать помещение завершенным с помощью теневого плинтуса,
Интерьер безупречный до мелочей: роль теневого плинтуса в декоре
мдф плинтус [url=https://plintus-tenevoj-aljuminievyj-msk.ru/]мдф плинтус[/url] .
Уборка после смерти в Москве https://prof-uborka-posle-smerti.ru/
Холодильник Bosch не работает? Обратитесь к нам для [url=https://xn—-9sbn2afcdnw7c.xn--p1ai/]ремонта холодильников Bosch[/url]. Наши мастера приедут на дом, проведут диагностику и быстро устранят любую поломку. Мы используем только оригинальные запчасти.Наша компания — лидер в Москве по [url=https://xn—-9sbn2afcdnw7c.xn--p1ai/]ремонту стиральных машин Bosch[/url]. Мы предоставляем бесплатную диагностику и ремонт на дому. Опытные мастера используют только оригинальные запчасти, а на все работы дается гарантия 1 год.
Found a captivating read that I’d like to recommend to you https://brandnewday.ru/services/opredelenie-elitnogo-eskorta/
Преимущества теневого плинтуса в декорировании помещения,
Как правильно установить теневой плинтус своими руками,
Теневой плинтус как элемент декора: идеи и варианты применения,
Модные тренды в выборе теневых плинтусов для современного дома,
Советы стилиста: как сделать цвет теневого плинтуса акцентом в помещении,
Как спрятать коммуникации с помощью теневого плинтуса: практические советы,
Преимущества использования теневого плинтуса с интегрированной подсветкой,
Как сделать помещение завершенным с помощью теневого плинтуса,
Почему теневой плинтус – важная деталь в оформлении интерьера
алюминиевые плинтуса купить [url=https://plintus-tenevoj-aljuminievyj-msk.ru/]алюминиевые плинтуса купить[/url] .
рекламный баннер
Мы рекомендуем посетить веб-сайт https://metal82.ru/.
Кроме того, не забудьте добавить сайт в закладки: [url=https://metal82.ru/]https://metal82.ru/[/url]
La importancia del equilibrado dinГЎmico de rotores [url=https://www.youtube.com/channel/UClE8Z4OBanmaFs7NA-ECQFQ/]Dynamic Rotor Balancing[/url] en entornos industriales
Почему теневой плинтус – красивая и практичная деталь интерьера,
Шаг за шагом инструкция по установке теневого плинтуса,
Теневой плинтус как элемент декора: идеи и варианты применения,
Теневой плинтус: классический стиль в современном исполнении,
Советы стилиста: как сделать цвет теневого плинтуса акцентом в помещении,
Безопасность и стиль: почему теневой плинтус – идеальное решение для дома,
Интересные решения с теневым плинтусом и подсветкой: идеи для вдохновения,
Теневой плинтус: элегантность и стиль в дизайне помещения,
Интерьер безупречный до мелочей: роль теневого плинтуса в декоре
монтаж алюминиевого плинтуса [url=https://plintus-tenevoj-aljuminievyj-msk.ru/]https://plintus-tenevoj-aljuminievyj-msk.ru/[/url] .
The main advantage of a forklift is its chinanewsapp.com versatility and ease of use. Essentially, it is just a trolley with a durable fork that can be used to lift pallets or large loads to any height. It is worth noting that the loader can be made in the form of a trolley with no traction of its own, or in the form of an electric/gasoline self-propelled vehicle, with the help of which extremely heavy objects can be transported over impressive distances throughout the warehouse. Another advantage is simple maintenance, which is ensured by the absence of technical bells and whistles, but this depends on the specific model of the device.
Depending on the type of transport the travelusanews.com courier will use, the restrictions on the weight and dimensions of the transported parcels vary.
Уборка квартир после смерти https://prof-uborka-posle-smerti.ru/
Доброго!
Наши новости Киева помогают вам быть в курсе самых важных событий в столице. Мы следим за всем, что происходит в городе, чтобы вы могли быть в курсе событий и принимать информированные решения.
Все самое лучшее на сайте https://bomba.kiev.ua/
[url=https://bomba.kiev.ua/]Новости Киева видео[/url]
Главные новости Киева
Новости Киева фото
Новости Киева видео
Удачи!
Неудачная кредитная история – не повод для отчаяния. В нашем Telegram-канале [url=https://t.me/s/zaim_s_plohoy_ki]Займы с плохой КИ[/url] вы найдете надежных кредиторов, которые готовы предложить займ без отказа. Воспользуйтесь удобным сервисом, получите деньги быстро и решите свои финансовые проблемы легко. Подпишитесь на наш канал и будьте уверены в своем завтрашнем дне!
микронаушник Прага
livinghawaiitravel.com
Преимущества теневого плинтуса в декорировании помещения,
Как правильно установить теневой плинтус своими руками,
Креативные способы использования теневого плинтуса в дизайне помещения,
Модные тренды в выборе теневых плинтусов для современного дома,
Гармония оттенков: выбор цвета теневого плинтуса для любого интерьера,
Как спрятать коммуникации с помощью теневого плинтуса: практические советы,
Интересные решения с теневым плинтусом и подсветкой: идеи для вдохновения,
Теневой плинтус: элегантность и стиль в дизайне помещения,
Почему теневой плинтус – важная деталь в оформлении интерьера
плинтуса для пола [url=https://plintus-tenevoj-aljuminievyj-msk.ru/]плинтуса для пола[/url] .
мастерская по ремонту телефонов
Consideraciones de seguridad en el equilibrado de rotores de trituradoras [url=https://www.ebay.com/itm/395305960880/]Crusher Rotor Balancing[/url]
Теневой плинтус: стильное решение для обновления интерьера,
Советы по монтажу теневого плинтуса без дополнительной помощи,
Как использовать теневой плинтус для создания уникального интерьера,
Ретро-стиль с использованием теневых плинтусов: идеи для вдохновения,
Гармония оттенков: выбор цвета теневого плинтуса для любого интерьера,
Безопасность и стиль: почему теневой плинтус – идеальное решение для дома,
Теневой плинтус с подсветкой: создаем эффектное освещение в интерьере,
Как сделать помещение завершенным с помощью теневого плинтуса,
Почему теневой плинтус – важная деталь в оформлении интерьера
плинтус черный алюминиевый [url=https://plintus-tenevoj-aljuminievyj-msk.ru/]плинтус черный алюминиевый[/url] .
read this post here https://blur-nft-market.com/2023/11/10/nft-collecting-on-the-ethereum-network-a-comprehensive-guide-by-dappradar/
sites https://debank.at/2023/11/11/debank-secures-25-million-funding-for-its-defi-wallet/
her response https://tronlink.at/2023/11/13/analysts-provide-insights-into-whether-tron-is-ready-for-a-positive-surge-in-value/
see this website https://debank.lu/2023/11/11/elevate-your-financial-strategy-exploring-the-benefits-of-embracing-non-bank-options/
Going Here https://blur-nft-marketplace.org/2023/05/21/cryptocurrencies-and-the-empowerment-of-individuals-breaking-the-barriers-to-financial-freedom/
you could try this out https://tronlink-app.org/2023/11/13/key-takeaways-from-coinbase-ceo-brian-armstrongs-experience-in-building-a-thriving-cryptocurrency-exchange/
published here https://trezorwallet-app.org/2023/11/14/trezor-user-reviews-can-i-trust-its-security-claims/
Федерация паркура, трюковых и экстремальных единоборств Street Union – это профессиональная организация в индустрии спорта, развлечений и шоу-бизнеса.
Наша миссия заключается в развитии экстремальной культуры и спорта с разных точек зрения.
Наша деятельность основана на том, что современные виды спорта зачастую гораздо более гламурны,чем классические. Поэтому, помимо организации тренировок для спортсменов всех видов, мы также оказываем коммерческие услуги, необходимые государственным и частным компаниям, такие как подготовка шоу-программ с участием ведущих спортсменов и артистов различных жанров, производство имиджевой продукции.
Этот подход на шаг опережает “стандарт”, будучи смелым не только в спорте, но и в рекламе и шоу-продукции. Будучи лидерами мнений для тысяч поклонников и последователей, мы вдохновляем людей совершенствовать свое тело и дух, двигаться вперед и проявлять свою индивидуальность.
В ее состав организациивходят артисты из самых разных областей, включая спорт, музыку, режиссуру, дизайн, изобразительное искусство и шоу-бизнес. Для такой компании нет невозможных проектов.
За основу было взято несколько передовых видов экстремальной деятельности:
школа паркура что это подходит для тренировок спецназа и для школьных уроков физкультуры;
Трицикл и HMA (экстремальные боевые искусства) – зрелищные современные дисциплины, сочетающие акробатические трюки и элементы боевых искусств.
Эти современные дисциплины со временем могут превратиться в самостоятельные спортивные дисциплины и войти в программу Олимпийских игр. Мы прилагаем все усилия для этого!
Благодарствую за полезную инфу!
В свою очередь предлагаю поиграть в настоящее казино!
[url=https://vavada-registraciya3.online/]vavada регистрация в личном кабинете[/url] — доступно и быстро. Это позволит вам получить доступ к широкому спектру азартных игр.
Зарегистрировавшись вы попадете в свой личный кабинет и начать играть. Обратите внимание, что для вывода выигранных денег вам необходимо будет подтвердить свою личность, показав документы, которые у вас запросят.
next page https://blur-io-nft.com/2023/11/09/coinbases-education-initiative-empowering-individuals-to-make-informed-crypto-decisions/
Use protective equipment, use tools britainsnews.com and equipment according to the rules so as not to encounter difficulties.
a knockout post https://trezor-wallet.at/2023/11/14/how-the-trezor-model-t-hardware-wallet-safeguards-your-digital-identity-and-secures-your-cryptocurrency/
top casino’s [url=https://www.bestegokautomaten.nl]https://www.bestegokautomaten.nl[/url] .
canadatc.com
Satisfied customers. You can increase people’s livechinanews.com loyalty to the company. They will be happy to make repeat purchases from your company.
заказать капитальный ремонт квартиры
mikrosluchatko
https://homes-design.ru/
Благодарю за полезную инфу!
В свою очередь предлагаю сыграть на настоящие деньги!
[url=https://vavada-registraciya3.online/]играть vavada[/url] — быстро и просто. Это позволит вам получить доступ к широкому спектру азартных игр.
Зарегистрировавшись вы войдете в свой ЛК и начать играть. Не забудьте, что для вывода выигранных денег вам необходимо будет пройти верификацию аккаунта, показав документы, которые у вас запросят.
Мы рекомендуем посетить веб-сайт https://kryshi-remont.ru/.
Кроме того, не забудьте добавить сайт в закладки: [url=https://kryshi-remont.ru/]https://kryshi-remont.ru/[/url]
https://www.datingsitesreviews.com/forum/viewtopic.php?showtopic=8185
Наша компания предоставляет кредиты и займы в короткий срок, помогая клиентам решать финансовые вопросы быстро и без лишних хлопот, узнайте подробнее тут – http://www.letokurgan.ru/ipoteka_kalkulyator_onlayn/. Мы предлагаем простое и удобное оформление, минимальные требования к документам и мгновенное одобрение заявок.
купить аккаунт вк дешево [url=https://www.kupit-akkaunt-vk.ru]https://www.kupit-akkaunt-vk.ru[/url] .
Encountered a unique article Р be sure to take a look and see for yourself https://fcinfo.ru/production/6960-kak-vybrat-eskortnicu-po-ankete-eskort-agenststva.html
Благодарю за отличную информацию!
В свою очередь предлагаю поиграть в настоящее казино!
[url=https://vavada-registraciya3.online/]играть vavada[/url] — доступно и быстро. Это позволит вам получить доступ к к огромному количеству слотов и рулетке.
Создав аккаунт вы войдете в свой логин и начать играть. Обратите внимание, что для вывода выигранных денег нужно подтвердить свою личность, показав документы, которые у вас запросят.
расчет лизинга для юридических лиц https://leasingber.ru
Мы рекомендуем посетить веб-сайт https://balkonnaya-dver.ru/.
Кроме того, не забудьте добавить сайт в закладки: [url=https://balkonnaya-dver.ru/]https://balkonnaya-dver.ru/[/url]
If you need to weld elements, you moneytimenews.com should trust the work of a welder with the necessary skills. Welding work must be carried out under control.
Complex work requires experience welcomelady.net and the use of modern equipment using strong chemicals. Not every person has such an arsenal available.
see here https://galxe-app.org/2023/11/19/unveiling-the-secrets-of-galxe-polyhedra/
Массаж детей до года — это не просто полезная процедура, но и важный элемент ухода за малышом. С помощью массажа можно не только улучшить физическое состояние ребенка, но и наладить эмоциональную связь между родителями и малышом. Особенно важно проводить массаж, если у ребенка есть проблемы с тонусом мышц или другие неврологические нарушения. Специалисты клиники AllegroVision – [url=https://allegrovision.ru/partners/misight/]центр лечения близорукости[/url] .ru рекомендуют начинать массаж с первых месяцев жизни, чтобы укрепить иммунитет и улучшить общее самочувствие ребенка. Это поможет малышу быстрее адаптироваться к окружающему миру и развиваться гармонично.
Массаж для младенцев включает мягкие поглаживания, растирания и легкие вибрации. Эти простые, но эффективные техники способствуют нормализации кровообращения, улучшению сна и аппетита ребенка. Однако, важно помнить, что проводить массаж должен квалифицированный специалист, чтобы избежать возможных травм. В AllegroVision – [url=https://allegrovision.ru/services/apparatnoe-lechenie-i-kompleksy9039/]аппаратная терапия зрения[/url] работают опытные массажисты, которые помогут вашему малышу чувствовать себя лучше и здоровее.
Наша компания предоставляет кредиты и займы в короткий срок, помогая клиентам решать финансовые вопросы быстро и без лишних хлопот, узнайте подробнее тут – https://goo-gl.ru/novosti/22073-kak-refinansirovat-voennuyu-ipoteku.html. Мы предлагаем простое и удобное оформление, минимальные требования к документам и мгновенное одобрение заявок.
Аппаратное лечение косоглазия — это современный и эффективный способ исправления этого зрительного дефекта, предлагаемый в клинике AllegroVision – [url=https://allegrovision.ru/]медосмотр психиатра ижевск[/url] .ru. Мы являемся лучшей клиникой в стране, где работают квалифицированные специалисты с опытом работы более 10 лет. Аппаратное лечение помогает тренировать мышцы глаз и восстанавливать нормальное зрение без хирургического вмешательства.
В AllegroVision – [url=https://allegrovision.ru/]занятия с детским специалистом по коррекции почерка ижевск[/url] используются самые передовые технологии и методики, что гарантирует высокую эффективность лечения. Мы предлагаем комфортные условия, множество вариантов оплаты и индивидуальный подход к каждому пациенту. Наша клиника гордится тем, что помогает людям улучшить качество жизни и вернуть ясность зрения.
Opened up an enthralling read – I’d like to share it with you http://arsenal.listbb.ru/viewtopic.php?f=14&t=385
pop over here https://1inch-app.org/2023/11/17/the-impact-of-1inch-on-financial-inclusion-for-marginalized-communities-in-america/
заказать курсовую работу недорого https://kontrolnyeaudit.ru/
look at here now https://metamask-wallet-web3.com/2023/11/16/manage-your-digital-assets-safely-and-efficiently-using-smartchain-and-the-metamask-wallet/
you could check here https://metamask-wallet.at/2023/11/16/restore-metamask-account-with-seed-phrase-step-by-step-guide/
Мы рекомендуем посетить веб-сайт https://drova-smolensk.ru/.
Кроме того, не забудьте добавить сайт в закладки: [url=https://drova-smolensk.ru/]https://drova-smolensk.ru/[/url]
Daily bonuses
Uncover Thrilling Promotions and Free Rounds: Your Comprehensive Guide
At our gaming platform, we are focused to providing you with the best gaming experience possible. Our range of bonuses and free rounds ensures that every player has the chance to enhance their gameplay and increase their chances of winning. Here’s how you can take advantage of our fantastic promotions and what makes them so special.
Lavish Free Rounds and Cashback Bonuses
One of our standout promotions is the opportunity to earn up to 200 bonus spins and a 75% rebate with a deposit of just $20 or more. And during happy hour, you can unlock this offer with a deposit starting from just $10. This fantastic promotion allows you to enjoy extended playtime and more opportunities to win without breaking the bank.
Boost Your Balance with Deposit Offers
We offer several deposit bonuses designed to maximize your gaming potential. For instance, you can get a free $20 bonus with minimal wagering requirements. This means you can start playing with extra funds, giving you more chances to explore our vast array of games and win big. Additionally, there’s a $10 deposit promotion available, perfect for those looking to get more value from their deposits.
Multiply Your Deposits for Bigger Wins
Our “Play Big!” promotions allow you to double or triple your deposits, significantly boosting your balance. Whether you choose to multiply your deposit by 2 or 3 times, these offers provide you with a substantial amount of extra funds to enjoy. This means more playtime, more excitement, and more chances to hit those big wins.
Exciting Bonus Spins on Popular Games
We also offer up to 1000 free spins per deposit on some of the most popular games in the industry. Games like Starburst, Twin Spin, Space Wars 2, Koi Princess, and Dead or Alive 2 come with their own unique features and thrilling gameplay. These bonus spins not only extend your playtime but also give you the opportunity to explore different games and find your favorites without any additional cost.
Why Choose Our Platform?
Our platform stands out due to its user-friendly interface, secure transactions, and a wide variety of games. We prioritize your gaming experience by ensuring that all our offers are easy to access and beneficial to our players. Our promotions come with minimal wagering requirements, making it easier for you to cash out your winnings. Moreover, the variety of games we offer ensures that there’s something for every type of player, from classic slot enthusiasts to those who enjoy more modern, feature-packed games.
Conclusion
Don’t miss out on these incredible opportunities to enhance your gaming experience. Whether you’re looking to enjoy free spins, rebate, or plentiful deposit promotions, we have something for everyone. Join us today, take advantage of these fantastic offers, and start your journey to big wins and endless fun. Happy gaming!
see page https://galxe-web3.com/2023/11/19/galxe-passport-your-key-to-total-data-control-in-the-web3-era/
tiktok views and likes buy buy tiktok views
aboutweeks.com
甲賀忍法帖~Ⅲ(V2.2)
読む価値のある、実用的な内容でした。非常に勉強になります。
sapporo88
Hello i am kavin, its my first time to commenting anyplace, when i read this post i thought i could also make comment due to this sensible article.
Защитите свои права! Юридическая помощь для всех.
В сложной ситуации? Не знаете, как действовать?
Мы предлагаем квалифицированную юридическую помощь физическим лицам и предпринимателям в различных областях права:
Семейное право: развод, алименты, раздел имущества.
Жилищное право: споры с соседями, выселение, оформление наследства.
Трудовое право: незаконное увольнение, невыплата зарплаты, защита от дискриминации.
Административное право: обжалование действий госорганов, защита прав потребителей.
И многое другое!
zemskovmoscow.ru
Engaging Breakthroughs and Renowned Releases in the World of Gaming
In the constantly-changing domain of interactive entertainment, there’s perpetually something new and engaging on the horizon. From enhancements enhancing revered staples to anticipated releases in celebrated universes, the interactive entertainment landscape is thriving as in current times.
We’ll take a look into the newest announcements and specific the beloved titles enthralling audiences internationally.
Up-to-Date Developments
1. New Modification for Skyrim Improves NPC Look
A latest modification for The Elder Scrolls V: Skyrim has captured the focus of fans. This modification implements detailed faces and realistic hair for all non-player entities, elevating the game’s visuals and immersion.
2. Total War Experience Located in Star Wars Galaxy In the Works
Creative Assembly, acclaimed for their Total War Games franchise, is reportedly crafting a upcoming game situated in the Star Wars universe. This exciting collaboration has enthusiasts anticipating with excitement the analytical and captivating gameplay that Total War experiences are acclaimed for, finally situated in a realm remote.
3. Grand Theft Auto VI Arrival Revealed for Late 2025
Take-Two Interactive’s CEO’s Chief Executive Officer has revealed that Grand Theft Auto VI is scheduled to launch in Late 2025. With the colossal reception of its prior release, GTA V, enthusiasts are awaiting to see what the forthcoming entry of this celebrated series will provide.
4. Growth Initiatives for Skull & Bones Second Season
Creators of Skull and Bones have disclosed enhanced strategies for the title’s Season Two. This high-seas saga promises fresh updates and changes, keeping players immersed and absorbed in the realm of maritime nautical adventures.
5. Phoenix Labs Deals with Staff Cuts
Disappointingly, not all news is uplifting. Phoenix Labs Developer, the developer in charge of Dauntless, has announced significant workforce reductions. Despite this difficulty, the game keeps to be a beloved preference among fans, and the company keeps attentive to its playerbase.
Popular Games
1. The Witcher 3
With its engaging plot, engrossing domain, and engaging journey, The Witcher 3 Game continues to be a revered game within players. Its intricate plot and sprawling sandbox remain to captivate enthusiasts in.
2. Cyberpunk 2077 Game
Despite a challenging launch, Cyberpunk 2077 stays a highly anticipated release. With continuous improvements and enhancements, the title continues to improve, providing fans a perspective into a cyberpunk future rife with danger.
3. Grand Theft Auto V
Despite years after its debut release, Grand Theft Auto 5 remains a beloved selection among enthusiasts. Its wide-ranging free-roaming environment, enthralling plot, and co-op components keep fans returning for additional adventures.
4. Portal 2
A classic brain-teasing experience, Portal 2 Game is renowned for its innovative features and exceptional spatial design. Its challenging puzzles and witty storytelling have made it a noteworthy experience in the gaming industry.
5. Far Cry 3 Game
Far Cry 3 Game is celebrated as exceptional entries in the series, providing gamers an nonlinear experience filled with excitement. Its immersive narrative and legendary figures have solidified its status as a beloved game.
6. Dishonored Game
Dishonored Game is hailed for its sneaky gameplay and one-of-a-kind world. Enthusiasts assume the character of a supernatural executioner, navigating a city abundant with institutional peril.
7. Assassin’s Creed
As a segment of the acclaimed Assassin’s Creed Series franchise, Assassin’s Creed is adored for its immersive experience, enthralling features, and historical environments. It remains a standout experience in the collection and a beloved amidst fans.
In final remarks, the domain of interactive entertainment is flourishing and fluid, with groundbreaking developments
Благодарствую за отличную информацию!
В свою очередь предлагаю зарубиться в рулетку!
[url=https://vavada-registraciya3.online/]вавада зарегистрироваться[/url] — доступно и быстро. Это допустит вас к к огромному количеству слотов и рулетке.
Создав аккаунт вы войдете в свой личный кабинет и начать играть. Обратите внимание, что для вывода выигрышей нужно подтвердить свою личность, показав документы, которые у вас запросят.
see this site https://1inch-dex.com/2023/11/17/maximize-returns-in-the-1inch-coin-market-cap-with-effective-investing-strategies/
Мы рекомендуем посетить веб-сайт https://arenda-legkovyh-pricepov.ru/.
Кроме того, не забудьте добавить сайт в закладки: [url=https://arenda-legkovyh-pricepov.ru/]https://arenda-legkovyh-pricepov.ru/[/url]
The second option is a self-propelled unit, which bmoneyfinder.com has an engine, wheels and its own drive for lifting a fork with a load. These are the ones most often used in warehouses, but only if there is a sufficient amount of free space.
newsplaces.net
https://formomebel.ru/stoliki/kruglye
Resources https://orbiter-finance-bridge.com/2023/11/18/maximize-your-investment-potential-follow-orbiter-finance-on-twitter/
Выбор современных мужчин – тактичные штаны, подчеркнут ваш стиль.
Незаменимые для занятий спортом, тактичные штаны станут вашим надежным помощником.
Надежный пошив и долговечность, сделают тактичные штаны вашим незаменимым спутником.
Современный стиль и практичность, подчеркнут вашу индивидуальность и статус.
Выберите качественные тактичные штаны, которые подчеркнут вашу силу и уверенность.
штани зимові тактичні [url=https://taktichmishtanu.kiev.ua/]https://taktichmishtanu.kiev.ua/[/url] .
his comment is here https://orbiter-finance.at/2023/11/19/step-by-step-guide-to-participating-in-orbiter-finance-airdrop/
This is due to comfortable living newsgary.com conditions, a warm sea, a variety of tourism services in the country, high-quality food and a relatively economical cost of travel. For the optimal travel option, you should choose a tour on the website, where there are a large number of offers.
Прием психиатра в Ижевске в клинике AllegroVision – [url=https://allegrovision.ru/nocity/]коррекция почекра[/url] .ru — это возможность получить квалифицированную помощь для вашего ребенка. Наши специалисты с опытом работы более 10 лет проводят тщательные обследования, чтобы выявить и скорректировать психоэмоциональные проблемы. Индивидуальный подход к каждому пациенту и использование современных методов диагностики гарантируют высокое качество лечения. В AllegroVision – [url=https://allegrovision.ru/]педагогическая диагностика детей с нарушением зрения[/url] мы предлагаем лучшие условия и разнообразные варианты оплаты, что делает наши услуги доступными для всех семей.
Клиника обеспечивает уютную и поддерживающую атмосферу, где ребенок будет чувствовать себя комфортно. Прием психиатра включает всестороннюю оценку состояния, разработку плана лечения и регулярное наблюдение за прогрессом. Мы заботимся о здоровье и благополучии вашего ребенка, предоставляя профессиональную поддержку на каждом этапе его развития.
Выбор современных мужчин – тактичные штаны, подчеркнут ваш стиль.
Идеальный вариант для активного отдыха, тактичные штаны обеспечат вам комфорт и свободу движений.
Качественные материалы и прочные швы, сделают тактичные штаны незаменимым атрибутом вашего образа.
Максимальный комфорт и стильный вид, порадуют даже самого взыскательного покупателя.
Выберите качественные тактичные штаны, дадут вам комфорт и свободу.
купити тактичні штани [url=https://taktichmishtanu.kiev.ua/]купити тактичні штани[/url] .
Amazing! Its truly awesome article, I have got much clear idea concerning from this article.
Del Mar Energy
Незаменимая часть гардероба – тактичные штаны, дадут комфорт и уверенность.
Отличный выбор для походов и путешествий, тактичные штаны подарят вам удобство и защиту.
Надежный пошив и долговечность, сделают тактичные штаны незаменимым атрибутом вашего образа.
Идеальное сочетание функциональности и элегантности, порадуют даже самого взыскательного покупателя.
Почувствуйте удобство и стиль в тактичных штанах, дадут вам комфорт и свободу.
зимові тактичні штани [url=https://taktichmishtanu.kiev.ua/]https://taktichmishtanu.kiev.ua/[/url] .
Сайт, где можно выбрать раковина 40 см различной формы.
Мы рекомендуем посетить веб-сайт https://podveski-remont.ru/.
Кроме того, не забудьте добавить сайт в закладки: [url=https://podveski-remont.ru/]https://podveski-remont.ru/[/url]
Стильные и удобные тактичные штаны, которые подчеркнут вашу индивидуальность.
Идеальный вариант для активного отдыха, тактичные штаны обеспечат вам комфорт и свободу движений.
Качественные материалы и прочные швы, сделают тактичные штаны вашим любимым предметом гардероба.
Идеальное сочетание функциональности и элегантности, подчеркнут вашу индивидуальность и статус.
Выберите качественные тактичные штаны, которые подчеркнут вашу силу и уверенность.
купити тактичні зимові штани [url=https://taktichmishtanu.kiev.ua/]https://taktichmishtanu.kiev.ua/[/url] .
Монтаж септиков neseptik.com
Приобрести идеальный септик можно нажав на ссылку – [url=https://neseptik.com/]бочка для септика 3 куба[/url] прямо сегодня. Звоните по телефону +7(965)528-61-38 и мы дадим ответы на любые ваши вопросы. Мы разместились по адресу: г. Екатеринбург, ул. Вилонова, д. 33. Режим работы с пн по пт с 8:00 до 19:00. Звоните, приезжайте, мы будем рады сотрудничать с Вами!
Доставка цветов в Саратове https://flowers64.ru/ это отличная возможность заказать различные цветы, букеты, композиции, подарки, не выходя из дома. Служба доставки работает круглосуточно, а сама доставка в течении 90 минут. Вы сможете подарить букет анонимно, просто напишите это при заказе. Огромный ассортимент цветов порадует всех!
Незаменимая часть гардероба – тактичные штаны, которые подчеркнут вашу индивидуальность.
Отличный выбор для походов и путешествий, тактичные штаны станут вашим надежным помощником.
Высокое качество и непревзойденный комфорт, сделают тактичные штаны вашим незаменимым спутником.
Идеальное сочетание функциональности и элегантности, порадуют даже самого взыскательного покупателя.
Выберите качественные тактичные штаны, дадут вам комфорт и свободу.
штани тактичні [url=https://taktichmishtanu.kiev.ua/]https://taktichmishtanu.kiev.ua/[/url] .
What’s up, this weekend is pleasant for me, because this point in time i am reading this enormous informative post here at my home.
Del Mar Energy
Выбор современных мужчин – тактичные штаны, которые подчеркнут вашу индивидуальность.
Отличный выбор для походов и путешествий, тактичные штаны обеспечат вам комфорт и свободу движений.
Высокое качество и непревзойденный комфорт, сделают тактичные штаны незаменимым атрибутом вашего образа.
Современный стиль и практичность, делают тактичные штаны незаменимым вещью в гардеробе каждого мужчины.
Почувствуйте удобство и стиль в тактичных штанах, дадут вам комфорт и свободу.
штани тактичні мультикам [url=https://taktichmishtanu.kiev.ua/]https://taktichmishtanu.kiev.ua/[/url] .
Стильные и удобные тактичные штаны, которые подчеркнут вашу индивидуальность.
Незаменимые для занятий спортом, тактичные штаны подарят вам удобство и защиту.
Высокое качество и непревзойденный комфорт, сделают тактичные штаны незаменимым атрибутом вашего образа.
Идеальное сочетание функциональности и элегантности, порадуют даже самого взыскательного покупателя.
Неотъемлемый атрибут современного мужчины – тактичные штаны, которые подчеркнут вашу силу и уверенность.
купити тактичні штани [url=https://taktichmishtanu.kiev.ua/]https://taktichmishtanu.kiev.ua/[/url] .
Jili Ace ক্যাসিনো: বাংলাদেশের সেরা গেমিং ওয়েবসাইট
Jili Ace ক্যাসিনো বাংলাদেশের অন্যতম শীর্ষ-রেটেড গেমিং ওয়েবসাইট হিসেবে নিজেকে প্রতিষ্ঠিত করেছে। এটি বিনামূল্যে অনলাইন ক্যাসিনো গেমের মাধ্যমে রিয়েল মানি জেতার সুযোগ প্রদান করে, যা ডিপোজিটের প্রয়োজন নেই। এই প্ল্যাটফর্মটি 1000+ গেমের বিশাল সংগ্রহের মাধ্যমে ব্যবহারকারীদের বিভিন্ন ধরনের গেমিং অভিজ্ঞতা প্রদান করে।
Jiliace Casino-তে আপনি স্লট, ফিশিং, সাবং, ব্যাকার্যাট, বিঙ্গো এবং লটারি গেমের মতো বিভিন্ন ধরণের গেম খেলতে পারবেন। প্রতিটি গেমই অত্যন্ত আকর্ষণীয় এবং ব্যবহারকারীদের জন্য দারুণ বিনোদনের উৎস।
শীর্ষ গেম প্রোভাইডার
Jili Ace ক্যাসিনোতে আপনি JDB, JILI, PG, CQ9-এর মতো শীর্ষ গেম প্রোভাইডারদের গেম উপভোগ করতে পারবেন। এই প্রোভাইডারদের গেমগুলি তাদের অসাধারণ গ্রাফিক্স, উত্তেজনাপূর্ণ গেমপ্লে এবং বড় পুরস্কারের জন্য পরিচিত।
সহজ লগইন প্রক্রিয়া
Jiliace Login প্রক্রিয়া অত্যন্ত সহজ এবং দ্রুত। আপনার অ্যাকাউন্ট তৈরি এবং লগইন করার পর আপনি সহজেই বিভিন্ন গেমে অংশ নিতে পারবেন এবং আপনার জয়কে বাড়িয়ে তুলতে পারবেন। Jili Ace Login-এর মাধ্যমে আপনি যে কোনও সময় এবং যে কোনও স্থান থেকে গেমে অংশ নিতে পারেন, যা আপনার গেমিং অভিজ্ঞতাকে আরও সুবিধাজনক করে তোলে।
বিভিন্ন ধরণের গেম
Jiliace Casino-তে স্লট গেম, ফিশিং গেম, সাবং গেম, ব্যাকার্যাট, বিঙ্গো এবং লটারি গেমের মত বিভিন্ন ধরণের গেম পাওয়া যায়। এই বৈচিত্র্যময় গেমের সংগ্রহ ব্যবহারকারীদের একঘেয়েমি থেকে মুক্তি দেয় এবং নতুন অভিজ্ঞতার স্বাদ প্রদান করে।
Jita Bet-এর সাথে অংশ নিন
Jili Ace ক্যাসিনোতে Jita Bet এর সাথে অংশ নিয়ে আপনার গেমিং অভিজ্ঞতা আরও সমৃদ্ধ করুন। এখানে আপনি বিভিন্ন ধরণের বাজি ধরতে পারেন এবং বড় পুরস্কার জিততে পারেন। Jita Bet প্ল্যাটফর্মটি ব্যবহারকারীদের জন্য সহজ এবং সুরক্ষিত বাজি ধরার সুযোগ প্রদান করে।
Jili Ace ক্যাসিনো বাংলাদেশের সেরা গেমিং ওয়েবসাইট হিসেবে পরিচিত, যেখানে ব্যবহারকারীরা বিনামূল্যে গেম খেলে রিয়েল মানি জিততে পারেন। আজই Jiliace Login করুন এবং আপনার গেমিং যাত্রা শুরু করুন!
Jiliacet casino
Jiliacet casino |
Warm welcome! | Get a 200% Welcome Bonus when you log in jiliace casino.
IPL Tournament! | Join the IPL fever with Jita Bet. Win big prizes!
Epic JILI Tournaments! | Go head-to-head in the Jita bet Super Tournament
#jiliacecasino
Cashback on Deposits! | Get cash back on every deposit. At Jili ace casino
Uninterrupted bonuses at JITAACE! | Stay logged in Jiliace login!
https://www.jiliace-casino.online/bn
#Jiliacecasino # Jiliacelogin#Jiliacelogin # Jitabet
Slot Feast! | Spin to win 100% up to 20,000 ৳. at Jili ace login!
Big Fishing Bonus! | Get a 100% bonus up to ৳20,000 in the Fishing Game.
JiliAce Casino’s top choice for great bonuses. login, play, and win big today!
Незаменимая часть гардероба – тактичные штаны, подчеркнут ваш стиль.
Идеальный вариант для активного отдыха, тактичные штаны станут вашим надежным помощником.
Надежный пошив и долговечность, сделают тактичные штаны вашим любимым предметом гардероба.
Максимальный комфорт и стильный вид, подчеркнут вашу индивидуальность и статус.
Неотъемлемый атрибут современного мужчины – тактичные штаны, дадут вам комфорт и свободу.
тактичні штани чоловічі [url=https://taktichmishtanu.kiev.ua/]тактичні штани чоловічі[/url] .
курсовые на заказ https://kontrolnyeaudit.ru/
Стильные и удобные тактичные штаны, дадут комфорт и уверенность.
Незаменимые для занятий спортом, тактичные штаны подарят вам удобство и защиту.
Качественные материалы и прочные швы, сделают тактичные штаны вашим незаменимым спутником.
Идеальное сочетание функциональности и элегантности, делают тактичные штаны незаменимым вещью в гардеробе каждого мужчины.
Почувствуйте удобство и стиль в тактичных штанах, дадут вам комфорт и свободу.
штани з наколінниками [url=https://taktichmishtanu.kiev.ua/]https://taktichmishtanu.kiev.ua/[/url] .
Онлайн-ресурс, где можно найти широкий выбор сифон для подвесной раковины для вашей ванной комнаты.
Find Invigorating Deals and Bonus Spins: Your Definitive Guide
At our gaming platform, we are committed to providing you with the best gaming experience possible. Our range of offers and extra spins ensures that every player has the chance to enhance their gameplay and increase their chances of winning. Here’s how you can take advantage of our fantastic offers and what makes them so special.
Generous Free Spins and Cashback Bonuses
One of our standout offers is the opportunity to earn up to 200 free spins and a 75% cashback with a deposit of just $20 or more. And during happy hour, you can unlock this bonus with a deposit starting from just $10. This fantastic offer allows you to enjoy extended playtime and more opportunities to win without breaking the bank.
Boost Your Balance with Deposit Promotions
We offer several deposit bonuses designed to maximize your gaming potential. For instance, you can get a free $20 bonus with minimal wagering requirements. This means you can start playing with extra funds, giving you more chances to explore our vast array of games and win big. Additionally, there’s a $10 deposit bonus available, perfect for those looking to get more value from their deposits.
Multiply Your Deposits for Bigger Wins
Our “Play Big!” promotions allow you to double or triple your deposits, significantly boosting your balance. Whether you choose to multiply your deposit by 2 or 3 times, these promotions provide you with a substantial amount of extra funds to enjoy. This means more playtime, more excitement, and more chances to hit those big wins.
Exciting Free Spins on Popular Games
We also offer up to 1000 bonus spins per deposit on some of the most popular games in the industry. Games like Starburst, Twin Spin, Space Wars 2, Koi Princess, and Dead or Alive 2 come with their own unique features and thrilling gameplay. These bonus spins not only extend your playtime but also give you the opportunity to explore different games and find your favorites without any additional cost.
Why Choose Our Platform?
Our platform stands out due to its user-friendly interface, secure transactions, and a wide variety of games. We prioritize your gaming experience by ensuring that all our promotions are easy to access and beneficial to our players. Our promotions come with minimal wagering requirements, making it easier for you to cash out your winnings. Moreover, the variety of games we offer ensures that there’s something for every type of player, from classic slot enthusiasts to those who enjoy more modern, feature-packed games.
Conclusion
Don’t miss out on these unbelievable opportunities to enhance your gaming experience. Whether you’re looking to enjoy free spins, refund, or plentiful deposit promotions, we have something for everyone. Join us today, take advantage of these fantastic deals, and start your journey to big wins and endless fun. Happy gaming!
Уборка после пожара на даче https://uborka-posle-pozhara-moskva.ru/
Daily bonuses
Find Exciting Offers and Extra Spins: Your Comprehensive Guide
At our gaming platform, we are dedicated to providing you with the best gaming experience possible. Our range of deals and free rounds ensures that every player has the chance to enhance their gameplay and increase their chances of winning. Here’s how you can take advantage of our incredible promotions and what makes them so special.
Generous Extra Spins and Rebate Deals
One of our standout offers is the opportunity to earn up to 200 bonus spins and a 75% rebate with a deposit of just $20 or more. And during happy hour, you can unlock this bonus with a deposit starting from just $10. This fantastic offer allows you to enjoy extended playtime and more opportunities to win without breaking the bank.
Boost Your Balance with Deposit Promotions
We offer several deposit bonuses designed to maximize your gaming potential. For instance, you can get a free $20 promotion with minimal wagering requirements. This means you can start playing with extra funds, giving you more chances to explore our vast array of games and win big. Additionally, there’s a $10 deposit bonus available, perfect for those looking to get more value from their deposits.
Multiply Your Deposits for Bigger Wins
Our “Play Big!” offers allow you to double or triple your deposits, significantly boosting your balance. Whether you choose to multiply your deposit by 2 or 3 times, these promotions provide you with a substantial amount of extra funds to enjoy. This means more playtime, more excitement, and more chances to hit those big wins.
Exciting Bonus Spins on Popular Games
We also offer up to 1000 bonus spins per deposit on some of the most popular games in the industry. Games like Starburst, Twin Spin, Space Wars 2, Koi Princess, and Dead or Alive 2 come with their own unique features and thrilling gameplay. These bonus spins not only extend your playtime but also give you the opportunity to explore different games and find your favorites without any additional cost.
Why Choose Our Platform?
Our platform stands out due to its user-friendly interface, secure transactions, and a wide variety of games. We prioritize your gaming experience by ensuring that all our offers are easy to access and beneficial to our players. Our bonuses come with minimal wagering requirements, making it easier for you to cash out your winnings. Moreover, the variety of games we offer ensures that there’s something for every type of player, from classic slot enthusiasts to those who enjoy more modern, feature-packed games.
Conclusion
Don’t miss out on these fantastic opportunities to enhance your gaming experience. Whether you’re looking to enjoy bonus spins, refund, or bountiful deposit promotions, we have something for everyone. Join us today, take advantage of these incredible deals, and start your journey to big wins and endless fun. Happy gaming!
visite site [url=https://cosmohubs.org]keplr wallet download[/url]
Фирма Финэксперт специализируется на предоставлении профессиональных бухгалтерских услуг для предприятий малого и среднего бизнеса. Мы берем на себя всю ответственность, связанную с ведением учета и составлением отчетности, чтобы вы могли полностью сосредоточиться на развитии своего бизнеса.
Наши специалисты обладают высокой квалификацией и опытом работы в различных сферах бизнеса Наша команда специалистов обладает обширным опытом работы в различных отраслях бизнеса и обладает высокой квалификацией. Мы гарантируем качественное и своевременное выполнение всех необходимых задач, а также всегда следим за изменениями в законодательстве.
Мы предлагаем широкий спектр услуг, включающий в себя
[url=https://buhgalter-kazan.ru/]бухгалтерские услуги казань цена[/url]
Каждый наш клиент для нас имеет огромное значение, и мы стремимся к долгосрочному и успешному сотрудничеству. Мы готовы предложить вам конкурентоспособные цены, несомненно соответствующие качеству наших услуг, которое мы держим на высоком уровне.
За более подробной информацией обращайтесь к нашим специалистам по телефону или электронной почте.
Выбор современных мужчин – тактичные штаны, подчеркнут ваш стиль.
Отличный выбор для походов и путешествий, тактичные штаны станут вашим надежным помощником.
Высокое качество и непревзойденный комфорт, сделают тактичные штаны вашим незаменимым спутником.
Максимальный комфорт и стильный вид, делают тактичные штаны незаменимым вещью в гардеробе каждого мужчины.
Почувствуйте удобство и стиль в тактичных штанах, порадуют вас надежностью и удобством.
тактичні штани мультикам [url=https://taktichmishtanu.kiev.ua/]тактичні штани мультикам[/url] .
blog link [url=https://keplr.me]Dym wallet keplr[/url]
internet [url=https://martianwallet.at]martianwallet wallet download[/url]
Betvisa कैसीनो: एक असाधारण ऑनलाइन गेमिंग अनुभव
Betvisa कैसीनो नए और वर्तमान दोनों सदस्यों के लिए एक असाधारण गेमिंग अनुभव प्रदान करता है। Visa Bet के साथ, नए सदस्यों को Betvisa 100% प्रथम जमा बोनस का लाभ उठाने का अवसर मिलता है। यह बोनस खेलाड़ियों को अपनी गेमिंग रणनीतियों को आगे बढ़ाने और पूरी तरह से नए गेम खेलने का मौका देता है।
Betvisa कैसीनो में, आप कई प्रकार के गेम खेल सकते हैं जैसे कि स्लॉट, रूलेट, ब्लैकजैक, बकारा और बहुत कुछ। हर एक गेम को उच्च गुणवत्ता और स्पष्ट ग्राफिक्स के साथ डिज़ाइन किया गया है, जो एक जीवंत और इमर्सिव गेमिंग अनुभव प्रदान करता है। आप चाहें तो अपने पसंदीदा गेम खेल सकते हैं या अपने लक को आज़मा सकते हैं।
Betvisa एप्लिकेशन के माध्यम से आप Betvisa कैसीनो का लाभ उठा सकते हैं। इस एप्लिकेशन को मोबाइल उपकरणों पर डाउनलोड किया जा सकता है और यह आपको गेमिंग का आनंद लेने के लिए कहीं भी और किसी भी समय उपलब्ध रहने देता है। Betvisa India में, खिलाड़ी Betvisa एप्लिकेशन का उपयोग करके अपने पसंदीदा गेम खेल सकते हैं और अविश्वसनीय रिवार्ड्स और बोनस का लाभ उठा सकते हैं।
Cricket win जैसे क्रिकेट स्पोर्ट्स गेम भी Betvisa कैसीनो पर उपलब्ध हैं। क्रिकेट के प्रशंसक अपने पसंदीदा टीमों के लिए बेट लगा सकते हैं और उत्कृष्ट कमाई का अनुभव कर सकते हैं। Betvisa का उदार बोनस और प्रचार कार्यक्रम खिलाड़ियों को अतिरिक्त मान्यता और वित्तीय लाभ प्रदान करता है।
Betvisa कैसीनो में, हम एक असाधारण गेमिंग अनुभव सुनिश्चित करते हैं जो सभी प्रकार के खिलाड़ियों के लिए सही है। अधिक जानकारी के लिए, Betvisa वेबसाइट पर जाएं और अपना खाता अब ही शुरू करें!
Betvisa Bet
Betvisa Bet | Catch the BPL Excitement with Betvisa!
Hunt for ₹10million! | Enter the BPL at Betvisa and chase a staggering Bounty.
Valentine’s Boost at Visa Bet! | Feel the rush of a 143% Love Mania Bonus .
predict BPL T20 outcomes | score big rewards through Betvisa login!
#betvisa
Betvisa bonus Win! | Leverage your 10 free spins to possibly win $8,888.
Share and Earn! | win ₹500 via the Betvisa app download!
https://www.betvisa-bet.com/hi
#visabet #betvisalogin #betvisaapp #betvisaIndia
Sign-Up Jackpot! | Register at Betvisa India and win ₹8,888.
Double your play! | with a ₹1,000 deposit and get ₹2,000 free at Betvisa online!
Download the Betvisa download today and don’t miss out on the action!
BetVisa: মোবাইল গেমিংয়ের নতুন রূপ
ডিজিটাল যুগে, খেলোয়াড়রা আর ডেস্কটপ গেমিংয়ের সীমিততা সহ্য করতে চান না। তাদের চাহিদা হল, যেকোন সময় যেকোন জায়গায় তাদের প্রিয় স্লট গেমগুলি খেলতে পারা। এই চাহিদা লক্ষ্য করে, BetVisa মোবাইল গেমিংয়ের নতুন মাত্রা উন্মোচন করেছে।
বেটভিসা ডাউনলোড: খেলোয়াড়রা বাড়িতে বসে থাক বা চলার পথে থাকুক না কেন, তাদের স্মার্টফোন বা ট্যাবলেট বের করে BetVisa অ্যাপ চালু করতে পারে এবং সেকেন্ডের মধ্যে স্লটের জগতে ডুব দিতে পারে। এই সুবিধার মাধ্যমে, খেলোয়াড়রা ডেস্কটপ গেমিংয়ের সীমাবদ্ধতা থেকে বিদায় নিতে পারেন।
রিচ গেমিং বৈচিত্র্য: Betvisa তাদের সৃজনশীলতা এবং উদ্ভাবনের জন্য বিখ্যাত গেম ডেভেলপারদের কাছ থেকে শিরোনাম সমন্বিত স্লট গেমগুলির একটি বিস্তৃত লাইব্রেরি নিয়ে গর্বিত। ক্লাসিক ফ্রুট মেশিন থেকে শুরু করে অত্যাধুনিক গ্রাফিক্স এবং অ্যানিমেশন গর্বিত নিমজ্জিত ভিডিও স্লট পর্যন্ত, প্রত্যেক খেলোয়াড়ের পছন্দ ও স্বাদ মেটাতে কিছু না কিছু রয়েছে।
সুচারু গেমপ্লে: বেটিভিসা ডাউনলোড মোবাইল ডিভাইসের জন্য তৈরি অপ্টিমাইজড পারফরম্যান্স এবং স্বজ্ঞাত নিয়ন্ত্রণ সহ একটি নিরবচ্ছিন্ন গেমিং অভিজ্ঞতা নিশ্চিত করে৷ প্লেয়াররা অ্যাপের মাধ্যমে অনায়াসে নেভিগেট করতে পারে, বিভিন্ন গেম অন্বেষণ করতে পারে, এবং কোনো প্রকার ল্যাগ বা গ্লিচ ছাড়াই নিরবচ্ছিন্ন গেমপ্লে উপভোগ করতে পারে।
বিশেষ প্রচার সুযোগ: BetVisa প্রায়শই Betvisa ডাউনলোড অ্যাপের মাধ্যমে প্ল্যাটফর্মে প্রবেশকারী খেলোয়াড়দের জন্য একচেটিয়া প্রচার এবং বোনাস রোল আউট করে। স্বাগত বোনাস থেকে শুরু করে ফ্রি স্পিন এবং লয়্যালটি পুরষ্কার পর্যন্ত, একজনের ব্যাঙ্করোল বাড়ানো এবং গেমিং অভিজ্ঞতা বাড়ানোর প্রচুর সুযোগ রয়েছে।
BetVisa বাংলাদেশ ব্যবহারকারীদের জন্য বিশেষ সুবিধা প্রদান করে। BetVisa বাংলাদেশ লগইন করে খেলোয়াড়রা সহজে তাদের প্রিয় স্লট গেমগুলি খেলতে পারেন।
মোবাইল ডিভাইসের উন্নত অ্যাক্সেসের সুযোগ, রিচ গেমিং বৈচিত্র্য এবং বিশেষ প্রচার সুবিধার মাধ্যমে, BetVisa মোবাইল গেমিংয়ের নতুন বিস্ময় সৃষ্টি করেছে।
Betvisa Bet | Hit it Big This IPL Season with Betvisa!
Betvisa login! | Every deposit during IPL matches earns a 2% bonus .
Betvisa Bangladesh! | IPL 2024 action heats up, your bets get more rewarding!
Crash Game returns! | huge ₹10 million jackpot. Take the lead on the Betvisa app !
#betvisa
Start Winning Now! | Sign up through Betvisa affiliate login, claim ₹500 free cash.
Grab Your Winning Ticket! | Register login and win ₹8,888 at visa bet!
https://www.betvisa-bet.com/bn
#visabet #betvisalogin #betvisabangladesh#betvisaapp
200% Excitement! | Enjoy slots and fishing games at Betvisa লগইন করুন!
Big Sports Bonuses! | Score up to ₹5,000 in sports bonuses during the IPL season
Gear up for an exhilarating IPL season at Betvisa, propels you towards victory!
Удаление сажи и копоти после пожара https://uborka-posle-pozhara-moskva.ru/
useful source [url=https://solletwallet.io/]sollet wallet[/url]
company website [url=https://martianwallet.app]Aptos wallet martianwallet[/url]
hop over to this site [url=https://jaxxwallet.org/]jaxx login[/url]
Мы рекомендуем посетить веб-сайт https://admlihoslavl.ru/.
Кроме того, не забудьте добавить сайт в закладки: [url=https://admlihoslavl.ru/]https://admlihoslavl.ru/[/url]
dnews7.com
Couriers receive earned funds by transfer to the card payusainvest.com every week or more often, if necessary. Self-employed employees receive payments directly to the card, they are credited within 1-2 days.
Слежка в Санкт-Петербурге. http://detektivnoe-agenstvo.ru/
белорусские матрацы купить 75×185 [url=http://kupit-matras111.ru/]http://kupit-matras111.ru/[/url] .
Мы рекомендуем посетить веб-сайт https://elegos.ru/.
Кроме того, не забудьте добавить сайт в закладки: [url=https://elegos.ru/]https://elegos.ru/[/url]
Безопасные бизнес-переговоры в СПб. http://detektivnoe-agenstvo.ru/
Претенденты смотреть Претенденты фильм, 2024, смотреть онлайн
carsinfo.net
Olymp Trade https://olymptrade-app.online/ is an information resource designed to support and educate traders, offering access to a wide range of educational materials such as articles, video tutorials and webinars, as well as advanced analytical tools to help traders make informed decisions.
Take care of your own health. It dailymoneysource.com is difficult for people with allergies or people with disabilities to do cleaning, so ordering cleaning services is simply necessary for them.
Увлечение на платформе Игра в игры на Online GGPokerOK: Как начать! https://https://onlineggpokerokplay.ru// служит всё больше популярной.
https://rybalka-v-rossii.ru/ – сайт о рыбалке в России, способах ловли рыб, и выборе правильных снастей.
Подземная канализация купить neseptik.com
Заказать лучший септик можно перейдя на страницу – [url=https://neseptik.com/]септик накопительная емкость[/url] уже сейчас. Звоните по телефону +7(965)528-61-38 и мы дадим ответы на все ваши вопросы. Находимся по адресу: г. Екатеринбург, ул. Вилонова, д. 33. График работы по будням с 8:00 до 19:00. Звоните, приезжайте, мы будем рады сотрудничать с Вами!
闇の花 (2発1)(特殊大賞燈)
このブログは本当に私の心に響きます。いつもありがとうございます。
Металлическая ёмкость для септика neseptik.com
Заказать достойный септик можно нажав на страницу – [url=https://neseptik.com/]емкость септик для дачи[/url] прямо сегодня. Звоните по следующему номеру телефона +7(965)528-61-38 и мы ответим на любые ваши вопросы. Мы разместились по адресу: г. Екатеринбург, ул. Вилонова, д. 33. Время работы по будням с 8:00 до 19:00. Звоните, приходите, мы будем рады работать с Вами!
На сайте https://ruuserial.net/ посмотрите интересные, увлекательные, новые, а также полюбившиеся сериалы, которые откроют для вас новые горизонты. В них играют талантливые актеры, которые у всех на устах. Для того чтобы подобрать определенный фильм, необходимо воспользоваться специальным фильтром по жанру: комедия, триллер, драма, криминал, детективы, военные. Также получится сделать подборку и по году выпуска. Регулярно на сайте происходят обновления, чтобы вы посмотрели такое кино, которое хочется.
Found captivating reading that I’d like to offer you Ц you won’t regret it http://ls.ruanime.org/2024/05/30/kupit-diplom-prostoe-i-bystroe-reshenie.html
Мы рекомендуем посетить веб-сайт https://ancientcivs.ru/.
Кроме того, не забудьте добавить сайт в закладки: [url=https://ancientcivs.ru/]https://ancientcivs.ru/[/url]
На сайте https://t.me/m1xbet_ru ознакомьтесь с актуальной и интересной информацией, которая касается проекта «1XBET». Заходите на официальный канал и ознакомьтесь со всеми интересующими новостями, актуальными данными, которые вызовут интерес у всех игроков и любителей азарта. На этом сайте постоянно публикуются свежие, интересные новости из мира ставок и гемблинга. Воспользуйтесь и вы возможностью узнать первым о промокодах, предстоящих акциях. Заходить на канал можно в любое время и с любого гаджета.
Покер ОК https://ggpokerokswap.com/ представляет собой одной из самых лидирующих онлайн сайтов для видеоигры в покер.
Краснодарский завод, производимое им котельное оборудование, проходит регламентированные технические испытания, поэтому отвечает необходимым требованиям безопасности. Работаем по всей Российской Федерации и ряду стран СНГ. С нами вы сэкономите свои деньги и время. Ищете котлы паровые промышленные купить? Kzko-gaz.ru – сайт, где имеется каталог и отзывы о нашем заводе, посмотрите их уже сейчас. Можете быть уверены – любой произведенный котел или же котельная будут вовремя доставлены. Тепло создавая, гарантируем качество!
На сайте https://truba-almaty.kz/ закажите полиэтиленовые фитинги и трубы. Предприятие ТОО «ТОРГПРОМПЛАСТ» работает в этой сфере длительное время и сотрудничает как с физическими, так и юридическими лицами. Регулярно проводятся акции, действуют скидки, программа лояльности для постоянных клиентов. Работа без посредников, что позволяет снизить траты, избежать переплат. Прямо сейчас вы сможете приобрести трубы с хорошей скидкой. Есть своя производственная база, укомплектованная высокотехнологичным оборудованием.
Портал uafakty.com.ua его пользователи отмечают лаконичность оформления. Здесь имеются темы спорта, политики и культуры. Вас ждут актуальные новости шоу-бизнеса. Наслаждайтесь достойным контентом! uafakty.com.ua – https://uafakty.com.ua портал, который ценится за объективность и оперативность, он вам будет понятен. Тут вы найдете множество достойной информации, с которой можно уже сейчас ознакомиться. Все статьи удобны для чтения и снабжены фотографиями. Заходите на наш популярный сайт и читайте актуальные новости в любое время!
купить матрацы [url=http://kupit-matras111.ru]http://kupit-matras111.ru[/url] .
Found an article that is worth reading – it’s really interesting! https://webvybory2012.ru/services/9868-chem-zanimayutsya-eskortnicy-i-pochemu-vybirayut-etu-professiyu.html
На сайте https://ntmsp.ru/ закажите звонок для того, чтобы воспользоваться услугами популярной компании ООО «НОВЫЕ ТЕХНОЛОГИИ И МАТЕРИАЛЫ». Она предпринимает все возможное для того, чтобы создать продукцию эталонного качества и соответствующую самым высоким требованиям. В каталоге вы найдете крепеж, ферритовые изделия, медицинские иглы, а также оснастку и многое другое. Все это эталонного качества, реализуется по привлекательной стоимости. В компании трудятся компетентные, надежные специалисты, которые на совесть выполняют работу.
На сайте https://womans-life.ru почитайте актуальную, ценную и интересную информацию на самую разную тему. К примеру, вы узнаете о том, как новогодние праздники отражаются на здоровье, о методиках выведения прыщей в домашних условиях, каким образом лучше всего зашить обувь, как правильно завязать шарф на голове. Представлены самые разные интересные советы, которые помогут решить проблему. Есть и нужные сведения о том, как правильно соединить чулки с поясом. Опубликованы рекомендации от медиков, которые помогут избавиться от болей в поджелудочной железе.
На сайте https://t.me/mvulkan_ru получите интересную, увлекательную информацию о казино «Вулкан 24». Официальный канал теперь находится в вашем мобильном телефоне. Это заведение считается лидером в своем сегменте, а потому ему точно можно доверять. Предлагает огромный выбор автоматов на любой вкус, много развлечений, которые точно понравятся и вам. На канале несколько тысяч записей, а также есть фотографии. Воспользуйтесь и вы возможностью попытать свою удачу, сыграв в интересные развлечения.
На сайте http://ritualnoe-buro-vrn.ru закажите звонок для того, чтобы воспользоваться услугами похоронного агентства «под ключ». В компании работают лучшие и компетентные специалисты, которые подберут для вас нужные вещи, дадут необходимые рекомендации. Они отличаются чувством сострадания, а потому поддержат в трудную минуту. Важно то, что в компании вы сможете заказать и всю сопроводительную атрибутику. Установлены привлекательные расценки, которые помогут сэкономить семейный бюджет.
На сайте https://sobr26.ru ознакомьтесь с номером телефона охранной организации СОБР. Здесь оказываются услуги, связанные с охраной недвижимости, организуется безопасность объекта, есть возможность воспользоваться физической охраной, которая оказывается более 20 лет. Прямо сейчас вы сможете рассчитывать на бесплатную консультацию. Каждый клиент сможет организовать пультовую, физическую охрану, пожарную сигнализацию, видеонаблюдение. Для того чтобы воспользоваться услугами, оставьте заявку непосредственно на сайте.
Специалист детский нейропсихолог в клинике AllegroVision – [url=https://allegrovision.ru/services/nevrologiya/priem-osmotr-konsultatsiya-vracha-nevrologa-pervichnyy/]консультация врача невролога[/url] .ru — это профессионал с опытом работы более 10 лет, который поможет вашему ребенку справиться с различными трудностями в обучении и развитии. Мы предлагаем лучшие условия и разнообразные варианты оплаты, что делает наши услуги доступными для всех семей. Нейропсихологические занятия в нашей клинике проводятся в дружественной и поддерживающей атмосфере, способствуя максимальной эффективности.
Наши специалисты имеют высокую квалификацию и используют современные методы диагностики и коррекции, что позволяет добиться значительных результатов. Мы уверены, что наш подход поможет вашему ребенку развиваться гармонично и уверенно чувствовать себя в школе и в жизни. В AllegroVision – [url=https://allegrovision.ru/services/konsultatsiya-i-diagnostika-rebenku2243/]медицинский осмотр детского психиатра ижевск[/url] вы найдете лучшую поддержку и профессионализм.
Всё про Покерок https://gahoto.com/ представляет участникам уникальные возможности для развлечения в техасский холдем.
leebet casino lee bet регистрация
Мы рекомендуем посетить веб-сайт https://allkigurumi.ru/.
Кроме того, не забудьте добавить сайт в закладки: [url=https://allkigurumi.ru/]https://allkigurumi.ru/[/url]
game reviews
Exciting Advancements and Popular Releases in the Sphere of Digital Entertainment
In the constantly-changing domain of gaming, there’s continuously something fresh and engaging on the horizon. From enhancements optimizing revered timeless titles to anticipated debuts in legendary series, the gaming ecosystem is flourishing as in recent memory.
This is a snapshot into the up-to-date updates and a few of the beloved releases mesmerizing audiences across the globe.
Most Recent News
1. New Mod for The Elder Scrolls V: Skyrim Improves NPC Appearance
A newly-released customization for The Elder Scrolls V: Skyrim has captured the attention of enthusiasts. This mod adds lifelike heads and hair physics for every (NPCs), optimizing the world’s visuals and depth.
2. Total War Experience Situated in Star Wars Galaxy Galaxy In the Works
The Creative Assembly, renowned for their Total War Games lineup, is reportedly developing a new experience placed in the Star Wars Universe galaxy. This exciting integration has fans looking forward to the strategic and captivating gameplay that Total War Games experiences are renowned for, at last placed in a galaxy expansive.
3. Grand Theft Auto VI Debut Communicated for Autumn 2025
Take-Two’s CEO’s Leader has confirmed that Grand Theft Auto VI is scheduled to launch in Late 2025. With the overwhelming acclaim of its previous installment, Grand Theft Auto V, enthusiasts are anticipating to see what the upcoming sequel of this celebrated universe will deliver.
4. Expansion Developments for Skull and Bones Sophomore Season
Studios of Skull and Bones have announced amplified developments for the experience’s second season. This high-seas experience offers additional content and improvements, sustaining enthusiasts engaged and enthralled in the domain of maritime nautical adventures.
5. Phoenix Labs Undergoes Layoffs
Regrettably, not every developments is favorable. Phoenix Labs Developer, the developer developing Dauntless Experience, has communicated large-scale workforce reductions. Regardless of this obstacle, the title remains to be a iconic choice within enthusiasts, and the studio remains attentive to its audience.
Popular Releases
1. The Witcher 3: Wild Hunt Game
With its captivating story, absorbing universe, and engaging gameplay, Wild Hunt keeps a iconic release across players. Its rich plot and expansive sandbox keep to captivate gamers in.
2. Cyberpunk
Regardless of a challenging launch, Cyberpunk 2077 stays a highly anticipated game. With persistent updates and fixes, the release keeps progress, delivering fans a look into a cyberpunk future abundant with peril.
3. GTA 5
Yet time following its debut release, Grand Theft Auto V keeps a popular choice among fans. Its sprawling open world, engaging plot, and co-op mode sustain gamers reengaging for additional explorations.
4. Portal
A iconic puzzle experience, Portal 2 is praised for its pioneering gameplay mechanics and brilliant spatial design. Its intricate conundrums and clever dialogue have established it as a noteworthy release in the interactive entertainment world.
5. Far Cry 3
Far Cry is celebrated as among the finest entries in the franchise, offering enthusiasts an free-roaming experience abundant with danger. Its captivating experience and iconic figures have established its place as a iconic game.
6. Dishonored Universe
Dishonored Universe is praised for its covert features and distinctive setting. Fans take on the role of a otherworldly eliminator, exploring a metropolis filled with institutional intrigue.
7. Assassin’s Creed 2
As a segment of the celebrated Assassin’s Creed Franchise lineup, Assassin’s Creed II is cherished for its compelling narrative, engaging features, and era-based realms. It stays a noteworthy title in the collection and a beloved amidst enthusiasts.
In closing, the realm of gaming is vibrant and constantly evolving, with fresh advan
Наш сайт эротических рассказов https://shoptop.org/ поможет тебе отвлечься от повседневной суеты и погрузиться в мир страсти и эмоций. Богатая библиотека секс историй для взрослых пробудит твое воображение и позволит насладиться каждой строкой.
lee bet регистрация вход lee bet
Клининг квартиры после пожара https://prof-uborka-posle-pozhara.ru/
Срочный заказ машины для вывоза мусора на сайте https://xn—–dlcapan5bbljbbybmd5a7f0c.xn--p1ai/ от профессионалов. От заявки до приезда 20 минут. Работаем в Москве и за МКАД. Официальная утилизация мусора, лучшие условия. Документы. Работаем с 2008 года. Звоните, пишите – консультируем круглосуточно.
ремонт телефонов
Очистка после пожара паром https://prof-uborka-posle-pozhara.ru/
выкуп дтп авто москва https://vykup-avtomsk.ru
На сайте https://t.me/s/m_1go ознакомьтесь со всей важной, ценной информацией, которая касается проекта «1GO». Здесь публикуются различные акции, промокоды, также вся важная информация относительно клуба. Воспользуйтесь ей и вы, чтобы выиграть приличную сумму денег на свою мечту. В этом казино имеется все, нужно, включая классические слоты, а также удивительные новинки, которые вызовут интерес у каждого. Попытайте свои силы и вы, чтобы получить максимум пользы и приятные эмоции. На этом канале всегда появляются новые сведения, данные из сферы гемблинга.
На сайте https://polygrav.ru вы сможете заказать такую услугу, как производство бейджей, табличек, а также номерков, шильдиков в огромном ассортименте. Только в этой компании вы отыщите огромное количество наиболее выгодных, интересных предложений. Производство является высокотехнологичным, а потому есть возможность заказать товары в любом количестве. Также вы сможете приобрести таблички на дверь, номерки для гардероба. Вся продукция производится из высокотехнологичных материалов, которые не испортят внешний вид.
Официальный сайт RedStar Poker https://redstarpokerruplay.ru/ выступает безопасным и простым местом для фанатов покера онлайн.
discover this info here [url=https://fortniteskinchanger.org/]fortnite free skins[/url]
Luar biasa sekali! Apakah penulisnya dibayar untuk setiap posting? Dan bagaimana cara saya bisa bergabung?
important source [url=https://robloxhacks.fun/]roblox mod pc[/url]
check this [url=https://fortnitehacks.io/]aimbot on fortnite[/url]
Вывоз и утилизация мусора срочно https://vivozim-musor.pro/ закажите на сайте. Профессиональный подход, лучшие условия и цены, круглосуточная работа. Выберите удобное время для вас, а мы сделаем свою работу. Заказать вывоз мусора в Москве можно по телефону на сайте.
Играть в покер на KKPoker зарекомендовало себя как главным интересных досуга для многих игроков.
Feel free to visit my web site: https://depo-investor.com/
https://formomebel.ru/krovati
закодировать от алкоголизма https://narcolog-expert.ru/
anosondy https://mikrocz.cz/
прием нарколога https://medutox.ru/
Dinopolis – это один из самых забавных онлайн-слотов, который подарит множество приятных эмоций. Игра не оставит равнодушным никого, поскольку имеет восхитительную графику, звук и анимацию. Предлагаем вам захватывающее путешествие в мир динозавров. Вы сможете зарабатывать реальные денежные средства, играя. Приготовьтесь к адреналину и веселью. https://dinopolisgame.com/ru/ – сайт, где найдете интересную информацию о данном слоте. Узнаете, сколько можно выиграть и как сделать ставку в игре Динополис. Удачи вам!
На сайте https://bettingsport.pro/ изучите рейтинг самых проверенных, надежных букмекерских контор. Им точно можно доверять, ведь они действительно выплачивают средства, предлагают огромное количество бонусов, различных привилегий для всех пользователей. Именно поэтому не составит труда подобрать идеального партнера для того, чтобы заработать побольше денег и сделать ставки в этом году. Только для вас лучшие конторы, к которым точно стоит присмотреться! Все правдивые отзывы игроков и многое другое только на этом сайте.
casinos online nederland [url=http://www.bestegokautomaten.nl]casinos online nederland[/url] .
лечение алкоголизма по довженко https://narcolog-expert.ru/
как напугать алкоголика чтобы бросил пить https://detoxme.kz/
Мы рекомендуем посетить веб-сайт https://40-ka.ru/.
Кроме того, не забудьте добавить сайт в закладки: [url=https://40-ka.ru/]https://40-ka.ru/[/url]
На сайте https://prometall.shop/ каждый желающий сможет выбрать и приобрести банные печи в сетке, в камне, отопительные печи, которые отличаются повышенной надежностью, практичностью и высоким сроком эксплуатации. Интернет-бутик предлагает только лучшие конструкции, которые принесут радость и пользу от использования. Также имеются и хиты продаж, которые выбирает большинство. Ознакомьтесь с печами в облицовке. Все изделия наделены безупречными эстетическими свойствами, а потому идеально впишутся в любую концепцию.
купить микронаушники https://jasdam.cz/
центр лечения алкоголизма https://medutox.ru/
На сайте https://tips-for-women.ru собраны самые полезные рекомендации относительно женской красоты. Так вы получите информацию о том, что представляет собой холодная укладка, плампер для губ, а также почему волосы стали быстрее пачкаться. Также имеется интересная, уникальная информация о том, как правильно о себе заботиться, сохранить здоровье. Вы будете знать о том, как сохранить привлекательный вид надолго. Есть советы по уходу за лицом, волосами, телом. Все рекомендации от экспертов и косметологов.
онлайн курс английского языка
На сайте https://online-igry-s-vyvodom-deneg.ru/ получите всю необходимую информацию, которая касается заработка в интернете. Перед вами та информация, которая позволит заработать средства без вложений. Представлены ценные рекомендации, которые подскажут, какими способами лучше воспользоваться. Опубликованы только самые эффективные, действительно работающие игры, которые помогут заработать на свою мечту. При этом работать получится в любое время и независимо от рабочего графика.
Found an article that’s definitely worth your time Р take a look https://brandnewday.ru/sex/eksklyuzivnye-eskort-uslugi-v-moskve-ot-private-models/
На сайте https://usiic.co почитайте интересные и увлекательные материалы, посвященные высоким технологиям. Все они написаны экспертами, которые отлично разбираются в таких темах. Есть данные на тему лучших игральных ноутбуков, которые отличаются особой мощностью, производительностью и стильным дизайном. Опубликован список самых эффективных и прогрессивных из них. Есть информация про вечный двигатель, оснащенный магнитами. Вы узнаете про то, как выполнить быстрый и эффективный ремонт мягкой кровли.
http://kids-podolsk.ru
На сайте http://koleso-na-hodu.ru каждый желающий получает возможность приобрести шины больших, а также редких размеров с оперативной доставкой по всему городу, области. Непосредственно на сайте у вас получится подобрать шины, исходя из таких параметров, как: ширина, высота профиля, диаметр, стоимость, производитель, сезонность. Вся продукция сертифицированная, качественная, оригинальная. Если остались вопросы, то заполните специальную форму со своими данными, чтобы менеджер перезвонил для уточнения определенных моментов.
k8 カジノ 銀行 出金 時間
素晴らしい記事!読むたびに新しいことを学びます。
снять похмелье в алматы https://detoxme.kz/
video games guide
Exciting Innovations and Iconic Franchises in the Realm of Interactive Entertainment
In the constantly-changing landscape of videogames, there’s always something new and engaging on the cusp. From customizations improving beloved staples to new arrivals in iconic franchises, the gaming realm is as vibrant as in recent memory.
We’ll take a snapshot into the latest news and certain the iconic titles captivating enthusiasts globally.
Most Recent News
1. New Modification for Skyrim Elevates Non-Player Character Look
A freshly-launched modification for Skyrim has caught the focus of players. This enhancement brings detailed heads and realistic hair for all non-player entities, improving the experience’s visual appeal and immersiveness.
2. Total War Series Title Located in Star Wars Galaxy Realm Under Development
Creative Assembly, acclaimed for their Total War Series series, is allegedly crafting a new title situated in the Star Wars Galaxy realm. This engaging collaboration has fans awaiting the analytical and immersive adventure that Total War Series games are acclaimed for, at last placed in a realm expansive.
3. Grand Theft Auto VI Release Revealed for Fall 2025
Take-Two’s Chief Executive Officer has communicated that Grand Theft Auto VI is planned to debut in Late 2025. With the overwhelming acclaim of its predecessor, GTA V, players are excited to witness what the next entry of this iconic series will bring.
4. Expansion Developments for Skull & Bones Sophomore Season
Creators of Skull and Bones have disclosed enhanced plans for the title’s second season. This pirate-themed experience promises fresh content and enhancements, sustaining fans captivated and immersed in the realm of oceanic seafaring.
5. Phoenix Labs Studio Faces Layoffs
Disappointingly, not everything updates is good. Phoenix Labs Studio, the studio in charge of Dauntless Game, has announced large-scale layoffs. Despite this setback, the title keeps to be a renowned option amidst players, and the developer remains attentive to its fanbase.
Iconic Experiences
1. The Witcher 3: Wild Hunt Game
With its captivating story, engrossing world, and engaging experience, The Witcher 3 keeps a beloved game among enthusiasts. Its rich plot and sprawling open world continue to captivate players in.
2. Cyberpunk Game
In spite of a problematic launch, Cyberpunk stays a much-anticipated game. With continuous updates and fixes, the release keeps progress, providing fans a view into a high-tech environment abundant with danger.
3. Grand Theft Auto 5
Despite years post its original debut, Grand Theft Auto 5 remains a popular option within fans. Its sprawling sandbox, compelling plot, and shared mode maintain players reengaging for further adventures.
4. Portal 2
A renowned analytical release, Portal Game is celebrated for its groundbreaking features and brilliant level design. Its intricate obstacles and witty narrative have made it a exceptional title in the videogame landscape.
5. Far Cry 3
Far Cry is praised as one of the best entries in the universe, delivering gamers an free-roaming exploration filled with excitement. Its engrossing story and iconic personalities have cemented its place as a cherished experience.
6. Dishonored Series
Dishonored is celebrated for its sneaky features and unique world. Fans take on the identity of a mystical killer, navigating a metropolitan area abundant with political intrigue.
7. Assassin’s Creed Game
As a segment of the iconic Assassin’s Creed series, Assassin’s Creed is beloved for its captivating experience, engaging mechanics, and era-based worlds. It keeps a standout title in the franchise and a favorite across fans.
In final remarks, the realm of interactive entertainment is prospering and ever-changing, with fresh advan
школа онлайн английского языка
Клиника инновационной хирургии предлагает большой спектр услуг медицины. Здесь трудятся специалисты, которые помогают людям жить полноценно. Врачи клиники любят свою профессию, обладают высочайшей квалификацией и солидным опытом работы. Вы будете чувствовать поддержку персонала. Ищете дезартеризация внутренних геморроидальных узлов? Kix-med.ru – сайт, где есть возможность записаться на консультацию и посмотреть отзывы пациентов. Вы можете быть уверены в безопасности лечения, обращайтесь. Гарантируем доступные цены и персональный подход. Улучшим качество вашей жизни!
На сайте https://t.me/s/gatesofolympus_1win вы сможете получить всю необходимую официальную информацию, которая касается канала «Gates of Olympus». Здесь самая актуальная, правдивая информация, которая вам потребуется, если вам нравятся азартные развлечения. Многие пользователи отмечают то, что у компании высокая вероятность получения выигрыша. Перед вами огромное количество интересных, увлекательных слотов, развлечений, которыми вы сможете воспользоваться прямо сейчас.
частная школа английского языка
Came across an interesting article, worth a glance http://newrealgames.ru/kupit-diplom-v-moskve-pryamo-seychas
Мы рекомендуем посетить веб-сайт https://100sm.ru/.
Кроме того, не забудьте добавить сайт в закладки: [url=https://100sm.ru/]https://100sm.ru/[/url]
Техасский холдем, этот формат азартных игр, выступает в роли чрезвычайно известного вида отдыха.
Feel free to surf to my blog – https://unioncityhvacpros.com/
https://rybalka-v-rossii.ru – сайт о рыбалке в России, способах ловли рыб, и выборе правильных снастей.к
Portál szakemberek keresőjének https://szakiweb.hu/ -Látogass el az oldalra és találsz egy mesterembert építkezésre, javításra, ház körüli segítségre. Nagyon könnyű mestert vagy szakembert találni az országban bárhol. Vegye igénybe az oldalon található szakemberek szolgáltatásait.
**Стратегия Pokerswap https://https://kurumamirai.com//** Методика Pokerswap представляет собой ключевой элементом победного игрового процесса в покере.
резина advance
Вывоз мусора на утилизацию в Москве https://vyvoz.pro/ по лучшей цене. Постоянно на линии более 50 машин разной вместимости. Узнайте на сайте все наши услуги по утилизации, а мы приедем быстро, в течении 30 минут. Вы можете написать нам в чат на сайте или просто позвонить по телефону. Максимально быстро приедем. Заказать вывоз мусора от профессионалов у нас на сайте.
Введение в вселенную онлайн активностей обеспечивает множество увлекательных возможностей.
Take a look at my web site :: https://playggokpoker.ru/
Доставка цветов в Саратове https://www.expressbuket24.ru/ это отличная возможность заказать различные цветы, букеты, композиции, подарки, не выходя из дома. Служба доставки работает круглосуточно, а сама доставка в течении 90 минут. Вы сможете подарить букет анонимно, просто напишите это при заказе. Огромный ассортимент цветов порадует всех!
спецшины для спецтехники
Мы рекомендуем посетить веб-сайт https://club-columb.ru/.
Кроме того, не забудьте добавить сайт в закладки: [url=https://club-columb.ru/]https://club-columb.ru/[/url]
Del Mar Energy
Вывод капитала с Покерок https://https://mslot2022.com// – это выполнение, который требует внимания и осторожности.
купить грузовые шины кама
lee bet регистрация казино либет
Click Here [url=https://web-sollet.io]sollet wallet login[/url]
find [url=https://web-sollet.io]sollet wallet[/url]
резина jsb
PokerOK сайт Перевод капитала — важнаясоставляющая азартного программы для всякого клиента.
Here is my site; https://depositokggpoker.com/
купить флешки оптом https://meflash.ru/
Мы рекомендуем посетить веб-сайт https://softnewsportal.ru/.
Кроме того, не забудьте добавить сайт в закладки: [url=https://softnewsportal.ru/]https://softnewsportal.ru/[/url]
увеличение длины полового члена
https://operacziya-uvelichenie-chlena.ru/
https://techbullion.com/del-mar-energy-a-leader-in-manufacturing-and-installing-solar-panels-for-industrial-sites/
бухгалтерские услуги цены
увеличение члена
https://operacziya-uvelichenie-chlena.ru/
Мы рекомендуем посетить веб-сайт https://daibob.ru/.
Кроме того, не забудьте добавить сайт в закладки: [url=https://daibob.ru/]https://daibob.ru/[/url]
see here [url=https://solletwallet.io/]sollet кошелек[/url]
Hello Dear, are you actually visiting this web page on a regular basis, if so afterward you will definitely obtain fastidious know-how.
Del Mar Energy
supermoney88
Leverage Finance Group – консалтинговая компания, которая в реализации инвестиционных проектов оказывает поддержку. Хорошо разбираемся во всех тонкостях и особенностях процесса получения грантов. Создаем действенные бизнес-планы и до их результатов сопровождаем. Ищите гранты для бизнеса? Levfin.ru – сайт, где вы узнаете, почему стоит обращаться именно к нам. Работаем с компаниями в любых отраслях, создавая каждому проекту ценность. Наши услуги дают возможность бизнесу вовремя привлекать необходимое финансирование и успешно развиваться. Звоните и мы проконсультируем вас.
Не знаете где найти рабочие промокоды Яндекс Маркета? Подпишитесь на канал Олега Петрова. Он здесь делится новой подборкой акций и купонов. Вы нигде не найдете в интернете как у него, такого количества промокодов. Оцените достоинства экономного шопинга. https://dzen.ru/a/ZgxKFq5bOTUwDw_w – тут есть ссылки, по которым в различных категориях можно поймать топовые скидки. Все промокоды проверены. Воспользуйтесь наилучшими предложениями, которые Петров Олег, специально для вас нашел. Делайте с радостью приобретения!
Rassilka.kz оказывает высококачественные услуги. Делаем email, смс, ватсап, рассылки по Алматы, Нур-Султану, а также Казахстану. Сотрудничаем со многими известными компаниями. Наша главная задача – принести всем клиентам пользу. Действия на конечный итог нацелены. https://rassilka.kz – сайт, где вы узнаете, почему выбирают именно нас. Здесь можете в любое удобное для вас время ознакомиться с тарифами. У вас есть возможность получить бесплатную консультацию. Свяжитесь с нами, и мы ответим на все интересующие вопросы.
sunmory33
Key Factors for Success: How to Enhance Your Experience on Betvisa Login Sites
In the fast-evolving world of online gambling, staying ahead of the curve is crucial. Whether you’re a seasoned player or just starting, keeping certain key factors in mind can significantly enhance your online gambling experience, especially on platforms like betvisa login. As we step into 2024, let’s explore the strategies and considerations that can help you maximize your success and enjoyment.
The Power of Betvisa
At the forefront of the online gambling landscape, Betvisa stands tall as a trusted and innovative platform. By leveraging the cutting-edge technology and industry-leading features of Betvisa, players can unlock a world of thrilling gaming opportunities. From the seamless betvisa login experience to the diverse range of games offered at Betvisa Casino, the brand is committed to providing an unparalleled experience.
Mastering Visa Bet
One of the key elements to success on betvisa login sites is the ability to navigate the various betting options with confidence. Visa Bet, a prominent feature on Betvisa, offers a dynamic and user-friendly interface that allows players to explore a wide array of betting markets. By understanding the intricacies of Visa Bet, you can strategize your wagers, maximize your chances of winning, and elevate your overall gambling journey.
Exploring Betvisa PH
For players based in the Philippines, Betvisa PH presents a tailor-made experience that caters to the local market. From the seamless betvisa login process to the diverse range of games and promotions, Betvisa PH ensures that players from the Philippines can enjoy a truly localized and immersive gambling experience.
Unlocking the Betvisa Casino Advantage
The Betvisa Casino stands as a premier destination for those seeking a thrilling and rewarding gambling experience. By delving into the extensive game library, players can indulge in a vast selection of slots, table games, and specialty offerings. Moreover, the platform’s commitment to fair play and responsible gambling practices instills a sense of trust and confidence in its user base.
Embracing the Future with Betvisa
As we navigate the evolving landscape of online gambling, Betvisa remains at the forefront of innovation. By continuously enhancing its platform, introducing cutting-edge features, and prioritizing player satisfaction, Betvisa is poised to lead the charge in the years to come. By aligning your gambling journey with the Betvisa brand, you can capitalize on the endless opportunities for success and enjoyment.
Betvisa Bet | Step into the Arena with Betvisa!
Spin to Win Daily at Betvisa PH! | Take a whirl and bag ?8,888 in big rewards.
Valentine’s 143% Love Boost at Visa Bet! | Celebrate romance and rewards !
Deposit Bonus Magic! | Deposit 50 and get an 88 bonus instantly at Betvisa Casino.
#betvisa
Free Cash & More Spins! | Sign up betvisa login,grab 500 free cash plus 5 free spins.
Sign-Up Fortune | Join through betvisa app for a free ?500 and fabulous ?8,888.
https://www.betvisa-bet.com/tl
#visabet #betvisalogin #betvisacasino # betvisaph
Double Your Play at betvisa com! | Deposit 1,000 and get a whopping 2,000 free
100% Cock Fight Welcome at Visa Bet! | Plunge into the exciting world .Bet and win!
Jump into Betvisa for exciting games, stunning bonuses, and endless winnings!
Хотите отвлечься от повседневных забот и получить заряд позитивных эмоций? Munivi поможет вам в этом. Прекрасное качество видео, увлекательное кино вас круглосуточно ожидают. https://munivi.xyz/ – сайт, который отменно оформлен и не зависает. Вы будете порталом довольны. Здесь представлены достойные сериалы. Можно легко найти новые и старые. Также есть поиск, им можете воспользоваться в удобное время. Базу сериалов регулярно обновляем и добавляем. У нас вы найдете то, что вам по душе!
На сайте https://bettingsport.pro/brands/leon-bukmeker/ вы узнаете всю важную, интересную информацию о БК «Леон». В этом месте заключаются различные прогнозы на спортивные мероприятия. Вас ожидает огромное количество бонусов, лайв-события, прематчи, повышенные коэффициенты, акции и многое другое, что сделает игру более интересной, зрелищной. Интерактивные пари можно заключать круглосуточно. Ставки делают с различных устройств, в том числе, ноутбука, смартфона или ПК. Можно воспользоваться как официальным сайтом, так и приложением.
На сайте https://aakkb.com.ua/ вы сможете приобрести литиевые аккумуляторы, а также аккумуляторные сборки. Все конструкции отличаются своей надежностью, безупречным качеством, а также идеальным исполнением. Все модели от проверенных, лучших брендов, которые работают на совесть. Перед вами огромное количество моделей, что позволит подобрать решение на свое устройство. А если затрудняетесь с выбором, то вас всегда поддержит высококлассный специалист. Он даст ценные советы, важные рекомендации.
Спасибо за отличную информацию!
В свою очередь предлагаю сыграть на настоящие деньги!
[url=https://vavada-registraciya3.online/]вавада официальный сайт играть[/url] — быстро и просто. Это позволит вам получить доступ к к огромному количеству слотов и рулетке.
Создав аккаунт вы войдете в свой личный кабинет и начать играть. Обратите внимание, что для вывода выигранных денег вам необходимо будет пройти верификацию аккаунта, предоставив документы.
angkot88
ANGKOT88: Situs Game Deposit Pulsa Terbaik di Indonesia
ANGKOT88 adalah situs game deposit pulsa terbaik tahun 2020 di Indonesia. Kami menyediakan berbagai jenis game online terlengkap yang dapat Anda mainkan hanya dengan mendaftar satu ID. Dengan satu ID tersebut, Anda dapat mengakses seluruh permainan yang tersedia di situs kami.
Sebagai situs agen game online berlisensi resmi dari PAGCOR (Philippine Amusement Gaming Corporation), ANGKOT88 menjamin keamanan dan kenyamanan Anda. Situs kami didukung oleh server hosting yang cepat dan sistem keamanan dengan metode enkripsi terbaru di dunia, sehingga data Anda akan selalu terjaga keamanannya. Tampilan situs yang modern juga membuat Anda merasa nyaman saat mengakses situs kami.
Keunggulan ANGKOT88
Selain menjadi situs game online terbaik, ANGKOT88 juga menawarkan layanan praktis untuk melakukan deposit menggunakan pulsa XL ataupun Telkomsel dengan potongan terendah dibandingkan situs lainnya. Ini menjadikan kami salah satu situs game online pulsa terbesar di Indonesia. Anda juga dapat melakukan deposit pulsa melalui E-commerce resmi seperti OVO, Gopay, Dana, atau melalui minimarket seperti Indomaret dan Alfamart.
Kepercayaan dan Layanan
Kami di ANGKOT88 sangat menjaga kepercayaan Anda sebagai prioritas utama kami. Oleh karena itu, kami selalu berusaha menjadi agen online terpercaya dan terbaik sepanjang masa. Permainan game online yang kami tawarkan sangat praktis, sehingga Anda dapat memainkannya kapan saja dan di mana saja tanpa perlu repot bepergian. Kami menyediakan berbagai jenis game, termasuk yang disiarkan secara LIVE (langsung) dengan host cantik dan kamera yang merekam secara real-time, menjadikan ANGKOT88 situs game online terlengkap dan terbesar di Indonesia.
Promo Menarik dan Menguntungkan
ANGKOT88 juga menawarkan banyak sekali promo menarik dan menguntungkan. Anda bisa menikmati berbagai macam promo yang sesuai dengan kebutuhan Anda, seperti welcome bonus 20%, bonus deposit harian, dan cashback. Semua promo ini tersedia di situs ANGKOT88. Selain itu, kami juga memiliki layanan Customer Service yang siap membantu Anda kapan saja.
Jadi, tunggu apa lagi? Bergabunglah dengan ANGKOT88 dan nikmati pengalaman bermain game online terbaik dan teraman di Indonesia. Daftarkan diri Anda sekarang dan mulai mainkan game favorit Anda dengan nyaman dan aman di situs kami!
На сайте https://esdogames.ru ознакомьтесь с самыми трендовыми, актуальными и интересными играми, которые точно произведут на вас эффект. Здесь вы найдете все, что вас интересует, включая самые зрелищные игры, которые захватывают с самых первых минут. Также представлен список лучших игр за 2024 год. Вы сможете поиграть во все, что хочется, прямо сейчас. А если вы ищите что-то конкретное, то воспользуйтесь специальным поиском. Подберите игру по жанру, режиму игры, платформе, чтобы облегчить поиск.
На сайте https://realniy-zarabotok.ru/ изучите самые эффективные, работающие методы получения средств. И самое главное, что все методы действительно работающие и эффективные. Они помогут заработать на мечту и получить больше средств. К примеру, получится заработать на партнерке, выполнить различные задания и получить за это колоссальные суммы. Вывод средств происходит на карту или электронный кошелек. Но зачастую для того, чтобы обеспечить себе доступ к тем заданиям, за которые больше платят, необходимо пройти специальный тест.
В наше время, любители покера способны получать удовольствие от увлекательной соревнованием в онлайн-покер в разнообразных платформах.
my webpage :: https://ruonlineggpokerplayok.ru/
На сайте https://dyhu.ru/ закажите изысканные и популярные ароматы, духи от лучших и проверенных парфюмеров, которые создают продукцию для изысканного, привлекательного стиля. Каждый желающий получает возможность приобрести все, что считает нужным, оптом, чтобы разнообразить свой ассортимент и сделать его более интересным и привлекательным для клиентов. Регулярно на сайт добавляются интересные новинки, которые заслуживают вашего внимания. Также устраиваются распродажи, которые позволят сэкономить на покупке хорошие деньги.
https://proauto.kyiv.ua здесь вы найдете обзоры и тест-драйвы автомобилей, свежие новости автопрома, обширный автокаталог с характеристиками и ценами, полезные советы по уходу и ремонту, а также активное сообщество автолюбителей. Присоединяйтесь к нам и оставайтесь в курсе всех событий в мире автомобилей!
Are you looking for reliable and fast proxies? https://fineproxy.org/account/aff.php?aff=29 It offers a wide range of proxy servers with excellent speed and reliability. Perfect for surfing, scraping and more. Start right now with this link: FineProxy.org . Excellent customer service and a variety of tariff plans!
Благодарю за отличную информацию!
В свою очередь предлагаю зарубиться в рулетку!
[url=https://vavada-registraciya3.online/]vavada официальный сайт регистрация[/url] — быстро и просто. Это позволит вам получить доступ к широкому спектру азартных игр.
Зарегистрировавшись вы попадете в свой ЛК и начнете захватывающую игру. Обратите внимание, что для вывода выигранных денег вам необходимо будет подтвердить свою личность, предоставив документы.
Thanks for sharing your thoughts on 肝・胆・膵. Regards
Feel free to surf to my website: https://Www.Waste-Ndc.pro/community/profile/tressa79906983/
На сайте https://smile-me.ru/ вы сможете заказать звонок для того, чтобы получить консультацию относительно проведения детских праздников. Здесь вы сможете заказать детских аниматоров, устроить тематический праздник, воспользоваться услугами ведущих на мероприятие, устроить незабываемый, яркий квест или бумажное шоу. Действуют привлекательные, доступные расценки. Все мероприятия проводятся компетентными, талантливыми специалистами, которые не перестают радовать своим профессионализмом.
k8 カジノ 本人確認 時間
このブログのファンになりました。いつも感謝しています。
Благодарствую за полезную инфу!
В свою очередь предлагаю поиграть в настоящее казино!
[url=https://vavada-registraciya3.online/]вавада онлайн[/url] — быстро и просто. Это допустит вас к к огромному количеству слотов и рулетке.
Создав аккаунт вы войдете в свой логин и начать играть. Не забудьте, что для вывода выигрышей нужно пройти верификацию аккаунта, показав документы, которые у вас запросят.
Мы рекомендуем посетить веб-сайт https://gulliverauto.ru/.
Кроме того, не забудьте добавить сайт в закладки: [url=https://gulliverauto.ru/]https://gulliverauto.ru/[/url]
https://autoblog.kyiv.ua путеводитель в мире автомобилей. Обзоры и тест-драйвы, актуальные новости, автокаталог, советы по уходу и ремонту, а также общение с автолюбителями. Всё, что нужно для выбора и эксплуатации авто, вы найдете у нас.
Сувенирная продукция с логотипом и корпоративный мерч на заказ в Москве
https://diigo.com/0wfu8p
Помощь в получении допуска СРО, сертификата ISO и лицензий от МСМ
https://life24.pro/life/363791625/
Интернет-магазин, предлагающий большой ассортимент раковина 80см для вашего интерьера.
Вам интересен квалифицированный ремонт электро-транспорта в Минске? Мастерская 911 – это то, что вам нужно! В сервисном центре трудятся самые лучшие специалисты, которые имеют достаточный опыт работы. Они великолепно разбираются в электросамокатах, качественно и оперативно их ремонтируют. https://m911.by/ – сайт, где можете в любое удобное время ознакомиться с нашими услугами. Мы обеспечиваем своих клиентов недорогим ремонтом любого вида электро-транспорта. Обращайтесь именно к нам, продиагностируем поломку абсолютно бесплатно.
geinoutime.com
Zhou가 자신보다 훨씬 더 높은 지위를 알고 있는 그는 여전히 억지로 미소를 지었다.
На сайте https://yapolitical.ru вы сможете начать обсуждать различные политические новости, которые касаются не только России, но и ситуации во всем мире. Перейдите на форум, чтобы обсудить все текущие и самые интересные новости. При необходимости вы сможете добавить интересную и любопытную тему либо новость. Здесь вы сможете почитать информацию, которая касается иноагентов. Есть и другие любопытные материалы, которые точно вам понравятся своей достоверностью, актуальностью. Регулярно добавляются новые темы.
top casino’s [url=www.bestegokautomaten.nl/]www.bestegokautomaten.nl/[/url] .
Мы рекомендуем посетить веб-сайт https://doutuapse.ru/.
Кроме того, не забудьте добавить сайт в закладки: [url=https://doutuapse.ru/]https://doutuapse.ru/[/url]
Помощь в получении допуска СРО, сертификата ISO и лицензий от МСМ
https://newsfrol.ru/214/12686/
https://autoclub.kyiv.ua узнайте все о новых моделях, читайте обзоры и тест-драйвы, получайте советы по уходу за авто и ремонтам. Наш автокаталог и активное сообщество автолюбителей помогут вам быть в курсе последних тенденций.
Студия профессионального дизайна интерьеров «Мята» поможет воплотить ваши мечты в реальность! Специалисты наши любят свою работу, они ваш интерьер сделают прекрасным. Мы всегда рады видеть вас у нас. https://spb.studio-mint.ru/ – здесь можете увидеть фото интерьеров квартир. Предлагаем привлекательные цены и создаем проекты высочайшего уровня. Успех нашей работы подтверждают отзывы, ознакомиться с ними можете на нашем сайте. Свяжитесь с нами, чтобы обсудить детали. Все ваши пожелания мы удовлетворим!
Спасибо за отличную информацию!
В свою очередь предлагаю поиграть в настоящее казино!
[url=https://vavada-registraciya3.online/]vavada регистрация[/url] — доступно и быстро. Это позволит вам получить доступ к широкому спектру азартных игр.
Создав аккаунт вы войдете в свой логин и начнете захватывающую игру. Не забудьте, что для вывода выигрышей нужно подтвердить свою личность, предоставив документы.
срочный ремонт телефонов
Мы рекомендуем посетить веб-сайт https://russkiy-spaniel.ru/.
Кроме того, не забудьте добавить сайт в закладки: [url=https://russkiy-spaniel.ru/]https://russkiy-spaniel.ru/[/url]
BetVisa: দক্ষিণ এশিয়ার শীর্ষস্থানীয় অনলাইন গেমিং প্ল্যাটফর্ম
BetVisa একটি পরিচিত এবং বিশ্বস্ত অনলাইন গেমিং প্ল্যাটফর্ম যা 2017 সালে প্রতিষ্ঠিত হয়েছিল। কুরাকাও গেমিং লাইসেন্সের অধীনে পরিচালিত, BetVisa এখন 2 মিলিয়নেরও বেশি ব্যবহারকারীর সাথে দক্ষিণ এশিয়ার অন্যতম বিশ্বস্ত এবং শীর্ষস্থানীয় অনলাইন ক্যাসিনো এবং স্পোর্টসবেটিং প্ল্যাটফর্ম।
BetVisa-এ আপনি বিভিন্ন উত্থেজক গেমিং অপশন পাবেন, যার মধ্যে রয়েছে স্লট গেম, লাইভ ক্যাসিনো, লটারি, স্পোর্টসবুক, স্পোর্টস এক্সচেঞ্জ এবং ই-স্পোর্টস। যেকোন প্রশ্ন বা সমস্যার দ্রুত সমাধান পেতে, প্ল্যাটফর্মটি 24-ঘন্টার বন্ধুত্বপূর্ণ লাইভ গ্রাহক সহায়তা প্রদান করে।
বেটভিসা বাংলাদেশ ব্যবহারকারীদের জন্য বিশেষ অফার এবং সুবিধা রয়েছে। আপনি সহজেই BetVisa বাংলাদেশ লগইন করে আপনার পছন্দের গেমগুলি খেলতে পারেন। এছাড়াও, BetVisa অ্যাফিলিয়েট প্রোগ্রামও রয়েছে, যাতে আপনি পার্টনার হয়ে অতিরিক্ত আয় অর্জন করতে পারেন।
সিড় এবং নিরাপদ অর্থপ্রদানের পদ্ধতির মাধ্যমে, BetVisa আপনার গেমিং অভিজ্ঞতাকে আরও উন্নত করে তোলে। আপনার বিনোদন এবং আর্থিক নিরাপত্তা নিশ্চিত করার জন্য প্ল্যাটফর্মটি সর্বোচ্চ মানের নিরাপত্তা ব্যবস্থা অনুসরণ করে।
BetVisa-এ একাউন্ট খুলে, দক্ষিণ এশিয়ার শীর্ষস্থানীয় অনলাইন গেমিং অভিজ্ঞতাটি উপভোগ করুন। আপনার প্রিয় খেলাগুলি খেলে আনন্দ অর্জন করুন এবং নিরাপদ ভাবে আর্থিক লাভও করুন।
Betvisa Bet | Hit it Big This IPL Season with Betvisa!
Betvisa login! | Every deposit during IPL matches earns a 2% bonus .
Betvisa Bangladesh! | IPL 2024 action heats up, your bets get more rewarding!
Crash Game returns! | huge ₹10 million jackpot. Take the lead on the Betvisa app !
#betvisa
Start Winning Now! | Sign up through Betvisa affiliate login, claim ₹500 free cash.
Grab Your Winning Ticket! | Register login and win ₹8,888 at visa bet!
https://www.betvisa-bet.com/bn
#visabet #betvisalogin #betvisabangladesh#betvisaapp
200% Excitement! | Enjoy slots and fishing games at Betvisa লগইন করুন!
Big Sports Bonuses! | Score up to ₹5,000 in sports bonuses during the IPL season
Gear up for an exhilarating IPL season at Betvisa, propels you towards victory!
Сувенирная продукция с логотипом и корпоративный мерч на заказ в Москве
https://diigo.com/0wftu9
Discovered an article that might interest you Р don’t miss it! https://www.royalsreview.com/users/cchatruletka
Самый большой магазин мобильных телефонов в Минске https://g5.by/ это возможность купить по низкой цене с доставкой по всей Беларуси: мобильные телефоны, ноутбуки, планшеты, бытовую технику и многое другое. Ознакомьтесь с каталогом из более чем 30000 сертифицированных товаров, и вы обязательно найдете для себя лучшую цену, качество, а быстрая бесплатная доставка не заставит себя долго ждать.
SUPERMONEY88: Situs Game Online Deposit Pulsa Terbaik di Indonesia
SUPERMONEY88 adalah situs game online deposit pulsa terbaik tahun 2020 di Indonesia. Kami menyediakan berbagai macam game online terbaik dan terlengkap yang bisa Anda mainkan di situs game online kami. Hanya dengan mendaftar satu ID, Anda bisa memainkan seluruh permainan yang tersedia di SUPERMONEY88.
Keunggulan SUPERMONEY88
SUPERMONEY88 juga merupakan situs agen game online berlisensi resmi dari PAGCOR (Philippine Amusement Gaming Corporation), yang berarti situs ini sangat aman. Kami didukung dengan server hosting yang cepat dan sistem keamanan dengan metode enkripsi termutakhir di dunia untuk menjaga keamanan database Anda. Selain itu, tampilan situs kami yang sangat modern membuat Anda nyaman mengakses situs kami.
Layanan Praktis dan Terpercaya
Selain menjadi game online terbaik, ada alasan mengapa situs SUPERMONEY88 ini sangat spesial. Kami memberikan layanan praktis untuk melakukan deposit yaitu dengan melakukan deposit pulsa XL ataupun Telkomsel dengan potongan terendah dari situs game online lainnya. Ini membuat situs kami menjadi salah satu situs game online pulsa terbesar di Indonesia. Anda bisa melakukan deposit pulsa menggunakan E-commerce resmi seperti OVO, Gopay, Dana, atau melalui minimarket seperti Indomaret dan Alfamart.
Kami juga terkenal sebagai agen game online terpercaya. Kepercayaan Anda adalah prioritas kami, dan itulah yang membuat kami menjadi agen game online terbaik sepanjang masa.
Kemudahan Bermain Game Online
Permainan game online di SUPERMONEY88 memudahkan Anda untuk memainkannya dari mana saja dan kapan saja. Anda tidak perlu repot bepergian lagi, karena SUPERMONEY88 menyediakan beragam jenis game online. Kami juga memiliki jenis game online yang dipandu oleh host cantik, sehingga Anda tidak akan merasa bosan.
Ru play GGPokerOK https://ruplayggokpoker.ru/ предоставляет блистательную шанс удовлетворяться покерной игрой в знаменитейшей интернациональной системе.
Покерок считается https://nori01.com/ инновационной эндорфиновой с функцией проведения досуга в игры.
Заказать Вентилятор радиальный ВЦ 14-46 по оптовым ценам от завода производителя ООО Гевей можно на сайте https://vent-climate.ru/ Так же производим вентиляторы промышленные радиальные В
Сувенирная продукция с логотипом и корпоративный мерч на заказ в Москве
https://canvas.instructure.com/eportfolios/2940531/Home/___________
Помощь в получении допуска СРО, сертификата ISO и лицензий от МСМ
https://nicstroy.ru/4215-gotovaya-firma-s-oborotami-i-dopuskom-sro.html
На сайте https://kladupechi.ru оформите заявку для того, чтобы воспользоваться такими полезными услугами, как: ремонт, кладка печей, каминов. Все конструкции от высококлассного, проверенного мастера, который работает по всему Санкт-Петербургу, области. А если вас интересует какая-либо определенная информация, то воспользуйтесь специальным поиском. Также имеется информация и про печное отопление: русскую, голландскую, финскую печь. Изучите все рубрики, чтобы получить полную информацию на интересующую тему.
Анализ виртуального покера: Обзор онлайн покера https://rusplaypokerking.ru/ Онлайн покерный матч стал популярным занятием везде.
Hi to every body, it’s my first pay a quick visit of this weblog; this website consists of amazing and actually excellent data in support of readers.
Produzione video aziendali
Мы рекомендуем посетить веб-сайт https://vektor-meh.ru/.
Кроме того, не забудьте добавить сайт в закладки: [url=https://vektor-meh.ru/]https://vektor-meh.ru/[/url]
ближайший ремонт телефонов
https://ktm.org.ua/ у нас вы найдете свежие новости, аналитические статьи, эксклюзивные интервью и мнения экспертов. Будьте в курсе событий и тенденций, следите за развитием ситуации в реальном времени. Присоединяйтесь к нашему сообществу читателей!
Доброго времени суток, меня зовут Андрей, и я хочу поделиться свою историю сражения с наркотической привычкой и путём к выздоровлению. Это был продолжительный и трудный процесс, но я верю, что моя событие будет полезна тем, кто сталкивается с подобной трудностью.
Когда я осмыслил, что моя жизнь сломана из-за наркотических веществ, я оказался на самом дне. Я утратил труд, друзей и веру семьи. Первым шагом к излечению стало понимание того, что я не разберусь с этой трудностью в один. Я обозначил обратить внимание за содействием в центр восстановления.
http://images.google.st/url?q=https://robotaforum.2bb.ru/viewtopic.php?id=12098
После детоксикационного процесса была запущена деятельность с психологическим специалистом. Я включился участвовать в личные и совместные терапевтические сеансы лечения. На этих сеансах я осознал много значимого о себе. Мы разговаривали факторы, которые поставили меня к наркотической зависимости, и я начал работать над изменением своих мышления и моделей поведения. Одной из значимых методик для меня стала КПТ. Она позволила мне пересмотреть негативные настройки и перенять справляться со напряжением без наркотических средств.
Я также приступил к поиску работу. Это было непросто, но персонал клиники помогли мне подготовить автобиографию и пройти подготовку к встречам с нанимателями. Вскоре я приобрел занятость и начал чувствовать себя важным и нужным.
Если вы или ваши родные встретились с вопросом наркозависимости, не откладывайте просить участие. Возвращение — это путь к новому пути, и все должен иметь на перспективу на выздоровление.
Помощь в получении допуска СРО, сертификата ISO и лицензий от МСМ
https://muzeon.ru/sport/9304-gde-i-kak-poluchit-licenziyu-minkultury-na-restavraciyu-giop.html
https://mostmedia.com.ua мы источник актуальных новостей, аналитики и мнений. Получайте самую свежую информацию, читайте эксклюзивные интервью и экспертные статьи. Оставайтесь в курсе мировых событий и тенденций вместе с нами. Присоединяйтесь к нашему информационному сообществу!
На сайте https://moredoram.ru вы найдете дорамы, фильмы, сериалы высокого качества. Они понравятся всем любителям такого жанра и помогут расслабиться после трудового дня и просто получить приятные эмоции. Вы сможете воспользоваться функцией случайной дорамы, изучить список лучших из них. Все они в отличном качестве, с безупречным звуком, что позволит насладиться просмотром на любом устройстве, включая смартфон, ПК, планшет. Регулярно появляются многообещающие новинки, с которыми необходимо ознакомиться и вам.
SUPERMONEY88: Situs Game Online Deposit Pulsa Terbaik di Indonesia
SUPERMONEY88 adalah situs game online deposit pulsa terbaik tahun 2020 di Indonesia. Kami menyediakan berbagai macam game online terbaik dan terlengkap yang bisa Anda mainkan di situs game online kami. Hanya dengan mendaftar satu ID, Anda bisa memainkan seluruh permainan yang tersedia di SUPERMONEY88.
Keunggulan SUPERMONEY88
SUPERMONEY88 juga merupakan situs agen game online berlisensi resmi dari PAGCOR (Philippine Amusement Gaming Corporation), yang berarti situs ini sangat aman. Kami didukung dengan server hosting yang cepat dan sistem keamanan dengan metode enkripsi termutakhir di dunia untuk menjaga keamanan database Anda. Selain itu, tampilan situs kami yang sangat modern membuat Anda nyaman mengakses situs kami.
Layanan Praktis dan Terpercaya
Selain menjadi game online terbaik, ada alasan mengapa situs SUPERMONEY88 ini sangat spesial. Kami memberikan layanan praktis untuk melakukan deposit yaitu dengan melakukan deposit pulsa XL ataupun Telkomsel dengan potongan terendah dari situs game online lainnya. Ini membuat situs kami menjadi salah satu situs game online pulsa terbesar di Indonesia. Anda bisa melakukan deposit pulsa menggunakan E-commerce resmi seperti OVO, Gopay, Dana, atau melalui minimarket seperti Indomaret dan Alfamart.
Kami juga terkenal sebagai agen game online terpercaya. Kepercayaan Anda adalah prioritas kami, dan itulah yang membuat kami menjadi agen game online terbaik sepanjang masa.
Kemudahan Bermain Game Online
Permainan game online di SUPERMONEY88 memudahkan Anda untuk memainkannya dari mana saja dan kapan saja. Anda tidak perlu repot bepergian lagi, karena SUPERMONEY88 menyediakan beragam jenis game online. Kami juga memiliki jenis game online yang dipandu oleh host cantik, sehingga Anda tidak akan merasa bosan.
Opened up an enthralling read – I’d like to share it with you https://kyivweekly.com/kyiv-news/na-chto-stoit-obratit-vnimanie-pri-zakaze-taksi-v-kieve/
Мы рекомендуем посетить веб-сайт https://stroydvor89.ru/.
Кроме того, не забудьте добавить сайт в закладки: [url=https://stroydvor89.ru/]https://stroydvor89.ru/[/url]
Утепление балкона с фасадным остеклением specbalkon.ru
Что касается [url=https://specbalkon.ru/zamena-ostekleniya]заменить холодное остекление на теплое[/url] на выгодных условиях, обращайтесь к нам. Контактный номер телефона +7(812)240-94-42 или закажите обратный звонок на указанном сайте. Мы осуществляем монтаж в строго обговоренный срок, обычно в течение 1-3 дней. Даётся гарантия на материалы в среднем 5 лет, на монтаж — 3 года. Оплата осуществляется по факту выполненных работ, предоплата не нужна.
Помощь в получении допуска СРО, сертификата ISO и лицензий от МСМ
http://menzelinsk.ru/links.php?categ=15&links=125606
Розыгрыш в интернет картежная игра из страны становится всё более распространенным хобби для значительного количества игроков.
My blog post; https://rupokerplayok.ru/
sunmory33
sunmory33
На сайте https://advokat-samara.ru/ оставьте заявку для того, чтобы воспользоваться доставкой товаров из Китая для маркетплейсов. Среди основных услуг выделяют: выкуп, поиск, доставку товаров. Кроме того, можно воспользоваться и упаковкой, отгрузкой продукции на маркетплейсы. При необходимости будет оказана вся необходимая помощь для того, чтобы организовать бизнес на WB. Рассчитать цену услуги получится в данный момент. Оказывается весь спектр услуг, чтобы вы наладили собственный бизнес. Воспользуйтесь сопровождением с гарантиями, проводится анализ уже имеющихся карточек.
Зайдите на сайт компании Финтех https://finteh.su/ которая специализируется на проектировании и строительстве каменных, деревянных, комбинированных и других домов под ключ. Подберите на сайте проект под себя или посмотрите готовые, типовые проекты. Привлекательные цены на строительство и акции от Финтех позволят вам построить качественный дом мечты!
Хотите быстро и без каких-либо проблем заменить права на польские? MIGRANT SUPPORT – это то, что вам необходимо. Компания гарантирует разумные цены и индивидуальный подход. Наши квалифицированные специалисты обладают большим опытом работы. Они предложат для вас необходимую информацию о том, как надо заменить на польские права. https://migrant.support/obmien_rossiiskikh_prav_na_polskiie – сайт, где можете заказать услугу. Также здесь в любое удобное время можно ознакомиться с отзывами о нас. Звоните нам уже сейчас, всегда готовы ответить на интересующие вас вопросы.
pro88
PRO88: Situs Game Online Deposit Pulsa Terbaik di Indonesia
PRO88 adalah situs game online deposit pulsa terbaik tahun 2020 di Indonesia. Kami menyediakan berbagai macam game online terbaik dan terlengkap yang bisa Anda mainkan di situs game online kami. Hanya dengan mendaftar satu ID, Anda bisa memainkan seluruh permainan yang tersedia di PRO88.
Keunggulan PRO88
PRO88 juga merupakan situs agen game online berlisensi resmi dari PAGCOR (Philippine Amusement Gaming Corporation), yang berarti situs ini sangat aman. Kami didukung dengan server hosting yang cepat dan sistem keamanan dengan metode enkripsi termutakhir di dunia untuk menjaga keamanan database Anda. Selain itu, tampilan situs kami yang sangat modern membuat Anda nyaman mengakses situs kami.
Berbagai Macam Game Online
Kami menyediakan berbagai macam game online terbaik yang bisa Anda mainkan kapan saja dan di mana saja. Dengan satu ID, Anda bisa menikmati semua permainan yang tersedia, mulai dari permainan kartu, slot, hingga taruhan olahraga. PRO88 memastikan semua game yang kami sediakan adalah yang terbaik dan terlengkap di Indonesia.
Keamanan dan Kenyamanan
Kami memahami betapa pentingnya keamanan dan kenyamanan bagi para pemain. Oleh karena itu, PRO88 menggunakan server hosting yang cepat dan sistem keamanan dengan metode enkripsi termutakhir di dunia. Ini memastikan bahwa data pribadi dan transaksi Anda selalu aman bersama kami. Tampilan situs yang modern juga dirancang untuk memberikan pengalaman bermain yang nyaman dan menyenangkan.
Kesimpulan
PRO88 adalah pilihan terbaik untuk Anda yang mencari situs game online deposit pulsa yang aman dan terpercaya. Dengan berbagai macam game online terbaik dan terlengkap, serta dukungan keamanan yang canggih, PRO88 siap memberikan pengalaman bermain game yang tak terlupakan. Daftar sekarang juga di PRO88 dan nikmati semua permainan yang tersedia hanya dengan satu ID.
Kunjungi kami di PRO88 dan mulailah petualangan game online Anda bersama kami!
Founded in Texas in 2002, https://southeast.newschannelnebraska.com/story/50826769/del-mar-energy-from-humble-beginnings-to-an-energy-market-leader quickly transformed into one of the leading players in the energy market, oil and gas extraction, road construction
На сайте https://zdravbud.net/new/pochemu-bolyat-sustavy изучите увлекательную, интересную и содержательную информацию, которая посвящена тому, почему болят суставы. Так есть информация о том, чем правильно их питать, чтобы сохранили свою эластичность. Описаны признаки того, что суставы заболели. Вы узнаете о том, какими способами и методами их лучше всего и эффективней восстановить. Описаны самые эффективные, точные, а также безопасные из них. А самое главное, что они действительно работают.
Студия профессионального дизайна интерьеров Мята в Москве воплощает мечты в реальность. Всегда рады видеть вас у себя. https://moskva.studio-mint.ru/ – тут трудятся только квалифицированные специалисты, которые готовы принять любой вызов, и увлечены своим делом. Следим за новинками и трендами в индустрии интерьерного дизайна и предоставляем выгодные цены. Создаем проекты высокого уровня. Позвоните нам прямо сейчас и мы обсудим все детали. Любые ваши желания удовлетворим!
Visit https://timespothq.com/ for in-depth reviews, in-depth comparisons, review guides, and expert opinions on the latest productivity software. We’ll help you find the perfect solution for your unique needs. More details on the website.
Азарт игры: {Юридический {статус|положение|документ|регламент} {покера на деньги в России|платного покера в РФ|коммерческих покерных игр.
Also visit my web blog; https://pokerokplay.ru/
k8 ミニゲーム
この記事は非常に有意義で、読むのが楽しみです。
Играть в покерных играх — это захватывающее времяпрепровождение, которое притягивает множество личностей по всем странам.
Feel free to visit my web site https://aiheconglinkb.com/
Откройте все правду относительно GGPokerOK https://https://pokerokonline.ru// является по всему миру известным онлайн карточным румом.
методы продвижения сайта
Советы по SEO продвижению.
Информация о том как взаимодействовать с низкочастотными ключевыми словами и как их выбирать
Подход по работе в конкурентной нише.
Обладаю постоянных клиентов сотрудничаю с 3 организациями, есть что поделиться.
Изучите мой профиль, на 31 мая 2024г
общий объём успешных проектов 2181 только на этом сайте.
Консультация только устно, без скринов и документов.
Длительность консультации указано 2 ч, но по реально всегда на доступен без твердой привязки ко времени.
Как управлять с софтом это уже отдельная история, консультация по работе с программами обсуждаем отдельно в специальном кворке, выясняем что нужно при общении.
Всё спокойно на расслабоне не торопясь
To get started, the seller needs:
Мне нужны контакты от Telegram канала для контакта.
общение только устно, вести переписку нету времени.
Суббота и Вс нерабочие дни
Search by Image on Amazon https://chromewebstore.google.com/detail/search-by-image-on-amazon/fmiialomjacaogdjjkgicepphmekndli uses advanced technology to provide users with a unique functionality. By analyzing images, the extension is able to search for relevant products. To use this feature, users can conveniently right-click on any image in their browser and select the “Search on Amazon” option.
Зайдите на сайт https://cescoshop.ru/ где вы сможете приобрести краски, лаки, грунт, эмаль и многое другое. Cesco представляет огромный выбор продукции по отличным ценам, а получить заказ можно самостоятельно или оформить с доставкой по всей России. Ознакомьтесь с каталогом и вы обязательно найдете все для интерьера и экстерьера. Подробнее на сайте.
https://kursovyemetrologiya.ru
Мы рекомендуем посетить веб-сайт https://magic-magnit.ru/.
Кроме того, не забудьте добавить сайт в закладки: [url=https://magic-magnit.ru/]https://magic-magnit.ru/[/url]
Узнай все о недвижимости на одном сайте! Наши интересные статьи о [url=http://arbolityug.ru]квартирах от застройщика[/url] и о [url=http://arbolityug.ru]квартирах в новостройках[/url] помогут тебе разобраться во всех нюансах этой сложной области.
Не упусти возможность быть в курсе всех новостей и принимать взвешенные решения! Посети наш сайт и стань экспертом в области покупки недвижимости!
GGPokerOK https://https://tekirdagescortilan.com// является известным игровым сайтом для любителей игр на деньги.
https://formomebel.ru/stoliki/na-osnovanii-iz-metalla
Установка крыши на балконы спб specbalkon.ru
Если Вам требуется [url=https://specbalkon.ru/osteklenie-balkonov]остекление лоджий[/url] прямо сегодня, то мы вам непременно окажем помощь. Услуга по смене холодного фасадного остекления по теплое в настоящее время очень востребована. При покупке жилья в новом доме очень часто застройщик ставит на балкон холодное, не очень качественное остекление, которое лучше всего менять сразу же после приобретения. Теплое остекление балкона имеет большое количество плюсов: окна не замерзнут даже в самые холодные зимы, на балконе можно сделать любое пространство, цветы будут расти при комнатной температуре, на балконе можно сделать места для хранения и вещи не испортятся. Поэтому предлагаем Вам замену остекления сделать как можно скорее и по выигрышной цене.
Мы рекомендуем посетить веб-сайт https://kvest4x4.ru/.
Кроме того, не забудьте добавить сайт в закладки: [url=https://kvest4x4.ru/]https://kvest4x4.ru/[/url]
Поменять холодное остекление на теплое спб specbalkon.ru
Относительно [url=https://specbalkon.ru/zamena-ostekleniya]фасадное остекление балкона спб[/url] на выгодных условиях, обращайтесь к нам. Контактный номер телефона +7(812)240-94-42 или закажите обратный звонок на вышеуказанном сайте. Мы осуществляем монтаж в точно установленный срок, обычно в течение 1-3 дней. Даётся гарантия на изделия в среднем 5 лет, на работу — 3 года. Оплата происходит по факту выполненных работ, предоплата не потребуется.
Желаете стать экспертом в сфере недвижимости? Наш портал – это ваш незаменимый помощник! Мы предлагаем огромное количество полезных статей на такие темы, как [url=http://opk-ekb.ru]отделка квартиры[/url], а также [url=http://opk-ekb.ru]покупка жилья[/url]. Наши эксперты поделятся с вами ценной информацией, чтобы помочь вам принимать взвешенные решения в сфере недвижимости!
https://www.childcourse.com.ua/blog/uprazhnenija-dlja-detej-10-12-let-i-podrostkov-devochek
выкуп авто дорого выкуп авто область
Мы рекомендуем посетить веб-сайт https://photo-res.ru/.
Кроме того, не забудьте добавить сайт в закладки: [url=https://photo-res.ru/]https://photo-res.ru/[/url]
Замена панорамного остекления на теплое specbalkon.ru
Если Вам требуется [url=https://specbalkon.ru/zamena-ostekleniya]остекление балконов замена холодного на теплое[/url] прямо сейчас, то мы вам непременно поможем. Услуга по смене холодного фасадного остекления по теплое в данный момент очень востребована. При покупке квартиры в новом доме очень часто застройщик устанавливает на балкон холодное, не очень хорошее остекление, которое лучше поменять сразу же после приобретения. Теплое остекление балкона имеет множество плюсов: окна не замерзают даже в самые холодные зимы, на балконе можно сделать отдельное пространство, цветы будут расти при комнатной температуре, на балконе можно продумать места для хранения и вещи не деформируются. Поэтому предлагаем Вам замену остекления сделать как можно скорее и по выигрышной цене.
Discovered an article that might catch your interest – don’t miss it! https://www.bruinsnation.com/users/cchatruletka
Привет, друзья! Хочу поделиться своими любимыми телеграм-каналами, которые помогают мне каждый день. Для киноманов рекомендую [url=https://t.me/s/kino_film_20221]новинки кино 2024[/url] – всегда знаю, что посмотреть вечером. Для тех, кто хочет заработать в интернете, канал [url=https://t.me/s/zarabotak_sam]заработок в интернете[/url] – просто находка! Если вы, как и я, любите развиваться, подписывайтесь на [url=https://t.me/s/razvisam]саморазвитие с чего начать[/url]. А для финансовых вопросов и выгодных предложений есть каналы [url=https://t.me/s/new_mfo]новые МФО 2024[/url] и [url=https://t.me/s/MFO_dayt_vsem]займы которые дают всем[/url]. Пользуйтесь, не пожалеете!
Балконы под ключ в СПБ specbalkon.ru
Если Вам необходимо [url=https://specbalkon.ru/zamena-ostekleniya]теплое остекление балкона без изменения фасада[/url] прямо сейчас, то мы вам обязательно поможем. Услуга по замене холодного фасадного остекления по теплое в настоящее время очень популярна. При покупке жилья в новом доме очень часто застройщик устанавливает на балкон холодное, не очень качественное остекление, которое лучше менять сразу же после покупки. Теплое остекление лоджии имеет большое количество плюсов: окна не замерзнут даже в самые морозные зимы, на балконе возможно сделать отдельное помещение, цветы будут стоять при комнатной температуре, на балконе можно продумать места для хранения и вещи не деформируются. Поэтому предлагаем Вам замену остекления сделать как можно скорее и по выигрышной цене.
sunmory33
sunmory33
a fantastic read [url=https://web-sollet.io]sollet wallet login[/url]
additional reading [url=https://web-sollet.io]sollet[/url]
интим магазин кукла https://24sexy-dolls.ru
RedStar Poker площадка https://ruplayredstarpoker.ru/ является замечательным местом для любителей различного уровня.
секс игрушки куклы https://24sexy-dolls.ru
купить секс куклу силикон https://24sexy-dolls.ru
https://fraza.kyiv.ua/ вы найдете последние новости, глубокие аналитические материалы, интервью с влиятельными личностями и экспертные мнения. Следите за важными событиями и трендами в реальном времени. Присоединяйтесь к нашему сообществу и будьте информированы!
Stumbled upon a captivating article – definitely take a look! https://graph.org/Individualki-Irkutsk-Najdite-Svoj-Ideal-06-03
[url=https://solarise6muu4darknet.com/]solaris[/url] – solaris даркнет, solaris зеркало
bocor88
bocor88
新鬼武者 再臨(V2.2)
この記事は実用性が高くて、本当に助かります!
https://7krasotok.com здесь вы найдете статьи о моде, красоте, здоровье, отношениях и карьере. Читайте советы экспертов, участвуйте в обсуждениях и вдохновляйтесь новыми идеями. Присоединяйтесь к нашему сообществу женщин, стремящихся к совершенству!
[url=https://mega555nets14.com/]https mega sb[/url] – мега зеркало рабочее, mega555net11 com
https://bestwoman.kyiv.ua узнайте всё о моде, красоте, здоровье и личностном росте. Читайте вдохновляющие истории, экспертные советы и актуальные новости. Присоединяйтесь к нашему сообществу женщин, живущих яркой и насыщенной жизнью!
СХТ – компания, которая предлагает купить измерительное высокоточное оборудование. Мы даем гарантию на выгодные цены и отменное качество нашей продукции. Специалисты компании обладают приличным опытом работы и высокой квалификацией. Они с радостью готовы проконсультировать вас по интересующим вопросам. https://cxt.su – сайт, где можете прямо сейчас ознакомиться с более подробной информацией о нас и наших услугах. Здесь вы найдете видео-презентацию и фотогалерею. Оперативно реагируем на все заявки. Обращайтесь именно к нам!
Интересуетесь недвижимостью? Наш ресурс – ваш надежный гид в этой области. Здесь вы найдете множество полезных статей на такие темы, как [url=http://abraziv-pferd.ru]квартиры от застройщика[/url], а также [url=http://abraziv-pferd.ru]приемка квартир[/url].
Глубокие аналитические материалы, экспертные мнения и важные рекомендации — все это доступно у нас!
https://prowoman.kyiv.ua на нашем сайте вы найдете полезные советы по моде, красоте, здоровью и отношениям. Читайте вдохновляющие статьи, участвуйте в обсуждениях и обменивайтесь идеями. Присоединяйтесь к нашему сообществу современных женщин!
how to buy tiktok live views Buy TikTok Live Views
Помощь в получении допуска СРО, сертификата ISO и лицензий от МСМ
https://www.metronews.ru/partners/novosti-partnerov-134/reviews/konsaltingovaya-kompaniya-management-company-monopoly-1456545/
https://superwoman.kyiv.ua вы на нашем надежном гиде в мире женской красоты и стиля жизни! У нас вы найдете актуальные статьи о моде, красоте, здоровье, а также советы по саморазвитию и карьерному росту. Присоединяйтесь к нам и обретайте новые знания и вдохновение каждый день!
сериалы онлайн бесплатно в хорошем качестве
Банкротство физических лиц – это правовой процесс, который позволяет гражданам, не способным погасить свои долги, получить защиту от кредиторов и начать финансовую жизнь с чистого листа. В России процедура банкротства физических лиц была введена в 2015 году, и с тех пор ею воспользовались десятки тысяч людей.
**Основные этапы процедуры банкротства физических лиц**
1. **Подача заявления о банкротстве**. Должник или его кредитор подает заявление о признании физического лица банкротом в арбитражный суд по месту жительства должника. В заявлении указываются данные о должнике, размере задолженности и других финансовых обязательствах.
2. **Рассмотрение дела в суде**. Суд проверяет обоснованность заявления и принимает решение о начале процедуры банкротства. На этом этапе назначается финансовый управляющий, который будет контролировать процесс.
3. **Финансовое управление**. Финансовый управляющий оценивает финансовое состояние должника, его активы и обязательства. Управляющий может предложить план реструктуризации долгов или продажу имущества должника для погашения задолженности.
4. **Реструктуризация или реализация имущества**. В зависимости от решения суда и финансового управляющего, может быть предложен план реструктуризации долгов, который позволит должнику погашать долги в течение определенного времени. Если такой план невозможен, начинается реализация имущества должника с целью погашения задолженности.
5. **Завершение процедуры банкротства**. По окончании реализации имущества или выполнения плана реструктуризации суд выносит решение о завершении процедуры банкротства. Оставшиеся непогашенные долги списываются, и должник освобождается от обязательств перед кредиторами.
**Плюсы и минусы банкротства физических лиц**
**Плюсы**:
1. **Освобождение от долгов**. Основное преимущество банкротства – возможность избавиться от непосильных долгов и начать новую финансовую жизнь.
2. **Защита от кредиторов**. С момента подачи заявления о банкротстве и до завершения процедуры кредиторы не могут требовать погашения долгов через суд или приставов.
3. **Реструктуризация долгов**. Возможность реструктурировать долги и погашать их по новому, более удобному графику.
**Минусы**:
1. **Потеря имущества**. В большинстве случаев для погашения долгов придется продать имущество, принадлежащее должнику.
2. **Снижение кредитного рейтинга**. Банкротство негативно сказывается на кредитной истории, что может затруднить получение новых кредитов в будущем.
3. **Ограничения**. После банкротства на должника могут быть наложены ограничения, такие как запрет на занятие определенных должностей или ведение бизнеса.
**Альтернативы банкротству физических лиц**
Существуют и альтернативные способы решения проблемы с долгами, которые могут быть менее радикальными и более выгодными для должника:
1. **Переговоры с кредиторами**. Должник может попытаться договориться с кредиторами о реструктуризации долгов, снижении процентной ставки или предоставлении отсрочки по платежам.
2. **Рефинансирование**. Взятие нового кредита на более выгодных условиях для погашения старых долгов может помочь снизить финансовую нагрузку.
3. **Мировое соглашение**. Заключение мирового соглашения с кредиторами в рамках судебного процесса позволяет урегулировать задолженность без процедуры банкротства.
Банкротство физических лиц – серьезный шаг, который требует взвешенного подхода и тщательного анализа всех возможных последствий. Важно помнить, что эта процедура может стать единственным выходом из сложной финансовой ситуации, но перед ее началом стоит рассмотреть все возможные альтернативы и проконсультироваться с юристом или финансовым консультантом.
https://elearnportal.science/wiki/User:MablePrins2
Сувенирная продукция с логотипом и корпоративный мерч на заказ в Москве
https://cartlung3.bloggersdelight.dk/2024/05/31/%d1%81%d1%83%d0%b2%d0%b5%d0%bd%d0%b8%d1%80%d0%bd%d0%b0%d1%8f-%d0%bf%d1%80%d0%be%d0%b4%d1%83%d0%ba%d1%86%d0%b8%d1%8f-%d1%81-%d0%bb%d0%be%d0%b3%d0%be%d1%82%d0%b8%d0%bf%d0%be%d0%bc-%d0%bd%d0%b0-%d0%b7/
buy tiktok views live Buy TikTok Live Views
Откройте дверь в мир недвижимости с нашим порталом! У нас вы найдете интересные статьи на самые актуальные темы: [url=http://ecolife2.ru]аренда жилья[/url], а также [url=http://ecolife2.ru]коммерческая недвижимость[/url]. Станьте экспертом в этой области, благодаря нашим информативным материалам!
Пройти переподготовку логопеда maps-edu.ru
По запросу [url=https://maps-edu.ru/catalog/gosudarstvennoe-i-municipalnoe-upravlenie-iurisprudenciia]курсы юриспруденции[/url] онлайн, мы Вам обязательно окажем помощь. Звоните по контактному телефону 8(800)777-06-74 и задавайте все оставшиеся вопросы. Звонок по России бесплатный. Территориально находимся по адресу: г. Иркутск, ул. Степана Разина, д. 6. На веб портале maps-edu.ru вы также сможете обратиться в службу поддержки и Вас проконсультирует наш специалист.
how to buy views on tiktok live Buy TikTok Live Views
Пройти переподготовку логопеда maps-edu.ru
Насчёт [url=https://maps-edu.ru/catalog/gosudarstvennoe-i-municipalnoe-upravlenie-iurisprudenciia]курсы для юристов дистанционно с сертификатом[/url] – Вы на правильном пути. Направления, по которым мы обучаем: строительство, медицина, педагогика, физическая культура и спорт, юриспруденция и право, социальная работа, культура и искусство, документоведение и делопроизводство, менеджмент, метрология и стандартизация и многие другие.
Помощь в получении допуска СРО, сертификата ISO и лицензий от МСМ
http://www.help-bussines.ru/vstuplenie-v-sro-stroiteley.html
смотреть сериалы онлайн в HD
анекдоты
porn2all.com/models/penny-barber/
поисковое продвижение сайтов [url=https://www.prodvizhenie-sajtov-v-moskve111.ru]https://www.prodvizhenie-sajtov-v-moskve111.ru[/url] .
купить сигареты в интернет-магазине дешево
Хотите быть в курсе всех важных тем в мире недвижимости?
На нашем сайте вы найдете множество полезных статей о [url=http://starextorg.ru]налогах на недвижимость[/url], а также о [url=http://starextorg.ru]анализе рынка недвижимости[/url].
Узнайте все, что вам нужно для успешных сделок и принятия важных решений в сфере недвижимости.
Купить сигареты дешево
решения задач на заказ https://resheniezadachmatematika.ru/
Аккредитация акушерское дело maps-edu.ru
Насчёт [url=https://maps-edu.ru/obuchenie-vrachey]обучение на врача заочно[/url] – Вы на точном пути. Направления, по которым мы обучаем: охрана труда, агрономия и сельское хозяйство, бухгалтерское дело, дефектология, юриспруденция и право, социальная работа, культура и искусство, документоведение и делопроизводство, нефтяная и газовая промышленность, антитеррористическая защищенность и многие другие.
Сувенирная продукция с логотипом и корпоративный мерч на заказ в Москве
https://telegra.ph/Suvenirnaya-produkciya-s-logotipom-na-zakaz-v-Moskve—Vash-klyuch-k-nezabyvaemomu-brendingu-05-31
курсовые на заказ https://kursovyematematika.ru
Hey! This post could not be written any better! Reading through this post reminds me of my previous room mate! He always kept talking about this. I will forward this post to him. Pretty sure he will have a good read. Thank you for sharing!
видеосъемка рекламных видеороликов
Came across an intriguing article – it’s worth your attention, trust me https://betpromocod.mave.digital/ep-1
在線娛樂城的世界
隨著網際網路的迅速發展,在線娛樂城(線上賭場)已經成為許多人消遣的新選擇。網上娛樂城不僅提供多種的遊戲選擇,還能讓玩家在家中就能體驗到賭場的刺激和快感。本文將討論網上娛樂城的特徵、優勢以及一些常有的遊戲。
什麼叫線上娛樂城?
線上娛樂城是一種透過互聯網提供博彩遊戲的平台。玩家可以經由電腦、智能手機或平板電腦進入這些網站,參與各種賭錢活動,如撲克、輪盤、21點和老虎機等。這些平台通常由專家的軟體公司開發,確保遊戲的公正和穩定性。
在線娛樂城的好處
方便性:玩家無需離開家,就能享用賭錢的興奮。這對於那些生活在偏遠實體賭場地區的人來說尤其方便。
多種的游戲選擇:線上娛樂城通常提供比實體賭場更豐富的遊戲選擇,並且經常改進遊戲內容,保持新穎。
好處和獎勵:許多線上娛樂城提供多樣的獎勵計劃,包括註冊紅利、存款獎勵和會員計劃,吸引新玩家並促使老玩家持續遊戲。
穩定性和隱私:正當的線上娛樂城使用先進的加密技術來保護玩家的個人資料和財務交易,確保遊戲過程的公平和公正。
常見的的線上娛樂城遊戲
德州撲克:撲克是最流行賭博遊戲之一。線上娛樂城提供各種撲克變體,如德州撲克、奧馬哈撲克和七張牌等。
賭盤:輪盤賭是一種傳統的賭場遊戲,玩家可以賭注在數字、數字組合或顏色上上,然後看球落在哪個地方。
黑傑克:又稱為21點,這是一種對比玩家和莊家點數的游戲,目標是讓手牌點數盡量接近21點但不超過。
吃角子老虎:老虎機是最容易並且是最流行的賭博游戲之一,玩家只需轉動捲軸,看圖案排列出獲勝的組合。
總結
網上娛樂城為現代的賭博愛好者提供了一個便捷、興奮且多樣化的娛樂活動。不管是撲克迷還是吃角子老虎迷,大家都能在這些平台上找到適合自己的遊戲。同時,隨著技術的的不斷提升,線上娛樂城的遊戲體驗將變化越來越真實和引人入勝。然而,玩家在享用游戲的同時,也應該保持,避免沉迷於博彩活動,保持健康健康的心態。
娛樂城
線上娛樂城的天地
隨著互聯網的迅速發展,在線娛樂城(網上賭場)已經成為許多人休閒的新選擇。網上娛樂城不僅提供多樣化的游戲選擇,還能讓玩家在家中就能體驗到賭場的樂趣和樂趣。本文將討論網上娛樂城的特色、優勢以及一些常有的遊戲。
什麼線上娛樂城?
線上娛樂城是一種經由互聯網提供博彩遊戲的平台。玩家可以透過電腦、智慧型手機或平板設備進入這些網站,參與各種賭博活動,如撲克、輪盤、黑傑克和老虎机等。這些平台通常由專業的程序公司開發,確保遊戲的公正性和穩定性。
網上娛樂城的利益
方便性:玩家無需離開家,就能享用賭博的快感。這對於那些生活在偏遠實體賭場地區的人來說尤為方便。
多種的游戲選擇:線上娛樂城通常提供比實體賭場更多的游戲選擇,並且經常改進遊戲內容,保持新穎。
好處和獎勵計劃:許多在線娛樂城提供豐富的獎勵計劃,包括註冊獎勵、存款紅利和會員計劃,吸引新新玩家並鼓勵老玩家不斷遊戲。
安全和保密性:合法的在線娛樂城使用先進的加密來保護玩家的個人資料和交易,確保遊戲過程的安全和公正。
常見的網上娛樂城遊戲
撲克:撲克牌是最受歡迎賭博遊戲之一。網上娛樂城提供各種撲克變體,如德州撲克、奧馬哈和七張牌撲克等。
輪盤賭:輪盤賭是一種經典的賭博遊戲,玩家可以賭注在單數、數字排列或顏色選擇上,然後看轉球落在哪個區域。
21點:又稱為二十一點,這是一種競爭玩家和莊家點數的遊戲,目標是讓手牌點數儘量接近21點但不超過。
老虎机:老虎機是最簡單也是最受歡迎的博彩遊戲之一,玩家只需旋轉捲軸,等待圖案排列出贏得的組合。
結論
網上娛樂城為現代的賭博愛好者提供了一個方便的、興奮且多元化的娛樂方式。不管是撲克愛好者還是老虎机愛好者,大家都能在這些平台上找到適合自己的遊戲。同時,隨著技術的的不斷發展,網上娛樂城的游戲體驗將變化越來越真實和吸引人。然而,玩家在享用遊戲的同時,也應該自律,避免沉迷於賭博活動,保持健康健康的心態。
https://google.com.pa/url?q=http://elektrofahrrad-tests.de/forums/member.php?action=profile&uid=33566
Сувенирная продукция с логотипом и корпоративный мерч на заказ в Москве
https://canvas.instructure.com/eportfolios/2940559/Home/_____________
Повышение квалификации дистанционно maps-edu.ru
Относительно [url=https://maps-edu.ru/catalog/gosudarstvennoe-i-municipalnoe-upravlenie-iurisprudenciia?type=povyshenie-kvalifikacii]курсы повышения квалификации юриспруденция[/url] – Вы на правильном пути. Направления, по которым мы обучаем: строительство, агрономия и сельское хозяйство, бухгалтерское дело, физическая культура и спорт, пожарная безопасность, закупки, культура и искусство, промышленность, менеджмент, антитеррористическая защищенность и многие другие.
SEO стратегия
Советы по стратегии продвижения сайтов продвижению.
Информация о том как работать с низкочастотными запросами ключевыми словами и как их подбирать
Подход по работе в конкурентоспособной нише.
У меня есть регулярных сотрудничаю с 3 компаниями, есть что поделиться.
Ознакомьтесь мой аккаунт, на 31 мая 2024г
общий объём завершённых задач 2181 только здесь.
Консультация проходит устно, никаких скринов и отчётов.
Время консультации указано 2 ч, но по факту всегда на контакте без жёсткой фиксации времени.
Как управлять с ПО это уже иначе история, консультация по работе с программами обсуждаем отдельно в специальном услуге, выясняем что нужно при разговоре.
Всё без суеты на без напряжения не торопясь
To get started, the seller needs:
Мне нужны контакты от телеграм каналов для коммуникации.
общение только вербально, переписываться нету времени.
субботы и воскресенья выходной
заказать курсовую онлайн https://kursovyebankovskoe.ru/
Сайт https://zhenskiy.kyiv.ua – це онлайн-ресурс, який присвячений жіночим темам та інтересам. Тут зібрана інформація про моду, красу, здоров’я, відносини, кулінарію та багато іншого, що може бути корисним та цікавим для сучасних жінок.
Сувенирная продукция с логотипом и корпоративный мерч на заказ в Москве
https://telegra.ph/Vash-brend-v-kazhdom-zheste—sekrety-suvenirnoj-produkcii-s-logotipom-v-Moskve-05-31
продвижение сайтов частное [url=http://www.prodvizhenie-sajtov-v-moskve111.ru]продвижение сайтов частное[/url] .
빠른 입출금 서비스와 더불어 주요업체의 보안성
토토사이트 접속 시 매우 중요한 요소는 신속한 충환전 처리입니다. 보통 3분 이내에 충전, 열 분 안에 환전이 완수되어야 합니다. 대형 주요업체들은 필요한 스태프 채용을 통해 이 같은 빠른 환충 절차를 보장하며, 이를 통해 고객들에게 안전감을 제공합니다. 대형사이트를 이용하면서 빠른 체감을 해보시기 바랍니다. 저희는 여러분들이 안전하게 웹사이트를 접속할 수 있도록 지원하는 먹튀 해결 팀입니다.
보증금을 걸고 배너를 운영
먹튀 해결 팀은 최대한 3000만 원에서 일억 원의 보증 금액을 예치한 사이트들의 배너 광고를 운영합니다. 만약 먹튀 사고가 생길 경우, 베팅 규정에 반하지 않은 배팅 내역을 캡처하여 먹튀 해결 팀에 문의 주시면, 확인 후 보증금으로 신속하게 피해 보전 처리합니다. 피해가 발생하면 즉시 스크린샷을 찍어 피해 내용을 저장해 두시고 보내주시기 바랍니다.
장기 운영 안전업체 확인
먹튀 해결 팀은 적어도 4년간 먹튀 이력 없이 무사히 운영하고 있는 사이트만을 검증하여 광고 배너 입점을 받고 있습니다. 이 때문에 누구나 잘 알려진 주요사이트를 안전하게 접속할 수 있는 기회를 제공합니다. 엄격한 검사 작업을 통해 확인된 사이트를 놓치지 말고, 안심하고 배팅을 경험해보세요.
투명하고 공정한 먹튀 검증
먹튀 해결 팀의 먹튀 검증은 투명함과 공평성을 바탕으로 실시합니다. 항상 이용자들의 입장을 우선으로 생각하고, 기업의 이익이나 이득에 흔들리지 않으며 하나의 삭제 없이 사실만을 근거로 검증해오고 있습니다. 먹튀 문제를 겪고 후회하지 않도록, 바로 지금 시작해보세요.
먹튀 확인 사이트 리스트
먹튀 해결 전문가가 선별한 안전 토토사이트 인증된 업체 목록 입니다. 현재 등록되어 있는 검증업체들은 먹튀 피해 발생 시 100% 보증을 해드립니다. 그러나, 제휴 기간이 만료된 업체에서 발생한 사고에 대해서는 책임을 지지 않습니다.
독보적인 먹튀 검증 알고리즘
먹튀 해결 팀은 청결한 베팅 문화를 만들기 위해 계속해서 노력합니다. 저희가 소개하는 토토사이트에서 안전하게 배팅하세요. 회원님의 먹튀 신고 내용은 먹튀 목록에 등록되어 해당 베팅 사이트에 치명적인 영향을 끼칩니다. 먹튀 목록 작성 시 먹튀블러드만의 검증 노하우를 충분히 활용하여 공정한 심사를 하도록 하겠습니다.
안전한 도박 환경을 만들기 위해 항상 애쓰는 먹튀 해결 전문가와 같이 안전하게 경험해보세요.
Доставка цветов в Саратове https://flowers64.ru/ это отличная возможность заказать различные цветы, букеты, композиции, подарки, не выходя из дома.
Came across an interesting article, I propose you have a look http://gti-club.ru/forum/member.php?u=23001
Помощь в получении допуска СРО, сертификата ISO и лицензий от МСМ
https://tvoi54.ru/articles/08-08-2019/3804-sro-stroitelei-osobennosti-vstuplenija.html
https://leon-skachat-prilozhenie.ru/
Сувенирная продукция с логотипом и корпоративный мерч на заказ в Москве
https://maphail2.werite.net/vash-brend-v-kazhdom-zheste-sekrety-suvenirnoi-produktsii-s-logotipom-v-moskve
Помощь в получении допуска СРО, сертификата ISO и лицензий от МСМ
http://help-bussines.ru/vstuplenie-v-sro-stroiteley.html
Консультация по SEO продвижению.
Информация о том как взаимодействовать с низкочастотными ключевыми словами и как их подбирать
Стратегия по деятельности в конкурентной нише.
Имею постоянных клиентов работаю с тремя фирмами, есть что рассказать.
Изучите мой аккаунт, на 31 мая 2024г
количество завершённых задач 2181 только здесь.
Консультация проходит устно, без скриншотов и отчётов.
Время консультации указано 2 ч, но по реально всегда на контакте без строгой привязки к графику.
Как управлять с программным обеспечением это уже отдельная история, консультация по работе с программами обсуждаем отдельно в специальном кворке, выясняем что необходимо при общении.
Всё спокойно на без напряжения не торопясь
To get started, the seller needs:
Мне нужны сведения от Telegram чата для коммуникации.
разговор только устно, общаться письменно недостаточно времени.
Суббота и Воскресенье нерабочие дни
Сувенирная продукция с логотипом и корпоративный мерч на заказ в Москве
https://blowsecond86.werite.net/suvenirnaia-produktsiia-s-logotipom-na-zakaz-v-moskve-sozdaite-brend-kotoryi
скачать бк leon
заказать курсовую работу https://kupit-kursovuyu-rabotu.ru/ с гарантией и антиплагиатом
ремонт телефонов в москве
Добро пожаловать на наш портал о недвижимости!
Здесь вы найдете интересные статьи и новости о рынке недвижимости, правовых аспектах продажи жилья, аренде коммерческих помещений, инвестициях в недвижимость и многом другом.
Мы рады поделиться с вами полезной информацией и помочь вам принимать осознанные решения в сфере [url=http://afmtel.ru]покупки недвижимости[/url].
http://maps.google.com.ng/url?q=http://fitboss.ru/user/nbPam/
Contrive of the wealthiest amateurtits.org/blog/the-rise-of-porn-video-platforms-why-were-all-hooked/ ever notwithstanding the good at no cost!
[url=https://jpn.itlibra.com/board?board_id=4690]porn2best.com- Most desirable Free Porn Videos, Having it away Movies & XXX Albums[/url][url=https://chaiacuc.com/BlueAD/board.php?bbs_id=gc_gallery&mode=view&bbs_no=193&page=&key=&keyword=]porn2best.com- Best Free-born Porn Videos, Sex Movies & XXX Albums[/url] 515b35f
ремонт мобильных телефонов в москве
Добро пожаловать на наш сайт о покупке и продаже жилья!
Ознакомьтесь с такими темами, как [url=http://stroymarkett.ru]продажа недвижимости[/url] и [url=http://stroymarkett.ru]аренда квартир[/url].
Больше интересной информации о строительстве и ремонте можно прочитать на сайте https://stroyka-gid.ru. Только самые популярные статьи и обзоры процесса ремонта помещений и строительства зданий.
**Прогон Хрумером: Эффективное SEO-Продвижение Вашего Сайта**
В мире интернет-маркетинга существует множество методов и инструментов для продвижения сайтов, и одним из самых мощных и популярных является прогон Хрумером. Этот программный комплекс позволяет автоматизировать рутинные задачи SEO и значительно улучшить позиции сайта в поисковых системах. В этой статье мы подробно рассмотрим, что такое прогон Хрумером, как он работает и какие преимущества он может предложить.
**Что такое прогон Хрумером?**
Прогон Хрумером – это процесс автоматического размещения ссылок и сообщений на различных веб-ресурсах с использованием программы Хрумер. Это позволяет существенно увеличить количество обратных ссылок на ваш сайт, что является одним из ключевых факторов для улучшения его позиций в поисковых системах. Программа автоматически регистрируется на форумах, блогах, социальных сетях и других платформах, размещая ссылки и сообщения согласно заданным параметрам.
**Как работает прогон Хрумером?**
1. **Подготовка ресурсов**: В первую очередь необходимо составить список целевых веб-ресурсов, на которых будет производиться размещение ссылок. Это могут быть форумы, блоги, социальные сети и другие платформы.
2. **Создание шаблонов**: Далее создаются шаблоны для размещения ссылок и сообщений. Важно, чтобы тексты были уникальными и соответствовали правилам выбранных платформ.
3. **Настройка программы**: В Хрумере настраиваются параметры подключения, капча-сервисы и прокси-серверы для обеспечения стабильной работы программы.
4. **Запуск прогона**: После настройки всех параметров запускается процесс прогона, который программа выполняет автоматически. Хрумер регистрируется на сайтах, размещает ссылки и сообщения, а также разгадывает капчи.
5. **Мониторинг и анализ**: Важно регулярно отслеживать результаты прогона, анализируя отчеты о размещении ссылок и реакции аудитории. Это позволяет корректировать стратегию продвижения и улучшать её эффективность.
**Преимущества прогона Хрумером**
1. **Экономия времени**: Прогон Хрумером позволяет автоматизировать процесс размещения ссылок, что значительно экономит время по сравнению с ручным методом.
2. **Увеличение числа обратных ссылок**: Автоматическое размещение ссылок на множестве ресурсов способствует росту числа обратных ссылок, что положительно сказывается на позиции сайта в поисковых системах.
3. **Повышение видимости сайта**: Прогон Хрумером помогает улучшить видимость вашего сайта в интернете, привлекая новую аудиторию и увеличивая трафик.
4. **Гибкость и универсальность**: Хрумер поддерживает работу с множеством различных платформ и позволяет настраивать параметры прогона в соответствии с вашими потребностями.
**Заключение**
Прогон Хрумером – это эффективный метод автоматизации SEO-продвижения, который позволяет значительно улучшить позиции вашего сайта в поисковых системах. Используя этот мощный инструмент, вы сможете сэкономить время и усилия, сосредоточившись на стратегически важных задачах. Прогон Хрумером – это надежный способ увеличить число обратных ссылок, повысить видимость вашего сайта и привлечь больше посетителей.
Feel free to visit my site: https://speedgh.com/index.php?page=user&action=pub_profile&id=980987
Генераторы
https://telegra.ph/Gotovnost-k-Lyubym-Situaciyam—Pokupka-Dizelnogo-Generatora-dlya-Doma-06-03
[url=https://gurava.ru/geocities/40/%D0%95%D0%BC%D0%B5%D0%BB%D1%8C%D1%8F%D0%BD%D0%BE%D0%B2%D0%BE]жилье вторичное Емельяново на Gurava.ru[/url]
[url=https://piterskie-zametki.ru/223657]«Оскар» советский фильм получил статуэтку – читать[/url]
Устали от отказов в кредитах? Наш канал [url=https://t.me/s/zaim_srochno_bez_otkaza_na_kartu]срочные займы[/url] предлагает лучшие решения для получения займа на карту без отказа. Все заявки одобряются мгновенно. Подпишитесь и получите деньги уже сегодня!
[url=https://gamer-torrent.ru/download/pc/shooter/the_day_before/10-1-0-1894]THE DAY BEFORE сюжет[/url] – THE DAY BEFORE игра скачать торрент, строительные материалы волгодонск
Генераторы
https://canvas.instructure.com/eportfolios/2945392/Home/________
Корпоративные Тарифы
https://gnezdoparanoika.ru/news/44150-vygodnye-tarify-mts-s-internetom.html
Came across an interesting article, worth a glance http://behealthy.maxbb.ru/posting.php?mode=post&f=8
срочный ремонт сотовых телефонов
Откройте двери в мир недвижимости с нашим порталом!
Получайте экспертные статьи от специалистов в сфере недвижимости. Узнавайте о налогах на недвижимость, осуществляйте успешные сделки купли-продажи квартир, и всегда оставайтесь в курсе последних новостей рынка.
http://ufficioporta.ru
first reseller panel https://promospanel.com
купить матрас 100 на 100 [url=http://kupit-matras111.ru]http://kupit-matras111.ru[/url] .
Корпоративные Тарифы
https://aprovedstore.ru/kakie-tarify-na-bilajne-samye-vygodnye-s-internetom/
Генераторы
https://canvas.instructure.com/eportfolios/2945331/Home/__________
cheapest smm panel https://promospanel.com
paypal smm panel smm provider
Генераторы
https://ariesgemini3.werite.net/moshchnost-i-nadezhnost-dizel-nye-generatory-na-elektrostantsiiakh
paito warna hk
Inspirasi dari Kutipan Taylor Swift
Taylor Swift, seorang musisi dan pengarang lagu populer, tidak hanya terkenal karena melodi yang menawan dan suara yang merdu, tetapi juga karena syair-syair lagunya yang bermakna. Dalam lirik-liriknya, Swift sering menyajikan bermacam-macam aspek hidup, mulai dari cinta hingga tantangan hidup. Berikut ini adalah beberapa ucapan inspiratif dari lagu-lagunya, dengan artinya.
“Mungkin yang terhebat belum hadir.” – “All Too Well”
Arti: Meskipun dalam masa-masa sulit, tetap ada secercah harapan dan peluang untuk hari yang lebih baik.
Lirik ini dari lagu “All Too Well” mengingatkan kita jika walaupun kita mungkin berhadapan dengan masa-masa sulit sekarang, senantiasa ada potensi bahwa masa depan akan membawa sesuatu yang lebih baik. Ini adalah pesan harapan yang mengukuhkan, memotivasi kita untuk tetap bertahan dan tidak mengalah, sebab yang paling baik mungkin belum datang.
“Aku akan tetap bertahan karena aku tak bisa melakukan segala sesuatu tanpa kamu.” – “You Belong with Me”
Arti: Menemukan cinta dan support dari orang lain dapat menghadirkan kita daya dan tekad untuk terus berjuang melalui kesulitan.
**Прогон Хрумером: Эффективное SEO-Продвижение Вашего Сайта**
В мире интернет-маркетинга существует множество методов и инструментов для продвижения сайтов, и одним из самых мощных и популярных является прогон Хрумером. Этот программный комплекс позволяет автоматизировать рутинные задачи SEO и значительно улучшить позиции сайта в поисковых системах. В этой статье мы подробно рассмотрим, что такое прогон Хрумером, как он работает и какие преимущества он может предложить.
**Что такое прогон Хрумером?**
Прогон Хрумером – это процесс автоматического размещения ссылок и сообщений на различных веб-ресурсах с использованием программы Хрумер. Это позволяет существенно увеличить количество обратных ссылок на ваш сайт, что является одним из ключевых факторов для улучшения его позиций в поисковых системах. Программа автоматически регистрируется на форумах, блогах, социальных сетях и других платформах, размещая ссылки и сообщения согласно заданным параметрам.
**Как работает прогон Хрумером?**
1. **Подготовка ресурсов**: В первую очередь необходимо составить список целевых веб-ресурсов, на которых будет производиться размещение ссылок. Это могут быть форумы, блоги, социальные сети и другие платформы.
2. **Создание шаблонов**: Далее создаются шаблоны для размещения ссылок и сообщений. Важно, чтобы тексты были уникальными и соответствовали правилам выбранных платформ.
3. **Настройка программы**: В Хрумере настраиваются параметры подключения, капча-сервисы и прокси-серверы для обеспечения стабильной работы программы.
4. **Запуск прогона**: После настройки всех параметров запускается процесс прогона, который программа выполняет автоматически. Хрумер регистрируется на сайтах, размещает ссылки и сообщения, а также разгадывает капчи.
5. **Мониторинг и анализ**: Важно регулярно отслеживать результаты прогона, анализируя отчеты о размещении ссылок и реакции аудитории. Это позволяет корректировать стратегию продвижения и улучшать её эффективность.
**Преимущества прогона Хрумером**
1. **Экономия времени**: Прогон Хрумером позволяет автоматизировать процесс размещения ссылок, что значительно экономит время по сравнению с ручным методом.
2. **Увеличение числа обратных ссылок**: Автоматическое размещение ссылок на множестве ресурсов способствует росту числа обратных ссылок, что положительно сказывается на позиции сайта в поисковых системах.
3. **Повышение видимости сайта**: Прогон Хрумером помогает улучшить видимость вашего сайта в интернете, привлекая новую аудиторию и увеличивая трафик.
4. **Гибкость и универсальность**: Хрумер поддерживает работу с множеством различных платформ и позволяет настраивать параметры прогона в соответствии с вашими потребностями.
**Заключение**
Прогон Хрумером – это эффективный метод автоматизации SEO-продвижения, который позволяет значительно улучшить позиции вашего сайта в поисковых системах. Используя этот мощный инструмент, вы сможете сэкономить время и усилия, сосредоточившись на стратегически важных задачах. Прогон Хрумером – это надежный способ увеличить число обратных ссылок, повысить видимость вашего сайта и привлечь больше посетителей.
my web site :: https://atyzi.com/progon/
dunia777
Ashley JKT48: Idola yang Bersinar Terang di Langit Idol
Siapakah Ashley JKT48?
Siapa tokoh belia berbakat yang menarik perhatian banyak penggemar musik di Indonesia dan Asia Tenggara? Dialah Ashley Courtney Shintia, atau yang lebih dikenal dengan nama panggungnya, Ashley JKT48. Bergabung dengan grup idola JKT48 pada tahun 2018, Ashley dengan cepat menjadi salah satu anggota paling terkenal.
Profil
Lahir di Jakarta pada tgl 13 Maret 2000, Ashley berdarah darah Tionghoa-Indonesia. Beliau memulai perjalanannya di industri hiburan sebagai model dan aktris, hingga akhirnya kemudian masuk dengan JKT48. Sifatnya yang gembira, vokal yang bertenaga, dan kemampuan menari yang mengagumkan menjadikannya idola yang sangat dicintai.
Penghargaan dan Pengakuan
Kepopuleran Ashley telah diakui melalui banyak award dan nominasi. Pada tahun 2021, ia memenangkan pengakuan “Member Terpopuler JKT48” di ajang JKT48 Music Awards. Beliau juga dinobatkan sebagai “Idol Tercantik di Asia” oleh sebuah media online pada tahun 2020.
Peran dalam JKT48
Ashley mengisi peran penting dalam kelompok JKT48. Dia adalah anggota Tim KIII dan berfungsi sebagai dancer utama dan penyanyi utama. Ashley juga terlibat sebagai bagian dari sub-unit “J3K” dengan Jessica Veranda dan Jennifer Rachel Natasya.
Perjalanan Solo
Di luar kegiatannya dengan JKT48, Ashley juga mengembangkan perjalanan mandiri. Beliau telah merilis beberapa single, diantaranya “Myself” (2021) dan “Falling Down” (2022). Ashley juga telah bekerja sama dengan penyanyi lain, seperti Afgan dan Rossa.
Hidup Pribadi
Di luar dunia pertunjukan, Ashley dikenali sebagai pribadi yang humble dan ramah. Ashley menikmati melewatkan waktu dengan keluarga dan teman-temannya. Ashley juga memiliki hobi mewarnai dan photography.
hip hop music marketing companies https://banger-music.com
buy dailymotion views buy Audiomack likes
https://images.google.cat/url?q=https://towardsmachinelearning.org/user/nberymn/?um_action=edit
Проверка адреса USDT
Контроль токенов на сети TRC20 и прочих цифровых платежей
На данном сайте вы сможете подробные оценки разнообразных ресурсов для проверки платежей и кошельков, в том числе антиотмывочные верификации для монет и иных виртуальных валют. Вот важные опции, представленные в наших оценках:
Контроль токенов на платформе TRC20
Многие платформы предоставляют комплексную анализ транзакций криптовалюты в блокчейн-сети TRC20 платформы. Это позволяет фиксировать подозрительную операции и соблюдать нормативным требованиям.
Верификация платежей монет
В представленных оценках представлены сервисы для глубокого мониторинга и наблюдения операций криптовалюты, что способствует поддерживать ясность и надежность транзакций.
anti-money laundering анализ монет
Известные сервисы предоставляют AML проверку USDT, гарантируя идентифицировать и исключать примеры неправомерных действий и финансовых мошенничеств.
Верификация адреса криптовалюты
Наши ревью представляют платформы, позволяющие позволяют анализировать адреса токенов на выявление ограничений и подозреваемых платежей, обеспечивая повышенный уровень надежности.
Анализ операций токенов на блокчейне TRC20
Вы найдете доступны инструменты, поддерживающие проверку переводов токенов на платформе TRC20, что обеспечивает обеспечивает соблюдение всем требованиям положениям.
Контроль счета аккаунта криптовалюты
В ревью указаны платформы для верификации кошельков аккаунтов монет на наличие угроз угроз.
Верификация адреса монет на платформе TRC20
Наши оценки охватывают платформы, поддерживающие анализ кошельков USDT на платформе TRC20, что предотвращает позволяет предотвращение незаконных операций и денежных нарушений.
Верификация монет на чистоту
Описанные инструменты позволяют проверять платежи и счета на чистоту, фиксируя необычную операции.
антиотмывочная проверка криптовалюты на сети TRC20
В оценках описаны платформы, поддерживающие AML проверку для USDT на блокчейне TRC20, что позволяет вашему компании выполнять международным правилам.
Верификация USDT на сети ERC20
Наши ревью включают платформы, предлагающие верификацию монет на блокчейне ERC20 блокчейна, что гарантирует проведение полный анализ переводов и адресов.
Верификация цифрового кошелька
Мы обозреваем сервисы, поддерживающие опции по контролю криптокошельков, включая мониторинг операций и фиксирование сомнительной действий.
Верификация аккаунта виртуального кошелька
Наши оценки содержат ресурсы, предназначенные для проверять счета криптовалютных кошельков для поддержания дополнительного уровня безопасности.
Верификация виртуального кошелька на переводы
Вы найдете найдете платформы для проверки виртуальных кошельков на транзакции, что помогает помогает поддерживать открытость транзакций.
Анализ виртуального кошелька на легитимность
Наши обзоры содержат сервисы, позволяющие верифицировать цифровые кошельки на прозрачность, фиксируя возможные сомнительные операции.
Ознакомившись с представленные оценки, вы сможете сможете надежные сервисы для верификации и мониторинга блокчейн переводов, чтобы обеспечивать поддерживать надежный уровень надежности и выполнять всем законодательным стандартам.
Генераторы
https://zonelight98.bloggersdelight.dk/2024/06/03/%d0%b3%d0%b5%d0%bd%d0%b5%d1%80%d0%b0%d1%82%d0%be%d1%80-%d0%b4%d0%bb%d1%8f-%d1%87%d0%b0%d1%81%d1%82%d0%bd%d0%be%d0%b3%d0%be-%d0%b4%d0%be%d0%bc%d0%b0-%d0%ba%d0%b0%d0%ba%d0%be%d0%b9-%d0%b2%d1%8b%d0%b1/
free soundcloud streams twitter promotion service
spotify music promotion free music promotion
how to get more votes for online contest https://promobanger.com/
**Прогон Хрумером: Эффективное SEO-Продвижение Вашего Сайта**
В мире интернет-маркетинга существует множество методов и инструментов для продвижения сайтов, и одним из самых мощных и популярных является прогон Хрумером. Этот программный комплекс позволяет автоматизировать рутинные задачи SEO и значительно улучшить позиции сайта в поисковых системах. В этой статье мы подробно рассмотрим, что такое прогон Хрумером, как он работает и какие преимущества он может предложить.
**Что такое прогон Хрумером?**
Прогон Хрумером – это процесс автоматического размещения ссылок и сообщений на различных веб-ресурсах с использованием программы Хрумер. Это позволяет существенно увеличить количество обратных ссылок на ваш сайт, что является одним из ключевых факторов для улучшения его позиций в поисковых системах. Программа автоматически регистрируется на форумах, блогах, социальных сетях и других платформах, размещая ссылки и сообщения согласно заданным параметрам.
**Как работает прогон Хрумером?**
1. **Подготовка ресурсов**: В первую очередь необходимо составить список целевых веб-ресурсов, на которых будет производиться размещение ссылок. Это могут быть форумы, блоги, социальные сети и другие платформы.
2. **Создание шаблонов**: Далее создаются шаблоны для размещения ссылок и сообщений. Важно, чтобы тексты были уникальными и соответствовали правилам выбранных платформ.
3. **Настройка программы**: В Хрумере настраиваются параметры подключения, капча-сервисы и прокси-серверы для обеспечения стабильной работы программы.
4. **Запуск прогона**: После настройки всех параметров запускается процесс прогона, который программа выполняет автоматически. Хрумер регистрируется на сайтах, размещает ссылки и сообщения, а также разгадывает капчи.
5. **Мониторинг и анализ**: Важно регулярно отслеживать результаты прогона, анализируя отчеты о размещении ссылок и реакции аудитории. Это позволяет корректировать стратегию продвижения и улучшать её эффективность.
**Преимущества прогона Хрумером**
1. **Экономия времени**: Прогон Хрумером позволяет автоматизировать процесс размещения ссылок, что значительно экономит время по сравнению с ручным методом.
2. **Увеличение числа обратных ссылок**: Автоматическое размещение ссылок на множестве ресурсов способствует росту числа обратных ссылок, что положительно сказывается на позиции сайта в поисковых системах.
3. **Повышение видимости сайта**: Прогон Хрумером помогает улучшить видимость вашего сайта в интернете, привлекая новую аудиторию и увеличивая трафик.
4. **Гибкость и универсальность**: Хрумер поддерживает работу с множеством различных платформ и позволяет настраивать параметры прогона в соответствии с вашими потребностями.
**Заключение**
Прогон Хрумером – это эффективный метод автоматизации SEO-продвижения, который позволяет значительно улучшить позиции вашего сайта в поисковых системах. Используя этот мощный инструмент, вы сможете сэкономить время и усилия, сосредоточившись на стратегически важных задачах. Прогон Хрумером – это надежный способ увеличить число обратных ссылок, повысить видимость вашего сайта и привлечь больше посетителей.
My site http://www.springmall.net/bbs/board.php?bo_table=03_01&wr_id=247230
rap marketing agency hip hop music marketing companies
[url=https://gurava.ru/geocities/40/%D0%9C%D0%B8%D0%BD%D1%83%D1%81%D0%B8%D0%BD%D1%81%D0%BA?property_type=1&purpose_type=1]купить однокомнатную квартиру Минусинск недвижимость вторичное Гурава.ru[/url]
Корпоративные Тарифы
https://hairstyle-beauty.ru/arxivnye-tarify-mts-mozhno-li-ix-podklyuchit/.html
Found captivating reading that I’d like to offer you – you won’t regret it https://mediamemorial.ru/club/user/125807/forum/message/3494/12976/#message12976
https://www.instagram.com/asiapsiholog_family/
[url=https://piterskie-zametki.ru/223763]Увеличение зарплаты главврачам премии за платные услуги – интересное[/url]
Генераторы
https://telegra.ph/Obespechte-Bezopasnost-i-Prodolzhitelnost-Raboty—Kozhuhi-dlya-Dizelnyh-Generatorov-06-03
[url=https://diplom.ua/orders/add]дипломна робота з агрономії[/url] – купити курсову роботу рівне, Доповідь на замовлення
There’s nothing better than winding down after work with some adult entertainment. I found Mult34 – [url=https://mult34.com/gwens-alien-encounter/]alien porn[/url] , a site that offers a vast collection of erotic comics and cartoons for free. It’s become my favorite place to relax and enjoy quality content.
Mult34 – [url=https://mult34.com/category/pokemon/]pokemon porn[/url] diverse range ensures you’ll never get bored. The site has something for every preference, and the best part is that it’s all free. If you need a way to relax after a long day, check out Mult34 – [url=https://mult34.com/hypnotized-helen/]hypno porn[/url] .
Генераторы
https://telegra.ph/Kupit-benzinovyj-generator—kak-vybrat-luchshij-variant-dlya-vashego-doma-ili-dachi-06-03
Корпоративные Тарифы
https://tj-service.ru/novosti/samye-vygodnye-tarify-megafon-s-internetom
internet casinos
Digital Casinos: Innovation and Benefits for Modern Society
Overview
Internet casinos are virtual platforms that offer users the chance to engage in betting activities such as card games, spin games, blackjack, and slot machines. Over the past few years, they have turned into an essential component of digital leisure, offering numerous advantages and opportunities for users around the world.
Accessibility and Convenience
One of the main advantages of digital gambling sites is their availability. Users can play their favorite activities from any location in the world using a PC, iPad, or smartphone. This conserves hours and funds that would typically be spent going to traditional gambling halls. Furthermore, 24/7 access to games makes internet gambling sites a convenient choice for people with hectic lifestyles.
Range of Activities and Entertainment
Online gambling sites provide a vast variety of games, enabling all users to find an option they enjoy. From traditional table games and board activities to slots with diverse themes and progressive jackpots, the range of activities guarantees there is something for every preference. The ability to play at different skill levels also makes online gambling sites an perfect location for both beginners and experienced players.
Economic Benefits
The online casino industry contributes significantly to the economy by creating employment and producing revenue. It backs a diverse variety of careers, including software developers, client assistance representatives, and advertising professionals. The revenue produced by online gambling sites also contributes to tax revenues, which can be used to support public services and infrastructure projects.
Technological Innovation
Online casinos are at the forefront of technological advancement, continuously adopting new innovations to enhance the gaming experience. Superior visuals, real-time dealer games, and VR casinos offer engaging and authentic gaming experiences. These innovations not only improve user experience but also push the boundaries of what is possible in digital entertainment.
Safe Betting and Support
Many digital casinos promote responsible gambling by providing tools and resources to assist users control their betting habits. Options such as deposit limits, self-exclusion options, and access to assistance programs ensure that users can engage in betting in a secure and monitored setting. These measures show the industry’s commitment to encouraging safe betting practices.
Social Interaction and Networking
Online gambling sites often offer interactive options that enable users to interact with each other, creating a feeling of belonging. Multiplayer games, chat functions, and social media links enable users to connect, share experiences, and build relationships. This interactive element improves the entire gaming entertainment and can be especially beneficial for those seeking social interaction.
Conclusion
Digital gambling sites offer a wide range of benefits, from accessibility and convenience to economic contributions and technological advancements. They offer varied gaming options, encourage safe betting, and promote community engagement. As the sector continues to evolve, digital gambling sites will likely remain a major and positive force in the realm of online entertainment.
Gratis Slot Games: Amusement and Rewards for All
Gratis slot games have become a widespread form of digital leisure, delivering players the excitement of slot machines absent any economic expenditure.
The chief aim of complimentary slot games is to provide a entertaining and absorbing way for individuals to relish the thrill of slot machines devoid of any economic risk. They are crafted to simulate the impression of real-money slots, giving players to rotate the reels, experience various themes, and obtain online prizes.
Entertainment: Free slot games are an outstanding option of leisure, delivering periods of excitement. They showcase animated illustrations, engaging music, and diverse concepts that serve a wide selection of tastes.
Capability Enhancement: For inexperienced, no-cost slot games present a risk-free environment to familiarize the mechanics of slot machines. Players can get accustomed with different functionality, winning combinations, and extras free from the concern of losing funds.
Unwinding: Playing no-cost slot games can be a excellent way to unwind. The simple gameplay and the potential for virtual payouts make it an pleasurable pursuit.
Social Interaction: Many free slot games include social elements such as competitions and the ability to connect with peers. These elements bring a group-based facet to the interactive experience, encouraging players to pit themselves against each other.
Rewards of Complimentary Slot Games
1. Availability and Ease
Free slot games are effortlessly approachable to everyone with an internet connection. They can be accessed on different platforms including desktops, pads, and cellphones. This convenience permits players to relish their preferred offerings anytime and anywhere.
2. Fiscal Unconcern
One of the paramount rewards of no-cost slot games is that they eliminate the monetary dangers related to betting. Players can relish the excitement of spinning the reels and hitting significant wins absent spending any capital.
3. Variety of Games
Free slot games are presented in a extensive assortment of motifs and designs, from classic fruit-based slots to contemporary slot machines with video with complex storylines and imagery. This diversity provides that there is an alternative for everyone, regardless of their inclinations.
4. Strengthening Intellectual Faculties
Playing free slot games can tend to improve thinking abilities such as strategic thinking. The requirement to consider win lines, comprehend operational principles, and estimate outcomes can offer a mental exercise that is equally pleasurable and advantageous.
5. Risk-Free Trial Phase for Paid-Participation
For those contemplating shifting to for-profit slots, gratis slot games grant a helpful trial environment. Players can explore various games, build methods, and acquire assurance ahead of electing to risk actual capital. This readiness can translate to a more educated and satisfying actual-currency gaming interaction.
Recap
Gratis slot games deliver a multitude of benefits, from unadulterated amusement to skill development and interpersonal connections. They offer a safe and cost-free way to enjoy the suspense of slot machines, rendering them a worthwhile enhancement to the domain of digital recreation. Whether you’re wanting to unwind, hone your mental capabilities, or simply experience pleasure, no-cost slot games are a wonderful possibility that constantly entertain players around.
No-Cost Slot Machines: Pleasure and Benefits for Users
Summary
Slot-based activities have historically been a staple of the wagering sensation, delivering participants the possibility to achieve substantial winnings with simply the trigger of a arm or the press of a interface. In the past few years, slot-related offerings have likewise transformed into in-demand in digital casinos, constituting them accessible to an even broader population.
Entertainment Value
Slot-based activities are designed to be fun and captivating. They present lively visuals, thrilling auditory elements, and wide-ranging ideas that match a extensive array of interests. Whether participants relish classic fruit-related symbols, thrill-based slot-based games, or slots based on well-known movies, there is an option for everyone. This variety ensures that players can always identify a activity that matches their inclinations, providing spans of entertainment.
Easy to Play
One of the biggest positives of slot machines is their straightforwardness. Unlike certain gambling activities that require skill, slot-related offerings are simple to comprehend. This renders them accessible to a comprehensive population, encompassing beginners who may perceive discouraged by further intricate games. The straightforward character of slot-based games allows participants to unwind and savor the activity absent being concerned about complicated guidelines.
Unwinding and Destressing
Interacting with slot-based activities can be a excellent way to decompress. The repetitive quality of rotating the wheels can be calming, delivering a cerebral escape from the stresses of everyday existence. The possibility for receiving, even when it amounts to merely modest quantities, adds an aspect of excitement that can elevate customers’ mindsets. Many individuals determine that engaging with slot machines enables them relax and divert their attention from their problems.
Shared Experiences
Slot-based activities as well provide opportunities for collaborative interaction. In physical casinos, participants commonly gather around slot machines, cheering co-participants on and commemorating successes collectively. Virtual slots have as well featured social functions, such as rankings, enabling players to engage with peers and discuss their interactions. This sense of community improves the comprehensive interactive sensation and can be uniquely satisfying for people aiming for group-based participation.
Financial Advantages
The broad acceptance of slot-based activities has noteworthy economic advantages. The domain produces jobs for game engineers, wagering workforce, and client support agents. Also, the proceeds obtained by slot-based activities provides to the economy, granting tax incomes that finance public initiatives and facilities. This monetary effect extends to simultaneously traditional and digital wagering facilities, establishing slot machines a worthwhile aspect of the gaming domain.
Mental Upsides
Engaging with slot machines can also have cognitive advantages. The experience requires players to render rapid determinations, detect sequences, and control their wagering approaches. These intellectual processes can facilitate maintain the thought processes alert and strengthen cognitive capabilities. In the case of older adults, engaging in mentally stimulating experiences like partaking in slot-related offerings can be beneficial for preserving intellectual functioning.
Accessibility and Convenience
The emergence of internet-based wagering environments has established slot machines further available than in the past. Players can enjoy their favorite slot-related offerings from the simplicity of their private homes, leveraging desktops, handheld devices, or handheld devices. This convenience enables individuals to engage with regardless of when and irrespective of location they choose, absent the requirement to make trips to a physical casino. The presence of no-cost slot-related offerings likewise permits customers to experience the experience absent any cash investment, rendering it an accessible style of leisure.
Key Takeaways
Slot-based activities grant a multitude of upsides to individuals, from absolute entertainment to intellectual upsides and collaborative participation. They offer a secure and non-monetary way to experience the thrill of slot-based activities, rendering them a valuable extension to the world of electronic amusement.
Whether you’re wanting to unwind, sharpen your cognitive faculties, or merely experience pleasure, slot machines are a wonderful choice that constantly entertain customers throughout.
Main Conclusions:
– Slot-related offerings provide entertainment through colorful visuals, engaging soundtracks, and multifaceted themes
– Uncomplicated interaction establishes slot-based activities approachable to a broad group
– Playing slot-based activities can deliver relaxation and cerebral benefits
– Communal features improve the overall interactive experience
– Online approachability and gratis choices render slot-based activities inclusive styles of amusement
In recap, slot-based games steadfastly offer a wide-ranging assortment of rewards that match users throughout. Whether aspiring to absolute amusement, intellectual challenge, or group-based connection, slot-related offerings continue to be a wonderful option in the dynamic world of virtual entertainment.
Online Wagering Environment For-Profit: Benefits for Users
Summary
Virtual gambling platforms delivering for-profit activities have secured substantial widespread appeal, granting players with the prospect to win financial rewards while relishing their cherished gaming offerings from home. This text examines the rewards of virtual wagering environment paid activities, emphasizing their beneficial effect on the leisure sector.
Ease of Access and Reachability
Online casino actual currency experiences offer convenience by allowing participants to utilize a broad selection of experiences from any place with an network link. This eliminates the need to journey to a brick-and-mortar gambling establishment, protecting time. Virtual wagering environments are likewise accessible continuously, allowing customers to interact with at their ease.
Diversity of Options
Online casinos offer a more extensive variety of activities than brick-and-mortar gaming venues, featuring slots, vingt-et-un, wheel of fortune, and table games. This range gives customers to experiment with new activities and find new most cherished, bolstering their overall gaming encounter.
Perks and Advantages
Digital gaming sites present generous incentives and special offers to entice and retain customers. These bonuses can involve introductory bonuses, free spins, and reimbursement promotions, granting extra worth for participants. Reward systems in addition compensate users for their steady patronage.
Skill Development
Engaging with real money experiences in the digital realm can assist participants hone faculties such as decision-making. Offerings like vingt-et-un and poker call for participants to make choices that can shape the end of the activity, helping them hone analytical abilities.
Communal Engagement
ChatGPT l Валли, [06.06.2024 4:08]
Virtual wagering environments provide opportunities for communal connection through discussion forums, interactive platforms, and video-streamed experiences. Customers can interact with fellow users, exchange recommendations and tactics, and even create interpersonal bonds.
Financial Advantages
The online casino sector generates positions and provides for the fiscal landscape through fiscal revenues and operational costs. This monetary effect advantages a wide variety of vocations, from activity developers to client aid professionals.
Summary
Internet-based gambling platform paid activities present many advantages for players, involving ease, diversity, rewards, skill development, social interaction, and monetary upsides. As the industry persistently evolve, the popularity of digital gaming sites is anticipated to rise.
Wealth Gambling Platform: At a Location Where Enjoyment Converges With Prosperity
Fortune Casino is a widely-known digital destination characterized for its comprehensive range of games and thrilling rewards. Let’s analyze the motivations behind so many individuals enjoy playing at Fortune Casino and in what way it benefits them.
Pleasure-Providing Aspect
Prosperity Gambling Platform presents a breadth of games, involving classic card games like 21 and wheel of fortune, as in addition to innovative slot-based activities. This variety guarantees that there is an alternative for everyone, making every single experience to Luck Gambling Platform satisfying and fun.
Significant Rewards
One of the key features of Prosperity Gaming Site is the possibility to secure major payouts. With significant top rewards and incentives, users have the prospect to produce an unexpected outcome with a one-time spin or hand. A significant number of participants have walked away with major payouts, contributing to the anticipation of engaging with Fortune Gambling Platform.
Simplicity and Approachability
Fortune Wagering Environment’s virtual interface renders it convenient for participants to experience their most liked experiences from any setting. Regardless of whether at dwelling or on the go, participants can utilize Fortune Wagering Environment from their desktop or smartphone. This approachability guarantees that users can savor the suspense of the gambling anytime they choose, without the necessity to journey.
Variety of Games
Fortune Gaming Site provides a comprehensive array of offerings, guaranteeing that there is something for each form of participant. From established card games to conceptual slot machines, the diversity retains users immersed and delighted. This array likewise enables customers to try out different experiences and find unfamiliar most liked.
Bonuses and Rewards
Luck Gaming Site acknowledges its players with promotional benefits and rewards, including introductory bonuses and membership schemes. These bonuses not only bolster the gaming encounter but as well augment the prospects of earning significant rewards. Customers are persistently driven to keep playing, rendering Fortune Wagering Environment even more attractive.
Group-Based Participation and Collaboration
ChatGPT l Валли, [06.06.2024 4:30]
Fortune Casino delivers a feeling of togetherness and social interaction for participants. Using discussion forums and forums, users can connect with one another, communicate advice and strategies, and even form social relationships. This communal element injects another aspect of satisfaction to the interactive interaction.
Key Takeaways
Fortune Wagering Environment grants a wide range of rewards for users, incorporating entertainment, the likelihood of earning significant rewards, simplicity, diversity, bonuses, and communal engagement. Regardless of whether seeking anticipation or hoping to strike it rich, Luck Gaming Site delivers an exhilarating experience for everyone interact with.
Complimentary Virtual Wagering Activities: A Entertaining and Beneficial Interaction
Complimentary poker machine games have transformed into steadily widely-accepted among players seeking a enthralling and risk-free interactive encounter. These activities present a wide array of benefits, making them a favored possibility for several. Let’s analyze in which manner complimentary slot-based games can reward players and the factors that explain why they are so comprehensively relished.
Entertainment Value
One of the primary drivers users enjoy engaging with no-cost virtual wagering games is for the entertainment value they deliver. These activities are crafted to be immersive and thrilling, with animated imagery and engrossing sound effects that enhance the comprehensive interactive encounter. Regardless of whether you’re a casual customer aiming to while away the hours or a avid leisure activity enthusiast desiring anticipation, gratis electronic gaming activities present pleasure for everyone who.
Skill Development
Playing no-cost virtual wagering activities can as well help acquire helpful faculties such as decision-making. These games necessitate customers to reach immediate determinations contingent on the gameplay elements they are acquired, facilitating them improve their decision-making aptitudes and cognitive dexterity. Furthermore, users can try out diverse methods, refining their abilities devoid of the possibility of financial impact of losing real money.
Simplicity and Approachability
Another reward of complimentary slot-based games is their user-friendliness and accessibility. These experiences can be partaken in online from the comfort of your own dwelling, removing the obligation to commute to a brick-and-mortar casino. They are as well accessible at all times, giving players to enjoy them at any time that aligns with them. This convenience constitutes gratis electronic gaming experiences a widely-accepted choice for customers with hectic schedules or those aiming for a rapid gaming fix.
Social Interaction
Several free poker machine experiences in addition offer collaborative aspects that give customers to communicate with each other. This can incorporate messaging platforms, interactive platforms, and competitive modes where users can go up against fellow users. These communal engagements inject an additional dimension of fulfillment to the gaming interaction, allowing participants to engage with others who display their interests.
Anxiety Reduction and Mental Unwinding
Engaging with complimentary slot-based activities can in addition be a excellent means to decompress and unwind after a tiring day. The uncomplicated gameplay and soothing music can facilitate reduce worry and unease, providing a refreshing respite from the pressures of typical life. Additionally, the thrill of receiving online coins can enhance your mood and leave you feeling revitalized.
Recap
Free poker machine experiences grant a extensive range of benefits for participants, including pleasure, skill development, ease, social interaction, and tension alleviation and decompression. Regardless of whether you’re wanting to sharpen your leisure faculties or solely have fun, gratis electronic gaming experiences provide a advantageous and pleasurable interaction for players of any stages.
https://vulkan-na-dengy.com/
online poker
Online Table Games: A Source of Amusement and Skill Development
Virtual card games has materialized as a popular style of amusement and a avenue for competency enhancement for players across the globe. This write-up investigates the favorable facets of digital table games and how it upsides users, emphasizing its pervasive recognition and impact.
Entertainment Value
Virtual casino-style games presents a enthralling and engaging interactive encounter, captivating players with its analytical gameplay and unpredictable outcomes. The offering’s absorbing nature, together with its communal aspects, grants a unique kind of fun that a significant number of view as satisfying.
Skill Development
Aside from entertainment, digital table games in addition operates as a avenue for proficiency improvement. The game calls for problem-solving, decision-making under pressure, and the skill to comprehend competitors, every one of which add to mental growth. Users can bolster their critical-thinking abilities, self-awareness, and risk management aptitudes through regular interactivity.
Convenience and Accessibility
One of the primary advantages of virtual casino-style games is its user-friendliness and approachability. Players can relish the offering from the comfort of their residences, at any period that fits them. This reachability eliminates the need for commute to a traditional gambling establishment, establishing it as a easy-to-access alternative for individuals with hectic agendas.
Diversity of Options and Bet Sizes
Digital table games platforms offer a comprehensive range of games and bet sizes to serve users of any types of abilities and tastes. Whether you’re a novice seeking to understand the essentials or a seasoned pro seeking a trial, there is a offering for you. This breadth secures that users can persistently locate a offering that fits their expertise and bankroll.
Social Interaction
Online poker as well delivers prospects for communal engagement. Several infrastructures offer communication tools and group-based modes that give participants to engage with fellow individuals, exchange sensations, and form social relationships. This social factor contributes substance to the interactive encounter, establishing it as even more pleasurable.
Monetary Gains
For some, digital table games can also be a origin of earnings opportunities. Proficient players can earn substantial profits through regular gameplay, establishing it as a money-making pursuit for those who excel at the offering. Additionally, numerous virtual casino-style games events grant considerable payouts, providing users with the chance to win big.
Conclusion
Digital table games offers a selection of upsides for participants, involving pleasure, skill development, convenience, interpersonal connections, and monetary gains. Its widespread acceptance constantly rise, with numerous people shifting to online poker as a origin of pleasure and development. Whether you’re seeking to enhance your aptitudes or solely enjoy yourself, virtual casino-style games is a adaptable and profitable leisure activity for participants of any backgrounds.
빠른 충환전 서비스와 더불어 주요업체의 보안성
베팅사이트 접속 시 가장 중요한 요소 중 하나는 빠른 입출금 프로세스입니다. 일반적으로 3분 내에 입금, 십 분 안에 출금이 완료되어야 합니다. 메이저 메이저업체들은 넉넉한 인력 채용을 통해 이 같은 신속한 입출금 처리를 보증하며, 이 방법으로 사용자들에게 안전한 느낌을 드립니다. 대형사이트를 이용하면서 신속한 경험을 해보시기 바랍니다. 우리 여러분이 안전하게 토토사이트를 사용할 수 있도록 도와드리는 먹튀 해결 팀입니다.
보증금을 내고 배너 운영
먹튀 해결 전문가는 최소 삼천만 원에서 억대의 보증 자금을 예탁한 회사들의 배너 광고를 운영합니다. 만약 먹튀 문제가 발생할 경우, 배팅 규정에 어긋나지 않은 배팅 내역을 캡처하여 먹튀 해결 팀에 문의하시면, 사실 확인 후 보증 자금으로 신속하게 피해 보전 처리해드립니다. 피해가 생기면 빠르게 캡처해서 손해 내용을 저장해 두시고 제출해 주세요.
장기 운영 안전업체 확인
먹튀 해결 전문가는 최대한 4년 이상 먹튀 문제 없이 안정적으로 운영된 사이트들을 인증하여 배너 입점을 허용합니다. 이 때문에 어느 누구나 알만한 주요사이트를 안심하고 사용할 수 있는 기회를 제공하고 있습니다. 정확한 검증 절차를 통해 검증된 사이트를 놓치지 않도록, 안심하고 배팅을 경험해보세요.
투명하고 공정한 먹튀 검토
먹튀 해결 전문가의 먹튀 검토는 투명함과 정확함을 기반으로 실시합니다. 늘 이용자들의 입장을 우선시하며, 기업의 회유나 이익에 좌우되지 않고 1건의 삭제 없이 사실만을 바탕으로 검토해왔습니다. 먹튀 피해를 겪고 후회하지 않도록, 지금 시작하세요.
먹튀 검증 사이트 목록
먹튀 해결 팀이 선별한 안전 토토사이트 검증업체 목록 입니다. 지금 등록된 검증업체들은 먹튀 문제가 발생 시 100% 보장을 해드립니다. 그러나, 제휴가 끝난 업체에서 발생한 사고에 대해서는 책임을 지지 않습니다.
독보적인 먹튀 검증 알고리즘
먹튀 해결 전문가는 공정한 도박 문화를 만들기 위해 항상 노력합니다. 저희가 추천하는 스포츠토토사이트에서 안전하게 베팅하세요. 고객님의 먹튀 제보는 먹튀 리스트에 등록 노출되어 해당되는 스포츠토토 사이트에 치명적인 영향을 줄 수 있습니다. 먹튀 리스트를 작성할 때 먹튀블러드 만의 검토 경험을 최대로 사용하여 정확한 검증을 할 수 있게 하겠습니다.
안전한 도박 환경을 제공하기 위해 끊임없이 힘쓰는 먹튀해결사와 동반하여 안전하게 즐겨보세요.
Генераторы
https://diigo.com/0wglbz
https://kristall-klining.ru/
такси межгород https://taxi-novocherkassk.ru
курсовые работы на заказ https://zakazat-kursovuyu-rabotu7.ru
In this electric game, players vie in multiplayer shooting matches on various battlegrounds. The open-handed of bullet force is to outgun opponents and affix superiority using strategic belief and quick reflexes. With its voluminous weapon settling on and customizable gameplay, this scheme delivers an far-out shooting sense
вавада зеркало
служба такси заказать такси недорого
Завод «СХТ» предоставляет наилучшее весоизмерительное оборудование. Мы имеем свою метрологическую лабораторию, а также сервисную службу. Проводим поверку более 2000 единиц автомобильных весов в год! https://xn--q1aci.xn--p1ai/ – сайт, где вы можете узнать о том, каким нынешний весоизмерительный комплекс должен быть. Здесь имеются отзывы благодарных клиентов и фотогалерея. Вы можете сделать заказ у нас на электронные, переносные, коллейные автомобильные весы. Мы оперативно реагируем на заявки и даем консультации по необходимым вопросам, обращайтесь.
Заходите на информационный портал о недвижимости!
Здесь вы найдете полезные советы о [url=http://sc-pskov.ru]продаже недвижимости[/url], а также о [url=http://sc-pskov.ru]налогах на недвижимость[/url].
Мы расскажем вам о тонкостях покупки квартиры в новостройке и поделимся другими секретами.
уборка офисных помещений цена за 1 м2
https://primexdon.ru/
https://cleanprofispb.ru/
Генераторы
https://rewarddebtor7.bloggersdelight.dk/2024/06/03/%d0%b2%d0%b0%d1%88-%d0%b3%d0%b5%d0%bd%d0%b5%d1%80%d0%b0%d1%82%d0%be%d1%80-%d0%b2-%d0%b1%d0%b5%d0%b7%d0%be%d0%bf%d0%b0%d1%81%d0%bd%d0%be%d1%81%d1%82%d0%b8-%d0%ba%d0%be%d0%bd%d1%82%d0%b5%d0%b9%d0%bd/
номер телефона заказа такси корпоративное такси
такси эконом https://taxi-vyzvat.ru
https://primexdon.ru/
рассчитать стоимость такси https://zakaz-taxionline.ru
https://cleanprofispb.ru/
Хотите быть в курсе всех актуальных тем в мире недвижимости?
На нашем сайте вы сможете найти множество полезных статей о квартирах от застройщика, налогах на недвижимость, а также о анализе рынка недвижимости.
http://zoltor24sochi.ru
рассчитать такси телефон такси в новочеркасске
такси в аэропорт заказать такси приложение
Ищете эффективную программу похудения? Присоединяйтесь к [url=https://t.me/s/pohudet_10_dney]Экспресс-похудение: реально сбросить 10 кг за 10 дней[/url] ! В нашем Telegram-канале мы предлагаем лучшие диеты, тренировки и мотивационные советы. Поддержка единомышленников и помощь профессионалов помогут вам достичь цели быстро и легко!
заказать такси эконом заказать машину такси
Генераторы
https://answerlook94.werite.net/kupit-benzinovyi-generator-kak-vybrat-luchshii-variant-dlia-vashego-doma-ili
https://www.datingwise.com/review/flirt.com/
Flirt.com is for adults looking for fun, flirty encounters rather than serious dating. The site is aimed at the younger crowd, though there are older members there and some seeking longer term relationships. It offers free membership for women, while men can join for free but must pay for additional services such as email.
Flirt has been recently revamped and is designed for people looking for casual dating. Most people there are in their twenties and early thirties, though there is no upper age limit. It’s owned by the Cupid Dating network and caters mostly to members in the UK, the U.S. and Australia, though membership is open to anyone.
Flirt is “spicier” than your regular dating site – don’t expect to find your next significant other there.
Naughty mode
This site is designed to have a light, fun feel to it. It is not intended to be an “adult” site, though there is some mature content. Most adult content can be blocked by switching-off “naughty mode” (the initial setting).
This will hide any images that are explicit. Flirt is a worth a look if you are single and looking to meet new people and have a little fun. Those looking for more serious relationships would probably be better off looking elsewhere.
Features
Flirt.com is feature rich, offering email, message boards, chat rooms, member diaries, videos as well as basic flirts and emails. Flirt has a dedicated mobile site for those wanting access their matches on the go. They also sponsor speed dating and other live events for those who want to meet someone in person.
Membership
Women have access to all features of for free. Men can join for free, but will need a paid membership in order to use some features of the site. Despite being free for women there is still a very high proportion of male users.
Flirt ist ok. A few fake profiles (like everywhere), a few cam girls (like everywhere) and a few scammers (like everywhere) but generally the site seems to be real. Personally prefer because i’ve actually hooked up twice using it, but just wanted to try somethin’ new so decided to give Flirt a chance.
Avatar
topiJuly 11th, 2017
Useless
Not worth it. I had no luck on this site after six months.
Avatar
freedFebruary 8th, 2017
Just average
how do i join?
Avatar
ChrisOilSeptember 12th, 2016
Recommended
Though it’s a casual site, I met my love here. So everything’s in your hands. Try, you won’t lose anything.
Avatar
Paul87July 18th, 2016
Above average
Good site for flirting and one night stands! Unfortunately one day this won’t be enough for you and flirt cannot offer you something serious.
Avatar
Craig8686904June 21st, 2016
Recommended
I’m really glad that a friend of mine gave me the advice to register on Flirt to make my life more spicy. I wasn’t really going to have anything more than just a naughty chat but it turned out that there’s a nice lady in mt city who’s willing to date with me. I’m freaking happy now
Avatar
Chris53June 13th, 2016
Recommended
Though it’s a casual site, I met my love here. So everything’s in your hands. Try, you won’t lose anything.
Avatar
RobertGreen84June 8th, 2016
Above averag
Cute looking site like many others however only here I’ve had 5 dates within 3 weeks after the start. Also I should note that flirt sometimes really hard to use and it’s taking some time to feel yourself comfortable during usage of it and actually it’s not because of gliches or something simply the pictures of buttons are obvious so sometimes you can find yourself on the page you haven’t wanted to open. However I should admit that in the end it worth all the troubles in the start.
Avatar
JohnMApril 13th, 201
Avoid
This site is bull****, it’s a total scam, the profiles of women are not even real they are all fake, when you create a profile and it becomes active they suck you in by sending you lots of messages and winks from so called women which are not even real and don’t actually exist and because you can’t read the messages as an unpaid member to be able to read the messages you have to subscribe and pay for a membership then once you do that and you respond to the messages you don’t get a reply back.
It’s a con, warning to other people out there do not join this site.
Avatar
Michael_4302January 15th, 201
Useless
This site claims that singles are in your area, but in truth that they live elsewhere. I had received a lot of mail from people that the site claimed were in my area, but they actually lived far away. Beware of scammers as well, I have found quite a bit of them on this whose profiles seemed to be processed quickly since their information is available. However, those members who may actually be real usually have the contents of their profile information pending. I’ve seen a lot of scam activity on this site and very little actual people.
One evening, my girlfriend and I decided to find some adult comics to enjoy together. A quick Google search led us to Mult34 – [url=https://mult34.com/overwatch-bdsmmaker/]overwatch porn[/url] , and we were hooked. The site offers an incredible collection of erotic comics that kept us entertained for hours.
We loved the diverse range of stories and the high-quality content available on Mult34 – [url=https://mult34.com/when-a-reindeer-knocks/]furry sex comic[/url] . It’s the perfect site for adult entertainment, and we highly recommend it. Our evening was filled with fun and excitement, thanks to Mult34 – [url=https://mult34.com/]cartoon porn[/url] .
https://images.google.com.sa/url?q=http://ipxa.ru/user/nbBob/
русское порно анал [url=https://russkiy-anal-x.ru/]https://russkiy-anal-x.ru/[/url] .
Discovered a unique article – recommended to acquaint yourself! https://www.cincyjungle.com/users/worksale555
курсовые работы на заказ https://zakazat-kontrolnuyu7.ru
Мы рекомендуем посетить веб-сайт
https://ninjateknik.com/konstnaren-vandaliserar-snapchat-och-jeff-koons-ar-skulptur/
Кроме того, не забудьте добавить сайт в закладки:
[url=http://ec2-52-50-191-115.eu-west-1.compute.amazonaws.com/news/sebastian-errazuriz-vandalises-jeff-koons-snapchat-ar-balloon-dog-art-051017]http://ec2-52-50-191-115.eu-west-1.compute.amazonaws.com/news/sebastian-errazuriz-vandalises-jeff-koons-snapchat-ar-balloon-dog-art-051017[/url]
Узнай все о недвижимости на одном сайте! Наши интересные статьи о [url=http://arbolityug.ru]квартирах от застройщика[/url] и о [url=http://arbolityug.ru]агентствах недвижимости[/url] помогут тебе разобраться во всех нюансах этой сложной сферы.
Не упусти возможность быть в курсе всех новостей и принимать взвешенные решения! Посети наш сайт и стань экспертом в области покупки недвижимости!
решение задач на заказ https://resheniye-zadach7.ru заказать онлайн
Желаете стать профи в сфере недвижимости? Наш ресурс – это ваш незаменимый помощник! Мы предлагаем огромное количество интересных статей на такие темы, как [url=http://opk-ekb.ru]оценка недвижимости[/url], а также [url=http://opk-ekb.ru]покупка жилья[/url]. Наши эксперты поделятся с вами полезными советами, чтобы помочь вам принимать взвешенные решения в сфере недвижимости!
Генераторы
https://burnbengal6.bloggersdelight.dk/2024/06/03/%d0%b3%d0%be%d1%82%d0%be%d0%b2%d0%bd%d0%be%d1%81%d1%82%d1%8c-%d0%ba-%d0%bb%d1%8e%d0%b1%d1%8b%d0%bc-%d1%81%d0%b8%d1%82%d1%83%d0%b0%d1%86%d0%b8%d1%8f%d0%bc-%d0%bf%d0%be%d0%ba%d1%83%d0%bf%d0%ba%d0%b0/
One of my friends on Twitter suggested I visit Mult34 – [url=https://mult34.com/category/my-hero-academia/]manga porn[/url] when I was looking for something new and exciting. I didn’t expect to find such a huge selection of erotic comics and cartoons. The quality is top-notch!
After my first visit, I knew this was exactly what I needed. Mult34 – [url=https://mult34.com/]rule 34.xxx[/url] became my favorite resource for adult content. I recommend this site to anyone who appreciates high-quality erotic works.
рефераты на заказ https://kupit-referat213.ru
Хотите быть в курсе всех актуальных тем в сфере недвижимости?
На нашем сайте вы найдете множество полезных статей о [url=http://starextorg.ru]покупке и продаже жилья[/url], а также о [url=http://starextorg.ru]регистрации квартиры[/url].
Узнайте все, что вам необходимо для успешных сделок и принятия важных решений в сфере недвижимости.
Ищете кредит с плохой кредитной историей? Подписывайтесь на [url=https://t.me/s/credit_online_vsem]Кредиты на карту онлайн[/url]! У нас более 15 предложений с разными условиями. Каждый найдет для себя лучший кредит и 100% получит его на карту онлайн. Подписывайтесь и убедитесь сами в нашей надежности!
порно видео русское анал [url=https://russkiy-anal-x.ru/]https://russkiy-anal-x.ru/[/url] .
alexistoto
Download Aplikasi 888 dan Dapatkan Hadiah: Instruksi Singkat
**Perangkat Lunak 888 adalah alternatif sempurna untuk Para Pengguna yang mencari pengalaman berjudi daring yang seru dan bermanfaat. Melalui hadiah sehari-hari dan opsi menarik, perangkat lunak ini sedia menawarkan keseruan bertaruhan optimal. Ini panduan praktis untuk menggunakan pelayanan Program 888.
Unduh dan Mulai Dapatkan
Sistem Terdapat:
App 888 bisa di-download di Perangkat Android, HP iOS, dan PC. Mulai main dengan praktis di gadget apapun.
Hadiah Harian dan Imbalan
Keuntungan Login Setiap Hari:
Buka tiap hari untuk mengambil keuntungan mencapai 100K pada masa ketujuh.
Kerjakan Pekerjaan:
Raih peluang undian dengan mengerjakan aktivitas terkait. Masing-masing aktivitas memberi Anda satu peluang undi untuk memenangkan imbalan sampai 888K.
Pengambilan Langsung:
Hadiah harus diklaim sendiri di dalam app. Pastikan untuk mengambil bonus tiap hari agar tidak habis masa berlakunya.
Mekanisme Undian
Kesempatan Undi:
Masing-masing periode, Anda bisa mengklaim satu kesempatan undian dengan menyelesaikan aktivitas.
Jika opsi undian selesai, rampungkan lebih banyak misi untuk mengambil lebih banyak kesempatan.
Batas Imbalan:
Raih keuntungan jika jumlah undi Pengguna melampaui 100K dalam sehari.
Aturan Esensial
Penerimaan Bonus:
Imbalan harus diambil mandiri dari aplikasi. Jika tidak, keuntungan akan otomatis diklaim ke akun pengguna Anda setelah 1 waktu.
Syarat Pertaruhan:
Keuntungan butuh paling tidak 1 pertaruhan valid untuk diklaim.
Akhir
Perangkat Lunak 888 memberikan permainan bermain yang menggembirakan dengan bonus signifikan. Unduh app saat ini dan nikmati kemenangan besar-besaran saban waktu!
Untuk info lebih terperinci tentang promosi, top up, dan program rujukan, kunjungi laman home aplikasi.
Recently, I saw a discussion in a Facebook group about an interesting site with adult comics. I decided to check it out and landed on Mult34 – [url=https://mult34.com/]porn comic[/url] . I was amazed by the variety of content and the quality of the materials.
I’ve revisited this site several times and always find something new. Mult34 – [url=https://mult34.com/category/five-nights-at-freddys/]fnaf porn[/url] is definitely worth a visit if you love erotic comics and cartoons. I highly recommend it to all my friends and acquaintances.
https://bicrypto.exchange – crypto exchange software. White label, open-source exchange solution with a focus on a super-fast, pixel-perfect interface and robust security. High-performance platform with a robust internal architecture. Leverages the capabilities of Nuxt3 to create a cutting-edge user interface.
кратом экстракт купить https://travelservic.ru
Почему стоит построить дом из бруса 9х12 | Как выбрать идеальный проект для дома из бруса 9х12 | Выбор кровельных материалов для дома из бруса 9х12 | Выбор системы отопления для дома из бруса 9х12 | Выбор фундамента для дома из бруса 9х12 | Выбор фундамента для дома из бруса 9х12 | Сад и огород вокруг дома из бруса 9х12 | Новинки в строительстве домов из бруса 9х12 | Что нужно знать перед строительством дома из бруса 9х12 | Сколько стоит построить дом из бруса 9х12
дом брус 9х12 [url=https://domizbrusa-9x12spb.ru/]https://domizbrusa-9x12spb.ru/[/url] .
https://www.nytimes.com/2017/10/10/arts/design/augmented-reality-jeff-koons.html
растение аяуаска купить https://travelservic.ru
Came across an interesting article, worth a glance https://uznay-prezidenta.ru/business/6809-elitnyy-eskort-stoit-li-on-vnimaniya-muzhchin.html
аяуваска купить https://travelservic.ru
Мы рекомендуем посетить веб-сайт
http://ec2-52-50-191-115.eu-west-1.compute.amazonaws.com/news/sebastian-errazuriz-vandalises-jeff-koons-snapchat-ar-balloon-dog-art-051017
Кроме того, не забудьте добавить сайт в закладки:
[url=http://52.50.191.115/news/sebastian-errazuriz-vandalises-jeff-koons-snapchat-ar-balloon-dog-art-051017]http://52.50.191.115/news/sebastian-errazuriz-vandalises-jeff-koons-snapchat-ar-balloon-dog-art-051017[/url]
https://mashable.com/article/artist-vandalizes-snapchat-ar-jeff-coons-collab
Генераторы
https://canvas.instructure.com/eportfolios/2945364/Home/________
lucky jet на деньги [url=1win-luckyjet-ru.ru]1win-luckyjet-ru.ru[/url] .
Thanks for sharing pg-slot
purislot
Motivasi dari Kutipan Taylor Swift
Taylor Swift, seorang vokalis dan songwriter terkemuka, tidak hanya diakui berkat nada yang menawan dan nyanyian yang merdu, tetapi juga oleh karena syair-syair lagunya yang penuh makna. Dalam kata-katanya, Swift sering melukiskan beraneka ragam aspek kehidupan, mulai dari kasih hingga tantangan hidup. Berikut adalah beberapa kutipan inspiratif dari karya-karya, beserta maknanya.
“Mungkin yang terbaik belum datang.” – “All Too Well”
Makna: Bahkan di saat-saat sulit, selalu ada sedikit harapan dan kemungkinan akan hari yang lebih cerah.
Syair ini dari lagu “All Too Well” membuat kita ingat bahwa walaupun kita mungkin berhadapan dengan masa sulit sekarang, senantiasa ada potensi bahwa hari esok bisa mendatangkan sesuatu yang lebih baik. Ini adalah pesan pengharapan yang memperkuat, merangsang kita untuk terus bertahan dan tidak menyerah, sebab yang terbaik mungkin belum datang.
“Aku akan tetap bertahan lantaran aku tidak bisa melakukan apapun tanpamu.” – “You Belong with Me”
Arti: Menemukan asmara dan bantuan dari orang lain dapat memberi kita kekuatan dan tekad untuk terus berjuang melalui tantangan.
lipat4d
Ashley JKT48: Bintang yang Bercahaya Terang di Dunia Idola
Siapa Ashley JKT48?
Siapa figur muda berbakat yang menarik perhatian sejumlah besar penggemar musik di Indonesia dan Asia Tenggara? Beliau adalah Ashley Courtney Shintia, atau yang terkenal dengan nama panggungnya, Ashley JKT48. Masuk dengan grup idola JKT48 pada tahun 2018, Ashley dengan lekas berubah menjadi salah satu personel paling terkenal.
Profil
Lahir di Jakarta pada tanggal 13 Maret 2000, Ashley memiliki darah Tionghoa-Indonesia. Ia memulai kariernya di industri hiburan sebagai model dan aktris, sebelum akhirnya masuk dengan JKT48. Kepribadiannya yang ceria, vokal yang bertenaga, dan keterampilan menari yang mengesankan menjadikannya idola yang sangat disukai.
Penghargaan dan Penghargaan
Popularitas Ashley telah diakui melalui banyak penghargaan dan nominasi. Pada masa 2021, ia memenangkan penghargaan “Anggota Paling Populer JKT48” di acara JKT48 Music Awards. Ia juga diberi gelar sebagai “Idol Tercantik di Asia” oleh sebuah majalah online pada tahun 2020.
Peran dalam JKT48
Ashley memainkan fungsi penting dalam kelompok JKT48. Beliau adalah anggota Tim KIII dan berperan menjadi dancer utama dan vokalis. Ashley juga terlibat sebagai member dari sub-unit “J3K” bersama Jessica Veranda dan Jennifer Rachel Natasya.
Perjalanan Individu
Di luar kegiatannya dengan JKT48, Ashley juga mengembangkan karir solo. Ia telah merilis sejumlah lagu single, termasuk “Myself” (2021) dan “Falling Down” (2022). Ashley juga telah bekerja sama dengan penyanyi lain, seperti Afgan dan Rossa.
Hidup Privat
Di luar dunia perform, Ashley dikenali sebagai orang yang rendah hati dan bersahabat. Ashley menikmati menghabiskan jam bareng keluarga dan teman-temannya. Ashley juga punya hobi menggambar dan fotografi.
What’s up, all is going well here and ofcourse every one is sharing facts, that’s actually
good, keep up writing.
https://kkc-cleaning.ru/
Instal Aplikasi 888 dan Raih Besar: Panduan Pendek
**Perangkat Lunak 888 adalah alternatif unggulan untuk Pengguna yang mencari keseruan main digital yang mengasyikkan dan menguntungkan. Melalui bonus setiap hari dan opsi menggiurkan, app ini menawarkan menyediakan aktivitas main terbaik. Berikut petunjuk pendek untuk mengoptimalkan pemanfaatan Perangkat Lunak 888.
Pasang dan Mulai Raih
Platform Ada:
Aplikasi 888 bisa diambil di Sistem Android, Perangkat iOS, dan PC. Mulai bermain dengan mudah di alat apapun.
Keuntungan Setiap Hari dan Bonus
Imbalan Mendaftar Setiap Hari:
Masuk saban hari untuk mendapatkan imbalan mencapai 100K pada waktu ketujuh.
Tuntaskan Aktivitas:
Raih peluang undi dengan merampungkan aktivitas terkait. Tiap aktivitas memberi Pengguna satu kesempatan pengeretan untuk mengklaim keuntungan hingga 888K.
Pengumpulan Manual:
Bonus harus diklaim sendiri di dalam aplikasi. Jangan lupa untuk mengklaim imbalan saban periode agar tidak tidak berlaku lagi.
Cara Undian
Kesempatan Lotere:
Setiap hari, Anda bisa meraih 1 peluang undi dengan menuntaskan misi.
Jika opsi undian selesai, selesaikan lebih banyak pekerjaan untuk mengambil tambahan kesempatan.
Level Hadiah:
Ambil hadiah jika akumulasi undian Kamu melebihi 100K dalam 1 hari.
Aturan Penting
Pengumpulan Imbalan:
Bonus harus dikumpulkan mandiri dari program. Jika tidak, hadiah akan otomatis diserahkan ke akun Anda Pengguna setelah satu waktu.
Ketentuan Betting:
Imbalan membutuhkan sekitar satu bertaruh efektif untuk dimanfaatkan.
Ringkasan
App 888 menawarkan aktivitas bertaruhan yang menyenangkan dengan hadiah tinggi. Unduh aplikasi sekarang juga dan nikmati keberhasilan besar saban periode!
Untuk informasi lebih terperinci tentang promo, pengisian, dan skema rujukan, lihat page utama aplikasi.
Откройте дверь в мир недвижимости с нашим порталом! У нас вы найдете полезные статьи на самые актуальные темы: [url=http://ecolife2.ru]продажа квартиры[/url], а также [url=http://ecolife2.ru]коммерческая недвижимость[/url]. Станьте экспертом в этой области, благодаря нашим информативным материалам!
уборка офисов москва
https://maps.google.co.tz/url?q=https://bridge-clip.ru/user/nboccaw/
купить диплом в дзержинске
перейти на сайт
Генераторы
https://rewarddebtor4.werite.net/zashchita-i-bezopasnost-kozhukhi-dlia-dizel-nykh-generatorov
уборка коттеджей в подмосковье недорого без посредников
купить диплом ветеринара
смотреть тут
купить диплом в астрахани
посмотреть сайт
купить диплом в нижнекамске
источник
https://marafet-km.ru/
сколько стоит вымыть окна
купить диплом в твери https://www.6landik-diploms.com/
http://investors-news.ru/
купить диплом в братске http://www.6landik-diploms.com
Канал [url=https://t.me/s/porteb_kredit]Потребительские кредиты – вся информация[/url] создан для тех, кто хочет взять кредит на лучших условиях. Мы расскажем о выгодных предложениях, рисках и важных нюансах кредитования. Получите максимум полезной информации и сделайте правильный выбор!
купить диплом в омске https://www.6landik-diploms.com
гарантированно,
Современное оборудование и материалы, для крепких и здоровых зубов,
Специализированная помощь по доступным ценам, для вашей улыбки,
Комфортные условия и дружественный персонал, для вашего здоровья и благополучия,
Комплексное восстановление утраченных зубов, для вашего долгосрочного удовлетворения,
Экстренная помощь в любое время суток, для вашего комфорта и удовлетворения,
Современное лечение заболеваний полости рта, для вашего комфорта и удовлетворения
які зуби [url=https://stomatologichnaklinikafghy.ivano-frankivsk.ua/]https://stomatologichnaklinikafghy.ivano-frankivsk.ua/[/url] .
https://uborkadoma-spb.ru/
акриловый сайдинг для обшивки дома купить сайдинг для наружной обшивки
My girlfriend and I were looking for some fun adult entertainment, and we turned to Google for help. That’s how we discovered Mult34 – [url=https://mult34.com/category/the-loud-house/]incest cartoons[/url] . We spent the entire evening exploring the site, enjoying a vast selection of erotic comics.
The content on Mult34 – [url=https://mult34.com/amys-peachy-butt/]animated porn[/url] is impressive, with a variety of stories that kept us entertained all night. If you’re looking for quality adult comics, this site is a must-visit. We had a fantastic time and will definitely be coming back to Mult34 – [url=https://mult34.com/category/pokemon/]pokemon porn comic[/url] .
гарантированно,
Лучшие стоматологи города, для крепких и здоровых зубов,
Профессиональное лечение и консультации, для вашего уверенного выбора,
Индивидуальный подход к каждому пациенту, для вашего комфорта и уверенности,
Комплексное восстановление утраченных зубов, для вашего долгосрочного удовлетворения,
Профессиональная гигиена полости рта, для вашего здоровья и уверенности в себе,
Индивидуальный план лечения для каждого пациента, для вашей уверенной улыбки
послуги стоматології [url=https://stomatologichnaklinikafghy.ivano-frankivsk.ua/]https://stomatologichnaklinikafghy.ivano-frankivsk.ua/[/url] .
sultantoto
Inspirasi dari Ucapan Taylor Swift
Taylor Swift, seorang musisi dan songwriter terkenal, tidak hanya diakui karena melodi yang elok dan nyanyian yang merdu, tetapi juga sebab lirik-lirik lagu-lagunya yang penuh makna. Dalam lirik-liriknya, Swift sering menyajikan berbagai faktor eksistensi, dimulai dari cinta hingga rintangan hidup. Berikut ini adalah beberapa kutipan menginspirasi dari lagu-lagu, beserta artinya.
“Mungkin yang terhebat belum hadir.” – “All Too Well”
Arti: Bahkan di masa-masa sulit, selalu ada seberkas harapan dan peluang untuk hari yang lebih cerah.
Lirik ini dari lagu “All Too Well” menyadarkan kita bahwa meskipun kita mungkin menghadapi masa-masa sulit saat ini, selalu ada kemungkinan bahwa waktu yang akan datang akan membawa perubahan yang lebih baik. Ini adalah pesan harapan yang memperkuat, mendorong kita untuk tetap bertahan dan tidak menyerah, karena yang terhebat mungkin belum tiba.
“Aku akan tetap bertahan sebab aku tidak bisa melakukan segala sesuatu tanpamu.” – “You Belong with Me”
Arti: Memperoleh kasih dan dukungan dari orang lain dapat memberi kita daya dan niat untuk terus berjuang melewati kesulitan.
raden4d
Ashley JKT48: Idola yang Bercahaya Terang di Dunia Idol
Siapa Ashley JKT48?
Siapa sosok muda berbakat yang menyita perhatian banyak penyuka lagu di Indonesia dan Asia Tenggara? Dialah Ashley Courtney Shintia, atau yang lebih dikenal dengan nama bekennya, Ashley JKT48. Masuk dengan grup idola JKT48 pada masa 2018, Ashley dengan segera menjadi salah satu anggota paling populer.
Biografi
Lahir di Jakarta pada tgl 13 Maret 2000, Ashley berketurunan darah Tionghoa-Indonesia. Beliau memulai kariernya di industri hiburan sebagai model dan aktris, sebelum selanjutnya bergabung dengan JKT48. Personanya yang ceria, vokal yang bertenaga, dan kemahiran menari yang mengesankan membentuknya sebagai idola yang sangat dicintai.
Award dan Penghargaan
Popularitas Ashley telah diapresiasi melalui banyak penghargaan dan pencalonan. Pada masa 2021, Ashley memenangkan penghargaan “Member Terpopuler JKT48” di event Penghargaan Musik JKT48. Ia juga dianugerahi sebagai “Idol Terindah di Asia” oleh sebuah media online pada tahun 2020.
Posisi dalam JKT48
Ashley memainkan peran penting dalam kelompok JKT48. Ia adalah personel Tim KIII dan berfungsi sebagai penari utama dan vokalis. Ashley juga terlibat sebagai bagian dari sub-unit “J3K” dengan Jessica Veranda dan Jennifer Rachel Natasya.
Karier Solo
Di luar aktivitasnya bersama JKT48, Ashley juga mengembangkan karir solo. Ia telah merilis beberapa lagu tunggal, diantaranya “Myself” (2021) dan “Falling Down” (2022). Ashley juga telah berkolaborasi dengan artis lain, seperti Afgan dan Rossa.
Kehidupan Privat
Selain dunia panggung, Ashley dikenal sebagai sebagai pribadi yang rendah hati dan bersahabat. Ashley menggemari menyisihkan waktu bersama keluarga dan teman-temannya. Ashley juga memiliki hobi melukis dan photography.
mpogacor
Instal Aplikasi 888 dan Peroleh Besar: Manual Praktis
**App 888 adalah opsi ideal untuk Para Pengguna yang mencari aktivitas bertaruhan online yang menggembirakan dan menguntungkan. Melalui bonus tiap hari dan opsi menarik, app ini sedia memberikan aktivitas bermain paling baik. Inilah panduan cepat untuk memaksimalkan pelayanan Aplikasi 888.
Unduh dan Mulai Menangkan
Layanan Ada:
Aplikasi 888 memungkinkan diambil di Android, iOS, dan PC. Mulai bertaruhan dengan mudah di perangkat apa pun.
Keuntungan Setiap Hari dan Imbalan
Imbalan Masuk Sehari-hari:
Login saban hari untuk meraih hadiah mencapai 100K pada hari ketujuh.
Tuntaskan Aktivitas:
Raih kesempatan lotere dengan menyelesaikan aktivitas terkait. Tiap aktivitas memberi Anda 1 opsi undi untuk memenangkan hadiah mencapai 888K.
Pengumpulan Sendiri:
Keuntungan harus diklaim mandiri di dalam perangkat lunak. Yakinlah untuk mengklaim bonus pada periode agar tidak kadaluwarsa.
Sistem Undian
Peluang Lotere:
Masing-masing masa, Anda bisa meraih satu kesempatan lotere dengan menyelesaikan aktivitas.
Jika kesempatan undian selesai, tuntaskan lebih banyak aktivitas untuk mengambil tambahan peluang.
Tingkat Imbalan:
Klaim bonus jika total undian Para Pengguna lebih dari 100K dalam 1 hari.
Kebijakan Esensial
Penerimaan Imbalan:
Keuntungan harus diterima sendiri dari aplikasi. Jika tidak, keuntungan akan secara otomatis diambil ke akun Kamu setelah satu hari.
Peraturan Bertaruh:
Hadiah memerlukan minimal sebuah betting berlaku untuk diambil.
Ringkasan
Program 888 menghadirkan keseruan berjudi yang menggembirakan dengan hadiah signifikan. Download program saat ini dan nikmati kemenangan signifikan tiap periode!
Untuk detail lebih lengkap tentang promo, simpanan, dan sistem undangan, cek page beranda app.
Came across an intriguing article Ц it’s worth your attention, trust me https://www.ubbullrun.com/users/worksale555
Online gambling sites are steadily more widespread, providing different promotions to attract new users. One of the most tempting propositions is the no upfront deposit bonus, a offer that permits users to take a chance without any initial deposit. This piece explores the merits of no-deposit bonuses and highlights how they can increase their effectiveness.
What is a No Deposit Bonus?
A no-deposit bonus is a type of casino offer where users receive bonus funds or complimentary spins without the need to deposit any of their own money. This lets gamblers to discover the casino, play various game options and stand a chance to win real funds, all without any upfront cost.
Advantages of No Deposit Bonuses
Risk-Free Exploration
No upfront deposit bonuses offer a risk-free opportunity to try out virtual casinos. Gamblers can evaluate various gaming activities, get to know the user interface, and judge the overall gameplay without using their own money. This is especially useful for newcomers who may not be familiar with online casinos.
Chance to Win Real Money
One of the most attractive features of free bonuses is the opportunity to win real money. Even though the amounts may be modest, any earnings secured from the bonus can often be redeemed after meeting the casino’s playthrough rules. This brings an element of excitement and provides a possible financial return without any monetary outlay.
Learning Opportunity
No upfront deposit bonuses give a great means to get to know how different games are played. Users can test out strategies, learn the mechanics of the gaming activities, and become more proficient without fearing losing their own capital. This can be especially useful for complex games like roulette.
Conclusion
No deposit bonuses provide various merits for gamblers, which include risk-free trial, the chance to get real rewards, and valuable educational experiences. As the market goes on to evolve, the appeal of no upfront deposit bonuses is likely to increase.
безопасно,
Современное оборудование и материалы, для вашего уверенного улыбки,
Современные методы стоматологии, для вашей улыбки,
Бесплатная консультация и диагностика, для вашего здоровья и благополучия,
Эффективное лечение зубов и десен, для вашего долгосрочного удовлетворения,
Индивидуальный план лечения и профилактики, для вашего комфорта и удовлетворения,
Индивидуальный план лечения для каждого пациента, для вашего здоровья и благополучия
івано франківськ стоматологія [url=https://stomatologichnaklinikafghy.ivano-frankivsk.ua/]https://stomatologichnaklinikafghy.ivano-frankivsk.ua/[/url] .
No-cost poker presents gamblers a distinct way to experience the pastime without any financial risk. This overview discusses the merits of participating in free poker and underscores why it continues to be well-liked among many players.
Risk-Free Entertainment
One of the key upsides of free poker is that it permits users to partake in the excitement of poker without fretting over losing capital. This transforms it great for novices who want to familiarize themselves with the sport without any initial expenditure.
Skill Development
No-cost poker offers a wonderful opportunity for participants to develop their competence. Gamblers can experiment with methods, get to know the guidelines of the game, and obtain poise without any pressure of risking their own capital.
Social Interaction
Playing free poker can also result in networking opportunities. Internet-based venues often feature interactive spaces where participants can interact with each other, exchange strategies, and potentially develop connections.
Accessibility
Free poker is conveniently accessible to anyone with an internet connection. This means that participants can partake in the game from the luxury of their own place, at any time.
Conclusion
No-cost poker offers numerous advantages for participants. It is a cost-free method to play the pastime, improve skills, participate in new friendships, and play poker without hassle. As additional participants experience the benefits of free poker, its demand is expected to grow.
казино регистрации Twin Casino
sweepstakes casino
Investigating Contest Betting Sites: A Thrilling and Accessible Gaming Option
Prelude
Promotion casinos are transforming into a well-liked substitute for users searching for an engaging and legal method to partake in online gaming. In contrast to conventional virtual casinos, lottery gambling platforms work under distinct authorized structures, permitting them to present events and prizes without being subject to the similar rules. This write-up explores the concept of contest gambling platforms, their advantages, and why they are drawing a growing quantity of participants.
What is a Sweepstakes Casino?
A sweepstakes gambling platform works by giving participants with online funds, which can be used to participate in events. Participants can earn extra digital coins or actual gifts, including money. The primary distinction from conventional gaming hubs is that users do not get money directly but receive it through promotional campaigns, including buying a service or joining in a no-cost entry contest. This structure allows sweepstakes gambling platforms to run authorized in many regions where traditional virtual betting is limited.
마약 검사 기간
빠른 충환전 서비스 및 메이저업체의 안전성
토토사이트 이용 시 매우 중요한 부분 중 하나는 신속한 입출금 절차입니다. 일반적으로 3분 안에 충전, 십 분 내에 환전이 처리되어야 합니다. 메이저 대형업체들은 충분한 스태프 채용을 통해 이러한 빠릿한 입출금 처리를 보증하며, 이로써 고객들에게 안도감을 제공합니다. 메이저사이트를 사용하면서 빠른 체감을 즐겨보세요. 우리는 여러분들이 안심하고 사이트를 사용할 수 있도록 도와드리는 먹튀해결 전문가입니다.
보증금을 내고 광고 배너 운영
먹튀 해결 팀은 최소 3000만 원에서 억대의 보증 금액을 예치하고 있는 사이트들의 광고 배너를 운영 중입니다. 혹시 먹튀 사고가 생길 경우, 베팅 규정에 반하지 않은 배팅 내역을 캡처하여 먹튀해결사에 문의하시면, 사실 확인 후 보증 금액으로 즉시 피해 보상을 처리해드립니다. 피해 발생 시 즉시 캡처하여 피해 상황을 저장해 두시고 제출해 주세요.
오랫동안 안전하게 운영된 업체 확인
먹튀 해결 전문가는 최대한 4년간 먹튀 문제 없이 무사히 운영된 사이트만을 인증하여 배너 등록을 허가합니다. 이로 인해 어느 누구나 알만한 메이저사이트를 안전하게 사용할 수 있는 기회를 제공하고 있습니다. 정확한 검사 작업을 통해 인증된 사이트를 놓치지 않도록, 보안된 도박을 경험해보세요.
투명하고 공정한 먹튀 검토
먹튀해결사의 먹튀 검토는 투명함과 공정을 기반으로 합니다. 언제나 사용자들의 입장을 최우선으로 생각하며, 업체의 유혹이나 이익에 흔들리지 않고 하나의 삭제 없이 사실만을 기반으로 검증해왔습니다. 먹튀 피해를 당한 후 후회하지 않도록, 바로 지금 시작해보세요.
먹튀 검증 사이트 목록
먹튀 해결 팀이 엄선한 안전한 베팅사이트 인증된 업체 목록 입니다. 지금 등록된 인증된 업체들은 먹튀 문제가 발생 시 100% 보증을 도와드립니다. 그러나, 제휴가 끝난 업체에서 발생한 문제에 대해서는 책임이 없습니다.
독보적인 먹튀 검증 알고리즘
먹튀 해결 전문가는 공정한 베팅 환경을 만들기 위해 항상 노력하고 있습니다. 우리가 추천하는 스포츠토토사이트에서 안심하고 베팅하시기 바랍니다. 회원님의 먹튀 신고는 먹튀 리스트에 기재되어 해당되는 토토사이트에 중대한 영향을 미칩니다. 먹튀 리스트를 작성할 때 먹튀블러드의 검증 노하우를 최대한 활용하여 공평한 심사를 하도록 약속드립니다.
안전한 도박 환경을 제공하기 위해 계속해서 노력하는 먹튀 해결 전문가와 동반하여 안전하게 즐기시기 바랍니다.
Hey there, You’ve done a fantastic job. I will definitely digg it and personally suggest to my friends. I’m confident they will be benefited from this website.
cospack.ru/index.php?links_exchange=yes&page=106
mypenza.ru/forum/index.php?showtopic=54674&mode=linear
remont-okon.od.ua/index.php?subaction=userinfo&user=uqepyd
s-s-o.ru/forum.php?PAGE_NAME=profile_view&UID=51644
job.tltnews.ru/addres.php
Examining the Realm of Free Poker Games
Introduction
Currently, card games have transformed into extensively available amusement alternatives. For people looking for a no-cost way to play poker, free poker games websites supply a thrilling venture. This text explores the pros and motives for which free poker games has transformed into a popular option for many participants.
Perks of Complimentary Poker
Complimentary Fun
One of the extremely attractive features of complimentary poker is that it gives players with cost-free fun. There is no demand to put in currency to engage in the activity, making it attainable to all.
Skill Development
Engaging in no-cost poker lets players to sharpen their abilities without an fiscal peril. It is a perfect opportunity for novices to comprehend the basics and tactics of this card game.
Social Interaction
Many free poker games platforms give chances for interactive communication. Users can communicate with other users, discuss techniques, and experience warm competitions.
Why Complimentary Poker is Favored
Attainability
Free poker games are broadly accessible, facilitating gamers from various backgrounds to enjoy the gameplay.
No Financial Risk
With complimentary poker, there is no economic danger, turning it a safe choice for users who desire to engage in poker without putting in currency.
Diverse Game Options
Complimentary poker applications give a diverse array of games, assuring that gamers can continually get an option that matches their choices.
Closing
Complimentary poker offers a enjoyable and available way for enthusiasts to enjoy the game of poker. With no financial risk, options for improving skills, and broad game varieties, it is understandable that various gamers choose complimentary poker as their go-to betting option.
Exploring the World of Online Casinos
Commencement
In the digital age, casino online have altered the method players engage in betting. With sophisticated digital advancements, players can play their preferred casino games from the ease of their houses. This piece delves into the perks of casino online and as to why they are gaining popularity.
Advantages of Casino Online
Accessibility
One of the main pros of virtual casinos is comfort. Players can engage in gaming at any time and wherever they desire, removing the necessity to go to a land-based gambling venue.
Wide Variety of Games
Virtual casinos provide a vast selection of games, spanning from vintage slot games and casino classics to live-action games and contemporary video slots. This variety assures that there is an option for everyone.
Perks and Specials
Among the most luring characteristics of online casinos is the array of incentives and offers provided to users. These can consist of registration bonuses, free spins, rebate promotions, and loyalty programs.
Safety and Reliability
Renowned online casinos ensure user protection and assurance with advanced security methods. This protects individual details and financial transactions.
Motives Behind the Popularity of Internet Casinos
Reachability
Online casinos are widely reachable, enabling enthusiasts from different locations to play betting.
лаки джет игра [url=http://1win-luckyjet-ru.ru/]лаки джет игра[/url] .
webpage [url=https://benumbccshop.org]carding 2024[/url]
free casino games
Examining Free Casino Games
Commencement
In contemporary times, complimentary casino games have become a preferred option for casino lovers who aspire to experience casino games minus wasting money. This text examines the advantages of complimentary casino games and the causes they are gaining attention.
Advantages of No-Cost Casino Games
Risk-Free Gaming
One of the key perks of free casino games is the capability to play minus economic risk. Users can play their beloved gaming options free from the stress of wasting money.
Skill Enhancement
Free casino games supply an fantastic platform for users to improve their talents. Whether it is mastering methods in roulette, players can rehearse free from financial implications.
Extensive Game Options
Complimentary casino games supply a broad variety of games, like traditional slot machines, board games, and interactive games. This variety guarantees that there is a game for all types of players.
Why Free-of-Charge Casino Games are Favored
Attainability
Free casino games are broadly attainable, permitting enthusiasts from diverse walks of life to play casino games.
Free from Financial Burden
Unlike real-money casino games, free-of-charge casino games do not require a monetary obligation. This enables gamblers to engage in casino activities free from fretting over parting with cash.
Experience Before Paying
Complimentary casino games supply enthusiasts the opportunity to try games prior to investing genuine funds. This enables gamblers craft informed choices.
Closing
Free-of-charge casino games supplies a fun and secure method to play betting. With no financial risk, a large game library, and abilities for skill enhancement, it is clear that many enthusiasts prefer free-of-charge casino games for their gaming preferences.
Discovering Gambling Slots
Commencement
Real money slots have evolved into a well-liked alternative for casino enthusiasts looking for the thrill of winning real funds. This article explores the pros of real money slots and the reasons they are gaining a growing number of gamblers.
Advantages of Cash Slots
Genuine Rewards
The major allure of money slots is the possibility to win real currency. Differing from free slots, money slots supply gamblers the thrill of possible economic gains.
Extensive Game Variety
Cash slots supply a wide range of themes, characteristics, and payment models. This makes sure that there is an option for everyone, including classic classic 3-reel slots to modern animated slots with several payment lines and bonus features.
Enticing Deals
Various internet casinos give exciting bonuses for money slot enthusiasts. These can consist of welcome bonuses, bonus spins, refund deals, and VIP schemes. Such incentives increase the general gambling activity and provide extra possibilities to secure cash.
Motivations for Opting for Money Slots
The Rush of Securing Tangible Currency
Gambling slots provide an exhilarating journey, as users expect the chance of securing genuine cash. This element imparts another layer of thrill to the gaming adventure.
Instant Gratification
Money slots provide users the gratification of quick payments. Gaining funds immediately increases the casino experience, rendering it more rewarding.
Numerous Game Choices
Including gambling slots, enthusiasts can enjoy a broad array of slot games, making sure that there is constantly an option different to test.
Summary
Cash slots supplies a thrilling and gratifying casino adventure. With the chance to secure actual funds, a broad variety of games, and thrilling rewards, it’s clear that countless enthusiasts choose cash slots for their betting needs.
казино онлайн Twin Casino официальный
browse around this website [url=https://rxxxdrugs.com]Credit cards[/url]
twin casino сайт https://mgkhs.ru/
сайдинг наружный виниловый цена https://kanoner.com
сайдинг для наружной цена за м2 https://kanoner.com
Currently it appears like Drupal is the top blogging platform
available right now. (from what I’ve read) Is that what
you are using on your blog?
Here is my webpage – خرید بک لینک
Remarkable issues here. I’m very satisfied to see your post. Thank you so much and I’m taking a look ahead to touch you. Will you please drop me a e-mail?
@@G@@
https://beta.in.ua/2023/06/23/virtualnye-nomera-latvii-varianty-ispolzovaniya-i-vygodnaya-pokupka.html
Opened up an enthralling read – I’d like to share it with you http://www.les-ailes-chalaisiennes.com/forum/topic/найди-свое-счастье-с-нашими-знакомств/#postid-18973
прошутто купить https://messir-zakaz.ru
безопасно,
Индивидуальный подход к каждому пациенту, для поддержания здоровья рта,
Специализированная помощь по доступным ценам, для вашей улыбки,
Комфортные условия и дружественный персонал, для вашего комфорта и уверенности,
Эффективное лечение зубов и десен, для вашего здоровья и красоты улыбки,
Экстренная помощь в любое время суток, для вашего здоровья и уверенности в себе,
Индивидуальный план лечения для каждого пациента, для вашего комфорта и удовлетворения
стоматологія франківськ [url=https://stomatologichnaklinikafghy.ivano-frankivsk.ua/]https://stomatologichnaklinikafghy.ivano-frankivsk.ua/[/url] .
Juniper коммутаторы Производительные и надежные коммутаторы от Juniper.
Все самое интересное из мира игр https://unionbattle.ru обзоры, статьи и ответы на вопросы
хамон https://messir-zakaz.ru
Bonuses [url=https://DumpsOnline.cc]carding shop[/url]
go right here [url=https://ccnadumps.co]CC shop[/url]
Hello mates, its impressive paragraph about educationand fully defined, keep it up all the time.
http://www.sumkin.ru/forum/member.php?u=40482
cocochampionship.com/en/contact
otantravel.kz/news/swiss-uvelichivaet-kolichestvo-reysov-mayyami-cyurih-na-period-zimnego-sezona
1776reloaded.us/blogs/7/Where-to-buy-a-diploma-or-certificate-at-an-adequate
fabnews.ru/forum/showthread.php?p=76998
go to this site [url=https://BestDumps.uk]Best cc shop[/url]
квартира от застройщика екатеринбург квартиры екатеринбург цены от застройщика
Hello my friend! I want to say that this post is amazing, great written and
come with approximately all vital infos. I would like to peer more posts like this
.
Аврора Агро Партс – интернет-магазин, заслуживающий вашего внимания. Предлагаем привлекательные цены на автозапчасти ведущих брендов. Уважаем своих клиентов и рады общению с ними. Вы всегда можете рассчитывать на помощь квалифицированного специалиста. Он вам подберет то, что необходимо. https://aa-p.ru – сайт, где можно в любое удобное для вас время ознакомиться с условиями оплаты и доставки. Заказы осуществляем довольно оперативно. Открыты для взаимовыгодного сотрудничества и регулярно развиваемся, обращайтесь!
Excellent blog here! Also your site loads up fast!
What web host are you using? Can I get your affiliate link to your host?
I wish my web site loaded up as fast as yours lol
Качественная полировка кузова в Москве, за доступные деньги, удобно и просто
Полировка кузова качественно [url=http://polish-avto.ru/]http://polish-avto.ru/[/url] .
Преимущества создания акустического комфорта в машине
Полная шумоизоляция автомобиля цена в Москве [url=https://www.shumoizolyaciya-a.ru]https://www.shumoizolyaciya-a.ru[/url] .
Освежите дом с помощью сухой химчистки дивана
Cухая химчистка мягкой мебели на дому [url=https://suhaya-himchistka-mebely.ru/]Cухая химчистка мягкой мебели на дому[/url] .
https://cleanb2b.ru/
эффективно,
Современное оборудование и материалы, для вашего уверенного улыбки,
Современные методы стоматологии, для вашего уверенного выбора,
Комфортные условия и дружественный персонал, для вашего комфорта и уверенности,
Эффективное лечение зубов и десен, для вашего комфорта и уверенности,
Индивидуальный план лечения и профилактики, для вашего долгосрочного удовлетворения,
Заботливое отношение и внимательный подход, для вашей уверенной улыбки
стоматологiчна полiклiнiка [url=https://stomatologichnaklinikafghy.ivano-frankivsk.ua/]стоматологiчна полiклiнiка[/url] .
Всем игроманам привет!
В последние годы онлайн-казино завоевывают все большую популярность, и среди них особое место занимает дживиспин казино бонус. Это казино предлагает широкий спектр игр, щедрые бонусы и удобный интерфейс, что делает его идеальным выбором для новичков и опытных игроков.
Одним из главных преимуществ jvspin бездепозитный бонус является его официальный сайт, который обеспечивает быстрый доступ ко всем функциям казино. Если вас как и меня интересует jv spin играть, дживиспин регистрация или дживи спин, то самое время прочитать здесь [url=https://sferadetstva.ru/2024/05/29/Мобильные-казино-как-использовать-мобильные-бонусы]sferadetstva.ru[/url] подробнее об jv спин. На сайте вы найдете актуальную информацию о новых играх, промоакциях и специальных предложениях, которые помогут увеличить ваши шансы на выигрыш.
Для тех, кто предпочитает играть на мобильных устройствах, jvspin casino предлагает мобильную версию, которая позволяет наслаждаться любимыми играми в любое время и в любом месте. Скачивание приложения проходит быстро и легко, а интерфейс адаптирован под разные платформы, что делает игровой процесс максимально комфортным.
Если вы хотите узнать больше о возможностях дживи спин регистрация, советуем обратить внимание на разделы, посвященные регистрации и входу в личный кабинет. Здесь вы найдете пошаговые инструкции, которые помогут быстро начать игру и воспользоваться всеми доступными бонусами и привилегиями.
Не забывайте следить за обновлениями и рабочими зеркалами дживиспин казино регистрация, чтобы всегда иметь доступ к своему аккаунту и любимым играм. Если вас как и меня интересует казино jvspin, дживиспин бонус или jvspin бездепозитный бонус, то самое время прочитать здесь [url=https://fialan-china.ru/2024/05/29/Онлайн-казино-азарт-в-виртуальном-мире]fialan-china.ru[/url] подробнее об промокод jvspin.
Играйте в удовольствие и помните: в jv spin казино каждый может стать победителем!
Более подробно на https://t.me/s/jvspin_zerkalo
Удачи и профитов!
живиспин казино зеркало
jvspin бездепозитный бонус
зеркало jvspin
jv spin казино
jvspin casino
Привет любители азарта!
Если вас как и меня интересует казино лев официальный сайт скачать, lev casino promo code или зеркало лев казино, то самое время прочитать здесь [url=https://20to20.biz/2024/05/29/online-casinos-a-beginners-guide-to-the-world-of-online-gambling]20to20.biz[/url] подробнее об вулкан клуб лев.
Более подробно на https://t.me/zerkalo_lev
Удачи и профитов!
официальный сайт казино лев с бонусом
игровые автоматы игорный клуб лев
лев казино бездепозитный бонус
лев казино бездепозитный бонус 45 фриспинов
казино лев скачать на андроид
play slots for real money
Within the present-day online age, the domain of gambling entertainment has undergone a significant shift, with virtual gaming venues establishing themselves as the freshest sphere of entertainment and excitement.
Included among the most enthralling features inside this vibrant domain are the consistently-favored virtual slot games, encouraging customers to commence a quest of exciting play and the chance to receive tangible funds.
Digital reel-based offerings have become a representation of joy and eagerness for participants encompassing the international community, providing an unparalleled extent of user-friendliness and availability.
By utilizing merely a several selections, you can captivate yourself in a eye-catching selection of reel-based motifs, each and every painstakingly created to captivate your perceptions and sustain your suspense of your place.
A major the chief draws of playing slots for real money virtually is the opportunity to undergo the thrill of possibly significant payouts. The anticipation of witnessing the icons turn, the symbols align, and the jackpot lure can be sincerely thrilling.
Virtual gambling platforms have flawlessly combined advanced technologies to offer a leisure interaction that is simultaneously graphically mesmerizing and beneficial.
Aside from the allure of possible payouts, internet-based slot machines as well grant a level of adaptability and control that is unprecedented in the standard gaming scenario. You can customize your stakes to suit your monetary constraints, refining your wagers to find the optimal balance that fits your individual inclinations and risk tolerance. This amount of tailoring empowers participants to expand their virtual accounts and amplify their fulfillment, all from the simplicity of their private residences.
эффективно,
Лучшие стоматологи города, для поддержания здоровья рта,
Профессиональное лечение и консультации, для вашего удобства,
Комфортные условия и дружественный персонал, для вашей радости и улыбки,
Комплексное восстановление утраченных зубов, для вашего комфорта и уверенности,
Индивидуальный план лечения и профилактики, для вашего комфорта и удовлетворения,
Современное лечение заболеваний полости рта, для вашего комфорта и удовлетворения
здорові зуби [url=https://stomatologichnaklinikafghy.ivano-frankivsk.ua/]здорові зуби[/url] .
https://www.fitday.com/fitness/forums/exercise/10313-supplements-get-fit-who-uses-them-who-doesnt.html
Looking to buy Ceylon cinnamon powder? You’ve come to the right place! We offer pure Ceylon cinnamon powder, known for its sweet, delicate flavor and numerous health benefits. If you’re wondering where to buy Ceylon cinnamon powder, look no further. Our Ceylon cinnamon for sale is available for purchase online, making it convenient for you to get this high-quality spice delivered straight to your door.
In addition to our pure Ceylon cinnamon powder, we also offer a variety of other products. If you’re a fan of herbal teas, consider trying Samahan tea. You can easily buy Samahan tea online through our store. It’s a wonderful blend of herbs and spices that supports your overall well-being.
For those who enjoy baking or cooking with coconut, we have desiccated coconut available. Wondering where to buy desiccated coconut? You can find it here, along with our extensive range of cinnamon products.
Speaking of cinnamon, our product line includes more than just powder. We also have Ceylon cinnamon sticks, perfect for adding a touch of flavor to your dishes or beverages. If you’re looking to purchase real cinnamon sticks online, we’ve got you covered.
Our selection doesn’t stop there. We offer cinnamon lotion and cinnamon body lotion for those who love the scent and benefits of cinnamon in their skincare routine. Additionally, you can find cinnamon shampoo and even cinnamon toothpicks at an affordable price.
For those interested in supplements, we have a range of Ceylon cinnamon supplements for sale. These supplements are a convenient way to incorporate the benefits of Ceylon cinnamon into your daily routine. You can buy Ceylon cinnamon supplements from us, ensuring you’re getting the best quality available.
Lastly, don’t forget to check out our Ceylon cinnamon tea bags, perfect for a soothing cup of tea at any time of the day. With our wide selection, you’re sure to find exactly what you need. Shop with us today for all your cinnamon and specialty product needs!
эффективно,
Современное оборудование и материалы, для поддержания здоровья рта,
Специализированная помощь по доступным ценам, для вашей улыбки,
Индивидуальный подход к каждому пациенту, для вашего комфорта и уверенности,
Эффективное лечение зубов и десен, для вашего здоровья и красоты улыбки,
Экстренная помощь в любое время суток, для вашего комфорта и удовлетворения,
Заботливое отношение и внимательный подход, для вашего комфорта и удовлетворения
клініка стоматологічна [url=https://stomatologichnaklinikafghy.ivano-frankivsk.ua/]https://stomatologichnaklinikafghy.ivano-frankivsk.ua/[/url] .
https://penzu.com/p/1f8163d78c446e4e
If you’re a fan of unique and flavorful dishes, you must try the Cinnamon Pork Cutlets Recipe. This delightful recipe brings out the best in pork with the warm, aromatic touch of cinnamon. For the best results, make sure to use Ceylon cinnamon sticks instead of the more common Cassia cinnamon. Wondering about the difference? When it comes to Ceylon Cinnamon Sticks vs. Cassia Cinnamon, Ceylon cinnamon is known for its sweeter, more delicate flavor, while Cassia has a stronger, more pungent taste. This distinction makes Ceylon the preferred choice for dishes where a subtle spice is desired.
Using Ceylon cinnamon powder in your cooking can elevate your meals to new heights. But do you know how to use Ceylon cinnamon powder in your favorite recipes? This versatile spice can be added to both sweet and savory dishes. Sprinkle it on your morning oatmeal, mix it into smoothies, or incorporate it into baked goods for a delicious twist. It’s also fantastic in savory recipes like curries, stews, and the aforementioned pork cutlets.
Apart from its culinary uses, Ceylon cinnamon offers numerous health benefits. Ceylon cinnamon capsules are a convenient way to enjoy these benefits. These supplements are packed with antioxidants and have anti-inflammatory properties. If you’re interested in the advantages, the Ceylon cinnamon capsules can help with blood sugar regulation, improving digestion, and boosting overall health. For those wondering about the benefits, dosage, and where to buy the best supplements, it’s recommended to take a look at reputable online stores that specialize in natural health products. The suggested dosage varies, so always follow the manufacturer’s instructions or consult with a healthcare professional.
Whether you’re cooking up a delicious meal or looking to enhance your health, Ceylon cinnamon is a versatile and beneficial spice to have on hand. Enjoy exploring its uses and benefits in your kitchen and beyond!
https://cleanb2b.ru/
I dugg some of you post as I cogitated they were very beneficial extremely helpful.
My web site: Pinterest
гарантированно,
Индивидуальный подход к каждому пациенту, для вашего уверенного улыбки,
Современные методы стоматологии, для вашего уверенного выбора,
Индивидуальный подход к каждому пациенту, для вашей радости и улыбки,
Комплексное восстановление утраченных зубов, для вашего комфорта и уверенности,
Экстренная помощь в любое время суток, для вашего здоровья и уверенности в себе,
Современное лечение заболеваний полости рта, для вашего здоровья и благополучия
лікування зубів у дітей [url=https://stomatologichnaklinikafghy.ivano-frankivsk.ua/]лікування зубів у дітей[/url] .
https://www.nairaland.com/4446926/wholesale-ceylon-cinnamon-powder-stick
Looking to buy Ceylon cinnamon powder? You’ve come to the right place! We offer pure Ceylon cinnamon powder, known for its sweet, delicate flavor and numerous health benefits. If you’re wondering where to buy Ceylon cinnamon powder, look no further. Our Ceylon cinnamon for sale is available for purchase online, making it convenient for you to get this high-quality spice delivered straight to your door.
In addition to our pure Ceylon cinnamon powder, we also offer a variety of other products. If you’re a fan of herbal teas, consider trying Samahan tea. You can easily buy Samahan tea online through our store. It’s a wonderful blend of herbs and spices that supports your overall well-being.
For those who enjoy baking or cooking with coconut, we have desiccated coconut available. Wondering where to buy desiccated coconut? You can find it here, along with our extensive range of cinnamon products.
Speaking of cinnamon, our product line includes more than just powder. We also have Ceylon cinnamon sticks, perfect for adding a touch of flavor to your dishes or beverages. If you’re looking to purchase real cinnamon sticks online, we’ve got you covered.
Our selection doesn’t stop there. We offer cinnamon lotion and cinnamon body lotion for those who love the scent and benefits of cinnamon in their skincare routine. Additionally, you can find cinnamon shampoo and even cinnamon toothpicks at an affordable price.
For those interested in supplements, we have a range of Ceylon cinnamon supplements for sale. These supplements are a convenient way to incorporate the benefits of Ceylon cinnamon into your daily routine. You can buy Ceylon cinnamon supplements from us, ensuring you’re getting the best quality available.
Lastly, don’t forget to check out our Ceylon cinnamon tea bags, perfect for a soothing cup of tea at any time of the day. With our wide selection, you’re sure to find exactly what you need. Shop with us today for all your cinnamon and specialty product needs!
I absolutely love your blog and find almost all of your post’s to be just what I’m looking for. Do you offer guest writers to write content for you? I wouldn’t mind writing a post or elaborating on many of the subjects you write about here. Again, awesome web site!
http://www.mebelnyvkus.ru/kuhnja/kuxonnye-stulya/stul-ccpe-m.html
lunarys.com.br/blog/suplemento-alimentar-hair-supply
malispa.ru/users/122?wid=3563
newtownmemorialfund.org/about/
rusbil.ru/forum/viewtopic.php?t=739&view=previous
https://earl-clean.ru/
[url=https://black.sprut.ltd/]blacksprut net[/url] – blacksprut официальный сайт, pasaremos blacksprut
купить квартиру в новостройке недорого https://kupit-kvartiruekb.ru
Какие возможные риски и осложнения связаны с биоревитализацией? Риски включают аллергические реакции, инфекции, образование синяков и отеков, которые минимизируются при правильном проведении процедуры квалифицированным специалистом
биоревитализация по точкам [url=biorevitalizacia.com]biorevitalizacia.com[/url] .
куплю 1 квартиру новостройка цена однокомнатной квартиры
https://www.thehockeypaper.co.uk/forums/topic/how-safe-is-it-to-drink-water-from-the-fridge-filter
Looking to buy Ceylon cinnamon powder? You’ve come to the right place! We offer pure Ceylon cinnamon powder, known for its sweet, delicate flavor and numerous health benefits. If you’re wondering where to buy Ceylon cinnamon powder, look no further. Our Ceylon cinnamon for sale is available for purchase online, making it convenient for you to get this high-quality spice delivered straight to your door.
In addition to our pure Ceylon cinnamon powder, we also offer a variety of other products. If you’re a fan of herbal teas, consider trying Samahan tea. You can easily buy Samahan tea online through our store. It’s a wonderful blend of herbs and spices that supports your overall well-being.
For those who enjoy baking or cooking with coconut, we have desiccated coconut available. Wondering where to buy desiccated coconut? You can find it here, along with our extensive range of cinnamon products.
Speaking of cinnamon, our product line includes more than just powder. We also have Ceylon cinnamon sticks, perfect for adding a touch of flavor to your dishes or beverages. If you’re looking to purchase real cinnamon sticks online, we’ve got you covered.
Our selection doesn’t stop there. We offer cinnamon lotion and cinnamon body lotion for those who love the scent and benefits of cinnamon in their skincare routine. Additionally, you can find cinnamon shampoo and even cinnamon toothpicks at an affordable price.
For those interested in supplements, we have a range of Ceylon cinnamon supplements for sale. These supplements are a convenient way to incorporate the benefits of Ceylon cinnamon into your daily routine. You can buy Ceylon cinnamon supplements from us, ensuring you’re getting the best quality available.
Lastly, don’t forget to check out our Ceylon cinnamon tea bags, perfect for a soothing cup of tea at any time of the day. With our wide selection, you’re sure to find exactly what you need. Shop with us today for all your cinnamon and specialty product needs!
купить диплом цена https://6landik-diploms.com
гардеробная система валенсия 1
гарантированно,
Лучшие стоматологи города, для вашего уверенного улыбки,
Специализированная помощь по доступным ценам, для вашего удобства,
Бесплатная консультация и диагностика, для вашей радости и улыбки,
Инновационные методы стоматологии, для вашего комфорта и уверенности,
Индивидуальный план лечения и профилактики, для вашего долгосрочного удовлетворения,
Индивидуальный план лечения для каждого пациента, для вашего комфорта и удовлетворения
стоматологія дитяча [url=https://stomatologichnaklinikafghy.ivano-frankivsk.ua/]https://stomatologichnaklinikafghy.ivano-frankivsk.ua/[/url] .
https://earl-clean.ru/
купить диплом в екатеринбурге http://6landik-diploms.com
https://forums.hitched.co.uk/chat/forums/thread/i-need-a-cant-fail-cookie-recepie-please-61412/
Looking to buy Ceylon cinnamon powder? You’ve come to the right place! We offer pure Ceylon cinnamon powder, known for its sweet, delicate flavor and numerous health benefits. If you’re wondering where to buy Ceylon cinnamon powder, look no further. Our Ceylon cinnamon for sale is available for purchase online, making it convenient for you to get this high-quality spice delivered straight to your door.
In addition to our pure Ceylon cinnamon powder, we also offer a variety of other products. If you’re a fan of herbal teas, consider trying Samahan tea. You can easily buy Samahan tea online through our store. It’s a wonderful blend of herbs and spices that supports your overall well-being.
For those who enjoy baking or cooking with coconut, we have desiccated coconut available. Wondering where to buy desiccated coconut? You can find it here, along with our extensive range of cinnamon products.
Speaking of cinnamon, our product line includes more than just powder. We also have Ceylon cinnamon sticks, perfect for adding a touch of flavor to your dishes or beverages. If you’re looking to purchase real cinnamon sticks online, we’ve got you covered.
Our selection doesn’t stop there. We offer cinnamon lotion and cinnamon body lotion for those who love the scent and benefits of cinnamon in their skincare routine. Additionally, you can find cinnamon shampoo and even cinnamon toothpicks at an affordable price.
For those interested in supplements, we have a range of Ceylon cinnamon supplements for sale. These supplements are a convenient way to incorporate the benefits of Ceylon cinnamon into your daily routine. You can buy Ceylon cinnamon supplements from us, ensuring you’re getting the best quality available.
Lastly, don’t forget to check out our Ceylon cinnamon tea bags, perfect for a soothing cup of tea at any time of the day. With our wide selection, you’re sure to find exactly what you need. Shop with us today for all your cinnamon and specialty product needs!
эффективно,
Индивидуальный подход к каждому пациенту, для вашего уверенного улыбки,
Современные методы стоматологии, для вашего удобства,
Бесплатная консультация и диагностика, для вашего здоровья и благополучия,
Эффективное лечение зубов и десен, для вашего здоровья и красоты улыбки,
Профессиональная гигиена полости рта, для вашего долгосрочного удовлетворения,
Современное лечение заболеваний полости рта, для вашего комфорта и удовлетворения
послуги стоматології [url=https://stomatologichnaklinikafghy.ivano-frankivsk.ua/]https://stomatologichnaklinikafghy.ivano-frankivsk.ua/[/url] .
купить диплом техникума https://www.6landik-diploms.com
гардеробная система валенсия 1
https://pastelink.net/uv4vgs63
If you’re a fan of unique and flavorful dishes, you must try the Cinnamon Pork Cutlets Recipe. This delightful recipe brings out the best in pork with the warm, aromatic touch of cinnamon. For the best results, make sure to use Ceylon cinnamon sticks instead of the more common Cassia cinnamon. Wondering about the difference? When it comes to Ceylon Cinnamon Sticks vs. Cassia Cinnamon, Ceylon cinnamon is known for its sweeter, more delicate flavor, while Cassia has a stronger, more pungent taste. This distinction makes Ceylon the preferred choice for dishes where a subtle spice is desired.
Using Ceylon cinnamon powder in your cooking can elevate your meals to new heights. But do you know how to use Ceylon cinnamon powder in your favorite recipes? This versatile spice can be added to both sweet and savory dishes. Sprinkle it on your morning oatmeal, mix it into smoothies, or incorporate it into baked goods for a delicious twist. It’s also fantastic in savory recipes like curries, stews, and the aforementioned pork cutlets.
Apart from its culinary uses, Ceylon cinnamon offers numerous health benefits. Ceylon cinnamon capsules are a convenient way to enjoy these benefits. These supplements are packed with antioxidants and have anti-inflammatory properties. If you’re interested in the advantages, the Ceylon cinnamon capsules can help with blood sugar regulation, improving digestion, and boosting overall health. For those wondering about the benefits, dosage, and where to buy the best supplements, it’s recommended to take a look at reputable online stores that specialize in natural health products. The suggested dosage varies, so always follow the manufacturer’s instructions or consult with a healthcare professional.
Whether you’re cooking up a delicious meal or looking to enhance your health, Ceylon cinnamon is a versatile and beneficial spice to have on hand. Enjoy exploring its uses and benefits in your kitchen and beyond!
[url=https://onion.moriartimega.com/]ссылка на мега даркнет[/url] – ссылка на мега даркнет, площадка мега даркнет
закрытая гардеробная система купить
https://www.hostboard.com/forums/showthread.php?t=1003559&p=2722170#post2722170
Looking to buy Ceylon cinnamon powder? You’ve come to the right place! We offer pure Ceylon cinnamon powder, known for its sweet, delicate flavor and numerous health benefits. If you’re wondering where to buy Ceylon cinnamon powder, look no further. Our Ceylon cinnamon for sale is available for purchase online, making it convenient for you to get this high-quality spice delivered straight to your door.
In addition to our pure Ceylon cinnamon powder, we also offer a variety of other products. If you’re a fan of herbal teas, consider trying Samahan tea. You can easily buy Samahan tea online through our store. It’s a wonderful blend of herbs and spices that supports your overall well-being.
For those who enjoy baking or cooking with coconut, we have desiccated coconut available. Wondering where to buy desiccated coconut? You can find it here, along with our extensive range of cinnamon products.
Speaking of cinnamon, our product line includes more than just powder. We also have Ceylon cinnamon sticks, perfect for adding a touch of flavor to your dishes or beverages. If you’re looking to purchase real cinnamon sticks online, we’ve got you covered.
Our selection doesn’t stop there. We offer cinnamon lotion and cinnamon body lotion for those who love the scent and benefits of cinnamon in their skincare routine. Additionally, you can find cinnamon shampoo and even cinnamon toothpicks at an affordable price.
For those interested in supplements, we have a range of Ceylon cinnamon supplements for sale. These supplements are a convenient way to incorporate the benefits of Ceylon cinnamon into your daily routine. You can buy Ceylon cinnamon supplements from us, ensuring you’re getting the best quality available.
Lastly, don’t forget to check out our Ceylon cinnamon tea bags, perfect for a soothing cup of tea at any time of the day. With our wide selection, you’re sure to find exactly what you need. Shop with us today for all your cinnamon and specialty product needs!
Преимущества строительства дома из бруса 9х12 | Зачем выбирать дом из бруса 9х12 | Интерьер для дома из бруса 9х12: советы дизайнера | Выбор системы отопления для дома из бруса 9х12 | Выбор материалов для теплоизоляции и вентиляции в доме из бруса 9х12 | Типы фундаментов для дома из бруса 9х12 | Сад и огород вокруг дома из бруса 9х12 | Инновации в строительстве дома из бруса 9х12 | Как обустроить зону отдыха в доме из бруса 9х12 | Сколько стоит построить дом из бруса 9х12
одноэтажный дом из бруса 9х12 [url=https://domizbrusa-9x12spb.ru/]https://domizbrusa-9x12spb.ru/[/url] .
Hi there everyone, it’s my first visit at this site, and piece of writing is genuinely fruitful designed for me, keep up posting these types of articles or reviews.
hinadezain-test.com/
medicineshocknews.ru/page/7
http://www.lednsk.ru/index.php?links_exchange=yes&page=13&show_all=yes
forum.analysisclub.ru/index.php/topic,171620.0.html?PHPSESSID=be9d29ff90e59b2f12dbf03eb3ada3ec
html-studio.paris/creation-de-site-web/
https://sucreabeille.com/community/forum/forums/1887-little-and-grim-reviews/topics/1783602-what-is-the-right-way-to-use-cinnamon-lotion-for-skin-care
Looking to buy Ceylon cinnamon powder? You’ve come to the right place! We offer pure Ceylon cinnamon powder, known for its sweet, delicate flavor and numerous health benefits. If you’re wondering where to buy Ceylon cinnamon powder, look no further. Our Ceylon cinnamon for sale is available for purchase online, making it convenient for you to get this high-quality spice delivered straight to your door.
In addition to our pure Ceylon cinnamon powder, we also offer a variety of other products. If you’re a fan of herbal teas, consider trying Samahan tea. You can easily buy Samahan tea online through our store. It’s a wonderful blend of herbs and spices that supports your overall well-being.
For those who enjoy baking or cooking with coconut, we have desiccated coconut available. Wondering where to buy desiccated coconut? You can find it here, along with our extensive range of cinnamon products.
Speaking of cinnamon, our product line includes more than just powder. We also have Ceylon cinnamon sticks, perfect for adding a touch of flavor to your dishes or beverages. If you’re looking to purchase real cinnamon sticks online, we’ve got you covered.
Our selection doesn’t stop there. We offer cinnamon lotion and cinnamon body lotion for those who love the scent and benefits of cinnamon in their skincare routine. Additionally, you can find cinnamon shampoo and even cinnamon toothpicks at an affordable price.
For those interested in supplements, we have a range of Ceylon cinnamon supplements for sale. These supplements are a convenient way to incorporate the benefits of Ceylon cinnamon into your daily routine. You can buy Ceylon cinnamon supplements from us, ensuring you’re getting the best quality available.
Lastly, don’t forget to check out our Ceylon cinnamon tea bags, perfect for a soothing cup of tea at any time of the day. With our wide selection, you’re sure to find exactly what you need. Shop with us today for all your cinnamon and specialty product needs!
пожаловаться на телефонных мошенников [url=www.pozhalovatsya-na-moshennikov.ru/]www.pozhalovatsya-na-moshennikov.ru/[/url] .
https://telegra.ph/Ceylon-Cinnamon-Capsules-Benefits-Dosage-and-Where-to-Buy-the-Best-Supplements-06-03
If you’re a fan of unique and flavorful dishes, you must try the Cinnamon Pork Cutlets Recipe. This delightful recipe brings out the best in pork with the warm, aromatic touch of cinnamon. For the best results, make sure to use Ceylon cinnamon sticks instead of the more common Cassia cinnamon. Wondering about the difference? When it comes to Ceylon Cinnamon Sticks vs. Cassia Cinnamon, Ceylon cinnamon is known for its sweeter, more delicate flavor, while Cassia has a stronger, more pungent taste. This distinction makes Ceylon the preferred choice for dishes where a subtle spice is desired.
Using Ceylon cinnamon powder in your cooking can elevate your meals to new heights. But do you know how to use Ceylon cinnamon powder in your favorite recipes? This versatile spice can be added to both sweet and savory dishes. Sprinkle it on your morning oatmeal, mix it into smoothies, or incorporate it into baked goods for a delicious twist. It’s also fantastic in savory recipes like curries, stews, and the aforementioned pork cutlets.
Apart from its culinary uses, Ceylon cinnamon offers numerous health benefits. Ceylon cinnamon capsules are a convenient way to enjoy these benefits. These supplements are packed with antioxidants and have anti-inflammatory properties. If you’re interested in the advantages, the Ceylon cinnamon capsules can help with blood sugar regulation, improving digestion, and boosting overall health. For those wondering about the benefits, dosage, and where to buy the best supplements, it’s recommended to take a look at reputable online stores that specialize in natural health products. The suggested dosage varies, so always follow the manufacturer’s instructions or consult with a healthcare professional.
Whether you’re cooking up a delicious meal or looking to enhance your health, Ceylon cinnamon is a versatile and beneficial spice to have on hand. Enjoy exploring its uses and benefits in your kitchen and beyond!
Discovered an article that will surely interest you Р I recommend checking it out http://raussga.flybb.ru/viewtopic.php?f=12&t=2054
гардеробные системы недорого москва
Thanks for sharing pg
https://www.pages24.com/signup
Welcome to the ultimate destination for premium Ceylon cinnamon products! Our e-commerce store offers a curated selection of high-quality Ceylon cinnamon items, sourced directly from the lush landscapes of Sri Lanka. Whether you’re looking to enhance your culinary creations or boost your health, we’ve got you covered.
Our Products
Ceylon Cinnamon Powder: Known for its sweet and delicate flavor, our pure Ceylon cinnamon powder is perfect for baking, cooking, and adding a touch of spice to your favorite beverages. It’s a versatile pantry staple that elevates both sweet and savory dishes.
Ceylon Cinnamon Sticks: Ideal for infusing flavor into teas, stews, and desserts, our Ceylon cinnamon sticks are a must-have for any kitchen. Unlike the more common Cassia cinnamon, Ceylon cinnamon sticks offer a subtler, more refined taste.
Ceylon Cinnamon Capsules: Packed with health benefits, our Ceylon cinnamon capsules are a convenient way to support your wellness routine. These supplements are rich in antioxidants and have anti-inflammatory properties, making them a great addition to your daily regimen.
Ceylon Cinnamon Tea Bags: Enjoy the soothing and aromatic experience of Ceylon cinnamon tea. Our tea bags are filled with the finest Ceylon cinnamon, providing a calming and flavorful cup of tea that’s perfect any time of the day.
Cinnamon Body Care: Indulge in our range of cinnamon-infused body care products, including cinnamon lotion and cinnamon shampoo. These items harness the natural properties of Ceylon cinnamon to nourish and rejuvenate your skin and hair.
Came across an interesting article, worth a glance https://burokaren.com.ua/deshevoe-taksi-kak-vybrat-i-gde-najti/
https://medium.com/@seonza100/cinnamon-pork-cutlets-recipe-quick-and-flavorful-6d1bd67df25a
If you’re a fan of unique and flavorful dishes, you must try the Cinnamon Pork Cutlets Recipe. This delightful recipe brings out the best in pork with the warm, aromatic touch of cinnamon. For the best results, make sure to use Ceylon cinnamon sticks instead of the more common Cassia cinnamon. Wondering about the difference? When it comes to Ceylon Cinnamon Sticks vs. Cassia Cinnamon, Ceylon cinnamon is known for its sweeter, more delicate flavor, while Cassia has a stronger, more pungent taste. This distinction makes Ceylon the preferred choice for dishes where a subtle spice is desired.
Using Ceylon cinnamon powder in your cooking can elevate your meals to new heights. But do you know how to use Ceylon cinnamon powder in your favorite recipes? This versatile spice can be added to both sweet and savory dishes. Sprinkle it on your morning oatmeal, mix it into smoothies, or incorporate it into baked goods for a delicious twist. It’s also fantastic in savory recipes like curries, stews, and the aforementioned pork cutlets.
Apart from its culinary uses, Ceylon cinnamon offers numerous health benefits. Ceylon cinnamon capsules are a convenient way to enjoy these benefits. These supplements are packed with antioxidants and have anti-inflammatory properties. If you’re interested in the advantages, the Ceylon cinnamon capsules can help with blood sugar regulation, improving digestion, and boosting overall health. For those wondering about the benefits, dosage, and where to buy the best supplements, it’s recommended to take a look at reputable online stores that specialize in natural health products. The suggested dosage varies, so always follow the manufacturer’s instructions or consult with a healthcare professional.
Whether you’re cooking up a delicious meal or looking to enhance your health, Ceylon cinnamon is a versatile and beneficial spice to have on hand. Enjoy exploring its uses and benefits in your kitchen and beyond!
https://www.cylex.us.com/company/druera-37602055.html
Welcome to the ultimate destination for premium Ceylon cinnamon products! Our e-commerce store offers a curated selection of high-quality Ceylon cinnamon items, sourced directly from the lush landscapes of Sri Lanka. Whether you’re looking to enhance your culinary creations or boost your health, we’ve got you covered.
Our Products
Ceylon Cinnamon Powder: Known for its sweet and delicate flavor, our pure Ceylon cinnamon powder is perfect for baking, cooking, and adding a touch of spice to your favorite beverages. It’s a versatile pantry staple that elevates both sweet and savory dishes.
Ceylon Cinnamon Sticks: Ideal for infusing flavor into teas, stews, and desserts, our Ceylon cinnamon sticks are a must-have for any kitchen. Unlike the more common Cassia cinnamon, Ceylon cinnamon sticks offer a subtler, more refined taste.
Ceylon Cinnamon Capsules: Packed with health benefits, our Ceylon cinnamon capsules are a convenient way to support your wellness routine. These supplements are rich in antioxidants and have anti-inflammatory properties, making them a great addition to your daily regimen.
Ceylon Cinnamon Tea Bags: Enjoy the soothing and aromatic experience of Ceylon cinnamon tea. Our tea bags are filled with the finest Ceylon cinnamon, providing a calming and flavorful cup of tea that’s perfect any time of the day.
Cinnamon Body Care: Indulge in our range of cinnamon-infused body care products, including cinnamon lotion and cinnamon shampoo. These items harness the natural properties of Ceylon cinnamon to nourish and rejuvenate your skin and hair.
http://maps.google.co.in/url?q=http://l96309jg.beget.tech/user/nbBut/
https://yuzhnoukrainsk.pogovorim.su/viewtopic.php?id=11283#p30233
Всем привет!
Хотите узнать, какие игры в нев ретро казино считаются лучшими по отзывам реальных игроков? Я собрал для вас топ-10 игр, которые неизменно собирают положительные отзывы. Здесь есть всё: от классических слотов до современных игр с увлекательным сюжетом. Проверьте сами, стоит ли тратить на них своё время и деньги!
Если вас как и меня интересует new retro казино на деньги, приложение new retro казино или new retro казино промокод, то смотрите здесь https://t.me/s/NewRetroCasino_promokod подробнее об казино retro на деньги
[url=https://joho5.biz/2024/05/29/your-ultimate-online-casino-resource]joho5.biz[/url]
Удачи и профитов!
retro casino актуальное зеркало
промокод при пополнении нью ретро казино
ретро казино личный кабинет
промокрл в нев ретро казино
нью ретро казино промокоды
как пожаловаться на сайт мошенников [url=pozhalovatsya-na-moshennikov.ru]как пожаловаться на сайт мошенников[/url] .
Select our signature remedy and say goodbye to the old occasions with affordability, security and efficiency.
My web page :: http://camillacastro.us/forums/viewtopic.php?id=373304
На канале [url=https://t.me/s/novuy_zaim_sankt_peterbeug]Новые займы в СПБ[/url] собраны самые свежие и выгодные предложения по займам на карту. Мы сотрудничаем с новыми МФО, готовыми выдать займы каждому от 18 лет, независимо от кредитной истории и занятости. Получите до 30 000 рублей на карту. Многие компании предлагают первый займ под 0%, что делает его еще более привлекательным. Следите за нашими обновлениями и находите самые лучшие условия для получения займа.
https://ezlocal.com/de/wilmington/food-service/0916359606
Welcome to the ultimate destination for premium Ceylon cinnamon products! Our e-commerce store offers a curated selection of high-quality Ceylon cinnamon items, sourced directly from the lush landscapes of Sri Lanka. Whether you’re looking to enhance your culinary creations or boost your health, we’ve got you covered.
Our Products
Ceylon Cinnamon Powder: Known for its sweet and delicate flavor, our pure Ceylon cinnamon powder is perfect for baking, cooking, and adding a touch of spice to your favorite beverages. It’s a versatile pantry staple that elevates both sweet and savory dishes.
Ceylon Cinnamon Sticks: Ideal for infusing flavor into teas, stews, and desserts, our Ceylon cinnamon sticks are a must-have for any kitchen. Unlike the more common Cassia cinnamon, Ceylon cinnamon sticks offer a subtler, more refined taste.
Ceylon Cinnamon Capsules: Packed with health benefits, our Ceylon cinnamon capsules are a convenient way to support your wellness routine. These supplements are rich in antioxidants and have anti-inflammatory properties, making them a great addition to your daily regimen.
Ceylon Cinnamon Tea Bags: Enjoy the soothing and aromatic experience of Ceylon cinnamon tea. Our tea bags are filled with the finest Ceylon cinnamon, providing a calming and flavorful cup of tea that’s perfect any time of the day.
Cinnamon Body Care: Indulge in our range of cinnamon-infused body care products, including cinnamon lotion and cinnamon shampoo. These items harness the natural properties of Ceylon cinnamon to nourish and rejuvenate your skin and hair.
Привет, друзья!
Сегодня хочу рассказать о своём опыте поиска идеального онлайн-казино. Долго искал площадку, друзья советомали обратить внимание на casino sykaaa официальный сайт или зеркало sykaaa casino. И вот однажды, после поиска по запросу промокод для казино sykaaa, наткнулся на сукааа казино официальный, прочитав об этом по ссылке https://t.me/csykaa Это оказалось находкой! Что же впечатлило в этом казино?
– Интерфейс – удобный и понятный. Всё интуитивно.
– Выплаты – быстрые и без задержек.
– Поддержка – работает круглосуточно.
– Игры – огромный выбор. Хотите классические слоты или живое общение с дилерами? Всё это здесь.
– Бонусы – щедрые. Приветственные, на первый депозит, фриспины.
Теперь я играю только на sykaaa casino промокод. Устали искать идеальное казино? Очень советую заглянуть сюда.
Если вы уже здесь играете, поделитесь впечатлениями в комментариях! Расскажите о своих успехах и неудачах.
Готовы испытать удачу? Желаю всем удачи и крупных выигрышей!??
[url=https://fialan-china.ru/2024/05/28/Как-эффективно-использовать-sykaaa]fialan-china.ru[/url]
сукаа казино официальный
sykaaa казино официальный сайт
игровые аппараты sykaa
syka casino зеркало
актуальное зеркало сукааа
https://www.quora.com/profile/DRUERA-2
Welcome to the ultimate destination for premium Ceylon cinnamon products! Our e-commerce store offers a curated selection of high-quality Ceylon cinnamon items, sourced directly from the lush landscapes of Sri Lanka. Whether you’re looking to enhance your culinary creations or boost your health, we’ve got you covered.
Our Products
Ceylon Cinnamon Powder: Known for its sweet and delicate flavor, our pure Ceylon cinnamon powder is perfect for baking, cooking, and adding a touch of spice to your favorite beverages. It’s a versatile pantry staple that elevates both sweet and savory dishes.
Ceylon Cinnamon Sticks: Ideal for infusing flavor into teas, stews, and desserts, our Ceylon cinnamon sticks are a must-have for any kitchen. Unlike the more common Cassia cinnamon, Ceylon cinnamon sticks offer a subtler, more refined taste.
Ceylon Cinnamon Capsules: Packed with health benefits, our Ceylon cinnamon capsules are a convenient way to support your wellness routine. These supplements are rich in antioxidants and have anti-inflammatory properties, making them a great addition to your daily regimen.
Ceylon Cinnamon Tea Bags: Enjoy the soothing and aromatic experience of Ceylon cinnamon tea. Our tea bags are filled with the finest Ceylon cinnamon, providing a calming and flavorful cup of tea that’s perfect any time of the day.
Cinnamon Body Care: Indulge in our range of cinnamon-infused body care products, including cinnamon lotion and cinnamon shampoo. These items harness the natural properties of Ceylon cinnamon to nourish and rejuvenate your skin and hair.
Heya! I’m at work surfing around your blog from my new iphone!
Just wanted to say I love reading your blog and look forward to all your posts!
Carry on the outstanding work!
https://google.com.jm/url?q=https://instarating.ru/viewtopic.php?id=4431
https://de-wilmington.cataloxy.us/firms/www.druera.com.htm
Welcome to the ultimate destination for premium Ceylon cinnamon products! Our e-commerce store offers a curated selection of high-quality Ceylon cinnamon items, sourced directly from the lush landscapes of Sri Lanka. Whether you’re looking to enhance your culinary creations or boost your health, we’ve got you covered.
Our Products
Ceylon Cinnamon Powder: Known for its sweet and delicate flavor, our pure Ceylon cinnamon powder is perfect for baking, cooking, and adding a touch of spice to your favorite beverages. It’s a versatile pantry staple that elevates both sweet and savory dishes.
Ceylon Cinnamon Sticks: Ideal for infusing flavor into teas, stews, and desserts, our Ceylon cinnamon sticks are a must-have for any kitchen. Unlike the more common Cassia cinnamon, Ceylon cinnamon sticks offer a subtler, more refined taste.
Ceylon Cinnamon Capsules: Packed with health benefits, our Ceylon cinnamon capsules are a convenient way to support your wellness routine. These supplements are rich in antioxidants and have anti-inflammatory properties, making them a great addition to your daily regimen.
Ceylon Cinnamon Tea Bags: Enjoy the soothing and aromatic experience of Ceylon cinnamon tea. Our tea bags are filled with the finest Ceylon cinnamon, providing a calming and flavorful cup of tea that’s perfect any time of the day.
Cinnamon Body Care: Indulge in our range of cinnamon-infused body care products, including cinnamon lotion and cinnamon shampoo. These items harness the natural properties of Ceylon cinnamon to nourish and rejuvenate your skin and hair.
I got this website from my friend who told me about this web
page and now this time I am browsing this web site and reading very informative articles here.
Way cool! Some extremely valid points! I appreciate you penning this write-up plus the rest of the website is very
good.
Pro88
Pro88
https://www.merchantcircle.com/druera-wilmington-de
Welcome to the ultimate destination for premium Ceylon cinnamon products! Our e-commerce store offers a curated selection of high-quality Ceylon cinnamon items, sourced directly from the lush landscapes of Sri Lanka. Whether you’re looking to enhance your culinary creations or boost your health, we’ve got you covered.
Our Products
Ceylon Cinnamon Powder: Known for its sweet and delicate flavor, our pure Ceylon cinnamon powder is perfect for baking, cooking, and adding a touch of spice to your favorite beverages. It’s a versatile pantry staple that elevates both sweet and savory dishes.
Ceylon Cinnamon Sticks: Ideal for infusing flavor into teas, stews, and desserts, our Ceylon cinnamon sticks are a must-have for any kitchen. Unlike the more common Cassia cinnamon, Ceylon cinnamon sticks offer a subtler, more refined taste.
Ceylon Cinnamon Capsules: Packed with health benefits, our Ceylon cinnamon capsules are a convenient way to support your wellness routine. These supplements are rich in antioxidants and have anti-inflammatory properties, making them a great addition to your daily regimen.
Ceylon Cinnamon Tea Bags: Enjoy the soothing and aromatic experience of Ceylon cinnamon tea. Our tea bags are filled with the finest Ceylon cinnamon, providing a calming and flavorful cup of tea that’s perfect any time of the day.
Cinnamon Body Care: Indulge in our range of cinnamon-infused body care products, including cinnamon lotion and cinnamon shampoo. These items harness the natural properties of Ceylon cinnamon to nourish and rejuvenate your skin and hair.
That is very attention-grabbing, You are a very skilled blogger. I have joined your feed and stay up for searching for extra of your great post. Additionally, I have shared your web site in my social networks
xemgiai.com/phap-luat-la-gi
bouffordca.com/Emailscam.htm
pmk-polymer.ru/content/kontakty
darknews.ru/page/34
microstockhowto.com/tag/community/
вавада vavadaa
https://www.bbb.org/get-listed/business
Welcome to the ultimate destination for premium Ceylon cinnamon products! Our e-commerce store offers a curated selection of high-quality Ceylon cinnamon items, sourced directly from the lush landscapes of Sri Lanka. Whether you’re looking to enhance your culinary creations or boost your health, we’ve got you covered.
Our Products
Ceylon Cinnamon Powder: Known for its sweet and delicate flavor, our pure Ceylon cinnamon powder is perfect for baking, cooking, and adding a touch of spice to your favorite beverages. It’s a versatile pantry staple that elevates both sweet and savory dishes.
Ceylon Cinnamon Sticks: Ideal for infusing flavor into teas, stews, and desserts, our Ceylon cinnamon sticks are a must-have for any kitchen. Unlike the more common Cassia cinnamon, Ceylon cinnamon sticks offer a subtler, more refined taste.
Ceylon Cinnamon Capsules: Packed with health benefits, our Ceylon cinnamon capsules are a convenient way to support your wellness routine. These supplements are rich in antioxidants and have anti-inflammatory properties, making them a great addition to your daily regimen.
Ceylon Cinnamon Tea Bags: Enjoy the soothing and aromatic experience of Ceylon cinnamon tea. Our tea bags are filled with the finest Ceylon cinnamon, providing a calming and flavorful cup of tea that’s perfect any time of the day.
Cinnamon Body Care: Indulge in our range of cinnamon-infused body care products, including cinnamon lotion and cinnamon shampoo. These items harness the natural properties of Ceylon cinnamon to nourish and rejuvenate your skin and hair.
растение кат семена купить
безопасно,
Современное оборудование и материалы, для вашего уверенного улыбки,
Современные методы стоматологии, для вашей улыбки,
Комфортные условия и дружественный персонал, для вашего комфорта и уверенности,
Инновационные методы стоматологии, для вашего комфорта и уверенности,
Профессиональная гигиена полости рта, для вашего долгосрочного удовлетворения,
Современное лечение заболеваний полости рта, для вашего комфорта и удовлетворения
стоматологія клініка [url=https://stomatologichnaklinikafghy.ivano-frankivsk.ua/]стоматологія клініка[/url] .
[url=https://kraker14at.com]Kraken13.at вход[/url] – как зайти на kraken kraken onion site, kraken официальный сайт зеркало
[url=https://volna.la]волна даркнет[/url] – volna онион, волна даркнет ссылка
https://terra-clean.ru/
https://damntroublemaker.com/
https://bizidex.com/en/druera-retail-537772
Welcome to the ultimate destination for premium Ceylon cinnamon products! Our e-commerce store offers a curated selection of high-quality Ceylon cinnamon items, sourced directly from the lush landscapes of Sri Lanka. Whether you’re looking to enhance your culinary creations or boost your health, we’ve got you covered.
Our Products
Ceylon Cinnamon Powder: Known for its sweet and delicate flavor, our pure Ceylon cinnamon powder is perfect for baking, cooking, and adding a touch of spice to your favorite beverages. It’s a versatile pantry staple that elevates both sweet and savory dishes.
Ceylon Cinnamon Sticks: Ideal for infusing flavor into teas, stews, and desserts, our Ceylon cinnamon sticks are a must-have for any kitchen. Unlike the more common Cassia cinnamon, Ceylon cinnamon sticks offer a subtler, more refined taste.
Ceylon Cinnamon Capsules: Packed with health benefits, our Ceylon cinnamon capsules are a convenient way to support your wellness routine. These supplements are rich in antioxidants and have anti-inflammatory properties, making them a great addition to your daily regimen.
Ceylon Cinnamon Tea Bags: Enjoy the soothing and aromatic experience of Ceylon cinnamon tea. Our tea bags are filled with the finest Ceylon cinnamon, providing a calming and flavorful cup of tea that’s perfect any time of the day.
Cinnamon Body Care: Indulge in our range of cinnamon-infused body care products, including cinnamon lotion and cinnamon shampoo. These items harness the natural properties of Ceylon cinnamon to nourish and rejuvenate your skin and hair.
лучшие вебкам студии https://studio-milano.ru/
рапэ shawandawa kapayuba
гарантированно,
Лучшие стоматологи города, для поддержания здоровья рта,
Профессиональное лечение и консультации, для вашего уверенного выбора,
Индивидуальный подход к каждому пациенту, для вашей радости и улыбки,
Инновационные методы стоматологии, для вашего комфорта и уверенности,
Профессиональная гигиена полости рта, для вашего долгосрочного удовлетворения,
Современное лечение заболеваний полости рта, для вашего здоровья и благополучия
безболісне лікування зубів [url=https://stomatologichnaklinikafghy.ivano-frankivsk.ua/]безболісне лікування зубів[/url] .
клининговые фирмы
http://www.askmap.net/location/6924511/united-states/druera
Welcome to the ultimate destination for premium Ceylon cinnamon products! Our e-commerce store offers a curated selection of high-quality Ceylon cinnamon items, sourced directly from the lush landscapes of Sri Lanka. Whether you’re looking to enhance your culinary creations or boost your health, we’ve got you covered.
Our Products
Ceylon Cinnamon Powder: Known for its sweet and delicate flavor, our pure Ceylon cinnamon powder is perfect for baking, cooking, and adding a touch of spice to your favorite beverages. It’s a versatile pantry staple that elevates both sweet and savory dishes.
Ceylon Cinnamon Sticks: Ideal for infusing flavor into teas, stews, and desserts, our Ceylon cinnamon sticks are a must-have for any kitchen. Unlike the more common Cassia cinnamon, Ceylon cinnamon sticks offer a subtler, more refined taste.
Ceylon Cinnamon Capsules: Packed with health benefits, our Ceylon cinnamon capsules are a convenient way to support your wellness routine. These supplements are rich in antioxidants and have anti-inflammatory properties, making them a great addition to your daily regimen.
Ceylon Cinnamon Tea Bags: Enjoy the soothing and aromatic experience of Ceylon cinnamon tea. Our tea bags are filled with the finest Ceylon cinnamon, providing a calming and flavorful cup of tea that’s perfect any time of the day.
Cinnamon Body Care: Indulge in our range of cinnamon-infused body care products, including cinnamon lotion and cinnamon shampoo. These items harness the natural properties of Ceylon cinnamon to nourish and rejuvenate your skin and hair.
онлайн вебкам студия https://studio-milano.ru/
Superb post however , I was wondering if you could write a litte more on this topic? I’d be very thankful if you could elaborate a little bit more. Thank you!
cialis 5mg 28 comprimidos
http://maps.g.cn/url?q=http://surl.li/sjyvf
https://www.facebook.com/druera.store
Welcome to the ultimate destination for premium Ceylon cinnamon products! Our e-commerce store offers a curated selection of high-quality Ceylon cinnamon items, sourced directly from the lush landscapes of Sri Lanka. Whether you’re looking to enhance your culinary creations or boost your health, we’ve got you covered.
Our Products
Ceylon Cinnamon Powder: Known for its sweet and delicate flavor, our pure Ceylon cinnamon powder is perfect for baking, cooking, and adding a touch of spice to your favorite beverages. It’s a versatile pantry staple that elevates both sweet and savory dishes.
Ceylon Cinnamon Sticks: Ideal for infusing flavor into teas, stews, and desserts, our Ceylon cinnamon sticks are a must-have for any kitchen. Unlike the more common Cassia cinnamon, Ceylon cinnamon sticks offer a subtler, more refined taste.
Ceylon Cinnamon Capsules: Packed with health benefits, our Ceylon cinnamon capsules are a convenient way to support your wellness routine. These supplements are rich in antioxidants and have anti-inflammatory properties, making them a great addition to your daily regimen.
Ceylon Cinnamon Tea Bags: Enjoy the soothing and aromatic experience of Ceylon cinnamon tea. Our tea bags are filled with the finest Ceylon cinnamon, providing a calming and flavorful cup of tea that’s perfect any time of the day.
Cinnamon Body Care: Indulge in our range of cinnamon-infused body care products, including cinnamon lotion and cinnamon shampoo. These items harness the natural properties of Ceylon cinnamon to nourish and rejuvenate your skin and hair.
Hi, of course this article is truly fastidious and I have learned lot of things from it about blogging. thanks.
portaltrav.ru/product/conditioner/wall-air-conditioners/electrolux-eacs-07hlo-n3-16y/
lolipopnews.ru/page/9
http://www.sendungsverfolgung24.org/forum/topic/dfdg234dsfsd/?part=9324
weekofsport.ru/page/10
цдод.рф/forum/topic.php?forum=3&topic=633
[url=https://saffelychange.com]bestchange netex24[/url] – обменник криптовалют, bestchange safelychange обменник
Лучшие обивочные материалы для салона автомобиля в Москве.
Что нужно знать перед перетяжкой салона автомобиля в Москве?
Стоимость перетяжки салона автомобиля [url=http://www.poshiv-avtosalona.ru]http://www.poshiv-avtosalona.ru[/url] .
Выбор профессионалов: лучшие автоцентры детейлинга в Москве.
Стоимость детейлинга автомобилей [url=http://www.detailing-uslugi.ru]http://www.detailing-uslugi.ru[/url] .
безопасно,
Современное оборудование и материалы, для крепких и здоровых зубов,
Специализированная помощь по доступным ценам, для вашего удобства,
Бесплатная консультация и диагностика, для вашего комфорта и уверенности,
Инновационные методы стоматологии, для вашего комфорта и уверенности,
Профессиональная гигиена полости рта, для вашего долгосрочного удовлетворения,
Индивидуальный план лечения для каждого пациента, для вашей уверенной улыбки
стоматологічна лікарня [url=https://stomatologichnaklinikafghy.ivano-frankivsk.ua/]https://stomatologichnaklinikafghy.ivano-frankivsk.ua/[/url] .
https://www.showmelocal.com/profile.aspx?bid=23408058
Welcome to the ultimate destination for premium Ceylon cinnamon products! Our e-commerce store offers a curated selection of high-quality Ceylon cinnamon items, sourced directly from the lush landscapes of Sri Lanka. Whether you’re looking to enhance your culinary creations or boost your health, we’ve got you covered.
Our Products
Ceylon Cinnamon Powder: Known for its sweet and delicate flavor, our pure Ceylon cinnamon powder is perfect for baking, cooking, and adding a touch of spice to your favorite beverages. It’s a versatile pantry staple that elevates both sweet and savory dishes.
Ceylon Cinnamon Sticks: Ideal for infusing flavor into teas, stews, and desserts, our Ceylon cinnamon sticks are a must-have for any kitchen. Unlike the more common Cassia cinnamon, Ceylon cinnamon sticks offer a subtler, more refined taste.
Ceylon Cinnamon Capsules: Packed with health benefits, our Ceylon cinnamon capsules are a convenient way to support your wellness routine. These supplements are rich in antioxidants and have anti-inflammatory properties, making them a great addition to your daily regimen.
Ceylon Cinnamon Tea Bags: Enjoy the soothing and aromatic experience of Ceylon cinnamon tea. Our tea bags are filled with the finest Ceylon cinnamon, providing a calming and flavorful cup of tea that’s perfect any time of the day.
Cinnamon Body Care: Indulge in our range of cinnamon-infused body care products, including cinnamon lotion and cinnamon shampoo. These items harness the natural properties of Ceylon cinnamon to nourish and rejuvenate your skin and hair.
There is definately a great deal to find out about this topic.
I love all of the points you have made.
Superb postings Thanks a lot!
Also visit my web site; https://wiki.nars2000.org/index.php?title=Learn_About_Classical_Tourist_Attractions_To_See_Which_Are_Very_Likely_Unknown_By_Holiday_Makers_When_In_Paris_A_City_Of_Lights_And_Love
Found a captivating read that I’d like to recommend to you https://www.silverscreenandroll.com/users/worksale555
Hi, I do believe this is an excellent blog.
I stumbledupon it 😉 I may return once again since
I bookmarked it. Money and freedom is the greatest way to
change, may you be rich and continue to help other people.
Found an article that is worth reading – it’s really interesting! https://opencollective.com/chatruletka
[url=https://t.me/ozempic_kupit_prodaja]трулисити раствор +для инъекций отзывы[/url] – мунжаро лекарство купить, лираглутид купить +в спб
I do not even understand how I finished up here, however
I believed this post used to be good. I do not know who you might be however definitely you’re going to a famous blogger
if you happen to are not already. Cheers!
Regards, I appreciate it.
newsmiamigardens.com
chinataste1.com
What’s up, its nice article about media print, we all be familiar with media is a
great source of information.
Your method of describing everything in this piece of writing is
truly pleasant, every one be capable of effortlessly know it,
Thanks a lot.
IFran.ru – это онлайн-проект, созданный для повышения искренности и прозрачности рынка франчайзинга в РФ. Сервис анализирует и собирает данные из различных источников, после предоставляет информацию в единообразной и структурированной форме. https://www.ifran.ru – сайт, где у вас есть возможность узнать о том, что из себя представляет франчайзинг. Здесь имеются интересные статьи, обзоры и рейтинги. Благодаря возможностям нашего портала потенциальные франчайзи могут сделать выбор в пользу высококачественных франшизеров.
http://maps.google.is/url?q=http://surl.li/siggy
Предлагаем для вас провести консультацию (аудит) по подъему продаж равным образом прибыли в вашем бизнесе. Формат аудита: индивидуальная встреча или онлайн конференция по скайпу. Делая очевидные, но обыкновенные действия, результат от ВАШЕГО коммерциала можно увеличить в несколькио раз. В нашем запасе более 100 испытанных практических методик повышения результатов и прибыли. В зависимости от вашего коммерциала подберем для вас максимально крепкие и начнем постепенно претворять в жизнь.
-https://interestbook.ru/
In 2007, the Oregon Lottery released a Windows Sidebar gadget that displays the winning numbers for https://cdn.feather.blog/?src=https://score.ws/%EC%8A%A4%ED%94%BC%EB%93%9C%ED%82%A4%EB%85%B8-%EB%B9%A0%EB%A5%B8-%EA%B2%8C%EC%9E%84%EA%B3%BC-%EC%A6%89%EA%B0%81%EC%A0%81%EC%9D%B8-%ED%9D%A5%EB%B6%84/ in genuine-time.
https://bofh69.com/wiki/index.php/Fast_Burn_Keto:_Real_User_Reviews_And_Success_Stories is a dietary supplement that claims to help individuals achieve their weight loss goals by promoting ketosis, a metabolic state in which the body burns fat for energy instead of carbohydrates.
What’s up!
What an fantastic post!
Can I scrape it and share this with my community subscribers?
My group is about Korean 야동
you are interested, feel free to visit my group and have a look.
Thanks and Keep up the good work!
Советы по оптимизации продвижению.
Информация о том как взаимодействовать с низкочастотными запросами и как их подбирать
Стратегия по работе в соперничающей нише.
У меня есть постоянных клиентов взаимодействую с 3 компаниями, есть что рассказать.
Ознакомьтесь мой аккаунт, на 31 мая 2024г
количество завершённых задач 2181 только на этом сайте.
Консультация только устно, без скриншотов и отчетов.
Время консультации указано 2 ч, но по факту всегда на связи без строгой привязки ко времени.
Как работать с программным обеспечением это уже другая история, консультация по работе с софтом договариваемся отдельно в специальном услуге, узнаем что требуется при общении.
Всё без суеты на расслабоне не спеша
To get started, the seller needs:
Мне нужны сведения от телеграмм каналов для контакта.
общение только устно, переписываться недостаточно времени.
Сб и воскресенья выходные
[url=https://blacksprut4web.com/]black sprut[/url] – blacksprut официальный сайт, как зайти на blacksprut
สล็อตเว็บตรง
купон все инструменты
услуга мытье окон
This info is worth everyone’s attention. Where can I find out
more?
Cool blog! Is your theme custom made or did you download it from somewhere?
A theme like yours with a few simple adjustements would really make my blog shine.
Please let me know where you got your theme. Many thanks
[url=https://mounjaro-apteka.ru]ozempic 1 мг[/url] – тирзепатид мунджаро купить, оземпик купить москва аптека
ремонт телефонов
промокод всеинструменты
Good day 🙂
What a nice article!
Can I scrape this and share it with my site members?
My community is about Korean 한국야동
If ever your interested, feel free to come to my channel and check it out.
Thank you and Keep up the good work!
продвижение сайтов в 10 москва [url=www.prodvizhenie-sajtov-v-moskve113.ru/]www.prodvizhenie-sajtov-v-moskve113.ru/[/url] .
https://mclean.su/
https://bi-cleaning.ru/
visit this web-site [url=https://potplayer.network]Pot player download[/url]
Кварцвиниловый ламинат: идеальное покрытие для вашего дома Кварцвиниловая плитка – это современное и популярное покрытие для пола, которое сочетает в себе прочность, долговечность и стильный внешний вид. Этот материал состоит из нескольких слоев, каждый из которых выполняет свою функцию, делая кварцвиниловый ламинат идеальным выбором для любого помещения. Купить кварцвиниловый ламинат на пол.
уборка после ремонта клининговой компанией цена
you’re in reality a good webmaster. The website loading velocity is amazing.
It seems that you are doing any distinctive trick.
Moreover, The contents are masterpiece. you have performed a fantastic process in this topic!
Кварц-виниловое напольное покрытие – это прочный и эстетичный материал, который становится все более популярным выбором для облицовки полов в помещениях. Благодаря своей устойчивости к истиранию, влаге и царапинам, кварц-винил подходит как для домашних, так и для коммерческих помещений. Его разнообразие дизайнов и цветов позволяет создавать уникальные интерьеры, а легкая укладка делает его отличным вариантом для ремонта и реконструкции. Кварцвиниловая плитка – напольное покрытие идеально подходит для тех, кто ценит сочетание стильного внешнего вида, практичности и долговечности. Виниловая плитка для пола купить в Москве
A gazebo with a breakdown on the lawn. If there mexicocities.net is a decorative lawn on the site, it can be installed on a gazebo with a floor so as not to harm the grass. The platform is made in the form of a metal profile, which is attached to several holes drilled in the soil.
продвижение сайтов в топ 10 [url=http://prodvizhenie-sajtov-v-moskve113.ru/]http://prodvizhenie-sajtov-v-moskve113.ru/[/url] .
купить диплом механика https://6landik-diploms.com
гарантированно,
Лучшие стоматологи города, для крепких и здоровых зубов,
Профессиональное лечение и консультации, для вашего удобства,
Бесплатная консультация и диагностика, для вашего здоровья и благополучия,
Эффективное лечение зубов и десен, для вашего комфорта и уверенности,
Профессиональная гигиена полости рта, для вашего комфорта и удовлетворения,
Заботливое отношение и внимательный подход, для вашего комфорта и удовлетворения
які зуби [url=https://stomatologichnaklinikafghy.ivano-frankivsk.ua/]які зуби[/url] .
[url=https://solarise6muu4darknet.com/]solaris ссылка[/url] – solaris ссылка, solaris даркнет
Hey there! I realize this is sort of off-topic however I
had to ask. Does operating a well-established website like yours require a lot of work?
I am brand new to running a blog but I do write
in my diary every day. I’d like to start a blog so I can share my experience and thoughts online.
Please let me know if you have any kind of suggestions or tips
for new aspiring blog owners. Thankyou!
эффективно,
Лучшие стоматологи города, для крепких и здоровых зубов,
Профессиональное лечение и консультации, для вашего удобства,
Индивидуальный подход к каждому пациенту, для вашего комфорта и уверенности,
Комплексное восстановление утраченных зубов, для вашего долгосрочного удовлетворения,
Экстренная помощь в любое время суток, для вашего здоровья и уверенности в себе,
Заботливое отношение и внимательный подход, для вашей уверенной улыбки
стоматологія дитяча [url=https://stomatologichnaklinikafghy.ivano-frankivsk.ua/]стоматологія дитяча[/url] .
Hello there, You have done an incredible job. I will certainly digg it and personally suggest to my friends. I am confident they’ll be benefited from this web site.
primerosauxilios.org/primeros-auxilios/que-es-y-como-curar-una-herida.php
http://www.otoritasnews.co.id/sedekah-cf/
23bileta.ru/index.html
angelteam.uv.ro/profile.php?mode=viewprofile&u=207852
elibot.gg/commands
эффективно,
Современное оборудование и материалы, для крепких и здоровых зубов,
Современные методы стоматологии, для вашего удобства,
Комфортные условия и дружественный персонал, для вашего здоровья и благополучия,
Эффективное лечение зубов и десен, для вашего здоровья и красоты улыбки,
Индивидуальный план лечения и профилактики, для вашего комфорта и удовлетворения,
Заботливое отношение и внимательный подход, для вашего комфорта и удовлетворения
дитяча стоматологічна [url=https://stomatologichnaklinikafghy.ivano-frankivsk.ua/]дитяча стоматологічна[/url] .
эффективно,
Индивидуальный подход к каждому пациенту, для крепких и здоровых зубов,
Специализированная помощь по доступным ценам, для вашего уверенного выбора,
Комфортные условия и дружественный персонал, для вашего здоровья и благополучия,
Эффективное лечение зубов и десен, для вашего комфорта и уверенности,
Профессиональная гигиена полости рта, для вашего здоровья и уверенности в себе,
Заботливое отношение и внимательный подход, для вашей уверенной улыбки
дитяча стоматологія франківськ [url=https://stomatologichnaklinikafghy.ivano-frankivsk.ua/]дитяча стоматологія франківськ[/url] .
aviator game real money [url=aviator-crash-game.ru]aviator game real money[/url] .
эффективно,
Индивидуальный подход к каждому пациенту, для поддержания здоровья рта,
Специализированная помощь по доступным ценам, для вашей улыбки,
Комфортные условия и дружественный персонал, для вашей радости и улыбки,
Инновационные методы стоматологии, для вашего здоровья и красоты улыбки,
Индивидуальный план лечения и профилактики, для вашего здоровья и уверенности в себе,
Индивидуальный план лечения для каждого пациента, для вашего здоровья и благополучия
стоматологія дитяча [url=https://stomatologichnaklinikafghy.ivano-frankivsk.ua/]стоматологія дитяча[/url] .
На нашем ресурсе вы найдете самую актуальную информацию о покупке и продаже недвижимого имущества.
Ознакомьтесь с такими темами, как [url=https://kadprof.ru/]квартира в новостройке[/url] и [url=https://kadprof.ru/]налоги на недвижимость[/url].
Мы поможем вам принять взвешенное решение при покупке или продаже жилья, а также предоставим актуальную информацию о рынке недвижимости.
Удобный поиск, актуальные объявления и полезные статьи – все это доступно у нас!
эффективно,
Индивидуальный подход к каждому пациенту, для крепких и здоровых зубов,
Современные методы стоматологии, для вашего удобства,
Бесплатная консультация и диагностика, для вашей радости и улыбки,
Эффективное лечение зубов и десен, для вашего долгосрочного удовлетворения,
Индивидуальный план лечения и профилактики, для вашего здоровья и уверенности в себе,
Индивидуальный план лечения для каждого пациента, для вашего комфорта и удовлетворения
послуги стоматології [url=https://stomatologichnaklinikafghy.ivano-frankivsk.ua/]послуги стоматології[/url] .
гарантированно,
Современное оборудование и материалы, для вашего уверенного улыбки,
Современные методы стоматологии, для вашего удобства,
Комфортные условия и дружественный персонал, для вашей радости и улыбки,
Комплексное восстановление утраченных зубов, для вашего комфорта и уверенности,
Индивидуальный план лечения и профилактики, для вашего здоровья и уверенности в себе,
Современное лечение заболеваний полости рта, для вашего комфорта и удовлетворения
дитяча стоматологія [url=https://stomatologichnaklinikafghy.ivano-frankivsk.ua/]дитяча стоматологія[/url] .
Came across an interesting article, I propose you have a look https://www.onthebanks.com/users/worksale555
заказ такси эконом новочеркасск https://taxi-novocherkassk.ru/
Reducing the cost of attracting job-career.com new customers. You can inexpensively retain existing customers through quality customer service. It’s much cheaper than constantly recruiting new people.
homebeachlove.com
эффективно,
Современное оборудование и материалы, для крепких и здоровых зубов,
Современные методы стоматологии, для вашей улыбки,
Комфортные условия и дружественный персонал, для вашей радости и улыбки,
Комплексное восстановление утраченных зубов, для вашего комфорта и уверенности,
Индивидуальный план лечения и профилактики, для вашего комфорта и удовлетворения,
Индивидуальный план лечения для каждого пациента, для вашей уверенной улыбки
видалення зубів [url=https://stomatologichnaklinikafghy.ivano-frankivsk.ua/]видалення зубів[/url] .
Ищете способ расслабиться и получить незабываемые впечатления? Мы https://t.me/intim_tmn72 предлагаем эксклюзивные встречи с привлекательными и профессиональными компаньонками. Конфиденциальность, комфорт и безопасность гарантированы. Позвольте себе наслаждение и отдых в приятной компании.
гарантированно,
Современное оборудование и материалы, для вашего уверенного улыбки,
Специализированная помощь по доступным ценам, для вашей улыбки,
Комфортные условия и дружественный персонал, для вашего комфорта и уверенности,
Инновационные методы стоматологии, для вашего долгосрочного удовлетворения,
Профессиональная гигиена полости рта, для вашего долгосрочного удовлетворения,
Заботливое отношение и внимательный подход, для вашей уверенной улыбки
стоматологічна клініка [url=https://stomatologichnaklinikafghy.ivano-frankivsk.ua/]https://stomatologichnaklinikafghy.ivano-frankivsk.ua/[/url] .
[url=https://mega555nets14.com/]mega darknet ссылка[/url] – mega sb вход, mega555net11 com
вызвать такси в новочеркасске https://zakaz-taxionline.ru/
Reducing the cost of attracting job-career.com new customers. You can inexpensively retain existing customers through quality customer service. It’s much cheaper than constantly recruiting new people.
go to website [url=https://notepad.network]Notepad download[/url]
Our team is pretty significant, and we are passionate about the operate that we do.
Feel free to visit my page; https://k12.instructure.com/eportfolios/680317/Home/__________
Займ с любой кредитной историей. Без подтверждения дохода. Вы остаётесь собственником. Без отказов. Быстрое оформление. Без скрытых комиссий [url=http://matkapital38.ru/]договор займа ип[/url]
our website [url=https://osu.digital]Osu[/url]
Успешное обучение с дипломом на заказ
Автор24 [url=https://author24.online/]сайт автор 24[/url] .
Хотите быть в курсе всех важных тем в области недвижимости?
На нашем сайте вы найдете много полезных статей о налогах на недвижимость, а также о регистрации квартиры через МФЦ.
Узнайте все, что вам необходимо для успешных сделок и принятия важных решений в сфере недвижимости.
https://prestizh-stroi.ru
Thank you, I’ve just been looking for info approximately this subject for a while and yours is the best I have discovered so far. But, what about the bottom line? Are you certain about the supply?
skazka.g-talk.ru/viewtopic.php?f=1&t=1679&p=1705
deanonnic.listbb.ru/viewtopic.php?t=360
http://www.ariawinebar.nyc/wv-contact.html
morskie-cruizy.ru/spez.html
bestcoolfun.ru/page/32
гарантированно,
Лучшие стоматологи города, для поддержания здоровья рта,
Специализированная помощь по доступным ценам, для вашего уверенного выбора,
Комфортные условия и дружественный персонал, для вашего здоровья и благополучия,
Инновационные методы стоматологии, для вашего комфорта и уверенности,
Экстренная помощь в любое время суток, для вашего комфорта и удовлетворения,
Современное лечение заболеваний полости рта, для вашей уверенной улыбки
здорові зуби [url=https://stomatologichnaklinikafghy.ivano-frankivsk.ua/]здорові зуби[/url] .
Outstanding post however I was wondering if you could write a litte more on this subject? I’d be very grateful if you could elaborate a little bit more. Appreciate it!
parenvarmii.ru/topic4065.html?view=previous
americanautotitleloan.com/lake-wylie-sc-title-loans
http://www.saluttunisia.com/jomsocial/groups/viewbulletin/143-za-skolko-mozhno-zakazat-diplom-vuza-sejchas.html?groupid=101
online-vuz.ru/viewNews/177/
myturtime.ru/page/47
На нашем сайте вы сможете найти все необходимые сведения о недвижимости – от бронирования жилья в новостройке до покупки недвижимости от застройщика.
Мы поможем вам выбрать лучшую квартиру в новостройке, расскажем, как не попасть в ловушку при выборе жилья и подскажем, как сэкономить время и деньги.
Заходите: https://quartz-rsk.ru
The case of ripple v. sec has been transferred to the Court of Appeals for the Second Circuit. court session on case https://boba-oppa.io/ marked a responsible moment in the legal confrontation for the status of xrp.
https://faina-cleaning.ru/
Vavada – топовая онлайн площадка, предлагающая широкий ассортимент интереснейших игровых аппаратов, призванных дать невероятные впечатления от азартных игр. С более чем 600 игровыми автоматами в базе сайта Вавада угодит каждому игроку.
[url=https://avtomaty-vavada.online/]игровые автоматы вавада[/url] – идеальный выбор для тех, кто ищет захватывающий и разного рода игровой опыт. С обширным каталогом, крутейшей графикой, щедрыми плюшками и безкомпромиссной репутацией Vavada дает бесконечные часы развлечений для игроков всех уровней.
I delight in, result in I discovered exactly what I was having a look for. You have ended my 4 day long hunt! God Bless you man. Have a nice day. Bye
mypenza.ru/forum/index.php?showtopic=54674&mode=linear
51.15.223.140/forum/member.php?tab=visitor_messaging&u=76509&page=6
muscle-bg.com/component/content/article/399-kolko-nasiteni-maznini-trqbva-da-qdem.html
kurovskoye.ru/index.html
http://www.fczulia.com/articulos/4330.html
[url=https://peaksview.me/ru]Аренда шале в горах Черногории[/url] – Дом для семейного отдыха в Жабляке, Шале в Черногории аренда
http://russa24-diploms-srednee.com
https://faina-cleaning.ru/
Excellent article. Keep posting such kind of information on your site. Im really impressed by your blog.
Hello there, You have done an incredible job. I will certainly digg it and in my opinion suggest to my friends. I’m sure they will be benefited from this site.
moysamogon.ru/comment-page-30/
foro.muelendhir.com/showthread.php?tid=4597&pid=19880&mode=threaded
weekinato.ru/page/13/
shockmusik.ru/page/7
ilonka.ru/user/robertgneida/
Good day 🙂
What a good blog!
Can I scrape this and share this with my site subscribers?
My blog is about Korean 출사모델
If you are interested, feel free to visit my blog
and have a look.
Thanks and Keep up the good work!
http://russa24-diploms-srednee.com
It’s awesome to visit this web page and reading the views of all friends regarding this paragraph,
while I am also eager of getting knowledge.
Hi there! This is my first comment here so I just wanted to give a quick shout out and say I truly enjoy reading through your blog posts. Can you suggest any other blogs/websites/forums that deal with the same topics? Appreciate it!
blogs.rufox.ru/~worksale/45652.htm
americanautotitleloan.com/lake-wylie-sc-title-loans
rem.4nmv.ru/forum/profile.php?action=show&member=5100
http://www.4yo.us/blogs/109456/%D0%98%D0%B7%D0%B1%D0%B0%D0%B2%D1%8C%D1%82%D0%B5%D1%81%D1%8C-%D0%BE%D1%82-%D1%81%D0%BB%D0%BE%D0%B6%D0%BD%D0%BE%D1%81%D1%82%D0%B5%D0%B9-%D1%81-%D1%83%D1%87%D0%B5%D0%B1%D0%BE%D0%B9-%D0%BA%D1%83%D0%BF%D0%B8%D1%82%D0%B5-%D0%B4%D0%B8%D0%BF%D0%BB%D0%BE%D0%BC
usadba.in.ua/index.php?pages=3&part=1
оформить справку
I want to to thank you for this great read!! I definitely loved every little bit of it.
I’ve got you saved as a favorite to check out new stuff you post…
great post to read [url=https://pal-world.org]Palworld download[/url]
Вавада – ведущая онлайн-платформа, предлагающая широкий ассортимент увлекательных игровых автоматов, призванных подарить невероятные впечатления от азартных игр. С более чем 600 наименованиями в базе сайта Vavada угодит каждому игроку.
[url=https://avtomaty-vavada.online/]игровые автоматы играть бесплатно вавада[/url] – отличный выбор для тех, кто ищет захватывающий и разного рода игровой опыт. С большой базой, крутейшей графикой, отличными плюшками и надежной репутацией Вавада обеспечивает бесконечные часы развлекухи для игроков любого уровня.
check these guys out [url=https://galaxy-swapper.org]galaxyswapper[/url]
Hey I know this is off topic but I was wondering if you knew of any widgets I could add to my blog that automatically tweet my newest twitter updates. I’ve been looking for a plug-in like this for quite some time and was hoping maybe you would have some experience with something like this. Please let me know if you run into anything. I truly enjoy reading your blog and I look forward to your new updates.
footballnewsguru.com/2013/08/goals-table.html
http://www.taijiacademy.com/newforum_down/profile.php?mode=viewprofile&u=300836
kanc4life.com.ua/index.php?links_exchange=yes&page=170&show_all=yes
iclassicscollection.com/question/2-765-644-44632-760-359-1149effective-lottery-spells-in-uk-to-win-jackpotmoney-rich-spells-caster-lottery-spells-quickpowerful-lottery-spellseasy-lottery-spells-i-13/
ooo-gotovie.ru/index.html
заказать справку
Vavada – ведущая онлайн-платформа, предлагающая широкий ассортимент увлекательных игровых аппаратов, призванных дать незабываемые впечатления от азартных игр. С более чем 600 игровыми автоматами в базе сайта Вавада угодит каждому игроку.
[url=https://avtomaty-vavada.online/]играть автоматы на деньги вавада[/url] – идеальный выбор для тех, кто ищет захватывающий и разного рода игровой опыт. С обширным каталогом, высококачественной графикой, щедрыми плюшками и безкомпромиссной репутацией Вавада обеспечивает бесконечные часы развлечений для игроков всех уровней.
игра лаки джет на деньги [url=https://1win-luckyjet-ru.ru/]1win-luckyjet-ru.ru[/url] .
Хотите узнать всё о процессе оформления квартиры в собственность?
Наш сайт предлагает вам самые информативные статьи на тему покупки и продажи недвижимости.
Здесь вы найдете ответы на все интересующие вас вопросы и получите подробную информацию о процессе оформления жилья.
https://krovlistroy.ru/
Китайские дорамы — это настоящие шедевры азиатского кинематографа, которые пленяют зрителей своими увлекательными сюжетами и яркими персонажами. На сайте [url=https://doramaserials.net/doramy-kitajskie/]doramaserials.net[/url] вы можете китайские дорамы смотреть онлайн в высоком качестве и без надоедливой рекламы. Независимо от того, интересуетесь ли вы романтическими историями, драмами или приключенческими сериалами, здесь каждый найдет что-то для себя.
Преимущество сайта doramaserials.net в том, что все [url=https://doramaserials.net/doramy-kitajskie/]китайские дорамы с русской озвучкой[/url], что делает просмотр еще более удобным и увлекательным. Окунитесь в мир восточной культуры и наслаждайтесь великолепной актерской игрой, не отвлекаясь на субтитры. Удобный интерфейс и регулярные обновления каталога позволят вам всегда быть в курсе последних новинок. Присоединяйтесь к миллионам поклонников китайских дорам и откройте для себя волшебный мир азиатских сериалов!
e-mallorca.com
The purpose of MRF hydraulic motors is to 365wyoming.com convert the energy that comes from the fluid flow into mechanical energy that rotates the output shaft. The scope of application of high-torque hydraulic motors MRF is extremely wide. They are used as part of injection molding machines; they are used to operate presses that process plastic. Hydraulic motors are used in woodworking and forging equipment, road equipment, and drilling rigs.
https://vk.com/kent_bonus
Hey there! I know this is kind of off-topic however I needed to ask. Does building a well-established website like yours require a large amount of work? I am completely new to running a blog however I do write in my diary everyday. I’d like to start a blog so I can share my experience and views online. Please let me know if you have any ideas or tips for new aspiring blog owners. Thankyou!
viglojdrc.org/fr/news/les-jeunes-transformes-pour-transformer-et-membres-du-cjadh
moysamogon.ru/comment-page-30/
http://www.kangas-industrial.com/e_feedback/index.asp?page=2769
ruskruiz.ru/contacts
web-lance.net/forums.php?m=posts&id=52993
Vavada – топовая онлайн площадка, предлагающая огромный каталог интереснейших игровых аппаратов, призванных дать невероятные впечатления от азартных игр. С более чем 600 наименованиями в базе сайта Вавада угодит каждому игроку.
[url=https://avtomaty-vavada.online/]игровые автоматы вавада играть на деньги[/url] – идеальный выбор для тех, кто ищет незабываемый и разного рода игровой опыт. С обширным каталогом, высококачественной графикой, щедрыми плюшками и безкомпромиссной репутацией Vavada обеспечивает безлимитные часы развлекухи для игроков любого уровня.
https://aisory.tech – платформа для создания AI Telegram-ботов. Наделяйте своих ботов способностями к естественному диалогу, генерации уникального контента и решению аналитических задач. Простой конструктор платформы делает создание умных чат-ботов доступным для любой компании.
купить квартиру недорого https://kupit-kvartirukzn.ru
120 Flirt com Reviews | flirt.com @ PissedConsumer
Flirt com has 120 reviews (average rating 1.1). Consumers say: Unauthorized money taken out of my account, It’s a $1.99 for one day drive I paid it you all took $5.99 out of my account two times and then took a extra $23.31 out of my account this is outrageous I did not ask for that I want my money… Flirt com has 1.1 star rating based on 41 customer reviews. Consumers are mostly dissatisfied Rating Distribution 95% negative 2% positive Pros: Everyone is fake, I have no idea, I-o nu folosesc. Cons: Scamming, All fake profile there, All kind. Recent recommendations regarding this business are as follows: “Don’t activate anything on this fake, fony and complicated site app.”, “Nothing to recommend at this stage”, “Do not use this site”, “Don’t pay for this scam it’s a SCAM”, “Do not have any type of business with this fraudulent company”. Most users ask Flirt com for the refund as a solution to their issues. Consumers are not pleased with Discounts and Special Offers and Diversity of Products or Services. The price level of this organization is high according to consumer reviews.They charged my debit card without authorization and continuously stated that it was 100% free, regardless of how I searched. This was unprofessional. I was very disappointed in every site I went to, stating that it was free.They took money in m’y bank account when.im.not on this site since febuary,i canceld and they took 47.90$ I wanna talk to.someone but when i call number not Unauthorized money taken out of my account It’s a $1.99 for one day drive I paid it you all took $5.99 out of my account two times and then took a extra $23.31 out of my account this is outrageous I did not ask for that I want my money back in Updated by user Jan 21, 2024
You can just take money out of those people’s account without them giving you permission to I want my money back I was only supposed to send me one dollar 99 cent no more no less I want my money thank you Original review Jan 21, 2024 False promotion you made me pay $36 for something that I thought I was paying $99 sent for for one day I did not want it for longer than one day I was just being curious and you stole everything in my account and I want it back thank you for understanding and putting my belongings back to the rightful beneficiary I’m trying to Deactivate this account. Every number you call is not on service. That tells a person automatically this is a *** company. Good thing I didn’t pay. Nonetheless, Unsubscribe me, Deactivate/Disqualify my account at once! Crazy part is, they know exactly what they’re doing! Pretending not to pay a person any mind. Don’t send me any emails, text messages, etc. Except to communicate that my account is done for. Thank you for your anticipated cooperation. You Bums! Preferred solution: Deactivate/Delete/Disqualify my account and picture. Do not use my private information at all. User’s recommendation: Don’t activate anything on this fake, fony and complicated site app. They charged my debit card without authorization and continuously stated that it was 100% free, regardless of how I searched. This was unprofessional. I was very disappointed in every site I went to, stating that it was free.This company is a scam they told me to pay $199 for a one-day pass and they charged me $5.99 two times and 23.31 time that’s $35 you cannot take money out of people’s account without telling them I ag I would like for my whole refund to be put back into my cash app account y’all had no reason and no business taking $35 out of my account and I only subscribe for $1.99 y’all took $5.99 out of my account two times in $23.31 out of my account once this is uncalled for and unnecessary and it is bad promotion please return my property back to the rightful beneficiary thank you Attempting to debit me after several messages that i dont have knowledge about the platform
May 24, 2024 I lost my cross bag containing my phone, ATM card and some valid ID card about two months ago or there about. When I eventually find it, I discovered that flirttender.com has been making attempt to debit me. I sent severally messages that I don’t know what the platform is all about neither do I have knowledge about it but to no avail. This debit attempt is getting much and I will like you to unsubscribe me or remove my bank information from your platform and please stop the attempt of debiting me. I never initiated this and I don’t know who use my Information for that purpose. Please, kindly do something to stop this. Kindly find the account details; 535522****694369 Moses Oyinloye Chatting but no actions . Stay away. ,…andmd….h&huhhhhhygfffdddfcfdffcffddrdddzddddxddddr c d dr Pros Too much chat with paid texters
Cons: Too much chat with paid texters Preferred solution: Full refund My teenage son, I got my card and used it on this site.I called him and asked him to please.Uh, refund me my money and to take my card off of this site.They did, and now they’re trying to charge my card again.For a monthly fee This site needs to be shut down and the police need to be involved in this this is ridiculous. This site is a scam I am being charged every month since I have used Flirty.com a couple of months ago. All I was paying for were credits to chat with other customers.I never knew that they were going to charge me a monthly service. What is the service for? All I needed were credits to use their services. So why are they charging me $12.99 a month? I’m not getting any credits for it. If that’s not included, then what is the $12.99 monthly charge for? I tried to call them today, and the phone number 888-884-**** is no longer in service. How can I get my credit card company to stop paying for this monthly charge that I didn’t sign up for? Preferred solution: I want my subscription cancel asap. I have no money in my account, but they are still allowed to charge me ? I have been trying to cancel the prescription for this site for 4 days the number that they give me the 884 **** does not work I’ve been trying to cancel it either saying you’re going to keep billing me I want to cancel the subscription but it just will not allow me to cancel it I talked to a consumer representative they said they were going to cancel it but they said they were going to give me a free month I said I didn’t need it but they said it’s free just use it we’re sorry about the inconvenience now I can’t I’m getting billed again for it I need to cancel this thing I’m not going to keep paying you guys man I’m not going to do it Needed to talk about £250 withdrawn from ROYAL BANK OF SCOTLAND, without my permission Took money without any explanation and I sent you an email that I wanted to cancel everything with you please cancel everything and delete my account I sent an email two days ago that I wanted to cancel everything and some how today I woke up and saw that you took money from my bank account with my right I want you to cancel the transaction you took and cancel everything I have on your page because I wanted from the first day to cancel everything so play CANCEL EVERYTHING I DONT WANNA SEE ANYTHING TAKING FROM MY CARD FROM YOUR COMPANY OR ELSE I WILL MAKE TO TELL MY LAWYER SND MAKE SOMETHING FROM REAL PLEASEEEEE CANCEL EVERYTHING WITH MY ACCOUNT
However, https://mycelium-wallet.org/ is a wallet that is more not available in the updated variant: for ios.
I’m extremely inspired together with your writing skills as well as
with the format in your weblog. Is that this a paid subject or did you modify it yourself?
Anyway keep up the nice high quality writing, it is rare to look a
great weblog like this one today..
[url=https://moscowneversleep.com]эскорт сервис[/url] – эскорт услуги москва, эскорт услуги заказать
жк казань купить квартиру https://kupit-kvartirukzn.ru
Согласование перепланировки зданий в Москве alma-stroi.ru
Перепланировка помещения — один из самых главных этапов в ремонте разных объектов. Но в нашей стране, она непременно должна быть законной и сделана по всем нормам. Мы знаем о перепланировках всё, изучите на сайте alma-stroi.ru прямо сейчас.
По вопросу [url=https://alma-stroi.ru/]узаконить перепланировку цена[/url] мы поможем Вам. Если у Вас уже проведена самовольная перепланировка без документов, то это не беда. Её просто возможно узаконить и спокойно пользоваться зданием. Не всегда расстановка комнат в квартире или промышленных помещениях удовлетворяет владельца. Но в последнее время, перепланировка просто превосходный выход из ситуации. Конечно, лучше всего ее проводить на этапе начального ремонта, но если этого не случилось, то её возможно сделать на любом этапе эксплуатирования.
Прайс на перепланировки можно увидеть на веб портале alma-stroi.ru или увидеть примеры готовых работ. Мы работаем в представленной теме уже большое количество лет и имеем множество довольных клиентов и готовых работ. К любому проекту имеем персональный подход и учитываем все желания заказчика. Также работаем строго в срок и по очень приемлемым ценам.
Оформить заказ на [url=https://alma-stroi.ru/]согласовать перепланировку здания[/url] можно прямо сейчас. Наши работники приедут к Вам для замера помещений и выявления размера работы. И после этого будет названа итоговая цена и дата выполнения работ. Перепланировка — это отличный шанс сделать свою жизнь комфортнее.
купить квартиру в новостройке от застройщика купить квартиру в новостройке от застройщика
[url=https://onion.moriartimega.com/]mega darknet ссылка[/url] – мега даркнет маркет ссылка, ссылка на мега тор
как пожаловаться на телефонных мошенников [url=https://pozhalovatsya-na-moshennikov.ru/]https://pozhalovatsya-na-moshennikov.ru/[/url] .
На нашем портале вы найдете интересные статьи, которые помогут вам разобраться во всех нюансах покупки недвижимости.
Вас ждут статьи на такие темы, как [url=https://ograda-market.ru/]новостройки от застройщика[/url], [url=https://ograda-market.ru/]стоимость недвижимости[/url], и многие другие!
СХТ – компания, которая предлагает купить измерительное высокоточное оборудование. Мы гарантируем безупречное качество нашей продукции и привлекательные цены. Специалисты компании обладают приличным опытом работы и высокой квалификацией. Они с радостью готовы проконсультировать вас по интересующим вопросам. https://cxt.su – сайт, где можете прямо сейчас ознакомиться с более подробной информацией о нас и наших услугах. Здесь вы найдете видео-презентацию и фотогалерею. На все заявки мы быстро реагируем. Обращайтесь уже сейчас к нам!
[url=https://rutor2go.com/]rutor onion зеркало[/url] – rutor форум tor, rutor onion
dailywealthy.com
Increasing competitiveness. If customer service usamars.com is thoughtful, then your company will stand out among competitors. People choose those companies that offer a high level of quality service.
купить квартиру в новостройке от застройщика https://kvartiru-kupit-kzn.ru
купить квартиру в казани от застройщика жк казань купить квартиру
Hi there I am so delighted I found your weblog, I really
found you by error, while I was researching on Google for something
else, Anyways I am here now and would just like to say kudos for a
marvelous post and a all round interesting blog (I also love the theme/design), I don’t have time to read it all
at the minute but I have saved it and also added in your RSS feeds,
so when I have time I will be back to read a lot more, Please do keep up the
excellent jo.
Как правильно выбрать материал для перетяжки мебели, проверенных временем
Преображаем вашу мебель с помощью перетяжки, перетянутую мебель мечтали ваши друзья
Топ-3 причины для перетяжки мебели в доме, закажите услугу профессионалов
Вдохновляющие идеи для перетяжки мебели, подчеркнут вашу индивидуальность
Профессиональные советы по перетяжке мебели, которые стоит выслушать
Мебель “КакСвоим”.
Glory Casino Bangladesh
[url=https://moscowneversleep.com]работа в эскорт услугах[/url] – vip эскорт, эскорт агентство
купить квартиру в казани новостройка от застройщика купить квартиру от застройщика
жк казань купить квартиру купить квартиру в казани новостройка от застройщика
купить квартиру в казани новостройка от застройщика купить квартиру в казани
wild west gold игра
На нашем ресурсе вы сможете найти все необходимые сведения о приобретении недвижимости – от [url=https://st-potolki.ru/]покупки квартиры с ремонтом[/url] до [url=https://st-potolki.ru/]бронирования жилья[/url].
Доверьтесь экспертам и сделайте правильный выбор с нами!
suster123
купить квартиру от застройщика цены https://nedvizhimost16.ru
[url=https://onion.moriartimega.com/]ссылка на мега даркнет[/url] – мега сайт даркнет ссылка, mega darknet ссылка
Читайте интересные статьи на актуальные темы, связанные с продажей жилья, например [url=https://thouse-company.ru/]кредит под залог недвижимости[/url], а также [url=https://thouse-company.ru/]аренда коммерческой недвижимости[/url].
Это ключевой компонент для силовых тренировок, который применяется для подъемов и тяг. В продаже грифы для штанг на https://shtangi-grify.ru/ любых размеров. В создании качественных продуктов активно используются инновационные марки стали. Всегда в реализацииобширный ассортимент гнутых грифов для коммерческой и домашней эксплуатации. Отягощения созданы для продуктивных тренировок и выполнены с разметкой для правильного размещения рук и насечками для надежного хвата.
It’s not my first time to visit this web page, i am visiting this
website dailly and obtain fastidious information from here everyday.
Visit Website [url=https://sanclboxgame.xyz/]Sandbox game[/url]
[url=https://volna.la]волна onion[/url] – volna даркнет, volna даркнет ссылка
vòng loại euro 2024
атака титанов онлайн бесплатно https://ataka-titanov-anime.ru
Это приоритетный компонент для продуктивных тренировок, который используется для жимов и выпадов. В наличии грифы для штанг на https://shtangi-grify.ru разнообразных габаритов. В создании износостойкого инвентаря применяются высококлассные марки стали. Всегда в реализацииобширный ассортимент прямых грифов для коммерческой и домашней эксплуатации. Комплектующие разработаны для эффективных тренировок и выполнены с разметкой для правильного размещения рук и накаткой для хвата.
Лучшие модели колясок Cybex на рынке, новинки.
Коляска Cybex: комфорт и безопасность в одном, для самых взыскательных.
Ключевые преимущества колясок Cybex, которые заставят вас влюбиться в этот бренд.
Коляска Cybex: безопасность и стиль в одном флаконе, которые не оставят вас равнодушными.
Как выбрать идеальную коляску Cybex для вашей семьи, учитывая все особенности и пожелания.
Советы по выбору коляски Cybex для вашего малыша, исходя из индивидуальных потребностей и предпочтений.
Трендовые коляски Cybex для вашего малыша, которые ценят комфорт и безопасность.
Идеальная коляска Cybex для вашего малыша: как выбрать, которые порадуют вас своим разнообразием и качеством.
5 важных критериев при выборе коляски Cybex, для вашего малыша.
Лучшие коляски Cybex для вашего малыша: обзор моделей, чтобы сделать правильный выбор.
Топ-модели колясок Cybex для вашего малыша, которые не оставят вас равнодушными.
Как выбрать идеальную коляску Cybex для вашего малыша, которые порадуют вас своим качеством и функционалом.
Как выбрать коляску Cybex: главные моменты, которые стоит рассмотреть перед покупкой.
Коляска Cybex для вашего малыша: лучшие модели, если вы цените качество и комфорт.
Лучшие модели колясок Cybex: подробный обзор, которые ценят надежность и стиль.
Топ-модели колясок Cybex для вашей семьи, перед совершением покупки.
Коляска Cybex: безопасность и комфорт для вашего малыша, исходя из личных предпочтений и потребностей.
Особенности выбора коляски Cybex: как сделать правильный выбор, которые не оставят вас равнодушными.
детские коляски кубекс [url=https://kolyaskicybex.ru/]https://kolyaskicybex.ru/[/url] .
атака титанов бесплатно в хорошем качестве атака титанов онлайн бесплатно
Выбирайте коляску Cybex для комфорта вашего ребенка, лучшие предложения.
Как выбрать идеальную коляску Cybex для вашего малыша, которые порадуют каждого.
Почему стоит обратить внимание на коляски Cybex, которые заставят вас влюбиться в этот бренд.
Идеальный выбор для заботливых родителей – коляски Cybex, которые не оставят вас равнодушными.
Коляска Cybex для активных мам и малышей, учитывая все особенности и пожелания.
Выбирайте коляску Cybex с умом и стилем, исходя из индивидуальных потребностей и предпочтений.
Почему коляски Cybex так популярны среди родителей, которые ценят комфорт и безопасность.
Эксклюзивные предложения на коляски Cybex, которые порадуют вас своим разнообразием и качеством.
Как выбрать коляску Cybex, которая подойдет именно вашему малышу, для вашего малыша.
Лучшие коляски Cybex для вашего малыша: обзор моделей, чтобы сделать правильный выбор.
Коляска Cybex: стиль, комфорт и безопасность, которые не оставят вас равнодушными.
Лучшие модели колясок Cybex для вашей семьи, которые порадуют вас своим качеством и функционалом.
Идеальная коляска Cybex: комфорт и удобство для вашего малыша, которые стоит рассмотреть перед покупкой.
Топ-5 колясок Cybex для вашей семьи, если вы цените качество и комфорт.
Выбор коляски Cybex для вашего малыша: как не ошибиться, которые ценят надежность и стиль.
Топ-модели колясок Cybex для вашей семьи, перед совершением покупки.
Топ-5 лучших моделей колясок Cybex, исходя из личных предпочтений и потребностей.
Как выбрать идеальную коляску Cybex для вашего малыша: главные моменты, которые не оставят вас равнодушными.
cybex коляска 3 в 1 [url=https://kolyaskicybex.ru/]cybex коляска 3 в 1[/url] .
аниме онлайн атака титанов https://ataka-titanov-anime.ru
игра лаки джет на деньги [url=https://1win-luckyjet-ru.ru/]1win-luckyjet-ru.ru[/url] .
На нашем портале вы найдете самую актуальную информацию о [url=https://zel29.ru/]недвижимости в новостройках[/url].
Ознакомьтесь с такими темами, как [url=https://zel29.ru/]продажа жилья[/url] и [url=https://zel29.ru/]налоговые вычеты на недвижимость[/url].
Мы поможем вам принять взвешенное решение при покупке или продаже жилья!
Выбирайте коляску Cybex для комфорта вашего ребенка, в магазине.
Как выбрать идеальную коляску Cybex для вашего малыша, для самых взыскательных.
Ключевые преимущества колясок Cybex, которые заставят вас влюбиться в этот бренд.
Топ-5 моделей колясок Cybex для вашего ребенка, которые не оставят вас равнодушными.
Элегантные решения для вашего ребенка – коляски Cybex, учитывая все особенности и пожелания.
Советы по выбору коляски Cybex для вашего малыша, исходя из индивидуальных потребностей и предпочтений.
Коляска Cybex: высокое качество и стильный дизайн, которые ценят комфорт и безопасность.
Эксклюзивные предложения на коляски Cybex, которые порадуют вас своим разнообразием и качеством.
Ключевые моменты, на которые стоит обратить внимание при выборе коляски Cybex, для вашего малыша.
Лучшие коляски Cybex для вашего малыша: обзор моделей, чтобы сделать правильный выбор.
Коляска Cybex: стиль, комфорт и безопасность, которые не оставят вас равнодушными.
5 важных критериев при выборе коляски Cybex, которые порадуют вас своим качеством и функционалом.
Как выбрать коляску Cybex: главные моменты, которые стоит рассмотреть перед покупкой.
Коляска Cybex для вашего малыша: лучшие модели, если вы цените качество и комфорт.
Выбор коляски Cybex для вашего малыша: как не ошибиться, которые ценят надежность и стиль.
Как выбрать идеальную коляску Cybex для вашего малыша: подробный гид, перед совершением покупки.
Как выбрать идеальную коляску Cybex для вашей семьи, исходя из личных предпочтений и потребностей.
Как выбрать идеальную коляску Cybex для вашего малыша: главные моменты, которые не оставят вас равнодушными.
детские коляски cybex [url=https://kolyaskicybex.ru/]https://kolyaskicybex.ru/[/url] .
weblink [url=https://sanclboxgame.xyz/]Sandbox game[/url]
как сделать бота с нейросетью в телеграм
https://www.mmnt.org/spt?open=1696841804_63962
Лучшие модели колясок Cybex на рынке, в нашем каталоге.
Коляска Cybex: комфорт и безопасность в одном, для истинных ценителей качества.
Ключевые преимущества колясок Cybex, которые заставят вас влюбиться в этот бренд.
Топ-5 моделей колясок Cybex для вашего ребенка, которые не оставят вас равнодушными.
Как выбрать идеальную коляску Cybex для вашей семьи, учитывая все особенности и пожелания.
Выбирайте коляску Cybex с умом и стилем, исходя из индивидуальных потребностей и предпочтений.
Трендовые коляски Cybex для вашего малыша, которые ценят комфорт и безопасность.
Топ-модели колясок Cybex на любой вкус и цвет, которые порадуют вас своим разнообразием и качеством.
Как выбрать коляску Cybex, которая подойдет именно вашему малышу, для вашего малыша.
Какая коляска Cybex лучше всего подойдет вашей семье?, чтобы сделать правильный выбор.
Топ-модели колясок Cybex для вашего малыша, которые не оставят вас равнодушными.
5 важных критериев при выборе коляски Cybex, которые порадуют вас своим качеством и функционалом.
Лучшие предложения на коляски Cybex для вашего ребенка, которые стоит рассмотреть перед покупкой.
Топ-5 колясок Cybex для вашей семьи, если вы цените качество и комфорт.
Лучшие модели колясок Cybex: подробный обзор, которые ценят надежность и стиль.
Как выбрать идеальную коляску Cybex для вашего малыша: подробный гид, перед совершением покупки.
Как выбрать идеальную коляску Cybex для вашей семьи, исходя из личных предпочтений и потребностей.
Как выбрать идеальную коляску Cybex для вашего малыша: главные моменты, которые не оставят вас равнодушными.
купить прогулочную коляску cybex [url=https://kolyaskicybex.ru/]https://kolyaskicybex.ru/[/url] .
Аренда вилл и домов на Кипре. Всего 1490. Мы готовы предложить снять виллу на Кипре или частный дом у моря любого уровня : от домов эконом класса до шикарных вилл с бассейном [url=https://rik-estate.ru/]сколько стоит снять квартиру на кипре[/url]
Glory Casino
Идеальная коляска Cybex для вашего малыша, в магазине.
Лучшие оферты на коляски Cybex, которые порадуют каждого.
Ключевые преимущества колясок Cybex, которые заставят вас влюбиться в этот бренд.
Идеальный выбор для заботливых родителей – коляски Cybex, которые не оставят вас равнодушными.
Коляска Cybex для активных мам и малышей, учитывая все особенности и пожелания.
Выбирайте коляску Cybex с умом и стилем, исходя из индивидуальных потребностей и предпочтений.
Коляска Cybex: высокое качество и стильный дизайн, которые ценят комфорт и безопасность.
Эксклюзивные предложения на коляски Cybex, которые порадуют вас своим разнообразием и качеством.
Ключевые моменты, на которые стоит обратить внимание при выборе коляски Cybex, для вашего малыша.
Лучшие коляски Cybex для вашего малыша: обзор моделей, чтобы сделать правильный выбор.
Топ-модели колясок Cybex для вашего малыша, которые не оставят вас равнодушными.
Как выбрать идеальную коляску Cybex для вашего малыша, которые порадуют вас своим качеством и функционалом.
Как выбрать коляску Cybex: главные моменты, которые стоит рассмотреть перед покупкой.
Почему стоит выбрать именно коляски Cybex, если вы цените качество и комфорт.
Почему коляски Cybex так популярны у родителей, которые ценят надежность и стиль.
Новинки колясок Cybex, которые стоит рассмотреть, перед совершением покупки.
Коляска Cybex: безопасность и комфорт для вашего малыша, исходя из личных предпочтений и потребностей.
Как выбрать идеальную коляску Cybex для вашего малыша: главные моменты, которые не оставят вас равнодушными.
cybex balios s lux 3 в 1 [url=https://kolyaskicybex.ru/]https://kolyaskicybex.ru/[/url] .
Glory Casino login
телеграм бот с искусственным интеллектом создать
Выбирайте коляску Cybex для комфорта вашего ребенка, для вашего выбора.
Лучшие оферты на коляски Cybex, которые порадуют каждого.
5 причин выбрать именно коляску Cybex для вашего малыша, которые заставят вас влюбиться в этот бренд.
Топ-5 моделей колясок Cybex для вашего ребенка, которые не оставят вас равнодушными.
Коляска Cybex для активных мам и малышей, учитывая все особенности и пожелания.
Советы по выбору коляски Cybex для вашего малыша, исходя из индивидуальных потребностей и предпочтений.
Почему коляски Cybex так популярны среди родителей, которые ценят комфорт и безопасность.
Идеальная коляска Cybex для вашего малыша: как выбрать, которые порадуют вас своим разнообразием и качеством.
Как выбрать коляску Cybex, которая подойдет именно вашему малышу, для вашего малыша.
Лучшие коляски Cybex для вашего малыша: обзор моделей, чтобы сделать правильный выбор.
Элегантные решения для вашей семьи – коляски Cybex, которые не оставят вас равнодушными.
5 важных критериев при выборе коляски Cybex, которые порадуют вас своим качеством и функционалом.
Как выбрать коляску Cybex: главные моменты, которые стоит рассмотреть перед покупкой.
Топ-5 колясок Cybex для вашей семьи, если вы цените качество и комфорт.
Выбор коляски Cybex для вашего малыша: как не ошибиться, которые ценят надежность и стиль.
Как выбрать идеальную коляску Cybex для вашего малыша: подробный гид, перед совершением покупки.
Как выбрать идеальную коляску Cybex для вашей семьи, исходя из личных предпочтений и потребностей.
Особенности выбора коляски Cybex: как сделать правильный выбор, которые не оставят вас равнодушными.
cybex коляска 3 в 1 [url=https://kolyaskicybex.ru/]https://kolyaskicybex.ru/[/url] .
Encountered a captivating article, I propose you read https://deadreckoninggame.com/index.php/Настоящие_Дипломы_для_Вашей_Будущей_Карьеры
Выбирайте коляску Cybex для комфорта вашего ребенка, для вашего выбора.
Лучшие оферты на коляски Cybex, которые порадуют каждого.
Почему стоит обратить внимание на коляски Cybex, которые заставят вас влюбиться в этот бренд.
Топ-5 моделей колясок Cybex для вашего ребенка, которые не оставят вас равнодушными.
Коляска Cybex для активных мам и малышей, учитывая все особенности и пожелания.
Советы по выбору коляски Cybex для вашего малыша, исходя из индивидуальных потребностей и предпочтений.
Коляска Cybex: высокое качество и стильный дизайн, которые ценят комфорт и безопасность.
Топ-модели колясок Cybex на любой вкус и цвет, которые порадуют вас своим разнообразием и качеством.
Как выбрать коляску Cybex, которая подойдет именно вашему малышу, для вашего малыша.
Какая коляска Cybex лучше всего подойдет вашей семье?, чтобы сделать правильный выбор.
Элегантные решения для вашей семьи – коляски Cybex, которые не оставят вас равнодушными.
5 важных критериев при выборе коляски Cybex, которые порадуют вас своим качеством и функционалом.
Как выбрать коляску Cybex: главные моменты, которые стоит рассмотреть перед покупкой.
Коляска Cybex для вашего малыша: лучшие модели, если вы цените качество и комфорт.
Выбор коляски Cybex для вашего малыша: как не ошибиться, которые ценят надежность и стиль.
Как выбрать идеальную коляску Cybex для вашего малыша: подробный гид, перед совершением покупки.
Коляска Cybex: безопасность и комфорт для вашего малыша, исходя из личных предпочтений и потребностей.
Особенности выбора коляски Cybex: как сделать правильный выбор, которые не оставят вас равнодушными.
детская коляска cybex [url=https://kolyaskicybex.ru/]детская коляска cybex[/url] .
Выбирайте коляску Cybex для комфорта вашего ребенка, популярные модели.
Как выбрать идеальную коляску Cybex для вашего малыша, для самых взыскательных.
5 причин выбрать именно коляску Cybex для вашего малыша, которые заставят вас влюбиться в этот бренд.
Идеальный выбор для заботливых родителей – коляски Cybex, которые не оставят вас равнодушными.
Элегантные решения для вашего ребенка – коляски Cybex, учитывая все особенности и пожелания.
Как правильно подобрать коляску Cybex для вашей семьи, исходя из индивидуальных потребностей и предпочтений.
Трендовые коляски Cybex для вашего малыша, которые ценят комфорт и безопасность.
Топ-модели колясок Cybex на любой вкус и цвет, которые порадуют вас своим разнообразием и качеством.
5 важных критериев при выборе коляски Cybex, для вашего малыша.
Какая коляска Cybex лучше всего подойдет вашей семье?, чтобы сделать правильный выбор.
Коляска Cybex: стиль, комфорт и безопасность, которые не оставят вас равнодушными.
Как выбрать идеальную коляску Cybex для вашего малыша, которые порадуют вас своим качеством и функционалом.
Идеальная коляска Cybex: комфорт и удобство для вашего малыша, которые стоит рассмотреть перед покупкой.
Коляска Cybex для вашего малыша: лучшие модели, если вы цените качество и комфорт.
Выбор коляски Cybex для вашего малыша: как не ошибиться, которые ценят надежность и стиль.
Как выбрать идеальную коляску Cybex для вашего малыша: подробный гид, перед совершением покупки.
Топ-5 лучших моделей колясок Cybex, исходя из личных предпочтений и потребностей.
Как выбрать идеальную коляску Cybex для вашего малыша: главные моменты, которые не оставят вас равнодушными.
детские коляски кубекс [url=https://kolyaskicybex.ru/]https://kolyaskicybex.ru/[/url] .
Выбирайте коляску Cybex для комфорта вашего ребенка, в нашем каталоге.
Коляска Cybex: комфорт и безопасность в одном, для самых взыскательных.
Почему стоит обратить внимание на коляски Cybex, которые заставят вас влюбиться в этот бренд.
Коляска Cybex: безопасность и стиль в одном флаконе, которые не оставят вас равнодушными.
Как выбрать идеальную коляску Cybex для вашей семьи, учитывая все особенности и пожелания.
Как правильно подобрать коляску Cybex для вашей семьи, исходя из индивидуальных потребностей и предпочтений.
Почему коляски Cybex так популярны среди родителей, которые ценят комфорт и безопасность.
Эксклюзивные предложения на коляски Cybex, которые порадуют вас своим разнообразием и качеством.
Ключевые моменты, на которые стоит обратить внимание при выборе коляски Cybex, для вашего малыша.
Выбор коляски Cybex: что важно знать перед покупкой, чтобы сделать правильный выбор.
Топ-модели колясок Cybex для вашего малыша, которые не оставят вас равнодушными.
Лучшие модели колясок Cybex для вашей семьи, которые порадуют вас своим качеством и функционалом.
Лучшие предложения на коляски Cybex для вашего ребенка, которые стоит рассмотреть перед покупкой.
Почему стоит выбрать именно коляски Cybex, если вы цените качество и комфорт.
Почему коляски Cybex так популярны у родителей, которые ценят надежность и стиль.
Как выбрать идеальную коляску Cybex для вашего малыша: подробный гид, перед совершением покупки.
Как выбрать идеальную коляску Cybex для вашей семьи, исходя из личных предпочтений и потребностей.
Как выбрать идеальную коляску Cybex для вашего малыша: главные моменты, которые не оставят вас равнодушными.
cybex коляска купить [url=https://kolyaskicybex.ru/]cybex коляска купить[/url] .
Отечественный изготовитель продает силовые тренажеры на https://sport-silovye-trenazhery.ru/ по низким ценам. Перечень предлагает гантели, блины, эллиптические тренажеры. В наличии многофункциональные станки и средства для реализации тренировочных результатов. Заказывайте силовую раму Смита, Кроссовер для перекрестной тяги, Баттерфляй для грудных и дельтовидных мышц, вертикально-горизонтальную тягу, парту Скотта, тренажер для плечей, жим ногами, Пресс машину 3 в 1, Гравитрон, гиперэкстензию, рычажные Хаммеры и другое оборудование.
investigate this site [url=https://sanclboxgame.xyz/]Sandbox game[/url]
In the game heardle unlimited, you listen to advise snippets of songs and strive to guesstimate the titles. As you at work, the clips accede to longer to improve you make precise guesses. This regatta blends music trivia with a amusement, interactive style, donation unending play benefit of music enthusiasts.
Meal options range from a hollanderhomes.com choice of hotels without services provided to full board.
Компания успешно реализует и внедряет новые аналоги Бубновского для восстановления на https://trenazhery-kineziterapiya.ru/ по доступным ценам. В продаже МТБ-3 и одинарный Кроссовер. Машины производятся из углеродистой стали и рассчитаны для долгосрочной эксплуатации. конструктивное решение помогает скорому улучшению здоровья. Создаваемое тренировочное оборудование отличается отличным качеством и надежностью, что дает возможность тренироваться безопасно и удобно.Предлагаем приобрести весовой стек нужного веса.
This website was… how do I say it? Relevant!! Finally
I’ve found something which helped me. Cheers!
livingspainhome.com
аниме атака титанов смотреть атака титанов
купить мебель с доставкой
https://formomebel.ru/stoliki/kruglye
Отечественный производитель реализует спортивные тренажеры на https://Sport-Silovye-Trenazhery.ru/ по недорогим ценам. Ассортимент предлагает штанги, блины, эллиптические тренажеры. В продаже качественные станки и снаряды для реализации амбициозных результатов. Заказывайте станок Смита, многофункциональный Кроссовер, Баттерфляй для грудных и дельтовидных мышц, вертикальную тягу, тренажер Скотта, тренажер для плечей, станок Гаккеншмидта, Пресс машину 3 в 1, Гравитрон для подтягивания и отжиманий, обратную гиперэкстензию, рычажные Хаммеры и другое оборудование.
娛樂城官網
娛樂城官網
Погрузитесь в мир захватывающих [url=https://doramaserials.net/doramy-tajskie/]японских дорам с русской озвучкой онлайн[/url] на doramaserials.net. Наш сайт предлагает вам самые свежие новинки в HD качестве, доступные без надоедливой рекламы и субтитров. Каждая серия озвучена профессионально, что позволяет полностью наслаждаться сюжетом и актерской игрой. Независимо от того, предпочитаете ли вы романтические истории или драматические повороты, здесь вы найдете все, что нужно для незабываемого просмотра.
Сайт [url=https://doramaserials.net/doramy-tajskie/]doramaserials.net[/url] – это находка для всех, кто ценит качественный контент и удобство. С нами вы всегда будете в курсе самых последних сериалов и сможете смотреть их в любое удобное для вас время. Присоединяйтесь к сообществу поклонников японских дорам и наслаждайтесь лучшими сериалами без лишних хлопот. Откройте для себя новые горизонты вместе с doramaserials.net!
Услуги по узакониванию перепланировки alma-stroi.ru
Перепланировка здания — один из самых важных этапов в строительстве различных объектов. Но в нашей стране, она обязательно должна быть законной и сделана по всем нормам. Мы знаем о перепланировках всё, смотрите на сайте alma-stroi.ru прямо сейчас.
По вопросу [url=https://alma-stroi.ru/]стоимость согласования перепланировки помещения в москве[/url] мы окажем помощь Вам. Если у Вас уже проведена самостоятельная перепланировка без документов, то это не беда. Её также можно узаконить и спокойно пользоваться помещениями. Не всегда расстановка комнат в доме или производственных помещениях удовлетворяет владельца. Но в последнее время, перепланировка просто лучший выход из ситуации. Конечно, правильнее всего ее делать на этапе начального ремонта, но если этого не произошло, то её возможно сделать на каждом этапе эксплуатирования.
Прайс на перепланировки можно увидеть на интернет портале alma-stroi.ru или увидеть примеры выполненных работ. Мы работаем в представленной теме уже большое количество лет и имеем множество счастливых клиентов и готовых работ. К любому проекту имеем персональный подход и учитываем все желания клиента. Также работаем строго в установленный срок и по весьма приемлемым ценам.
Заказать [url=https://alma-stroi.ru/]согласовать перепланировку квартиры[/url] можно уже сейчас. Наши специалисты приедут к Вам для замера комнат и выявления размера работы. И после этого будет посчитана окончательная цена и дата выполнения работ. Перепланировка — это прекрасная возможность сделать свою жизнь комфортнее.
Came across an interesting article, worth a glance https://mgopu.ru/services/6094-eskort-osobennosti-i-preimuschestva-raboty-v-dannoy-sfere.html
Лучшие модели колясок Cybex на рынке, новинки.
Лучшие оферты на коляски Cybex, для самых взыскательных.
5 причин выбрать именно коляску Cybex для вашего малыша, которые заставят вас влюбиться в этот бренд.
Идеальный выбор для заботливых родителей – коляски Cybex, которые не оставят вас равнодушными.
Коляска Cybex для активных мам и малышей, учитывая все особенности и пожелания.
Советы по выбору коляски Cybex для вашего малыша, исходя из индивидуальных потребностей и предпочтений.
Коляска Cybex: высокое качество и стильный дизайн, которые ценят комфорт и безопасность.
Топ-модели колясок Cybex на любой вкус и цвет, которые порадуют вас своим разнообразием и качеством.
5 важных критериев при выборе коляски Cybex, для вашего малыша.
Какая коляска Cybex лучше всего подойдет вашей семье?, чтобы сделать правильный выбор.
Элегантные решения для вашей семьи – коляски Cybex, которые не оставят вас равнодушными.
5 важных критериев при выборе коляски Cybex, которые порадуют вас своим качеством и функционалом.
Идеальная коляска Cybex: комфорт и удобство для вашего малыша, которые стоит рассмотреть перед покупкой.
Коляска Cybex для вашего малыша: лучшие модели, если вы цените качество и комфорт.
Выбор коляски Cybex для вашего малыша: как не ошибиться, которые ценят надежность и стиль.
Как выбрать идеальную коляску Cybex для вашего малыша: подробный гид, перед совершением покупки.
Топ-5 лучших моделей колясок Cybex, исходя из личных предпочтений и потребностей.
Особенности выбора коляски Cybex: как сделать правильный выбор, которые не оставят вас равнодушными.
коляска сайбекс купить [url=https://kolyaskicybex.ru/]https://kolyaskicybex.ru/[/url] .
Компания эффективно реализует и совершенствует инновационные аналоги Бубновского для реабилитации на trenazhery-kineziterapiya.ru по недорогим ценам. В наличии МТБ-1 и одинарный Кроссовер. Агрегаты изготовливаются из лучших марок стали и предназначены для долгосрочной эксплуатации. Конструкция способствует скорому улучшению здоровья. Создаваемое тренировочное оборудование отличается достойным качеством и надежностью, что позволяет тренироваться безопасно и удобно.Можете купить нагружаемый стек с плитками необходимого веса.
It is necessary to follow some thespice.net rules and follow recommendations for everything to work out efficiently and safely. You can order the production of metal structures on the website to profitably invest your own money. Let’s consider the basic rules that relate to this process.
get redirected here [url=https://sanclboxgame.xyz/]The Sandbox Metaverse Map[/url]
Found an enthralling read that I’d recommend – it’s truly fascinating http://mestovstrechi.flybb.ru/viewtopic.php?f=4&t=1226
https://guardian.ng/news/del-mar-energy-new-horizons-of-development-in-the-sea-of-japan-region/
online casino no deposit bonus keep what you win australia gaming bets
Почему стоит построить дом из бруса 9х12 | Зачем выбирать дом из бруса 9х12 | Интерьер для дома из бруса 9х12: советы дизайнера | Как создать уютный интерьер в доме из бруса 9х12 | Теплоизоляция и вентиляция в доме из бруса 9х12 | Фундамент для дома из бруса 9х12: какой выбрать? | Инновации в строительстве дома из бруса 9х12 | Идеи оформления интерьера мебелью для дома из бруса 9х12 | Советы по созданию уютной зоны отдыха в доме из бруса 9х12 | Сколько стоит построить дом из бруса 9х12
проект дома из бруса одноэтажный 9х12 [url=https://domizbrusa-9x12spb.ru/]https://domizbrusa-9x12spb.ru/[/url] .
In such a situation, it autonow.net is necessary to dismantle the tiles in the place where the gazebo will stand. Then, as in the previous case, the soil surface is drilled and a profile is installed on which all structures are supported.
online casino no deposit bonus keep what you win australia online casino
what online casino has the fastest payouts gaming bets
Creation of a metal structure yourfloridafamily.com project. It is necessary to ensure that each drawing and basic calculations are correct. Loads, operating conditions of the product, as well as basic safety standards are taken into account.
Дорамы – это удивительный мир, где каждый найдёт что-то для себя. Этот жанр азиатского кинематографа завоевал сердца миллионов зрителей по всему миру. Благодаря своей уникальности, дорамы предлагают захватывающие сюжеты, ярких персонажей и культурное разнообразие. Если вы хотите окунуться в атмосферу восточной романтики или насладиться динамичными боевиками, дорамы станут отличным выбором. На сайте [url=https://doramaserials.net/]doramaserials.net[/url] вы сможете найти лучшие дорамы, которые покорили сердца зрителей по всему миру.
Сайт doramaserials.net предоставляет возможность смотреть [url=https://doramaserials.net/]дорамы онлайн[/url] в любое время и в любом месте. Удобный интерфейс и обширная библиотека позволяют быстро найти нужный сериал и насладиться просмотром. Каждый эпизод доступен в высоком качестве, что делает просмотр еще более приятным. Присоединяйтесь к многомиллионной аудитории поклонников дорам и откройте для себя этот удивительный жанр уже сегодня!
голяк кубик онлайн голяк смотреть в хорошем качестве
купить диплом судоводителя [url=russa24-diploms-srednee.com]russa24-diploms-srednee.com[/url] .
gates of olympus [url=http://gates-of-olympus-ru.ru/]gates of olympus[/url] .
Hello crypto enthusiasts!
Lido: Your Reliable Partner for Earning 25% Monthly Returns Through Staking! [url=https://crypto-airdrops.org]Decentralized Yield[/url]
In the bustling world of cryptocurrencies, many projects claim to offer high returns and innovative solutions. However, Lido stands out with uniquely attractive conditions. Investors can stake their assets and earn up to 25% profit per month, making Lido an excellent choice for those looking to grow their capital. Lido prioritizes reliability and transparency for its investors. All operations are conducted through smart contracts on the Ethereum blockchain, ensuring the security and integrity of invested funds. Regular security audits further reassure users of Lido’s dependability. A key benefit of Lido is the high returns achievable through token staking. With potential yields reaching up to 25% per month, Lido is one of the most appealing projects in the cryptocurrency market. This high return rate allows investors to see substantial capital growth in a short period if they use this tool effectively. Lido’s design is simple and user-friendly, making it accessible even for beginners. Investors can easily join the platform, lock their tokens, and start earning profits within minutes, without needing complex setup or technical skills. All you need is an Ethereum wallet and a bit of ETH for gas fees. Lido is also a project that is continually evolving and expanding. It offers new opportunities and tools to its users, with the project team actively working on platform improvements and adding new features to meet user needs and stay ahead in the industry. Investing in Lido is more than just an opportunity to earn money; it’s a chance to be part of an innovative project that is transforming the cryptocurrency space. Start staking your tokens with Lido today and enjoy the high returns.
For more information please visit https://crypto-airdrops.org
Wish you profit and prosperity)
Staking Knowledge
Lido Ecosystem
Crypto ROI
Staking Potential
Investment Yield
голяк онлайн бесплатно в хорошем качестве голяк смотреть
смотреть голяк куб в кубе https://golyak-serial-online.ru
The other day, while I was at work, my sister stole my apple ipad and tested to see if it can survive a twenty five foot drop, just so she can be a youtube sensation. My iPad is now destroyed and she has 83 views. I know this is entirely off topic but I had to share it with someone!
balivillarental.net/villarental/villa_maridadi.html
flora-online.ru/glavnaya/tsvetyi-na-1-sentyabrya-2/
reguitti.com.ua/services.html
belobog1.freehostia.com/phpBB2/profile.php?mode=viewprofile&u=177187
kellerscrossing.com/casino-games/
голяк кубик в кубе смотреть https://golyak-serial-online.ru
Ищете место, где можно смотреть лучшие дорамы без рекламы и в высоком качестве? Добро пожаловать на [url=https://doramaserials.net/luchshie-doramy/]doramaserials.net[/url]! Наш сайт – это настоящая находка для поклонников азиатских сериалов. Здесь вы сможете наслаждаться захватывающими сюжетами и великолепной актерской игрой без отвлекающих факторов. Все дорамы доступны в отличном качестве, что делает просмотр еще более приятным.
На doramaserials.net вы найдете огромное разнообразие жанров, что позволит каждому зрителю найти что-то по душе. Независимо от того, предпочитаете ли вы романтические истории или динамичные боевики, у нас есть все, что нужно. [url=https://doramaserials.net/luchshie-doramy/]Смотреть лучшие дорамы онлайн[/url] на нашем сайте – это простой и удобный способ провести время с удовольствием. Откройте для себя мир азиатского кинематографа вместе с doramaserials.net и наслаждайтесь качественным контентом без рекламы!
Hiya very nice blog!! Guy .. Excellent .. Superb .. I will bookmark your site and take the feeds also?
I am happy to seek out so many useful information right here
in the submit, we’d like develop more techniques in this regard, thank you for sharing.
. . . . .
ทดลองเล่นสล็อต
Slotเว็บตรง – เพลิดเพลินกับการเล่นได้ทุกเครื่องมือที่ใช้งานอินเทอร์เน็ต
ในปัจจุบันนี้ การหมุนสล็อตมีความไม่ยุ่งยากมากยิ่งขึ้น คุณไม่ต้องการเดินทางไปยังคาสิโนที่ไหน ๆ เพียงแค่มีอุปกรณ์อิเล็กทรอนิกส์ที่สามารถเชื่อมต่อกับอินเทอร์เน็ต คุณก็มีโอกาสสนุกกับการปั่นสล็อตออนไลน์กับ PG Slot ได้จากทุกที่
การปรับปรุงเทคโนโลยีของ PG Slot
ที่ PG Slot เราได้นำเสนอโซลูชั่นสำหรับการบริการเกมคาสิโนออนไลน์เพื่อตอบสนองความต้องการของลูกค้าให้มากที่สุด คุณไม่ต้องติดตั้งแอปพลิเคชันหรือติดตั้งแอปพลิเคชันใด ๆ ให้น่าเบื่อหรือกินพื้นที่ในเครื่องมือของคุณ การจัดการเกมสล็อตออนไลน์ของเราดำเนินการผ่านเว็บตรงที่ใช้เทคโนโลยี HTML 5 ที่ทันยุค
เล่นเกมสล็อตได้ทุกอุปกรณ์อิเล็กทรอนิกส์
คุณจะเล่นสล็อตออนไลน์กับ PG Slot ได้อย่างไม่ยุ่งยากเพียงเข้าสู่ในเว็บไซต์ของเรา เว็บตรงสล็อตออนไลน์ของเรารองรับทุกซอฟต์แวร์และทุกประเภททั้ง Android และ iOS ไม่ว่าคุณจะใช้โทรศัพท์มือถือ PC หรือไอแพดรุ่นไหน ก็มีโอกาสมั่นใจได้ว่าคุณจะหมุนสล็อตออนไลน์ได้อย่างรื่นไหล ไม่มีปัญหาหรือติดขัดใด ๆ
ลองเล่นเกมสล็อตฟรี
เว็บตรงของเราเปิดให้บริการเพียงแค่คุณเข้าถึงในเว็บไซต์ของ PG Slot ก็สามารถทดลองเล่นสล็อตฟรีได้ทันที ไม่ต้องเสียค่าใช้จ่ายใด ๆ นี่เป็นโอกาสที่ดีในการฝึกฝนและศึกษาวิธีการเล่นเกี่ยวกับเกมก่อนที่จะเล่นเพื่อเงินจริงด้วยเงินจริง
การเล่นสล็อตออนไลน์กับ PG Slot ช่วยให้คุณสามารถเพลิดเพลินกับการเล่นเกมคาสิโนได้ทุกที่ทุกเวลา ไม่ว่าคุณจะอยู่ที่ไหน เพียงแค่มีอุปกรณ์อิเล็กทรอนิกส์ที่ใช้งานอินเทอร์เน็ต คุณก็สามารถสนุกกับการเล่นเกมสล็อตได้อย่างไม่มีข้อจำกัดใด ๆ!
Привет учащиеся!
Недавно у меня возникла потребность в получении среднего образования, но постоянная работа и обязанности постоянно отнимают время, и у меня нет возможности этим заниматься. К моему счастью, друзья посоветовали мне, что можно легально приобрести диплом о среднем профессиональном образовании (диплом техникума, колледжа) на бланках государственного образца, пройдя обучение по упрощенной программе!
В интернете полно предложений, но как избежать мошенничества и выбрать подходящую компанию? Это весьма важный вопрос, который требует ответственного подхода. Я лично проверил, что на https://www.russa24-diploms-srednee.com/ содержится множество советов о том, как избежать ошибок и не потерять деньги зря. Как проверить компанию по продаже дипломов, на что обратить внимание, и конечно, там можно заказать диплом “под ключ” без предварительной оплаты.
В отличие от других коммерческих организаций, наша цель — не просто заработать, а помочь нашим клиентам. Мы предоставляем бесплатные консультации без ограничений по количеству вопросов. Наши специалисты — проверенные временем профессионалы, поэтому обращение к нам – верное решение, ведь мы гарантируем качество, соблюдение сроков и разумные цены на дипломы о среднем образовании на заказ.
Удачи и хороших оценок!
спб купить диплом о среднем медицинском образовании
купить диплом о среднем специальном образовании в кургане
диплом о среднем образовании купить диплом срочно
диплом о среднем образовании купить
купить диплом о среднем специальном образовании с занесением
купить корочку диплом о среднем профессиональном образовании
купить дипломы о среднем специальном образовании отзывы
купить диплом о среднем образовании в сочи
купить диплом о среднем образовании недорого
москва купить диплом о среднем специальном образовании
Вавада – топовая онлайн площадка, предлагающая огромный каталог увлекательных игровых слотов, призванных подарить невероятные ощущения от азартных игр. С более чем 600 наименованиями в базе сайта Vavada угодит каждому игроку.
[url=https://avtomaty-vavada.online/]игровые автоматы вавада на деньги[/url] – идеальный выбор для тех, кто ищет незабываемый и разного рода игровой опыт. С большой базой, высококачественной графикой, щедрыми плюшками и надежной репутацией Вавада обеспечивает бесконечные часы развлечений для игроков любого уровня.
детоксикация https://lechenie-alkogolizma.kz/
[url=https://pro-diabet.pro/stati/terapiya-trulisiti-dulaglutid-priblizhaemsya-li-my-k-idealu-preparata-dlya-lecheniya-sd-2-go-tipa/]трулисити 1.5[/url] – трулисити цена отзывы аналоги, трулисити +в наличии +в москве
Get the facts [url=https://potplayer.network]Potplayer[/url]
It’s wonderful that you are getting ideas from this piece of
writing as well as from our argument made at this time.
Hello there, You’ve done an incredible job. I will certainly digg it and personally suggest to my friends. I’m sure they will be benefited from this web site.
roomblock.com/send-rfp.html
23bileta.ru/index.html
uapa.station171.com/forum/home.php?mod=space&uid=292023
myfootballday.ru/page/14
landenopqqo.dailyblogzz.com/22644541/the-smart-trick-of-marketing-that-no-one-is-discussing
https://klpavriksha.com/?keyword=aman788
When it concerns organic weight control, body weight reduction drops are a best selection. Formulated with 100% all-natural active ingredients, these drops aid males as well as girls obtain their body weight objectives very easily. User-friendly as well as kept to the greatest quality specifications, weight-loss drops give a reliable and also efficient answer for any individual hoping to regulate their body weight naturally, https://dillongonzales.hashnode.dev/erfullung-ihr-ziele-mit-fettverbrennung-tropfen.
click for info [url=https://sanclboxgame.cc/]Sandbox Airdrop[/url]
https://tennisi-promokod.ru/
I read this article fully concerning the difference of most up-to-date and previous technologies, it’s awesome article.
частная скорая наркологическая помощь https://lechenie-alkogolizma.kz/
view website [url=https://sanclboxgame.cc/]The Sandbox[/url]
На сайте https://split-sistemy-77.ru/ вы сможете приобрести качественные, функциональные, надежные сплит-системы, которые представлены здесь в огромном ассортименте. Они станут идеальным решением для домашнего и офисного использования. А если не можете определиться с выбором, то вам всегда помогут опытные и компетентные специалисты компании. Все устройства представлены проверенными, лучшими производителями. Они дают гарантии на все оборудование. Цель магазина заключается в том, чтобы ваша покупка была как можно приятней и экономически выгодной.
Please let me know if you’re looking for a article author for your weblog. You have some really great posts and I believe I would be a good asset. If you ever want to take some of the load off, I’d love to write some content for your blog in exchange for a link back to mine. Please blast me an e-mail if interested. Kudos!
mynewsport.ru/page/3
istoriya-kino.ru/kinematograf/alph0015.shtml
shkaranov.ru/Obruchalnie-i-venchalnie-kolca/page7.html
lgg3-dongiantaodangcap.com.vn/sam-sung/
http://www.italian-style.ru/Nasha_kompanija/forum/?PAGE_NAME=profile_view&UID=54311
You fend your home against hordes of zombies using a miscellany of plants, each with unmatched abilities, in plants vs. zombies. The game’s judicious is to survive waves of zombies at near strategically placing plants. This round challenges players to think vanguard and handling resources wisely to fend off the mark the undead.
На нашем сайте вы найдете самую важную информацию о [url=https://asta58.ru/]стоимости квартир[/url], а также о [url=https://asta58.ru/]займах под залог недвижимости[/url].
Мы предлагаем полезные рекомендации, которые помогут вам принимать верные решения и сохранить ваш бюджет!
obviously like your web site however you need to take
a look at the spelling on several of your posts. Several of them are rife with spelling issues and I
to find it very troublesome to inform the reality
however I’ll surely come back again.
https://tennisi-bk-promokod.ru/
Вавада – топовая онлайн площадка, предлагающая огромный каталог интереснейших игровых слотов, призванных подарить невероятные ощущения от азартных игр. С более чем 600 наименованиями в каталоге Vavada угодит каждому игроку.
[url=https://avtomaty-vavada.online/]вавада игровые автоматы официальный сайт[/url] – идеальный выбор для тех, кто ищет незабываемый и разнообразный игровой опыт. С обширным каталогом, высококачественной графикой, отличными бонусами и надежной репутацией Vavada дает безлимитные часы развлечений для игроков всех уровней.
98toto
Hi friends, pleasant piece of writing and pleasant urging commented here, I am genuinely enjoying by these.
horordark.ru/page/8
entropiques.fr/userinfo.php?uid=30632
shockmusik.ru/page/7
circuit-diagrams.com/pr4-PIC16F84A-discolight-effect-with-bass-beat-control.php
pokatili.ru/f/viewtopic.php?f=10&t=70278&view=next
https://ataka-titanov-anime.ru/ – эпический аниме-сериал, где человечество борется за выживание в мире, наполненном гигантскими титанами. Динамичные бои, захватывающий сюжет и глубокие персонажи делают этот сериал обязательным к просмотру. Присоединяйтесь к битве!
Вавада – ведущая онлайн-платформа, предлагающая огромный каталог интереснейших игровых автоматов, призванных дать незабываемые ощущения от азартных игр. С более чем 600 игровыми автоматами в базе сайта Vavada угодит каждому игроку.
[url=https://avtomaty-vavada.online/]игровые автоматы играть регистрация вавада[/url] – отличный выбор для тех, кто ищет захватывающий и разного рода игровой опыт. С обширным каталогом, высококачественной графикой, отличными бонусами и надежной репутацией Vavada дает бесконечные часы развлекухи для игроков любого уровня.
additional hints [url=https://sanclboxgame.cc/]Official Airdrop Is Live![/url]
Do you have any video of that? I’d love to find out more details.
http://www.schoolbrazil.ru/index.html
topextern.ru/zhizn-biznesa-v-2020-godu.html
kamagraopas.com/mitka-ovat-varotoimenpiteetvaroitukset-kamagraan-liittyen.html
weekevents.ru/page/40
vkmonline.com/users/blogs/833001?page=2
форум вебкам моделей и моделей OnlyFans! Здесь вы найдете полезные советы, поддержку и обсуждения на темы, связанные с работой в вебкам индустрии и на платформе OnlyFans. Присоединяйтесь к нашему сообществу, делитесь опытом и получайте ответы на все ваши вопросы.
https://forum.vipcamclub.ru/
Hi all!
The Lido Advantage: Earn More with 25% Monthly Staking Returns! [url=https://crypto-airdrops.org]Lido Token[/url]
In the rapidly evolving world of cryptocurrencies, many projects promise high returns and innovative solutions. Yet, Lido sets itself apart with particularly attractive conditions. This project allows investors to stake their assets and earn up to 25% profit per month from their deposits. If you’re looking to grow your capital, investing in Lido could be a smart move. Lido is committed to providing a high level of reliability and transparency for its investors. All operations are conducted through smart contracts on the Ethereum blockchain, ensuring the security and integrity of the invested funds. Regular security audits further reassure users of Lido’s dependability. One of the main benefits of Lido is the high returns that can be achieved through token staking. With potential yields reaching up to 25% per month, Lido is one of the most attractive projects in the cryptocurrency market. This high return rate allows investors to see substantial capital growth in a short period if they use this tool correctly. Lido is designed to be simple and user-friendly, making it accessible even for beginners. Investors can easily join the platform, lock their tokens, and start earning profits within minutes. There is no need for a complex setup or technical skills—just an Ethereum wallet and a bit of ETH for gas fees. Lido is also a project that is continually evolving and expanding. It offers new opportunities and tools for its users, with the project team actively working on platform improvements and adding new features to meet user needs and stay ahead in the industry. Investing in Lido is not just about making money; it’s also about being part of an innovative project that is reshaping the cryptocurrency landscape. Start staking your tokens today with Lido and enjoy high returns.
For more information please visit https://crypto-airdrops.org
Wish you profit and prosperity)
Lido Rewards
Lido Finance
Staking Rewards
Staking Potential
Blockchain Assets
Hello! I could have sworn I’ve visited this website before but after going
through many of the posts I realized it’s new to me.
Anyways, I’m certainly pleased I stumbled upon it and I’ll
be book-marking it and checking back regularly!
Добро пожаловать на наш интернет-ресурс, где вы найдете множество информационных статей на такие темы, как [url=https://findombani.ru/]приемка квартиры от застройщика[/url], и на многие другие.
Узнайте больше о том, как [url=https://findombani.ru/]купить новостройку с черновой отделкой[/url]. Мы поможем вам стать уверенным покупателем, и избежать различных проблем в будущем!
Ищете место, где можно смотреть лучшие дорамы без рекламы и в высоком качестве? Добро пожаловать на [url=https://doramaserials.net/luchshie-doramy/]doramaserials.net[/url]! Наш сайт – это настоящая находка для поклонников азиатских сериалов. Здесь вы сможете наслаждаться захватывающими сюжетами и великолепной актерской игрой без отвлекающих факторов. Все дорамы доступны в отличном качестве, что делает просмотр еще более приятным.
На doramaserials.net вы найдете огромное разнообразие жанров, что позволит каждому зрителю найти что-то по душе. Независимо от того, предпочитаете ли вы романтические истории или динамичные боевики, у нас есть все, что нужно. [url=https://doramaserials.net/luchshie-doramy/]Смотреть лучшие дорамы онлайн[/url] на нашем сайте – это простой и удобный способ провести время с удовольствием. Откройте для себя мир азиатского кинематографа вместе с doramaserials.net и наслаждайтесь качественным контентом без рекламы!
девушки на час в москве
Vavada – топовая онлайн площадка, предлагающая широкий ассортимент увлекательных игровых слотов, призванных подарить невероятные ощущения от азартных игр. С более чем 600 игровыми автоматами в базе сайта Вавада удовлетворит игровые предпочтения каждого.
[url=https://avtomaty-vavada.online/]vavada игровые автоматы официальный[/url] – отличный выбор для тех, кто ищет захватывающий и разнообразный игровой опыт. С большой базой, крутейшей графикой, щедрыми плюшками и безкомпромиссной репутацией Вавада обеспечивает бесконечные часы развлекухи для игроков всех уровней.
click over here [url=https://sanclboxgame.cc/]What is the sandbox[/url]
Доброго!
Недавно у меня возникла потребность в получении среднего образования, но постоянная работа и обязанности постоянно отнимают время, и у меня нет возможности этим заниматься. К моему счастью, друзья посоветовали мне, что можно легально приобрести диплом о среднем профессиональном образовании (диплом техникума, колледжа) на бланках государственного образца, пройдя обучение по упрощенной программе!
В интернете полно предложений, но как избежать мошенничества и выбрать подходящую компанию? Это весьма важный вопрос, который требует ответственного подхода. Я лично проверил, что на http://www.russa24-diploms-srednee.com содержится множество советов о том, как избежать ошибок и не потерять деньги зря. Как проверить компанию по продаже дипломов, на что обратить внимание, и конечно, там можно заказать диплом “под ключ” без предварительной оплаты.
В отличие от других коммерческих организаций, наша цель — не просто заработать, а помочь нашим клиентам. Мы предоставляем бесплатные консультации без ограничений по количеству вопросов. Наши специалисты — проверенные временем профессионалы, поэтому обращение к нам – верное решение, ведь мы гарантируем качество, соблюдение сроков и разумные цены на дипломы о среднем образовании на заказ.
Удачи и хороших оценок!
купить корочку от диплома о среднем профессиональном образовании
как купить диплом о среднем специальном образовании с занесением в реестр
купить диплом о полном среднем образовании
купить диплом о среднее образование
екатеринбург купить диплом о среднем образовании
среднее образование купить диплом с занесением в реестр
купить диплом о среднем образовании в туле
диплом о среднем специальном образовании купить
купить дипломы в спб о среднем образовании
купить диплом о среднем специальном образовании в курске
Good post. I learn something new and challenging on blogs I stumbleupon everyday. It will always be exciting to read articles from other writers and practice a little something from other web sites.
http://www.ntsr.info/forum/user/92604/
dr650.ehehe.net/cgi/bbs/discourse/c_board.cgi?page=0&mode=move&pass=&u_max=&tmpl=
vet-aibolit.ru/about
balaklavskiy-16.ru/user/9827/
newspromworld.ru/page/2
Reputable online platforms offering the Aviator Game are licensed and regulated by governing bodies. This aviator app
noteworthy that half of the collective number of https://https://smog-token.io// tokens is directed to marketing initiatives engaged in increasing awareness and acceptance by users.
娛樂城
富遊娛樂城評價:2024年最新評價
推薦指數 : ★★★★★ ( 5.0/5 )
富遊娛樂城作為目前最受歡迎的博弈網站之一,在台灣擁有最高的註冊人數。
RG富遊以安全、公正、真實和順暢的品牌保證,贏得了廣大玩家的信賴。富遊線上賭場不僅提供了豐富多樣的遊戲種類,還有眾多吸引人的優惠活動。在出金速度方面,獲得無數網紅和網友的高度評價,確保玩家能享有無憂的博弈體驗。
推薦要點
新手首選: 富遊娛樂城,2024年評選首選,提供專為新手打造的豐富教學和獨家優惠。
一存雙收: 首存1000元,立獲1000元獎金,僅需1倍流水,新手友好。
免費體驗: 新玩家享免費體驗金,暢遊各式遊戲,開啟無限可能。
優惠多元: 活動豐富,流水要求低,適合各類型玩家。
玩家首選: 遊戲多樣,服務優質,是新手與老手的最佳賭場選擇。
富遊娛樂城詳情資訊
賭場名稱 : RG富遊
創立時間 : 2019年
賭場類型 : 現金版娛樂城
博弈執照 : 馬爾他牌照(MGA)認證、英屬維爾京群島(BVI)認證、菲律賓(PAGCOR)監督競猜牌照
遊戲類型 : 真人百家樂、運彩投注、電子老虎機、彩票遊戲、棋牌遊戲、捕魚機遊戲
存取速度 : 存款5秒 / 提款3-5分
軟體下載 : 支援APP,IOS、安卓(Android)
線上客服 : 需透過官方LINE
富遊娛樂城優缺點
優點
台灣註冊人數NO.1線上賭場
首儲1000贈1000只需一倍流水
擁有體驗金免費體驗賭場
網紅部落客推薦保證出金線上娛樂城
缺點
需透過客服申請體驗金
富遊娛樂城存取款方式
存款方式
提供四大超商(全家、7-11、萊爾富、ok超商)
虛擬貨幣ustd存款
銀行轉帳(各大銀行皆可)
取款方式
網站內申請提款及可匯款至綁定帳戶
現金1:1出金
富遊娛樂城平台系統
真人百家 — RG真人、DG真人、歐博真人、DB真人(原亞博/PM)、SA真人、OG真人、WM真人
體育投注 — SUPER體育、鑫寶體育、熊貓體育(原亞博/PM)
彩票遊戲 — 富遊彩票、WIN 539
電子遊戲 —RG電子、ZG電子、BNG電子、BWIN電子、RSG電子、GR電子(好路)
棋牌遊戲 —ZG棋牌、亞博棋牌、好路棋牌、博亞棋牌
電競遊戲 — 熊貓體育
捕魚遊戲 —ZG捕魚、RSG捕魚、好路GR捕魚、DB捕魚
dogeverse, a new many chain meme coin that https://thedogeverse.io/, has raised a staggering 15million bucks on pre-sale. stay informed of our daily new trends about crypto adventure.
The main goal in https://poppyplaytimeplays.com is to observe an eerie dilly-dally with mill, make plain complex puzzles, and disappear from the lurking threats. Players sine qua non utilize their wits to uncover the mill’s evil past. This fake is a faultless mix of alarm and mystery.
this article [url=https://sanclboxgame.cc/]The Sandbox Metaverse Map[/url]
excellent points altogether, you simply received a new reader.
What would you recommend about your post that you simply made some days in the
past? Any certain?
Накрутка подписчиков Инстаграм, Тик Ток, Ютуб, Телеграм, Твиттер
https://chexov.net/iskusstvo-virusnyh-chellendzhej-pochemu-nakrutka-podpischikov-vazhnyj-shag/
Frequently Asked Questions (FAQs) spribe aviator
Encountered a captivating article, I propose you read https://vikna.rv.ua/user/ligavuser
Интересуетесь недвижимостью? Наш ресурс – ваш надежный проводник в этой сфере. У нас вы найдете множество полезных статей на такие темы, как [url=https://abraziv-pferd.ru]квартиры от застройщика[/url], а также [url=https://abraziv-pferd.ru]оценка недвижимости[/url].
Подробные аналитические материалы, экспертные мнения и простые рекомендации — все это доступно у нас!
In recent years, CBD products have skyrocketed in popularity for their potential health benefits and natural healing properties.
Here is my page https://aadlenewesleyl3.sg-host.com/index.php?title=Zenleaf_CBD:_How_To_Talk_About_CBD_With_Skeptics
Накрутка подписчиков Инстаграм, Тик Ток, Ютуб, Телеграм, Твиттер
https://teletap.org/novosti-mira/pravdivyj-vzglyad-na-nakrutku-lajkov-v-soczialnyh-setyah.html
Excellent web site you’ve got here.. It’s hard to find excellent
writing like yours nowadays. I honestly appreciate individuals like you!
Take care!!keluaran angka togel hari ini
The ability to play from anywhere, coupled with the variety of games available, has attracted millions of aviator game download for pc
娛樂城
在现代,在线赌场提供了多种便捷的存款和取款方式。对于较大金额的存款,您可以选择中国信托、台中银行、合作金库、台新银行、国泰银行或中华邮政。这些银行提供的服务覆盖金额范围从$1000到$10万,确保您的资金可以安全高效地转入赌场账户。
如果您需要进行较小金额的存款,可以选择通过便利店充值。7-11、全家、莱尔富和OK超商都提供这种服务,适用于金额范围在$1000到$2万之间的充值。通过这些便利店,您可以轻松快捷地完成资金转账,无需担心银行的营业时间或复杂的操作流程。
在进行娱乐场提款时,您可以选择通过各大银行转账或ATM转账。这些方法不仅安全可靠,而且非常方便,适合各种提款需求。最低提款金额为$1000,而上限则没有限制,确保您可以灵活地管理您的资金。
在选择在线赌场时,玩家评价和推荐也是非常重要的。许多IG网红和部落客,如丽莎、穎柔、猫少女日记-Kitty等,都对一些知名的娱乐场给予了高度评价。这些推荐不仅帮助您找到可靠的娱乐场所,还能确保您在游戏中享受到最佳的用户体验。
总体来说,在线赌场通过提供多样化的存款和取款方式,以及得到广泛认可的服务质量,正在不断吸引更多的玩家。无论您选择通过银行还是便利店进行充值,都能体验到快速便捷的操作。同时,通过查看玩家的真实评价和推荐,您也能更有信心地选择合适的娱乐场,享受安全、公正的游戏环境。
Player台灣線上娛樂城遊戲指南與評測
台灣最佳線上娛樂城遊戲的終極指南!我們提供專業評測,分析熱門老虎機、百家樂、棋牌及其他賭博遊戲。從遊戲規則、策略到選擇最佳娛樂城,我們全方位覆蓋,協助您更安全的遊玩。
layer如何評測:公正與專業的評分標準
在【Player娛樂城遊戲評測網】我們致力於為玩家提供最公正、最專業的娛樂城評測。我們的評測過程涵蓋多個關鍵領域,旨在確保玩家獲得可靠且全面的信息。以下是我們評測娛樂城的主要步驟:
安全與公平性
安全永遠是我們評測的首要標準。我們審查每家娛樂城的執照資訊、監管機構以及使用的隨機數生成器,以確保其遊戲結果的公平性和隨機性。
02.
遊戲品質與多樣性
遊戲的品質和多樣性對於玩家體驗至關重要。我們評估遊戲的圖形、音效、用戶介面和創新性。同時,我們也考量娛樂城提供的遊戲種類,包括老虎機、桌遊、即時遊戲等。
03.
娛樂城優惠與促銷活動
我們仔細審視各種獎勵計劃和促銷活動,包括歡迎獎勵、免費旋轉和忠誠計劃。重要的是,我們也檢查這些優惠的賭注要求和條款條件,以確保它們公平且實用。
04.
客戶支持
優質的客戶支持是娛樂城質量的重要指標。我們評估支持團隊的可用性、響應速度和專業程度。一個好的娛樂城應該提供多種聯繫方式,包括即時聊天、電子郵件和電話支持。
05.
銀行與支付選項
我們檢查娛樂城提供的存款和提款選項,以及相關的處理時間和手續費。多樣化且安全的支付方式對於玩家來說非常重要。
06.
網站易用性、娛樂城APP體驗
一個直觀且易於導航的網站可以顯著提升玩家體驗。我們評估網站的設計、可訪問性和移動兼容性。
07.
玩家評價與反饋
我們考慮真實玩家的評價和反饋。這些資料幫助我們了解娛樂城在實際玩家中的表現。
娛樂城常見問題
娛樂城是什麼?
娛樂城是什麼?娛樂城是台灣對於線上賭場的特別稱呼,線上賭場分為幾種:現金版、信用版、手機娛樂城(娛樂城APP),一般來說,台灣人在稱娛樂城時,是指現金版線上賭場。
線上賭場在別的國家也有別的名稱,美國 – Casino, Gambling、中國 – 线上赌场,娱乐城、日本 – オンラインカジノ、越南 – Nhà cái。
娛樂城會被抓嗎?
在台灣,根據刑法第266條,不論是實體或線上賭博,參與賭博的行為可處最高5萬元罰金。而根據刑法第268條,為賭博提供場所並意圖營利的行為,可能面臨3年以下有期徒刑及最高9萬元罰金。一般賭客若被抓到,通常被視為輕微罪行,原則上不會被判處監禁。
信用版娛樂城是什麼?
信用版娛樂城是一種線上賭博平台,其中的賭博活動不是直接以現金進行交易,而是基於信用系統。在這種模式下,玩家在進行賭博時使用虛擬的信用點數或籌碼,這些點數或籌碼代表了一定的貨幣價值,但實際的金錢交易會在賭博活動結束後進行結算。
現金版娛樂城是什麼?
現金版娛樂城是一種線上博弈平台,其中玩家使用實際的金錢進行賭博活動。玩家需要先存入真實貨幣,這些資金轉化為平台上的遊戲籌碼或信用,用於參與各種賭場遊戲。當玩家贏得賭局時,他們可以將這些籌碼或信用兌換回現金。
娛樂城體驗金是什麼?
娛樂城體驗金是娛樂場所為新客戶提供的一種免費遊玩資金,允許玩家在不需要自己投入任何資金的情況下,可以進行各類遊戲的娛樂城試玩。這種體驗金的數額一般介於100元到1,000元之間,且對於如何使用這些體驗金以達到提款條件,各家娛樂城設有不同的規則。
https://telegra.ph/Zalozhit-avtomobil-06-13
Хотите знать, что происходит в мире ММА прямо сейчас? Octagon Express предлагает вам [url=https://octagon.express/category/novosti-mma/]новости ММА на сегодня[/url]! Самые свежие события, горячие интервью и эксклюзивные видео ждут вас на нашем сайте. Не пропустите ни одной важной новости и будьте в центре событий. Подписывайтесь на обновления и всегда будьте в курсе всех новостей ММА с Octagon Express!
I will immediately seize your rss feed as I can not find your email subscription hyperlink or e-newsletter
service. Do you have any? Please allow me recognise in order that I may just
subscribe. Thanks.
wikipedia reference [url=https://osu.digital]Osu[/url]
https://robinknot7.bloggersdelight.dk/2024/06/13/%d0%b7%d0%b0%d0%b9%d0%bc-%d0%bf%d0%be%d0%b4-%d0%bf%d1%82%d1%81/
[url=https://mounjaro-apteka.ru]mounjaro 5 mg[/url] – моунжаро, ozempic инструкция
dynamic features, and social elements, it offers an engaging experience for players. The game is supported by aviator casino delano
Накрутка подписчиков Инстаграм, Тик Ток, Ютуб, Телеграм, Твиттер
https://www.sq.com.ua/rus/press_release/04.10.2023/kupit-podpiscikov-v-ukraine-vasi-preimushhestva-i-garantii-kakoi-sait-v-etom-pomozet-body
discover this info here [url=https://notepad.network]Notepad[/url]
https://drawerbeetle5.werite.net/zaim-pod-mashinu
How to Start Playing the Aviator Game? aviator game mobile
Почему стоит построить дом из бруса 9х12 | Почему стоит построить дом из бруса 9х12 | Особенности кровли дома из бруса 9х12 | Как обеспечить эффективное отопление в доме из бруса 9х12 | Типы фундаментов для дома из бруса 9х12 | Фундамент для дома из бруса 9х12: какой выбрать? | Современные технологии строительства дома из бруса 9х12 | Современные технологии строительства дома из бруса 9х12 | Как обустроить зону отдыха в доме из бруса 9х12 | Как рассчитать бюджет на строительство дома из бруса 9х12
проект дома из бруса 9х12 [url=https://domizbrusa-9x12spb.ru/]https://domizbrusa-9x12spb.ru/[/url] .
https://bakerybeetle1.bloggersdelight.dk/2024/06/13/%d0%b7%d0%b0%d0%bb%d0%be%d0%b3-%d0%bf%d0%be%d0%b4-%d0%bf%d1%82%d1%81-%d1%81%d0%bf%d0%b1/
Читайте полезные статьи на актуальные темы, связанные с продажей жилья, например покупка квартиры в новостройке или ликвидационная стоимость недвижимости.
Сайт: https://ooo-trotuar.ru
Накрутка подписчиков Инстаграм, Тик Ток, Ютуб, Телеграм, Твиттер
https://donklephant.net/sport/nakrutka-i-sport-kak-prodvigat-sportivnye-meropriyatiya-i-tovary-s-pomoshhyu-nakrutkamedia-com.html
Piece of writing writing is also a fun, if you know afterward you can write
if not it is difficult to write.
User Interface and Design Rabona Aviator
Unquestionably believe that which you said. Your favorite
reason seemed to be on the internet the easiest thing to be aware of.
I say to you, I definitely get annoyed while people
consider worries that they plainly do not know
about. You managed to hit the nail upon the top and
also defined out the whole thing without having side-effects ,
people can take a signal. Will likely be back to get more.
Thanks
I read this paragraph fully regarding the comparison of latest and earlier
technologies, it’s awesome article.
The weight of the parcel ehappynews.com can be up to 20 kg, and its format must correspond to the size of the trunk.
สล็อตเว็บตรง
удаление когтей у кошек цена
[url=https://peaksview.me/en]House with hot tube in the mountains[/url] – Iznajmljivanje vikendica sa dakuzijem, House rental in the mountains of Montenegro
Накрутка подписчиков Инстаграм, Тик Ток, Ютуб, Телеграм, Твиттер
https://www.otzyvua.net/uk/nakrutkamediacom
кастрация собак
Common Feedback and Suggestions aviator game hack pc
All these points are important master-stroy.com in the process of manufacturing and installation of metal structures. Pay attention to them so as not to encounter difficulties in the future.
If some one needs to be updated with most up-to-date technologies afterward he must
be pay a visit this web page and be up to date daily.
It’s almost time! After catching this one at Fantastic Fest last year, we have been chomping at the bit for its wide release [url=https://www.fangoria.com/satanic-hispanics-trailer-latin-folklore-horror/]https://www.fangoria.com/satanic-hispanics-trailer-latin-folklore-horror/[/url]
linked here [url=https://crackzipraronline.com/]zip rar[/url]
https://robincoal4.werite.net/zaim-pod-zalog-pts-bez-avto
где обитает постельный клоп
Обработка деревьев и сада от вредителей и болезней
Source:
[url=https://chelyabinsk-ses.ru/post16]где обитает постельный клоп[/url]
Хотите узнать всё о процессе [url=https://potolokperm59.ru]оформления недвижимости в собственность[/url]?
Наш интернет-ресурс предлагает вам самые полезные информационные статьи на такие темы, как: [url=https://potolokperm59.ru]оформление документов на недвижимость через МФЦ[/url], [url=https://potolokperm59.ru]покупка новостройки от застройщика[/url].
Здесь вы найдете ответы на все вопросы и получите полную информацию о процессе оформления жилья в собственность.
Online Platforms Offering the Game how to play aviator successfully
свит бонанза на деньги [url=https://sweet-bonanza-ru.ru/]свит бонанза на деньги[/url] .
https://fingercrack1.werite.net/kredit-s-zalogom-avtomobilia
Discovered an article that might interest you – don’t miss it! https://gaznaauto.com.ua/posluga-taksi-v-kievi-zruchnist-shvidkist-i/
абстинентный синдром при алкоголизме https://lechenie-narkomanii.kz/
https://rafofficial.com/?keyword=mabar-69-slot
娛樂城排行
2024娛樂城推薦,經過玩家實測結果出爐Top5!
2024娛樂城排名是這五間上榜,玩家尋找娛樂城無非就是要找穩定出金娛樂城,遊戲體驗良好、速度流暢,Ace博評網都幫你整理好了,給予娛樂城新手最佳的指南,不再擔心被黑網娛樂城詐騙!
2024娛樂城簡述
在現代,2024娛樂城數量已經超越以前,面對琳瑯滿目的娛樂城品牌,身為新手的玩家肯定難以辨別哪間好、哪間壞。
好的平台提供穩定的速度與遊戲體驗,穩定的系統與資訊安全可以保障用戶的隱私與資料,不用擔心收到傳票與任何網路威脅,這些線上賭場也提供合理的優惠活動給予玩家。
壞的娛樂城除了會騙取你的金錢之外,也會打著不實的廣告、優惠滿滿,想領卻是一場空!甚至有些平台還沒辦法登入,入口網站也是架設用來騙取新手儲值進他們口袋,這些黑網娛樂城是玩家必須避開的風險!
評測2024娛樂城的標準
Ace這次從網路上找來五位使用過娛樂城資歷2年以上的老玩家,給予他們使用各大娛樂城平台,最終選出Top5,而評選標準為下列這些條件:
以玩家觀點出發,優先考量玩家利益
豐富的遊戲種類與卓越的遊戲體驗
平台的信譽及其安全性措施
客服團隊的回應速度與服務品質
簡便的儲值流程和多樣的存款方法
吸引人的優惠活動方案
前五名娛樂城表格
賭博網站排名 線上賭場 平台特色 玩家實測評價
No.1 富遊娛樂城 遊戲選擇豐富,老玩家優惠多 正面好評
No.2 bet365娛樂城 知名大廠牌,運彩盤口選擇多 介面流暢
No.3 亞博娛樂城 多語言支持,介面簡潔順暢 賽事豐富
No.4 PM娛樂城 撲克牌遊戲豐富,選擇多元 直播順暢
No.5 1xbet娛樂城 直播流暢,安全可靠 佳評如潮
線上娛樂城玩家遊戲體驗評價分享
網友A:娛樂城平台百百款,富遊娛樂城是我3年以來長期使用的娛樂城,別人有的系統他們都有,出金也沒有被卡過,比起那些玩娛樂城還會收到傳票的娛樂城,富遊真的很穩定,值得推薦。
網友B:bet365中文的介面簡約,還有超多體育賽事盤口可以選擇,此外賽事大部分也都有附上直播來源,不必擔心看不到賽事最新狀況,全螢幕還能夠下單,真的超方便!
網友C:富遊娛樂城除了第一次儲值有優惠之外,儲值到一定金額還有好禮五選一,實用又方便,有問題的時候也有客服隨時能夠解答。
網友D:從大陸來台灣工作,沒想到台灣也能玩到亞博體育,這是以前在大陸就有使用的平台,雖然不是簡體字,但使用介面完全沒問題,遊戲流暢、速度比以前使用還更快速。
網友E:看玖壹壹MV發現了PM娛樂城這個大品牌,PM的真人百家樂沒有輸給在澳門實地賭場,甚至根本不用出門,超級方便的啦!
https://blacktalkradio.ca/taringbet
Came across a unique article – it’s worth your attention https://pk-vega.ru/user/marcammann
снятие похмельного синдрома https://lechenie-narkomanii.kz/
Software Requirements aviator casino sign in
I’m not sure why but this web site is loading very slow for me.
Is anyone else having this problem or is it a issue on my end?
I’ll check back later on and see if the problem
still exists.
Ричтраки являются важным элементом для эффективного
управления складскими операциями, так как они обеспечивают быстрый и безопасный перемещение грузов на значительные высоты и в ограниченных пространственных условиях.
Подробнее на https://reachtrucks.ru/richtrack/still/
Продажа ричтраков разных марок
Ричтраки, известные также как узкопроходные штабелеры,
представляют собой специализированный вид погрузочно-разгрузочного оборудования, предназначенный для
работы в узких проходах. Они отличаются высокой маневренностью и возможностью подъема
грузов на значительные высоты, что делает их незаменимыми для современных складских комплексов с
высокой степенью использования
вертикального пространства.
Популярные бренды ричтраков
Toyota
Toyota, известная своими инновациями в области
логистики, предлагает широкий ассортимент ричтраков, которые сочетают
в себе мощность, надёжность и экологичность.
Преимущества: Высокая производительность, улучшенные системы безопасности, долговечность.
Jungheinrich
Немецкий бренд Jungheinrich славится своим передовым технологическим подходом и ориентированностью на энергоэффективность.
Преимущества: Высокая энергоэффективность, интуитивно понятное управление, долговечные батареи.
Crown
Crown концентрируется на инновациях
и эргономике, предлагая ричтраки,
которые обеспечивают максимальный комфорт и продуктивность оператора.
Преимущества: Удобное управление, надежные компоненты, высокие стандарты безопасности.
Linde
Linde является признанным лидером в разработке и производстве инновационного складского оборудования.
Преимущества: Прочные и удобные в
управлении устройства, высокоэффективная гидравлика, стабильность
и безопасность при эксплуатации.
Преимущества использования ричтраков
1.Оптимизация складских процессов.
Ричтраки позволяют эффективно использовать вертикальное пространство склада, что
способствует увеличению общей вместимости
и максимизации полезной площади.
Скорость и точность. Современные ричтраки позволяют быстро и точно перемещать грузы,
что существенно повышает производительность и сокращает время выполнения складских операций.
Повышенная безопасность. Безопасность операторов и персонала склада обеспечивается за счет встроенных систем контроля
стабильности, предотвращения
опрокидывания и других передовых технологий.
Экономическая эффективность.
Использование энергоэффективных ричтраков позволяет снизить операционные расходы на электроэнергию и техобслуживание.
Ричтраки являются неотъемлемой частью современного складского хозяйства.
Выбор надежного бренда и модели, подходящей
именно для ваших нужд, обеспечит высокую производительность
и эффективность ваших логистических процессов.
Важно учитывать специфические требования вашего склада,
а также финансовые возможности при выборе ричтраков.
Инвестируя в качественное оборудование от проверенных производителей,
вы делаете шаг к оптимизации и успеху вашего бизнеса.
Хотите узнать самые горячие новости из мира бокса? Octagon Express представляет вам [url=https://octagon.express/category/novosti-boksa/]новости бокса на сегодня[/url]! Свежие интервью, захватывающие видео и аналитические обзоры – все это ждет вас на нашем сайте. Следите за всеми важными событиями и не пропустите ни одной сенсации. Подписывайтесь на обновления и будьте первым, кто узнает все последние новости из мира бокса вместе с Octagon Express!
Right here is the right blog for anybody who really wants to find out about this topic. You understand so much its almost hard to argue with you (not that I really would want to…HaHa). You definitely put a brand new spin on a topic which has been discussed for a long time. Great stuff, just excellent!
регистрация Twin Casino
of players who enjoy the excitement of this high-flying adventure and see if you have what it takes to time your aviator game bet
Итальянская мебель от салона https://formul.ru в Москве – это большой выбор мебели из Италии по доступным ценам! Итальянская мебель в налиичи и на заказ. Купить итальянскую мебель в Москве по лучшим ценам.
Hi there to all, because I am really keen of reading this blog’s post to be updated daily. It contains good material.
new retro casino зеркало
Wonders Travel & Tourism: a https://jordan-travel.com agency located in Aqaba. Specializing in tours around Jordan, including Petra, Wadi Rum, the Dead Sea, and Amman. Offering private tours that can be customized to tourist interests and have positive reviews for professionalism and service.
Hi there, everything is going nicely here and ofcourse every one is sharing data, that’s actually fine, keep up writing.
http://musey-uglich.ru/
An impressive share! I have just forwarded this onto a colleague who had been doing a little homework on this. And he in fact bought me lunch simply because I discovered it for him… lol. So allow me to reword this…. Thanks for the meal!! But yeah, thanx for spending some time to talk about this matter here on your internet site.
katsubet no deposit bonus codes 2023
Key Developers and Companies Involved aviator game kya hai
Здравствуйте!
Студенческая жизнь прекрасна, пока не приходит время писать диплом, как это случилось со мной. Не стоит отчаиваться, ведь существуют компании, которые помогают с написанием и защитой диплома на высокие оценки!
Сначала я искал информацию по теме: купить диплом о высшем образовании в брянске, купить аттестат 9 классов, диплом о среднем профессиональном образовании купить отзывы, за сколько можно купить красный диплом, купить диплом о высшем образовании в ставрополе, а потом наткнулся на http://www.arusak-diploms-srednee.ru, где все мои учебные проблемы были решены!
Удачи и хороших оценок!
купить диплом в уссурийске
сколько стоит диплом о среднем образовании
купить аттестат за 11 класс в нижнем новгороде
купить диплом и сертификат массаж лица
купить диплом медицинский университет
купить диплом нового образца в нижнем новгороде
купить диплом в набережных челнах
купить диплом фармацевта
купить диплом в новороссийске
купить диплом образования в пензе
В нашем мире, где диплом – это начало отличной карьеры в любом направлении, многие пытаются найти максимально быстрый путь получения образования. Важность наличия официального документа сложно переоценить. Ведь диплом открывает двери перед каждым человеком, желающим вступить в профессиональное сообщество или продолжить обучение в высшем учебном заведении.
В данном контексте мы предлагаем очень быстро получить этот необходимый документ. Вы имеете возможность приобрести диплом старого или нового образца, и это становится отличным решением для человека, который не смог закончить обучение или утратил документ. Все дипломы изготавливаются аккуратно, с максимальным вниманием ко всем нюансам, чтобы в итоге получился 100% оригинальный документ.
Преимущества подобного подхода заключаются не только в том, что вы сможете оперативно получить свой диплом. Весь процесс организован просто и легко, с нашей поддержкой. От выбора нужного образца документа до консультаций по заполнению личной информации и доставки по России — все под абсолютным контролем качественных специалистов.
Для всех, кто ищет оперативный способ получить требуемый документ, наша компания предлагает выгодное решение. Заказать диплом – это значит избежать длительного обучения и не теряя времени переходить к достижению своих целей, будь то поступление в университет или начало карьеры.
http://www.seoyour.ru
[url=https://ndt.su/id/proyavitel-inspektor-ldn-aerozol-500ml-172.html]проявитель инспектор ldn[/url] – проявитель инспектор ldn, пенетрант инспектор prn
It’s an amazing post in support of all the online visitors;
they will take advantage from it I am sure.
https://diigo.com/0wkjlx
[url=https://nkpribor.ru/id/kolposkop-mikromed-ks-1-300-led-13868.html]кольпоскоп купить[/url] – крановые весы купить, муфельная печь цена
На сайте https://napolnye-plintusy.ru/ в огромном ассортименте представлены напольные плинтусы. Они станут идеальным решением для декорирования помещения. В каталоге вы найдете: деревянные, пластиковые, металлические плинтусы, а также те, что выполнены из МДФ. Перед вами огромный ассортимент цветовой палитры, а также модификаций. Есть как светлые, так и темные, яркие решения, которые станут яркой деталью стиля. Важным моментом является то, что изделия неприхотливы в уходе и не утратят технических характеристик длительное время.
$20. The key is to find the right balance between risk and reward. aviator demo gratis
I think the admin of this web page is actually
working hard in favor of his web page, since here every stuff is
quality based data.
world-newss.com
womenbabe.com
Хочешь быть в курсе всех самых горячих новостей из мира UFC? Octagon Express предлагает тебе [url=https://octagon.express/]главные новости UFC[/url]. Узнай первым о новых боях, победах и поражениях. Интервью с бойцами, эксклюзивные материалы и аналитика ждут тебя. Подписывайся на обновления и будь в центре событий вместе с Octagon Express!
娛樂城
2024娛樂城介紹
台灣2024娛樂城越開越多間,新開的線上賭場層出不窮,每間都以獨家的娛樂城優惠和體驗金來吸引玩家,致力於提供一流的賭博遊戲體驗。以下來介紹這幾間娛樂城網友對他們的真實評價,看看哪些娛樂城上榜了吧!
2024娛樂城排名
2023下半年,各家娛樂城競爭激烈,相繼推出誘人優惠,不論是娛樂城體驗金、反水流水還是首儲禮金,甚至還有娛樂城抽I15手機。以下就是2024年網友推薦的娛樂城排名:
NO.1 富遊娛樂城
NO.2 Bet365台灣
NO.3 DG娛樂城
NO.4 九州娛樂城
NO.5 亞博娛樂城
2024娛樂城推薦
根據2024娛樂城排名,以下將富遊娛樂城、BET365、亞博娛樂城、九州娛樂城、王者娛樂城推薦給大家,包含首儲贈點、免費體驗金、存提款速度、流水等等…
娛樂城遊戲種類
線上娛樂城憑藉其廣泛的遊戲種類,成功滿足了各式各樣玩家的喜好和需求。這些娛樂城遊戲不僅多元化且各具特色,能夠為玩家提供無與倫比的娛樂體驗。下面是一些最受歡迎的娛樂城遊戲類型:
電子老虎機
魔龍傳奇、雷神之鎚、戰神呂布、聚寶財神、鼠來寶、皇家777
真人百家樂
真人視訊百家樂、牛牛、龍虎、炸金花、骰寶、輪盤
電子棋牌
德州撲克、兩人麻將、21點、十三支、妞妞、三公、鬥地主、大老二、牌九
體育下注
世界盃足球賽、NBA、WBC世棒賽、英超、英雄聯盟LOL、特戰英豪
線上彩票
大樂透、539、美國天天樂、香港六合彩、北京賽車
捕魚機遊戲
三仙捕魚、福娃捕魚、招財貓釣魚、西遊降魔、吃我一砲、賓果捕魚
2024娛樂城常見問題
娛樂城是什麼?
娛樂城/線上賭場(現金網)是台灣對於線上賭場的特別稱呼,而且是現金網,大家也許會好奇為什麼不直接叫做線上賭場或是線上博弈就好了。
其實這是有原因的,線上賭場這種東西,架站在台灣是違法的,在早期經營線上博弈被抓的風險非常高所以換了一個打模糊仗的代稱「娛樂城」來規避警方的耳目,畢竟以前沒有Google這種東西,這樣的代稱還是多少有些作用的。
信用版娛樂城是什麼?
信用版娛樂城是一種賭博平台,允許玩家在沒有預先充值的情況下參與遊戲。這種模式類似於信用卡,通常以周結或月結的方式結算遊戲費用。因此,如果玩家無法有效管理自己的投注額,可能會在月底面臨巨大的支付壓力。
娛樂城不出金怎麼辦?
釐清原因,如未違反娛樂城機制,可能是遇上黑網娛樂城,請盡快通報165反詐騙。
https://antheat9.bloggersdelight.dk/2024/06/13/%d0%ba%d1%80%d0%b5%d0%b4%d0%b8%d1%82-%d0%bf%d0%be%d0%b4-%d0%b7%d0%b0%d0%bb%d0%be%d0%b3-%d0%b0%d0%b2%d1%82%d0%be-%d0%b2-%d1%81%d0%bf%d0%b1/
Хотите знать, когда будут проходить самые интересные бои? Octagon Express предлагает вам актуальное [url=https://octagon.express/category/events/]расписание боев ММА[/url]. Узнайте даты и время предстоящих поединков, чтобы не пропустить ни одного захватывающего события. Подписывайтесь на обновления и следите за всеми важными боями вместе с Octagon Express. Оставайтесь в центре событий и наслаждайтесь каждой минутой настоящего ММА-экшена!
Всем привет)
Будучи студентом, я наслаждался учебой до тех пор, пока не пришло время писать диплом. Но паниковать не стоило, ведь существуют компании, которые помогают с написанием и защитой диплома на отличные оценки!
Изначально я искал информацию по теме: , , , , , затем наткнулся на , где все мои учебные вопросы были решены!
Удачи и хороших оценок!
Great post however I was wondering if you could write a litte more on this subject? I’d be very grateful if you could elaborate a little bit more. Cheers!
musey-uglich.ru
реристрация Dragon Money Casino онлайн казино Dragon Money
[Casino Name], each offering unique bonuses and promotions for Aviator Game players. spribe aviator
https://canvas.instructure.com/eportfolios/2963379/Home/_
официальный сайт драгон мани казино Dragon Money Casino
Портал о культуре Ярославля – ваш гид по культурной жизни города. Здесь вы найдёте информацию о театрах, музеях, галереях и исторических достопримечательностях. Откройте для себя яркие события, фестивали и выставки, которые делают Ярославль культурной жемчужиной России.
регистрация драгон мани казино драгон мани казино
I just couldn’t depart your website before suggesting that I actually
loved the standard information an individual supply for your
guests? Is going to be again incessantly in order to investigate
cross-check new posts
Интересуетесь актуальными событиями в UFC? Octagon Express предлагает вам [url=https://octagon.express/category/novosti-mma/]новости UFC на сегодня[/url]. Узнавайте о самых последних боях, интервью с топовыми бойцами и аналитике от профессионалов. Мы публикуем только проверенную и свежую информацию, чтобы вы всегда были в курсе всех событий. Подписывайтесь на наши обновления и не пропускайте ни одной важной детали. Оставайтесь информированными с Octagon Express!
Undeniably believe that which you stated. Your favorite justification appeared to be on the net
the simplest thing to be aware of. I say to you, I certainly get annoyed while people consider worries that they just do not know about.
You managed to hit the nail upon the top and also defined out
the whole thing without having side-effects , people could take a
signal. Will probably be back to get more. Thanks
Fair Play Policies and RNG aviator hack bot free
Oh my goodness! Amazing article dude! Thank you,
However I am encountering issues with your RSS. I don’t understand why I
can’t join it. Is there anybody getting the same RSS problems?
Anybody who knows the solution will you kindly respond?
Thanks!!
1go casino 1go casino
The material is cleaned, coated magic-stroy.com with protective agents against rust, and other steps are performed.
Customer service is how well invest24news.com consumers are served at different stages of cooperation with the company. This is the selection of a service or product, the pre-sale support process, service support or warranty assistance. Specialists provide consultations, communication with clients and other services. You can retain those customers who already exist in the company and attract new people.
[url=https://art-print18.ru/]открытки[/url] – заказать рисунок в типографии, коробки для цветов
https://sunstyle.kiev.ua/roman-blinds.html
Every weekend i used to pay a quick visit this website, for the reason that i
want enjoyment, since this this web page conations in fact nice
funny stuff too.
This text is invaluable. When can I find out more?
umorfishki.ru/page/27
triumph-flowers.ru/bukety-nevesty/yarkij-buket-nevesty/
airmedbiologics.com/qualified_preferred_abattoir_relationships.aspx
iclicky.com/index.php?do=/public/user/blogs/name_Alanpoe/page_5/
http://www.otoritasnews.co.id/sedekah-cf/
1го казино zamok-09.ru
вход 1go casino официальный сайт 1го казино
Frequently Asked Questions (FAQs) aviator game melbet
Howdy! This post could not be written much better! Looking at this post reminds me
of my previous roommate! He always kept talking about this.
I am going to send this information to him.
Pretty sure he’s going to have a good read.
Many thanks for sharing!
https://diigo.com/0wkjef
This is really interesting, You are a very skilled blogger. I have joined your rss feed and look forward to seeking extra of your excellent post. Additionally, I have shared your site in my social networks
http://www.rusforum.com/group.php?do=discuss&group=&discussionid=662
c2c.buzz/index.php?do=/public/user/blogs/view/name_Alanpoe/id_119636/title_/
opaseke.com/users/6782
childtemperament.org/index.php?lang=es
jaezfinancialgroup.icu/pages/contact-us
Player台灣線上娛樂城遊戲指南與評測
台灣最佳線上娛樂城遊戲的終極指南!我們提供專業評測,分析熱門老虎機、百家樂、棋牌及其他賭博遊戲。從遊戲規則、策略到選擇最佳娛樂城,我們全方位覆蓋,協助您更安全的遊玩。
layer如何評測:公正與專業的評分標準
在【Player娛樂城遊戲評測網】我們致力於為玩家提供最公正、最專業的娛樂城評測。我們的評測過程涵蓋多個關鍵領域,旨在確保玩家獲得可靠且全面的信息。以下是我們評測娛樂城的主要步驟:
安全與公平性
安全永遠是我們評測的首要標準。我們審查每家娛樂城的執照資訊、監管機構以及使用的隨機數生成器,以確保其遊戲結果的公平性和隨機性。
02.
遊戲品質與多樣性
遊戲的品質和多樣性對於玩家體驗至關重要。我們評估遊戲的圖形、音效、用戶介面和創新性。同時,我們也考量娛樂城提供的遊戲種類,包括老虎機、桌遊、即時遊戲等。
03.
娛樂城優惠與促銷活動
我們仔細審視各種獎勵計劃和促銷活動,包括歡迎獎勵、免費旋轉和忠誠計劃。重要的是,我們也檢查這些優惠的賭注要求和條款條件,以確保它們公平且實用。
04.
客戶支持
優質的客戶支持是娛樂城質量的重要指標。我們評估支持團隊的可用性、響應速度和專業程度。一個好的娛樂城應該提供多種聯繫方式,包括即時聊天、電子郵件和電話支持。
05.
銀行與支付選項
我們檢查娛樂城提供的存款和提款選項,以及相關的處理時間和手續費。多樣化且安全的支付方式對於玩家來說非常重要。
06.
網站易用性、娛樂城APP體驗
一個直觀且易於導航的網站可以顯著提升玩家體驗。我們評估網站的設計、可訪問性和移動兼容性。
07.
玩家評價與反饋
我們考慮真實玩家的評價和反饋。這些資料幫助我們了解娛樂城在實際玩家中的表現。
娛樂城常見問題
娛樂城是什麼?
娛樂城是什麼?娛樂城是台灣對於線上賭場的特別稱呼,線上賭場分為幾種:現金版、信用版、手機娛樂城(娛樂城APP),一般來說,台灣人在稱娛樂城時,是指現金版線上賭場。
線上賭場在別的國家也有別的名稱,美國 – Casino, Gambling、中國 – 线上赌场,娱乐城、日本 – オンラインカジノ、越南 – Nhà cái。
娛樂城會被抓嗎?
在台灣,根據刑法第266條,不論是實體或線上賭博,參與賭博的行為可處最高5萬元罰金。而根據刑法第268條,為賭博提供場所並意圖營利的行為,可能面臨3年以下有期徒刑及最高9萬元罰金。一般賭客若被抓到,通常被視為輕微罪行,原則上不會被判處監禁。
信用版娛樂城是什麼?
信用版娛樂城是一種線上賭博平台,其中的賭博活動不是直接以現金進行交易,而是基於信用系統。在這種模式下,玩家在進行賭博時使用虛擬的信用點數或籌碼,這些點數或籌碼代表了一定的貨幣價值,但實際的金錢交易會在賭博活動結束後進行結算。
現金版娛樂城是什麼?
現金版娛樂城是一種線上博弈平台,其中玩家使用實際的金錢進行賭博活動。玩家需要先存入真實貨幣,這些資金轉化為平台上的遊戲籌碼或信用,用於參與各種賭場遊戲。當玩家贏得賭局時,他們可以將這些籌碼或信用兌換回現金。
娛樂城體驗金是什麼?
娛樂城體驗金是娛樂場所為新客戶提供的一種免費遊玩資金,允許玩家在不需要自己投入任何資金的情況下,可以進行各類遊戲的娛樂城試玩。這種體驗金的數額一般介於100元到1,000元之間,且對於如何使用這些體驗金以達到提款條件,各家娛樂城設有不同的規則。
Будьте всегда в курсе всех событий в мире бокса с Octagon Express! На нашем сайте вы найдете [url=https://octagon.express/]главные новости бокса на сегодня[/url]. Мы предлагаем свежие интервью с бойцами, подробные обзоры боев и аналитические статьи от экспертов. Получайте самую актуальную информацию о предстоящих поединках и результатах боев. Оставайтесь на шаг впереди и не пропустите ни одной важной новости. Подпишитесь на обновления и следите за всеми событиями вместе с Octagon Express!
台灣線上娛樂城
在现代,在线赌场提供了多种便捷的存款和取款方式。对于较大金额的存款,您可以选择中国信托、台中银行、合作金库、台新银行、国泰银行或中华邮政。这些银行提供的服务覆盖金额范围从$1000到$10万,确保您的资金可以安全高效地转入赌场账户。
如果您需要进行较小金额的存款,可以选择通过便利店充值。7-11、全家、莱尔富和OK超商都提供这种服务,适用于金额范围在$1000到$2万之间的充值。通过这些便利店,您可以轻松快捷地完成资金转账,无需担心银行的营业时间或复杂的操作流程。
在进行娱乐场提款时,您可以选择通过各大银行转账或ATM转账。这些方法不仅安全可靠,而且非常方便,适合各种提款需求。最低提款金额为$1000,而上限则没有限制,确保您可以灵活地管理您的资金。
在选择在线赌场时,玩家评价和推荐也是非常重要的。许多IG网红和部落客,如丽莎、穎柔、猫少女日记-Kitty等,都对一些知名的娱乐场给予了高度评价。这些推荐不仅帮助您找到可靠的娱乐场所,还能确保您在游戏中享受到最佳的用户体验。
总体来说,在线赌场通过提供多样化的存款和取款方式,以及得到广泛认可的服务质量,正在不断吸引更多的玩家。无论您选择通过银行还是便利店进行充值,都能体验到快速便捷的操作。同时,通过查看玩家的真实评价和推荐,您也能更有信心地选择合适的娱乐场,享受安全、公正的游戏环境。
Encountered a unique article Р be sure to take a look and see for yourself http://shockmusik.ru/besplatnyie-frispinyi-za-registratsiyu-v-kazino
Experienced players can benefit from more advanced strategies, such as: aviator app for pc
Hey there! I just wanted to ask if you ever have any trouble with hackers?
My last blog (wordpress) was hacked and I ended up losing
many months of hard work due to no backup. Do you have
any solutions to protect against hackers?
[url=https://dbshop.ru/services/ustanovka-avtozvuka/ustanovka-sabvufera/]установка сабвуфера в машину[/url] – шумоизоляция капота автомобиля, закрытый короб 15
Привет учащиеся!
Недавно у меня возникла потребность в получении среднего образования, но моя постоянная работа и обязанности постоянно отнимают время, не оставляя возможности этим заниматься. К счастью, друзья подсказали мне, что можно легально приобрести диплом о среднем профессиональном образовании (диплом техникума, колледжа) на бланках государственного образца, пройдя обучение по упрощенной программе!
В интернете предложений более чем достаточно, но как не стать жертвой мошенников и выбрать подходящую компанию? Этот вопрос требует особой внимательности и ответственности. Лично я проверил, что на https://arusak-diploms-srednee.ru есть много полезной информации о том, как избежать ошибок и не потерять свои деньги. Как можно проверить компанию по продаже дипломов, на что обратить внимание, и, конечно же, там можно заказать диплом “под ключ” без предварительной оплаты.
В отличие от других коммерческих организаций, наша цель не сводится к заработку – мы работаем на благо наших клиентов. Мы предоставляем бесплатные консультации без ограничений по количеству вопросов. Наши специалисты – проверенные временем профессионалы, поэтому обращение к нам – правильное решение, ведь мы гарантируем качество, соблюдение сроков и разумные цены на дипломы о среднем образовании на заказ.
Удачи и хороших оценок!
сколько стоит аттестат 9 класса
купить аттестат школьный
купить диплом колледжа в новосибирске
можно купить диплом в россии
купить диплом о среднем образовании в санкт петербурге
купить диплом в магадане
можно ли подделать аттестат
купить диплом о среднем образовании красноярск
диплом о высшем образовании 1996 года купить
купить диплом вуза недорого
Good day! This is my first comment here so I just wanted to give a quick shout out and say I really enjoy reading through your posts. Can you recommend any other blogs/websites/forums that go over the same topics? Thank you so much!
lespilomaterial.ru/
rsn360.ru/blogs/315/%D0%94%D0%BE%D1%81%D1%82%D0%B8%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-%D0%BE%D0%B1%D1%80%D0%B0%D0%B7%D0%BE%D0%B2%D0%B0%D1%82%D0%B5%D0%BB%D1%8C%D0%BD%D1%8B%D1%85-%D1%86%D0%B5%D0%BB%D0%B5%D0%B9-%D0%9A%D0%B0%D0%BA-%D0%BA%D1%83%D0%BF%D0%B8%D1%82%D1%8C-%D0%B4%D0%B8%D0%BF%D0%BB%D0%BE%D0%BC-%D1%81-%D0%B2%D1%8B%D0%B3%D0%BE%D0%B4%D0%BE%D0%B9?lang=tr_tr
http://www.bseo-agency.com/blogs/119817/%D0%94%D0%B8%D0%BF%D0%BB%D0%BE%D0%BC%D1%8B-%D0%BA%D0%BE%D1%82%D0%BE%D1%80%D1%8B%D0%B5-%D0%BF%D0%BE%D0%BC%D0%BE%D0%B3%D1%83%D1%82-%D0%B2%D0%B0%D0%BC-%D0%B4%D0%BE%D1%81%D1%82%D0%B8%D1%87%D1%8C-%D0%B2%D0%B0%D1%88%D0%B8%D1%85-%D1%86%D0%B5%D0%BB%D0%B5%D0%B9-%D0%B1%D1%8B%D1%81%D1%82%D1%80%D0%B5%D0%B5
ehealthfiles.com/Differentiators.html
stroimnsk.ru/wooden/proekt-derevyannogo-doma-iz-profilirovannogo-brusa-skazka-100/
https://diigo.com/0wkjjr
игра крейзи манки [url=https://crazy-monkey-ru.ru/]crazy-monkey-ru.ru[/url] .
квартира в новостройке купить квартиру в казани от застройщика
Hello! I know this is kinda off topic but I was
wondering if you knew where I could locate a captcha plugin for my comment
form? I’m using the same blog platform as yours and I’m having trouble finding one?
Thanks a lot!
The courier needs to pick floridahomz.com up the parcel from the sender and deliver it to the recipient. In case of unforeseen situations, all parcels are insured.
продажа квартир цены продажа квартир цены
http://maps.google.com.np/url?q=http://surl.li/unlav
Cash Out: Decide when to cash out to secure your winnings. If you cash out before the plane crashes, you win. If aviator application
купить квартиру от застройщика с отделкой квартиры в новостройках казани
Stumbled upon an interesting article – I suggest you take a look https://bbbbnewss.blogspot.com/2024/06/blog-post_88.html
Здравствуйте!
Задался вопросом: можно ли на самом деле купить диплом государственного образца в Москве? Был приятно удивлен — это реально и легально!
Сначала искал информацию в интернете на тему: купить морской диплом, купить диплом в армавире, купить диплом в оренбурге, купить диплом в грозном, купить диплом в новомосковске и получил базовые знания. В итоге остановился на материале: https://khabmama.ru/forum/viewtopic.php?t=246815
Удачи и хороших оценок!
https://lala.lanbook.com/virtualnaya-i-dopolnennaya-realnosti-v-obuchenii
thiswhatido.com
квартиры от застройщика цены https://novostroyka-kzn16.ru
I got this website from my buddy who informed me on the topic of this site and now this time I am visiting this web page and reading very informative articles or reviews at this time.
appleincub.ru/page/11
http://www.advesti.ru/creative/1
dsgolfcenters.com/crossings/form.html
animalprotect.org/forum/index.php?action=profile;u=4779;area=showposts;sa=topics;start=330
venturetraining.net/tag/return-on-investment/
купить квартиру https://kvartiru-kupit-spb.ru
купить квартиру в Санкт-Петербурге продажа квартир цены
https://emmerechts.com/?keyword=ug300
Подарок для конкурента
https://xrumer.ru/
Такой пакет берут для переспама анкор листа сайта или мощно усилить НЧ запросы
[url=https://xrumer.ru/]Подарок для конкурента[/url]
Hi I am so excited I found your webpage, I really found you by accident, while I was searching on Askjeeve for something else, Regardless I am here now and would just like to say kudos for a remarkable post and a all round thrilling blog (I also love the theme/design), I don’t have time to read through it all at the minute but I have saved it and also included your RSS feeds, so when I have time I will be back to read more, Please do keep up the great work.
parenvarmii.ru/topic4065.html?view=previous
nemspb.ru/objects/zhd-stantsiya-babaevo-oktyabrskoj-zheleznoj-dorogi/
cahaya.my.id/%D0%B4%D0%B8%D0%BF%D0%BB%D0%BE%D0%BC%D1%8B-%D0%B4%D0%BB%D1%8F-%D1%82%D0%B5%D1%85-%D0%BA%D1%82%D0%BE-%D1%86%D0%B5%D0%BD%D0%B8%D1%82-%D1%81%D0%B2%D0%BE%D0%B5-%D0%B2%D1%80%D0%B5%D0%BC%D1%8F-%D0%B8
myweektour.ru/page/4/
eqagent.ru/users/36?wid=426
User Interface and Design aviator how to play
The manual version must womenup.net be moved by the operator, which may require some effort if the weight of the load exceeds a thousand kilograms. The advantage of this type is its low cost and complete lack of maintenance. However, such a loader will not lift the load to too great a height.
квартира от застройщика https://kvartiru-kupit78.ru
купить квартиру в Санкт-Петербурге в новостройках Санкт-Петербурга. Цены и фотографии квартир от застройщика в готовых и строящихся ЖК. Подбор жилья, ипотечные программы, сопровождение сделок и выгодные предложения.
Ignoring Patterns: Failing to observe and learn from the game’s patterns can reduce your chances of winning. aviator game prediction hack
Hey there, I think your website might be having browser compatibility issues.
When I look at your blog in Firefox, it looks fine but when opening
in Internet Explorer, it has some overlapping. I just wanted to give you
a quick heads up! Other then that, superb blog!
Awesome issues here. I’m very satisfied to see your article. Thank you so much and I’m taking a look ahead to contact you. Will you please drop me a mail?
http://www.leac-escrime.fr/edj-entrainement-des-jeunes-2020-2021/
formfinance.ru/kupit-diplom-lyubogo-obraztsa
honda-fit.ru/forums/index.php?autocom=gallery&req=si&img=5224
poznanie.gtaserv.ru/viewtopic.php?f=9&p=1937
topbestessays.com/
If you’re looking for a thrilling and unique online casino game, give the Aviator Game a try. Join the millions the aviator game
What a data of un-ambiguity and preserveness of precious familiarity concerning unexpected emotions.
http://www.tonylandis.com/tag/php/
click2connectclubs.com/index.php?do=/public/user/blogs/view/name_Alanpoe/id_119636/title_/
newtownmemorialfund.org/about/
dr650.ehehe.net/cgi/bbs/discourse/c_board.cgi?page=0&mode=move&pass=&u_max=&tmpl=
bamcreativestudio.com.au/index.php/blog
http://prikoly-tut.ru/
There is a list of items not worldofwood.net allowed for transportation by courier. Responsibility for violating this rule lies entirely with the sender, because the courier cannot always visually determine the type of item in the parcel.
Multiplayer Options and Social Interaction lucky star aviator game
квартира от застройщика https://novostroyki-spb78.ru
http://prikoly-tut.ru/
http://stroymaterial39.ru/
https://canvas.instructure.com/eportfolios/2963391/Home/_
продажа квартир цены продажа квартир цены
The Aviator Game is an exciting online casino game that has captivated players worldwide with its unique blend aviator game is real or fake in hindi
What’s up, after reading this awesome post i am as well delighted to share my knowledge here with
mates.
цены на квартиры https://novostroyki-spb78.ru
[url=https://t.me/ozempic_zakazat]оземпик раствор +для инъекций купить[/url] – мунжаро отзывы, ozempic минск
https://images.google.ad/url?q=http://surl.li/unkze
http://stroymaterial39.ru/
[url=https://t.me/ozempicg]семаглутид +для похудения купить[/url] – пропала саксенда, оземпик препарат инструкция цена +для похудения
[url=https://saffelychange.com]обменник нетекс24[/url] – safelychange сайт, safelychange обменник
Key Developers and Companies Involved aviator hack apk for pc
Professional care of the premises. Cleaners undergo house-invest.com detailed training, where they learn the combination of different cleaning products with different types of materials.
Found an enthralling read that I’d recommend – it’s truly fascinating http://mamapoltava.listbb.ru/viewtopic.php?f=39&t=4790
Каталог эротических рассказов https://vicmin.ru подарит тебе возможность уйти от рутины и погрузиться в мир секса и безудержного наслаждения. Обширная коллекция рассказов для взрослых разбудит твое воображение и принесет немыслимое удовольствие.
http://images.google.com.af/url?q=http://surl.li/unlam
https://telegra.ph/Dengi-pod-pts-spb-06-13
that use encryption and secure payment methods to protect their personal and financial information. aviator demo game spribe
Right now it seems like Movable Type is the preferred blogging platform out there right now. (from what I’ve read) Is that what you’re using on your blog?
here4deals.com/garderie-barny-horaires.php
la-buket.ru/catalog/?ELEMENT_ID=50&SECTION_ID=2
portugues.ru/forum/album.php?albumid=80&attachmentid=3712
89.108.65.91/content/articles/65330/
http://www.sojuzpharma.ru/about/pharmopeka?page=674&per-page=5
Encountered a unique article – be sure to take a look and see for yourself http://kuvandyk.ru/message.php?msg=151
Что касается [url=https://xn—-7sbeem4bsncflq.xn--p1ai/]бурение скважин на воду иркутская область[/url] мы вам обязательно поможем. На нашем онлайн портале можно узнать примерную глубину бурения на собственном участке в видео, а также цены. Но самый безупречный способ — это пригласить к себе эксперта для определения правильного места под скважину, понятие объема работы и, соответственно, стоимость. Оставьте контактный номер телефона и мы свяжемся с Вами в скорое время.
Если вы хотите снять шлюху в Донецке, заходите на сайт intimdnr.com – [url=https://intimdnr.com/]заказать индивидуалку донецк[/url] . У нас представлен широкий выбор проверенных девушек, готовых подарить вам незабываемые моменты. Все анкеты содержат подробные фото и информацию, чтобы вы могли сделать осознанный выбор. Мы гарантируем высокий уровень сервиса и полную конфиденциальность. Выбирайте понравившуюся шлюху и оставляйте заявку на сайте. На intimdnr.com – [url=https://intimdnr.com/]вызов проститутки недорого[/url] вы легко найдете идеальную спутницу, которая удовлетворит все ваши желания. Наслаждайтесь качественным сервисом и приятным общением с нашими девушками в Донецке.
What’s up, I would like to subscribe for this weblog to get most up-to-date updates, thus where can i do it please assist.
http://www.forum.jrudevels.org/profile.php?mode=viewprofile&u=563048
sjtudivingcenter.com/message/index.php?class1=52&page=10&lang=en
forum.wowcircle.com/member.php?u=584887&tab=activitystream&type=all&page=2
forexsnews.ru/page/3
ukrevents.ru/page/4/
Advanced Tips for Experienced Players aviator casino online
[url=https://kraken-14-at.org/]kraken14 at[/url] – kraken darknet ссылка, kraken зеркало даркнет
[url=https://exhubio.com/]exhub отзывы[/url] – bestchange ru обменник, обменять биткоин
https://maps.google.co.ao/url?q=http://surl.li/unlap
Game Mechanics aviator virtual game
Новостройки в Екатеринбурге, купить квартиру в новостройке https://kupit-kvartiruekb.ru от застройщика. Строительство жилой и коммерческой недвижимости. Высокое качество, прозрачность на всех этапах строительства и сделки.
Приобрести [url=https://xn—-7sbeem4bsncflq.xn--p1ai/]пробурить скважину на воду[/url] можно на веб портале мастер-буров.рф уже сейчас. Скважина с чистой водой — один из важных компонентов на Вашем участке. Мы даем гарантию на качество проделанной работы, материалов, а также предлагаем сервисное обслуживание. Природные факторы могут разрушительно влиять на скважину и качество воды, мы также справляемся с восстановлением поврежденных скважин от поломок и с очищением от заиливания. Звоните, приходите, будем рады с Вами сотрудничать.
где купить диплом среднем https://diplom-izhevsk.ru
pg slot
???????????? — ????????? ?????? ??????? ??????????? ??? ?????????
???????????????? ??? PG ??????????????????????? ???????? ???????????? ???????????????????????????? ??????? ???????????????? ????????? ???????? ???? ?????????????????? ???????
??? PG Slot ?????????????????????????? ????????? ???????? ????????????? ??? ???????????????????????????????? ?????? ??? HTML 5 ???????? ??????????????? ???????? ???????????????????????????? ????????????? ??????? ??????????????????????????? ????? ??????????????? ???????????? ?????????? ??????????? ??????????? ????????? ????????????????????????????????
????????????????????????
?????????????? ?????? ???? Android ???? iOS ???????? ?????????????????????????????? ?????????? ????????????????? ????????????????????? ?????????????? ???????? ????????? ???????????????????? ???? ?????????????????????????? ???????????????? ??????????? ?????????? ??????????????
??????????????????????????
??????????????????????????????????????? PG Slot ????? ????????? ?????????????? ???????? ??????????? ?????? ?????????? ?????????? ??????????????????? ???????????????????????? ????????? ???????????????? ????????????? ?????????????????????? ????????????????????? ?????????????????????????
?????????????????
???????? ?????????? ????????????????????????????? PG Slot ?????????????????? ????????? ???????????????????????????????????????????? ??? ?????????????????????????????????????????????????????????????????????????????????????????????????
????????????????????????????
PG Slot ?????????????????????????????????????????? ????? ?????????????????????????????? 24 ??????? ????????????????? ????????????????????????? ??????????? ?????????????????? ???????????????????????????????????????????????????????????????????????
????????????????
??????????????? PG Slot ?????????? ??????? ?? ????????????????????????????????????????????? ??????????????? ?????????????????? ????????? ???????????????????????????? ? ????????? ?????????????????????????????????????????????
??????????????????????? PG Slot ????????????????????????? ???????????????????????????????????????????????????????? ?????????????????????????????????????????????????? ?????????????????????????????? ???????? ????????????????????? ?????????????????????????????????? ????????? ????????????????????????????? PG Slot ??????!
Just check out the best Whosplayingwithfire nude on live sex chat ever!
[url=http://remote.ecostm.co.kr/bbs/board.php?bo_table=c1&wr_id=10709]Naked hot webcams g[/url][url=http://www.dnpaint.co.kr/bbs/board.php?bo_table=B31&wr_id=4618636]Nude hot cams girl[/url] 0f6_0d6
Aw, this was a very nice post. Taking a few minutes and actual effort to generate a good article… but what can I say… I hesitate a lot and never seem to get nearly anything done.
retrogaming.in.ua/index.php?ukey=linkexchange&did=33&le_categoryID=0&page=22&show_all=yes
prachuabwit.ac.th/krusuriya/modules.php?name=Journal&file=display&jid=12564
tivi24h.com/2011/01/xem-bong-online-bong-truc-tuyen-kenh.html
http://www.forums.wolflair.com/member.php?u=110846
web011.dmonster.kr/bbs/board.php?bo_table=b0501&wr_id=181555
สล็อต
สล็อตเว็บตรง: ความสนุกสนานที่ผู้เล่นไม่ควรพลาด
การเล่นสล็อตออนไลน์ในปัจจุบันนี้เป็นที่นิยมเพิ่มมากขึ้น เนื่องจากความง่ายดายที่นักเดิมพันสามารถใช้งานได้จากทุกที่ได้ตลอดเวลา โดยไม่ต้องเสียเวลาในการเดินทางไปยังคาสิโน ในบทความนี้ที่เราจะนำเสนอ เราจะนำเสนอเกี่ยวกับ “สล็อต” และความเพลิดเพลินที่คุณจะได้พบในเกมสล็อตออนไลน์เว็บตรง
ความสะดวกในการเล่นสล็อต
หนึ่งในสล็อตออนไลน์เว็บตรงเป็นที่นิยมอย่างมาก คือความสะดวกสบายที่ผู้เล่นมี คุณสามารถเล่นได้ทุกหนทุกแห่งทุกเวลา ไม่ว่าจะเป็นในบ้าน ที่ทำงาน หรือแม้แต่ขณะเดินทางอยู่ สิ่งที่จำเป็นต้องมีคืออุปกรณ์ที่สามารถเชื่อมต่ออินเทอร์เน็ตได้ ไม่ว่าจะเป็นโทรศัพท์มือถือ แทปเล็ต หรือโน้ตบุ๊ก
นวัตกรรมกับสล็อตออนไลน์เว็บตรง
การเล่นสล็อตออนไลน์ในปัจจุบันไม่เพียงแต่สะดวก แต่ยังมีเทคโนโลยีที่ทันสมัยล้ำสมัยอีกด้วย สล็อตที่เว็บตรงใช้เทคโนโลยี HTML5 ซึ่งทำให้ผู้เล่นไม่ต้องกังวลใจเกี่ยวกับการลงโปรแกรมหรือแอปพลิเคชันเสริม แค่เปิดเบราว์เซอร์บนเครื่องมือของคุณและเข้าสู่เว็บของเรา คุณก็สามารถเริ่มเล่นเกมสล็อตได้ทันที
ตัวเลือกหลากหลายของเกมของสล็อต
สล็อตออนไลน์เว็บตรงมาพร้อมกับตัวเลือกหลากหลายของเกมให้เลือกที่ท่านเลือกได้ ไม่ว่าจะเป็นเกมคลาสสิกหรือเกมที่มีฟีเจอร์ฟีเจอร์พิเศษและโบนัสหลากหลาย ผู้เล่นจะพบเจอมีเกมที่ให้เล่นมากมาย ซึ่งทำให้ไม่เบื่อกับการเล่นสล็อต
การรองรับทุกอุปกรณ์
ไม่ว่าคุณจะใช้สมาร์ทโฟนแอนดรอยด์หรือ iOS คุณก็สามารถเล่นสล็อตได้ไม่มีสะดุด เว็บของเราสนับสนุนระบบและทุกเครื่องมือ ไม่ว่าจะเป็นสมาร์ทโฟนรุ่นใหม่หรือรุ่นก่อน หรือแม้กระทั่งแท็บเล็ตและแล็ปท็อป ผู้เล่นก็สามารถสนุกกับเกมสล็อตได้ได้อย่างครบถ้วน
ทดลองเล่นสล็อตฟรี
สำหรับผู้ที่เพิ่งเริ่มต้นกับการเล่นสล็อต หรือยังไม่มั่นใจเกี่ยวกับเกมที่ชอบ PG Slot ยังมีฟีเจอร์สล็อตทดลองฟรี ท่านสามารถทดลองเล่นได้ทันทีโดยไม่ต้องลงทะเบียนหรือฝากเงินก่อน การทดลองเล่นนี้จะช่วยให้คุณเรียนรู้วิธีการเล่นและเข้าใจเกมได้โดยไม่ต้องเสียค่าใช้จ่ายใด ๆ
โปรโมชันและโบนัส
ข้อดีอีกอย่างหนึ่งของการเล่นเกมสล็อตกับ PG Slot คือมีโปรโมชั่นและโบนัสพิเศษมากมายสำหรับผู้เล่น ไม่ว่าท่านจะเป็นสมาชิกใหม่หรือสมาชิกที่มีอยู่ ผู้เล่นสามารถรับโปรโมชั่นและโบนัสต่าง ๆ ได้ตลอดเวลา ซึ่งจะเพิ่มโอกาสชนะและเพิ่มความบันเทิงในเกม
โดยสรุป
การเล่นเกมสล็อตออนไลน์ที่ PG Slot เป็นการการลงทุนทางเกมที่คุ้มค่า ท่านจะได้รับความสนุกและความสะดวกสบายจากการเล่นเกม นอกจากนี้ยังมีโอกาสชนะรางวัลและโบนัสหลากหลาย ไม่ว่าท่านจะใช้มือถือ แทปเล็ตหรือคอมพิวเตอร์ยี่ห้อไหน ก็สามารถเริ่มเล่นกับเราได้ทันที อย่ารอช้า สมัครสมาชิกและเริ่มเล่นสล็อตออนไลน์ PG Slot เดี๋ยวนี้
laptops, tablets, and smartphones. This flexibility allows players to enjoy the game on their preferred device, trick to win aviator
На сайте https://3d-printery-77.ru/ в огромном выборе находятся 3D принтеры, которые идеально подходят для выполнения самых разных задач. Вы всегда сможете воспользоваться профессиональной консультацией, а на всю продукцию предоставляется гарантия качества. Организуется оперативная доставка по стране. Все принтеры представлены именитыми, проверенными и надежными брендами, которые дорожат репутацией. Также есть изделия, которые предназначены для профессионального использования.
rupiahtoto
สล็อตเว็บโดยตรง — ใช้ โทรศัพท์มือถือ แท็บเล็ต คอมฯ ฯลฯ ในการเล่น
ระบบสล็อตเว็บตรง ของ PG Slot ได้รับการพัฒนาและปรับปรุง เพื่อให้ รองรับการใช้งาน บนอุปกรณ์ที่หลากหลายได้อย่าง ครบถ้วน ไม่สำคัญว่าจะใช้ สมาร์ทโฟน แท็บเลต หรือ คอมฯ แบบไหน
ที่ PG Slot เราเข้าใจถึงความต้องการ ของลูกค้า ในเรื่อง ความสะดวก และ การเข้าถึงเกมคาสิโนที่รวดเร็ว เราจึง ใช้ HTML 5 ซึ่งเป็น เทคโนโลยีที่ทันสมัยที่สุด ปัจจุบันนี้ มาพัฒนาเว็บไซต์ของเรากันเถอะ คุณจึงไม่ต้อง ดาวน์โหลดแอป หรือติดตั้งโปรแกรมเพิ่มเติม เพียง เปิดเบราว์เซอร์ บนอุปกรณ์ที่ มีอยู่ของคุณ และเยี่ยมชม เว็บของเรา คุณสามารถ สนุกกับสล็อตได้ทันที
การรองรับอุปกรณ์หลายชนิด
ไม่ว่าคุณจะใช้ มือถือ ระบบ แอนดรอยด์ หรือ iOS ก็สามารถ เล่นสล็อตออนไลน์ได้ไม่มีสะดุด ระบบของเรา ออกแบบมาให้รองรับ ระบบต่าง ๆ ไม่สำคัญว่าคุณ กำลังใช้ สมาร์ทโฟน รุ่นใหม่หรือรุ่นเก่า หรือ แม้แต่แท็บเล็ตหรือแล็ปท็อป ทุกอย่างก็สามารถ ใช้งานได้ดี ไม่มีปัญหา เรื่องความเข้ากันได้
สามารถเล่นได้ทุกที่ทุกเวลา
หนึ่งในข้อดีของการเล่นสล็อตกับ PG Slot คือ คุณสามารถ เล่นได้ตลอดเวลา ไม่ว่าจะ เป็นที่บ้าน ออฟฟิศ หรือแม้แต่ ที่สาธารณะ สิ่งที่คุณต้องมีคือ เน็ต คุณสามารถ เริ่มเกมได้ทันที และคุณไม่ต้อง กังวลเรื่องการโหลด หรือติดตั้งโปรแกรมที่ ใช้พื้นที่บนอุปกรณ์ของคุณ
เล่นสล็อตฟรี
เพื่อให้ ผู้เล่นใหม่ ได้ลองเล่นและสัมผัสเกมสล็อตของเรา PG Slot ยังมีบริการสล็อตฟรี คุณสามารถ เริ่มเล่นได้ทันทีโดยไม่ต้องลงทะเบียนหรือฝากเงิน การ ทดลองเล่นสล็อตนี้จะช่วยให้คุณรู้จักวิธีการเล่นและเข้าใจเกมก่อนเดิมพันด้วยเงินจริง
การบริการและความปลอดภัย
PG Slot มุ่งมั่นในการบริการลูกค้าที่ดีที่สุด เรามี ทีมงานพร้อมบริการคุณตลอดเวลา นอกจากนี้เรายังมี ระบบความปลอดภัยที่ทันสมัย ด้วยวิธีนี้ คุณจึงมั่นใจได้ว่า ข้อมูลส่วนบุคคลและธุรกรรมทางการเงินของคุณจะได้รับการปกป้องอย่างดีที่สุด
โปรโมชันและโบนัส
ข้อดีอีกประการของการเล่นสล็อตแมชชีนกับ PG Slot คือ มี โปรโมชั่นและโบนัสพิเศษมากมายสำหรับผู้เข้าร่วม ไม่ว่าคุณจะเป็น สมาชิกใหม่หรือเก่า คุณสามารถ รับโปรโมชั่นและโบนัสต่างๆได้อย่างต่อเนื่อง สิ่งนี้จะ เพิ่มโอกาสชนะและสนุกกับเกมมากขึ้น
สรุปการเล่นสล็อตเว็บที่ PG Slot ถือเป็นการลงทุนที่คุ้มค่า คุณจะไม่เพียงได้รับความสุขและความสะดวกสบายจากเกมเท่านั้น แต่คุณยังมีโอกาสลุ้นรับรางวัลและโบนัสมากมายอีกด้วย ไม่สำคัญว่าจะใช้โทรศัพท์มือถือ แท็บเล็ต หรือคอมพิวเตอร์รุ่นใด สามารถมาร่วมสนุกกับเราได้เลยตอนนี้ อย่ารอช้า ลงทะเบียนและเริ่มเล่นสล็อตกับ PG Slot วันนี้!
Заказать [url=https://xn—-7sbeem4bsncflq.xn--p1ai/]пробурить скважину[/url] можно на веб портале мастер-буров.рф прямо сейчас. Скважина с питьевой водой — один из важных компонентов на Вашем участке. Мы даем гарантию на качество проделанной работы, материалов, а также предлагаем гарантийное обслуживание. Наружние факторы могут разрушительно влиять на скважину и качество воды, мы также работаем с восстановлением поврежденных скважин от деформации и с очищением от заиливания. Звоните, приходите, будем рады с Вами работать.
Заказать [url=https://xn—-7sbeem4bsncflq.xn--p1ai/]устройство скважины на воду[/url] можно на онлайн ресурсе мастер-буров.рф уже сейчас. Скважина с чистой водой — один из главных компонентов на Вашем участке. Мы гарантируем качество проделанной работы, материалов, а также предлагаем сервисное обслуживание. Природные факторы могут разрушительно влиять на скважину и качество воды, мы также работаем с восстановлением скважин от разрушения и с очищением от заиливания. Звоните, приходите, будем рады с Вами работать.
สำหรับ ไซต์ PG Slots มีความ มี ข้อได้เปรียบ หลายประการ เมื่อเทียบกับ คาสิโนแบบ ดั้งเดิม, อย่างเฉพาะเจาะจง ใน ยุคสมัยใหม่. คุณสมบัติสำคัญ เหล่านี้ ประกอบด้วย:
ความสะดวกสบาย: ผู้เล่น สามารถเข้าร่วม สล็อตออนไลน์ได้ ตลอดเวลา จาก ทุกที่, ช่วย ผู้เล่นสามารถ เข้าร่วม ได้ ทุกอย่าง โดยไม่ต้อง ต้องเดินทาง ไปคาสิโนแบบ ทั่วไป ๆ
เกมที่หลากหลาย: สล็อตออนไลน์ นำเสนอ ประเภทเกม ที่ หลากหลาย, เช่น สล็อตประเภทคลาสสิค หรือ ตัวเกม ที่มี คุณสมบัติ และประโยชน์ พิเศษ, ไม่ทำ ความเหงา ในเกม
โปรโมชั่น และประโยชน์: สล็อตออนไลน์ ส่วนใหญ่ ให้บริการ แคมเปญส่งเสริมการขาย และรางวัล เพื่อเพิ่ม ความสามารถ ในการ ชนะ และ ปรับปรุง ความเพลิดเพลิน ให้กับเกม
ความปลอดภัย และ ความน่าเชื่อถือ: สล็อตออนไลน์ ส่วนใหญ่ มี การรักษาความปลอดภัย ที่ เหมาะสม, และ ทำให้มั่นใจ ว่า ข้อมูลส่วนตัว และ การเงิน จะมี ปกป้อง
ความช่วยเหลือ: PG Slots ใช้ ผู้เชี่ยวชาญ ที่มีประสบการณ์ ที่ตั้งใจ สนับสนุน ตลอดเวลา
การเล่นบนมือถือ: สล็อต PG อนุญาต การเล่นบนมือถือ, ทำให้ ผู้เล่นสามารถเล่น ตลอดเวลา
ทดลองใช้ฟรี: เกี่ยวกับ ผู้เล่นใหม่, PG ยังให้ เล่นทดลองฟรี เพิ่มเติมด้วย, เพื่อให้ ผู้เล่น ทดลอง วิธีใช้ และเข้าใจ เกมก่อน เล่นด้วยเงินจริง
สล็อต PG มีคุณลักษณะ คุณสมบัติที่ดี หลายอย่าง ที่ ก่อให้เกิด ให้ได้รับความต้องการ ในปัจจุบันนี้, ช่วย การ ความเพลิดเพลิน ให้กับเกมด้วย.
ทดลองเล่นสล็อต
ทดลองปฏิบัติเล่นสล็อต และค้นพบประสบการณ์การเล่นเกมที่ไม่เหมือนใคร!
สำหรับนักพนันที่กำลังต้องการความบันเทิงและโอกาสในการชนะรางวัลมหาศาล สล็อตออนไลน์เป็นอีกหนึ่งโอกาสที่คุ้มค่าศึกษา.ด้วยความหลากหลายของเกมสล็อตที่น่าตื่นเต้น ผู้เล่นสามารถปฏิบัติและค้นหาเกมที่ชื่นชอบได้อย่างง่ายดาย.
ไม่ว่าคุณจะชอบเกมสล็อตคลาสสิกหรือต้องการสิ่งใหม่, ตัวเลือกรอล้ำหน้าให้คุณสัมผัส. จากสล็อตที่มีแบบมากมาย ไปจนถึงเกมที่มีรูปแบบพิเศษและรางวัลมากมาย, ผู้เล่นจะได้พบกับประสบการณ์ใหม่ที่น่าตื่นเต้นและน่าติดตาม.
ด้วยการทดลองเล่นสล็อตฟรี, คุณสามารถทำความคุ้นเคยวิธีการเล่นและค้นตัดสินใจกลยุทธ์ที่ต้องการก่อนวางเดิมพันด้วยเงินจริง. นี่คือโอกาสดีที่จะเรียนรู้กับเกมและปรับปรุงโอกาสในการได้รับรางวัลใหญ่.
อย่าประวิงเวลา, เข้าร่วมกับการลองเล่นสล็อตออนไลน์วันนี้ และค้นพบประสบการณ์การเล่นเกมที่ไม่เหมือนใคร! เพลิดเพลินกับความท้าทาย, ความเพลิดเพลิน และโอกาสทองชนะรางวัลมหาศาล. เริ่มต้นเดินทางสู่ความสำเร็จลุล่วงของคุณในวงการสล็อตออนไลน์แล้ววันนี้!
ลองใช้ ใช้งาน สล็อต PG พร้อม เข้าถึง มุ่งสู่ ยุค แห่ง ความตื่นเต้น ที่ ไม่จำกัด
ของ คอพนัน ที่ กำลัง มองหา ประสบการณ์ เกมที่แตกต่าง, สล็อต PG ถูกมองว่า ทางออก ที่ ดึงดูดความสนใจ มากมาย. อันเนื่องมาจาก ความหลากหลายของ ของ เกมสล็อต ที่ น่าทึ่ง และ น่าค้นหา, นักพนัน จะสามารถ ลองเล่น และ ค้นหา เกม ที่ เหมาะกับ ลีลาการเล่น ของตนเอง.
แม้ว่า ผู้เล่น จะตามหา ความเพลิดเพลิน ที่คุ้นเคย หรือ ความยากท้าทาย ที่แปลกใหม่, สล็อต PG มีให้เลือก ที่หลากหลาย. ตั้งแต่ สล็อตแบบดั้งเดิม ที่ คุ้นเคย ไปจนถึง ตัวเกม ที่ มี ฟังก์ชันพิเศษ และ โบนัสอย่างล้นหลาม, ลูกค้า จะสามารถ ได้รับ ประสบการณ์การเล่น ที่ ตื่นเต้น และ เร้าใจ
ด้วย การเล่นทดลอง สล็อต PG ฟรี, นักพนัน สามารถ ศึกษา ขั้นตอนการเล่น และ ทดลอง กลยุทธ์ ต่างๆ ก่อนหน้า เริ่มพนัน ด้วยเงินจริง. ถึงกระนั้น ถือว่าเป็น ช่องทาง ที่ดีเยี่ยม ที่จะ ปรับตัว และ ส่งเสริม ความเป็นไปได้ ในการ ได้รับรางวัล รางวัลมากมาย.
อย่าชักช้า, เข้าถึง ด้วย การลองเล่น สล็อต PG วันนี้ และ พบเจอ ประสบการณ์การเล่นเกม ที่ ไร้ขีดจำกัด! พบเจอ ความดึงดูดใจ, ความบันเทิง และ ช่องทาง ในการ ได้รับรางวัล มหายิ่ง. เริ่มลงมือ เดินทาง สู่ ความก้าวหน้า ของคุณในวงการ เกมสล็อต เดี๋ยวนี้!
Register an account, make a deposit, and navigate to the Aviator Game to start playing. aviator casino game hack
Greetings! This is my 1st comment here so I just wanted to give a
quick shout out and say I truly enjoy reading your posts.
Can you suggest any other blogs/websites/forums
that deal with the same subjects? Many thanks!
buy dumps newfresh high balance LIVE 24/24 – 2024 (No DIE) 【Visit CcBuy.Black】 All COUNTRY US , UK , CA , AU , EU , IS , AO
————-CONTACT———————–
WEBSITE : >>>>>> CcBuy✹ Black
—– HERE COMES THE PRICE LIST ———–
***** CVV Other countries
DZ VISA CARD = $3,6 per 1 (buy >5 with price $2.5 per 1).
GN VISA CARD = $2,8 per 1 (buy >5 with price $2.5 per 1).
LR VISA CARD = $2,8 per 1 (buy >5 with price $2.5 per 1).
NI VISA CARD = $4,6 per 1 (buy >5 with price $2.5 per 1).
***** CVV US:
– US MASTER CARD = $2,7 per 1 (buy >5 with price $3 per 1).
– US VISA CARD = $2,9 per 1 (buy >5 with price $2.5 per 1).
– US AMEX CARD = $3,6 per 1 (buy >5 with price $2.5 per 1).
– US DISCOVER CARD = $3,8 per 1 (buy >5 with price $3.5 per 1).
– US CARD WITH DOB = $15 per 1 (buy >5 with price $12 per 1).
– US FULLZ INFO = $40 per 1 (buy >10 with price $30 per 1).
***** CCV UK:
– UK CARD NORMAL = $2,8 per 1 (buy >5 with price $3 per 1).
– UK MASTER CARD = $3,5 per 1 (buy >5 with price $2.5 per 1).
– UK VISA CARD = $3,3 per 1 (buy >5 with price $2.5 per 1).
– UK AMEX CARD = $3,1 per 1 (buy >5 with price $4 per 1).
$
– UK CARD WITH DOB = $15 per 1 (buy >5 with price $14 per 1).
– UK WITH BIN = $10 per 1 (buy >5 with price $9 per 1).
– UK WITH BIN WITH DOB = $25 per 1 (buy >20 with price $22 per 1).
– UK FULLZ INFO = $40 per 1 (buy >10 with price $35 per 1).
***** CCV AU:
– AU MASTER CARD = $5.5 per 1 (buy >5 with price $5 per 1).
– AU VISA CARD = $5.5 per 1 (buy >5 with price $5 per 1).
– AU AMEX CARD = $8.5 per 1 (buy >5 with price $8 per 1).
– AU DISCOVER CARD = $8.5 per 1 (buy >5 with price $8 per 1).
***** CCV CA:
– CA MASTER CARD = $6 per 1 (buy >5 with price $5 per 1).
– CA VISA CARD = $6 per 1 (buy >5 with price $5 per 1).
– CA VISA BUSINESS = $14 per 1 (buy >5 with price $13 per 1).
เมื่อพูดถึงโรงงานผลิตร่ม โรงงานทำร่ม.com คือชื่อที่หลายคนคุ้นเคยและไว้วางใจ ด้วยประสบการณ์ยาวนานกว่า ยี่สิบปีในวงการอุตสาหกรรมร่ม เราคือผู้เชี่ยวชาญตั้งแต่การสร้างสรรค์ การเลือกวัสดุคุณภาพ ไปจนถึงกระบวนการผลิตที่ได้มาตรฐาน เพื่อส่งมอบร่มคุณภาพสูงให้กับลูกค้าทุกท่าน
เรามุ่งเน้นการใช้วัสดุคุณภาพดี ทนทาน กันแดด ไม่เปียกชื้น และกันรังสี UV ได้อย่างมีประสิทธิภาพ มีให้เลือกหลากหลายทั้งดีไซน์ สี และขนาด ตอบโจทย์การใช้งานในทุกรูปแบบ ไม่ว่าจะเป็นร่มสำหรับใช้ในไลฟ์สไตล์ หรือร่มที่ใช้ในเชิงการตลาด เรายังรองรับการสกรีนโลโก้ ข้อความ เพื่อใช้เป็นของพรีเมียมในงานสำคัญต่างๆ
นอกจากคุณภาพสินค้าที่เหนือกว่าแล้ว เรายังมีราคาที่ย่อมเยา พร้อมบริการจัดส่งร่มถึงมือคุณทั่วประเทศ และยังมีบริการให้คำปรึกษา รวมถึงออกแบบร่มให้ตรงตามความต้องการของลูกค้าอีกด้วย
ไม่ว่าคุณจะต้องการร่มสำหรับใช้เอง ใช้ในบริษัท หรือเป็นของชำร่วย โรงงานทำร่ม.com พร้อมเป็นหนึ่งในตัวเลือกที่เหมาะสมที่สุดสำหรับคุณ ด้วยมาตรฐานที่เหนือกว่า ราคาที่คุ้มค่า และบริการที่เป็นเลิศ เราพร้อมส่งมอบร่มที่ตอบโจทย์ทุกความต้องการให้กับคุณ
Here is my webpage; โรงงานทำร่ม – https://giphy.com/channel/rubtamrom19,
Ignoring Patterns: Failing to observe and learn from the game’s patterns can reduce your chances of winning. demo aviator game
Шкаф купе на заказ Бровары – всем рекомендую эту компанию. Купить современную мебель в интернет магазине TM Mebel-24 в Киеве и Украине. Производство качественной нестандартной мебели для дома и офиса. Большой каталог готовой мебели на 15000 товаров. Наш опыт более 19 лет в мебельной промышленности!
Cериал Голяк https://golyak-serial-online.ru смотреть онлайн в хорошем качестве и с лучшей озвучкой на любых устройствах. Все сезоны истории мелкого преступника Винни и его друзей в английском городке!
Common Mistakes to Avoid how to play aviator game and win
Купить тумбу ТВ – всем рекомендую эту компанию. Купить современную мебель в интернет магазине TM Mebel-24 в Киеве и Украине. Производство качественной нестандартной мебели для дома и офиса. Большой каталог готовой мебели на 15000 товаров. Наш опыт более 19 лет в мебельной промышленности!
Competitive Tournaments and Events demo aviator game
An additional round of the winners from the Florida Lottery’s restricted-time raffle bonus play promotion were announced Monday.
my site :: https://onlinedhan.mn.co/posts/55764017
Относительно [url=https://xn—-7sbeem4bsncflq.xn--p1ai/]пробурить скважину на воду[/url] мы вам непременно окажем помощь. На данном веб портале можно узнать примерную глубину бурения на собственном участке в видео, а также стоимость. Но самый безошибочный способ — это пригласить к себе эксперта для определения правильного места под скважину, определения объема работы и, соответственно, цены. Оставьте свой номер телефона и мы свяжемся с Вами в ближайшее время.
[url=https://battlepass.ru/service/valorant_t]Купить VP[/url] – Купить Апекс Коины/Apex Coins/ валюту апекс, Купить ВБаксы/ВБакс/В-Баксы/V-Bucks
Купить [url=https://xn—-7sbeem4bsncflq.xn--p1ai/]устройство скважины на воду[/url] можно на веб портале мастер-буров.рф уже сейчас. Скважина с чистой водой — один из главных компонентов на Вашем участке. Мы гарантируем качество работы, материалов, а также осуществляем гарантийное обслуживание. Наружние факторы могут разрушительно влиять на скважину и качество воды, мы также справляемся с восстановлением скважин от разрушения и с очисткой от заиливания. Звоните, приходите, будем рады с Вами работать.
[url=https://kraken-14-at.org/]kraken14 at[/url] – kraken darknet зеркала, как зайти на kraken
[url=https://exhubio.com/]купить криптовалюту[/url] – bestchange обменник, покупка биткоина
Если вы хотите заказать проститутку онлайн, заходите на сайт intimdnr.com – [url=https://intimdnr.com/]эскорт массажистка[/url] . Мы предлагаем вам удобный сервис и широкий выбор проверенных девушек. Каждая анкета тщательно проверена, чтобы гарантировать вам безопасность и высокий уровень обслуживания. Наши девушки красивы, умны и профессиональны, что делает каждую встречу незабываемой. Выбирайте понравившуюся девушку и оставляйте заявку на сайте. На intimdnr.com – [url=https://intimdnr.com/]снять индивидуалки досуг[/url] вы найдете всё, чтобы ваша встреча прошла на высшем уровне. Закажите проститутку онлайн и наслаждайтесь приятным времяпрепровождением с идеальной спутницей.
Get the facts https://lv.trefoil.tv/
aviator game real money [url=www.aviator-crash-game.ru]aviator game real money[/url] .
https://speakerdeck.com/innarasmus4
На сайте intimdnr.com – [url=https://intimdnr.com/]заказать проститутку на час[/url] вы найдете всю необходимую информацию о проститутках: телефоны, фото и цены. Мы предлагаем широкий выбор проверенных девушек на любой вкус и цвет. Каждая анкета содержит детальные фото и контактную информацию, а также актуальные цены на услуги. Наши девушки отличаются профессионализмом и привлекательной внешностью, что гарантирует вам незабываемый опыт. На intimdnr.com – [url=https://intimdnr.com/]сколько стоит вызов проститутки[/url] легко выбрать и забронировать понравившуюся девушку, воспользовавшись контактной информацией. Получите удовольствие от общения с красивыми и опытными спутницами, зная точную цену услуг.
casino game. aviator play
Заказать [url=https://xn—-7sbeem4bsncflq.xn--p1ai/]бурение скважин на воду иркутск цены[/url] можно на сайте мастер-буров.рф уже сейчас. Скважина с чистой водой — один из важных компонентов на Вашем участке. Мы даем гарантию на качество проделанной работы, материалов, а также осуществляем сервисное обслуживание. Наружние факторы могут негативно влиять на скважину и качество воды, мы также справляемся с восстановлением скважин от разрушения и с очисткой от заиливания. Звоните, приходите, будем рады с Вами сотрудничать.
[url=https://opt24.store/brend/chupa_chups/ ]купить чупа чупс оптом[/url] – заказать конфеты оптом, купить шоколад оптом от производителя
Some goods are certainly not eligible for Worldwide shipping and delivery. Be sure to search for eligibility notifications on our product internet pages, or look at our rules to view which products are ineligible. All international orders needs to have a ship-to destination beyond the United States. We are not able to aid clients with Global billing addresses shipping and delivery to U.
He’d hold up the burned-out bulb to 20 diverse ones to the wall, trying and failing to seek out a precise match for a light fixture manufactured while in the ’40s. “Why don’t you just … question somebody?” I instructed like a idiot, not however being familiar with that a person doesn’t ask for assist in a man shop, just like a woman wouldn’t go right into a Sephora, delay an eyelash curler, and say, “Now what’s this right here doohickey for?”
Microsoft and DuckDuckGo have partnered to offer a search Remedy that provides suitable commercials for you when protecting your privateness. For those who click on a Microsoft-delivered advert, you can be redirected to the advertiser’s landing web site by Microsoft Marketing’s platform.
Such umbrellas are also called straight umbrellas, and come in classic and timeless designs many of us recognize. They typically feature a curved deal with and an automatic open feature, adding a contact of class in your strolls.
Zoom in on the ultimate version of the bobblehead before we ship it to you. We’ll very carefully pack and send it when all facial changes and physique modifications are created, and also you ultimately say ‘Yes’ to the doll.
Golf umbrellas boast an additional-substantial Cover, providing ample coverage for various persons. In addition to their Key use to the golf course, They may be superb for family members outings, situations, or any condition wherever in depth coverage is required.
With all of us from the house now, my moms and dads continue to keep even significantly less inside the fridge. Instead, my father goes to The shop after on a daily basis to acquire a bag of spinach and an orange. “Don’t overbuy,” he likes to mention.
Include a splash of stock or white wine, stir yet again to combine, then insert milk or 50 percent and 50 %, stirring all the while, until you’ve bought something that looks like gravy, that coats the again of the spoon. Season aggressively with salt and black pepper, then thin it out if you might want to with additional stock or wine.
They tend to be low priced and their modest dimension doesn’t compromise on security, guaranteeing you keep dry and classy where ever you go.
So, buy the ideal a single and make them sense more Exclusive with this kind of an remarkable gift. We have now an special choice of Intimate gifts for Husbands and One more range of
I needed to include onto an get, and the vendor could not do it since they weren’t permitted to make adjustments on the buy. The vendor instead experienced to generate a coupon code that provides free delivery and afterwards just ship them together, which might be taken advantage of and won’t operate for all circumstances.
referred to as also substitute gift — testamentary gift : a gift that does not turn into productive right up until the Dying on the donor specially : a gift made in the will
Kimberly Sue Abbott, a founding board member who explained to the AP that she was incorrectly listed as co-CEO, cast doubt on Gerami’s self-documented price of the shares and mentioned Batterson Farms “isn’t farming any hemp anywhere which i’m aware about.”
Review donation inter vivos and donation mortis causa at donation, gift inter vivos and testamentary gift With this entry — gift inter vivos \
my web-site; tanakaromruay (https://Www.Kickstarter.com/profile/817880806/about)
Драгон Мани Казино https://krpb.ru – ваше место для азартных приключений! Наслаждайтесь широким выбором игр, щедрыми бонусами и захватывающими турнирами. Безопасность и честная игра гарантированы. Присоединяйтесь к нам и испытайте удачу в самом захватывающем онлайн-казино!
Заказать [url=https://xn—-7sbeem4bsncflq.xn--p1ai/]сколько стоит скважина для воды под ключ[/url] можно на сайте мастер-буров.рф прямо сейчас. Скважина с питьевой водой — один из главных деталей на Вашем участке. Мы даем гарантию на качество работы, материалов, а также осуществляем гарантийное обслуживание. Наружние факторы могут разрушительно влиять на скважину и качество воды, мы также справляемся с восстановлением скважин от деформации и с очищением от заиливания. Звоните, приходите, будем рады с Вами поработать.
you could look here https://online-television.net/ro/
Приобрести [url=https://xn—-7sbeem4bsncflq.xn--p1ai/]скважина под воду цена за метр[/url] можно на онлайн ресурсе мастер-буров.рф уже сейчас. Скважина с чистой водой — один из главных элементов на Вашем участке. Мы даем гарантию на качество работы, материалов, а также предлагаем сервисное обслуживание. Наружние факторы могут плохо влиять на скважину и качество воды, мы также работаем с восстановлением скважин от разрушения и с очисткой от заиливания. Звоните, пишите, будем рады с Вами работать.
Yes, the Aviator Game is compatible with mobile devices. Players can enjoy the game on their smartphones or aviator game mod apk
Каждый год в течение сентября проводится Тюменский инновационный форум «[u][b]НЕФТЬГАЗТЭК[/b][/u]».
Форум посвящен определению мнтодов инновационного роста областей [b]топливно-энергетического комплекса[/b], обсуждению и определению решений, образованию благоприятных обстоятельств для формирования инновационных проектов. Ежегодный тюменский форум является авторитетной дискуссионной площадкой по увеличению роста нефтегазовой сферы в Российской Федерации, содержит высокий авторитет и актуальность, созвучен общей стратегии продвижения инновационного направления в [u][b]Российской Федерации[/b][/u]
-https://neftgaztek.ru/
https://images.google.com.tn/url?q=http://surl.li/unkzp
Если вы хотите заказать проститутку онлайн, заходите на сайт intimdnr.com – [url=https://intimdnr.com/]заказать проститутку лучший сайт[/url] . Мы предлагаем вам удобный сервис и широкий выбор проверенных девушек. Каждая анкета тщательно проверена, чтобы гарантировать вам безопасность и высокий уровень обслуживания. Наши девушки красивы, умны и профессиональны, что делает каждую встречу незабываемой. Выбирайте понравившуюся девушку и оставляйте заявку на сайте. На intimdnr.com – [url=https://intimdnr.com/]реальные проститутки на выезд[/url] вы найдете всё, чтобы ваша встреча прошла на высшем уровне. Закажите проститутку онлайн и наслаждайтесь приятным времяпрепровождением с идеальной спутницей.
Взять микрозайм в МФО может предприятие любой формы собственности — ИП, ООО или ЗАО. Чтобы государственная МФО предоставила микрозайм, бизнес должен попадать под четыре условия одновременно [url=http://otrafin.ru/]займы юр лицам[/url]
the opportunity to compete for larger prizes and showcase their skills on a larger stage. how to hack aviator
Зачем выбирать дом из бруса 9х12 | Преимущества строительства дома из бруса 9х12 | Выбор кровельных материалов для дома из бруса 9х12 | Плюсы отопления в доме из бруса 9х12 | Как обеспечить комфортную температуру в доме из бруса 9х12 | Выбор фундамента для дома из бруса 9х12 | Современные технологии строительства дома из бруса 9х12 | Новинки в строительстве домов из бруса 9х12 | Как обустроить зону отдыха в доме из бруса 9х12 | Расходы на строительство дома из бруса 9х12
дом из бруса 9х12 [url=https://domizbrusa-9x12spb.ru/]https://domizbrusa-9x12spb.ru/[/url] .
Famous French footballer Kylian Mbappe https://kylianmbappe.prostoprosport-ar.com has become a global ambassador for Dior. The athlete will represent the men’s collections of creative director Kim Jones and the Sauvage fragrance, writes WWD. Mbappe’s appointment follows on from the start of the fashion house’s collaboration with the Paris Saint-Germain football club. Previously, Jones created a uniform for the team where Kylian is a player.
From tomorrow till Friday, all activities will be overwritten by exams.
My page … http://wwwdisc.chimica.unipd.it/cgi-bin/search/search.pl?Match=0&Realm=All&Terms=https%3A%2F%2Fko.anotepad.com%2Fnote%2Fread%2Fyqgxpe9c
สำรวจเล่นสล็อต PG ซื้อฟรีสปิน
ในเวลานี้ การเล่นสล็อตออนไลน์ได้รับความสนใจอย่างมาก เฉพาะเกมสล็อตจากค่าย PG Slot ที่มีคุณลักษณะพิเศษพิเศษมากมายให้ผู้เล่นได้รื่นรมย์ หนึ่งในลักษณะพิเศษที่น่าสนใจและทำให้การปั่นสนุกยิ่งขึ้นคือ “การซื้อฟรีสปิน” ซึ่งเป็นการเพิ่มช่องทางในการชนะและเพิ่มความตื่นเต้นในการเล่น
การซื้อฟรีสปินคืออะไร?
การซื้อตัวเลือกการหมุนฟรีคือการที่ผู้เล่นสามารถซื้อโอกาสที่จะได้ในการหมุนวงล้อสล็อตโดยไม่ต้องรอให้เกิดไอคอนฟรีสปินบนวงล้อ ซึ่งเป็นการเพิ่มโอกาสในการได้รับรางวัลพิเศษต่างๆ ภายในเกม เช่น โบนัส แจ็คพอต และอื่นๆ นอกจากนี้ การซื้อฟรีสปินยังช่วยให้นักพนันสามารถเพิ่มจำนวนเงินรางวัลได้อย่างรวดเร็วและมีมีผลดี
ข้อดีของการทดสอบเล่นสล็อต PG ซื้อรอบหมุนฟรี
เพิ่มโอกาสชนะ: การซื้อฟรีสปินช่วยให้นักเล่นมีโอกาสในการได้รับของรางวัลมากขึ้น เนื่องจากมีการหมุนวงล้อฟรีเพิ่มเติม ซึ่งอาจนำพาไปถึงการได้รับแจ็คพอตหรือโบนัสที่มากขึ้นอื่นๆ
ลดเวลาในการเล่น: การซื้อตัวเลือกหมุนฟรีช่วยประหยัดเวลาในการเล่น จากที่ไม่ต้องรอให้เกิดสัญลักษณ์ฟรีสปินบนวงล้อ นักพนันสามารถเข้าไปในรอบฟรีสปินได้ทันที
ทดลองหมุนฟรี: สำหรับผู้ใช้งานที่ยังไม่แน่ใจเกี่ยวกับเกม PG Slot ยังมีโหมดทดลองเล่นฟรีผู้เล่นได้ทดสอบหมุนและศึกษาวิธีการเล่นก่อนที่จะตกลงใจซื้อฟรีสปินด้วยเงินจริง
เพิ่มความสนุกสนาน: การซื้อตัวเลือกการหมุนฟรีช่วยเพิ่มความสนุกในการเล่น เนื่องจากผู้เล่นสามารถเข้าสู่รอบโบนัสและคุณลักษณะพิเศษพิเศษอื่นๆ ได้อย่างง่ายดาย
กระบวนการซื้อฟรีสปินในสล็อต PG
เลือกเกมที่ต้องการหมุนจากผู้ผลิต PG Slot
คลิกที่ปุ่มคำสั่ง “ซื้อฟรีสปิน” ที่แสดงผลบนหน้าจอ
ใส่จำนวนฟรีสปินที่ต้องการซื้อและยืนยันการสั่งซื้อ
เริ่มต้นการหมุนวงล้อและสนุกไปกับการเล่น
สรุป
การทดสอบเล่นสล็อต PGและการซื้อตัวเลือกฟรีสปินเป็นวิธีที่ดีในการเพิ่มโอกาสในการชนะและเพิ่มความสนุกสนานในการเล่น ด้วยฟีเจอร์พิเศษนี้ ผู้เล่นสามารถเข้ารอบโบนัสและคุณสมบัติพิเศษต่างๆ ได้อย่างรวดเร็วทันใจและมีประสิทธิภาพ ไม่ว่าคุณคือผู้เล่นใหม่หรือผู้เล่นที่มีความสามารถ การสำรวจเล่นสล็อต PGและการซื้อตัวเลือกฟรีสปินจะช่วยให้คุณมีประสบการณ์การหมุนที่น่าตื่นเต้นใจและบันเทิงมากยิ่งขึ้น
ทดลองเล่นสล็อต PG ซื้อหมุนฟรี แล้วคุณจะพบกับความสนุกและช่องทางในการชนะที่ไม่มีที่สิ้นสุด
купить аттестат за 11 класс [url=ukr-diplom.ru]ukr-diplom.ru[/url] .
Encountered a captivating article, I propose you read http://kai87la.flybb.ru/viewtopic.php?f=5&t=362
Working as a courier is userhomes.com suitable for everyone, thanks to the ability to work on foot, by bicycle, by scooter or by car.
สล็อตเว็บตรง — ใช้ สมาร์ทโฟน แท็บเลต คอมพิวเตอร์ ฯลฯ สำหรับการเล่น
ระบบสล็อตเว็บตรง ของ พีจีสล็อต ได้รับการพัฒนาและอัปเดต เพื่อให้ รองรับการใช้งาน บนอุปกรณ์ที่หลากหลายได้อย่าง ครบถ้วน ไม่สำคัญว่าจะใช้ โทรศัพท์มือถือ แท็บเลต หรือ คอมพิวเตอร์ รุ่นไหน
ที่ PG เราเข้าใจถึงสิ่งที่ผู้เล่นต้องการ จากผู้เล่น ในเรื่อง การใช้งานง่าย และ การเข้าถึงเกมคาสิโนที่รวดเร็ว เราจึง ใช้เทคโนโลยี HTML 5 ซึ่งเป็น เทคโนโลยีที่ล้ำสมัย ในตอนนี้ มาใช้พัฒนาเว็บไซต์ คุณจึงไม่ต้อง โหลดแอป หรือติดตั้งโปรแกรมเพิ่มเติม เพียง เปิดบราวเซอร์ บนอุปกรณ์ที่ คุณใช้อยู่ และเยี่ยมชม เว็บไซต์เรา คุณสามารถ เล่นเกมสล็อตได้ทันที
การใช้งานกับอุปกรณ์หลากหลาย
ไม่ว่าคุณจะใช้ โทรศัพท์มือถือ ระบบ Android หรือ ไอโอเอส ก็สามารถ เล่นสล็อตออนไลน์ได้ไม่มีสะดุด ระบบของเรา ได้รับการออกแบบให้รองรับ ทุกระบบปฏิบัติการ ไม่สำคัญว่าคุณ กำลังใช้ สมาร์ทโฟน ใหม่หรือเก่า หรือ แท็บเล็ตหรือแล็ปท็อป ทุกอย่างก็สามารถ ใช้งานได้ ไม่มีปัญหา ความเข้ากันได้
เล่นได้ทุกที่ทุกเวลา
ข้อดีอย่างหนึ่งของการเล่นเว็บสล็อตอย่าง PG Slot นั่นคือ คุณสามารถ เล่นได้ทุกเวลา ไม่ว่าจะ เป็นที่บ้าน ที่ทำงาน หรือแม้แต่ ที่สาธารณะ สิ่งที่คุณต้องมีคือ เน็ต คุณสามารถ เริ่มเล่นได้ทันที และคุณไม่ต้อง กังวลกับการดาวน์โหลด หรือติดตั้งโปรแกรมที่ ใช้พื้นที่ในอุปกรณ์
ลองเล่นสล็อตแมชชีนฟรี
เพื่อให้ ผู้เล่นใหม่ ได้ลองเล่นและสัมผัสเกมสล็อตของเรา PG Slot ยังมีสล็อตทดลองฟรี คุณสามารถ เล่นได้ทันทีโดยไม่ต้องสมัครสมาชิกหรือฝากเงิน การ ทดลองเล่นสล็อตนี้จะช่วยให้คุณรู้จักวิธีการเล่นและเข้าใจเกมก่อนเดิมพันด้วยเงินจริง
บริการและการรักษาความปลอดภัย
PG Slot ตั้งใจให้บริการที่ดีที่สุดกับลูกค้า เรามี ทีมงานมืออาชีพพร้อมให้บริการและช่วยเหลือคุณตลอด 24 ชั่วโมง นอกจากนี้เรายังมี การรักษาความปลอดภัยที่ทันสมัย ด้วยวิธีนี้ คุณจึงมั่นใจได้ว่า ข้อมูลส่วนตัวและการเงินของคุณจะปลอดภัย
โปรโมชันและโบนัส
การเล่นสล็อตกับ PG Slot ยังมีข้อดี นั่นคือ มี โปรโมชันและโบนัสพิเศษสำหรับสมาชิก ไม่ว่าคุณจะเป็น สมาชิกใหม่หรือเก่า คุณสามารถ รับโปรโมชันและโบนัสได้เรื่อย ๆ สิ่งนี้จะ เพิ่มโอกาสชนะและความสนุกในเกม
สรุปการเล่นสล็อตเว็บที่ PG Slot ถือเป็นการลงทุนที่คุ้มค่า คุณจะไม่เพียงได้รับความสุขและความสะดวกสบายจากเกมเท่านั้น แต่คุณยังมีโอกาสลุ้นรับรางวัลและโบนัสมากมายอีกด้วย ไม่สำคัญว่าจะใช้โทรศัพท์มือถือ แท็บเล็ต หรือคอมพิวเตอร์รุ่นใด สามารถมาร่วมสนุกกับเราได้เลยตอนนี้ อย่ารอช้า ลงทะเบียนและเริ่มเล่นสล็อตกับ PG Slot วันนี้!
การเผชิญหน้าการทดลองเล่นเกมสล็อต PG บนเว็บเสี่ยงโชคโดยตรง: เปิดโลกแห่งความตื่นเต้นที่ไม่มีข้อจำกัด
สำหรับนักเดิมพันที่ค้นหาการเผชิญหน้าเกมที่ไม่เหมือนใคร และต้องการเจอแหล่งเสี่ยงโชคที่เชื่อถือได้, การทำการสล็อตแมชชีน PG บนเว็บไซต์ตรงถือเป็นตัวเลือกที่น่าประทับใจอย่างมาก. เนื่องจากมีความหลากหลายของเกมสล็อตแมชชีนที่มีให้คัดสรรมากมาย, ผู้เล่นจะได้สัมผัสกับโลกแห่งความรื่นเริงและความสนุกเพลิดเพลินที่ไร้ขีดจำกัด.
เว็บวางเดิมพันตรงนี้ มอบการเล่นการเล่นเกมที่น่าเชื่อถือ มั่นคง และตรงตามความต้องการของนักเสี่ยงโชคได้เป็นอย่างดี. ไม่ว่าท่านจะท่านจะหลงใหลเกมสล็อตแมชชีนที่คุ้นเคยที่คุ้นเคย หรืออยากทดลองลองเกมแปลกใหม่ที่มีฟีเจอร์พิเศษและรางวัลล้นหลาม, พอร์ทัลไม่ผ่านเอเย่นต์นี้ก็มีให้เลือกสรรอย่างหลากหลายมากมาย.
เพราะมีระบบการสำรวจเกมสล็อต PG ฟรี, ผู้เล่นจะได้โอกาสดีทำความเข้าใจขั้นตอนเล่นเกมพนันและทดลองกลยุทธ์ที่หลากหลาย ก่อนที่เริ่มใช้เงินจริงโดยใช้เงินจริง. การกระทำนี้นับว่าโอกาสอันดีที่สุดที่จะเสริมความพร้อมสมบูรณ์และเพิ่มโอกาสในการชิงโบนัสใหญ่.
ไม่ว่าคุณอาจจะปรารถนาความสนุกสนานที่เคยชิน หรือความท้าทายแปลกใหม่, เกมสล็อต PG บนเว็บไซต์พนันตรงก็มีให้เลือกสรรอย่างหลากหลาย. ท่านจะได้เผชิญกับการเล่นการเล่นที่น่าตื่นเต้นเร้าใจ เร้าใจ และเพลิดเพลินไปกับจังหวะในการคว้ารางวัลมหาศาลมหาศาล.
อย่ารอ, เข้าร่วมทดลองสล็อตแมชชีน PG บนเว็บเสี่ยงโชคโดยตรงตอนนี้ และค้นพบจักรวาลแห่งความสุขที่น่าเชื่อถือ น่าติดตาม และมีแต่ความสุขสนานรอคอยคุณ. ประสบความตื่นเต้น, ความสนุกสนาน และโอกาสดีในการคว้ารางวัลมหาศาลมหาศาล. เริ่มเข้าสู่ชัยชนะในวงการเกมออนไลน์เดี๋ยวนี้!
купить второй аккаунт телеграмм [url=http://kupit-akkaunt-telegramm11.ru/]http://kupit-akkaunt-telegramm11.ru/[/url] .
The scoring system in the Aviator Game is based on the multiplier at the time of cashing out. The higher the Megapari Aviator
Приобрести [url=https://xn—-7sbeem4bsncflq.xn--p1ai/]бурение скважины на воду под ключ цена[/url] можно на сайте мастер-буров.рф прямо сейчас. Скважина с питьевой водой — один из важных компонентов на Вашем участке. Мы даем гарантию на качество работы, материалов, а также предлагаем сервисное обслуживание. Внешние факторы могут негативно влиять на скважину и качество воды, мы также справляемся с восстановлением поврежденных скважин от деформации и с очищением от заиливания. Звоните, приходите, будем рады с Вами поработать.
הימורי ספורט – הימור באינטרנט
הימורי ספורטיביים הפכו לאחד הענפים המשגשגים ביותר בהימורים באינטרנט. שחקנים מסוגלים להתערב על תוצאות של אירועים ספורטיביים מוכרים לדוגמה כדורגל, כדורסל, טניס ועוד. האפשרויות להתערבות הן רבות, וביניהן תוצאתו המשחק, כמות השערים, כמות הנקודות ועוד. להלן דוגמאות של למשחקי נפוצים במיוחד עליהם ניתן להמר:
כדורגל: ליגת האלופות, גביע העולם, ליגות אזוריות
כדורסל: NBA, יורוליג, טורנירים בינלאומיים
משחק הטניס: טורניר ווימבלדון, US Open, אליפות צרפת הפתוחה
פוקר באינטרנט – הימור ברשת
פוקר באינטרנט הוא אחד ממשחקי ההימורים המוכרים ביותר בימינו. משתתפים יכולים להתמודד מול מתחרים מכל רחבי תבל במגוון גרסאות משחק , כגון טקסס הולדם, Omaha, Stud ועוד. ניתן למצוא תחרויות ומשחקי קש במבחר דרגות ואפשרויות מגוונות. אתרי פוקר הטובים מציעים גם:
מבחר רב של גרסאות פוקר
תחרויות שבועיים וחודשיות עם פרסים כספיים
שולחנות המשחק למשחק מהיר ולטווח הארוך
תוכניות נאמנות ומועדוני עם הטבות בלעדיות
בטיחות והוגנות
כאשר הבחירה פלטפורמה להימורים באינטרנט, חשוב לבחור אתרי הימורים מורשים ומפוקחים המציעים גם סביבה למשחק בטוחה והגיונית. אתרים אלה עושים שימוש בטכנולוגיות אבטחה מתקדמות להבטחה על מידע אישי ופיננסי, וכן בתוכנות גנרטור מספרים אקראיים (RNG) כדי לוודא הגינות המשחקים במשחקים.
בנוסף, הכרחי לשחק גם בצורה אחראי תוך הגדרת מגבלות הימורים אישיות של השחקן. רוב אתרי ההימורים מאפשרים גם למשתתפים להגדיר מגבלות הפסד ופעילויות, כמו גם לנצל כלים נגד התמכרויות. הימרו בתבונה ואל תרדפו אחר הפסדים.
המדריך המלא למשחקי קזינו באינטרנט, הימורי ספורט ופוקר באינטרנט באינטרנט
הימורים באינטרנט מציעים עולם שלם של של הזדמנויות מרתקות לשחקנים, מתחיל מקזינו אונליין וכל משחקי ספורט ופוקר באינטרנט. בזמן בחירת פלטפורמת הימורים, חשוב לבחור אתרי הימורים המפוקחים המציעים גם סביבת למשחק מאובטחת והגיונית. זכרו גם לשחק באופן אחראי תמיד ואחראי – משחקי ההימורים ברשת נועדו להיות מבדרים ולא גם ליצור לבעיות פיננסיות או חברתיות.
Register an account, make a deposit, and navigate to the Aviator Game to start playing. aviator game ethiopia
Very good info. Lucky me I ran across your website by accident (stumbleupon).
I have book-marked it for later!
Сайт turkvideo.tv предлагает вам эксклюзивный доступ к [url=https://turkvideo.tv/novie-turkey-serials/]новым турецким сериалам онлайн[/url]. Здесь вы найдете самые свежие и популярные сериалы, которые только вышли на экраны. Высокое качество видео, профессиональная озвучка и удобный интерфейс сделают ваш просмотр приятным и комфортным. Наслаждайтесь новыми историями, полными страсти, интриг и неожиданных поворотов сюжета. Не пропустите новинки турецкого кинематографа, начните смотреть прямо сейчас на turkvideo.tv!
Providing 24/7 live chat services, they ensure that users have access to assistance at any hour, reflecting a strong commitment to customer service.
תוקיר לכם תודה. אתם יכולים להפוך לחברים המועדפים עליה, והיא תהיה יותר קשובה לצרכים ולרצונות שלכם. עם זאת, אפילו ללא הפינוקים, ההיגיינה שלו, הנימוסים וההתנהגות. לעיתים רחוקות מאוד, אך אלו מקרים שקורים, בחורה משירותי העיסויים יכולה לסרב לפגישה עם גבר. זה דירות דיסקרטיות בחדרה
Discovered an intriguing article, I recommend you to check it out http://koxma.4adm.ru/viewforum.php?f=296
ทดลองปฏิบัติเล่นสล็อต และค้นพบประสบการณ์การเล่นเกมที่ไม่เหมือนใคร!
สำหรับนักพนันที่กำลังมองหาความบันเทิงและโอกาสในการคว้ารางวัลมหาศาล สล็อตออนไลน์เป็นอีกหนึ่งทางเลือกที่ที่คุ้มค่าศึกษา.ด้วยความหลากหลายของเกมสล็อตที่น่าตื่นเต้น ผู้เล่นสามารถปฏิบัติและค้นหาเกมที่เหมาะกับตัวเองได้อย่างง่ายดาย.
ไม่ว่าคุณจะชอบเกมสล็อตคลาสสิกหรือต้องการความแปลกใหม่, ทางเลือกมากมายรอต้อนรับให้คุณสัมผัส. จากสล็อตที่มีแนวคิดมากมาย ไปจนถึงเกมที่มีฟีเจอร์พิเศษและรางวัล, ผู้เล่นจะได้พบกับการทดลองเล่นที่น่าตื่นเต้นและน่าติดตาม.
ด้วยการทดลองเล่นสล็อตฟรี, คุณสามารถทำความคุ้นเคยวิธีการเล่นและค้นหากลยุทธ์ที่เหมาะสมก่อนวางเดิมพันด้วยเงินจริง. นี่คือโอกาสดีที่จะศึกษากับเกมและปรับปรุงโอกาสในการแสดงรางวัลใหญ่.
อย่าเลื่อนเวลา, เข้าร่วมกับการทดสอบสล็อตออนไลน์วันนี้ และค้นพบประสบการณ์การเล่นเกมที่ไม่เหมือนใคร! สัมผัสความท้าทาย, ความร่าเริง และโอกาสทองชนะรางวัล. กล้าก้าวไปเดินทางสู่ความสำเร็จลุล่วงของคุณในวงการสล็อตออนไลน์แล้ววันนี้!
שרוצות להכיר, אתם תמצאו את הסוג שמתאים לכם בקלות. לאחר שבחרתם את הבחורה, בדקו האם ההעדפות הפרטיות שלה דומות לשלכם. יכול להיות שימוש, כלומר לפי השעות שבהן ביליתם בחדר. דירות – מקום נוח ונעים ולסיום כמה מילים על דיסקרטיות ופרטיות. מי שמגיע לבילוי בדירות Meet hot Independent escort Tel Aviv girls
The Popularity of Online Casino Games aviator demo oyna
https://giah1.com/?keyword=sair-hk
דיסקרטיות בתל אביב, אל תפחדו לטעות – מטעויות לומדים דירות דיסקרטיות בתל אביב מסודרות המעמידות לרשותך צעירות הכי סקסיות הן בכל להתחלף עם שחקן קולנוע מפורסם, שפוגש אלפי נשים או נערות ליווי בבאר שבע. האתרים באינטרנט יעזרו לכם להפוך את החלום הפנטסטי הזה סקס בבת ים
בדירות דיסקרטיות. דירות דיסקרטיות בקריות זמינות 24 שעות ביממה, הן קרובות לבית ואפילו לא צריך להזמין מקום מראש. אתם יכולים להגיע האישה: כמה צעצועים היא יכולה לשים שם? באופן טבעי, כמה מהמקצועניות שעובדות בשירותי דירות דיסקרטיות ברחובות נוסעות ברכב. אתם דירות דיסקרטיות בטבריה
כאשר אתם הופכים להיות חברים של מעסה (או שתיים?), הגוף שלכם ירעד מרוב חשק, והתאווה תגדל עם כל רגע שחולף. הפצצות הללו כל כך שם והפתיחות שלהן יקסימו אתכם, כך שתחשבו שאתם אוהבים את המקום כמו שאתם אוהבים את הבחורות. הן נהנות מכל סוג של פינוקים! הבנות מכוני ליווי באשדוד, איך מוצאים?
increase the excitement of the game. aviator aposta demo
рутор онион
Эскорт модели Шлюшки Москвы, несомненно, являются украшением ночного города. Снять несложно в любом районе столицы, а предлагаемые клиентам интим услуги отличаются доступностью и разнообразием. Элитные проститутки по вызову в Мск позиционируют эротические услуги и секс за деньги, размещая интим объявления на нашем Воспользовавшись этим сайтом, любой москвич или гость столицы сможет найти эскортницу по своему вкусу и кошельку.
Source:
– https://volna.la/
שלכם, אלא אם כל הטיפולים מוסכמים מראש. כשאתם בדייט עם נערות ליווי באשקלון, ממשו את הצרכים הפיזיולוגיים שלכם ללא עיכוב! נגיעות מקצועניות שרואות את זה כתחביב מעניין ומרתק. זה למה הן תמיד כל כך נועזות, ותמיד מוכנות לפגוש גברים חדשים ולהתנסות איתם בדברים דירה דיסקרטית בדרום תל אביב – כל תענוגות החיים במרחק נגיעה
Скачать свежие новинки песен https://muzfo.net 2024 года ежедневно. Наслаждайтесь комфортным прослушиванием, скачивайте музыку за пару кликов на сайте.
While the employees chicagomj.com are cleaning, the customer can fully relax or go to earn additional income.
allnews-24.com
דיסקרטיות באילת מציעות את הנשים שתמיד מוכנות למלא אחר בקשותיכם. המקום הפופולרי והלוהט ביותר שנבחר לפגישה איתן הוא בדירה שלהן. של האפשרויות היכרות שהבנות מציעות לגברים. קראו את הרשימה והתקשרו אליהן על מנת לשאול אם היא מציעה משהו בנוסף. הרגישו חופשי לשאול נערות ליווי בעפולה
Scoring System and Winning Criteria aviator demo spribe
רך וחזה יפה. אם אתם מרגישים מדוכאים או עייפים, הן יעשו הכל על מנת לגרום לכם להרגיש שוב שמחים. הן שמחות לבצע את הגחמות הכי נועזות שיאפשר לך להשתחרר וליהנות. בדיוק בשביל זה ישנן דירות דיסקרטיות בבאר שבע. כאן נשים יפות וסקסיות יעזרו לך להשתחרר. הן יעשו זאת נערות ליווי באשדוד
เมื่อพูดถึงโรงงานผลิตร่ม แบรนด์ โรงงานทำร่ม.com คือชื่อที่หลายคนคุ้นเคยและไว้วางใจ ด้วยประสบการณ์ยาวนานกว่า 20ปีในวงการอุตสาหกรรมร่ม เราคือผู้เชี่ยวชาญตั้งแต่การออกแบบ การเลือกวัสดุคุณภาพ ไปจนถึงกระบวนการผลิตที่ได้มาตรฐาน เพื่อส่งมอบร่มคุณภาพสูงให้กับลูกค้าทุกท่าน
เรามุ่งเน้นการใช้วัสดุคุณภาพเยี่ยม ใช้งานได้ยาวนาน บังแดด กันฝน และกันรังสี UV ได้อย่างมีประสิทธิภาพ มีให้เลือกพร้อมทั้งดีไซน์ สี และขนาด ตอบโจทย์การใช้งานในทุกรูปแบบ ไม่ว่าจะเป็นร่มสำหรับใช้ในกิจวัตรประจำวัน หรือร่มที่ใช้ในเชิงการตลาด เรายังรองรับการสกรีนตราสินค้า ข้อความ เพื่อใช้เป็นของแจกในงานสำคัญต่างๆ
นอกจากคุณภาพสินค้าที่ดีเยี่ยมแล้ว เรายังมีราคาที่คุ้มค่า พร้อมบริการจัดส่งร่มถึงมือคุณทั่วประเทศ และยังมีบริการให้คำแนะนำ รวมถึงออกแบบร่มให้ตรงตามความต้องการของลูกค้าอีกด้วย
ไม่ว่าคุณจะต้องการร่มสำหรับพกติดตัว ใช้ในหน่วยงาน หรือเป็นของชำร่วย แบรนด์ โรงงานทำร่ม.com พร้อมเป็นหนึ่งในตัวเลือกที่ดีที่สุดสำหรับคุณ ด้วยคุณภาพที่เหนือกว่า ราคาที่คุ้มค่า และบริการที่เป็นเลิศ เราพร้อมส่งมอบร่มที่ตอบโจทย์ทุกความต้องการให้กับคุณ
Here is my web-site โรงงานทำร่ม, https://Quora.com/profile/Rubtamrom19,
Добро пожаловать на наш сайт, где вы найдете множество полезных статей на тему приемки недвижимости в новостройке или покупки квартиры с черновой отделкой. Узнайте, как защитить себя от недобросовестных застройщиков, какие проверки осуществить перед покупкой жилья, и о многом другом!
https://citadel-ca.ru
aviator bonus game [url=http://www.aviator-crash-game.ru]http://www.aviator-crash-game.ru[/url] .
הימורי ספורט – הימורים באינטרנט
הימורי ספורטיביים נהיו לאחד הענפים הצומחים ביותר בהימור ברשת. משתתפים מסוגלים להמר על תוצאותיהם של אירועי ספורטיביים נפוצים למשל כדורגל, כדור סל, טניס ועוד. האופציות להתערבות הן רבות, כולל תוצאתו ההתמודדות, מספר הגולים, כמות הנקודות ועוד. להלן דוגמאות של למשחקי נפוצים במיוחד עליהם אפשרי להמר:
כדור רגל: ליגת האלופות, מונדיאל, ליגות אזוריות
כדור סל: NBA, יורוליג, תחרויות בינלאומיות
משחק הטניס: טורניר ווימבלדון, US Open, אליפות צרפת הפתוחה
פוקר ברשת באינטרנט – הימורים ברשת
משחק הפוקר ברשת הוא אחד ממשחקי ההימור המוכרים ביותר כיום. משתתפים מסוגלים להתמודד נגד מתחרים מרחבי העולם במגוון סוגי משחק , למשל Texas Hold’em, Omaha, Stud ועוד. ניתן למצוא טורנירים ומשחקי קש במבחר דרגות ואפשרויות מגוונות. אתרי פוקר הטובים מציעים גם:
מגוון רחב של גרסאות פוקר
תחרויות שבועיים וחודשיים עם פרסים כספיים
שולחנות למשחק מהיר ולטווח ארוך
תוכניות נאמנות ללקוחות ומועדוני VIP עם הטבות
בטיחות ואבטחה והוגנות
כאשר הבחירה בפלטפורמה להימורים, חיוני לבחור אתרים מורשים המפוקחים המציעים סביבת למשחק בטוחה והגיונית. אתרים אלה משתמשים בטכנולוגיית הצפנה מתקדמת להבטחה על נתונים אישיים ופיננסי, וגם בתוכנות גנרטור מספרים אקראיים (RNG) כדי לוודא הגינות במשחקים.
מעבר לכך, חשוב לשחק גם בצורה אחראי תוך הגדרת מגבלות אישיות הימורים אישיות. רוב האתרים מאפשרים גם לשחקנים להגדיר מגבלות הפסד ופעילות, כמו גם לנצל כלים למניעת התמכרות. הימרו בחכמה ואל גם תרדפו גם אחר הפסדים.
המדריך המלא למשחקי קזינו ברשת, הימורי ספורט ופוקר באינטרנט
הימורים ברשת מציעים עולם שלם הזדמנויות מלהיבות לשחקנים, החל מקזינו באינטרנט וגם בהימורי ספורט ופוקר ברשת. בזמן בחירת פלטפורמת הימורים, הקפידו לבחור גם אתרי הימורים המפוקחים המציעים גם סביבה משחק בטוחה והגיונית. זכרו גם לשחק תמיד בצורה אחראית תמיד – ההימורים ברשת אמורים להיות מבדרים ומהנים ולא גם ליצור לבעיות פיננסיות או חברתיים.
Wide variety of designs and styles home365.net. An environmentally friendly material that does not produce toxic emissions and does not contain formaldehyde, unlike plastic analogues.
Высокотехнологичные медицинские расходные материалы для современной медицины, и улучшения обслуживания пациентов.
Медицинские расходные материалов Москва [url=https://www.medtovarka.ru/]https://www.medtovarka.ru/[/url] .
newhomeeasy.com
Cash Out: Decide when to cash out to secure your winnings. If you cash out before the plane crashes, you win. If aviator game legit
https://trademarketclassifieds.com/user/profile/319634
На нашем портале вы найдете полезные статьи, которые помогут вам разобраться во всех вопросах продажи недвижимости.
Вас ждут статьи на такие темы, как [url=https://afonya31.ru/]аренда земельного участка[/url], а также [url=https://afonya31.ru/]аренда офиса[/url], и многие другие!
https://sflwiki.com/wiki/User:EleanorLuevano
https://www.freelegal.ch/index.php?title=Utilisateur:TerrellMowery
Сайт turkvideo.tv дарит вам уникальную возможность наслаждаться лучшими турецкими сериалами абсолютно бесплатно! Раздел [url=https://turkvideo.tv/]бесплатные турецкие сериалы[/url] предлагает огромный выбор увлекательных сюжетов и ярких персонажей. Здесь вы найдете все: от драм до комедий, от историй о любви до захватывающих детективов. Каждый сериал доступен без регистрации и в хорошем качестве. Присоединяйтесь к тысячам зрителей, которые уже наслаждаются просмотром любимых сериалов без лишних затрат!
Скачать свежие новинки песен https://muzfo.net 2024 года ежедневно. Наслаждайтесь комфортным прослушиванием, скачивайте музыку за пару кликов на сайте.
http://oldwiki.bedlamtheatre.co.uk/index.php/Cyprus_Rent
Делаем отличное предложение для вас сделать консультацию (аудит) по подъему продаж а также доходы в вашем бизнесе. Формат аудита: индивидуальная встреча или конференция по скайпу. Делая верные, но обыкновенные действия, результат от ВАШЕГО бизнеса можно поднять в несколькио раз. В нашем арсенале более 100 опробованных практических инструментов подъема результатов а также доходов. В зависимости от вашего коммерциала подберем для вас максимально лучшие и будем постепенно претворять в жизнь.
http://r-diplom.ru/
https://autisticburnout.org/User_talk:DoyleVanguilder
[url=http://peregonavtofgtd.kiev.ua]http://peregonavtofgtd.kiev.ua[/url]
Я мухой, сверхэффективно равно надежно перебросить Ваш автомобиль из Украины в течение Европу, или изо Европы в Украину вместе один-два нашей командой. Оформление доказательств и вывоз изготовляются в течение оговоренные сроки.
http://peregonavtofgtd.kiev.ua
https://wiki.team-glisto.com/index.php?title=Overview_Estate
advances, players can expect even more exciting features and enhancements to the gameplay experience. aviator game demo free
анальный секс с разговорами на русском [url=safavia.ru]анальный секс с разговорами на русском[/url] .
На нашем сайте вы найдете информационные статьи, которые помогут вам разобраться во всех нюансах продажи недвижимости.
Вас ждут статьи на такие темы, как [url=https://afonya31.ru/]закладная на квартиру[/url], а также [url=https://afonya31.ru/]аренда офиса[/url], и многие другие!
Что касается [url=https://xn—-7sbeem4bsncflq.xn--p1ai/]бурение скважин в рассрочку[/url] мы вам обязательно окажем помощь. На данном веб портале можно узнать примерную глубину бурения на собственном участке в видео, а также цены. Но самый безошибочный способ — это пригласить к себе мастера для определения лучшего участка под скважину, определения объема работы и, соответственно, цены. Оставьте контактный номер и мы созвонимся с Вами в скорое время.
Found captivating reading that I’d like to offer you – you won’t regret it https://forum.resmihat.kz/viewtopic.php?f=10&t=2199614
Ищете индивидуалок в Донецке? Посетите сайт intimdnr.com – [url=https://intimdnr.com/]путаны по вызову[/url] и выберите из множества очаровательных девушек. Мы предлагаем профессиональных и красивых индивидуалок, готовых воплотить в жизнь ваши самые смелые фантазии. Все наши девушки проходят строгий отбор, чтобы гарантировать вам высокий уровень сервиса и полную конфиденциальность. Просто выберите понравившуюся девушку, оставьте заявку и наслаждайтесь незабываемыми моментами. На intimdnr.com – [url=https://intimdnr.com/]заказать индивидуалку донецк[/url] вы найдете индивидуалок в Донецке, которые сделают ваш вечер особенным.
Thee opening of your cover letter is exactly where you want to
whet their appetite.
my web blog :: ezalba.com
הימורי ספורטיביים – הימור באינטרנט
הימורי ספורט נהיו לאחד התחומים המתפתחים ביותר בהימור באינטרנט. שחקנים מסוגלים להתערב על תוצאותיהם של אירועי ספורט נפוצים למשל כדורגל, כדורסל, טניס ועוד. האפשרויות להתערבות הן מרובות, וביניהן תוצאת ההתמודדות, כמות השערים, כמות הנקודות ועוד. להלן דוגמאות למשחקים נפוצים עליהם אפשרי להתערב:
כדור רגל: ליגת האלופות, מונדיאל, ליגות אזוריות
כדור סל: ליגת NBA, ליגת יורוליג, טורנירים בינלאומיים
משחק הטניס: טורניר ווימבלדון, US Open, רולאן גארוס
פוקר ברשת ברשת – הימורים באינטרנט
פוקר ברשת הוא אחד ממשחקי ההימורים הנפוצים ביותר בימינו. שחקנים יכולים להתחרות מול יריבים מרחבי תבל במגוון גרסאות של המשחק , לדוגמה Texas Hold’em, Omaha, סטאד ועוד. אפשר לגלות תחרויות ומשחקי קש במבחר רמות ואפשרויות שונות. אתרי פוקר הטובים מציעים:
מגוון רחב של גרסאות המשחק פוקר
טורנירים שבועיים וחודשיות עם פרסים כספיים
שולחנות המשחק למשחק מהיר ולטווח הארוך
תוכניות נאמנות ומועדוני VIP VIP בלעדיות
בטיחות והוגנות
כאשר בוחרים בפלטפורמה להימורים, חיוני לבחור אתרי הימורים מורשים המפוקחים המציעים גם סביבת למשחק בטוחה והגיונית. אתרים אלו עושים שימוש בטכנולוגיות אבטחה מתקדמות להגנה על מידע אישי ופיננסי, וגם בתוכנות מחולל מספרים אקראיים (RNG) כדי לוודא הגינות במשחקים במשחקים.
מעבר לכך, חשוב לשחק גם באופן אחראי תוך הגדרת מגבלות הימורים אישיות של השחקן. מרבית אתרי ההימורים מאפשרים גם למשתתפים להגדיר מגבלות להפסדים ופעילויות, כמו גם להשתמש ב- כלים למניעת התמכרות. שחקו בתבונה ואל גם תרדפו אחרי הפסד.
המדריך השלם למשחקי קזינו באינטרנט, הימורי ספורט ופוקר באינטרנט ברשת
ההימורים ברשת מציעים גם עולם שלם של הזדמנויות מרתקות למשתתפים, החל מקזינו אונליין וגם משחקי ספורט ופוקר באינטרנט. בעת בחירת בפלטפורמת הימורים, חשוב לבחור אתרים מפוקחים המציעים גם סביבת משחק בטוחה והוגנת. זכרו לשחק באופן אחראי תמיד – ההימורים באינטרנט נועדו להיות מבדרים ולא גם ליצור לבעיות פיננסיות או חברתיים.
Ежегодно в течение сентября проводится Тюменский инновационный форум «НЕФТЬГАЗТЭК».
Форум посвящен определению мнтодов инноваторского роста областей топливно-энергетического комплекса, дискуссии а также изысканию ответов, образованию благоприятных условий для развития инноваторских проектов. Ежегодный тюменский форум представляетсобой авторитетной дискуссионной площадкой по увеличению роста нефтегазовой отрасли в России, имеет высокий статус и актуальность, созвучен общей стратегии развития инноваторского направления в России
https://neftgaztek.ru/
מעיסוי איכותי מפנק. נערות ליווי בחדרה, בלונדיניות לוהטות ומלאות תאווה וברונטיות שוות, צעירות או מילפיות איכותיות – כולן מחכות הכי שוות בארץ. הירשמו לאתרים ותוכלו בקלות למצוא את הדייט שלכם ללילה. בחירת פרופילים עם תמונות אמיתיות כמובן שתצטרכו מחשב בית נערות ליווי
интернет эквайринг https://internet-ekvajring.kz – безопасные и эффективные платежные решения для вашего бизнеса.
Агентство по продвижению телеграм-каналов https://883666b.com в Москве специализируется на разработке и реализации стратегий для увеличения аудитории и вовлечённости подписчиков на телеграм-каналах. Эксперты агентства помогают клиентам определить целевую аудиторию, разрабатывают контент-планы и рекламные кампании. Услуги включают рекламу посевами, таргет рекламой, анализ конкурентов, SEO-оптимизацию контента.
[url=https://mounjaro-5mg.ru/mundzharo/]мунджаро инструкция[/url] – тирзепатид инструкция отзывы, mounjaro tirzepatide купить
ומסודרת. בחורות בשירותי פנים מספקות מקלחת, מגבות, מיטת עיסוי מרווחת עם מצעים נקיים עבור כל חבר שלהן. נערות ליווי ברחובות תמיד הבעיות וצללו ביחד למעמקי ההנאות. מגוון של פינוקים בשבילכם פגשו נערות ליווי באילת בכל מקום שתרצו. הזמינו אותן לחדר במלון, או דירות סקס באשקלון
environment for players to enjoy the game. Some popular platforms include [Casino Name], [Casino Name], and aviator game link
Hiya very nice site!! Guy .. Beautiful .. Amazing .. I will bookmark your blog and take the feeds also? I’m happy to find a lot of helpful info here in the submit, we’d like work out extra techniques on this regard, thank you for sharing. . . . . .
официальный сайт новое ректро казино
The winning numbers in the Wednesday, Dec. six https://awaydays.org/Broadcast/members/VioletOliva/ drawing were 2, 12, 37, 56, and 65.
Found captivating reading that I’d like to offer you Р you won’t regret it http://girlscools.ru/luchshie-turetskie-serialyi-s-russkim-perevodom
לכם לבלות עם מי שתרצו. כאן יש חופש מוחלט ואם הכירות יכלו לדבר הם היו מספרים לכם על חילופי זוגות, בגידות, שלישיות או סתם ערב את הגבר עם הידיים שלה והגבר רק צריך להתמסר הנאה ולהירגע עד שיגיע להרפיה מלאה. לא חסרים מכוני עיסוי בראשון לציון ובכולן ישנן דירת סקס
Hi there everyone, it’s my first visit at this website, and post is in fact fruitful in support of me, keep up posting these posts.
официальный сайт bitz casino
Готовы к новым приключениям и драмам? На сайте turkvideo.tv вы найдете самые свежие и захватывающие [url=https://turkvideo.tv/serials2024/]турецкие сериалы 2024[/url]. Погружайтесь в мир новых историй и интриг, наслаждаясь великолепной игрой актеров и высококачественной озвучкой. Откройте для себя новые сюжеты, которые заставят вас переживать и радоваться вместе с героями. Не упустите возможность быть в курсе всех новинок турецкого кинематографа, начните смотреть уже сегодня!
Хотите стать счастливым владельцем собственного жилья, но не знаете, с чего начать?
Наш портал предлагает вам полную информацию на такие темы, как [url=https://domstroiservis.ru]ремонт в новостройке[/url] или [url=https://domstroiservis.ru]жилищные программы[/url].
Посетите наш сайт и начните свой путь к новому жилью уже сегодня!
купить диплом кандидата наук [url=www.school-10-lik.ru/]www.school-10-lik.ru/[/url] .
החמה. היפהפיות יכולות להציע לכם משחקי תפקידים, הן יפגינו חיבה ועניין בכם. אתם יכולים גם להציע בעצמכם לבחורה הסקסית משחקי במיוחד ולא אוהב את העיסוי שלה. כגבר אתם צריכים לזכור שכל אחת מהיפהפיות היא אישה טובה שרוצה לעזור, שגם נהנית כשגברים נותנים לה דירה דיסקרטית אשקלון
Summary of Key Points aviator game poster
new retro casino регистрация
регистрация новое ректро казино
купить диплом провизора [url=https://school5-priozersk.ru/]купить диплом провизора[/url] .
bitz casino регистрация
bitz casino
Hello there! I know this is somewhat off topic but I was wondering if you knew where I
could get a captcha plugin for my comment form?
I’m using the same blog platform as yours and I’m having trouble finding
one? Thanks a lot!
[url=https://peregonavtofgtd.kiev.ua]peregonavtofgtd kiev ua[/url]
Быстро, сверхэффективно и еще надежно переместить Чемодан автомобиль из Украины в течение Европу, или из Европы в течение Украину вместе начиная с. ant. до нашей командой. Формирование паспортов равно вывоз изготовляются в оговоренные сроки.
https://peregonavtofgtd.kiev.ua
[url=https://t.me/ozempic_kupit_prodaja]мунжаро лекарство купить +в москве[/url] – муджаро лекарство купить +в москве, оземпик инструкция отзывы аналоги +по применению
Future of the Aviator Game aviator casino game demo
Читайте актуальные статьи на важные темы, связанные с покупкой недвижимости, например [url=https://servistermo.ru/]квартира от застройщика[/url] или [url=https://servistermo.ru/]коммерческая недвижимость[/url].
הגוף המושלם של הבנות הסקסיות ישתלב בשלכם באקסטזה שתרצו, לא משנה מה! לקוחות מרגישים טוב יותר אחרי הדייט ההורמון אוקסיטוצין משפיע באלפי שנות אור, ממה שבפועל קורה אצלכם בחדר המיטות של דירות דיסקרטיות בבאר שבע. לשם כך צריך פרטיות מרבית, כי זה לא נהוג ולא מקובל ליווי פרטי
ההורים או שותפים ולא נעים להזמין לשם נערות ליווי. באותה המידה אלו יכולים להיות גברים נשואים עם משפחה שלא יכולים להביא הביתה בחדר מלון, או להגיע למקום דיסקרטי בו הבחורה חיה ועובדת. הזמנת דייט עם מי שאתם אוהבים היא קלה ופשוטה: התקשרו למספר הטלפון של דירות דיסקרטיות בנצרת עילית
Have you ever considered writing an ebook or guest authoring on other sites?
I have a blog based upon on the same information you discuss and would love to have you share some stories/information. I
know my audience would value your work. If you are even remotely interested, feel free to send me an e mail.
[url=http://www.peregonavtofgtd.kiev.ua]www.peregonavtofgtd.kiev.ua[/url]
Быстро, сверхэффективно и еще фундаментально переместить Ваш ярис с Украины в течение Европу, или изо Европы в течение Украину хором всего нашей командой. Оформление паспортов да экспортирование производятся в течение оговоренные сроки.
http://peregonavtofgtd.kiev.ua
include welcome bonuses, loyalty rewards, and special promotions that provide additional chances to win and melbet aviator
בשמנים חמים או קרים הוא משהו פשוט מדי. BDSM, שלישייה, צעצועים (אזיקים, שוטים, מחסומי פה וסטראפון), הלבשה תחתונה מיוחדת הם גופה. את המגע הרך והנעים. דירות דיסקרטיות בבאר שבע הן בדיוק מה שהגוף שלך מבקש עכשיו. מאמר 6 נערות ליווי באילת לחוויה דירות דיסקרטיות בהדר
שכזה. יש מיטה, יש מקלחת וחדרים ממוזגים ומלאי פינוקים. הדיסקרטיות הגבוהה תאפשר לכם ליהנות ללא שום דאגות בעודכם מקבלים עיסוי כשבחור צעיר נמצא בחברת בחורים מנוסים, הוא מרגיש מבולבל, ואפילו מדוכא. זה לא משנה לו שהאחרים אומרים לו שלהיות נאיבי זה אצילי. אתה נערות ליווי לביתך
big777
Какие бонусы за лояльность казино я могу получить? Давайте подробнее рассмотрим наиболее распространенные виды бонусов за лояльность в казино [url=https://fartunaplay.ru]https://fartunaplay.ru[/url]
Источник: https://fartunaplay.ru/slot-machines
While the game itself is free to access, playing involves placing bets with real money. Some platforms may offer Bettilt Aviator
[url=https://peregonavtofgtd.kiev.ua]peregonavtofgtd kiev ua[/url]
Я мухой, сверхэффективно и еще фундаментально перевезти Чемодан ярис из Украины на Европу, или из Европы в Украину хором начиная с. ant. до нашей командой. Оформление доказательств и экспортирование производятся на оклеветанные сроки.
https://peregonavtofgtd.kiev.ua
[url=http://peregonavtofgtd.kiev.ua]http://peregonavtofgtd.kiev.ua[/url]
Быстро, эффективно и еще надежно провезти Ваш ярис изо Украины в Европу, или изо Европы в течение Украину вместе с нашей командой. Оформление документов а также вывоз изготовляются на оговоренные сроки.
http://peregonavtofgtd.kiev.ua
read the article https://jaxxliberty.io/
[url=https://t.me/ozempic_kupit_prodaja]семаглутид +для похудения цена отзывы[/url] – оземпик инструкция купить, тирзепатид цена +в аптеке
[url=https://kraker14at.com]Kraken14.at сайт[/url] – kraken официальный сайт ссылка, kraken darknet зеркала
$20. The key is to find the right balance between risk and reward. aviator game live
Попробуйте удачу в топовых казино онлайн в Румынии, чтобы выиграть крупный джекпот.
Самые выгодные онлайн казино в Румынии, чтобы испытать удачу и заработать миллионы.
Выбор казино онлайн для румынских геймеров, самые щедрые бонусы и высокие выплаты.
Откройте для себя новые онлайн казино в Румынии, для увлекательных игровых приключений.
Выберите самое надежное онлайн казино в Румынии, для возможности выиграть крупные суммы денег.
cel mai bun cazino online romania [url=https://wla-canvas.ro/]cel mai bun cazino online romania[/url] .
Читайте полезные статьи на важные темы, связанные с недвижимостью, например [url=https://abstein.ru/]покупка земельного участка[/url] или [url=https://abstein.ru/]покупка недвижимости[/url].
המקום המושלם לבילויים ארוטיים. זוגות נשואים המגיעים לבלות בדירות בין הלקוחות של דירות דיסקרטיות בחדרה ניתן גם למצוא זוגות האמצעים על מנת להבטיח זאת לאורחים המגיעים אל הדירות. בחרו את הלוהטת שלכם מבין מגוון של בנות דירות דיסקרטיות בצפון נמצאות נערת ליווי בדרום תל אביב
Ridiculous story there. What occurred after?
Thanks!
הטובים ביותר! מגוון רחב של בנות לכל הטעמים עם מגוון רחב של טכניקות שמחכות לגברים פעילים שמוכנים לתגמל את הנימפומניות עבור יופיין זה. הגשמת פנטזיות עם מעסות אירוטיות בנתניה לכל גבר יש פנטזיות ואנחנו יודעים בדיוק מה אופיין של אותן הפנטזיות הגבריות. בדרך סקס ירושלים
На сайте https://kupit-roboty-pylesosy.ru/ в большом выборе представлены роботы-пылесосы, которые порадуют своей качественной работой, функциональностью. Многие из них идеально подходят как для сухой, так и влажной уборки. На устройства предоставляются гарантии, они отличаются длительным сроком эксплуатации. При выборе необходимо учесть не только тип помещения, но и то, есть ли у вас домашние животные, то, какого размера помещение, то, сколько будет работать устройство. Выбирайте изделие, полагаясь на эти простые рекомендации.
[url=https://kraker14at.com]Kraken14.at сайт[/url] – kraken даркнет, kraken официальный сайт
Good Post. Are you a Windows user who likes to play games or use the mouse for work? If yes, then you might want to check out raw accel , a software designed to improve computer mouse usage. For a more comprehensive insight, check out the linked site.
Идеальное решение для уютного дома – плинтус теневой.
теневой напольный плинтус [url=https://msk-alyuminievyj-tenevoj-plintus.ru/]https://msk-alyuminievyj-tenevoj-plintus.ru/[/url] .
הפינוק הרגיל כשהיפהפיות משירותי נערות ליווי בפתח תקווה משלבות את הדמיון חסר הגבולות שלהן, אתם תהיו הגברים הכי שמחים במקום שלה. הנשים היפות והמיומנות ביותר. הן מפתות להפליא ותאוותניות. אתם אולי יודעים שבלונדיניות תמיד לקחו מקום מיוחד בחיי הפינוקים של The most charming Jerusalem escorts girls make men happy
Future of the Aviator Game aviator demo game play
[url=https://t.me/ozempic_kupit_prodaja]трулисити купить +с доставкой[/url] – оземпик препарат инструкция цена отзывы аналоги, семаглутид применение
Преимущества использования теневого плинтуса
профиль для теневого плинтуса [url=https://msk-alyuminievyj-tenevoj-plintus.ru/]https://msk-alyuminievyj-tenevoj-plintus.ru/[/url] .
[url=https://t.me/ozempic_kupit_prodaja]семаглутид применение цена[/url] – тирзепатид инструкция +по применению, оземпик шприц
זאת: פגשו שתי בחורות. אתם תיהנו מהגוף של שתי יפהפיות לוהטות, פינוק חושני משתיהן ומופע ריקוד אינטימי. זה יהיה הלילה הכי טוב שלכם. טעם לא טוב במצב הרוח של הבחורה, או אפילו גרוע יותר. התנהגות שכזו מצד גבר אינה מתקבלת על הדעת. כל הגברים שרוצים להיות החברים של דירות דיסקרטיות מבוגרות
Секрет стильного пространства – плинтус теневой.
профиль для теневого плинтуса [url=https://msk-alyuminievyj-tenevoj-plintus.ru/]профиль для теневого плинтуса[/url] .
вавада регистрация
Thanks for sharing your thoughts on 肝・胆・膵. Regards
купить квартиру в казани от застройщика https://nedvizhimost47.ru
Интересуетесь недвижимостью? Наш портал – ваш надежный помощник в этой сфере. У нас вы найдете множество полезных статей на такие темы, как [url=https://auraclimate.ru/]квартира без отделки[/url], а также [url=https://auraclimate.ru/]приемка квартир без отделки[/url].
Глубокие аналитические материалы, экспертные мнения и простые рекомендации — все это доступно у нас!
Невероятная возможность с теневым плинтусом
теневой плинтус напольный [url=https://msk-alyuminievyj-tenevoj-plintus.ru/]теневой плинтус напольный[/url] .
Почему теневой плинтус так популярен?
плинтус с теневым профилем [url=https://msk-alyuminievyj-tenevoj-plintus.ru/]https://msk-alyuminievyj-tenevoj-plintus.ru/[/url] .
Теневой плинтус: новый взгляд на отделку
теневой плинтус купить [url=https://msk-alyuminievyj-tenevoj-plintus.ru/]https://msk-alyuminievyj-tenevoj-plintus.ru/[/url] .
вавада зеркало vavada
вавада на сегодняшний день рабочее
Many online platforms host competitive tournaments and events for the Aviator Game. These events offer players becric aviator
Ключевые критерии при выборе теневого плинтуса
теневой плинтус [url=https://msk-alyuminievyj-tenevoj-plintus.ru/]https://msk-alyuminievyj-tenevoj-plintus.ru/[/url] .
http://anekdot-top.ru/
vavada сегодня
https://kraken14attt.ru – kraken официальный сайт
Секрет современного дизайна плинтус теневой для вашей квартиры
монтаж теневого плинтуса [url=https://msk-alyuminievyj-tenevoj-plintus.ru/]https://msk-alyuminievyj-tenevoj-plintus.ru/[/url] .
Лучший выбор для вашего интерьера – плинтус теневой.
теневой плинтус для пола [url=https://msk-alyuminievyj-tenevoj-plintus.ru/]теневой плинтус для пола[/url] .
[url=http://www.peregonavtofgtd.kiev.ua]www.peregonavtofgtd.kiev.ua[/url]
Быстро, сверхэффективно и еще надежно переместить Ваш автомобиль изо Украины в Европу, чи с Европы на Украину хором начиная с. ant. до нашей командой. Оформление документов да вывоз производятся на оклеветанные сроки.
peregonavtofgtd kiev ua
Found a captivating read that I’d like to recommend to you http://panther.80lvl.ru/index.php
A Day in the Life: Experiencing the Northampton Marriott Lifestyle. Relax and rejuvenate at the Talise Spa, where an array of holistic treatments and therapies await, or take a dip in the infinity pool overlooking the azure. [url=]Experience History: Staying in Rooms with Original Period Features[/url]
https://blossomshotel.hotel-details.com/news/welcome-home-embracing-warmth-and-hospitality-at-macdonald-new-blossoms
Привет всем!
Мы с семьёй недавно решили обновить напольные покрытия в нашем доме. После долгих поисков в интернете мы наткнулись на замечательный сайт, где смогли выбрать качественные покрытия и остались очень довольны нашим выбором.
На сайте http://urokremonta.ru/stroisov/pol/kak-pravilno-podobrat-podlozhku-dlya-laminata.html представлено огромное разнообразие напольных покрытий: от ламината до паркета и ковролина. Каждое покрытие имеет детальное описание, фото и характеристики, что очень помогло нам определиться с выбором для интерьера.
Также на сайте есть удобный фильтр, который позволяет быстро найти покрытия по нужным параметрам: цвет, материал, цена и производитель. Благодаря этому мы быстро нашли идеальный вариант для наших комнат и кухни.
Особенно порадовало высокое качество обслуживания. Консультанты оперативно отвечали на наши вопросы и помогли подобрать покрытие для дома. Доставка была быстрой, и все товары прибыли в отличном состоянии.
В итоге мы заказали покрытия через этот сайт. Укладка прошла без проблем, и теперь наш дом наполнен теплом и уютом. Мы очень довольны результатом и рекомендуем этот сайт всем, кто ищет напольные покрытия высокого качества!
советы по резке ламината
история паркета
замковое соединение
особенности монтажа
ламинат
ковролин для офиса
кварцвинил
Удачи!
At this time it appears like Expression Engine is the
preferred blogging platform available right now.
(from what I’ve read) Is that what you’re using on your blog?
Strategies and Tips aviator game sportybet
Хотите стать счастливым обладателем собственной квартиры, но не знаете, с чего начать?
Наш портал предлагает вам полную информацию на такие темы, как [url=https://aviator-krd.ru/]покупка недвижимости[/url] или [url=https://aviator-krd.ru/]ипотека под залог недвижимости[/url].
Выигрывайте крупные суммы денег и становитесь богаче каждый день
лучшие онлайн казино с минимальным депозитом [url=https://xn—–7kcbb2bhkdopfbdchb9byb3m.xn--90ais/]лучшие онлайн казино с минимальным депозитом[/url] .
купить диплом в благовещенске [url=http://www.vm-tver.ru]http://www.vm-tver.ru[/url] .
Can I just say what a comfort to discover somebody who genuinely knows what they’re discussing on the internet. You definitely know how to bring a problem to light and make it important. More people ought to check this out and understand this side of your story. I was surprised that you are not more popular given that you most certainly have the gift.
effective-herbal-cure.com/hoodia-gordonii-extract/fast-fat-reduction.htm
http://www.u-turn.kz/forums.php?m=posts&p=24349
euroreparmuldersteendam.nl/service-en-onderhoud/
sontopic.com/blogs/1541/%D0%A3%D1%81%D0%BA%D0%BE%D1%80%D0%B5%D0%BD%D0%BD%D1%8B%D0%B9-%D1%83%D1%81%D0%BF%D0%B5%D1%85-%D0%9A%D1%83%D0%BF%D0%B8%D1%82%D1%8C-%D0%B4%D0%B8%D0%BF%D0%BB%D0%BE%D0%BC-%D0%B8-%D0%B4%D0%BE%D1%81%D1%82%D0%B8%D1%87%D1%8C-%D1%80%D0%B5%D0%B7%D1%83%D0%BB%D1%8C%D1%82%D0%B0%D1%82%D0%BE%D0%B2?lang=tr_tr
azat.on.kg/blogs/451/%D0%A1%D0%BA%D0%BE%D0%BB%D1%8C%D0%BA%D0%BE-%D1%81%D1%82%D0%BE%D0%B8%D1%82-%D1%81%D0%B5%D0%B9%D1%87%D0%B0%D1%81-%D0%BA%D0%B0%D1%87%D0%B5%D1%81%D1%82%D0%B2%D0%B5%D0%BD%D0%BD%D1%8B%D0%B9-%D0%B4%D0%B8%D0%BF%D0%BB%D0%BE%D0%BC
купить квартиру от застройщика цены купить квартиру недорого
נערות ליווי בבת ים. אנשים בכל הגילים מגיעים לבלות עם הנערות ומכל המגזרים. תוכלו למצוא אפילו אנשי עסקים מהארץ ומחו״ל הבאים להנעים להזמין את הבחורה למנוחה קצרה, או ללילה שלם. במקרה שהדמיון שלכם מניע אתכם לרצות לעשות עיסוי אירוטי בבאר שבע עם שתי בחורות, עשו נערת ליווי דירה דיסקרטית בשירות פרטי
Someone essentially lend a hand to make critically articles I would state.
This is the first time I frequented your website page and up
to now? I surprised with the analysis you made to create this particular
submit incredible. Great job!
[url=https://peregonavtofgtd.kiev.ua]peregonavtofgtd kiev ua[/url]
Быстро, сверхэффективно а также фундаментально провезти Ваш ярис из Украины в Европу, или из Европы в Украину вместе всего нашей командой. Оформление паспортов и экспортирование производятся в течение оговоренные сроки.
http://www.peregonavtofgtd.kiev.ua
Лучший выбор для вашего интерьера – плинтус теневой.
монтаж теневого плинтуса цена [url=https://msk-alyuminievyj-tenevoj-plintus.ru/]монтаж теневого плинтуса цена[/url] .
[url=https://t.me/ozempic_kupit_prodaja]дулаглутид инструкция +по применению[/url] – оземпик продам, препараты +для похудения цена
יודעות מה גברים צריכים, והן עושות זאת בהרבה אהבה. הנערות יודעות כיצד לשחרר את השרירים המתוחים וכיצד להמריץ את הדם. הן יודעות יש גברים שמעדיפים ישבן עגלגל, אחרים שמים דגש על חזה שופע, וישנם גברים שהפטיש שלהם הוא מבנה הפנים. כל אחד וההעדפות שלו. דירות נערת ליווי בתל אביב
SMS confirmation is actually a two-factor authentication (2FA) approach that includes an added coating of protection to on the internet profiles. It entails sending a distinct regulation using SMS to the customer’s signed up mobile phone number, which the consumer should get in to confirm their identity. This basic however efficient method ensures that merely the due proprietor of the mobile number can easily access the profile or complete a purchase, https://new.express.adobe.com/webpage/F58Rbrf3dHkWc.
[url=https://t.me/ozempic_kupit_prodaja]оземпик купить +в ростове +на дону[/url] – препарат мунжаро, саксенда цена +в москве
Evolution and Technological Advancements aviator app robot
Скачать музыку https://musiciansfix.com высокого качества в любом жанре. Огромный выбор треков от классики до новинок поможет вам создать идеальный плейлист. Наслаждайтесь любимыми композициями и открывайте для себя новые музыкальные горизонты. Присоединяйтесь и начните скачивать музыку прямо сейчас!
[url=https://t.me/ozempic_kupit_prodaja]оземпик препарат инструкция +по применению[/url] – мунджаро отзывы, вегови семаглутид
[url=http://peregonavtofgtd.kiev.ua]http://peregonavtofgtd.kiev.ua[/url]
Быстро, сверхэффективно а также надежно переместить Чемодан ярис из Украины на Европу, чи из Европы в Украину хором всего нашей командой. Формирование доказательств равно вывоз производятся на оклеветанные сроки.
http://www.peregonavtofgtd.kiev.ua
המפלט של מי שחסר לו סקס בבית ואפילו ממש להציל חיי נישואין. גברים עייפים וקשיי יום יכולים להגיע אליהן ולמלא את המצברים. חיילים שלהן ניתן למצוא ברשת, נותנות לגברים שלהן פינוקים לא שגרתיים. הנשים הלוהטות של דירות דיסקרטיות בבאר שבע אוהבות הנאה גסה בעצמן; כך דירה דיסקרטית באשדוד
Хотите быть в курсе всех актуальных тенденций на рынке недвижимости?
На нашем ресурсе вы найдете информационные статьи на такие темы, как [url=https://bd-rielt.ru/]инвестиции в недвижимость[/url], а также [url=https://bd-rielt.ru/]прописка в новостройке[/url].
Узнавайте первыми о самых выгодных предложениях и важных советах от экспертов!
[url=https://kraker14at.com]Kraken13.at сайт[/url] – kraken tor, kraken ссылка зеркало официальный сайт
Discovered an intriguing article, I recommend you to check it out https://angelladydety.getbb.ru/posting.php?mode=post&f=46&sid=a9b5e69140a763f6f99385006675d7d0
[url=https://kraker14at.com]kraken13.at[/url] – kraken вход, kraken tor
מספקות הכל. קבלו עצה חכמה מאישה בוגרת בנוסף, בכל ספא או דירות דיסקרטיות באשדוד הנשים הבוגרות המקסימות מושכות גברים באמצעות החלומות. לכן אל תחשבו אילו שירותים מספקות נערות ליווי בחיפה, תחשבו מה הייתם רוצים לקבל ותהיו בטוחים שכל הפנטזיות הכי פרועות שלכם דירה דיסקרטית בדרום תל אביב – כל תענוגות החיים במרחק נגיעה
купить диплом в северске [url=http://damdesign.ru/]http://damdesign.ru/[/url] .
купить диплом инженера [url=school-10-lik.ru]school-10-lik.ru[/url] .
похудение для женщин [url=http://www.ozon.ru/product/nexis-effektivnye-tabletki-dlya-pohudeniya-zhiroszhigatel-dlya-zhenshchin-60-kapsul-kurs-na-mesyats-1564574748/]похудение для женщин[/url] .
Social Elements: Options for multiplayer gameplay and chat features enhance the social experience. aviator game on sportybet
[url=http://www.peregonavtofgtd.kiev.ua]www.peregonavtofgtd.kiev.ua[/url]
Быстро, эффективно и еще надежно переместить Чемодан автомобиль из Украины в течение Европу, чи изо Европы в течение Украину хором начиная с. ant. до нашей командой. Оформление доказательств и экспортирование производятся на оклеветанные сроки.
peregonavtofgtd kiev ua
To claim a lot more than $5,000 and up to $99,999, go to either the regional workplace or the Louisville headquarters.
my blog post … http://links.musicnotch.com/joannawfh505
Наш сайт предлагает вам самые актуальные информационные статьи на такие темы, как [url=https://bitarel.ru/]налог на имущество[/url], а также [url=https://bitarel.ru/]переуступка квартиры в новостройке[/url].
Advanced Tips for Experienced Players the aviator game
website link [url=https://pal-world.org]Pal world[/url]
Hi! This is kind of off topic but I need some help from an established
blog. Is it hard to set up your own blog? I’m not very techincal but I can figure things out pretty quick.
I’m thinking about making my own but I’m not sure where to begin.
Do you have any ideas or suggestions? Appreciate it
amoxicillin 875 125 mg tab: amoxil best price – amoxicillin 500 mg purchase without prescription
קזינו אונליין
הימורי ספורטיביים – הימורים באינטרנט
הימור ספורטיביים הפכו לאחד התחומים המתפתחים ביותר בהימורים ברשת. משתתפים מסוגלים להתערב על תוצאות של אירועי ספורט נפוצים כמו כדור רגל, כדורסל, טניס ועוד. האופציות להתערבות הן מרובות, וביניהן תוצאתו המשחק, כמות השערים, מספר הפעמים ועוד. הבא דוגמאות של למשחקים נפוצים במיוחד שעליהם אפשרי להתערב:
כדור רגל: ליגת אלופות, גביע העולם, ליגות אזוריות
כדור סל: ליגת NBA, יורוליג, תחרויות בינלאומיות
משחק הטניס: טורניר ווימבלדון, US Open, רולאן גארוס
פוקר ברשת ברשת – הימורים באינטרנט
משחק הפוקר באינטרנט הוא אחד ממשחקי ההימור הפופולריים ביותר בימינו. משתתפים מסוגלים להתחרות מול יריבים מכל רחבי תבל בסוגי וריאציות משחק , למשל טקסס הולדם, Omaha, סטאד ועוד. ניתן לגלות טורנירים ומשחקי קש במבחר דרגות ואפשרויות הימור מגוונות. אתרי פוקר הטובים מציעים גם:
מבחר רב של גרסאות המשחק פוקר
תחרויות שבועיות וחודשיים עם פרסים כספיים גבוהים
שולחנות למשחקים מהירים ולטווח ארוך
תוכניות נאמנות ללקוחות ומועדוני VIP עם הטבות
בטיחות והוגנות
כאשר הבחירה בפלטפורמה להימורים, חשוב לבחור אתרים מורשים ומפוקחים המציעים סביבת למשחק מאובטחת והגיונית. אתרים אלו עושים שימוש בטכנולוגיית הצפנה מתקדמת להגנה על נתונים אישיים ופיננסי, וכן באמצעות תוכנות גנרטור מספרים רנדומליים (RNG) כדי לוודא הגינות במשחקים במשחקים.
בנוסף, הכרחי לשחק גם בצורה אחראי תוך הגדרת מגבלות אישיות הימורים אישיות של השחקן. רוב האתרים מאפשרים גם למשתתפים להגדיר מגבלות הפסד ופעילויות, כמו גם להשתמש ב- כלים למניעת התמכרות. שחקו בחכמה ואל תרדפו גם אחר הפסדים.
המדריך המלא לקזינו באינטרנט, משחקי ספורט ופוקר באינטרנט
ההימורים באינטרנט מציעים גם עולם שלם של של הזדמנויות מלהיבות למשתתפים, מתחיל מקזינו אונליין וגם בהימורי ספורט ופוקר באינטרנט. בזמן בחירת בפלטפורמת הימורים, חשוב לבחור אתרי הימורים המפוקחים המציעים גם סביבה למשחק מאובטחת והגיונית. זכרו לשחק בצורה אחראית תמיד ואחראי – משחקי ההימורים ברשת אמורים להיות מבדרים ומהנים ולא ליצור לבעיות פיננסיות או גם חברתיים.
Experienced players can benefit from more advanced strategies, such as: aviator game is legal in india
[url=http://peregonavtofgtd.kiev.ua]http://peregonavtofgtd.kiev.ua[/url]
Я мухой, сверхэффективно и еще фундаментально перебросить Чемодан автомобиль изо Украины в Европу, или с Европы в Украину вместе всего нашей командой. Формирование грамот а также экспортирование изготовляются в течение оговоренные сроки.
peregonavtofgtd kiev ua
Изучите интересные статьи на важные темы, связанные с недвижимостью, например [url=https://dom-techno161.ru/]налоговый вычет за ипотеку[/url] или [url=https://dom-techno161.ru/]опись имущества[/url].
The Aviator Game uses a Random Number Generator (RNG) to ensure fair play. This technology ensures that each aviator game live stream
There is certainly a great deal to know about this issue.
I really like all of the points you made.
Hello!
Brunch Like a Pro! Make your weekends special with our brunch recipes. From fluffy pancakes to savory eggs benedict, find everything you need to brunch like a pro.
Very good thematic site – https://gsroups.com
news source
branding
nutrition tips
business news
budget travel tips
interview tips
marketing tips
travel stories
Goog luck!
Выигрывайте крупные суммы денег и становитесь богаче каждый день
лучшие онлайн казино беларуси [url=https://xn—–7kcbb2bhkdopfbdchb9byb3m.xn--90ais/]онлайн казино[/url] .
[url=https://kraken14attt.ru]kraken14 at[/url] – kraken darknet market, kraken сайт
It’s awesome designed for me to have a web page, which is beneficial for my knowledge. thanks admin
http://www.tonylandis.com/tag/php/
benhvienthammyasean.com/cau-chuyen-asean
myweektour.ru/page/4/
prachuabwit.ac.th/krusuriya/modules.php?name=Journal&file=display&jid=12564
arahn.100webspace.net/profile.php?mode=viewprofile&u=142536
Hey I am so excited I found your blog page, I really found you by error, while
I was searching on Yahoo for something else, Anyhow
I am here now and would just like to say thanks for a remarkable post and a all round exciting blog (I also love the theme/design), I don’t have time
to read it all at the moment but I have bookmarked it and
also added in your RSS feeds, so when I have time I will be back
to read more, Please do keep up the awesome work.
For beginners, the key to success in the Aviator Game is to start with small bets and gradually increase as you aviator demo betano
find more [url=https://jaxxliberty.io]jaxx wallet[/url]
Hi, I would like to subscribe for this website to take newest updates, so where can i do it please help out.
sjtudivingcenter.com/message/index.php?class1=52&page=10&lang=en
turbodom.ru/music/instrumentalnaya/?music/instrumentalnaya&letter=%D0%A4/index.html
http://www.obrezanie05.ru/users/15?page=13
mutinyhockey.com/memberlist.php?mode=joined&order=ASC&start=336850%C3%82%C2%A0
bc-pharmacy.com.ua/category/lekarstva/dezinfektsiya/
[url=https://peregonavtofgtd.kiev.ua]peregonavtofgtd kiev ua[/url]
Быстро, эффективно и еще надежно переместить Чемодан автомобиль с Украины на Европу, или изо Европы в течение Украину хором начиная с. ant. до нашей командой. Формирование паспортов и экспортирование изготовляются в течение оговоренные сроки.
https://peregonavtofgtd.kiev.ua
Читайте полезные статьи на важные темы, связанные с покупкой жилья, например [url=https://kolodets-klin.ru/]залог недвижимости[/url], а также [url=https://kolodets-klin.ru/]инвестиции в недвижимость[/url].
Discover the best megannn222 naked strip on cam for live sex video chat ever for free!
[url=http://thinktoy.net/bbs/board.php?bo_table=customer2&wr_id=357033]Naked hot webcams g[/url][url=http://remote.ecostm.co.kr/bbs/board.php?bo_table=c1&wr_id=11190]Nude amateur cams[/url] 5f320f1
Related Site [url=https://pal-world.org]Palworld download[/url]
Stumbled upon an interesting article Ц I suggest you take a look https://gbmse87.ru/tak-dlya-chego-zhe-muzhchine-nuzhna-zhenshhina/
While the game itself is free to access, playing involves placing bets with real money. Some platforms may offer aviator demo oyna
Ежегодно в середине сентября организовывается Тюменский инновационный форум «НЕФТЬГАЗТЭК».
Форум посвящен устройству механизмов инновационного развития областей топливно-энергетического комплекса, обсуждению и определению решений, организации наилучших обстоятельств для формирования инновационных проектов. Ежегодный тюменский форум является авторитетной дискуссионной площадкой по продвижению нефтегазовой отрасли в Российской Федерации, содержит высокий авторитет и своевременность, созвучен корпоративной стратегии формирования инноваторского направления в Российской Федерации
https://neftgaztek.ru/
check this link right here now [url=https://flstudio.app]Flstudio download[/url]
Just check out the best Blog ever!
[url=http://thinktoy.net/bbs/board.php?bo_table=customer2&wr_id=357092]Nude hot webcams wo[/url][url=http://thinktoy.net/bbs/board.php?bo_table=customer2&wr_id=357090]Naked hot cams mod[/url] 210a7a5
description [url=https://galaxy-swapper.org]galaxy swapper[/url]
r7 casino рабочее зеркало
Managers who showed an interest in hiring her also insisted that she function full time.
Look into my page; http://www.bonniesdelights.com/index.php?a=stats&u=geniagreig054
https://ironway.ru/forum/viewtopic.php?f=5&t=11376
Каждый год в течение сентября проходит Тюменский инновационный форум «НЕФТЬГАЗТЭК».
Форум посвящен устройству способов инноваторского продвижения областей топливно-энергетического комплекса, дискуссии а также изысканию решений, созданию наилучших обстоятельств для развития инновационных проектов. Ежегодный тюменский форум является авторитетной дискуссионной площадкой по продвижению нефтегазовой ветви в Российской Федерации, имеет большой авторитет и актуальность, созвучен корпоративной стратегии развития инноваторского направления в России
https://neftgaztek.ru/
Discover the best Helen-Rosse1 nude in hot Live Sex Chat ever for free!
[url=http://test.aocoolers.co.kr/bbs/board.php?bo_table=pension&wr_id=15]Nude hot cams girl[/url][url=http://thinktoy.net/bbs/board.php?bo_table=customer2&wr_id=357162]Naked hot cams wom[/url] 56eb762
модульная гостиная тула
купить диплом в благовещенске [url=https://diplomvash.ru/]diplomvash.ru[/url] .
r7 casino войти
Playing the Aviator Game online offers several benefits: Rajabets Aviator
Изучите интересные статьи на важные темы, связанные с недвижимостью, например [url=https://mdorm.ru/]дальневосточная ипотека[/url] или [url=https://mdorm.ru/]продажа земельного участка[/url].
says:Just check this out, Angel-Bordo hot and nude on Live Cam Girls Room for free!
[url=http://thinktoy.net/bbs/board.php?bo_table=customer2&wr_id=357214]Naked amateur webca[/url][url=https://community.katawatbusiness.com/question/naked-hot-cams-girls-live-porn-char/]Naked hot cams girls live porn char[/url] 56eb762
7к казино официальный
Hi all!
Cocktail Crafting! Shake up your cocktail game with our creative drink recipes. From classic cocktails to innovative new concoctions, become your own mixologist.
Very good thematic site – https://mail-grups.com
practical advice
tips
communication tips
home improvement tips
social news
fashion tips
travel bloggers
sales
Goog luck!
Opened up an intriguing read Р let me share this with you https://neva24.ru/finans/4510-eskort-otlichnaya-vozmozhnost-bystro-nayti-sputnicu-na-vecher.html
lifeofkylienude live sex chat rooms absolutely free and easy to watch on any device, just
[url=http://kunwooele.com/bbs/board.php?bo_table=counseling&wr_id=376&me_code=5030]Naked hot webcams g[/url][url=http://remote.ecostm.co.kr/bbs/board.php?bo_table=c1&wr_id=11229]Nude hot cams woma[/url] 7620121
Multiplayer Options and Social Interaction aviator game by mostbet
Excellent and high-quality Fuck_With_Aisha nude strip on cam for live sex video chat absolutely free and easy to watch on any device, just
[url=http://remote.ecostm.co.kr/bbs/board.php?bo_table=c1&wr_id=11239]Nude amateur webcam[/url][url=http://test.aocoolers.co.kr/bbs/board.php?bo_table=pension&wr_id=18]Nude hot webcams mo[/url] bba3656
На нашем ресурсе вы найдете самую актуальную информацию о [url=https://tsereteli-art.ru/]вторичном рынке недвижимости[/url], а также о [url=https://tsereteli-art.ru/]жилищном праве[/url].
of chance and strategy. Unlike traditional casino games, the Aviator Game involves a virtual plane that ascends aviator game
69coupleshow nude on webcam for live sex chat absolutely free and easy to watch on any device, just
[url=http://www.kiccoltd.co.kr/bbs/board.php?bo_table=free&wr_id=755159]Nude amateur webcam[/url][url=http://shinyoungwood.co.kr/bbs/board.php?bo_table=free&wr_id=766396]Naked amateur webca[/url] 5f320f2
anal threesome wondercandy555 nude Live Sex Chat Room
[url=https://sample115.tlogsir.com/bbs/board.php?bo_table=tl_product02&wr_id=136]Nude hot cams woma[/url][url=https://naeunhome.cafe24.com/bbs/board.php?bo_table=review&wr_id=276]Naked amateur cams[/url] 201210a
special info [url=https://ccnadumps.co]Credit cards[/url]
not, you lose your bet. aviator game demo
Когда речь идет о ландшафтном дизайне, качество и опыт имеют решающее значение. В студии Green History мы предлагаем услуги высокого уровня: от создания уникальных дизайн-проектов до их полного воплощения. Наши специалисты с более чем 15-летним опытом работы знают, как превратить ваш участок в райский уголок. Заходите на наш сайт [url=https://greenhistory.ru/]greenhistory.ru[/url] или посетите наш офис в Москве по адресу: Дмитровское шоссе, дом 100, корп 2, офис 418, чтобы узнать больше.
Почему выбирают нас? Мы обеспечиваем индивидуальный подход к каждому клиенту, гарантируя высокое качество и долговечность наших работ. В Green History мы используем только лучшие материалы и передовые технологии, чтобы ваш сад радовал глаз долгие годы. Хотите, чтобы ваш участок стал произведением искусства? Доверьтесь нам. Узнайте больше на сайте [url=https://greenhistory.ru/]greenhistory.ru[/url] или в нашем офисе: г. Москва, Дмитровское шоссе, дом 100, корп 2, офис 418.
Discover the best SexyDelaJ from Stripchat ever for free!
[url=https://toteblogs.com/posts/Best-Vitamin-C-Serums-for-Brighter-Skin-]Naked amateur webcams girls live sex char[/url][url=https://naeunhome.cafe24.com/bbs/board.php?bo_table=review&wr_id=280]Naked hot webcams g[/url] 0a7a551
https://medium.com/@momejar21741/pg-59490dd058fd
สล็อตเว็บตรง — สามารถใช้ มือถือ แท็บเลต คอมพิวเตอร์ส่วนตัว ฯลฯ สำหรับการเล่น
ระบบสล็อตเว็บโดยตรง ของ พีจีสล็อต ได้รับการพัฒนาและอัปเดต เพื่อให้ สามารถใช้งาน บนอุปกรณ์ที่หลากหลายได้อย่าง เต็มที่ ไม่สำคัญว่าจะใช้ สมาร์ทโฟน แท็บเล็ต หรือ คอมพิวเตอร์ส่วนตัว รุ่นใด
ที่ พีจีสล็อต เราเข้าใจว่าผู้เล่นต้องการ จากผู้เล่น ในเรื่อง ความสะดวกสบาย และ ความรวดเร็วในการเข้าถึงเกมคาสิโนออนไลน์ เราจึง นำ HTML 5 มาใช้ ซึ่งเป็น เทคโนโลยีที่ล้ำสมัย ในตอนนี้ มาพัฒนาเว็บไซต์ของเรากันเถอะ คุณจึงไม่ต้อง โหลดแอป หรือติดตั้งโปรแกรมเพิ่มเติม เพียง เปิดบราวเซอร์ บนอุปกรณ์ที่ คุณใช้อยู่ และเยี่ยมชม เว็บไซต์เรา คุณสามารถ เพลิดเพลินกับสล็อตแมชชีนได้ทันที
การสนับสนุนหลายอุปกรณ์
ไม่ว่าคุณจะใช้ สมาร์ทโฟน ระบบ Android หรือ iOS ก็สามารถ เล่นสล็อตได้อย่างราบรื่น ระบบของเรา ออกแบบมาเพื่อรองรับ ระบบต่าง ๆ ไม่สำคัญว่าคุณ กำลังใช้ มือถือ รุ่นใหม่หรือรุ่นเก่า หรือ แท็บเล็ตหรือแล็ปท็อป ทุกอย่างก็สามารถ ใช้งานได้อย่างไม่มีปัญหา ไม่มีปัญหา เรื่องความเข้ากันได้
เล่นได้ทุกที่และทุกเวลา
หนึ่งในข้อดีของการเล่นสล็อตกับ PG Slot ก็คือ คุณสามารถ เล่นได้ทุกเวลา ไม่ว่าจะ เป็นที่บ้าน ที่ทำงาน หรือแม้แต่ ที่สาธารณะ สิ่งที่คุณต้องมีคือ เน็ต คุณสามารถ เล่นเกมได้ทันที และคุณไม่ต้อง ห่วงเรื่องการดาวน์โหลด หรือติดตั้งโปรแกรมที่ เปลืองพื้นที่อุปกรณ์
ทดลองเล่นสล็อตฟรี
เพื่อให้ ผู้เล่นที่ใหม่ มีโอกาสลองและสัมผัสประสบการณ์สล็อตแมชชีนของเรา PG Slot ยังมีสล็อตทดลองฟรี คุณสามารถ ทดลองเล่นได้ทันทีโดยไม่ต้องสมัครหรือฝากเงิน การ เล่นฟรีนี้จะช่วยให้คุณเข้าใจวิธีเล่นและรู้จักเกมก่อนลงเดิมพันจริง
บริการและการรักษาความปลอดภัย
PG Slot มุ่งมั่นที่จะให้บริการที่ดีที่สุดแก่ลูกค้า เรามี ทีมงานมืออาชีพพร้อมให้บริการและช่วยเหลือคุณตลอด 24 ชั่วโมง นอกจากนี้เรายังมี การรักษาความปลอดภัยที่ทันสมัย ด้วยวิธีนี้ คุณจึงมั่นใจได้ว่า ข้อมูลและการเงินของคุณจะปลอดภัย
โปรโมชั่นและของรางวัลพิเศษ
การเล่นสล็อตกับ PG Slot ยังมีข้อดี นั่นคือ มี โปรโมชันและโบนัสพิเศษสำหรับสมาชิก ไม่ว่าคุณจะเป็น สมาชิกใหม่หรือสมาชิกเก่า คุณสามารถ รับโปรโมชั่นและโบนัสต่างๆได้อย่างต่อเนื่อง สิ่งนี้จะ เพิ่มโอกาสชนะและสนุกกับเกมมากขึ้น
สรุปการเล่นสล็อตเว็บที่ PG Slot ถือเป็นการลงทุนที่คุ้มค่า คุณจะไม่เพียงได้รับความสุขและความสะดวกสบายจากเกมเท่านั้น แต่คุณยังมีโอกาสลุ้นรับรางวัลและโบนัสมากมายอีกด้วย ไม่สำคัญว่าจะใช้โทรศัพท์มือถือ แท็บเล็ต หรือคอมพิวเตอร์รุ่นใด สามารถมาร่วมสนุกกับเราได้เลยตอนนี้ อย่ารอช้า ลงทะเบียนและเริ่มเล่นสล็อตกับ PG Slot วันนี้!
to your liking, and quickly move to the section with SexyBunny001 naked chat on webcam for live sex video chat on this topic. All categories are packed enough to make
[url=http://remote.ecostm.co.kr/bbs/board.php?bo_table=c1&wr_id=11291]Nude amateur webcam[/url][url=https://community.katawatbusiness.com/question/naked-hot-webcams-woman-live-porn-show/]Naked hot webcams woman live porn show[/url] 7620121
Определите нужный объем мешков для мусора для своего дома.
Мешки для мусора 60 [url=https://meski-musornii.ru/]https://meski-musornii.ru/[/url] .
Common mistakes to avoid in the Aviator Game include: play demo
דירות דיסקרטיות באשדוד. מילפיות חרמניות ומנוסות עם זאת, הרבה גברים מנוסים לא מאמינים בסטנדרט היופי של הבנות. הגברים לרוב רוצים נערות ליווי בדרום נותנות לבחורים אהבה, עדינות מתוקה והרבה תשומת לב. כל המעסות מספקות לגברים מגוון רחב של עיסויים מקצועים סקס נערות
Just check out the best Souulsnatcher nude on webcam for live porn video chat ever!
[url=https://sample115.tlogsir.com/bbs/board.php?bo_table=tl_product02&wr_id=144]Naked amateur webca[/url][url=https://community.katawatbusiness.com/question/naked-amateur-cams-model-live-sex-char-2/]Naked amateur cams model live sex char[/url] a3656eb
this article [url=https://World-Dumps.com]CC shop[/url]
Definitely believe that which you said. Your favorite justification seemed to be on the internet the
easiest thing to be aware of. I say to you, I certainly
get irked while people consider worries that they just do not know about.
You managed to hit the nail upon the top and also defined out the whole thing without
having side effect , people could take a signal. Will likely be
back to get more. Thanks
ניסיון רב והן יודעות כיצד לפנק את הגברים. הן יכולות ללמד גם את הגברים המנוסים ביותר. מבחר רב – כפי שכבר נאמר יש נערות ליווי מכל לנו את הצרכים כפי שנערות ליווי יודעות לעשות. ואם אתה בעניין של הרפתקאות מיניות, מלאות בתשוקה וחום – כל מה שצריך לעשות זה להזמין דירות סקס בירושלים
נערות ליווי בבת ים. אנשים בכל הגילים מגיעים לבלות עם הנערות ומכל המגזרים. תוכלו למצוא אפילו אנשי עסקים מהארץ ומחו״ל הבאים להנעים בקריות הוא מדהים! הן הופכות בקלות את כל סוגי העיסוי לאמנות יוצאת מן הכלל ומלאת הנאה אינסופית. לא יהיה לכם אפילו זמן לשים לב איך סקס בבת ים
[url=https://peregonavtofgtd.kiev.ua]https://peregonavtofgtd.kiev.ua[/url]
Быстро, сверхэффективно а также надежно перебросить Ваш ярис изо Украины в течение Европу, или изо Европы в течение Украину хором начиная с. ant. до нашей командой. Оформление документов да экспортирование изготовляются на оклеветанные сроки.
https://peregonavtofgtd.kiev.ua
Discover the best and ever!
[url=http://thinktoy.net/bbs/board.php?bo_table=customer2&wr_id=357806]Naked amateur cams[/url][url=https://sample115.tlogsir.com/bbs/board.php?bo_table=tl_product02&wr_id=150]Naked hot webcams w[/url] 15b35f3
Future of the Aviator Game aviator demo game
see this site [url=https://GreatDumps.online]Credit cards[/url]
click for more [url=https://uniccshop.vc]Credit cards[/url]
WOW just what I was searching for. Came here by searching for %keyword%
ooo-gotovie.ru/index.html
http://www.empyrethegame.com/forum/memberlist.php?g=2&sk=m&sd=d&mode=group&start=71675
mailorderbridesfinder.com/
tritattoo.com/tattoo-ideas/unique-matching-tattoos-for-couples/
mybuildhouse.ru/page/13/
Hello!
Study & Exam Tips! Ace your exams with our study tips and techniques. Learn how to manage your time, stay focused, and achieve academic success.
Very good thematic site – https://mail-grups.com
Asian recipes
travel tips for families
branding
breaking news
meal delivery services
smoothie recipes
time management tips
entrepreneurship
Goog luck!
Читайте полезные статьи на актуальные темы, связанные с недвижимостью, например [url=https://3855154.ru/]сделки с недвижимостью[/url] или [url=https://3855154.ru/]налоговая декларация[/url].
visit this site [url=https://benumbccshop.org]carding shop[/url]
look at here now [url=https://rxxxdrugs.com]Bank cards[/url]
הללו אומרות שכשהן פוגשות גברים בדירה שלהן, הגברים יכולים להתקלח אצלה, להשתמש במגבות שלה ולקחת משקאות קרים מהמקרר. רוב הבנות גרות של האפשרויות היכרות שהבנות מציעות לגברים. קראו את הרשימה והתקשרו אליהן על מנת לשאול אם היא מציעה משהו בנוסף. הרגישו חופשי לשאול נערת ליווי במרכז
Lala Koi xxx nude on webcam – Live Sex Chat videos absolutely free and easy to watch on any device, just
[url=https://toteblogs.com/posts/Best-Vitamin-C-Serums-for-Brighter-Skin-]Naked hot webcams girls online sex show[/url][url=http://test.aocoolers.co.kr/bbs/board.php?bo_table=pension&wr_id=27]Naked amateur cams[/url] 20f0_74
Nice post. Do you want to know how to install scrcpy on your device? If so, installing Scrcpy is a very easy process you just have a better wi-fi connection, I know one post where you’ll get a reference to install Scrcpy. Check out a post for further information on installing Scrcpy.
check my site [url=https://BestDumps.uk]benumb[/url]
[url=https://bellingham-judefr.biz]bellingham[/url]
Merit comparison with Wealthiest Online Casinos in the Faction 2023. Leading online casino aggregator.
bellingham
Pin up костюмы: топ-5 идей для креативного образа, которые стоит попробовать
casino pin up [url=https://pinupbrazilnbfdrf.com/]https://pinupbrazilnbfdrf.com/[/url] .
a fantastic read [url=https://Dumps-Pin.cc]benumb[/url]
More about the author [url=https://hydraruzxpinew4af-onion.com]Credit cards[/url]
try here [url=https://uniccstore.cc]carding shop[/url]
Топ-10 идей для pin up татуировок, чтобы стать уникальной
pin up slots [url=https://pinupbrazilnbfdrf.com/]https://pinupbrazilnbfdrf.com/[/url] .
Проведение независимой строительной экспертизы — сложный процесс, требующий глубоких знаний. Наши специалисты обладают всеми необходимыми навыками, а их заключения часто служат основой для принятия верных стратегических решений. Строительно-техническая экспертиза https://stroytehexp.ru позволяет выявить факторы, вызвавшие ухудшение эксплуатационных характеристик объектов, проверить соответствие возведённых зданий градостроительным нормам.
Discover the best thats_lou naked on cam for live sex chat ever for free!
[url=https://community.katawatbusiness.com/question/nude-hot-cams-girls-live-sex-show/]Nude hot cams girls live sex show[/url][url=https://trust-used.com/best-gaming-laptop-models/]Naked hot cams model online sex show[/url] 515b35f
Competitive Tournaments and Events aviator game
lucky jet играть [url=https://1win-luckyjet-game.ru/]1win-luckyjet-game.ru[/url] .
Как внедрить ретро в свой образ, для стильного образа
2 pin up [url=https://pinupbrazilnbfdrf.com/]https://pinupbrazilnbfdrf.com/[/url] .
The story of Mbappe’s https://asma-online.org rise to fame is as remarkable as his on-field feats. Mbappe’s journey from local pitches to global arenas was meteoric. His early days at AS Monaco showcased his prodigious talent, with his blistering speed and fearless dribbling dismantling opposition defenses.
На сайте https://umnye-roboty-pylesosy.ru/ вы сможете приобрести умного робота-пылесоса, который порадует своей качественной работой. К его важным преимуществам относят эффективную, быструю, точную работу. А управление происходит при помощи смартфона. Предусмотрены различные параметры чистки, которые выбирают в соответствии с типом напольного покрытия. При выборе стоит учесть и габариты изделия, чтобы оно легко передвигалось по полу. Также важны и дополнительные функции, которые повысят комфорт.
Pin up стиль: идеи для каждого дня, для модного вида
pin up casino como funciona [url=https://pinupbrazilnbfdrf.com/]pin up casino como funciona[/url] .
anal threesome Venessa_123 nude strip on webcam for live porn chat
[url=http://thinktoy.net/bbs/board.php?bo_table=customer2&wr_id=358044]Naked hot webcams m[/url][url=http://test.aocoolers.co.kr/bbs/board.php?bo_table=pension&wr_id=29]Nude amateur webcam[/url] 56eb762
Competitive Tournaments and Events
aviator game demo
Pin up костюмы: топ-5 идей для креативного образа, которые стоит попробовать
pin up casino bonus [url=https://pinupbrazilnbfdrf.com/]https://pinupbrazilnbfdrf.com/[/url] .
Пользователи, желающие воспользоваться предложением регистрации, должны непременно ввести промокод в период процесса утомительной.
Feel free to visit my website … https://badgerboats.ru/themes/middle/?promokod_1hstavka_na_2020_god.html
Good post! Are you curious to know what is a zip code ? If so, it is a number assigned for a specific area that can help to travel the Postal mail more easily and quickly to the appropriate location. However, you can find it with a zip code finder tool online for free. Visit the linked site and learn more.
https://mediawiki.solutions/User:HattieWillason
Green History – это воплощение профессионализма и творчества в мире ландшафтного дизайна. Мы предлагаем уникальные проекты, которые подчеркивают индивидуальность каждого участка. Наши услуги включают разработку дизайн-проектов, мощение, устройство газонов, создание систем автоматического полива и озеленение. За более чем 15 лет работы мы заслужили репутацию надежных и качественных исполнителей. Узнайте больше на нашем сайте [url=https://greenhistory.ru/]greenhistory.ru[/url] или посетите нас по адресу: г. Москва, Дмитровское шоссе, дом 100, корп 2, офис 418.
Почему Green History? Мы предлагаем не просто услуги, а комплексные решения, которые удовлетворят все ваши потребности в благоустройстве территории. Наша команда профессионалов использует передовые технологии и качественные материалы, чтобы каждый проект был долговечным и красивым. Доверьтесь нам, и ваш сад станет местом, где сбываются мечты. Подробности на [url=https://greenhistory.ru/]greenhistory.ru[/url] или в нашем офисе: г. Москва, Дмитровское шоссе, дом 100, корп 2, офис 418.
Хотите быть в курсе всех значимых тем в мире недвижимости?
На нашем портале вы найдете много полезных статей на такие темы, как [url=https://cmy33.ru/]покупка квартиры в Москве[/url] а также [url=https://cmy33.ru/]налог на землю[/url].
Как внедрить ретро в свой образ, которые придают шарма
pin up como funciona [url=https://pinupbrazilnbfdrf.com/]pin up como funciona[/url] .
https://gen8ai.com/groups/ritual01/members/all-members/
Reena_Darlingg nude strip on cam for live sex chat absolutely free and easy to watch on any device, just
[url=https://sample115.tlogsir.com/bbs/board.php?bo_table=tl_product02&wr_id=156]Nude hot webcams mo[/url][url=http://remote.ecostm.co.kr/bbs/board.php?bo_table=c1&wr_id=11360]Naked amateur webca[/url] 5515b35
Информационный ресурс https://ardma.ru, посвящен бизнесу, финансам, инвестициям и криптовалютам. Сайт предлагает экспертные статьи, аналитические отчеты, стратегии и советы для предпринимателей и инвесторов. Здесь можно найти новости и обзоры о бизнесе, маркетинге, трейдинге, а также практические рекомендации по различным видам заработка и управлению финансами.
Pin up в литературе: книги и персонажи, которые важно изучить
casino online pin up [url=https://pinupbrazilnbfdrf.com/]https://pinupbrazilnbfdrf.com/[/url] .
[url=http://peregonavtofgtd.kiev.ua]http://peregonavtofgtd.kiev.ua[/url]
Я мухой, сверхэффективно а также надежно перевезти Ваш ярис с Украины в течение Европу, чи с Европы на Украину вместе всего нашей командой. Оформление доказательств а также вывоз производятся на оговоренные сроки.
https://peregonavtofgtd.kiev.ua
Since its inception, the Aviator Game has undergone numerous updates and enhancements. Technological
demo game
Opened up an intriguing read ? let me share this with you https://etoprosto.ru/ru/forum/?category=5&action=topic
[url=https://promagnit.ru/]магнит календарь[/url] – заказать магнитики, сувенирная продукция магниты
На нашем портале вы найдете самую нужную информацию о недвижимости на следующие темы: [url=https://glass161.ru/]покупка земельного участка[/url], а также [url=https://glass161.ru/]продажа квартиры от собственника[/url].
Green History – это не просто студия ландшафтного дизайна, это место, где ваши мечты о прекрасном саде становятся реальностью. Мы создаем гармоничные и уникальные ландшафты, используя лучшие материалы и передовые технологии. Узнайте больше на сайте [url=https://greenhistory.ru/]greenhistory.ru[/url] или посетите наш уютный офис по адресу: г. Москва, Дмитровское шоссе, дом 100, корп 2, офис 418.
Доверяя Green History, вы выбираете качество, надежность и профессионализм. Мы предлагаем комплексные решения по благоустройству и озеленению, которые удовлетворят даже самых требовательных клиентов. Посетите наш сайт [url=https://greenhistory.ru/]greenhistory.ru[/url] и узнайте, как мы можем преобразить ваш участок. Ждем вас по адресу: г. Москва, Дмитровское шоссе, дом 100, корп 2, офис 418, чтобы обсудить все детали вашего будущего оазиса.
navigation enhance the overall gaming experience, making it accessible to players of all skill levels.
aviator game demo
[url=https://elonnewz.com/]криптовалюта в россии[/url] – криптовалюта это, Курс биткоина
Секреты стиля в городской среде, для яркого образа в городе
pin up slots [url=https://pinupbrazilnbfdrf.com/]https://pinupbrazilnbfdrf.com/[/url] .
Real Madrid midfielder Rodrigo https://rodrygo.prostoprosport-ar.com gave Madrid the lead in the Champions League quarter-final first leg against Manchester City. The meeting takes place in Madrid. Rodrigo scored in the 14th minute after a pass from Vinicius Junior.
Came across a unique piece – be sure to check it out http://www.ivedu.ru/forum/viewthread.php?forum_id=18&thread_id=47436
melbet download
Do you mind if I quote a couple of your posts as long as I provide credit and sources back to your blog?
My blog site is in the very same niche as yours and my
users would definitely benefit from some of the information you provide here.
Please let me know if this alright with you.
Cheers!
скачать Мята знакомства
Pretty component to content. I just stumbled upon your web site and in accession capital to say that I get in fact loved account your blog posts. Anyway I’ll be subscribing on your augment or even I achievement you get admission to consistently quickly.
Аккумуляторный пылесос Dyson не держит заряд? Наши эксперты с https://servisdyson.ru/ проведут тестирование батареи и при необходимости заменят ее на оригинальную, восстановив время автономной работы.
[url=https://servisdyson.ru/]ремонт техники dyson[/url]
ремонт техники dyson в одинцово
ремонт увлажнителя воздуха dyson
ремонт техники дайсон в одинцово
[url=https://grand-kamin.ru/]встроенные электрокамины купить[/url] – встроенный биокамин купить, продажа электрокаминов в москве
Рекомендуем выбрать гантельные грифы на https://grify-dlya-gantely.ru/по приятным ценамподходящей длины. В создании долговечных снарядов активно используются высококлассные марки металла. Гантельные составляющие предлагаются в трех популярных диаметрах. Отягощения предназначены для тяжелых тренировок и созданы с разметкой и рифлением для уверенного хвата. Изделия покрываются предохранительным слоем никеля. Российская организация реализует достойный ассортимент тренировочного оборудования для дома и зала. Это универсальный инструмент для тяжелых занятий в любых условиях.
южный парк смотреть на русском бесплатно южный парк смотреть онлайн
and the player’s goal is to cash out before the plane crashes. This simple yet thrilling concept has made it a
aviator demo online
https://globals-melbet.ru/
[url=http://peregonavtofgtd.kiev.ua]http://peregonavtofgtd.kiev.ua[/url]
Я мухой, сверхэффективно и еще фундаментально перевезти Ваш ярис из Украины в течение Европу, чи изо Европы в Украину хором с нашей командой. Оформление грамот а также вывоз изготовляются на оговоренные сроки.
https://peregonavtofgtd.kiev.ua
ремонт ноутбуков ближайший ко мне
Наш ресурс предлагает вам полную информацию на такие темы, как [url=https://u-bereg.ru/]аренда земельных участков[/url] или [url=https://u-bereg.ru/]оформление наследства[/url].
Посетите наш сайт и начните свой путь к новому жилью уже сегодня!
aviator game play online [url=www.aviator-games-online.ru]www.aviator-games-online.ru[/url] .
[url=https://flower-market.kiev.ua/vse-buketi/]букет с доставкой Киев[/url] – цветы с доставкой Киев, экспресс доставка цветов Киев
Any work should open with the question “why?” The stroibloger.com answer is actually simple – customer service needs help to help people.
stagramer.com
купить квартиру в казани купить квартиру в казани
https://images.google.cl/url?q=https://taksafonchik.borda.ru/?1-3-0-00015206-000-0-0-1718801625
In-Game Bonuses and Rewards
aviator game online
[url=https://botmag.net]Сделать телеграмм бота для продажи товаров для животных[/url] – конструктор чат бот телеграм магазин, Открыть собственный магазин в телеграмм боте
my link
[url=https://heremyblog.com/31/sikh-community-protests-in-canada-tracing-links-seeking-justice/]Canadian Sikhs Protest Trudeau’s allegations, demand justice for slain advocate[/url]
[b]Привет всем[/b])
Хорошо быть студентом, пока не придет пора писать диплом, что и произошло со мной, но не стоит отчаиваться, ведь есть хорошие компании что помогают с написанием и сдачей диплома на хорошие оценки!
Изначально искал информацию про купить диплом, купить диплом в евпатории, купить диплом россия, купить диплом в нижнем новгороде, купить диплом в ревде, потом попал на http://iot.ttu.edu.tw/members/tomioneal3/ и там решили все мои учебные заботы!
Успехов в учебе!
Доброго!
Персонализированная Стратегия Повышения ПФ для Каждого Клиента: Наш подход к каждому проекту уникален. Мы тщательно изучаем специфику вашего бизнеса и потребности вашей целевой аудитории, чтобы разработать максимально эффективную стратегию улучшения поведенческих факторов. [url=https://nakrutka-pf.ru]накрутка поведенческих в яндексе[/url] Это включает в себя не только технические улучшения сайта, но и работу над созданием уникального пользовательского опыта, который будет соответствовать ожиданиям и предпочтениям вашей аудитории.
Более подробно на сайте – https://nakrutka-pf.ru/portfolio/
накрутка пф через яндекс
накрутка поведенческих
накрутить пф
накрутка пф ботами
накрутка пф портфолио
Будем рады сотрудничеству!
здесь
[url=https://xbomax.ru/25-peacemaker.html]Миротворец 2022 1 сезон 1-8 серия смотреть онлайн в хорошем качестве[/url]
Unique Features of the Aviator Game
aviator game demo
7k casino зеркало сайта
plane crashes, making it a game of both luck and timing. This dynamic gameplay keeps players engaged and coming
demo game
teplica-parnik.net
З 325 закладів iii-iv рівнів вищої освіти акредитації 215 державної форми власності, https://maup.com.ua/ 14-комунальної та 96-приватної.
casino game.
Can I play aviator demo on mobile
With the right approach, the besttoday.org entire process of assembling the gazebo and installing it takes a couple of hours. To prevent the structure from losing its decorative appearance, fastening materials should be stored in inconspicuous places. Or close them with special devices.
купить квартиру в казани купить квартиру недорого
Студия предлагает качественные услуги по технической поддержке веб-ресурса на https://podderzhka-dlya-saita.ru по приятным ценам. Заполним интернет-площадку экспертным содержимым. Окажем услуги по мониторингу и хакерских атак. Работники осуществят лучшие решения по программированию интернет-магазинов. Рекомендуем заказать доступные тарифы с абонентской платой. Тарифные предложения предлагаются по основным факторам: количеству вовлеченных сотрудников, объема и других.
[url=https://peaksview.me/en]Cottage rental in the countryside of Zabljak[/url] – Горные дома в Черногории, Дома для отдыха с семьей в Дурмиторе
Карьерный коуч https://vminske.by/fashion/kto-takie-karernye-konsultanty — эксперт рынка труда, который помогает людям определить свои карьерные цели, развиваться в выбранной области и достигать успеха в профессиональной деятельности.
Студия предлагает эффективные решения по технической поддержке веб-проекта на https://podderzhka-dlya-saita.ru по приятным ценам. Наполним веб-ресурс экспертным контентом. Окажем услуги по резервному копированию и защите от кибератак. Специалисты осуществят лучшие меры по наполнению веб-ресурсов. Рекомендуем приобрести недорогие расценки с месячной платой. Тарифные планы различаются по ключевым параметрам: скорости ответа на запросы, дополнительных опций и других.
How to Start Playing the Aviator Game?
Can I play aviator online for free
hop over to this site [url=https://openai-trade.io/]AI Trading Strategies[/url]
useful content [url=https://openai-trade.io/]AI in finance[/url]
Полезные советы по обслуживанию кондиционеров авто в Москве, плюсы и минусы.
Заправка автокондиционера Москва предлагает множество сервисных центров. [url=https://www.zapravka-avtokonditsioner.ru/]https://www.zapravka-avtokonditsioner.ru/[/url] .
click here to investigate [url=https://openai-trade.io/]Automated trading systems[/url]
Лучший сервис по обслуживанию автокондиционеров в Москве, опытные мастера.
Repairing car air conditioner pipes in Moscow is available at various service centers. [url=http://www.remont-avtokonditsioner.ru/]http://www.remont-avtokonditsioner.ru/[/url] .
I am regular reader, how are you everybody? This paragraph posted at this web page is genuinely good.
Opened up an intriguing read Ц let me share this with you http://dimitrii.flybb.ru/viewtopic.php?f=29&t=883
need a loans for 2500 with bad credit These loans are meant for people who are unable to provide the additional collateral demanded by banks.
Good day!
Foodie Travels! Taste your way around the world. Discover the best food destinations, local dishes, and culinary tours to satisfy your inner foodie.
Very good thematic site – https://gsroups.com
news broadcast
luxury travel
leadership
cultural news
food industry
travel tips for couples
blogging tips
news analysis
Goog luck!
Если вы предпочитаете [url=https://turkline.tv/boeviki/]турецкие сериалы боевики[/url], загляните на turkline.tv. Сайт предлагает лучшие боевики в HD 1080 качестве и с русской озвучкой. Захватывающие сюжеты и динамичные сцены в сериалах, таких как “Марашлы” и “Воин”, держат в напряжении с первой до последней серии. Все это доступно без рекламы и абсолютно бесплатно. Турклайн.тв – ваш лучший выбор для просмотра турецких боевиков онлайн.
olymp casino вход
buy cvv fullz Good validity rate Buying Make good job for MMO Pay all site activate your
card now for international transactions.
————-CONTACT———————–
WEBSITE : >>>>>> CvvBest☸CC
—- HERE COMES THE PRICE LIST ———–
***** CCV US:
– US MASTER CARD = $2,8 per 1 (buy >5 with price $3 per 1).
– US VISA CARD = $2,3 per 1 (buy >5 with price
$2.5 per 1).
– US AMEX CARD = $4,3 per 1 (buy >5 with price $2.5 per 1).
– US DISCOVER CARD = $3,5 per 1 (buy >5 with price $3.5 per
1).
– US CARD WITH DOB = $15 per 1 (buy >5 with price $12 per 1).
– US FULLZ INFO = $40 per 1 (buy >10 with price $30 per 1).
***** CCV UK:
– UK CARD NORMAL = $3,1 per 1 (buy >5 with price $3 per
1).
– UK MASTER CARD = $2,9 per 1 (buy >5 with price $2.5 per 1).
– UK VISA CARD = $3,5 per 1 (buy >5 with price $2.5 per 1).
– UK AMEX CARD = $2,1 per 1 (buy >5 with price $4 per 1).
$4,5
– UK CARD WITH DOB = $15 per 1 (buy >5 with price $14 per 1).
– UK WITH BIN = $10 per 1 (buy >5 with price $9 per 1).
– UK WITH BIN WITH DOB = $25 per 1 (buy >20 with price $22 per 1).
– UK FULLZ INFO = $40 per 1 (buy >10 with price $35 per 1).
***** CCV AU:
– AU MASTER CARD = $5.5 per 1 (buy >5 with price $5 per 1).
– AU VISA CARD = $5.5 per 1 (buy >5 with price $5 per 1).
– AU AMEX CARD = $8.5 per 1 (buy >5 with price $8 per 1).
– AU DISCOVER CARD = $8.5 per 1 (buy >5 with price $8 per 1).
***** CCV CA:
– CA MASTER CARD = $6 per 1 (buy >5 with price $5 per
1).
– CA VISA CARD = $6 per 1 (buy >5 with price $5 per 1).
– CA VISA BUSINESS = $14 per 1 (buy >5 with price $13 per 1).
[url=https://peaksview.me/ru]Аренда дома в горах Черногории[/url] – Дома для отдыха с семьей в Черногории, Cottages in Montenegro
Reputable online platforms offering the Aviator Game are licensed and regulated by governing bodies. This
aviator demo
[url=https://peaksview.me/en]Cottage rental in Montenegro[/url] – Дом с панорамным видом в Жабляке, Vacation home in Montenegro per day
seo продвижение цена раскрутка сайта seo
You need to have to match all four numbers if you want to win a prize in this game.
Look into my blog: https://digimac-technologies.mn.co/posts/57716638
сео оптимизация https://seo-prodvizhenye-kazan.ru
Hi there to all, how is the whole thing, I think every one is getting more from this web site, and
your views are nice in support of new visitors.
Discovered an article that will surely interest you – I recommend checking it out http://ya.creartuforo.com/viewtopic.php?id=11444#p23091
Доброго!
Внимание, жители Кропивницкого! На нашем сайте вы найдете самые свежие и актуальные новости города. Узнайте о последних событиях, важных решениях и общественных инициативах. Мы всегда на страже информации для вас!
Все самое лучшее на сайте https://0522.kr.ua/category/news-ukraine/
[url=https://0522.kr.ua/category/news-ukraine/]Новости Украины ТОП[/url]
Новости Кропивницкого сегодня
Новости Кропивницкого
Новости Кропивницкого за день
Удачи!
Do you have any video of that? I’d care to find out more details.
mutinyhockey.com/memberlist.php?mode=joined&order=ASC&start=336850%C3%82%C2%A0
winemastery.com.vn/giong-nho/garnacha-tintorera
web011.dmonster.kr/bbs/board.php?bo_table=b0501&wr_id=181555
financeokey.ru/page/9
myworldoftank.ru/article/kak-vklyuchit-otobrazhenie-shansov-na-pobedu-xvm-v-world-of-tanks.html
History and Development
How to play aviator online casino
купить диплом в братске [url=https://diplomvash.ru/]diplomvash.ru[/url] .
Привет!
Политический кризис в Израиле: анализ текущей ситуации
Политическая ситуация в Израиле всегда вызывает большой интерес у международного сообщества. В этом разделе мы предоставляем глубокий анализ текущего политического кризиса в стране. Читайте о последних событиях в Кнессете, выборах, коалиционных переговорах и основных политических игроках. Узнайте, какие решения принимаются и как они могут повлиять на будущее страны и ее отношения с другими государствами.
Все самое лучшее на сайте https://isra.news/category/fashion/
[url=https://isra.news/category/fashion/]Новости шоу-бизнеса[/url]
нвоости спорта
главные новости за день
новости экономики
Удачи!
สวัสดีทุกคน! เพิ่งได้ลองเล่นเว็บบาคาร่าที่ดีที่สุดที่ บาคาร่าทดลอง แล้วจำเป็นต้องพูดว่าติดอกติดใจมากมายค่ะ อินเตอร์เฟซใช้งานง่าย เล่นได้ลื่นไหลไม่มีสะดุด รวมทั้งที่สำคัญมีโปรโมชั่นดีๆให้เลือกมากมายก่ายกอง ทั้งยังสมาชิกใหม่แล้วก็เก่า คนไหนที่กำลังมองหาบาคาร่า88เล่น ชี้แนะตรงนี้เลยจ้ะ ไม่ผิดหวังแน่นอน!
A completely free schedule allows you to plitki.com consider working as a courier as a full-time job or part-time job.
купить сертификат специалиста [url=https://diplomvash.ru/]diplomvash.ru[/url] .
Hello Dear, are you truly visiting this website daily, if so after that you will without doubt obtain good knowledge.
backshowtime.ru/page/45
express-container.ru/about/founding/
elibot.gg/commands
http://www.4-mobile.ru/index.php?links_exchange=yes&page=13&show_all=yes
weekofsport.ru/page/10
you can look here [url=https://sanclboxgame.cc/]The Sandbox[/url]
The Popularity of Online Casino Games
How to play aviator for money
[url=https://bs2tsait1.cc]Blacksprut зеркало[/url] – Blacksprut ссылка, Блэкспрут
By carrying out timely pronovosti.org cleaning of your home, a person extends the life of furniture, flooring and other materials. The cleaning company’s employees treat all types of surfaces with care, using only professional products in their work.
see it here [url=https://sanclboxgame.xyz/]Sandbox AVATAR[/url]
Искал новинки турецких сериалов и наткнулся на [url=https://turkline.tv/serials2023/]смотреть турецкие сериалы 2023 онлайн[/url] на turkline.tv. Меня приятно удивило, что все сериалы доступны в HD качестве и совершенно бесплатно. Навигация по сайту очень удобная, а отсутствие рекламы делает просмотр комфортным. Порадовал большой выбор жанров – от драм до комедий. Очень рад, что нашел этот сайт и рекомендую его всем любителям турецких сериалов. Турклайн.тв – лучший выбор для просмотра новых сериалов 2023 года.
Licensing and Regulation
Can you play aviator on PC
Любому человеку рано или поздно приходится пользоваться услугами стоматологических клиник. Ни для кого не секрет, что лечение зубов и последующее протезирование – процедуры довольно дорогостоящие, не все граждане могут позволить себе их оплатить, если вам необходимо прайс стоматология мы Вам обязательно поможем.
Особенности
Благодаря услугам, которые предлагает населению стоматология Маэстро, люди разного финансового достатка имеют возможность не только поддерживать здоровье полости рта, но и проходить все необходимые процедуры. Цены на лечение зубов и протезирование значительно ниже, чем в других медучреждениях. Несмотря на то, что клиника работает для широких слоев населения, пациенты получают полный перечень услуг, используя современное оборудование и качественные материалы. Жителям доступны следующие процедуры:
• профилактика полости рта;
• лечение зубов с использованием различных методов;
• полная диагностика;
• профессиональная чистка;
• отбеливание;
• протезирование.
Сотрудники учреждения соблюдают все санитарные нормы, а для тщательной дезинфекции и стерилизации инструментов предусмотрено современное оборудование.
Преимущества
Востребованность бюджетной стоматологии объясняется рядом преимуществ. Во-первых, в клинике трудятся опытные высококвалифицированные сотрудники. Во-вторых, к каждому пациенту врач находит подход. В-третьих, кабинеты оснащены всем необходимым оборудованием, в работе используют только качественные безопасные материалы. В-четвертых, все виды протезирования будут проведены в сжатые сроки. Многие клиники получают субсидии от государства, что позволяет существенно сократить расходы. Кроме того, некоторые стоматологии сотрудничают со страховыми компаниями, поэтому у пациентов появляется возможность получить услуги по полюсу ОМС. Пациенты получают консультацию по профилактике заболеваний полости рта. Врачи после тщательного осмотра составляют индивидуальный план лечения, с помощью которого удается добиться наилучшего результата. Более доступные цены достигаются не только благодаря государственному финансированию, но и оптимизации расходов.
Благодаря стоматологии Маэстро, человек с небольшим достатком может не только вылечить зубы, но и поддерживать здоровье ротовой полости. Теперь любой человек может не откладывать поход к стоматологу, выбирая доступное качественное обслуживание.
High-quality timber stroihome.net is resistant to aggressive environmental influences. Does not fade and tolerates low temperatures. Long service life.
personal loans for bad credit maryland There are obvious concerns with this method but the reputable companies will have a gold calculator on their websites so you will know in advance the figure you are likely to receive and, more importantly, the best gold buying companies will offer a price guarantee.
южного парка смотреть бесплатно южный парк смотреть онлайн
The future of the Aviator Game looks promising, with continuous updates and improvements. As technology
Is aviator demo APK available
visit this page https://blur-io-nft.com/2023/11/09/exploring-the-future-of-receipt-technology-and-its-potential-to-eliminate-blurriness/
[url=https://bs2tsait1.cc]Bs2site[/url] – Blacksprut онион, Bs2best
Reputable online platforms offering the Aviator Game are licensed and regulated by governing bodies. This
aviator demo
Terrific data. Thanks a lot.
Visit my blog post :: https://late06.uzblog.net/loans-for-the-unemployed-top-choices-42022950
First of all, it should be 365newss.net clearly understood that these are completely different concepts in geography. For example, when considering absolute height, it is precisely this that acts as the most important indicator, which is measured in meters, thereby determining the height of geographical objects above sea level.
Документы, которые должны быть доступны при проверке сметы.
Проверка сметы на соответствие проектной документации необходима для утверждения финансирования. [url=proverka-smet-msk.ru]proverka-smet-msk.ru[/url] .
Social and Community Aspects
aviator demo
canadatc.com
Full Article https://blur-nft-market.com/2023/11/10/maximize-the-potential-of-the-blur-api-expert-advice-and-best-practices-for-developers/
На сайте https://jidkie-oboi-77.ru/ в огромном выборе находятся жидкие обои. К их важным преимуществам относят простоту нанесения, а потому решить задачу под силу даже дилетанту, который ни разу с этим не сталкивался. Важным моментом является то, что обои маскируют дефекты, неровности стен. Выбирая материал, необходимо учитывать следующие моменты: определитесь с цветовой гаммой, а также целями приобретения. Важно, чтобы цветовая гамма идеально вписалась в интерьер. Есть как шелковые, так и хлопковые.
balforum.net
Невероятные эмоции в онлайн казино, получайте щедрые призы в популярных онлайн казино, играйте с удовольствием.
Надежность и азарт в онлайн казино, вероятность выиграть увеличивается.
Эксклюзивные онлайн казино для настоящих азартных игроков, заходите и побеждайте.
Онлайн казино: азарт и выигрыш, выигрывайте и наслаждайтесь.
Онлайн казино: легкий способ заработка, учитесь и выигрывайте.
лучшие онлайн казино беларуси [url=https://xn——6cdbbg0agrfgefqjdk0adfll7cza3aw3g3a.xn--90ais/]лучшие онлайн казино беларуси[/url] .
I appreciate, cause I discovered just what I was having a look for. You’ve ended my 4 day lengthy hunt! God Bless you man. Have a nice day. Bye
keepnitreal.net/blogs/53813/%D0%A1%D0%B5%D0%BA%D1%80%D0%B5%D1%82-%D1%83%D1%81%D0%BF%D0%B5%D1%85%D0%B0-%D0%9A%D0%B0%D0%BA-%D0%BA%D1%83%D0%BF%D0%B8%D1%82%D1%8C-%D0%B4%D0%B8%D0%BF%D0%BB%D0%BE%D0%BC-%D0%B8-%D0%B8%D0%B7%D0%BC%D0%B5%D0%BD%D0%B8%D1%82%D1%8C-%D1%81%D0%B2%D0%BE%D1%8E-%D0%B6%D0%B8%D0%B7%D0%BD%D1%8C
http://www.knx-fr.com/member.php?action=profile&uid=9935
sharypovo.today/news/society/page/9/
jingji.8193.tw/product/product.php?id=162&page=
forum.trackbase.net/members/21965-sonnick84?vmid=2440
Busty-Ellie naked strip on webcam for live sex chat
[url=https://trust-used.com/best-gaming-laptop-models/]Nude amateur webcams girls live porn show[/url][url=https://community.katawatbusiness.com/question/nude-amateur-webcams-model-online-porn-char/]Nude amateur webcams model online porn char[/url] eb76201
I delight in, result in I found exactly what I was looking for. You have ended my four day lengthy hunt! God Bless you man. Have a great day. Bye
childtemperament.org/index.php?lang=es
angelteam.uv.ro/profile.php?mode=viewprofile&u=207852
giaibngdaquocteu23.com/2021-10-cb-hay-trong-trong-fifa-online-4-hien-nay-keo8386/
100dives.com/collections/eclipse-series/products/phanteks-eclipse-p600s-matte-white.html
drosetourmanila.com/vn/retail_promo.html
useful source https://trezorwallet-app.org/2023/11/14/the-implications-of-freezing-and-regulation-what-lies-ahead-for-usdt-in-the-future/
navigate to this site https://blur-nft-marketplace.org/2022/08/15/coinbase-expands-nft-operations-by-embracing-ethereums-platform/
demo versions or free play options to allow players to practice before betting real money.
aviator demo
Discover the best Meltem-Kerem nude live chat in sexy room ever for free!
[url=https://community.katawatbusiness.com/question/naked-hot-webcams-woman-online-porn-show/]Naked hot webcams woman online porn show[/url][url=http://remote.ecostm.co.kr/bbs/board.php?bo_table=c1&wr_id=11609]Naked amateur webca[/url] 5515b35
homeprorab.info
http://images.google.ba/url?q=https://companion.borda.ru/?1-14-0-00000480-000-0-0-1718802900
to your liking, and quickly move to the section with DollyBuoy naked in live sex video chat on this topic. All categories are packed enough to make
[url=http://remote.ecostm.co.kr/bbs/board.php?bo_table=c1&wr_id=11619]Naked amateur cams[/url][url=http://thinktoy.net/bbs/board.php?bo_table=customer2&wr_id=362197]Naked hot cams gir[/url] f2_624c
The below table capabilities thee welcome bonuses for each and every
of tthe most effective baccarat casinos.
Feel free to visit my website Joe2006.com
improvements have not only made the game more appealing but also more accessible to a wider audience.
aviator demo
Если хотите [url=https://turkline.tv/serials2023/]смотреть турецкие сериалы 2023 онлайн на русском языке[/url], зайдите на turkline.tv. Здесь вы найдете новейшие турецкие сериалы в HD 1080 качестве и с отличной русской озвучкой. Сайт предлагает удобный интерфейс, отсутствие рекламы и бесплатный доступ к сериалам. Турклайн.тв – лучший ресурс для тех, кто ценит качественные турецкие сериалы на русском языке.
Find out DollyBuoy nude webcam for live sex chat for free 🙂
[url=http://remote.ecostm.co.kr/bbs/board.php?bo_table=c1&wr_id=11630]Naked hot cams wom[/url][url=https://toteblogs.com/posts/Best-Vitamin-C-Serums-for-Brighter-Skin-]Nude hot webcams woman online porn char[/url] 7620121
[url=https://bs2tsait1.cc]Bs2best[/url] – Блэкспрут, Blacksprut онион
Discovered an article that will definitely interest you – don’t miss the chance to familiarize yourself http://superforum.spybb.ru/viewtopic.php?id=2620#p50505
Топ строительных аудиторов в Москве, которые имеют хорошую репутацию.
Аудит строительных работ помогает выявить дефекты и несоответствия в выполненных работах. [url=https://audit-stroitelnykh-rabot.ru/]https://audit-stroitelnykh-rabot.ru/[/url] .
Привет!
Следите за новостями Кропивницкого вместе с нами! Мы предлагаем оперативные репортажи, глубокий анализ и эксклюзивные интервью. Узнайте о последних событиях в городе и будьте первыми, кто узнает о важных новостях и изменениях.
Все самое лучшее на сайте https://bomba.kr.ua/news-ukraine/
[url=https://bomba.kr.ua/]Новости Кропивницкого[/url]
последние новости Кропивницкого
новости Украины за день
Новости Украины лента
Удачи!
купить диплом судоводителя [url=https://vm-tver.ru/]vm-tver.ru[/url] .
Доброго!
Будьте в курсе последних новостей Украины и мира! Читайте о политике, экономике, культуре и спорте – самые интересные и важные события в одном месте.
Все самое лучшее на сайте https://smi.in.ua/sport/
[url=https://smi.in.ua/proisshestviya/]Новости мира главные[/url]
новости шоу бизнеса
последние новости мира
новости технологий
Удачи!
madeintexas.net
Играйте в лучших онлайн казино и выигрывайте крупные суммы, испытать.
Наши рекомендации: самые популярные онлайн казино, испытайте прямо сейчас.
Популярные азартные игры в онлайн казино, посетите прямо сейчас.
Играйте в лучшие онлайн казино и получайте щедрые бонусы и выигрыши, попробуйте прямо сейчас.
Новые возможности для азартных игроков в онлайн казино, попробуйте прямо сейчас.
Играть и выигрывать: лучшие онлайн казино для вас, присоединяйтесь сейчас.
Популярные игры с выигрышами в онлайн казино, испытайте прямо сейчас.
Наши рекомендации: лучшие онлайн казино, испытайте сейчас.
Играйте в азартные игры и выигрывайте захватывающие призы в онлайн казино, попробуйте прямо сейчас.
Бонусы и выигрыши: самые популярные онлайн казино для вас, испытайте прямо сейчас.
Новые возможности и азартные игры в онлайн казино, попробуйте прямо сейчас.
Играйте и выигрывайте крупные суммы в самых популярных онлайн казино, испытайте сейчас.
Лучшие игры и призы в онлайн казино, испытайте прямо сейчас.
Наши рекомендации: самые популярные онлайн казино, присоединяйтесь сейчас.
Популярные игры и призы в онлайн казино, посетите прямо сейчас.
Лучшие бонусы и выигрыши в онлайн казино, присоединяйтесь прямо сейчас.
Новые возможности и азартные игры в онлайн казино,
лучшие онлайн казино беларуси [url=https://onlayn-kazino-reyting-belarusi.com/]https://onlayn-kazino-reyting-belarusi.com/[/url] .
Discover the best Blog ever for free!
[url=https://sample115.tlogsir.com/bbs/board.php?bo_table=tl_product02&wr_id=205]Naked amateur cams[/url][url=https://trust-used.com/best-gaming-laptop-models/]Nude amateur webcams model live sex char[/url] bba3656
Online Platforms Offering the Game
aviator demo
[url=https://bs2tsait1.cc]Bs.gl[/url] – Блэкспрут ссылка, Blacksprut зеркало
wikipedia reference https://debank.lu/2023/11/11/debank-pioneering-the-transformation-of-communication-and-investing-in-the-web3-era/
Just check this out, Blog
[url=https://sample115.tlogsir.com/bbs/board.php?bo_table=tl_product02&wr_id=206]Nude amateur webcam[/url][url=http://remote.ecostm.co.kr/bbs/board.php?bo_table=c1&wr_id=11649]Naked hot cams gir[/url] f320f6_
Found an enthralling read that I’d recommend – it’s truly fascinating http://onlinekinofun.ru/poluchite-diplom-v-lyuboe-vremya
To use, you simply need to instukzia.com drive the forklift up to the load and then lift it with a fork. Next, the goods are raised to a safe height and transported to the prospect of long-term storage. To make the use of equipment simple and fast, it is very important to store everything on special pallets, which are specifically designed to make it easier to lift the stored goods.
investigate this site https://debank.at/2023/11/11/exploring-the-debank-app-a-comprehensive-guide-for-beginners-to-understand-the-realm-of-decentralized-finance/
Awesome posts, Many thanks!
My blog post http://Www.Baitinghollowcommons.com/__media__/js/netsoltrademark.php?d=www.Consulting.Sbm.pw%2FNews%2Fpolitical-campaign%2F
Excellent and high-quality RangerRuu nude on adult cam in her Live Porn Chat absolutely free and easy to watch on any device, just
[url=https://trust-used.com/best-gaming-laptop-models/]Naked hot webcams girls online sex show[/url][url=https://community.katawatbusiness.com/question/nude-hot-webcams-woman-online-porn-show/]Nude hot webcams woman online porn show[/url] 0a7a551
Competitive Tournaments and Events
aviator demo
вскрытие замков межкомнатных дверей [url=http://vskrytie-zamkov-moskva113.ru/]http://vskrytie-zamkov-moskva113.ru/[/url] .
Just check out the best AmazeJuxtaposition nude before webcamcam – live sex chat ever!
[url=http://www.kiccoltd.co.kr/bbs/board.php?bo_table=free&wr_id=759012]Naked amateur webca[/url][url=http://thinktoy.net/bbs/board.php?bo_table=customer2&wr_id=362501]Nude amateur cams[/url] a5515b3
buy cc for carding Good validity rate Purchasing Make good job
for MMO Pay on website activate your card now for worldwide transactions.
————-CONTACT———————–
WEBSITE : >>>>>> Unicvv✶Top
—– HERE COMES THE PRICE LIST ———–
***** CCV US:
– US MASTER CARD = $2,6 per 1 (buy >5 with price $3 per 1).
– US VISA CARD = $2,7 per 1 (buy >5 with price $2.5 per 1).
– US AMEX CARD = $3,8 per 1 (buy >5 with price $2.5 per
1).
– US DISCOVER CARD = $2,3 per 1 (buy >5 with price $3.5 per 1).
– US CARD WITH DOB = $15 per 1 (buy >5 with price $12 per 1).
– US FULLZ INFO = $40 per 1 (buy >10 with price $30 per 1).
***** CCV UK:
– UK CARD NORMAL = $2,8 per 1 (buy >5 with price $3 per 1).
– UK MASTER CARD = $2,9 per 1 (buy >5 with price
$2.5 per 1).
– UK VISA CARD = $2,6 per 1 (buy >5 with price $2.5
per 1).
– UK AMEX CARD = $3,5 per 1 (buy >5 with price $4 per 1).
$
– UK CARD WITH DOB = $15 per 1 (buy >5 with price $14 per 1).
– UK WITH BIN = $10 per 1 (buy >5 with price $9
per 1).
– UK WITH BIN WITH DOB = $25 per 1 (buy >20 with price $22 per 1).
– UK FULLZ INFO = $40 per 1 (buy >10 with price $35
per 1).
***** CCV AU:
– AU MASTER CARD = $5.5 per 1 (buy >5 with price
$5 per 1).
– AU VISA CARD = $5.5 per 1 (buy >5 with price $5 per 1).
– AU AMEX CARD = $8.5 per 1 (buy >5 with price $8 per 1).
– AU DISCOVER CARD = $8.5 per 1 (buy >5 with price $8 per 1).
***** CCV CA:
– CA MASTER CARD = $6 per 1 (buy >5 with price $5 per 1).
– CA VISA CARD = $6 per 1 (buy >5 with price $5 per 1).
– CA VISA BUSINESS = $14 per 1 (buy >5 with price $13
per 1).
A person essentially lend a hand to make critically articles I would state.
This is the first time I frequented your web page and up to now?
I surprised with the research you made to create this particular submit incredible.
Fantastic activity!
look here https://tronlink-app.org/2023/11/13/discover-trondao-a-gastronomy-haven-for-food-lovers/
Alana-haze, рџ’— nude is waiting to chat with you live for FREE absolutely free and easy to watch on any device, just
[url=http://remote.ecostm.co.kr/bbs/board.php?bo_table=c1&wr_id=11668]Naked amateur webca[/url][url=https://community.katawatbusiness.com/question/nude-amateur-webcams-model-online-sex-show/]Nude amateur webcams model online sex show[/url] 56eb762
Experienced players can benefit from more advanced strategies, such as:
aviator demo
Regards, Ample stuff.
Post writing is also a fun, if you be familiar with after that you can write if not it is complicated to write.
to your liking, and quickly move to the section with free live sex chat room on this topic. All categories are packed enough to make
[url=https://naeunhome.cafe24.com/bbs/board.php?bo_table=review&wr_id=318]Nude hot webcams gi[/url][url=http://thinktoy.net/bbs/board.php?bo_table=customer2&wr_id=362657]Naked hot cams mod[/url] ba3656e
the thirteenth hour. movie movies filming in santa femovies in brooksville flbest alan rickman movies
to your liking, and quickly move to the section with KT_popo nude stripg before cam for live sex video chat on this topic. All categories are packed enough to make
[url=https://sample115.tlogsir.com/bbs/board.php?bo_table=tl_product02&wr_id=218]Naked amateur webca[/url][url=http://www.kiccoltd.co.kr/bbs/board.php?bo_table=free&wr_id=759369]Naked amateur webca[/url] f320f5_
Ignoring Patterns: Failing to observe and learn from the game’s patterns can reduce your chances of winning.
aviator demo
https://iqratrust.org/
Hi mates, pleasant article and fastidious urging commented at this place, I am truly enjoying by these.
kopd.ocdut.kr.ua/conference/topic/mentorska-diialnist-v-dytiachomu-samovriaduvanni/?part=4926
ukrlenta.ru/page/3
maisoncarlos.com/UserProfile/tabid/42/UserID/1942955/Default.aspx
sjtudivingcenter.com/message/index.php?class1=52&page=10&lang=en
5-5.ru/index.php?links_exchange=yes&page=501&show_all=yes
Heidy Wills nude on sex cam in XXX Live Sex Chat Room videos absolutely free and easy to watch on any device, just
[url=https://naeunhome.cafe24.com/bbs/board.php?bo_table=review&wr_id=319]Nude amateur cams[/url][url=http://thinktoy.net/bbs/board.php?bo_table=customer2&wr_id=362892]Naked hot webcams m[/url] 3656eb7
Run by a warm and welcoming lady Hemangi Gaikwad, Impulse has some of the ideal body massages that we’ve come across for ladies.
My page https://hoshino-vet.jp/archives/16
https://irhsca.org/
Resources https://galxe-app.org/2023/11/19/unleash-your-creativity-with-galxe-lineas-innovative-features/
Прохождение курсов по охране труда safetysystemsgroup.com
Помимо [url=https://safetysystemsgroup.com/pomosch-v-akkreditatsii-lab/]услуги аккредитация испытательных лабораторий[/url] у нас Вы найдете курсы по обучению в режиме онлайн по охране труда, пожарно-технический минимум, электробезопасность 2-я группа и другие. Свяжитесь с нами по вышеупомянутому номеру телефона, адресу или закажите возвратный звонок. Будем рады сотрудничеству.
Register an account, make a deposit, and navigate to the Aviator Game to start playing.
aviator demo
https://iqratrust.org/
https://muslim-forum.org/
This is a topic that is close to my heart…
Thank you! Where are your contact details though?
https://irhsca.org/
MaviMasr naked strip on XXX webcam for live sex video chat videos absolutely free and easy to watch on any device, just
[url=https://community.katawatbusiness.com/question/nude-hot-webcams-girls-online-sex-char/]Nude hot webcams girls online sex char[/url][url=http://test.aocoolers.co.kr/bbs/board.php?bo_table=pension&wr_id=47]Nude amateur webcam[/url] 656eb76
buy paypal dumps newfresh good balance LIVE 24/24 – 2024 (No DIE) 【Visit CvvDumps.US】 All COUNTRY US , UK , CA , AU , EU , TZ , EG
————-CONTACT———————–
WEBSITE : >>>>>> CvvDumps☸ US
—– HERE COMES THE PRICE LIST ———–
***** CVV Other countries
TK VISA CARD = $3,3 per 1 (buy >5 with price $2.5 per 1).
KM VISA CARD = $4,4 per 1 (buy >5 with price $2.5 per 1).
AE VISA CARD = $4 per 1 (buy >5 with price $2.5 per 1).
BA VISA CARD = $4,9 per 1 (buy >5 with price $2.5 per 1).
***** CVV US:
– US MASTER CARD = $2,1 per 1 (buy >5 with price $3 per 1).
– US VISA CARD = $2,6 per 1 (buy >5 with price $2.5 per 1).
– US AMEX CARD = $4 per 1 (buy >5 with price $2.5 per 1).
– US DISCOVER CARD = $3,7 per 1 (buy >5 with price $3.5 per 1).
– US CARD WITH DOB = $15 per 1 (buy >5 with price $12 per 1).
– US FULLZ INFO = $40 per 1 (buy >10 with price $30 per 1).
***** CCV UK:
– UK CARD NORMAL = $2,8 per 1 (buy >5 with price $3 per 1).
– UK MASTER CARD = $3 per 1 (buy >5 with price $2.5 per 1).
– UK VISA CARD = $3,2 per 1 (buy >5 with price $2.5 per 1).
– UK AMEX CARD = $3,7 per 1 (buy >5 with price $4 per 1).
$3,5
– UK CARD WITH DOB = $15 per 1 (buy >5 with price $14 per 1).
– UK WITH BIN = $10 per 1 (buy >5 with price $9 per 1).
– UK WITH BIN WITH DOB = $25 per 1 (buy >20 with price $22 per 1).
– UK FULLZ INFO = $40 per 1 (buy >10 with price $35 per 1).
***** CCV AU:
– AU MASTER CARD = $5.5 per 1 (buy >5 with price $5 per 1).
– AU VISA CARD = $5.5 per 1 (buy >5 with price $5 per 1).
– AU AMEX CARD = $8.5 per 1 (buy >5 with price $8 per 1).
– AU DISCOVER CARD = $8.5 per 1 (buy >5 with price $8 per 1).
***** CCV CA:
– CA MASTER CARD = $6 per 1 (buy >5 with price $5 per 1).
– CA VISA CARD = $6 per 1 (buy >5 with price $5 per 1).
– CA VISA BUSINESS = $14 per 1 (buy >5 with price $13 per 1).
https://muslim-forum.org/
The Aviator Game offers multiplayer options that allow players to compete against each other in real-time. This
aviator demo
uquest.net
Excellent and high-quality Blog absolutely free and easy to watch on any device, just
[url=https://trust-used.com/best-gaming-laptop-models/]Nude hot cams model online sex show[/url][url=https://community.katawatbusiness.com/question/nude-hot-webcams-woman-live-porn-show/]Nude hot webcams woman live porn show[/url] 656eb76
Swampy and creeping soil. In such areas, slush constantly forms after even a light rain. In repaircanada.net this case, you will have to raise the soil level using sprinkling. It could be rubble.
continue reading this https://metamask-wallet.at/2023/11/16/managing-multiple-accounts-with-metamask-guide-for-crypto-enthusiasts/
Подарок для конкурента
https://xrumer.ru/
Такой пакет берут для переспама анкор листа сайта или мощно усилить НЧ запросы
[url=https://xrumer.ru/]Подарок для конкурента[/url]
Excellent and high-quality Helen-Rosse1 nude on Live Cam Sex Chat absolutely free and easy to watch on any device, just
[url=https://community.katawatbusiness.com/question/nude-amateur-cams-girls-live-porn-char/]Nude amateur cams girls live porn char[/url][url=https://sample115.tlogsir.com/bbs/board.php?bo_table=tl_product02&wr_id=234]Naked amateur cams[/url] b35f320
продвижение сайтов в москве и московской области [url=www.prodvizhenie-sajtov-v-moskve117.ru/]продвижение сайтов в москве и московской области[/url] .
To play the Aviator Game, you need a device with internet access and a web browser that supports HTML5. This
aviator demo
important link https://1inch-dex.com/2023/11/01/a-comparison-of-1inch-dex-aggregator-with-other-popular-dex-platforms/
https://mozillabd.science/wiki/User:Waylon1200
view it https://orbiter-finance.at/2023/11/19/exploring-the-token-landscape-on-orbiter-finance-whats-available/
[url=https://bs2tsait1.cc]Bs2site2[/url] – Блэкспрут, Блэкспрут зеркало
Just check this out, Lilit Robins Nude Sex Cams, Live Sex, Free Porn Chat
[url=https://community.katawatbusiness.com/question/nude-amateur-cams-model-live-porn-char/]Nude amateur cams model live porn char[/url][url=http://thinktoy.net/bbs/board.php?bo_table=customer2&wr_id=363721]Naked hot cams mod[/url] b762012
http://wikivicente.x10host.com/index.php/Usuario:RowenaDetwiler
Как сделать правильный выбор между самостоятельным и профессиональным ремонтом кожаной мебели.
Ремонт кожаного дивана жидкой кожей на дому — удобно и качественно. [url=http://www.remont-kozhanoj-mebeli.ru]http://www.remont-kozhanoj-mebeli.ru[/url] .
webpage https://galxe-web3.com/2023/11/19/empowering-communities-through-reward-based-campaigns-with-galxe/
Truly lots of very good advice.
to your liking, and quickly move to the section with Blog on this topic. All categories are packed enough to make
[url=https://sample115.tlogsir.com/bbs/board.php?bo_table=tl_product02&wr_id=242]Nude amateur cams[/url][url=https://trust-used.com/best-gaming-laptop-models/]Naked hot cams girls live porn char[/url] 320f1_7
сервера л2 с дополнениями
Сервера ла2
Прохождение курсов по охране труда safetysystemsgroup.com
Чтобы найти [url=https://safetysystemsgroup.com/ocenka-riskov/]оценка профессиональных рисков стоимость услуг[/url] приходите в нашу компанию. Звоните по номеру телефона +7(499)348-25-03 или закажите обратный звонок. Наш профессиональный работник приедет к Вам и осуществит инструментальные измерения, сроком от пяти рабочих дней. Наши главные услуги: оценка профессиональных рисков, инженерно экологические изыскания, программа производственного контроля и другие.
the social features, and the quality of the user interface.
aviator demo
A former San Diego police detective who operated massage parlors that presented industrial sex solutions was sentenced Friday to practically three years in federal prison.
Check out my web site: https://365.expresso.blog/question/unwind-and-unknot-the-ultimate-full-body-massage-escape-4/
Искал, где можно [url=https://turkline.tv/]смотреть турецкие сериалы на русском[/url] и нашел отличный ресурс – turkline.tv. Здесь все сериалы в HD качестве и без рекламы, что делает просмотр комфортным. На сайте представлен большой выбор жанров, и каждый найдет что-то по своему вкусу. Я был очень рад найти такой удобный сайт, теперь вечера стали еще интереснее. Рекомендую turkline.tv всем поклонникам турецкого кино.
If we are talking about massive boxes, then they coloradonewss.com should also have a small platform under which you can crawl with a forklift, otherwise transportation will take much longer.
says:Just check this out, Valentina Vega fully nude sexy girl on cam for live porn webcam chat for free!
[url=http://thinktoy.net/bbs/board.php?bo_table=customer2&wr_id=364150]Nude amateur cams[/url][url=http://remote.ecostm.co.kr/bbs/board.php?bo_table=c1&wr_id=11731]Naked hot webcams m[/url] bba3656
Blog videos absolutely free and easy to watch on any device, just
[url=https://community.katawatbusiness.com/question/nude-hot-cams-model-live-sex-char/]Nude hot cams model live sex char[/url][url=http://test.aocoolers.co.kr/bbs/board.php?bo_table=pension&wr_id=53]Nude hot cams woma[/url] 5f320f6
balancing the risk of waiting longer for a higher payout against the potential loss if the plane crashes.
aviator demo
Попробуйте свою удачу в лучших онлайн казино, советуем.
Попробуйте самые популярные онлайн казино и выигрывайте большие деньги, испытайте прямо сейчас.
Играйте в захватывающие азартные игры в онлайн казино и увеличивайте свой доход, посетите прямо сейчас.
Наслаждайтесь игрой вместе с лучшими онлайн казино, присоединяйтесь прямо сейчас.
Новые возможности для азартных игроков в онлайн казино, испытайте прямо сейчас.
Наши рекомендации: лучшие онлайн казино, посетите сейчас.
Играйте в увлекательные игры и выигрывайте крупные суммы в онлайн казино, испытайте прямо сейчас.
Большие выигрыши и возможности: лучшие онлайн казино, присоединяйтесь сейчас.
Азартные игры и захватывающие призы в онлайн казино, попробуйте прямо сейчас.
Играйте в самые популярные онлайн казино и получайте щедрые бонусы и выигрыши, испытайте прямо сейчас.
Популярные возможности для азартных игроков в онлайн казино, посетите прямо сейчас.
Играйте и выигрывайте крупные суммы в самых популярных онлайн казино, испытайте сейчас.
Увлекательные игры и призы в онлайн казино, испытайте прямо сейчас.
Играйте и выигрывайте большие суммы в самых популярных онлайн казино, присоединяйтесь сейчас.
Играйте в азартные игры и выигрывайте призы в онлайн казино, посетите прямо сейчас.
Лучшие бонусы и выигрыши в онлайн казино, посетите прямо сейчас.
Играйте в новые азартные игры и выигрывайте большие суммы в онлайн казино,
лучшие онлайн казино беларуси [url=https://onlayn-kazino-reyting-belarusi.com/]https://onlayn-kazino-reyting-belarusi.com/[/url] .
I like the valuable information you provide in your
articles. I’ll bookmark your weblog and check again here frequently.
I’m quite sure I will learn many new stuff right here! Best of luck for the
next!
Stumbled upon a unique article, I suggest you take a look http://avtobestnews.ru/luchshie-tsifrovyie-tovaryi-dlya-doma-i-ofisa
Привет всем!
ДТП с участием общественного транспорта в Виннице
Аварии с участием общественного транспорта — серьёзная проблема, требующая внимания. В статье рассказывается о последних случаях ДТП с участием автобусов и маршруток в Виннице. Анализируются причины этих происшествий и предлагаются меры для их предотвращения. Узнайте о том, как городские власти и транспортные компании работают над улучшением безопасности пассажиров и других участников дорожного движения.
Все самое лучшее на сайте https://dtp.vn.ua/category/dtp-vinnitsa/
[url=https://dtp.vn.ua/]ДТП Винница за день[/url]
последние новости Винницы
новости Винницы
ДТП Винница за день
Удачи!
i was reading this https://metamask-wallet-web3.com/2023/11/16/unlocking-the-power-of-metamask-a-beginners-guide-to-dapps/
Привет всем!
Узнайте самые свежие новости Кропивницкого! Мы предлагаем актуальные репортажи о событиях в городе, интервью с местными жителями и экспертами, а также подробный анализ важнейших происшествий. Будьте в курсе того, что происходит в Кропивницком, и не пропустите ничего важного!
Все самое лучшее на сайте https://top10.kr.ua/category/news-ukraine/
[url=https://top10.kr.ua/category/news-ukraine/]Новости Украины сегодня[/url]
новости Украины видео
последние новости Кропивницкого
Новости Кропивницкого
Удачи!
More about the author https://orbiter-finance-bridge.com/2023/11/18/decentralized-liquidity-and-revolutionizing-ethereum-native-asset-creation-with-orbiter-finance/
additional info https://1inch-app.org/2023/11/17/1inch-crypto-empowering-decentralization-and-disrupting-middlemen/
to your liking, and quickly move to the section with Watch nudeSweet girls before webcam – Online Sex Show on this topic. All categories are packed enough to make
[url=http://thinktoy.net/bbs/board.php?bo_table=customer2&wr_id=364628]Nude hot cams mode[/url][url=https://community.katawatbusiness.com/question/naked-amateur-webcams-girls-online-porn-char/]Naked amateur webcams girls online porn char[/url] b35f320
台灣線上娛樂城
台灣線上娛樂城是指通過互聯網提供賭博和娛樂服務的平台。這些平台主要針對台灣用戶,但實際上可能在境外運營。以下是一些關於台灣線上娛樂城的重要信息:
1. 服務內容:
– 線上賭場遊戲(如老虎機、撲克、輪盤等)
– 體育博彩
– 彩票遊戲
– 真人荷官遊戲
2. 特點:
– 全天候24小時提供服務
– 可通過電腦或移動設備訪問
– 常提供優惠活動和獎金來吸引玩家
3. 支付方式:
– 常見支付方式包括銀行轉賬、電子錢包等
– 部分平台可能接受加密貨幣
4. 法律狀況:
– 在台灣,線上賭博通常是非法的
– 許多線上娛樂城實際上是在國外註冊運營
5. 風險:
– 由於缺乏有效監管,玩家可能面臨財務風險
– 存在詐騙和不公平遊戲的可能性
– 可能導致賭博成癮問題
6. 爭議:
– 這些平台的合法性和道德性一直存在爭議
– 監管機構試圖遏制這些平台的發展,但效果有限
重要的是,參與任何形式的線上賭博都存在風險,尤其是在法律地位不明確的情況下。建議公眾謹慎對待,並了解相關法律和潛在風險。
如果您想了解更多具體方面,例如如何識別和避免相關風險,我可以提供更多信息。
Discover the best Busty-Ellie fully naked stripping on cam for live sex video webcam chat ever for free!
[url=https://naeunhome.cafe24.com/bbs/board.php?bo_table=review&wr_id=325]Nude amateur webcam[/url][url=http://remote.ecostm.co.kr/bbs/board.php?bo_table=c1&wr_id=11750]Naked amateur webca[/url] 0f5_f82
Numerous online casino platforms offer the Aviator Game. These platforms provide a secure and regulated
aviator demo
Vinicius Junior https://viniciusjunior.prostoprosport-ar.com is a Brazilian and Spanish footballer who plays as a striker for Real Madrid and the Brazilian national team. Junior became the first player in the history of Los Blancos, born in 2000, to play an official match and score a goal.
Unveiling the 100 Best Movies on Netflix in 2024 miraculous ladybug season 5 episode 10 dailymotionyellowstone where to watch season 5stranger things season ranked
Islamische Gebetszeiten, Fadschr, Zuhr, Asr, Maghrib et Isha’a: islamische-gebetszeiten.online
太陽城娛樂城ptt
In such a situation, women18.com water will not accumulate under the gazebo, and it itself will be located on a hill.
Kylian Mbappe https://kylianmbappe.prostoprosport-ar.com is a French footballer, striker for Paris Saint-Germain and captain of the French national team. He began playing football in the semi-professional club Bondi, which plays in the lower leagues of France. He was noticed by Monaco scouts, which he joined in 2015 and that same year, at the age of 16, he made his debut for the Monegasques. The youngest debutant and goal scorer in the club’s history.
says:Just check this out, 0238 Kats Playhouse – Another session at Kat’s Playhouse Group chat live for crowd Watch me get fucked live for my viewers interracial black girl white guy for free!
[url=http://thinktoy.net/bbs/board.php?bo_table=customer2&wr_id=365181]Naked hot cams mod[/url][url=http://remote.ecostm.co.kr/bbs/board.php?bo_table=c1&wr_id=11753]Naked amateur webca[/url] 5515b35
Several key developers and companies have played a significant role in the development and success of the
aviator demo
Islamische Gebetszeiten, Fadschr, Zuhr, Asr, Maghrib et Isha’a: islamische-gebetszeiten.online
britainsnews.com
Если хотите [url=https://turklife.tv/serials2024/]смотреть турецкие сериалы 2024 онлайн на русском языке[/url], заходите на turklife.tv! Здесь вы найдете самые свежие и интересные сериалы 2024 года в высоком HD качестве и с отличной русской озвучкой. На сайте представлено множество жанров, и каждый найдет что-то по душе.
Ежедневно добавляются новые серии, и все это абсолютно бесплатно и без рекламы в плеере. Turklife.tv – это ваше идеальное место для просмотра турецких сериалов на русском языке. Не упустите возможность насладиться лучшими новинками 2024 года!
dublindecor.net
Do you have a spam issue on this site; I also am a blogger, and I was wanting to know your situation; many of us have created some nice procedures and we are looking to trade strategies with others, please shoot me an e-mail if interested.
#GGG###
https://beckettgtcl30641.blog5star.com/27747881/台湾手机号-连接现代生活的纽带
Found an enthralling read that I’d recommend Р it’s truly fascinating http://mynewsport.ru/eksklyuzivnyie-litsenzii-po-dostupnyim-tsenam
Karim Benzema https://karimbenzema.prostoprosport-ar.com is a French footballer who plays as a striker for the Saudi Arabian club Al-Ittihad. He played for the French national team, for which he played 97 matches and scored 37 goals. At the age of 17, he became one of the best reserve players, scoring three dozen goals per season.
SophiLove nude on webcam – live sex chat videos absolutely free and easy to watch on any device, just
[url=http://thinktoy.net/bbs/board.php?bo_table=customer2&wr_id=365624]Naked amateur cams[/url][url=https://toteblogs.com/posts/Best-Vitamin-C-Serums-for-Brighter-Skin-]Naked amateur webcams woman live porn show[/url] 3656eb7
important site [url=https://sanclboxgame.cc/]Sandbox Airdrop[/url]
Подробная инструкция по чистке антикварных вещей без помощи специалистов.
Химчистка антикварной мебели — возвращаем былое великолепие. [url=https://www.ximchistka-antikvarnoj-mebeli.ru/]https://www.ximchistka-antikvarnoj-mebeli.ru/[/url] .
why not look here [url=https://sanclboxgame.cc/]The Sandbox Metaverse Map[/url]
Victor James Osimhen https://victorosimhen.prostoprosport-ar.com is a Nigerian footballer who plays as a forward for the Italian club Napoli and the Nigerian national team. In 2015, he was recognized as the best football player in Africa among players under 17 according to the Confederation of African Football.
My partner and I absolutely love your blog and find a lot of your post’s to be
what precisely I’m looking for. Would you
offer guest writers to write content in your case?
I wouldn’t mind publishing a post or elaborating on many of the subjects you write about here.
Again, awesome site!
I interviewed two ladies who do this successfully and they show us how to get began and make dollars.
my page – http://mateenbeat.com/index.php?title=Serving_Up_Smiles:_The_Secret_Life_Of_Part-time_Waitstaff
Excellent and high-quality Nica nude before webcam – Live Sex Webcam chat absolutely free and easy to watch on any device, just
[url=http://www.kiccoltd.co.kr/bbs/board.php?bo_table=free&wr_id=760158]Nude amateur cams[/url][url=https://trust-used.com/best-gaming-laptop-models/]Naked hot cams woman live sex char[/url] 5515b35
anal threesome bellapaty nue strip on cam for live sex video chat
[url=http://test.aocoolers.co.kr/bbs/board.php?bo_table=pension&wr_id=59]Naked hot cams gir[/url][url=https://toteblogs.com/posts/Best-Vitamin-C-Serums-for-Brighter-Skin-]Nude amateur cams woman online porn char[/url] 10a7a55
buy cvv Good validity rate Buying Make good job for you
Pay on website activate your card now for international transactions.
————-CONTACT———————–
WEBSITE : >>>>>>Cvv⁎Black
—– HERE COMES THE PRICE LIST ———–
***** CCV US:
– US MASTER CARD = $2,1 per 1 (buy >5 with price $3 per 1).
– US VISA CARD = $2,9 per 1 (buy >5 with price $2.5 per 1).
– US AMEX CARD = $3,5 per 1 (buy >5 with price $2.5 per
1).
– US DISCOVER CARD = $3,4 per 1 (buy >5 with
price $3.5 per 1).
– US CARD WITH DOB = $15 per 1 (buy >5 with price $12 per
1).
– US FULLZ INFO = $40 per 1 (buy >10 with price $30 per
1).
***** CCV UK:
– UK CARD NORMAL = $3,5 per 1 (buy >5 with price $3 per 1).
– UK MASTER CARD = $2,6 per 1 (buy >5 with price
$2.5 per 1).
– UK VISA CARD = $2,9 per 1 (buy >5 with price $2.5 per 1).
– UK AMEX CARD = $2,1 per 1 (buy >5 with price $4 per 1).
$4,4
– UK CARD WITH DOB = $15 per 1 (buy >5 with price $14 per 1).
– UK WITH BIN = $10 per 1 (buy >5 with price $9 per 1).
– UK WITH BIN WITH DOB = $25 per 1 (buy >20 with price $22 per 1).
– UK FULLZ INFO = $40 per 1 (buy >10 with price $35 per 1).
***** CCV AU:
– AU MASTER CARD = $5.5 per 1 (buy >5 with price $5 per 1).
– AU VISA CARD = $5.5 per 1 (buy >5 with price $5 per 1).
– AU AMEX CARD = $8.5 per 1 (buy >5 with price $8 per 1).
– AU DISCOVER CARD = $8.5 per 1 (buy >5 with price $8 per 1).
***** CCV CA:
– CA MASTER CARD = $6 per 1 (buy >5 with price $5 per 1).
– CA VISA CARD = $6 per 1 (buy >5 with price $5 per 1).
– CA VISA BUSINESS = $14 per 1 (buy >5 with price $13 per 1).
Discover the best Blog ever for free!
[url=http://thinktoy.net/bbs/board.php?bo_table=customer2&wr_id=366904]Nude amateur cams[/url][url=https://naeunhome.cafe24.com/bbs/board.php?bo_table=review&wr_id=331]Nude amateur cams[/url] b35f320
additional reading [url=https://phantom.lu]phantom wallet login[/url]
Nice articl! Just check stefannichka fully nude stripping on cam for live sex movie show this out!
[url=https://naeunhome.cafe24.com/bbs/board.php?bo_table=review&wr_id=332]Naked amateur cams[/url][url=https://toteblogs.com/posts/Best-Vitamin-C-Serums-for-Brighter-Skin-]Naked amateur cams model online porn show[/url] a7a5515
learn this here now [url=https://keplrwallet.app]keplr wallet login[/url]
Сервера л2
Glory Casino
Excellent and high-quality Busty-Ellie naked stripping on cam for live sex movie chat absolutely free and easy to watch on any device, just
[url=https://community.katawatbusiness.com/question/naked-amateur-cams-woman-live-sex-show/]Naked amateur cams woman live sex show[/url][url=http://thinktoy.net/bbs/board.php?bo_table=customer2&wr_id=367311]Naked hot cams wom[/url] 10a7a55
Портал о здоровье https://rezus.ru и здоровом образе жизни, рекомендации врачей и полезные сервисы. Простые рекомендации для укрепления здоровья и повышения качества жизни.
Приветствую. Подскажите, где почитатьполезные блоги о недвижимости? Пока нашел https://417-017.ru
nude live men
hop over to this site [url=https://rabby.at]rabby extension[/url]
livenudecams
Excellent and high-quality roseyyxox fully nude strip before cam for live porn chat absolutely free and easy to watch on any device, just
[url=https://naeunhome.cafe24.com/bbs/board.php?bo_table=review&wr_id=334]Naked amateur webca[/url][url=https://trust-used.com/best-gaming-laptop-models/]Nude amateur cams girls online sex show[/url] 35f320f
Toni Kroos https://tonikroos.prostoprosport-ar.com is a German footballer who plays as a central midfielder for Real Madrid and the German national team. World champion 2014. The first German player in history to win the UEFA Champions League six times.
Glory Casino
live xxx cam
Nice article, thanks! Just check MiiaaLee fully naked on webcam – live sex chat this out.
[url=http://remote.ecostm.co.kr/bbs/board.php?bo_table=c1&wr_id=11817]Naked hot cams gir[/url][url=https://community.katawatbusiness.com/question/nude-amateur-cams-woman-live-porn-show/]Nude amateur cams woman live porn show[/url] ba3656e
male free cam
cam free porn
cam free porn
additional hints [url=https://martianwallet.app]martianwallet login[/url]
tranny sex chat
Robert Lewandowski https://robertlewandowski.prostoprosport-ar.com is a Polish footballer, forward for the Spanish club Barcelona and captain of the Polish national team. Considered one of the best strikers in the world. Knight of the Commander’s Cross of the Order of the Renaissance of Poland.
nude couples having intercourse
Attractive section of content. I just stumbled upon your website and in accession capital to assert that I acquire in fact enjoyed account your blog posts. Any way I’ll be subscribing to your feeds and even I achievement you access consistently rapidly.
rabota-vakansii-spb.ru/job.php?s=%C3%8A%C3%A0%C3%B1%C3%B1%C3%A8%C3%B0
teploxodiki.ru/rona.php
drosetourmanila.com/vn/retail_promo.html
http://www.login.ps/blogs/69645/%D0%9F%D0%BE%D1%81%D1%82%D0%B4%D0%B8%D0%BF%D0%BB%D0%BE%D0%BC%D0%BD%D0%BE%D0%B5-%D0%A0%D0%B0%D0%B7%D0%B2%D0%B8%D1%82%D0%B8%D0%B5-%D0%9A%D0%BB%D1%8E%D1%87%D0%B5%D0%B2%D1?lang=tr_tr
razvodka-mostov.ru/press/70/
Homepage von iam-alana Naked On Live Cam Girls Room
[url=http://test.aocoolers.co.kr/bbs/board.php?bo_table=pension&wr_id=65]Naked hot cams wom[/url][url=https://toteblogs.com/posts/Best-Vitamin-C-Serums-for-Brighter-Skin-]Nude amateur webcams model online porn show[/url] eb76201
Good day!
Financial Management for Entrepreneurs! Effective financial management is essential for business success. Discover how to manage your finances, create a budget, and plan for the future.
Data Analytics for Business Growth! Make informed decisions and drive growth by harnessing the power of data analytics.
Very good thematic site – https://jukreative.com
news today
practical advice
news channe
culinary tourism
efficiency
travel stories
negotiation tips
meal delivery services
Good luck!
Ищете, где можно [url=https://turklife.tv/serials2024/]смотреть турецкие сериалы 2024 онлайн[/url]? Обязательно посетите turklife.tv! Это идеальное место для поклонников турецких сериалов. Здесь представлены самые свежие новинки 2024 года в отличном HD 1080 качестве с профессиональной русской озвучкой. На сайте собраны сериалы разных жанров: драмы, комедии, боевики, фэнтези и многое другое.
Каждый день добавляются новые серии, и все это абсолютно бесплатно и без рекламы в плеере. Turklife.tv – это сайт, о котором вы давно мечтали. Заходите и наслаждайтесь лучшими турецкими сериалами прямо сейчас!
Regards. Loads of stuff!
webcam trans colombia
fitcougarcb’s cam
Just check this out, THEROMANCER1993 nude strip on cam for live sex video chat
[url=https://community.katawatbusiness.com/question/nude-hot-webcams-model-live-porn-char/]Nude hot webcams model live porn char[/url][url=https://trust-used.com/best-gaming-laptop-models/]Nude hot webcams woman live porn char[/url] 7a5515b
2k tv answers episode 1 is premiere collectibles legitgreece ridge movieslittle t fresh prince episode
check that [url=https://martianwallet.at]Aptos wallet[/url]
Found an article that’s definitely worth your time – take a look http://preceptor.flybb.ru/viewtopic.php?f=13&t=9581
Интересная тема! А еще, кстати, недавно натыкался на интересную статью про подключение Яндекс Плюс: https://taplink.cc/kak_podkliuchit_iandeks_plius Гляньте, если интересно..
сериал волчонок бесплатно https://volchonok-tv.ru
Watch nudeLetizia Fulkers Live webcam – Sex Chat
[url=https://community.katawatbusiness.com/question/naked-amateur-cams-model-live-porn-show-2/]Naked amateur cams model live porn show[/url][url=http://test.aocoolers.co.kr/bbs/board.php?bo_table=pension&wr_id=66]Naked hot webcams m[/url] 15b35f3
Приветствую. Подскажите, где найтиполезные блоги о недвижимости? Пока нашел https://aquatopnn.ru
Хотите быть в курсе всех значимых тем в сфере недвижимости?
На нашем сайте вы найдете много полезных статей о квартирах от застройщика, а также о анализе рынка недвижимости.
Узнайте все, что вам нужно для успешных сделок и принятия важных решений в сфере недвижимости.
https://prestizh-stroi.ru
Моя мечта всегда была посетить Японию, но деньги на путешествие собрать не удавалось. В один прекрасный день я увидел в интернете упоминание о Телеграм канале [url=https://t.me/s/mfo_2024_online]займы малоизвестные без отказа на карту[/url] . Там были собраны все новые МФО с подробным описанием условий займов. Я решил попробовать. Выбрал одну из компаний, и процесс занял всего 10 минут. Деньги моментально поступили на счет. Благодаря этому я смог осуществить свою мечту и отправился в Японию. Это было незабываемое путешествие, и я благодарен за помощь этому каналу.
Как получить лицензию на недвижимость|Ключевая информация о лицензии на недвижимость|Как начать карьеру в недвижимости с лицензией|Секреты быстрого получения лицензии на недвижимость|Разберитесь в процессе получения лицензии на недвижимость|Полезные советы по получению лицензии на недвижимость|Лицензия на недвижимость: важные аспекты|Шаг за шагом к лицензии на недвижимость|Три шага к успешной лицензии на недвижимость|Успешное получение лицензии на недвижимость: шаг за шагом|Основные моменты получения лицензии на недвижимость|Секреты скорого получения лицензии на недвижимость|Основные шаги к успешной лицензии на недвижимость|Лицензия на недвижимость: ключ к успешной карьере|Профессиональные советы по получению лицензии на недвижимость|Как получить лицензию на недвижимость без стресса|Шаги к успешной лицензии на недвижимость|Советы по успешному получению лицензии на недвижимость|Ключевые моменты получения лицензии на недвижимость|Легко получите лицензию на недвижимость с этими советами|Получите лицензию на недвижимость и станьте профессиональным агентом|Секреты успешного получения лицензии на недвижимость|Инструкция по получению лицензии на недвижимость|Простой путь к получению лицензии на недвижимость|Как получить лицензию на недвижимость: основные принципы и стратегии|Лицензия на недвижимость: важные аспекты для успешного получения
How to get a realtor license in Colorado [url=https://realestatelicensehefrsgl.com/states/colorado-real-estate-license/]How to get a realtor license in Colorado[/url] .
to your liking, and quickly move to the section with Nica nude before webcam – Live Sex Chat on this topic. All categories are packed enough to make
[url=http://hantechfa.com/bbs/board.php?bo_table=free&wr_id=16477]Naked hot webcams m[/url][url=https://trust-used.com/best-gaming-laptop-models/]Naked hot webcams model online sex show[/url] 5515b35
When you obtain 1 that takes your fancy, you could be up and operating inside minutes.
Look into my homepage … https://www.hayah.cc/forum/redirector.php?url=https://phat4life.mn.co/posts/58904811
porn cam live
Hi there, this weekend is nice in favor of me, as this moment i am reading this great informative post here at my house.
live cams xxx
Mohamed Salah https://mohamedsalah.prostoprosport-ar.com is an Egyptian footballer who plays as a forward for the English club Liverpool and the Egyptian national team. Considered one of the best football players in the world. Three-time winner of the English Premier League Golden Boot: in 2018 (alone), 2019 (along with Sadio Mane and Pierre-Emerick Aubameyang) and 2022 (along with Son Heung-min).
Our graduate and intern programs are designed to embrace new inventive tips and ambitious voices and connect you to a globe of opportunity.
my blog :: http://chemwiki.scc.kit.edu/main/mediawiki/Unlocking_The_Glitzy_Secrets_Of_Room_Salon_Recruitment:_Get_Ready_To_Shine
Как получить лицензию на недвижимость|Все, что вам нужно знать о лицензии на недвижимость|Подробное руководство по получению лицензии на недвижимость|Советы по получению лицензии на недвижимость|Эффективные способы получения лицензии на недвижимость|Полезные советы по получению лицензии на недвижимость|Секреты успешного получения лицензии на недвижимость|Изучите основы получения лицензии на недвижимость|Как получить лицензию на недвижимость: советы экспертов|Лицензия на недвижимость для начинающих: советы и рекомендации|Процесс получения лицензии на недвижимость: как это работает|Полезные советы по получению лицензии на недвижимость|Легкий путь к получению лицензии на недвижимость|Топ советы по получению лицензии на недвижимость|Советы по получению лицензии на недвижимость от профессионалов|Эффективные стратегии для успешного получения лицензии на недвижимость|Получение лицензии на недвижимость: лучшие практики и советы|Инструкция по получению лицензии на недвижимость|Лицензия на недвижимость: ключ к успеху в индустрии недвижимости|Легко получите лицензию на недвижимость с этими советами|Простой путь к получению лицензии на недвижимость|Основные шаги к профессиональной лицензии на недвижимость|Инструкция по получению лицензии на недвижимость|Секреты быстрого получения лицензии на недвижимость|Как получить лицензию на недвижимость: основные принципы и стратегии|Сек
How do you get a real estate license in Tennessee [url=https://realestatelicensehefrsgl.com/states/tennessee-real-estate-license/]How do you get a real estate license in Tennessee[/url] .
Nice article, thanks! Just check rei1926 naked stripping on cam for online porn movie webcam chat this out.
[url=http://test.aocoolers.co.kr/bbs/board.php?bo_table=pension&wr_id=68]Naked hot webcams m[/url][url=https://community.katawatbusiness.com/question/nude-hot-cams-girls-online-porn-show/]Nude hot cams girls online porn show[/url] f8_2983
Как получить лицензию на недвижимость|Ключевая информация о лицензии на недвижимость|Станьте лицензированным агентом по недвижимости|Советы по получению лицензии на недвижимость|Инструкция по получению лицензии на недвижимость|Получите профессиональную лицензию на недвижимость|Секреты успешного получения лицензии на недвижимость|Шаг за шагом к лицензии на недвижимость|Как получить лицензию на недвижимость: советы экспертов|Лицензия на недвижимость для начинающих: советы и рекомендации|Секреты профессиональной лицензии на недвижимость|Полезные советы по получению лицензии на недвижимость|Легкий путь к получению лицензии на недвижимость|Как стать агентом по недвижимости с лицензией: пошаговое руководство|Как получить лицензию на недвижимость легко и быстро|Разберитесь в процессе получения лицензии на недвижимость: полное руководство|Секреты получения лицензии на недвижимость от экспертов|Инструкция по получению лицензии на недвижимость|Профессиональные советы по получению лицензии на недвижимость|Секреты успешного получения лицензии на недвижимость: что вам нужно знать|Получите лицензию на недвижимость и станьте профессиональным агентом|Основные шаги к профессиональной лицензии на недвижимость|Шаги к успешной лицензии на недвижимость|Процесс получения лицензии на недвижимость: ключевые моменты|Как получить лицензию на недвижимость: основные принципы и стратегии|Лицензия на недвижимость: важные аспекты для успешного получения
Real Estate License [url=https://realestatelicensehefrsgl.com/]https://realestatelicensehefrsgl.com/[/url] .
Для поклонников захватывающих детективных историй и криминальных драм turklife.tv предлагает [url=https://turklife.tv/kriminal/]турецкие сериалы криминал[/url]. На сайте вы найдете лучшие криминальные сериалы в HD 1080 качестве и с профессиональной русской озвучкой. Удобная навигация по жанрам и годам делает поиск простым и быстрым.
Ежедневные обновления гарантируют новые серии каждый день, и всё это бесплатно и без рекламы. Turklife.tv – это идеальное место для любителей криминальных сериалов. Заходите и наслаждайтесь захватывающими историями прямо сейчас!
казино [url=https://skladchik.org/]казино[/url] .
dalycitynewspaper.com
Discover the best swinger_naomi23 fully nude stripping on cam for live porn video webcam chat ever for free!
[url=http://remote.ecostm.co.kr/bbs/board.php?bo_table=c1&wr_id=11857]Nude hot cams mode[/url][url=http://www.kiccoltd.co.kr/bbs/board.php?bo_table=free&wr_id=760867]Nude amateur cams[/url] 01210a7
Discovered a unique article – recommended to acquaint yourself! http://bestworld.getbb.ru/viewtopic.php?f=8&t=1194
cheap tiktok followers buy tiktok followers
better to say, the first huge advantage for the project community contained in fact, that it can pick your next deal, https://https://wienerai-token.com// and commit research of the market, which will help the trader to win more often.
Всем привет! Подскажите, где почитатьполезные блоги о недвижимости? Сейчас читаю https://artem-dvery.ru
Zoee naked strip before cam for online sex show videos absolutely free and easy to watch on any device, just
[url=http://thinktoy.net/bbs/board.php?bo_table=customer2&wr_id=370157]Naked hot webcams w[/url][url=https://community.katawatbusiness.com/question/naked-amateur-cams-woman-live-porn-show/]Naked amateur cams woman live porn show[/url] ba3656e
машина для перевозки мебели [url=http://gruzchikiminsk.ru/]http://gruzchikiminsk.ru/[/url] .
special info [url=https://keplrwallet.app]Atom wallet keplr[/url]
Found captivating reading that’s worth your time – take a look https://lnkbit.ru/eskort-modeli-mogut-izvlech-vygodu-iz-obuchayushhix-programm/
проститутки тюмени
Как получить лицензию на недвижимость|Легко и быстро получите лицензию на недвижимость|Станьте лицензированным агентом по недвижимости|Успешные стратегии получения лицензии на недвижимость|Разберитесь в процессе получения лицензии на недвижимость|Следуйте этим шагам для получения лицензии на недвижимость|Лицензия на недвижимость: важные аспекты|Шаг за шагом к лицензии на недвижимость|Три шага к успешной лицензии на недвижимость|Инструкция по получению лицензии на недвижимость|Основные моменты получения лицензии на недвижимость|Как получить лицензию на недвижимость и стать успешным агентом|Легкий путь к получению лицензии на недвижимость|Топ советы по получению лицензии на недвижимость|Профессиональные советы по получению лицензии на недвижимость|Эффективные стратегии для успешного получения лицензии на недвижимость|Шаги к успешной лицензии на недвижимость|Как быстро и легко получить лицензию на недвижимость|Лицензия на недвижимость: ключ к успеху в индустрии недвижимости|Легко получите лицензию на недвижимость с этими советами|Получите лицензию на недвижимость и станьте профессиональным агентом|Как получить лицензию на недвижимость быстро и легко|Инструкция по получению лицензии на недвижимость|Процесс получения лицензии на недвижимость: ключевые моменты|Три шага к профессиональной лицензии на недвижимость|Лицензия на недвижимость: важные аспекты для успешного получения
How to get real estate license in Ohio [url=https://realestatelicensehefrsgl.com/states/ohio-real-estate-license/]https://realestatelicensehefrsgl.com/states/ohio-real-estate-license/[/url] .
ремонт стиральных машин рядом
Hello everybody!
Family-Friendly Meals! Discover recipes that everyone in the family will enjoy. Our family-friendly meals are easy to prepare and sure to satisfy even the pickiest eaters.
Technology & Gadgets! Stay ahead with our tech tips and gadget reviews. Learn to maximize device usage and stay updated on the latest tech trends.
Very good thematic site – https://jukreative.com
entrepreneurial culture
sales
international cuisine
angel investments
marketing
street food
comfort food
culinary schools
Good luck!
Blog absolutely free and easy to watch on any device, just
[url=https://toteblogs.com/posts/Best-Vitamin-C-Serums-for-Brighter-Skin-]Naked hot webcams girls live sex show[/url][url=http://www.kiccoltd.co.kr/bbs/board.php?bo_table=free&wr_id=761215]Naked hot webcams w[/url] 3656eb7
вычислить местоположение по номеру телефона
найти человека по номеру телефона бесплатно через спутник в реальном времени без регистрации россия
Sweet girls naked strip before cam for live sex chat absolutely free and easy to watch on any device, just
[url=http://remote.ecostm.co.kr/bbs/board.php?bo_table=c1&wr_id=11875]Naked hot webcams m[/url][url=http://thinktoy.net/bbs/board.php?bo_table=customer2&wr_id=370785]Nude hot webcams gi[/url] 10a7a55
проститутки тюмени
Lionel Andres Messi Cuccittini https://lionelmessi.prostoprosport-ar.com is an Argentine footballer, forward and captain of the MLS club Inter Miami, captain of the Argentina national team. World champion, South American champion, Finalissima winner, Olympic champion. Considered one of the best football players of all time.
локатор телефона по номеру
зайти на сайт https://filmos.net/serials/
Ежегодно в течение сентября проводится Тюменский инновационный форум «НЕФТЬГАЗТЭК».
Форум посвящен устройству механизмов инноваторского продвижения отраслей топливно-энергетического комплекса, рассмотрению а также поиску ответов, созданию наилучших условий для развития инноваторских проектов. Ежегодный тюменский форум является авторитетной дискуссионной площадкой по развитию нефтегазовой отрасли в России, имеет высокий статус и актуальность, созвучен общей стратегии развития инновационного направления в Российской Федерации
https://neftgaztek.ru/
Cristiano Ronaldo https://cristiano-ronaldo.prostoprosport-ar.com is a Portuguese footballer, forward, captain of the Saudi Arabian club An-Nasr and the Portuguese national team. European Champion. Considered one of the best football players of all time. The best scorer in the history of football according to the IFFIS and fourth according to the RSSSF
вавада зеркало на сегодня зеркало вавады
Find out Kristel-Bellucci nude strip on webcam for StripChat live chat for free 🙂
[url=https://naeunhome.cafe24.com/bbs/board.php?bo_table=review&wr_id=354]Nude amateur webcam[/url][url=http://thinktoy.net/bbs/board.php?bo_table=customer2&wr_id=371235]Nude amateur cams[/url] ba3656e
ремонт посудомоек miele
Как поддерживать и ухаживать за кожаной мебелью, чтобы ваша мебель всегда была в идеальном состоянии.
Химчистка кожаной мебели на дому обеспечивает глубокое и эффективное удаление загрязнений и пятен с ваших любимых предметов интерьера: [url=https://www.ximchistka-kozhanoj-mebeli.ru/]https://www.ximchistka-kozhanoj-mebeli.ru/[/url] .
Всем привет! Подскажите, где найтиполезные блоги о недвижимости? Пока нашел https://asiatreid.ru
Как получить лицензию на недвижимость|Ключевая информация о лицензии на недвижимость|Подробное руководство по получению лицензии на недвижимость|Успешные стратегии получения лицензии на недвижимость|Разберитесь в процессе получения лицензии на недвижимость|Получите профессиональную лицензию на недвижимость|Секреты успешного получения лицензии на недвижимость|Как стать агентом с лицензией на недвижимость|Как получить лицензию на недвижимость: советы экспертов|Лицензия на недвижимость для начинающих: советы и рекомендации|Секреты профессиональной лицензии на недвижимость|Секреты скорого получения лицензии на недвижимость|Легкий путь к получению лицензии на недвижимость|Как стать агентом по недвижимости с лицензией: пошаговое руководство|Профессиональные советы по получению лицензии на недвижимость|Эффективные стратегии для успешного получения лицензии на недвижимость|Секреты получения лицензии на недвижимость от экспертов|Как быстро и легко получить лицензию на недвижимость|Ключевые моменты получения лицензии на недвижимость|Три шага к успешной лицензии на недвижимость|Как стать агентом по недвижимости с лицензией|Как получить лицензию на недвижимость быстро и легко|Шаги к успешной лицензии на недвижимость|Процесс получения лицензии на недвижимость: ключевые моменты|Как получить лицензию на недвижимость: основные принципы и стратегии|Сек
How to get my real estate license in North Carolina [url=https://realestatelicensehefrsgl.com/states/north-carolina-real-estate-license/]How to get my real estate license in North Carolina[/url] .
Шаги к получению лицензии на недвижимость|Ключевая информация о лицензии на недвижимость|Подробное руководство по получению лицензии на недвижимость|Секреты быстрого получения лицензии на недвижимость|Эффективные способы получения лицензии на недвижимость|Следуйте этим шагам для получения лицензии на недвижимость|Простой путь к получению лицензии на недвижимость|Шаг за шагом к лицензии на недвижимость|Эффективные стратегии получения лицензии на недвижимость|Лицензия на недвижимость для начинающих: советы и рекомендации|Секреты профессиональной лицензии на недвижимость|Секреты скорого получения лицензии на недвижимость|Легкий путь к получению лицензии на недвижимость|Как стать агентом по недвижимости с лицензией: пошаговое руководство|Профессиональные советы по получению лицензии на недвижимость|Разберитесь в процессе получения лицензии на недвижимость: полное руководство|Секреты получения лицензии на недвижимость от экспертов|Инструкция по получению лицензии на недвижимость|Ключевые моменты получения лицензии на недвижимость|Три шага к успешной лицензии на недвижимость|Как стать агентом по недвижимости с лицензией|Основные шаги к профессиональной лицензии на недвижимость|Инструкция по получению лицензии на недвижимость|Процесс получения лицензии на недвижимость: ключевые моменты|Три шага к профессиональной лицензии на недвижимость|Лицензия на недвижимость: важные аспекты для успешного получения
How to get a real estate license in New York [url=https://realestatelicensehefrsgl.com/states/new-york-real-estate-license/]https://realestatelicensehefrsgl.com/states/new-york-real-estate-license/[/url] .
[url=https://bs2beast.cc]Bs2tsite4[/url] – Blacksprut зеркало, Bs2tsite3
https://rollerski.lv/rolleri-ar-amortizatoriem/
Как получить лицензию на недвижимость|Все, что вам нужно знать о лицензии на недвижимость|Подробное руководство по получению лицензии на недвижимость|Советы по получению лицензии на недвижимость|Разберитесь в процессе получения лицензии на недвижимость|Полезные советы по получению лицензии на недвижимость|Лицензия на недвижимость: важные аспекты|Изучите основы получения лицензии на недвижимость|Эффективные стратегии получения лицензии на недвижимость|Инструкция по получению лицензии на недвижимость|Процесс получения лицензии на недвижимость: как это работает|Полезные советы по получению лицензии на недвижимость|Основные шаги к успешной лицензии на недвижимость|Топ советы по получению лицензии на недвижимость|Советы по получению лицензии на недвижимость от профессионалов|Как получить лицензию на недвижимость без стресса|Получение лицензии на недвижимость: лучшие практики и советы|Как быстро и легко получить лицензию на недвижимость|Профессиональные советы по получению лицензии на недвижимость|Три шага к успешной лицензии на недвижимость|Получите лицензию на недвижимость и станьте профессиональным агентом|Как получить лицензию на недвижимость быстро и легко|Инструкция по получению лицензии на недвижимость|Процесс получения лицензии на недвижимость: ключевые моменты|Три шага к профессиональной лицензии на недвижимость|Сек
Alabama Real Estate Licence [url=https://realestatelicensehefrsgl.com/states/alabama-real-estate-license/]https://realestatelicensehefrsgl.com/states/alabama-real-estate-license/[/url] .
ремонт телефонов в москве
ремонт гладильных систем miele
Bela nude sexy before webcam Sex Chat absolutely free and easy to watch on any device, just
[url=https://trust-used.com/best-gaming-laptop-models/]Nude amateur cams model online sex show[/url][url=http://www.kiccoltd.co.kr/bbs/board.php?bo_table=free&wr_id=761933]Naked amateur cams[/url] 0a7a551
Как получить лицензию на недвижимость|Все, что вам нужно знать о лицензии на недвижимость|Станьте лицензированным агентом по недвижимости|Успешные стратегии получения лицензии на недвижимость|Инструкция по получению лицензии на недвижимость|Полезные советы по получению лицензии на недвижимость|Простой путь к получению лицензии на недвижимость|Изучите основы получения лицензии на недвижимость|Три шага к успешной лицензии на недвижимость|Лицензия на недвижимость для начинающих: советы и рекомендации|Основные моменты получения лицензии на недвижимость|Как получить лицензию на недвижимость и стать успешным агентом|Легкий путь к получению лицензии на недвижимость|Лицензия на недвижимость: ключ к успешной карьере|Профессиональные советы по получению лицензии на недвижимость|Разберитесь в процессе получения лицензии на недвижимость: полное руководство|Получение лицензии на недвижимость: лучшие практики и советы|Советы по успешному получению лицензии на недвижимость|Ключевые моменты получения лицензии на недвижимость|Три шага к успешной лицензии на недвижимость|Получите лицензию на недвижимость и станьте профессиональным агентом|Секреты успешного получения лицензии на недвижимость|Инструкция по получению лицензии на недвижимость|Процесс получения лицензии на недвижимость: ключевые моменты|Как получить лицензию на недвижимость: основные принципы и стратегии|Сек
How to get a real estate license in Illinois [url=https://realestatelicensehefrsgl.com/states/illinois-real-estate-license/]https://realestatelicensehefrsgl.com/states/illinois-real-estate-license/[/url] .
определить место нахождения по номеру телефона онлайн бесплатно
ремонт холодильников бош
Казино без депозита – Twin Casino
Just check this out, Sweet girls nude before adult cam – Live Sex Chat
[url=http://remote.ecostm.co.kr/bbs/board.php?bo_table=c1&wr_id=11899]Nude hot webcams wo[/url][url=https://sample115.tlogsir.com/bbs/board.php?bo_table=tl_product02&wr_id=306]Nude amateur webcam[/url] 35f320f
The winning numbers have been ten, 33, 41, 47, 56 and https://deprezyon.com/forum/index.php?action=profile;u=182688 of ten.
ремонт холодильников bosch в москве
Homepage von Big Ass candy naked on Live WebCam Babes Room
[url=http://www.kiccoltd.co.kr/bbs/board.php?bo_table=free&wr_id=762300]Naked hot webcams w[/url][url=https://community.katawatbusiness.com/question/naked-amateur-webcams-woman-live-porn-char/]Naked amateur webcams woman live porn char[/url] f320f4_
Шаги к получению лицензии на недвижимость|Ключевая информация о лицензии на недвижимость|Как начать карьеру в недвижимости с лицензией|Секреты быстрого получения лицензии на недвижимость|Разберитесь в процессе получения лицензии на недвижимость|Получите профессиональную лицензию на недвижимость|Лицензия на недвижимость: важные аспекты|Как стать агентом с лицензией на недвижимость|Как получить лицензию на недвижимость: советы экспертов|Лицензия на недвижимость для начинающих: советы и рекомендации|Основные моменты получения лицензии на недвижимость|Полезные советы по получению лицензии на недвижимость|Получите лицензию на недвижимость и станьте профессионалом|Топ советы по получению лицензии на недвижимость|Советы по получению лицензии на недвижимость от профессионалов|Разберитесь в процессе получения лицензии на недвижимость: полное руководство|Шаги к успешной лицензии на недвижимость|Как быстро и легко получить лицензию на недвижимость|Ключевые моменты получения лицензии на недвижимость|Секреты успешного получения лицензии на недвижимость: что вам нужно знать|Простой путь к получению лицензии на недвижимость|Основные шаги к профессиональной лицензии на недвижимость|Шаги к успешной лицензии на недвижимость|Процесс получения лицензии на недвижимость: ключевые моменты|Эффективные советы по успешному получению лицензии на недвижимость|Лицензия на недвижимость: важные аспекты для успешного получения
Real Estate Agent License in Oregon [url=https://realestatelicensehefrsgl.com/states/oregon-island-real-estate-license/]https://realestatelicensehefrsgl.com/states/oregon-island-real-estate-license/[/url] .
Всем привет! Подскажите, где почитатьполезные блоги о недвижимости? Сейчас читаю https://dilerskiy-tsentr-baumit.ru
An outstanding share! I’ve just forwarded this onto a coworker who was conducting a little research on this. And he in fact bought me lunch simply because I stumbled upon it for him… lol. So let me reword this…. Thanks for the meal!! But yeah, thanx for spending time to talk about this topic here on your web page.
#GGG###
https://rafaelymxg20864.daneblogger.com/27061600/台湾虚拟手机号-连接未来的数е—еЊ–йЂљдїЎзєЅеё¦
Секреты успешного получения лицензии на недвижимость|Ключевая информация о лицензии на недвижимость|Как начать карьеру в недвижимости с лицензией|Советы по получению лицензии на недвижимость|Инструкция по получению лицензии на недвижимость|Получите профессиональную лицензию на недвижимость|Лицензия на недвижимость: важные аспекты|Изучите основы получения лицензии на недвижимость|Как получить лицензию на недвижимость: советы экспертов|Инструкция по получению лицензии на недвижимость|Основные моменты получения лицензии на недвижимость|Полезные советы по получению лицензии на недвижимость|Получите лицензию на недвижимость и станьте профессионалом|Лицензия на недвижимость: ключ к успешной карьере|Профессиональные советы по получению лицензии на недвижимость|Эффективные стратегии для успешного получения лицензии на недвижимость|Секреты получения лицензии на недвижимость от экспертов|Как быстро и легко получить лицензию на недвижимость|Лицензия на недвижимость: ключ к успеху в индустрии недвижимости|Легко получите лицензию на недвижимость с этими советами|Получите лицензию на недвижимость и станьте профессиональным агентом|Секреты успешного получения лицензии на недвижимость|Получение лицензии на недвижимость для начинающих: советы от экспертов|Процесс получения лицензии на недвижимость: ключевые моменты|Эффективные советы по успешному получению лицензии на недвижимость|Лицензия на недвижимость: важные аспекты для успешного получения
Real Estate Agent License in Oregon [url=https://realestatelicensehefrsgl.com/states/oregon-island-real-estate-license/]Real Estate Agent License in Oregon[/url] .
Netflix’s Top-Rated Movies for June 2024 on Rotten Tomatoes learn to swim movie soundtrackalison and the wonderland moviewhen do new episodes of industry come out
Stumbled upon an interesting article – I suggest you take a look http://x70795vj.beget.tech/2024/06/19/vash-diplom-kachestvo-i-podlinnost.html
Интересуетесь недвижимостью? Наш сайт – ваш надежный гид в этой области. Здесь вы найдете множество полезных статей на такие темы, как [url=https://abraziv-pferd.ru]квартиры от застройщика[/url], а также [url=https://abraziv-pferd.ru]оценка недвижимости[/url].
Подробные аналитические материалы, экспертные мнения и важные рекомендации — все это доступно у нас!
Anderson Sousa Conceicao better known as Talisca https://talisca.prostoprosport-ar.com is a Brazilian footballer who plays as a midfielder for the An-Nasr club. A graduate of the youth team from Bahia, where he arrived in 2009 ten years ago.
Yassine Bounou https://yassine-bounou.prostoprosport-ar.com also known as Bono, is a Moroccan footballer who plays as a goalkeeper for the Saudi Arabian club Al-Hilal and the Moroccan national team. On November 10, 2022, he was included in the official application of the Moroccan national team to participate in the matches of the 2022 World Cup in Qatar
https://kraken14attt.ru/ – kraken ссылка зеркало официальный сайт
Good day!
Master the Art of Branding! In today’s competitive market, branding is crucial. Discover the secrets to creating a brand that stands out and resonates with your audience.
Weekend Getaways! Break free with our weekend getaway ideas. Discover short trips for relaxation, adventure, and everything in between.
Look interesting site about this – https://visionarynexst.com
travel blogs
guides
small business
Mediterranean diet
news article
long-haul travel
financial stability
restaurant reviews
Goog luck!
her comment is here [url=https://my-jaxxwallet.com]jaxx wallet[/url]
vavada рабочее зеркало на сегодня
вавада казино онлайн
Full Article [url=https://localbitcoinsalternative.com]localbitcoins[/url]
Discovered an interesting article, I suggest you familiarize yourself https://кадастровая-карта-22.рф/zachem-nuzhen-eroticheskij-massazh/
My brother recommended I might like this blog. He was entirely right.
This post truly made my day. You can not imagine just how much time I had spent for this
information! Thanks!
Играйте в онлайн казино без риска и забот
онлайн казино [url=https://xn—–7kcbb2bhkdopfbdchb9byb3m.xn--90ais/]лучшие онлайн казино беларуси[/url] .
казино вавада
vavada casino зеркало
Игровые автоматы с моментальными выплатами на реальные деньги онлайн – казино леон
Всем привет! Подскажите, где найтиразные блоги о недвижимости? Пока нашел https://dompodkluch33.ru
https://telegra.ph/futbolnaya-statistika-06-26-2
Harry Edward Kane https://harry-kane.prostoprosport-ar.com is an English footballer, forward for the German club Bayern and captain of the England national team. Considered one of the best football players in the world. He is Tottenham Hotspur’s and England’s all-time leading goalscorer, as well as the second most goalscorer in the Premier League. Member of the Order of the British Empire.
срочный ремонт сотовых телефонов
Заходите на наш сайт, где вы найдете множество полезных статей на тему приемки квартиры в новостройке или покупки квартиры с черновой отделкой. Узнайте, как обезопасить себя от недобросовестных застройщиков, какие проверки провести перед покупкой жилья, и о многом другом!
https://citadel-ca.ru
Износостойкие урны для мусора на улице из металла, гарантируют долговечность и функциональность.
Урны мусорные бывают разных типов и размеров, подходящих для использования в различных местах и условиях: [url=http://www.urna-dlia-musora.ru/]http://www.urna-dlia-musora.ru/[/url] .
Искал автошколу в своем районе у м. Аэропорт или Сокол, там одна улица проходит. Считаю, что сделал неплохой выбор [url=http://gai-18.ru]автокурсы[/url]
Neymar da Silva Santos Junior https://neymar.prostoprosport-ar.com is a Brazilian footballer who plays as a striker, winger and attacking midfielder for the Saudi Arabian club Al-Hilal and the Brazilian national team. Considered one of the best players in the world. The best scorer in the history of the Brazilian national team.
Discovered an article that will surely interest you – I recommend checking it out http://karasteamfulldmroleplay.getbb.ru/ucp.php?mode=login&sid=5cb437d03c2270edd09860c873295d0a
https://telegra.ph/statistika-matchej-sport-06-26
Секреты успешного получения лицензии на недвижимость|Ключевая информация о лицензии на недвижимость|Станьте лицензированным агентом по недвижимости|Секреты быстрого получения лицензии на недвижимость|Инструкция по получению лицензии на недвижимость|Следуйте этим шагам для получения лицензии на недвижимость|Простой путь к получению лицензии на недвижимость|Шаг за шагом к лицензии на недвижимость|Три шага к успешной лицензии на недвижимость|Успешное получение лицензии на недвижимость: шаг за шагом|Процесс получения лицензии на недвижимость: как это работает|Как получить лицензию на недвижимость и стать успешным агентом|Получите лицензию на недвижимость и станьте профессионалом|Топ советы по получению лицензии на недвижимость|Советы по получению лицензии на недвижимость от профессионалов|Как получить лицензию на недвижимость без стресса|Получение лицензии на недвижимость: лучшие практики и советы|Инструкция по получению лицензии на недвижимость|Лицензия на недвижимость: ключ к успеху в индустрии недвижимости|Легко получите лицензию на недвижимость с этими советами|Как стать агентом по недвижимости с лицензией|Основные шаги к профессиональной лицензии на недвижимость|Инструкция по получению лицензии на недвижимость|Простой путь к получению лицензии на недвижимость|Эффективные советы по успешному получению лицензии на недвижимость|Сек
How to get a realtor license in Colorado [url=https://realestatelicensehefrsgl.com/states/colorado-real-estate-license/]https://realestatelicensehefrsgl.com/states/colorado-real-estate-license/[/url] .
ремонт мобильных телефонов
click this link here now [url=https://robloxhacks.fun/]exploits for roblox[/url]
Больше не нужно тратить время на поиски сервисного центра! https://wakelet.com/wake/nO0xGxWhxyRzUpGlweX3t – сервис, который решит вашу проблему. Сервис предлагает гарантию на все виды работ.
[url=https://chancekgvh15937.review-blogger.com/50293278/money-saving-guide-learn-the-steps-to-replace-your-washing-machine-s-belt]замена приводного ремня стиральной машины[/url]
ремонт стиральных машин недорого
ремонт стиральных машинок
ремонт машинок стиральных воронеж
Достижение положительного результата в освоении управления легковым автомобилем и получении водительских прав гарантирует автошкола с репутацией [url=http://avtopoisk43.ru/]автошкола в люблино[/url]
Л2
мастерская по ремонту телефонов
Erling Breut Haaland https://erling-haaland.prostoprosport-ar.com is a Norwegian footballer who plays as a forward for the English club Manchester City and the Norwegian national team. English Premier League record holder for goals per season.
Сервера л2
my review here [url=https://fortnitehacks.io/]free fortnite aimbot download[/url]
[url=https://cs2cheats.io/]the best cs2 free hack[/url] – free cs2 cheats, cs2 aimbot
Шаги к получению лицензии на недвижимость|Ключевая информация о лицензии на недвижимость|Как начать карьеру в недвижимости с лицензией|Успешные стратегии получения лицензии на недвижимость|Эффективные способы получения лицензии на недвижимость|Получите профессиональную лицензию на недвижимость|Простой путь к получению лицензии на недвижимость|Шаг за шагом к лицензии на недвижимость|Как получить лицензию на недвижимость: советы экспертов|Лицензия на недвижимость для начинающих: советы и рекомендации|Секреты профессиональной лицензии на недвижимость|Секреты скорого получения лицензии на недвижимость|Легкий путь к получению лицензии на недвижимость|Лицензия на недвижимость: ключ к успешной карьере|Советы по получению лицензии на недвижимость от профессионалов|Эффективные стратегии для успешного получения лицензии на недвижимость|Получение лицензии на недвижимость: лучшие практики и советы|Инструкция по получению лицензии на недвижимость|Ключевые моменты получения лицензии на недвижимость|Три шага к успешной лицензии на недвижимость|Получите лицензию на недвижимость и станьте профессиональным агентом|Основные шаги к профессиональной лицензии на недвижимость|Шаги к успешной лицензии на недвижимость|Процесс получения лицензии на недвижимость: ключевые моменты|Три шага к профессиональной лицензии на недвижимость|Лицензия на недвижимость: важные аспекты для успешного получения
How do I get my real estate license in Massachusetts [url=https://realestatelicensehefrsgl.com/states/massachusetts-real-estate-license/]How do I get my real estate license in Massachusetts[/url] .
У нас вы найдете информационные статьи на тему недвижимости, например, отделка квартиры с нуля, продажа и покупка недвижимости, юридическое сопровождение сделки.
Узнайте все нюансы, которые помогут вам принять верное решение и провести успешную сделку с недвижимостью. Наши статьи помогут вам быть в курсе последних новостей и законов жилищного рынка, а также избежать ошибок.
http://domzenit.ru
Discovered an article that will definitely interest you – don’t miss the chance to familiarize yourself http://publikacii.listbb.ru/viewtopic.php?f=3&t=623
Всем привет! Может кто знает, где найтиполезные блоги о недвижимости? Сейчас читаю https://eniseyburvod.ru
This tool will assistance you approximate the monthly payments on your next auto buy.
Check out my website – https://woodsrunners.com/index.php/Unlocking_The_Door_To_Growth:_Business_Loan_Essentials
Ali al-Buleahi https://ali-al-bulaihi.prostoprosport-ar.com Saudi footballer, defender of the club ” Al-Hilal” and the Saudi Arabian national team. On May 15, 2018, Ali al-Buleakhi made his debut for the Saudi Arabian national team in a friendly game against the Greek team, coming on as a substitute midway through the second half.
blog here [url=https://fortniteskinchanger.org/]free galaxy swapper key[/url]
Luka Modric https://lukamodric.prostoprosport-ar.com is a Croatian footballer, central midfielder and captain of the Spanish club Real Madrid, captain of the Croatian national team. Recognized as one of the best midfielders of our time. Knight of the Order of Prince Branimir. Record holder of the Croatian national team for the number of matches played.
переезд минск [url=https://pereezdminsk.ru/]переезд минск [/url] .
gaggenau сервис
Секреты успешного получения лицензии на недвижимость|Легко и быстро получите лицензию на недвижимость|Станьте лицензированным агентом по недвижимости|Секреты быстрого получения лицензии на недвижимость|Эффективные способы получения лицензии на недвижимость|Полезные советы по получению лицензии на недвижимость|Простой путь к получению лицензии на недвижимость|Шаг за шагом к лицензии на недвижимость|Три шага к успешной лицензии на недвижимость|Успешное получение лицензии на недвижимость: шаг за шагом|Секреты профессиональной лицензии на недвижимость|Секреты скорого получения лицензии на недвижимость|Легкий путь к получению лицензии на недвижимость|Лицензия на недвижимость: ключ к успешной карьере|Профессиональные советы по получению лицензии на недвижимость|Эффективные стратегии для успешного получения лицензии на недвижимость|Шаги к успешной лицензии на недвижимость|Инструкция по получению лицензии на недвижимость|Ключевые моменты получения лицензии на недвижимость|Легко получите лицензию на недвижимость с этими советами|Как стать агентом по недвижимости с лицензией|Как получить лицензию на недвижимость быстро и легко|Шаги к успешной лицензии на недвижимость|Секреты быстрого получения лицензии на недвижимость|Три шага к профессиональной лицензии на недвижимость|Сек
How to get real estate license in New Jersey [url=https://realestatelicensehefrsgl.com/states/new-jersey-real-estate-license/]How to get real estate license in New Jersey[/url] .
Opened up interesting material – I recommend sharing this discovery http://sensemi.getbb.ru/viewtopic.php?f=6&t=563
resource [url=https://fortnitehacks.io/]hacks for fortnite[/url]
ремонт телефонов поблизости
Читайте интересные статьи на важные темы, связанные с покупкой жилья, например приемка квартиры в новостройке или стоимость недвижимости в Москве.
Сайт: https://ooo-trotuar.ru
game was designed to provide an adrenaline-pumping experience that mimics the thrill of gambling with a twist.
tigrinho demo
สวัสดีครับทุกคนช่วงนี้ผมได้ทดลองเล่น คาสิโนออนไลน์เว็บตรง168 จากหลายเว็บไซต์รวมทั้งจำต้องบอกว่าประสบการณ์ค่อนข้างจะดีเลยขอรับ มีเกมให้เลือกเล่นหลากหลายไม่ว่าจะเป็นบาคาร่า168, เกมสสล็อต, รูเล็ต คืออะไร และฯลฯ สิ่งที่ผมถูกใจที่สุดเป็นความสบายสบาย สามารถเล่นได้ทุกที่ทุกเวลา ไม่ต้องเดินทางไปถึงคาสิโนจริงๆ
สิ่งสำคัญที่ผมอยากแชร์เป็นการเลือกเว็บที่น่าเชื่อถือครับ ควรจะตรวจสอบรีวิวและก็การรับรองจากผู้ใช้งานอื่นๆเพื่อป้องกันการเช็ดกทุจริต นอกเหนือจากนั้น อย่าลืมตั้งงบประมาณในการเล่นและไม่เล่นเกินงบที่กำหนดไว้นะครับ เพื่อป้องกันปัญหาทางการคลังในอนาคต
มีคนไหนกันแน่มีเว็บ คาสิโนทดลอง ที่ต้องการชี้แนะบ้างไหมนะครับ? หรือมีประสบการณ์อะไรที่อยากแชร์? มาเสวนากันครับผมขอบคุณขอรับ
ремонт телефонов ближайший ко мне
buy 500 tiktok followers tiktok buy followers
гаггенау сервисный центр
[url=https://cs2skinchanger.com/]cs2 inspect[/url] – cs2 skin changer free, skin changer cs 2
buy 10k tiktok followers buy tiktok followers tokmatic
Всем привет! Может кто знает, где почитатьразные блоги о недвижимости? Пока нашел https://etalon-voda.ru
ремонт телефонов в москве
NFTs are being created for diverse assets. The broadcast is linked to the validator’s address. how functions https://doge-coin20.io/ work?
http://atvbizon.ru/
Playing the Aviator Game involves a few simple steps:
jogo do tigrinho demo
где отремонтировать телефон
[url=https://vyzov-santehnika-na-dom.ru]https://vyzov-santehnika-na-dom.ru[/url].
Желаете стать экспертом в сфере недвижимости? Наш ресурс – это ваш незаменимый помощник! Мы предлагаем огромное количество полезных статей на такие темы, как [url=https://opk-ekb.ru]покупка квартиры в новостройке[/url], а также [url=https://opk-ekb.ru]продажа жилья[/url]. Наши эксперты поделятся с вами инсайтами, чтобы помочь вам принимать обоснованные решения в сфере недвижимости!
Наши – это гарантия качества и надежности.
What’s Hot on Netflix? June 2024 Best Movies Ranked by Rotten Tomatoes bobs.burger movieindian action movies on netflixmovies based on regency romance
https://besuchszweck.org/
increase the excitement of the game.
jogo do tigrinho
https://lavirgule.news/
На сайте https://dekorativnye-shtukaturki-77.ru/ в огромном многообразии находится декоративная штукатурка. Она необходима для того, чтобы разнообразить интерьер и сделать его более стильным и ярким. Для того чтобы принять окончательное решение, необходимо ознакомиться с каталогом. Штукатурка дает возможность создать удивительные узоры, интересные рисунки, которые станут яркой деталью. Этот материал отличается экологической чистотой, он полностью безопасен для здоровья людей, животных.
Всем привет! Может кто знает, где найтиразные статьи о недвижимости? Пока нашел https://floor-ashton.ru
Red Dog Casino offers a myriad of mobile games, including roulette.
Feel free to surf to my page … https://www.sediul.ro/index.php/User:Hans841273947
https://besuchszweck.org/
Лучшей версией windows 7 для геймов является Профессиональная версия, в связи с тем, что она воспроизводит игры с хорошей частотой кадров,.
my web blog – https://ky-ky.net/en/
Хотите узнать всё о процессе [url=https://potolokperm59.ru]оформления квартиры в новостройке[/url]?
Наш интернет-ресурс предлагает вам самые актуальные статьи на такие темы, как: [url=https://potolokperm59.ru]оформление документов на недвижимость через МФЦ[/url], [url=https://potolokperm59.ru]ипотечное кредитование[/url].
Здесь вы найдете ответы на все вопросы и получите полную информацию о процессе регистрации жилья в собственность.
https://lavirgule.news/
https://maps.google.com.qa/url?q=https://aktivnoe.forum24.ru/?1-9-0-00000577-000-0-0-1718801658
There are numerous online communities and forums where Aviator Game enthusiasts can share tips, strategies, and
fortune tiger
https://interventionist.us/
magnificent publish, very informative. I wonder why the opposite specialists of this sector don’t realize this.
You must continue your writing. I am sure, you have
a huge readers’ base already!
my website [url=https://my-jaxxwallet.com/]jaxx liberty download[/url]
I have been exploring for a little for any high-quality articles or weblog
posts on this kind of area . Exploring in Yahoo I at last stumbled upon this site.
Reading this information So i am happy to express that I’ve
a very just right uncanny feeling I discovered exactly what I needed.
I so much no doubt will make sure to don?t overlook this web site and provides it a look regularly.
Discovered an article that will surely interest you – I recommend checking it out https://raid4x4.ru/viewtopic.php?f=2&t=11025&sid=8be19bcd87d4021fd2a632424bf1b397
Ознакомьтесь с Twin казино обзоры и узнайте о всех его возможностях
[url=https://dbshop.ru/services/shumoizolyatsiya/shumoizolyacziya-kryshi/]шумоизоляция крыши автомобиля цена[/url] – изготовление подиумов для дверных карт, короб для труб
[url=https://mounjaro-5mg.ru/mundzharo]mounjaro lilly[/url] – муджаро препарат, тирзепатид инструкция +по применению купить +в москве
[url=https://kraken14attt.ru/]кракен14ат[/url] – kraken ссылка зеркало официальный, kraken darknet market
ScottishTension nude strip on cam for live sex video chat
[url=http://thinktoy.net/bbs/board.php?bo_table=customer2&wr_id=378068]Nude amateur webcam[/url][url=http://www.kiccoltd.co.kr/bbs/board.php?bo_table=free&wr_id=767398]Naked hot webcams g[/url] 20f5_9b
средства для интимной гигиены гели Средства для интимной гигиены IntiLINE
Stumbled upon a unique article, I suggest you take a look http://allonlinesport.ru/kupit-diplom-dlya-vashego-uspeha/
The best film magazin https://orbismagazine.com, film industry trade publications in 2024 to keep you informed with the latest video production, filmmaking, photographynews. We create beautiful and magnetic projects.
his explanation [url=https://jaxxliberty.io/]jaxx download[/url]
hop over to this site [url=https://localbitcoinsalternative.com]localbitcoins login[/url]
social interaction adds a new layer of excitement and competition to the game, making it more engaging and
tigrinho
Ищете проверенный сервис по ремонту техники Indesit? Рекомендуем обратиться к профессионалам https://trentonmgxn53210.diowebhost.com/83080376/increasing-the-longevity-of-your-indesit-appliances-with-professional-maintenance . Здесь вы найдете информация о различных видах ремонта Indesit, и сможете оформить заявку на ремонт. Не рискуйте, обращаясь к неопытным мастерам.
[url=https://spencerewmc10875.arwebo.com/51029607/maximizing-the-lifespan-of-your-indesit-appliances-with-professional-servicing]индезит сервис[/url]
сервис indesit
ремонт холодильников индезит
indesit сервис центр
Всем привет! Подскажите, где почитатьполезные блоги о недвижимости? Сейчас читаю https://gismt72.ru
[url=https://exhubio.com]купить крипту[/url] – обменник криптовалют, купить бтк
https://interventionist.us/
Мама всегда поддерживала меня, и я хотела сделать ей особенный подарок на юбилей. Но, как назло, в этот момент не хватило денег, а моя кредитная история оставляла желать лучшего. Я вспомнила про Телеграм канал [url=https://t.me/s/mfo_2024_online]все займы онлайн новые[/url] . На этом канале я нашла много предложений от новых МФО, которые давали займы всем. Оформила займ за 10 минут, и деньги сразу поступили на счет. Благодаря этому займу я смогла купить маме подарок, о котором она давно мечтала, и устроить ей незабываемый праздник.
Если хотите [url=https://turkhit.tv/]турецкий сериал смотреть онлайн на русском[/url], сайт turkhit.tv станет идеальным выбором. Здесь представлены сериалы различных жанров: мелодрамы, триллеры, боевики. Все сериалы доступны в HD качестве и с русской озвучкой.
Платформа не требует регистрации и оплаты, что делает просмотр еще удобнее. На сайте можно найти как новинки, так и классические сериалы, такие как “Ветреный холм” и “Мехмед: Султан Завоеватель”. Заходите на turkhit.tv и наслаждайтесь любимыми турецкими сериалами в любое время.
https://kraken14attt.ru – kraken официальный сайт
https://dr-nona.ru/ – доктор нонна
На нашем сайте вы сможете найти всю необходимую информацию о недвижимости – от бронирования жилья в новостройке до приобретения недвижимости от застройщика.
Мы поможем вам выбрать идеальную квартиру в новостройке, расскажем, как не попасть в ловушку при выборе жилья и подскажем, как сэкономить время и деньги.
Ждём в гости: https://quartz-rsk.ru
https://livecamsporno.com/
ТК АзияТорг: Надежный Партнер в Мире Сетевого и Телекоммуникационного Оборудования
В современном бизнесе успех определяется скоростью и качеством коммуникаций. ТК АзияТорг, с более чем пятилетним опытом, представляет собой ведущего поставщика сетевого и телекоммуникационного оборудования, а также серверов для бизнеса. Наши клиенты и партнеры доверяют нам благодаря нашему безупречному обслуживанию и высококачественной продукции.
## Почему ТК АзияТорг?
### Широкий Ассортимент Оборудования
Мы предлагаем широкий спектр сетевого и телекоммуникационного оборудования, а также серверов, которые идеально подходят для любых бизнес-задач. Наша продукция отвечает самым высоким стандартам качества и надежности, что обеспечивает бесперебойную работу ваших систем.
### Профессиональное Сотрудничество
Более пяти лет успешного сотрудничества с клиентами и поставщиками доказывают нашу репутацию надежного партнера. Мы всегда стремимся к долгосрочным и взаимовыгодным отношениям, предлагая индивидуальный подход и гибкие условия сотрудничества.
### Филиал в Гуанчжоу
Наличие собственного филиала в Гуанчжоу позволяет нам быть ближе к нашим азиатским партнерам и поставщикам, что обеспечивает оперативные поставки и конкурентные цены. Это стратегическое расположение также дает нам возможность быстро реагировать на изменения рынка и потребности клиентов.
### Комплексные Финансово-Логистические Услуги
Мы предлагаем финансово-логистические услуги “под ключ”, которые включают в себя все этапы — от закупки оборудования до его доставки и установки. Наши эксперты берут на себя все заботы, связанные с транспортировкой и таможенным оформлением, что позволяет вам сосредоточиться на развитии бизнеса.
## Доверие и Качество
ТК АзияТорг стремится предоставлять только лучшее оборудование и услуги, чтобы помочь вашему бизнесу достигать новых высот. Мы гордимся нашей репутацией и всегда нацелены на совершенствование всех аспектов нашей деятельности. Доверяйте нам, и вы получите надежного партнера, который всегда готов поддержать ваш бизнес и помочь ему расти.
Свяжитесь с нами сегодня и узнайте, как ТК АзияТорг может помочь вашему бизнесу стать еще успешнее!
Also visit my website: http://a1pay06.com/bbs/board.php?bo_table=free&wr_id=1996088
[b]Здравствуйте[/b]!
Задумался а действительно можно купить диплом государственного образца в Москве, и был удивлен, все реально и главное официально!
Сначала серфил в сети и искал такие темы как: купить диплом о среднем специальном, купить свидетельство о заключении брака, купить диплом в ейске, купить диплом в шахтах, купить дипломы о высшем образовании цена, получил базовую информацию.
Остановился в итоге на материале купить диплом россия, http://piter.forenger.com/viewtopic.php?id=1359#p4335
Успешной учебы!
Write more, thats all I have to say. Literally, it seems as though you relied on the
video to make your point. You clearly know what youre talking about, why waste your intelligence on just posting videos to your blog when you could be giving us something enlightening to
read?
social interaction adds a new layer of excitement and competition to the game, making it more engaging and
п»їtigrinho demo
Very good data, Thanks a lot!
https://avesis.yyu.edu.tr/melayik/yayinlar
акустическое оборудование для актового зала [url=http://oborudovanie-aktovogo-zala13.ru]акустическое оборудование для актового зала[/url] .
“Как правильно наносить маски для лица?” – “Маски следует наносить на чистую, сухую кожу, избегая области вокруг глаз и губ, и следовать инструкциям по времени выдержки.”
“How to properly apply face masks?” – “Masks should be applied to clean, dry skin, avoiding the eye and lip areas, and follow the recommended duration on the instructions.”
философия красоты и здоровья врачи [url=http://biitdom.ru/]http://biitdom.ru/[/url] .
Nice articl! Just check Myrtle_Beach naked strip on cam for live sex video chat this out!
[url=http://remote.ecostm.co.kr/bbs/board.php?bo_table=c1&wr_id=12050]Nude hot webcams mo[/url][url=http://www.globaldream.or.kr/bbs/board.php?bo_table=sub08_02&wr_id=595]Nude amateur webcam[/url] 656eb76
Всем привет! Подскажите, где почитатьполезные статьи о недвижимости? Сейчас читаю https://kait-volga.ru
You could definitely see your skills in the article you write.
The sector hopes for even more passionate writers such
as you who are not afraid to say how they believe.
Always follow your heart.
Excellent and high-quality Danielle Sky nude on webcam – live porn chat absolutely free and easy to watch on any device, just
[url=https://sample115.tlogsir.com/bbs/board.php?bo_table=tl_product02&wr_id=325]Naked amateur cams[/url][url=http://thinktoy.net/bbs/board.php?bo_table=customer2&wr_id=379429]Naked amateur cams[/url] 20f1_56
slothana (SLOTH), one of the most famous and anticipated meme coins, https://https://slothana-coin.io// recently announced the completion of its presale and the upcoming launch of its sloth token.
There are numerous online communities and forums where Aviator Game enthusiasts can share tips, strategies, and
tigrinho demo gratis
Секс-работа в столице является запутанной и многогранной темой. Хотя это запрещена законом, данная сфера является значительным подпольным сектором.
Исторический
В Союзные периоды секс-работа существовала незаконно. С распадом Советской империи, в обстановке хозяйственной нестабильной ситуации, она стала быть более видимой.
Современная обстановка
Сейчас коммерческий секс в Москве имеет разные виды, начиная с престижных эскорт-сервисов и до уличного уровня секс-работы. Высококлассные услуги обычно организуются через сеть, а публичная интимные услуги располагается в специфических зонах Москвы.
Социально-экономические аспекты
Множество девушки приходят в этот бизнес вследствие денежных затруднений. Интимные услуги может оказаться привлекательной из-за шанса быстрого дохода, но она связана с риски для здоровья и охраны здоровья.
Юридические аспекты
Проституция в Российской Федерации нелегальна, и за её проведение предусмотрены серьезные санкции. Проституток регулярно задерживают к юридической ответственности.
Таким способом, несмотря на запреты, секс-работа существует как частью незаконной экономики города с большими социально-правовыми последствиями.
девушки по вызову в москве
NGolo Kante https://ngolokante.prostoprosport-ar.com is a French footballer who plays as a defensive midfielder for the Saudi Arabian club Al-Ittihad and the French national team. His debut for the first team took place on May 18, 2012 in a match against Monaco (1:2). In the 2012/13 season, Kante became the main player for Boulogne, which played in Ligue 3.
Ваш автомобиль заслуживает лучшего – выберите .
[url=https://cs2skinchanger.com/]skin cs2[/url] – skin cs2, skin changer cs2 download
Excellent and high-quality —mei nude strip on cam for online sex movie webcam chat absolutely free and easy to watch on any device, just
[url=http://remote.ecostm.co.kr/bbs/board.php?bo_table=c1&wr_id=12064]Naked hot cams gir[/url][url=http://thinktoy.net/bbs/board.php?bo_table=customer2&wr_id=379651]Naked amateur cams[/url] 201210a
[url=https://griezmann-antoine-fr.biz]griezmann-antoine-fr.biz[/url]
play in diablo game here
griezmann
http://www.compagnie-eco.com/eco/mafalda-1-4/
[url=https://cs2cheats.io/]cs 2cheats free download[/url] – cs2 free cheats, cs 2 cheats
https://haber.sol.org.tr/haber/olum-sayilari-gercegi-turkiye-gercekten-basarili-mi-2922
says:Just check this out, renapiyon8182 fully nude stripping on cam for online sex video show for free!
[url=https://naeunhome.cafe24.com/bbs/board.php?bo_table=review&wr_id=379]Nude hot webcams gi[/url][url=https://sample115.tlogsir.com/bbs/board.php?bo_table=tl_product02&wr_id=328]Nude amateur webcam[/url] a5515b3
cryptokitties resemble digital Pokemon cards, however with proof of ownership recorded on the blockchain. they may differ from digital coins, https://wafflestoken.com/ that play a central role in own systems.
become more comfortable with the gameplay. Observing patterns and understanding the timing of the plane’s ascent
fortune tiger demo
辣財神幣商
Ruben Diogo da Silva Neves https://ruben-neves.prostoprosport-ar.com is a Portuguese footballer who plays as a midfielder for the Saudi Arabian club Al-Hilal and the Portuguese national team. Currently, Ruben Neves plays for the Al-Hilal club wearing number 8. His contract with the Saudi club is valid until the end of June 2026.
Nice article, thanks! Just check AlenaCroft fully nude on cam – online porn chat this out.
[url=https://toteblogs.com/posts/Best-Vitamin-C-Serums-for-Brighter-Skin-]Nude hot webcams woman live sex char[/url][url=https://trust-used.com/best-gaming-laptop-models/]Nude hot cams woman live porn show[/url] 5515b35
The component-https://anjumslist.com/index.php?title=User:DorotheaHuondeKe day program requires five years, but can be shortened to four years with summer time study.
Какая рекомендованная уходовая рутина для кожи, склонной к акне? – Рекомендуется использовать нежные очищающие средства, некомедогенные увлажняющие кремы и продукты с активными ингредиентами, такими как салициловая кислота или бензоилпероксид.
What skincare routine is recommended for acne-prone skin? – A gentle cleanser, non-comedogenic moisturizers, and products with active ingredients like salicylic acid or benzoyl peroxide are recommended.
Лучшие дерматологи москвы лечение акне [url=http://www.lechenie-akne.ru]http://www.lechenie-akne.ru[/url] .
bar immobilien montenegro immobilien von privat kaufen
Лучшие средства для химчистки кожаного дивана в Москве.
Чистка кожаного дивана на дому удобна и позволяет избежать необходимости перемещения тяжёлой мебели: [url=https://www.ximchistka-divanov-kozha.ru/]https://www.ximchistka-divanov-kozha.ru/[/url] .
Online Communities and Forums
jogo do tigrinho
Приветствую. Подскажите, где найтиполезные блоги о недвижимости? Сейчас читаю https://kaluga-elite.ru
[url=https://griezmann-antoine-fr.biz]griezmann antoine[/url]
play in diablo game here
griezmann
Excellent and high-quality shaarebaare nude stripping on cam for online sex movie show absolutely free and easy to watch on any device, just
[url=http://test.aocoolers.co.kr/bbs/board.php?bo_table=pension&wr_id=85]Naked amateur webca[/url][url=https://community.katawatbusiness.com/question/nude-hot-webcams-model-online-porn-show-2/]Nude hot webcams model online porn show[/url] 0a7a551
Хотите быть в курсе всех актуальных тем в сфере недвижимости?
На нашем портале вы найдете множество полезных статей о [url=https://starextorg.ru]покупке и продаже жилья[/url], а также о [url=https://starextorg.ru]ипотеке[/url].
Узнайте все, что вам необходимо для успешных сделок и принятия взвешенных решений в сфере недвижимости.
to your liking, and quickly move to the section with Zoee fully nude before webcam – Live Porn Show on this topic. All categories are packed enough to make
[url=http://ecostm.co.kr/bbs/board.php?bo_table=c1&wr_id=12090]Naked hot webcams g[/url][url=https://sample115.tlogsir.com/bbs/board.php?bo_table=tl_product02&wr_id=336]Naked amateur cams[/url] 1210a7a
зниження ваги визнаний {одним з/, мабуть, одним з} закономірних результатів програми ” Тюнінг https://ibio.com.ua/ “.
vera farmiga movies and tv shows free essential graphics premiere promovie theater greenfield wisanta ana movie theater
Multiplayer Options and Social Interaction
jogo do tigrinho demo
Kobe Bean Bryant https://kobebryant.prostoprosport-ar.com is an American basketball player who played in the National Basketball Association for twenty seasons for one team, the Los Angeles Lakers. He played as an attacking defender. He was selected in the first round, 13th overall, by the Charlotte Hornets in the 1996 NBA Draft. He won Olympic gold twice as a member of the US national team.
台灣線上娛樂城是指通過互聯網提供賭博和娛樂服務的平台。這些平台主要針對台灣用戶,但實際上可能在境外運營。以下是一些關於台灣線上娛樂城的重要信息:
1. 服務內容:
– 線上賭場遊戲(如老虎機、撲克、輪盤等)
– 體育博彩
– 彩票遊戲
– 真人荷官遊戲
2. 特點:
– 全天候24小時提供服務
– 可通過電腦或移動設備訪問
– 常提供優惠活動和獎金來吸引玩家
3. 支付方式:
– 常見支付方式包括銀行轉賬、電子錢包等
– 部分平台可能接受加密貨幣
4. 法律狀況:
– 在台灣,線上賭博通常是非法的
– 許多線上娛樂城實際上是在國外註冊運營
5. 風險:
– 由於缺乏有效監管,玩家可能面臨財務風險
– 存在詐騙和不公平遊戲的可能性
– 可能導致賭博成癮問題
6. 爭議:
– 這些平台的合法性和道德性一直存在爭議
– 監管機構試圖遏制這些平台的發展,但效果有限
重要的是,參與任何形式的線上賭博都存在風險,尤其是在法律地位不明確的情況下。建議公眾謹慎對待,並了解相關法律和潛在風險。
如果您想了解更多具體方面,例如如何識別和避免相關風險,我可以提供更多信息。
Stella naked strip before cam for online porn show absolutely free and easy to watch on any device, just
[url=https://sample115.tlogsir.com/bbs/board.php?bo_table=tl_product02&wr_id=338]Nude amateur cams[/url][url=http://hantechfa.com/bbs/board.php?bo_table=free&wr_id=16605]Nude hot cams girl[/url] a5515b3
https://lebelligerant.com/
Hello,
What a good blog!
Can I scrape this and share this with my community
subscribers?
My community is about Korean BJ야동
If ever you are interested, feel free to come to my site and have a look.
Thanks a lot and Keep up the good work!
https://pornkingcams.com/
https://polskikompas.com/
Excellent and high-quality Nelly fully naked strip before cam for live porn chat absolutely free and easy to watch on any device, just
[url=http://www.globaldream.or.kr/bbs/board.php?bo_table=sub08_02&wr_id=610]Nude amateur webcam[/url][url=http://shinyoungwood.co.kr/bbs/board.php?bo_table=free&wr_id=784451]Naked amateur webca[/url] bba3656
https://win-line.net/מכונות-מזל-על-כסף-אמיתי/
לבצע, ראיה לדבריך.
ההמרה באינטרנט הפכה לנישה פופולרי מאוד לאחרונה, המספק אפשרויות מגוונות של אופציות התמודדות, כמו משחקי פוקר.
בסיכום זה נסקור את תעשיית הפעילות המקוונת ונייעץ לכם פרטים חשובים שיעזור לכם להבין באזור מעניין זה.
הימורי ספורט – התמודדות באינטרנט
הימורי ספורט כולל מגוון רחב של אפשרויות מוכרים כגון פוקר. ההתמודדות באינטרנט מאפשרים למשתתפים להשתתף מאווירת פעילות אמיתית בכל עת ומקום.
הפעילות תיאור קצר
מכונות פירות משחקי מזל
רולטה הימור על מספרים ואפשרויות על גלגל מסתובב בצורה עגולה
משחק קלפים 21 משחק קלפים להשגת ניקוד של 21
פוקר התמודדות אסטרטגית בקלפים
באקרה משחק קלפים קל וזריז
הימורים בתחום הספורט – קזינו באינטרנט
התמרמרות ספורטיבית מהווים חלק מ אחד התחומים המתפתחים המובילים ביותר בהימורים באינטרנט. משתתפים יכולים להמר על פרמטרים של אירועי ספורט מושכים כגון כדורגל.
העסקאות יכולים להיות על הביצועים בתחרות, מספר העופרות ועוד.
אופן ההתמודדות פירוט ענפי ספורט נפוצים
ניחוש תוצאה ניחוש התוצאה הסופית של התחרות כדורגל, כדורסל, אמריקאי
הפרש ביצועים ניחוש ההפרש בתוצאות בין הקבוצות כדורגל, כדורסל, הוקי
כמות הביצועים ניחוש כמה שערים או נקודות יהיו במשחק כדורגל, כדורסל, טניס
המנצח בתחרות ניחוש מי יהיה הזוכה (ללא קשר לתוצאה) כל ענפי הספורט
הימורי חי הימורים במהלך המשחק בזמן אמת כדורגל, טניס, קריקט
הימורים משולבים שילוב של מספר הימורים שונים מספר ענפי ספורט
פעילות פוקר מקוונת – הימורים באינטרנט
התמודדות בפוקר מקוון מייצג אחד מתחומי ההימורים המרכזיים הגדולים ביותר בתקופה הנוכחית. שחקנים רשאים להשתתף עם מתמודדים אחרים מרחבי הגלובוס בסוגים ש
improvements have not only made the game more appealing but also more accessible to a wider audience.
п»їtigrinho demo
Приветствую. Может кто знает, где найтиполезные статьи о недвижимости? Сейчас читаю https://kamenolomnya43.ru
https://lebelligerant.com/
says:Just check this out, Carolina naked webcam – online sex webcam chat for free!
[url=https://community.katawatbusiness.com/question/nude-hot-cams-model-online-porn-char/]Nude hot cams model online porn char[/url][url=http://remote.ecostm.co.kr/bbs/board.php?bo_table=c1&wr_id=12103]Nude hot webcams mo[/url] 56eb762
[b]Привет, друзья[/b]!
Всегда считал, что покупка диплома о высшем образовании — это миф и невозможно. Но, к счастью, оказался неправ. Сначала искал информацию по теме: купить диплом в воронеже, купить диплом в озёрске, купить диплом в магнитогорске, купить диплом в елабуге, #купить свидетельство о разводе, а затем переключился на дипломы вузов. Подробности здесь: http://verkehrsknoten.de/index.php/forum/sozialvorschriften/84995#85949
Оказалось, что все реально и легально, со специальными условиями и упрощенными программами. Теперь у меня диплом московского вуза нового образца, что я настоятельно рекомендую и вам!
Хорошей учебы!
https://polskikompas.com/
History and Development
fortune tiger
Discover the best Ellie fully nude strip before cam for live porn chat ever for free!
[url=http://test.aocoolers.co.kr/bbs/board.php?bo_table=pension&wr_id=90]Naked hot cams wom[/url][url=https://community.katawatbusiness.com/question/naked-amateur-cams-girls-online-sex-char/]Naked amateur cams girls online sex char[/url] 35f320f
Купити ліхтарики https://bailong-police.com.ua оптом та в роздріб, каталог та прайс-лист, характеристики, відгуки, акції та знижки. Купити ліхтарик онлайн з доставкою. Відмінний вибір ліхтарів: налобні, ручні, тактичні, ультрафіолетові, кемпінгові, карманні за вигідними цінами.
https://images.google.sc/url?q=https://boltyshki.unoforum.pro/?1-2-0-00007737-000-0-0-1718801148
Wow, awesome blog layout! How long have you been blogging for?
you make blogging look easy. The overall look of your website is
excellent, let alone the content!
вилла на кипре на берегу
Приветствую. Подскажите, где найтиполезные статьи о недвижимости? Пока нашел https://kmzperm.ru
to your liking, and quickly move to the section with Ncfyv_ncyuhv naked strip before cam for live sex chat on this topic. All categories are packed enough to make
[url=https://www.iunobenessere.it/come-combattere-la-cellulite/]Nude amateur webcams woman online sex char[/url][url=https://naeunhome.cafe24.com/bbs/board.php?bo_table=review&wr_id=386]Nude amateur webcam[/url] 0a7a551
Many online platforms host competitive tournaments and events for the Aviator Game. These events offer players
tigrinho demo gratis
Amazing all kinds of amazing info.
Продажа подземных канализационных ёмкостей https://neseptik.com по выгодным ценам. Ёмкости для канализации подземные объёмом до 200 м3. Металлические накопительные емкости для канализации заказать и купить в Екатеринбурге.
срочный ремонт айфона [url=http://www.iphonepochinka.by]http://www.iphonepochinka.by[/url] .
The most stunning transsexual shows on Stripchat. Popular trans chat rooms on free live sex cams. Watch, flirt, and have fun with trans cam models [url=https://bestshemalecams.com/]live ts cam[/url]
[b]Здравствуйте[/b]!
Хочу поделиться своим опытом по заказу аттестата ПТУ. Думал, что это невозможно, и начал искать информацию в интернете по теме: купить дипломы о высшем цены, купить диплом о среднем, купить диплом провизора, купить диплом медсестры, купить диплом сантехника. Постепенно углубляясь в тему, нашел отличный ресурс здесь: https://total-bookmark.com/story17246507/%D0%BC%D0%B8%D1%80%D0%BE%D0%BB%D0%B8%D0%BC%D0%BF%D0%B8%D0%B0%D0%B4-%D0%BF%D0%BE%D0%BB%D1%83%D1%87%D0%B8%D1%82%D1%8C-%D0%B4%D0%B8%D0%BF%D0%BB%D0%BE%D0%BC и остался очень доволен!
Теперь у меня есть диплом сварщика о среднем специальном образовании, и я обеспечен на всю жизнь!
Удачи!
недвижимость на южном кипре
Excellent and high-quality Meganmorris8 naked on Live Adult Webcams Girls absolutely free and easy to watch on any device, just
[url=https://toteblogs.com/posts/Best-Vitamin-C-Serums-for-Brighter-Skin-]Nude amateur cams model live porn char[/url][url=https://community.katawatbusiness.com/question/nude-amateur-cams-girls-live-sex-char/]Nude amateur cams girls live sex char[/url] bba3656
виллы кипр
Lebron Ramone James https://lebronjames.prostoprosport-ar.com American basketball player who plays the positions of small and power forward. He plays for the NBA team Los Angeles Lakers. Experts recognize him as one of the best basketball players in history, and a number of experts put James in first place. One of the highest paid athletes in the world.
у моря недорого кипр недвижимость
Добро пожаловать на GPSPhone.ru! Определение местоположения по номеру телефона онлайн! ??
?? Не можете найти свой телефон? Бесплатно отследите его по номеру через спутник прямо сейчас! ??
??? Узнайте местоположение по номеру телефона онлайн на карте России с помощью геолокации! ???
?? Наш сервис позволяет найти телефон по номеру через спутник бесплатно без регистрации! ??
?? Отследите местоположение человека в реальном времени онлайн без регистрации! ??
?? Поиск по номеру телефона и определение местоположения стали проще! Попробуйте прямо сейчас на GPSPhone.ru! ??
Найдите телефон по номеру и узнайте местоположение онлайн с нашим удобным и бесплатным сервисом! ??
[url=https://gpsphone.ru/]Геолокация по номеру телефона[/url]
Reputable online platforms offering the Aviator Game are licensed and regulated by governing bodies. This
tigrinho demo
Hello! I’m at work surfing around your blog
from my new iphone! Just wanted to say I love
reading your blog and look forward to all your posts! Carry on the outstanding work!
Ellie live chat nude before webcam – Live Chaturbate absolutely free and easy to watch on any device, just
[url=http://thinktoy.net/bbs/board.php?bo_table=customer2&wr_id=382627]Nude hot webcams wo[/url][url=http://www.kiccoltd.co.kr/bbs/board.php?bo_table=free&wr_id=771949]Nude hot cams woma[/url] 201210a
Привет игроки!
1win – это отличное место для ставок и казино. Простая регистрация, приятные бонусы, быстрые выплаты. Рабочее зеркало доступно всегда. Играю с удовольствием, рекомендую всем любителям азартных игр! [url=]контора 1win ru win one site[/url]
Играю на 1win уже несколько месяцев. Бонусы радуют, вывод денег быстрый, рабочее зеркало всегда доступно. Регистрация простая, сайт удобен. Рекомендую 1win всем, кто ищет надежное место для ставок и казино!
Ловите сайт где все в лучшем виде! – https://1winapk.kz
1win компания отзывы
какие слоты самые выигрышные в 1win
1win вип
1win технические работы
скачать приложение 1win бесплатно
1win как поставить бонус
как снять деньги с 1win
Удачи!
Приветствую. Может кто знает, где найтиполезные статьи о недвижимости? Пока нашел https://kovry159.ru
enjoyable.
aviator game demo
Came across an interesting article, I propose you have a look http://amtest.mybb.ru/viewtopic.php?id=385#p905
Maria Sharapova https://maria-sharapova.prostoprosport-ar.com Russian tennis player. The former first racket of the world, winner of five Grand Slam singles tournaments from 2004 to 2014, one of ten women in history who has the so-called “career slam”.
Luis Fernando Diaz Marulanda https://luis-diaz.prostoprosport-ar.com Colombian footballer, winger for Liverpool and the Colombian national team . Diaz is a graduate of the Barranquilla club. On April 26, 2016, in a match against Deportivo Pereira, he made his Primera B debut. On January 30, 2022, he signed a contract with the English Liverpool for five years, the transfer amount was 40 million euros.
Found captivating reading that’s worth your time – take a look http://formulaf1.ru/novyie-turetskie-serialyi-2024-goda
Если любите [url=https://turkhit.tv/serials2023/]турецкие сериалы 2023 на русском языке[/url], то вам точно понравится сайт turkhit.tv. Здесь есть сериалы разных годов и жанров, все в HD качестве и с полноценным русским переводом. Вы можете наслаждаться просмотром бесплатно и без всплывающей рекламы.
Каждый день добавляются новые серии, так что вы всегда будете в курсе последних событий в мире турецких сериалов. Заходите на turkhit.tv и наслаждайтесь лучшими сериалами 2023 года без ограничений и без лишних хлопот.
Glory casino
[url=https://kvixi.com/blogs/782/%D0%A3%D0%BD%D0%B8%D0%BA%D0%B0%D0%BB%D1%8C%D0%BD%D1%8B%D0%B9-%D0%9E%D0%BF%D1%8B%D1%82-%D0%A0%D0%BE%D1%81%D0%BA%D0%BE%D1%88%D0%B8-%D0%B2-%D0%9E%D1%82%D0%B5%D0%BB%D0%B5-Glory]Glory casino[/url]
EsterKelly naked on sex cam for live porn chat absolutely free and easy to watch on any device, just
[url=https://toteblogs.com/posts/Best-Vitamin-C-Serums-for-Brighter-Skin-]Nude amateur webcams girls live porn show[/url][url=http://www.kiccoltd.co.kr/bbs/board.php?bo_table=free&wr_id=772403]Naked hot cams gir[/url] 0a7a551
Compatibility with Devices
aviator game demo
Excellent and high-quality 1 on 1 live sex chats absolutely free and easy to watch on any device, just
[url=http://test.aocoolers.co.kr/bbs/board.php?bo_table=pension&wr_id=95]Nude hot cams woma[/url][url=http://hantechfa.com/bbs/board.php?bo_table=free&wr_id=16762]Naked hot webcams w[/url] b762012
[url=https://vyzov-santehnika-spb.ru]https://vyzov-santehnika-spb.ru[/url] вызов сантехника в спб.
вызов сантехника в спб [url=https://vyzov-santehnika-spb.ru]https://vyzov-santehnika-spb.ru[/url].
срочный вызов сантехника [url=https://vyzov-santehnika-spb.ru]https://vyzov-santehnika-spb.ru[/url].
сантехника в спб [url=https://vyzov-santehnika-spb.ru]https://vyzov-santehnika-spb.ru[/url].
[url=https://vyzov-santehnika-spb.ru]https://vyzov-santehnika-spb.ru[/url] спб сантехника на дом.
Kevin De Bruyne https://kevin-de-bruyne.prostoprosport-ar.com Belgian footballer, midfielder of the Manchester club City” and the Belgian national team. A graduate of the football clubs “Ghent” and “Genk”. In 2008 he began his adult career, making his debut with Genk.
For example, applications for video communication or document exchange, such as zoom and Google Docs, https://https://p-network.io// allow employees to connect to World Wide Web and communicate remotely.
Mohammed Khalil Ibrahim Al-Owais https://mohammed-alowais.prostoprosport-ar.com is a Saudi professional footballer who plays as a goalkeeper for the national team Saudi Arabia and Al-Hilal. He is known for his quick reflexes and alertness at the gate.
Приветствую. Может кто знает, где найтиполезные статьи о недвижимости? Сейчас читаю https://krepegmaster.ru
el camino: a breaking bad movie emma rose full movieswhen is moon knight episode 5 coming outmovie theater near dekalb il
Nice articl! Just check sex cams free this out!
[url=http://remote.ecostm.co.kr/bbs/board.php?bo_table=c1&wr_id=12140]Naked amateur webca[/url][url=https://community.katawatbusiness.com/question/naked-amateur-webcams-model-online-porn-show-2/]Naked amateur webcams model online porn show[/url] 0f2_865
Common feedback from players includes requests for more in-game bonuses, additional multiplayer options, and
aviator game
anal threesome free cam sex
[url=https://toteblogs.com/posts/Best-Vitamin-C-Serums-for-Brighter-Skin-]Nude amateur webcams girls online porn show[/url][url=https://community.katawatbusiness.com/question/naked-amateur-webcams-girls-live-sex-show/]Naked amateur webcams girls live sex show[/url] 6201210
[b]Здравствуйте[/b]!
Задался вопросом: можно ли на самом деле купить диплом государственного образца в Москве? Был приятно удивлен — это реально и легально!
Сначала искал информацию в интернете на тему: купить диплом в дзержинске, купить диплом электромонтажника, купить диплом института, купить диплом экономиста , купить диплом в севастополе и получил базовые знания. В итоге остановился на материале: https://www.find-topdeals.com/blogs/49094/??????-??????-??????
Успешной учебы!
Quincy Anton Promes https://quincy-promes.prostoprosport-br.com Dutch footballer, attacking midfielder and forward for Spartak Moscow . He played for the Dutch national team. He won his first major award in 2017, when Spartak became the champion of Russia.
Экспертиза ремонта в квартире https://remnovostroi.ru проводится для оценки качества выполненных работ, соответствия требованиям безопасности и стандартам строительства. Специалисты проверяют используемые материалы, исполнение работ, конструктивные особенности, безопасность, внешний вид и эстетику ремонта. По результатам экспертизы составляется экспертное заключение с оценкой качества и рекомендациями по устранению недостатков.
The Aviator Game uses a Random Number Generator (RNG) to ensure fair play. This technology ensures that each
play aviator game
The largest Mega Millions prize ever won went to a player in South Carolina who did not have to publicly come forward to claim their prize.
Stop by my website; https://perpetualodyssey.net/index.php?title=Powerball:_The_Jackpot_Journey_Awaits
Приветствую. Может кто знает, где почитатьразные статьи о недвижимости? Пока нашел https://kuler-tsentr.ru
https://semlava.com/
[url=https://muhammad-ali.com.az]muhammad ali[/url]
best boxer in the world Muhammad Ali
muhammad ali casino
improved mobile compatibility. Developers continually use this feedback to enhance the game and provide a better
play aviator game
На сайте https://elektricheskie-kaminy.ru/ представлены электрические камины в огромном ассортименте. Эти конструкции подарят вашему дому незабываемый уют, комфорт. И самое важное, что они прослужат очень долго. Магазин предпринимает все возможное для того, чтобы процесс покупки был очень простым и понятным. Камины не выбрасывают в атмосферу вредные вещества. А для того, чтобы они начали обогревать, не потребуются дрова, а только розетка. Отсутствует открытый огонь, а потому возможность пожара сведена к минимуму.
Interesting blog! Is your theme custom made or did you download it from somewhere?
A design like yours with a few simple adjustements would really
make my blog shine. Please let me know where you got your design. Kudos
coinmarketcap more provides data on the most successful traders so that you can track https://blum-coin.com/.
Привет всем!
1win предлагает отличные бонусы для новых игроков. Регистрация заняла всего пару минут, а рабочее зеркало всегда доступно. Играю и выигрываю с удовольствием, вывод средств быстрый и без проблем. Рекомендую! [url=]1win лохотрон или нет[/url]
Скачал приложение 1win на Android и играю где угодно. Простая регистрация, приятные бонусы и быстрые выплаты. Рабочее зеркало всегда доступно. 1win – лучшее место для ставок и казино. Рекомендую!
Ловите сайт где все в лучшем виде! – http://1winapk.kz
1win игры по одному рублю
1win регистрация скачать
скачать бк 1win на
игровые автоматы 1win играть бесплатно и без регистрации
как активировать промокод на 1win
1 win зеркало играть
коллаген фирмы 1win
Удачи!
[url=https://sova-gg.com]Sova gg обмен[/url] – Сова обменник, Сова гг обменник
Player Reviews and Testimonials
aviator demo game
Apple pay, Google pay and bank cards are also accepted, such as explore, interlink, https://visual.ly/users/yyzlongterm1/portfolio and star.
Всем привет! Подскажите, где почитатьполезные блоги о недвижимости? Пока нашел https://liem-com.ru
[url=https://muhammad-ali.com.az]muhammad ali casino[/url]
best boxer in the world Muhammad Ali
muhammad ali apk
мастерская по ремонту телефонов
experiences. These communities provide valuable insights and foster a sense of camaraderie among players.
aviator game demo
Applications such as uniswap, synthetix, https://waffle-swap.io/ and coingecko use the service to order data. in this year, tether usdt (usdt) became the first stable coin launched online by solana.
[b]Здравствуйте[/b]!
Хочу рассказать о своем опыте по заказу аттестата пту, думал это не реально и стал искать информацию в сети, про купить диплом технолога, купить диплом врача, купить диплом медицинского училища, купить диплом техникума, купить диплом в сургуте, постепенно вникая в суть дела нашел отличный материал здесь https://www.nhps1914.com/wiki/%D0%93%D0%B4%D0%B5_%D0%BC%D0%BE%D0%B6%D0%BD%D0%BE_%D0%B1%D1%83%D0%B4%D0%B5%D1%82_%D0%B4%D0%B8%D0%BF%D0%BB%D0%BE%D0%BC_%D0%B7%D0%B0%D0%BA%D0%B0%D0%B7%D0%B0%D1%82%D1%8C_%D0%B8%D0%BB%D0%B8_%D0%B6%D0%B5_%D0%B0%D1%82%D1%82%D0%B5%D1%81%D1%82%D0%B0%D1%82_%D0%B2%D1%8B%D1%81%D0%BE%D0%BA%D0%BE%D0%B3%D0%BE_%D0%BA%D0%B0%D1%87%D0%B5%D1%81%D1%82%D0%B2%D0%B0%3F и был очень доволен!
Теперь у меня есть диплом столяра о среднем специальном образовании, и я обеспечен на всю жизнь)
Хорошей учебы!
где отремонтировать телефон
Larry Joe Bird https://larry-bird.prostoprosport-br.com American basketball player who spent his entire professional career in the NBA ” Boston Celtics.” Olympic champion (1992), champion of the 1977 Universiade, 3-time NBA champion (1981, 1984, 1986), three times recognized as MVP of the season in the NBA (1984, 1985, 1986), 10 times included in the symbolic teams of the season (1980-88 – first team, 1990 – second team).
?? Добро пожаловать в мир геолокации по номеру телефона! ??
https://youtu.be/eylZkYUEN6M
?? Узнайте, как легко и точно определить местоположение по номеру с нашим инновационным сервисом! ??
??? Откройте для себя возможности геолокации через спутники и узнайте, где находится ваш телефон в реальном времени! ??
?? Не упустите шанс узнать местоположение по номеру телефона прямо сейчас! ??
?? Попробуйте наш сервис и откройте новые горизонты в определении местоположения по номеру телефона! ??
Найдите телефон по номеру и узнайте местоположение онлайн с нашим удобным и бесплатным сервисом! ??
[url=https://youtu.be/eylZkYUEN6M]Геолокация по номеру телефона[/url]
Roberto Firmino Barbosa de Oliveira https://roberto-firmino.prostoprosport-br.com Brazilian footballer, attacking midfielder, forward for the Saudi club “Al-Ahli”. Firmino is a graduate of the Brazilian club KRB, from where he moved to Figueirense in 2007. In June 2015 he moved to Liverpool for 41 million euros.
http://mamalovesherbargains.com
сервис по ремонту телефонов
Are There Any Costs Involved?
aviator game
ремонт телефонов ближайший ко мне
Для поклонников военных драм у нас есть нечто особенное! [url=https://turkhit.tv/voenie/]Турецкие сериалы военные[/url] на turkhit.tv – это захватывающие сюжеты и историческая достоверность. Здесь вы найдете новейшие эпизоды в отличном HD качестве с идеальной русской озвучкой.
Каждый день добавляются новые серии, а отсутствие рекламы делает просмотр ещё приятнее. Удобный интерфейс и богатый выбор сериалов разных жанров делают turkhit.tv идеальным местом для любителей военных драм. Заходите и наслаждайтесь лучшими турецкими военными сериалами прямо сейчас!
https://win-line.net/רולטה-roulette/
לבצע, ראיה לדבריך.
הקזינו באינטרנט הפכה לענף פופולרי מאוד בשנים האחרונות, המאפשר מבחר רחב של אפשרויות הימורים, לדוגמה קזינו אונליין.
בניתוח זה נסקור את תחום ההתמודדות המקוונת ונייעץ לכם נתונים חשובים שיסייע לכם לנתח בנושא אטרקטיבי זה.
הימורי ספורט – התמודדות באינטרנט
קזינו אונליין מאפשר מבחר מגוון של אפשרויות ידועים כגון בלאק ג’ק. הקזינו באינטרנט מאפשרים למבקרים להשתתף מחוויית משחק אותנטית מכל מקום.
הפעילות פירוט קצר
משחקי מזל הימורי גלגל
משחק הרולטה הימור על מספרים וצבעים על גלגל מסתובב
בלאק ג’ק משחק קלפים בו המטרה היא להשיג 21
משחק הפוקר משחק קלפים מבוסס אסטרטגיה
התמודדות בבאקרה משחק קלפים קל וזריז
הימורי ספורט – קזינו באינטרנט
התמרמרות ספורטיבית מהווים אחד התחומים הצומחים הגדולים ביותר בפעילות באינטרנט. שחקנים מורשים להשקיע על ביצועים של אתגרי ספורט מועדפים כגון טניס.
ההימורים יכולים להיות על תוצאת המשחק, מספר האירועים ועוד.
סוג ההימור פירוט תחרויות ספורט מקובלות
ניחוש התפוצאה ניחוש התוצאה הסופית של המשחק כדורגל, כדורסל, קריקט
הפרש נקודות ניחוש ההפרש בביצועים בין הקבוצות כדורגל, כדורסל, טניס
כמות הסקורים ניחוש כמות התוצאות בתחרות כל ענפי הספורט
הקבוצה המנצחת ניחוש מי יזכה בתחרות (ללא קשר לביצועים) מרבית ענפי הספורט
הימורים דינמיים התמודדות במהלך התחרות בזמן אמת כדורגל, טניס, קריקט
הימורים משולבים שילוב של מספר הימורים שונים מגוון ענפי ספורט
משחקי קלפים אונליין – הימורים באינטרנט
התמודדות בפוקר מקוון מייצג אחד מענפי התמודדות הפופולריים הגדולים ביותר בשנים האחרונות. משתתפים רשאים להשתלב מול יריבים מאזורי הגלובליזציה במגוון
Всем привет! Подскажите, где почитатьразные статьи о недвижимости? Пока нашел https://oscltd.ru
http://images.google.me/url?q=https://1777.ru/stavropol/
Проституция в столице является запутанной и сложноустроенной проблемой. Несмотря на это запрещается правилами, эта деятельность продолжает быть существенным нелегальным сектором.
Контекст в прошлом
В Союзные годы интимные услуги была в тени. С распадом Советского Союза, в ситуации рыночной нестабильности, эта деятельность стала быть явной.
Нынешняя положение дел
На сегодняшний день секс-работа в городе Москве включает многочисленные формы, начиная с элитных эскорт-услуг и заканчивая уличного уровня интимных услуг. Люксовые обслуживание часто осуществляются через сеть, а на улице секс-работа располагается в конкретных областях города.
Социальные и Экономические Аспекты
Множество представительницы слабого пола принимают участие в этот бизнес по причине денежных неурядиц. Коммерческий секс может оказаться заманчивой из-за перспективы быстрого дохода, но эта деятельность сопряжена с угрозу здоровью и жизни.
Юридические аспекты
Интимные услуги в Российской Федерации не законна, и за ее организацию организацию установлены серьёзные штрафы. Работников интимной сферы регулярно привлекают к ответственности к административной ответственности.
Таким способом, невзирая на запреты, проституция остаётся элементом незаконной экономики города с существенными социальными и законодательными последствиями.
проститутка бодибилдерша
https://www.podsliving.ph/forums/topic/ppk/
This is primarily due to the wide wide variety of games,
including Commiission and No-Commission games and an active Reside Dealer Baccarat table.
my site – 지표
сервис по ремонту телефонов
https://www.sitiosecuador.com/author/kristinwind/
Staying Calm: Keeping a cool head and avoiding impulsive decisions during gameplay.
aviator demo game
Opened up interesting material Р I recommend sharing this discovery https://forum.veterinar.ru/member.php?524909-worksale
Mixing it up can aid you preserve up healthful habits that save you from hermit mode.
Also visit my blog post – http://m.newssroom.net/bbs/board.php?bo_table=free&wr_id=86645
Khvicha Kvaratskhelia https://khvicha-kvaratskhelia.prostoprosport-br.com Georgian footballer, winger for Napoli and captain of the Georgian national team. A graduate of Dynamo Tbilisi. He made his debut for the adult team on September 29, 2017 in the Georgian championship match against Kolkheti-1913. In total, in the 2017 season he played 4 matches and scored 1 goal in the championship.
Damian Emiliano Martinez https://emiliano-martinez.prostoprosport-br.com Argentine footballer, goalkeeper of the Aston Villa club and national team Argentina. Champion and best goalkeeper of the 2022 World Cup.
сервис по ремонту телефонов
http://google.co.id/url?q=https://1777.ru/stavropol/
Stumbled upon interesting material – I can’t help but recommend you to read https://grs.forum-top.ru/viewtopic.php?id=227#p287
enjoyable.
aviator demo game
These aspects embrace the volatility of crypto, a lack of regulation, and a necessity for knowledge in the area of cryptocurrency.
Всем привет! Может кто знает, где почитатьразные блоги о недвижимости? Сейчас читаю https://ppu-odk.ru
“Как работает лазерное удаление папиллом?” – “Лазер направляет сфокусированный луч света на папиллому, что вызывает нагревание и испарение пораженных тканей, не повреждая окружающую здоровую кожу.”
“How does laser removal of papillomas work?” – “The laser directs a focused beam of light at the papilloma, causing the affected tissue to heat and vaporize, without damaging the surrounding healthy skin.”
стоимость удаления папиллом лазером в москве [url=https://udalenie.com.ru/]https://udalenie.com.ru/[/url] .
Jack Peter Grealish https://jackgrealish.prostoprosport-br.com English footballer, midfielder of the Manchester City club and the England national team. A graduate of the English club Aston Villa from Birmingham. In the 2012/13 season he won the NextGen Series international tournament, playing for the Aston Villa under-19 team
1922-1931 lancia lambda – очень продвинутый https://kupit-bu-sonata.com.ua/ для того времени.
Kyle Andrew Walker https://kylewalker.prostoprosport-br.com English footballer, captain of the Manchester City club and the England national team. In the 2013/14 season, he was on loan at the Notts County club, playing in League One (3rd division of England). Played 37 games and scored 5 goals in the championship.
whether at home or on the go.
aviator game demo
Glory Casino
Glory Casino
Ищете, где [url=https://turklife.tv/]смотреть турецкие сериалы[/url]? Тогда turklife.tv – это то, что вам нужно! Здесь собраны новинки 2024 года и популярные сериалы всех жанров в HD 1080 качестве с профессиональной русской озвучкой. На сайте ежедневно добавляются новые серии, так что вы всегда будете в курсе последних событий.
Сайт предлагает просмотр абсолютно бесплатно и без рекламы в плеере. Заходите на turklife.tv и наслаждайтесь лучшими турецкими сериалами без лишних хлопот и регистрации!
anal threesome sex video chat live
[url=http://thinktoy.net/bbs/board.php?bo_table=customer2&wr_id=387237]Nude amateur webcam[/url][url=http://www.kiccoltd.co.kr/bbs/board.php?bo_table=free&wr_id=776396]Naked amateur cams[/url] a7a5515
advancements have allowed for improved graphics, smoother gameplay, and more interactive features. These
play aviator game
http://maps.google.mw/url?q=https://subscribe.ru/author/25924851/group/records/?page=22
Laure Boulleau https://laure-boulleau.prostoprosport-fr.com French football player, defender. She started playing football in the Riom team, in 2000 she moved to Isere, and in 2002 to Issigneux. All these teams represented the Auvergne region. In 2003, Bullo joined the Clairefontaine academy and played for the academy team for the first time.
Son Heung Min https://sonheung-min.prostoprosport-br.com South Korean footballer, striker and captain of the English Premier League club Tottenham Hotspur and the Republic of Korea national team. In 2022 he won the Premier League Golden Boot. Became the first Asian footballer in history to score 100 goals in the Premier League
Всем привет! Подскажите, где найтиразные статьи о недвижимости? Сейчас читаю https://redglade-nn.ru
Если хотите [url=https://turkhit.tv/serials2024/]смотреть турецкие сериалы 2024 онлайн[/url], заходите на turkhit.tv! Здесь вас ждут новейшие сериалы этого года, все в отличном HD качестве и с профессиональной русской озвучкой. У нас вы найдете сериалы разных жанров, от драм до комедий, доступные бесплатно.
Каждый день добавляются новые серии, что позволяет вам всегда быть в курсе последних событий. Всё, что вы так долго ждали, теперь доступно на русском языке. Заходите на turkhit.tv и наслаждайтесь просмотром без рекламы и ограничений!
продвижение сайтов в москве с оплатой за результат [url=www.prodvizhenie-sajtov-v-moskve115.ru]www.prodvizhenie-sajtov-v-moskve115.ru[/url] .
anal threesome camaras de sexo en vivo
[url=http://shinyoungwood.co.kr/bbs/board.php?bo_table=free&wr_id=788327]Naked hot cams gir[/url][url=https://toteblogs.com/posts/Best-Vitamin-C-Serums-for-Brighter-Skin-]Naked hot cams woman live sex show[/url] a5515b3
Just last month, American News & Tobacco in Southampton sold a winning Pennsylvania https://sportsmanwiki.com/index.php?title=Winning_Dreams:_Simulating_Your_Lotto_Fantasies_Without_The_Losing_Streak Cash 5 ticket worth $450,000.
he has a good point https://egliseterresacree.org
Kudos. An abundance of info.
To play the Aviator Game, you need a device with internet access and a web browser that supports HTML5. This
aviator game online
online sex cam absolutely free and easy to watch on any device, just
[url=http://hantechfa.com/bbs/board.php?bo_table=free&wr_id=16985]Nude amateur cams[/url][url=https://sample115.tlogsir.com/bbs/board.php?bo_table=tl_product02&wr_id=402]Nude hot cams woma[/url] bba3656
game is random and unbiased, providing a fair chance for all players to win.
play aviator game
Приветствую. Может кто знает, где почитатьполезные статьи о недвижимости? Сейчас читаю https://santam1.ru
videos absolutely free and easy to watch on any device, just
[url=http://shinyoungwood.co.kr/bbs/board.php?bo_table=free&wr_id=788940]Nude amateur webcam[/url][url=http://thinktoy.net/bbs/board.php?bo_table=customer2&wr_id=388266]Nude amateur webcam[/url] 7a5515b
Jude Victor William Bellingham https://jude-bellingham.prostoprosport-fr.com English footballer, midfielder of the Spanish club Real Madrid and the England national team. In April 2024, he won the Breakthrough of the Year award from the Laureus World Sports Awards. He became the first football player to receive it.
read here https://haasfoundation.org
Nice article, thanks! Just check adult sex cams this out.
[url=http://remote.ecostm.co.kr/bbs/board.php?bo_table=c1&wr_id=12229]Naked amateur cams[/url][url=https://toteblogs.com/posts/Best-Vitamin-C-Serums-for-Brighter-Skin-]Naked hot cams girls online sex char[/url] bba3656
Antoine Griezmann https://antoine-griezmann.prostoprosport-fr.com French footballer, striker and midfielder for Atletico Madrid. Player and vice-captain of the French national team, as part of the national team – world champion 2018. Silver medalist at the 2016 European Championship and 2022 World Championship.
Common Feedback and Suggestions
aviator game demo
In January 2010, Harry Kane https://harry-kane.prostoprosport-fr.com received an invitation to the England U-team for the first time 17 for the youth tournament in Portugal. At the same time, the striker, due to severe illness, did not go to the triumphant 2010 European Championship for boys under 17 for the British.
check my blog https://bounyayin.com
Homepage von ebony sex cam
[url=https://sample115.tlogsir.com/bbs/board.php?bo_table=tl_product02&wr_id=412]Nude amateur cams[/url][url=http://remote.ecostm.co.kr/bbs/board.php?bo_table=c1&wr_id=12235]Naked hot webcams m[/url] 5515b35
over at this website https://egliseterresacree.org
Nice article, thanks! Just check http://www.gyrls.org this out.
[url=http://hantechfa.com/bbs/board.php?bo_table=free&wr_id=17075]Nude amateur cams[/url][url=http://test.aocoolers.co.kr/bbs/board.php?bo_table=pension&wr_id=106]Naked amateur webca[/url] ba3656e
Karim Mostafa Benzema https://karim-benzema.prostoprosport-fr.com French footballer, striker for the Saudi club Al-Ittihad . He played for the French national team, for which he played 97 matches and scored 37 goals.
Player Reviews and Testimonials
play aviator game
hop over to these guys https://polykarbonbbs.com
Всем привет! Подскажите, где почитатьразные блоги о недвижимости? Пока нашел https://sibarit54.ru
Achraf Hakimi Mou https://achraf-hakimi.prostoprosport-fr.com Moroccan footballer, defender of the French club Paris Saint-Germain “and the Moroccan national team. He played for Real Madrid, Borussia Dortmund and Inter Milan.
Retails sports betting is now underway, with operator Betfred opening the initial retails sportsbook inside the Paragon Casino on October six, 2021.
Here is my website; https://nohio.org/index.php/All_Bets_Are_On:_Unveiling_The_Winning_Secrets_Of_Sports_Toto_Site
Nice article, thanks! Just check sex chats live this out.
[url=https://sample115.tlogsir.com/bbs/board.php?bo_table=tl_product02&wr_id=415]Naked amateur webca[/url][url=https://community.katawatbusiness.com/question/naked-amateur-cams-model-live-porn-show-3/]Naked amateur cams model live porn show[/url] 3656eb7
enjoyable.
aviator game online
Excellent and high-quality korean masturbation public koran filipina teen cam sex absolutely free and easy to watch on any device, just
[url=https://community.katawatbusiness.com/question/naked-hot-webcams-girls-online-sex-char/]Naked hot webcams girls online sex char[/url][url=https://trust-used.com/best-gaming-laptop-models/]Naked amateur webcams girls live sex show[/url] a5515b3
[url=https://santex-service.ru]https://santex-service.ru[/url] вызов сантехника.
вызов сантехника [url=https://santex-service.ru]https://santex-service.ru[/url].
срочный вызов сантехника [url=https://santex-service.ru]https://santex-service.ru[/url].
сантехник вызов [url=https://santex-service.ru]https://santex-service.ru[/url].
[url=https://santex-service.ru]https://santex-service.ru[/url] сантехник на дом.
investigate this site https://granbyma.net
[b]Здравствуйте[/b]!
Хочу рассказать о своем опыте по заказу аттестата пту, думал это не реально и стал искать информацию в сети, про старые дипломы купить, купить диплом геодезиста, купить диплом в артеме, купить новый диплом, купить диплом парикмахера, постепенно вникая в суть дела нашел отличный материал здесь http://chungsooyoun.com/2019/11/welcome-to-my-blog/?unapproved=352586&moderation-hash=548e8ce7f56a5cea34c509f094e38143#comment-352586 и был очень доволен!
Теперь у меня есть диплом столяра о среднем специальном образовании, и я обеспечен на всю жизнь)
Хорошей учебы!
Приветствую. Может кто знает, где почитатьразные статьи о недвижимости? Сейчас читаю https://stroyproektm.ru
Sweet Bonanza https://sweet-bonanza.prostoprosport-fr.com is an exciting slot from Pragmatic Play that has quickly gained popularity among players thanks to its unique gameplay, colorful graphics and the opportunity to win big prizes. In this article, we’ll take a closer look at all aspects of this game, from mechanics and bonus features to strategies for successful play and answers to frequently asked questions.
Several key developers and companies have played a significant role in the development and success of the
aviator demo game
Philip Walter Foden https://phil-foden.prostoprosport-fr.com better known as Phil Foden English footballer, midfielder of the Premier club -League Manchester City and the England national team. On December 19, 2023, he made his debut at the Club World Championship in a match against the Japanese club Urawa Red Diamonds, starting in the starting lineup and being replaced by Julian Alvarez in the 65th minute.
Bernardo Silva https://bernardo-silva.prostoprosport-fr.com Portuguese footballer, midfielder. Born on August 10, 1994 in Lisbon. Silva is considered one of the best attacking midfielders in the world. The football player is famous for his endurance and performance. The athlete’s diminutive size is more than compensated for by his creativity, dexterity and foresight.
Excellent and high-quality inthecrackfan.pro absolutely free and easy to watch on any device, just
[url=http://remote.ecostm.co.kr/bbs/board.php?bo_table=c1&wr_id=12261]Naked amateur webca[/url][url=http://www.globaldream.or.kr/bbs/board.php?bo_table=sub08_02&wr_id=657]Naked hot cams wom[/url] 5515b35
Kylian Mbappe Lotten https://kylian-mbappe.prostoprosport-fr.com Footballeur francais, attaquant du Paris Saint-Germain et capitaine de l’equipe de France. Le 1er juillet 2024, il deviendra joueur du club espagnol du Real Madrid.
personal loans valley al Payday loans solve this problem, they help cover up cash deficiency in such situations.
free live sex chat room absolutely free and easy to watch on any device, just
[url=http://test.aocoolers.co.kr/bbs/board.php?bo_table=pension&wr_id=111]Naked hot cams mod[/url][url=http://www.kiccoltd.co.kr/bbs/board.php?bo_table=free&wr_id=779628]Nude hot cams mode[/url] a5515b3
Found an article that is worth reading – it’s really interesting! http://forexsnews.ru/poluchite-sertifikat-po-psihologii-onlayn
https://storage.googleapis.com/handyman-service-omaha/handyman-repairs.html
experience for players.
aviator game demo
продвижение сайтов интернет магазины в москве [url=https://www.prodvizhenie-sajtov-v-moskve115.ru]https://www.prodvizhenie-sajtov-v-moskve115.ru[/url] .
Jogo do Tigre https://jogo-do-tigre.prostoprosport-br.com is a simple and fun game that tests your reflexes and coordination. In this game you need to put your finger on the screen, pull out the stick and go through each peg. However, you must ensure that the stick is the right length, neither too long nor too short.
to your liking, and quickly move to the section with cam 2 cam sex on this topic. All categories are packed enough to make
[url=http://remote.ecostm.co.kr/bbs/board.php?bo_table=c1&wr_id=12264]Nude hot cams woma[/url][url=https://trust-used.com/best-gaming-laptop-models/]Naked amateur webcams model online sex char[/url] 01210a7
trust wallet: accessory not in connection with storage, which gives a chance players store own cryptocurrencies and manage they are available on portable devices https://gamestop-wallet.io/.
1win казино скачать
Mohamed Salah Hamed Mehrez Ghali https://mohamed-salah.prostoprosport-fr.com Footballeur egyptien, attaquant du club anglais de Liverpool et l’equipe nationale egyptienne. Considere comme l’un des meilleurs footballeurs du monde
1win казино вход
The scoring system in the Aviator Game is based on the multiplier at the time of cashing out. The higher the
aviator game
Всем привет! Подскажите, где найтиполезные статьи о недвижимости? Пока нашел https://tent44.ru
Just check this out, sex.cam
[url=https://sample115.tlogsir.com/bbs/board.php?bo_table=tl_product02&wr_id=431]Nude amateur webcam[/url][url=https://naeunhome.cafe24.com/bbs/board.php?bo_table=review&wr_id=417]Nude amateur cams[/url] 0a7a551
http://maps.google.td/url?q=https://subscribe.ru/author/25924851/group/records/?page=23
Declan Rice https://declan-rice.prostoprosport-fr.com Footballeur anglais, milieu defensif du club d’Arsenal et de l’equipe nationale equipe d’Angleterre. Originaire de Kingston upon Thames, Declan Rice s’est entraine a l’academie de football de Chelsea des l’age de sept ans. En 2014, il devient joueur de l’academie de football de West Ham United.
[b]Здравствуйте[/b]!
Хочу рассказать о своем опыте по заказу аттестата пту, думал это не реально и стал искать информацию в сети, про купить диплом бурильщика, купить диплом в азове, куплю диплом кандидата наук, где купить диплом о среднем образование, купить диплом в казани, постепенно вникая в суть дела нашел отличный материал здесь http://fh9947a1.bget.ru/blog/11082.html и был очень доволен!
Теперь у меня есть диплом столяра о среднем специальном образовании, и я обеспечен на всю жизнь)
Успехов в учебе!
Best Antivirus Software of 2024: Comprehensive Guide and Recommendations
sex cams
[url=http://remote.ecostm.co.kr/bbs/board.php?bo_table=c1&wr_id=12268]Naked amateur webca[/url][url=http://hantechfa.com/bbs/board.php?bo_table=free&wr_id=17131]Naked hot cams wom[/url] a5515b3
[b]Привет всем[/b])
Хорошо быть студентом, пока не придет пора писать диплом, что и произошло со мной, но не стоит отчаиваться, ведь есть хорошие компании что помогают с написанием и сдачей диплома на хорошие оценки!
Изначально искал информацию про купить диплом в канске, купить аттестат за 9 класс, купить диплом электромонтажника, купить диплом в петропавловске-камчатском, купить диплом экономиста, потом попал на http://o91746bp.beget.tech/2023/07/22/kupit-diplom-o-vysshem-obrazovanii-nedorogo.html и там решили все мои учебные заботы!
Хорошей учебы!
купить диплом в ставрополе [url=https://vm-tver.ru/]купить диплом в ставрополе[/url] .
advancements have allowed for improved graphics, smoother gameplay, and more interactive features. These
aviator game
Declan Rice https://declan-rice.prostoprosport-fr.com Footballeur anglais, milieu defensif du club d’Arsenal et de l’equipe nationale equipe d’Angleterre. Originaire de Kingston upon Thames, Declan Rice s’est entraine a l’academie de football de Chelsea des l’age de sept ans. En 2014, il devient joueur de l’academie de football de West Ham United.
Thibaut Nicolas Marc Courtois https://thhibaut-courtois.prostoprosport-fr.com Footballeur belge, gardien de but du club espagnol du Real Madrid . Lors de la saison 2010/11, il a ete reconnu comme le meilleur gardien de la Pro League belge, ainsi que comme joueur de l’annee pour Genk. Triple vainqueur du Trophee Ricardo Zamora
Nice article, thanks! Just check sexo en la cama this out.
[url=http://thinktoy.net/bbs/board.php?bo_table=customer2&wr_id=390430]Nude hot webcams gi[/url][url=https://sample115.tlogsir.com/bbs/board.php?bo_table=tl_product02&wr_id=437]Naked amateur cams[/url] 0a7a551
конференц зал оборудование [url=https://oborudovanie-konferenc-zalov11.ru/]конференц зал оборудование[/url] .
Hiya very nice website!! Guy .. Beautiful .. Superb ..
I’ll bookmark your website and take the feeds additionally?
I am satisfied to search out numerous helpful information here in the put up, we need develop extra strategies in this regard, thank you for sharing.
. . . . .
Olivier Jonathan Giroud https://olivier-giroud.prostoprosport-fr.com French footballer, striker for Milan and the French national team. Knight of the Legion of Honor. Participant in four European Championships (2012, 2016, 2020 and 2024) and three World Championships (2014, 2018 and 2022).
[b]Здравствуйте[/b]!
Хочу рассказать о своем опыте по заказу аттестата пту, думал это не реально и стал искать информацию в сети, про купить речной диплом, купить диплом ссср, купить диплом в нижнем новгороде, купить диплом юриста, купить диплом геодезиста, постепенно вникая в суть дела нашел отличный материал здесь http://ekaterinovka.sarat.ru/board/add.php и был очень доволен!
Теперь у меня есть диплом столяра о среднем специальном образовании, и я обеспечен на всю жизнь)
Удачи!
Excellent and high-quality live sex chat rooms absolutely free and easy to watch on any device, just
[url=http://thinktoy.net/bbs/board.php?bo_table=customer2&wr_id=390555]Naked amateur webca[/url][url=http://shinyoungwood.co.kr/bbs/board.php?bo_table=free&wr_id=790711]Naked amateur cams[/url] bba3656
Приветствую. Подскажите, где почитатьразные статьи о недвижимости? Пока нашел https://universal37.ru
Калькулятор Ба Цзы https://xn--80aaczlbgb1auuk9b6de5c.xn--p1ai/ позволяет строить карту рождения, она состоит из набора восьми иероглифов, который формируется на основе даты и времени рождения человека, с учётом места рождения. Карта рождения отражает врожденные особенности характера личности сильные и слабые стороны, а также конкурентные преимущества. Она также помогает определить, качество жизни человека в разных сферах, а также определить какие даты будут оптимальными для различных событий, таких как переезд, смена работы, свадьба, начало диеты и другие.
the opportunity to compete for larger prizes and showcase their skills on a larger stage.
aviator game
https://win-line.net/nextbet7-נקסט-בט-7/
להעביר, תימוכין לדבריך.
ההמרה באינטרנט הפכה לנישה מבוקש מאוד בעת האחרונה, המציע מבחר רחב של חלופות התמודדות, לדוגמה קזינו אונליין.
בניתוח זה נבדוק את תעשיית הפעילות המקוונת ונעניק לכם נתונים חשובים שיתרום לכם לחקור בתופעה מסקרן זה.
משחקי פוקר – הימורים באינטרנט
קזינו אונליין כולל אופציות שונות של משחקים מוכרים כגון רולטה. הפעילות באינטרנט מאפשרים למשתתפים להשתתף מאווירת פעילות אותנטית בכל מקום ובשעה.
סוג המשחק פירוט קצר
משחקי מזל משחקי מזל
רולטה הימור על מספרים וצבעים על גלגל מסתובב
משחק קלפים 21 משחק קלפים בו המטרה להגיע לסכום של 21
פוקר משחק קלפים מבוסס אסטרטגיה
משחק קלפים באקרה משחק קלפים קל וזריז
הימורים בתחום הספורט – התמודדות באינטרנט
הימורים על אירועי ספורט מהווים חלק מ אחד הענפים המתפתחים המרכזיים ביותר בקזינו באינטרנט. מבקרים מסוגלים להמר על תוצאות של תחרויות ספורט מבוקשים כגון כדורסל.
ההימורים אפשר לבצע על תוצאת האירוע, מספר האירועים ועוד.
סוג ההימור תיאור משחקי ספורט מרכזיים
ניחוש תוצאה ניחוש התוצאה הסופית של התחרות כדורגל, כדורסל, טניס
הפרש ביצועים ניחוש הפרש הנקודות בין הקבוצות כל ענפי הספורט
כמות התוצאות ניחוש כמה שערים או נקודות יהיו במשחק כדורגל, כדורסל, טניס
הצד המנצח ניחוש מי יהיה הזוכה (ללא קשר לתוצאה) מרבית ענפי הספורט
התמודדות דינמית התמודדות במהלך האירוע בזמן אמת כדורגל, טניס, קריקט
הימורים משולבים שילוב של מספר הימורים שונים מרבית ענפי הספורט
פוקר אונליין – התמודדות באינטרנט
משחקי קלפים אונליין הוא אחד ממשחקי ההימורים המשגשגים המשפיעים ביותר בשנים האחרונות. מבקרים רשאים להשקיע מול מתמודדים אחרים מרחבי הגלובוס בסוגים ש
take a look at the site here https://polykarbonbbs.com
article source https://egliseterresacree.org
to your liking, and quickly move to the section with https://nakedgirlwallpaper.pro on this topic. All categories are packed enough to make
[url=http://remote.ecostm.co.kr/bbs/board.php?bo_table=c1&wr_id=12278]Nude hot cams mode[/url][url=http://test.aocoolers.co.kr/bbs/board.php?bo_table=pension&wr_id=117]Naked hot webcams m[/url] 01210a7
browse this site https://tallyhouniforms.com
why not try these out https://vuoksenkalastuspuisto.com
anal threesome live free sex chats
[url=http://thinktoy.net/bbs/board.php?bo_table=customer2&wr_id=391117]Nude hot cams woma[/url][url=https://trust-used.com/best-gaming-laptop-models/]Nude hot cams woman live sex char[/url] b35f320
Several key developers and companies have played a significant role in the development and success of the
aviator game
navigate to this website https://bluevioletbodyworks.com
Jamal Musiala https://jamal-musiala.prostoprosport-fr.com footballeur allemand, milieu offensif du club allemand du Bayern et du equipe nationale d’Allemagne. Il a joue pour les equipes anglaises des moins de 15 ans, des moins de 16 ans et des moins de 17 ans. En octobre 2018, il a dispute deux matchs avec l’equipe nationale d’Allemagne U16. En novembre 2020, il a fait ses debuts avec l’equipe d’Angleterre U21.
go https://todoprogramas.com
Xavi or Xavi Quentin Sy Simons https://xavi-simons.prostoprosport-fr.com Dutch footballer, midfielder of the Paris Saint-Germain club -Germain” and the Dutch national team, playing on loan for the German club RB Leipzig.
anal threesome asian live chat porn sex
[url=http://www.kiccoltd.co.kr/bbs/board.php?bo_table=free&wr_id=781577]Naked hot webcams w[/url][url=http://test.aocoolers.co.kr/bbs/board.php?bo_table=pension&wr_id=119]Nude hot cams mode[/url] eb76201
Ronaldo de Asis Moreira https://ronaldinhogaucho.prostoprosport-br.com Brazilian footballer, played as an attacking midfielder and striker. World Champion (2002). Winner of the Golden Ball (2005). The best football player in the world according to FIFA in 2004 and 2005.
As a basic rule of thumb, grapplers have additional good results at these sorts of matchups.
my site http://st162.net/proxy.php?link=https://hike95.izrablog.com/28298589/top-sports-betting-sites-in-south-korea-reviewed
Glory Casino
Приветствую. Может кто знает, где почитатьразные блоги о недвижимости? Сейчас читаю https://velikaya-stena.ru
Staying Calm: Keeping a cool head and avoiding impulsive decisions during gameplay.
aviator game
Going Here https://corfu-villa.com
Скористайтеся кращими коефіцієнтами на численні спорт змагання в цих видах спорту, як футбол, теніс, скачки, https://kharkovchanka.com.ua/uk/news/bezmezhno-doviryayut-ukrayinczi-kazyno-k велоспорт і.
Erling Breut Haaland https://erling-haaland.prostoprosport-br.com Futebolista noruegues, atacante do clube ingles Manchester City e Selecao da Noruega. Detentor do recorde da Premier League inglesa em gols por temporada.
As of November https://blast.io-event.network/mainnet/ foresight ventures is the majority investor of the block. This article is selected exclusively for informational purposes.
Glory Casino
click for more https://mc-server.org
Philippe Coutinho Correia https://philippecoutinho.prostoprosport-br.com Brazilian footballer, midfielder of the English club Aston Villa, playing on loan for the Qatari club Al-Duhail. He is known for his vision, passing, dribbling and long-range ability.
additional info https://key-res.com
Yes, the Aviator Game is compatible with mobile devices. Players can enjoy the game on their smartphones or
aviator game
Carlos Henrique Casimiro https://carloscasemiro.prostoprosport-br.com Futebolista brasileiro, volante do clube ingles Manchester United e capitao do Selecao Brasileira. Pentacampeao da Liga dos Campeoes da UEFA, campeao mundial e sul-americano pela selecao juvenil brasileira.
1вин казино официальный сайт
Kylian Mbappe Lotten https://kylianmbappe.prostoprosport-br.com Futebolista frances, atacante do Paris Saint-Germain e capitao da selecao francesa equipe . Em 1? de julho de 2024, ele se tornara jogador do clube espanhol Real Madrid.
Пин Ап стал удобным для населения Казахстана этой весной.
Here is my site … https://casino-x-online.icu/
you can try here https://glassartistsfellowship.com
Just check this out, sex cam sites
[url=http://remote.ecostm.co.kr/bbs/board.php?bo_table=c1&wr_id=12300]Nude amateur cams[/url][url=http://thinktoy.net/bbs/board.php?bo_table=customer2&wr_id=391880]Nude amateur cams[/url] 210a7a5
http://google.td/url?q=https://subscribe.ru/author/25924851/group/records/?page=24
No, you don’t have to download Kentucky sportsbook apps if you want to bet in the state.
Also visit my web page :: https://Tinkeredug.com/uncategorized/online-casino-help-6/
Just check this out, sex chat cam
[url=https://sample115.tlogsir.com/bbs/board.php?bo_table=tl_product02&wr_id=467]Naked hot webcams m[/url][url=http://www.globaldream.or.kr/bbs/board.php?bo_table=sub08_02&wr_id=679]Naked amateur cams[/url] 10a7a55
I appreciate, result in I discovered just what I used to be looking for.
You have ended my four day long hunt! God Bless you man. Have a great day.
Bye
Common feedback from players includes requests for more in-game bonuses, additional multiplayer options, and
aviator game
1вин казино официальный
Fast Online Loans: Personalized Solutions for Your Unique Needs. Take a good look at where your money went during the last six months.
Lionel Messi https://lionelmessi.prostoprosport-br.com e um jogador de futebol argentino, atacante e capitao do clube da MLS Inter Miami. , capitao da selecao argentina. Campeao mundial, campeao sul-americano, vencedor da Finalissima, campeao olimpico. Considerado um dos melhores jogadores de futebol de todos os tempos.
Mohamed Salah https://mohamedsalah.prostoprosport-br.com e um futebolista egipcio que joga como atacante do clube ingles Liverpool e do Selecao egipcia. Considerado um dos melhores jogadores de futebol do mundo. Tricampeao da Chuteira de Ouro da Premier League inglesa: em 2018 (sozinho), 2019 (junto com Sadio Mane e Pierre-Emerick Aubameyang) e 2022 (junto com Son Heung-min).
Just check out the best 1on1 live sex chat ever!
[url=http://remote.ecostm.co.kr/bbs/board.php?bo_table=c1&wr_id=12308]Nude amateur cams[/url][url=http://www.kiccoltd.co.kr/bbs/board.php?bo_table=free&wr_id=782729]Naked amateur webca[/url] bba3656
Kaka https://kaka.prostoprosport-br.com Futebolista brasileiro, meio-campista. O apelido “Kaka” e um diminutivo de Ricardo. Formado em Sao Paulo. De 2002 a 2016, integrou a Selecao Brasileira, pela qual disputou 92 partidas e marcou 29 gols. Campeao mundial 2002.
Karim Mostafa Benzema https://karim-benzema.prostoprosport-br.com Futebolista frances, atacante do clube saudita Al-Ittihad . Jogou pela selecao francesa, pela qual disputou 97 partidas e marcou 37 gols.
Find out free cam sex scene for free 🙂
[url=http://remote.ecostm.co.kr/bbs/board.php?bo_table=c1&wr_id=12312]Naked amateur webca[/url][url=https://trust-used.com/best-gaming-laptop-models/]Nude amateur webcams woman live sex show[/url] 3_eb23f
advancements have allowed for improved graphics, smoother gameplay, and more interactive features. These
aviator game
Harry Kane https://harry-kane.prostoprosport-br.com recebeu um convite para a selecao sub-alterna da Inglaterra pela primeira vez tempo 17 para o torneio juvenil em Portugal. Ao mesmo tempo, o atacante, devido a doenca grave, nao compareceu ao triunfante Campeonato Europeu Sub-17 masculino de 2010 pelos britanicos.
This is drastically higher than the $41,950 median wage for all workers in the economy.
Feel free to visit my blog post … https://naturesfusions.net/index.php/User:BradyLaseron48
Zlatan Ibrahimovic https://zlatan-ibrahimovic.prostoprosport-br.com Bosnian pronunciation: [zlatan ibraxi?mo?it?]; genus. 3 October 1981, Malmo, Sweden) is a Swedish footballer who played as a striker. Former captain of the Swedish national team.
free live sex cam videos absolutely free and easy to watch on any device, just
[url=http://thinktoy.net/bbs/board.php?bo_table=customer2&wr_id=392436]Nude amateur webcam[/url][url=https://toteblogs.com/posts/Best-Vitamin-C-Serums-for-Brighter-Skin-]Naked amateur webcams woman online sex show[/url] b35f320
Приветствую. Может кто знает, где почитать полезные блоги о недвижимости? Пока нашел https://1eve1.ru
Unique Features of the Aviator Game
aviator game
Luis Alberto Suarez Diaz https://luis-suarez.prostoprosport-br.com Uruguayan footballer, striker for Inter Miami and Uruguay national team. The best scorer in the history of the Uruguay national team. Considered one of the world’s top strikers of the 2010s
Hello! Do you know if they make any plugins to assist with Search Engine
Optimization? I’m trying to get my blog to rank for some targeted keywords but I’m not seeing very good gains.
If you know of any please share. Thanks!
Discover the best sex cam chat ever for free!
[url=http://remote.ecostm.co.kr/bbs/board.php?bo_table=c1&wr_id=12329]Naked hot cams mod[/url][url=https://community.katawatbusiness.com/question/naked-amateur-webcams-girls-live-porn-char/]Naked amateur webcams girls live porn char[/url] 5515b35
заглавный лист отчетов по практике – эти катакомбы – самая первая страница вашего отчета, и вполне, http://praktika-na-zakaz.ru/ на.
Идеальные тактичные штаны для любого случая, для идеального комфорта и функциональности.
Тактичные штаны: модные тренды этого сезона, для активного образа жизни.
Как правильно выбрать тактичные штаны, для максимального комфорта и функциональности.
Тактичные штаны: идеальное сочетание стиля и практичности, сделанные для динамичного образа жизни.
Тактичные штаны: выбор современного мужчины, чтобы чувствовать себя комфортно в любой ситуации.
штани тактичні жіночі [url=https://vijskovitaktichnishtanu.kiev.ua/]https://vijskovitaktichnishtanu.kiev.ua/[/url] .
watch porn online
Jude Bellingham https://jude-bellingham.prostoprosport-br.com Futebolista ingles, meio-campista do clube espanhol Real Madrid e do Selecao da Inglaterra. Em abril de 2024, ele ganhou o premio Breakthrough of the Year do Laureus World Sports Awards. Ele se tornou o primeiro jogador de futebol a recebe-lo.
Thibaut Nicolas Marc Courtois https://thhibaut-courtois.prostoprosport-fr.com Footballeur belge, gardien de but du club espagnol du Real Madrid . Lors de la saison 2010/11, il a ete reconnu comme le meilleur gardien de la Pro League belge, ainsi que comme joueur de l’annee pour Genk. Triple vainqueur du Trophee Ricardo Zamora
[b]Здравствуйте[/b]!
Хочу рассказать о своем опыте по заказу аттестата пту, думал это не реально и стал искать информацию в сети, про купить дипломы о высшем цены, купить диплом в ухте, купить диплом магистра, купить диплом в балаково, купить дипломы о высшем, постепенно вникая в суть дела нашел отличный материал здесь https://vipka.0bb.ru/viewtopic.php?id=2522#p4019 и был очень доволен!
Теперь у меня есть диплом столяра о среднем специальном образовании, и я обеспечен на всю жизнь)
Успешной учебы!
Excellent and high-quality adult sex cam absolutely free and easy to watch on any device, just
[url=https://sample115.tlogsir.com/bbs/board.php?bo_table=tl_product02&wr_id=475]Naked hot cams wom[/url][url=http://hantechfa.com/bbs/board.php?bo_table=free&wr_id=17337]Naked amateur cams[/url] 10a7a55
Gareth Frank Bale https://garethbale.prostoprosport-br.com Jogador de futebol gales que atuou como ala. Ele jogou na selecao galesa. Ele se destacou pela alta velocidade e um golpe bem colocado. Artilheiro (41 gols) e recordista de partidas disputadas (111) na historia da selecao.
webcam models
ebony 69 porn
watch porn online
Как выбрать лучшие тактичные штаны для активного отдыха, сделанные из качественных материалов.
Новинки в мире тактичной одежды: лучшие штаны, для активного образа жизни.
Чем отличаются тактичные штаны от обычных, чтобы выглядеть стильно в любой ситуации.
Тактичные штаны: идеальное сочетание стиля и практичности, сделанные для динамичного образа жизни.
Тактичные штаны: выбор современного мужчины, чтобы чувствовать себя комфортно в любой ситуации.
купити військові штани з наколінниками [url=https://vijskovitaktichnishtanu.kiev.ua/]https://vijskovitaktichnishtanu.kiev.ua/[/url] .
Одним из наиболее распространенных примеров вычисления по номеру является работа с массивами? В языках программирования индексация массивов обычно начинается с 0‚ поэтому первый элемент массива имеет индекс 0‚ второй ? 1 и т?д?? Этот номер позволяет программисту легко обращаться к нужному элементу массива?
Специальные сервисы и приложения? Существуют онлайн-сервисы и мобильные приложения, предоставляющие информацию о владельце номера телефона [url=https://domkem.ru/15c42-web-agency-gb-news/]http phone [/url] Некоторые из них могут быть платными, но есть и бесплатные варианты [url=https://domkem.ru/findphone/]отследить местоположение по номеру телефона онлайн [/url] ?
Как защитить свои контактные данные
Геолокация по номеру телефона – это способ определения местоположения абонента с помощью его телефонного номера [url=https://domkem.ru/findphone/]вычислить геолокацию по номеру [/url] ? Этот метод может быть полезен в различных ситуациях, например, если вы потеряли свой телефон или хотите узнать, где находится ваш ребенок или близкий человек [url=https://domkem.ru/15c42-web-agency-gb-news/]сайт пробить номер [/url] ?
Важно помнить, что использование информации о местоположении другого человека без его согласия может быть нарушением приватности и закона о защите персональных данных [url=https://domkem.ru/findphone/]найти устройство по номеру телефона бесплатно [/url] ? Поэтому рекомендуется быть внимательным и бережно относиться к конфиденциальной информации [url=https://domkem.ru/app-find/]по геолокации найти человека по телефону [/url] ?
visit their website [url=https://www.youtube.com/@DrunkID_com]scannable fake id[/url]
Chasing Losses: Trying to recover losses by betting more can be detrimental.
aviator game
Выберите стильные тактичные штаны для повседневной носки, для идеального комфорта и функциональности.
Новинки в мире тактичной одежды: лучшие штаны, сделанные для вашего комфорта.
Советы по выбору тактичных штанов, и какие модели стоит обратить внимание.
Тактичные штаны: идеальное сочетание стиля и практичности, сделанные для динамичного образа жизни.
Тактичные штаны: выбор современного мужчины, и какие модели стоит выбрать для уникального стиля.
тактичні штани жіночі [url=https://vijskovitaktichnishtanu.kiev.ua/]тактичні штани жіночі[/url] .
Robert Lewandowski https://robert-lewandowski.prostoprosport-br.com e um futebolista polones, atacante do clube espanhol Barcelona e capitao da selecao polonesa. Considerado um dos melhores atacantes do mundo. Cavaleiro da Cruz do Comandante da Ordem do Renascimento da Polonia.
Discovered an article that will surely interest you – I recommend checking it out http://boyara-analia.flybb.ru/viewtopic.php?f=7&t=673
Снижение комиссии в сети. до этого момента, например, https://aktivnyj-dialog.forumotion.com/t186-topic#https://aktivnyj-dialog.forumotion.com/t186-topic биткоин именовался электронной наличностью.
Nice article, thanks! Just check sex cam sites this out.
[url=http://remote.ecostm.co.kr/bbs/board.php?bo_table=c1&wr_id=12348]Naked hot webcams w[/url][url=https://sample115.tlogsir.com/bbs/board.php?bo_table=tl_product02&wr_id=478]Naked amateur cams[/url] 7a5515b
why not find out more [url=https://youtube.com/shorts/fi7zQPhlQco]scannable Ohio fake id[/url]
check that [url=https://www.youtube.com/shorts/p4noMt7gxCw]scannable Alabama fake ids[/url]
Kevin De Bruyne https://kevin-de-bruyne.prostoprosport-br.com Futebolista belga, meio-campista do Manchester club City” e a selecao belga. Formado pelos clubes de futebol “Ghent” e “Genk”. Em 2008 iniciou sua carreira adulta, fazendo sua estreia no Genk.
Excellent and high-quality live free sex cams absolutely free and easy to watch on any device, just
[url=http://hantechfa.com/bbs/board.php?bo_table=free&wr_id=17388]Naked hot webcams m[/url][url=https://naeunhome.cafe24.com/bbs/board.php?bo_table=review&wr_id=439]Naked amateur webca[/url] 20f1_f1
check it out [url=https://youtube.com/shorts/pRIrjr9q-08]order Texas fake id[/url]
Stumbled upon an interesting article – I suggest you take a look http://kvartal8b.getbb.ru/viewtopic.php?f=19&t=21150
Are There Any Costs Involved?
aviator game
Профессиональные seo https://seo-optimizaciya-kazan.ru услуги для максимизации онлайн-видимости вашего бизнеса. Наши эксперты проведут глубокий анализ сайта, оптимизируют контент и структуру, улучшат технические аспекты и разработают индивидуальные стратегии продвижения.
Antoine Griezmann https://antoine-griezmann.prostoprosport-br.com Futebolista frances, atacante e meio-campista do Atletico de Madrid. Jogador e vice-capitao da selecao francesa, integrante da selecao – campea mundial 2018. Medalhista de prata no Europeu de 2016 e no Mundial de 2022.
click to investigate [url=https://youtube.com/shorts/JP1dqf4dPDM]scannable Connecticut fake id[/url]
Homepage von http://www.spreadpussy.pro
[url=https://sample115.tlogsir.com/bbs/board.php?bo_table=tl_product02&wr_id=483]Nude hot cams mode[/url][url=https://trust-used.com/best-gaming-laptop-models/]Nude amateur webcams girls live porn show[/url] 656eb76
Выберите стильные тактичные штаны для повседневной носки, которые подчеркнут вашу индивидуальность.
Новинки в мире тактичной одежды: лучшие штаны, для активного образа жизни.
Как правильно выбрать тактичные штаны, и какие модели стоит обратить внимание.
Выберите удобные тактичные штаны для своего гардероба, и какие модели актуальны в этом сезоне.
Идеальные тактичные штаны для похода на природу, и какие модели стоит выбрать для уникального стиля.
зимові тактичні штани [url=https://vijskovitaktichnishtanu.kiev.ua/]https://vijskovitaktichnishtanu.kiev.ua/[/url] .
Профессиональные seo https://seo-optimizaciya-kazan.ru услуги для максимизации онлайн-видимости вашего бизнеса. Наши эксперты проведут глубокий анализ сайта, оптимизируют контент и структуру, улучшат технические аспекты и разработают индивидуальные стратегии продвижения.
https://images.google.com.ly/url?q=https://subscribe.ru/author/25924851/group/records/?page=53
Ederson Santana de Moraes https://edersonmoraes.prostoprosport-br.com Futebolista brasileiro, goleiro do clube Manchester City e da Selecao Brasileira . Participante do Campeonato Mundial 2018. Bicampeao de Portugal pelo Benfica e pentacampeao de Inglaterra pelo Manchester City.
anchor [url=https://youtube.com/shorts/uGe2YE_Uqr8]buy New Jersey fake ids[/url]
view [url=https://youtube.com/shorts/qdiio6YfAGI]order Florida fake id[/url]
Evolution and Technological Advancements
aviator game
Virgil van Dijk https://virgilvandijk.prostoprosport-br.com Futebolista holandes, zagueiro central, capitao do clube ingles Liverpool e capitao do a selecao holandesa.
Discover the best sex cam chat ever for free!
[url=http://thinktoy.net/bbs/board.php?bo_table=customer2&wr_id=393446]Nude hot cams girl[/url][url=https://trust-used.com/best-gaming-laptop-models/]Naked hot webcams girls online porn char[/url] 35f320f
20th Anniversary Grand Prize Drawing Saturday, January 27 Earn Entries January 2 – 27 Kicking offf our 20th anniversary year with a lot
more winners and bigger …..
My blog post; Trends
This piece of writing will help the internet
visitors for building up new weblog or even a weblog from start
to end.
[Casino Name], each offering unique bonuses and promotions for Aviator Game players.
aviator game
This paragraph is really a good one it assists new net viewers, who are wishing in favor of blogging.
sexo live chat videos absolutely free and easy to watch on any device, just
[url=http://www.kiccoltd.co.kr/bbs/board.php?bo_table=free&wr_id=784838]Nude hot webcams mo[/url][url=http://hantechfa.com/bbs/board.php?bo_table=free&wr_id=17503]Nude hot webcams mo[/url] f2_cfa4
Как выбрать лучшие тактичные штаны для активного отдыха, которые подчеркнут вашу индивидуальность.
Выберите стильные тактичные штаны для своего гардероба, которые подчеркнут вашу уверенность и стиль.
Как правильно выбрать тактичные штаны, для максимального комфорта и функциональности.
Выберите удобные тактичные штаны для своего гардероба, для стильного и практичного образа.
Какие материалы лучше всего подойдут для тактичных штанов, и какие модели стоит выбрать для уникального стиля.
штани зимові тактичні [url=https://vijskovitaktichnishtanu.kiev.ua/]https://vijskovitaktichnishtanu.kiev.ua/[/url] .
Выберите стильные тактичные штаны для повседневной носки, для идеального комфорта и функциональности.
Новинки в мире тактичной одежды: лучшие штаны, для активного образа жизни.
Как правильно выбрать тактичные штаны, чтобы выглядеть стильно в любой ситуации.
Какие тактичные штаны подойдут именно вам, и какие модели актуальны в этом сезоне.
Идеальные тактичные штаны для похода на природу, для максимального комфорта в походе.
штани чоловічі тактичні [url=https://vijskovitaktichnishtanu.kiev.ua/]штани чоловічі тактичні[/url] .
Как выбрать лучшие тактичные штаны для активного отдыха, для идеального комфорта и функциональности.
Тактичные штаны: модные тренды этого сезона, которые подчеркнут вашу уверенность и стиль.
Как правильно выбрать тактичные штаны, для максимального комфорта и функциональности.
Тактичные штаны: идеальное сочетание стиля и практичности, для стильного и практичного образа.
Какие материалы лучше всего подойдут для тактичных штанов, для максимального комфорта в походе.
тактичні зимові штани [url=https://vijskovitaktichnishtanu.kiev.ua/]https://vijskovitaktichnishtanu.kiev.ua/[/url] .
to your liking, and quickly move to the section with #1 cam sex on this topic. All categories are packed enough to make
[url=http://www.kiccoltd.co.kr/bbs/board.php?bo_table=free&wr_id=785062]Naked amateur webca[/url][url=http://test.aocoolers.co.kr/bbs/board.php?bo_table=pension&wr_id=132]Naked hot cams mod[/url] 10a7a55
На сайте https://ipoteka-1.ru представлена вся самая актуальная, полезная информация, касающаяся ипотеки на вторичку, новостройку. Представлен материал о созаемщиках, о том, что лучше: арендовать жилье либо взять ипотеку. Есть данные о расходах на ипотеку и каким образом их понизить. Вы узнаете все о займах в режиме реального времени, как получить ипотеку, чтобы вам не отказали. Все статьи написаны экспертами, поэтому в них только точная и надежная информация. Вы получите ответ на вопрос, как быть, если нечем платить за ипотеку.
[b]Здравствуйте[/b]!
Задался вопросом: можно ли на самом деле купить диплом государственного образца в Москве? Был приятно удивлен — это реально и легально!
Сначала искал информацию в интернете на тему: купить диплом в усолье-сибирском, купить диплом слесаря, купить диплом института, купить диплом в смоленске , купить диплом в чите и получил базовые знания. В итоге остановился на материале: http://mir.4admins.ru/viewtopic.php?f=10&t=12739
Успешной учебы!
plane crashes, making it a game of both luck and timing. This dynamic gameplay keeps players engaged and coming
aviator game
Идеальные тактичные штаны для любого случая, сделанные из качественных материалов.
Тактичные штаны: модные тренды этого сезона, которые подчеркнут вашу уверенность и стиль.
Чем отличаются тактичные штаны от обычных, чтобы выглядеть стильно в любой ситуации.
Выберите удобные тактичные штаны для своего гардероба, для стильного и практичного образа.
Какие материалы лучше всего подойдут для тактичных штанов, чтобы чувствовать себя комфортно в любой ситуации.
купити штани тактичні [url=https://vijskovitaktichnishtanu.kiev.ua/]https://vijskovitaktichnishtanu.kiev.ua/[/url] .
Victor James Osimhen https://victor-osimhen.prostoprosport-br.com e um futebolista nigeriano que atua como atacante. O clube italiano Napoli e a selecao nigeriana.
how to lend money legally Please check these policies before you submit any personal data to these websites.
На сайте http://koleso-na-hodu.ru каждый желающий получает возможность приобрести шины больших, а также редких размеров с оперативной доставкой по всему городу, области. Непосредственно на сайте у вас получится подобрать шины, исходя из таких параметров, как: ширина, высота профиля, диаметр, стоимость, производитель, сезонность. Вся продукция сертифицированная, качественная, оригинальная. Если остались вопросы, то заполните специальную форму со своими данными, чтобы менеджер перезвонил для уточнения определенных моментов.
live sex chat porn absolutely free and easy to watch on any device, just
[url=http://www.globaldream.or.kr/bbs/board.php?bo_table=sub08_02&wr_id=702]Naked hot cams wom[/url][url=http://ecostm.co.kr/bbs/board.php?bo_table=c1&wr_id=12408]Naked hot cams gir[/url] 6eb7620
Risk Management: Setting limits on how much to bet and when to cash out.
п»їaviator game
видеостена купить москва [url=http://kupit-videostenu.ru/]видеостена купить москва[/url] .
https://maps.google.jo/url?q=https://subscribe.ru/author/25924851/group/records/?page=52
Как выбрать лучшие тактичные штаны для активного отдыха, сделанные из качественных материалов.
Выберите стильные тактичные штаны для своего гардероба, для активного образа жизни.
Как правильно выбрать тактичные штаны, и какие модели стоит обратить внимание.
Выберите удобные тактичные штаны для своего гардероба, для стильного и практичного образа.
Тактичные штаны: выбор современного мужчины, чтобы чувствовать себя комфортно в любой ситуации.
зимові тактичні штани [url=https://vijskovitaktichnishtanu.kiev.ua/]https://vijskovitaktichnishtanu.kiev.ua/[/url] .
Romelu Menama Lukaku Bolingoli https://romelulukaku.prostoprosport-br.com Futebolista belga, atacante do clube ingles Chelsea e da selecao belga . Por emprestimo, ele joga pelo clube italiano Roma.
Discover the best sexo live chat ever for free!
[url=http://hantechfa.com/bbs/board.php?bo_table=free&wr_id=17611]Naked amateur cams[/url][url=https://community.katawatbusiness.com/question/nude-amateur-cams-model-online-porn-show-2/]Nude amateur cams model online porn show[/url] a5515b3
Всем привет! Может кто знает, где почитать полезные блоги о недвижимости? Пока нашел https://an72.ru
Выберите стильные тактичные штаны для повседневной носки, для идеального комфорта и функциональности.
Выберите стильные тактичные штаны для своего гардероба, которые подчеркнут вашу уверенность и стиль.
Советы по выбору тактичных штанов, чтобы выглядеть стильно в любой ситуации.
Тактичные штаны: идеальное сочетание стиля и практичности, и какие модели актуальны в этом сезоне.
Какие материалы лучше всего подойдут для тактичных штанов, и какие модели стоит выбрать для уникального стиля.
тактичні зимові штани чоловічі [url=https://vijskovitaktichnishtanu.kiev.ua/]https://vijskovitaktichnishtanu.kiev.ua/[/url] .
Roberto Carlos da Silva Rocha https://roberto-carlos.prostoprosport-br.com Brazilian footballer, left back. He was also capable of playing as both a central defender and a defensive midfielder. World champion 2002, silver medalist at the 1998 World Championships.
Идеальные тактичные штаны для любого случая, которые подчеркнут вашу индивидуальность.
Выберите стильные тактичные штаны для своего гардероба, сделанные для вашего комфорта.
Чем отличаются тактичные штаны от обычных, и какие модели стоит обратить внимание.
Какие тактичные штаны подойдут именно вам, для стильного и практичного образа.
Тактичные штаны: выбор современного мужчины, чтобы чувствовать себя комфортно в любой ситуации.
тактичні зимові штани чоловічі [url=https://vijskovitaktichnishtanu.kiev.ua/]https://vijskovitaktichnishtanu.kiev.ua/[/url] .
Origins of the Aviator Game
aviator game
says:Just check this out, sex live chats for free!
[url=https://naeunhome.cafe24.com/bbs/board.php?bo_table=review&wr_id=448]Naked amateur webca[/url][url=https://www.iunobenessere.it/come-combattere-la-cellulite/]Nude amateur cams woman online porn show[/url] 3656eb7
Как выбрать лучшие тактичные штаны для активного отдыха, сделанные из качественных материалов.
Тактичные штаны: модные тренды этого сезона, которые подчеркнут вашу уверенность и стиль.
Чем отличаются тактичные штаны от обычных, чтобы выглядеть стильно в любой ситуации.
Выберите удобные тактичные штаны для своего гардероба, и какие модели актуальны в этом сезоне.
Идеальные тактичные штаны для похода на природу, чтобы чувствовать себя комфортно в любой ситуации.
військові тактичні штани [url=https://vijskovitaktichnishtanu.kiev.ua/]https://vijskovitaktichnishtanu.kiev.ua/[/url] .
Играй и выигрывай в 1win казино, становись богаче.
Азартные игры в 1win казино, гарантируют яркие эмоции.
1win казино – ключ к финансовой независимости, выигрывай и радуйся.
Разгадай тайны удачи с 1win казино, закрывай невероятные джекпоты.
1win казино – твой шанс на удачу и успех, воплоти свои мечты в реальность.
Почувствуй адреналин победы в 1win казино, получай награды без границ.
1win казино – твой путь к успеху и богатству, получить все, что ты заслуживаешь.
Удовольствие и адреналин в 1win казино, гарантировано доставит тебе радость.
1win скачать [url=https://luchshiye-onlayn-kazino-rb.com/]1win скачать[/url] .
Neymar da Silva Santos Junior https://neymar.prostoprosport-br.com e um futebolista brasileiro que atua como atacante, ponta e atacante. meio-campista do clube saudita Al-Hilal e da selecao brasileira. Considerado um dos melhores jogadores do mundo. O maior artilheiro da historia da Selecao Brasileira.
Kylian Mbappe is a French professional footballer who plays as a forward for Paris Saint-Germain and the French national team. Renowned for his speed, dribbling, and finishing, Mbappe has won numerous titles, including multiple Ligue 1 championships and the FIFA World Cup in 2018. Find out more about him here – https://kylianmbappe.paris-saint-germain-ar.com/
Как выбрать лучшие тактичные штаны для активного отдыха, для идеального комфорта и функциональности.
Тактичные штаны: модные тренды этого сезона, для активного образа жизни.
Чем отличаются тактичные штаны от обычных, и какие модели стоит обратить внимание.
Какие тактичные штаны подойдут именно вам, сделанные для динамичного образа жизни.
Тактичные штаны: выбор современного мужчины, чтобы чувствовать себя комфортно в любой ситуации.
штани тактичні чоловічі [url=https://vijskovitaktichnishtanu.kiev.ua/]штани тактичні чоловічі[/url] .
Как выбрать лучшие тактичные штаны для активного отдыха, сделанные из качественных материалов.
Выберите стильные тактичные штаны для своего гардероба, для активного образа жизни.
Как правильно выбрать тактичные штаны, для максимального комфорта и функциональности.
Какие тактичные штаны подойдут именно вам, и какие модели актуальны в этом сезоне.
Идеальные тактичные штаны для похода на природу, и какие модели стоит выбрать для уникального стиля.
зимові тактичні штани [url=https://vijskovitaktichnishtanu.kiev.ua/]https://vijskovitaktichnishtanu.kiev.ua/[/url] .
Thomas Mueller https://thomasmueller.prostoprosport-br.com is a German football player who plays for the German Bayern Munich. Can play in different positions – striker, attacking midfielder. The most titled German footballer in history
Eligible corporations were then assessed on the percentage of females in their leadership positions.
Here is my blog https://heealthy.com/question/unlocking-the-mysteries-of-securing-the-perfect-helper-job/
Выберите стильные тактичные штаны для повседневной носки, для идеального комфорта и функциональности.
Тактичные штаны: модные тренды этого сезона, для активного образа жизни.
Чем отличаются тактичные штаны от обычных, для максимального комфорта и функциональности.
Тактичные штаны: идеальное сочетание стиля и практичности, для стильного и практичного образа.
Какие материалы лучше всего подойдут для тактичных штанов, и какие модели стоит выбрать для уникального стиля.
тактичні штани жіночі [url=https://vijskovitaktichnishtanu.kiev.ua/]тактичні штани жіночі[/url] .
Homepage von live sex cams xxx
[url=https://naeunhome.cafe24.com/bbs/board.php?bo_table=review&wr_id=449]Naked hot webcams g[/url][url=https://trust-used.com/best-gaming-laptop-models/]Nude amateur cams model online sex char[/url] 515b35f
https://maps.google.com.co/url?q=https://subscribe.ru/author/25924851/group/records/?page=51
Как выбрать лучшие тактичные штаны для активного отдыха, которые подчеркнут вашу индивидуальность.
Тактичные штаны: модные тренды этого сезона, для активного образа жизни.
Как правильно выбрать тактичные штаны, для максимального комфорта и функциональности.
Тактичные штаны: идеальное сочетание стиля и практичности, сделанные для динамичного образа жизни.
Тактичные штаны: выбор современного мужчины, для максимального комфорта в походе.
штани військові тактичні [url=https://vijskovitaktichnishtanu.kiev.ua/]https://vijskovitaktichnishtanu.kiev.ua/[/url] .
Conclusion
aviator game
Идеальные тактичные штаны для любого случая, которые подчеркнут вашу индивидуальность.
Тактичные штаны: модные тренды этого сезона, сделанные для вашего комфорта.
Как правильно выбрать тактичные штаны, чтобы выглядеть стильно в любой ситуации.
Какие тактичные штаны подойдут именно вам, для стильного и практичного образа.
Какие материалы лучше всего подойдут для тактичных штанов, для максимального комфорта в походе.
тактичні військові штани [url=https://vijskovitaktichnishtanu.kiev.ua/]https://vijskovitaktichnishtanu.kiev.ua/[/url] .
Всем привет! Подскажите, где найти полезные блоги о недвижимости? Пока нашел https://armid44.ru
Now that you know its positive aspects, right here are some of the most effective lymphatic drainage massage spas in Singapore.
my web page :: http://homeidealist.gorenje.ru/spinach_smoothie/
Nice article, thanks! Just check https://amateurgang.com this out.
[url=https://toteblogs.com/posts/Best-Vitamin-C-Serums-for-Brighter-Skin-]Naked amateur cams woman live porn show[/url][url=https://community.katawatbusiness.com/question/nude-hot-cams-model-live-sex-show-2/]Nude hot cams model live sex show[/url] 656eb76
Jude Victor William Bellingham https://jude-bellingham.prostoprosport-cz.org anglicky fotbalista, zaloznik spanelskeho klubu Real Madrid a anglicky narodni tym. V dubnu 2024 ziskal cenu za prulom roku z Laureus World Sports Awards. Stal se prvnim fotbalistou, ktery ji obdrzel.
Kylian Mbappe is a French professional footballer who plays as a forward for Paris Saint-Germain and the French national team. Renowned for his speed, dribbling, and finishing, Mbappe has won numerous titles, including multiple Ligue 1 championships and the FIFA World Cup in 2018. Find out more about him here – https://kylianmbappe.paris-saint-germain-ar.com/
Discovered an interesting article, I suggest you familiarize yourself http://www.scaleforum.ru/member.php?u=62004
Edson Arantes do Nascimento https://pele.prostoprosport-br.com Brazilian footballer, forward (attacking midfielder. Played for Santos clubs) and New York Cosmos. Played 92 matches and scored 77 goals for the Brazilian national team.
Erling Breut Haaland https://erling-haaland.prostoprosport-cz.org je norsky fotbalista, ktery hraje jako utocnik za Anglicky klub Manchester City a norska reprezentace. Rekordman anglicke Premier League v poctu golu za sezonu.
Nice article, thanks! Just check amateurs4sex.com this out.
[url=http://thinktoy.net/bbs/board.php?bo_table=customer2&wr_id=394788]Nude amateur cams[/url][url=http://remote.ecostm.co.kr/bbs/board.php?bo_table=c1&wr_id=12433]Nude hot cams mode[/url] 20f6_9d
https://images.google.com.uy/url?q=http://surl.li/pivppd
Лучшее казино для игры – 1win, начните игру прямо сейчас!
1win казино – место, где рождаются победы, выигрывайте крупные суммы вместе с 1win казино!
Увлекательное казино 1win ждет вас, попробуйте сами и убедитесь!
1win казино: ваш путь к легким деньгам, получите удовольствие от азарта!
1win казино: играйте и выигрывайте, присоединяйтесь к победителям!
1win зеркало [url=https://populyarnoye-onlayn-kazino-belarusi.com/]1win зеркало[/url] .
Kylian Mbappe Lotten https://kylian-mbappe.prostoprosport-cz.org Francouzsky fotbalista, utocnik Paris Saint-Germain a kapitan tymu francouzskeho tymu. 1. cervence 2024 se stane hracem spanelskeho klubu Real Madrid.
Outstanding post but I was wondering if you could write a litte more on this topic?
I’d be very thankful if you could elaborate a little bit more.
Cheers!
Encountered a captivating article, I propose you read https://wiki.hightgames.ru/index.php/UkrGo:_Ваша_Доска_Объявлений_в_Украине
Nice articl! Just check live cam chat sex this out!
[url=http://www.kiccoltd.co.kr/bbs/board.php?bo_table=free&wr_id=786918]Naked amateur cams[/url][url=http://remote.ecostm.co.kr/bbs/board.php?bo_table=c1&wr_id=12441]Nude hot cams woma[/url] bba3656
Как выбрать лучшие тактичные штаны для активного отдыха, которые подчеркнут вашу индивидуальность.
Новинки в мире тактичной одежды: лучшие штаны, сделанные для вашего комфорта.
Как правильно выбрать тактичные штаны, для максимального комфорта и функциональности.
Тактичные штаны: идеальное сочетание стиля и практичности, сделанные для динамичного образа жизни.
Какие материалы лучше всего подойдут для тактичных штанов, и какие модели стоит выбрать для уникального стиля.
купити штани чоловічі тактичні [url=https://vijskovitaktichnishtanu.kiev.ua/]купити штани чоловічі тактичні[/url] .
If you have federal https://dully.us/%ED%8F%89%ED%98%95-%EA%B3%84%EC%82%B0%EA%B8%B0-%ED%8F%89%ED%98%95%EC%9D%84-%EC%A0%95%ED%99%95%ED%9E%88-%EA%B3%84%EC%82%B0%ED%95%98%EB%8A%94-%EB%B9%84%EB%B0%80-%EB%8F%84%EA%B5%AC/ loans immediately after 2010, you most likely only have Direct Loans.
Incredible all kinds of very good tips!
Приветствую. Подскажите, где почитать разные блоги о недвижимости? Сейчас читаю https://azimut-irkutsk.ru
Discover the best free live sex cam chat ever for free!
[url=https://sample115.tlogsir.com/bbs/board.php?bo_table=tl_product02&wr_id=515]Nude hot cams mode[/url][url=https://toteblogs.com/posts/Best-Vitamin-C-Serums-for-Brighter-Skin-]Nude amateur webcams model live sex show[/url] bba3656
https://maps.google.iq/url?q=http://surl.li/drltnb
Mohamed Salah https://mohamed-salah.prostoprosport-cz.org je egyptsky fotbalista, ktery hraje jako utocnik za anglictinu. klub Liverpool a egyptsky narodni tym. Povazovan za jednoho z nejlepsich fotbalistu na svete.
Недавно я увидел потрясающую VR-гарнитуру, о которой давно мечтал. Но денег на неё не хватало, а кредитная история у меня была не лучшая. Решил искать выход и в Яндексе нашел на первом месте Телеграм канал [url=https://t.me/s/mfo_2024_online]займы новые мфо[/url] . Это сразу внушило доверие. На канале я нашел множество новых МФО, которые давали займы всем, даже с плохой кредитной историей. Оформив займ за 10 минут, я быстро получил деньги и купил гарнитуру. Теперь наслаждаюсь виртуальной реальностью и планирую улучшить свою кредитную историю. Всем советую подписаться на этот канал!
Harry Kane https://harry-kane.prostoprosport-cz.org dostal pozvanku do anglickeho tymu nezletilych jako prvni cas 17. na turnaj mladeze v Portugalsku. Utocnik se zaroven kvuli vazne nemoci neobjevil na triumfalnim mistrovstvi Evropy muzu do 17 let 2010 pro Brity.
Kevin De Bruyne https://kevin-de-bruyne.prostoprosport-cz.org Belgicky fotbalista, zaloznik Manchesteru klub City” a belgicky narodni tym. Absolvent fotbalovych klubu „Ghent” a „Genk”. V roce 2008 zahajil svou karieru dospelych, debutoval v Genku.
[url=https://sps134.ru]https://sps134.ru[/url] вызов сантехника.
вызов сантехника [url=https://sps134.ru]https://sps134.ru[/url].
срочный вызов сантехника [url=https://sps134.ru]https://sps134.ru[/url].
сантехник вызов [url=https://sps134.ru]https://sps134.ru[/url].
[url=https://sps134.ru]https://sps134.ru[/url] сантехник на дом.
[url=https://sps134.ru]https://sps134.ru[/url] сантехнические работы.
[url=https://sps134.ru]https://sps134.ru[/url] сантехнические услуги.
сантехнические работы вызвать мастера [url=https://sps134.ru]https://sps134.ru[/url] .
мастер сантехник [url=https://sps134.ru]https://sps134.ru[/url] .
Vinicius Jose Paixan de Oliveira Junior vinicius-junior.prostoprosport-cz.org bezne znamy jako Vinicius Junior je brazilsky a spanelsky fotbalista , utocnik klubu Real Madrid a brazilsky reprezentant.
Variants include Super 7 Blackjack, Pirate 21,
and MultiHand Blackjack.
Feel free to surf to my webpage: User-Friendly
In Wisconsin, it is illegal to participate in gambling activities,
plus it is also illegal to offer you them.
My web site :: popular
Homepage von live sex chat vidios
[url=https://toteblogs.com/posts/Best-Vitamin-C-Serums-for-Brighter-Skin-]Naked hot webcams girls online sex char[/url][url=http://thinktoy.net/bbs/board.php?bo_table=customer2&wr_id=395571]Nude hot cams girl[/url] b762012
http://www.google.es/url?q=https://subscribe.ru/author/25924851/group/records/?page=50
Всем привет! Подскажите, где почитать разные статьи о недвижимости? Пока нашел https://ecn-novodom.ru
[b]Привет всем[/b])
Студенческая жизнь прекрасна, пока не приходит время писать диплом, как это случилось со мной. Не стоит отчаиваться, ведь существуют компании, которые помогают с написанием и защитой диплома на высокие оценки!
Сначала я искал информацию по теме: купить диплом в новоуральске, купить диплом в чебоксарах, купить диплом в новочебоксарске, купить диплом в екатеринбурге, купить диплом в новочеркасске, а потом наткнулся на https://vk.com/club52212509?w=wall-52212509_11501, где все мои учебные проблемы были решены!
Удачи!
[u][b] Добрый день![/b][/u]
Для определенных людей, заказать [b]диплом[/b] о высшем образовании – это необходимость, удачный шанс получить достойную работу. Но для кого-то – это банальное желание не терять массу времени на учебу в институте. Что бы ни толкнуло вас на это решение, наша фирма готова помочь вам. Быстро, качественно и недорого сделаем диплом любого ВУЗа и года выпуска на настоящих бланках с реальными печатями.
[b]Наша компания предлагает[/b] быстро и выгодно купить диплом, который выполняется на бланке ГОЗНАКа и заверен мокрыми печатями, водяными знаками, подписями официальных лиц. Документ пройдет лубую проверку, даже с использованием специфических приборов. Достигайте свои цели быстро с нашей компанией.
[b]Плюсы наших документов:[/b]
• используем лишь настоящие бланки “Гознака”;
• подлинные подписи должностных лиц;
• настоящие печати ВУЗа;
• специальные водяные знаки, нити и иные степени защиты;
• идеальное качество оформления – ошибки исключены;
• любая проверка документа.
[b]Где приобрести диплом по актуальной специальности?[/b]
http://www.lada-xray.net/member.php?u=2434
[b]Успешной учебы![/b]
Lionel Messi https://lionel-messi.prostoprosport-cz.org je argentinsky fotbalista, utocnik a kapitan klubu MLS Inter Miami. , kapitan argentinske reprezentace. Mistr sveta, vitez Jizni Ameriky, vitez finale, olympijsky vitez. Povazovan za jednoho z nejlepsich fotbalistu vsech dob.
Bernardo Silva https://bernardo-silva.prostoprosport-cz.org Portugalsky fotbalista, zaloznik. Narozen 10. srpna 1994 v Lisabonu. Silva je povazovan za jednoho z nejlepsich utocnych zalozniku na svete. Fotbalista je povestny svou vytrvalosti a vykonem.
Antoine Griezmann https://antoine-griezmann.prostoprosport-cz.org Francouzsky fotbalista, utocnik a zaloznik za Atletico de Madrid. Hrac a vicekapitan francouzskeho narodniho tymu, clen tymu – mistr sveta 2018 Stribrny medailista z mistrovstvi Evropy 2016 a mistrovstvi sveta 2022.
Robert Lewandowski https://robert-lewandowski.prostoprosport-cz.org je polsky fotbalista, utocnik spanelskeho klubu Barcelona a kapitan polskeho narodniho tymu. Povazovan za jednoho z nejlepsich utocniku na svete. Rytir krize velitele polskeho renesancniho radu.
live one on one sex chat videos absolutely free and easy to watch on any device, just
[url=http://thinktoy.net/bbs/board.php?bo_table=customer2&wr_id=395762]Nude hot cams mode[/url][url=https://naeunhome.cafe24.com/bbs/board.php?bo_table=review&wr_id=453]Naked amateur cams[/url] a5515b3
Thanks. Lots of stuff.
Have a look at my blog :: http://paintings.freehostia.com/plogger/?level=picture&id=26
ebony sex cam videos absolutely free and easy to watch on any device, just
[url=http://shinyoungwood.co.kr/bbs/board.php?bo_table=free&wr_id=795343]Naked amateur webca[/url][url=https://sample115.tlogsir.com/bbs/board.php?bo_table=tl_product02&wr_id=521]Nude hot webcams wo[/url] 3656eb7
русское порно анал бесплатно [url=https://skladchik.org/]русское порно анал бесплатно[/url] .
Just check out the best gay sex live cam ever!
[url=http://thinktoy.net/bbs/board.php?bo_table=customer2&wr_id=396176]Naked hot cams gir[/url][url=http://test.aocoolers.co.kr/bbs/board.php?bo_table=pension&wr_id=142]Nude hot cams mode[/url] b762012
best website for payday loan The court may force the bank, through a legal motion, to continue to provide you with basic bank services, but the bank will remain reluctant to grant loans to you unless it wholeheartedly believes you were merely a victim in the matter, Pendeault says.
Приветствую. Может кто знает, где найти разные блоги о недвижимости? Пока нашел https://germes-alania.ru
you can look here [url=https://tronlink.cash]download tronlink[/url]
cum2livecams.com absolutely free and easy to watch on any device, just
[url=http://thinktoy.net/bbs/board.php?bo_table=customer2&wr_id=396329]Nude amateur cams[/url][url=http://hantechfa.com/bbs/board.php?bo_table=free&wr_id=17838]Nude hot webcams mo[/url] 5515b35
Индивидуалки Тюмень
Amazing! Its in fact remarkable piece of writing, I have
got much clear idea on the topic of from this post.
Excellent and high-quality real hidden cam sex absolutely free and easy to watch on any device, just
[url=http://hantechfa.com/bbs/board.php?bo_table=free&wr_id=17866]Nude amateur cams[/url][url=http://ecostm.co.kr/bbs/board.php?bo_table=c1&wr_id=12490]Nude hot cams mode[/url] bba3656
[u][b] Добрый день![/b][/u]
Для многих людей, заказать диплом университета – это необходимость, удачный шанс получить отличную работу. Однако для кого-то – это понятное желание не терять время на учебу в универе. Что бы ни толкнуло вас на такой шаг, мы готовы помочь. Оперативно, профессионально и недорого сделаем диплом любого ВУЗа и года выпуска на подлинных бланках с реальными подписями и печатями.
[b]Заказать документ[/b] о получении высшего образования вы сможете в нашей компании в столице. Мы предлагаем документы об окончании любых университетов Российской Федерации. Вы получите необходимый диплом по любой специальности, включая документы образца СССР. Даем 100% гарантию, что в случае проверки документа работодателями, никаких подозрений не возникнет.
Плюсы наших документов:
• используем настоящие бланки “Гознак”;
• необходимые подписи руководства;
• мокрые печати ВУЗа;
• специальные водяные знаки, нити и иные степени защиты;
• безупречное заполнение и оформление – ошибки полностью исключены;
• любая проверка документа.
[b]Наши специалисты предлагают[/b] выгодно и быстро приобрести диплом, который выполнен на оригинальной бумаге и заверен печатями, штампами, подписями должностных лиц. Наш диплом пройдет любые проверки, даже при использовании профессионального оборудования. Достигайте цели быстро и просто с нашим сервисом.
[b]Где заказать диплом по актуальной специальности?[/b]
https://volnodumie.bbmy.ru/viewtopic.php?id=10700#p21960
[b]Успешной учебы![/b]
купить диплом специалиста [url=https://vm-tver.ru/]vm-tver.ru[/url] .
have a peek at this website [url=https://flstudio.app]Fl studio download[/url]
Проститутки Тюмени
anal threesome chat live sexo
[url=https://community.katawatbusiness.com/question/naked-hot-webcams-model-online-porn-show-2/]Naked hot webcams model online porn show[/url][url=http://www.kiccoltd.co.kr/bbs/board.php?bo_table=free&wr_id=789755]Nude hot cams woma[/url] bba3656
Pablo Martin Paez Gavira https://gavi.prostoprosport-cz.org Spanelsky fotbalista, zaloznik barcelonskeho klubu a spanelske reprezentace. Povazovan za jednoho z nejtalentovanejsich hracu sve generace. Ucastnik mistrovstvi sveta 2022. Vitez Ligy narodu UEFA 2022/23
[url=https://peaksview.me/en]House rental in Montenegro[/url] – Аренда загородных домов в Жабляке, House in the mountains of Montenegro for rent
Luka Modric https://luka-modric.prostoprosport-cz.org je chorvatsky fotbalista, stredni zaloznik a kapitan spanelskeho tymu. klub Real Madrid, kapitan chorvatskeho narodniho tymu. Uznavan jako jeden z nejlepsich zalozniku nasi doby. Rytir Radu prince Branimira. Rekordman chorvatske reprezentace v poctu odehranych zapasu.
Son Heung Min https://son-heung-min.prostoprosport-cz.org Jihokorejsky fotbalista, utocnik a kapitan anglickeho klubu Premier League Tottenham Hotspur a narodniho tymu Korejske republiky. V roce 2022 vyhral Zlatou kopacku Premier League.
Cristiano Ronaldo https://cristiano-ronaldo.prostoprosport-cz.org je portugalsky fotbalista, utocnik, kapitan Saudske Arabie klubu An-Nasr a portugalskeho narodniho tymu. Mistr Evropy. Povazovan za jednoho z nejlepsich fotbalistu vsech dob. Nejlepsi strelec v historii fotbalu podle IFFIS a ctvrty podle RSSSF
Home Page [url=https://galaxy-swapper.org]galaxyswapper[/url]
Приветствую. Может кто знает, где почитать полезные блоги о недвижимости? Сейчас читаю https://ilinka2.ru
find out this here [url=https://pal-world.org]Palworld download[/url]
Discover the best http://www.flexypussy.net ever for free!
[url=https://trust-used.com/best-gaming-laptop-models/]Naked hot cams model live porn char[/url][url=https://sample115.tlogsir.com/bbs/board.php?bo_table=tl_product02&wr_id=530]Naked hot webcams m[/url] a7a5515
http://plus.google.com/url?q=https://subscribe.ru/author/25924851/group/records/?page=49
Все, https://radioenergyfm.ru/ что теперь вам надо для слушания радио – это пользоваться нашим плеером.
You can definitely see your skills in the work
you write. The sector hopes for even more passionate writers such as
you who aren’t afraid to mention how they believe.
All the time follow your heart.
Pedro Gonzalez Lopez https://pedri.prostoprosport-cz.org lepe znamy jako Pedri, je spanelsky fotbalista, ktery hraje jako utocny zaloznik. za Barcelonu a spanelskou reprezentaci. Bronzovy medailista z mistrovstvi Evropy 2020 a zaroven nejlepsi mlady hrac tohoto turnaje.
Discovered a unique article – recommended to acquaint yourself! https://www.import-moto.com/users/88
Nice articl! Just check online live sex chat this out!
[url=https://sample115.tlogsir.com/bbs/board.php?bo_table=tl_product02&wr_id=531]Nude hot cams mode[/url][url=http://hantechfa.com/bbs/board.php?bo_table=free&wr_id=17939]Naked amateur cams[/url] 515b35f
Alison Ramses Becker https://alisson-becker.prostoprosport-cz.org Brazilsky fotbalista nemeckeho puvodu, brankar klubu Liverpool a brazilsky narodni tym. Je povazovan za jednoho z nejlepsich brankaru sve generace a je znamy svymi vynikajicimi zakroky, presnosti prihravek a schopnosti jeden na jednoho.
We’re a group of volunteers and opening a new scheme in our community.
Your website provided us with valuable info to work on. You have done a formidable job
and our whole community will be grateful to you.
Karim Benzema https://karim-benzema.prostoprosport-cz.org je francouzsky fotbalista, ktery hraje jako utocnik za Saudskou Arabii. Arabsky klub Al-Ittihad. Hral za francouzsky narodni tym, za ktery odehral 97 zapasu a vstrelil 37 branek. V 17 letech se stal jednim z nejlepsich hracu rezervy, nastrilel tri desitky golu za sezonu.
Rodrigo Silva de Goiz https://rodrygo.prostoprosport-cz.org Brazilsky fotbalista, utocnik Realu Madrid a brazilskeho narodniho tymu. V breznu 2017 byl Rodrigo povolan do narodniho tymu Brazilie U17 na zapasy Montague Tournament.
[u][b] Добрый день![/b][/u]
Для некоторых людей, приобрести [b]диплом[/b] университета – это острая потребность, шанс получить достойную работу. Но для кого-то – это очевидное желание не терять огромное количество времени на учебу в ВУЗе. Что бы ни толкнуло вас на такое решение, наша фирма готова помочь вам. Максимально быстро, профессионально и по разумной стоимости сделаем документ любого года выпуска на настоящих бланках с реальными подписями и печатями.
[b]Наша компания предлагает[/b] быстро купить диплом, который выполняется на оригинальной бумаге и заверен печатями, водяными знаками, подписями. Документ пройдет лубую проверку, даже при использовании специального оборудования. Решайте свои задачи быстро с нашими дипломами.
[b]Основные преимущества наших документов:[/b]
• используются лишь фирменные бланки “Гознак”;
• необходимые подписи руководства;
• все печати ВУЗа;
• специальные водяные знаки, нити и другие степени защиты;
• безупречное качество оформления – ошибки исключены;
• любые проверки оригинальности документа.
[b]Дипломы об окончании ВУЗов и ССУЗов России:[/b]
– Повышают статус владельца;
– Открывают большие возможности в обществе;
– Повышают уважение в глазах обычных граждан;
– Повышают собственную самооценку.
[b]Где купить диплом по необходимой специальности?[/b]
http://forum.nnov.org/group.php?groupid=58
[b]Удачи![/b]
Discovered an article that will surely interest you – I recommend checking it out https://fbc.net.ua/news/stati/chy-vygidno-praczyuvaty-v-taksi-analiz-plyusiv-ta-minusiv/
says:Just check this out, random live sex chat for free!
[url=https://trust-used.com/best-gaming-laptop-models/]Nude hot webcams model online sex show[/url][url=http://www.globaldream.or.kr/bbs/board.php?bo_table=sub08_02&wr_id=719]Nude hot cams mode[/url] bba3656
Алтайский центр природного камня предоставляет прекрасную возможность купить глыбы с лишайником и мхом по самым привлекательным ценам. Существенно сэкономим ваши денежные средства! Мы осуществляем доставку. Гарантируем великолепное обслуживание. Вы можете сами в этом убедиться. Чтобы узнать сроки поставки и получить фото камня, пожалуйста, отправьте в WhatsApp запрос. Ищете купить гранитные скальные глыбы? Altdikam.ru – портал, мы регулярно работаем над его улучшением. Здесь все ясно и наглядно. Если у вас появились интересующие вопросы, позвоните нам по телефону. Будем рады вам помочь!
I for all time emailed this website post page to all my associates, because if like to read it then my contacts will too.
https://images.google.az/url?q=https://subscribe.ru/author/25924851/group/records/?page=48
[url=https://bs4shop.top/]блек спрут оригинальная ссылка[/url] – блэкспрут сайт, блек спрут оригинальная ссылка
Thibaut Nicolas Marc Courtois https://thibaut-courtois.prostoprosport-cz.org Belgicky fotbalista, brankar spanelskeho klubu Real Madrid . V sezone 2010/11 byl uznan jako nejlepsi brankar v belgicke Pro League a take hrac roku pro Genk. Trojnasobny vitez Ricardo Zamora Trophy
Bruno Guimaraes Rodriguez Moura https://bruno-guimaraes.prostoprosport-cz.org Brazilsky fotbalista, defenzivni zaloznik Newcastlu United a Brazilsky narodni tym. Vitez olympijskych her 2020 v Tokiu.
Virgil van Dijk https://virgil-van-dijk.prostoprosport-cz.org Nizozemsky fotbalista, stredni obrance, kapitan anglickeho klubu Liverpool a kapitan nizozemskeho narodniho tymu.
Thanks on your marvelous posting! I truly enjoyed reading it, you’re a great author.
I will remember to bookmark your blog and definitely will come back at some point.
I want to encourage you to definitely continue
your great job, have a nice weekend!
Toni Kroos https://toni-kroos.prostoprosport-cz.org je nemecky fotbalista, ktery hraje jako stredni zaloznik za Real Madrid a nemecky narodni tym. Mistr sveta 2014. Prvni nemecky hrac v historii, ktery sestkrat vyhral Ligu mistru UEFA.
Homepage von indian live sex chat
[url=http://www.kiccoltd.co.kr/bbs/board.php?bo_table=free&wr_id=790850]Nude amateur cams[/url][url=http://shinyoungwood.co.kr/bbs/board.php?bo_table=free&wr_id=797125]Naked amateur webca[/url] 10a7a55
Just check this out, live sex chat rooms
[url=http://thinktoy.net/bbs/board.php?bo_table=customer2&wr_id=397640]Naked hot webcams m[/url][url=https://sample115.tlogsir.com/bbs/board.php?bo_table=tl_product02&wr_id=533]Nude amateur cams[/url] 56eb762
[url=https://blacksprut-sait.top/]блэкспрут darknet[/url] – блэкспрут ссылка, блэкспрут сайт
Stumbled upon a unique article, I suggest you take a look http://power.ekafe.ru/viewtopic.php?f=2&t=1727
Toni Kroos https://toni-kroos.prostoprosport-cz.org je nemecky fotbalista, ktery hraje jako stredni zaloznik za Real Madrid a nemecky narodni tym. Mistr sveta 2014. Prvni nemecky hrac v historii, ktery sestkrat vyhral Ligu mistru UEFA.
Darwin Gabriel Nunez Ribeiro https://darwin-nunez.prostoprosport-cz.org Uruguaysky fotbalista, utocnik anglickeho klubu Liverpool a Uruguaysky narodni tym. Bronzovy medailista mistrovstvi Jizni Ameriky mezi mladeznickymi tymy.
Romelu Menama Lukaku Bolingoli https://romelu-lukaku.prostoprosport-cz.org Belgicky fotbalista, utocnik anglickeho klubu Chelsea a Belgican vyber. Na hostovani hraje za italsky klub Roma.
уличные спортивные комплексы для детей и взрослых [url=www.ploshadka-sport.ru/]уличные спортивные комплексы для детей и взрослых[/url] .
live sex chat video absolutely free and easy to watch on any device, just
[url=http://www.kiccoltd.co.kr/bbs/board.php?bo_table=free&wr_id=791066]Naked hot webcams w[/url][url=https://community.katawatbusiness.com/question/nude-amateur-webcams-woman-live-porn-show/]Nude amateur webcams woman live porn show[/url] 3656eb7
[u][b] Привет![/b][/u]
Наши специалисты предлагают выгодно купить диплом, который выполняется на оригинальном бланке и заверен мокрыми печатями, штампами, подписями. Наш диплом способен пройти любые проверки, даже с применением профессиональных приборов. Решите свои задачи максимально быстро с нашей компанией.
[b]Где заказать диплом специалиста?[/b]
https://angelladydety.getbb.ru/posting.php?mode=post&f=46&sid=e89984d3a025252ca7c36e520836b9a3
[b]Успешной учебы![/b]
Excellent and high-quality free live sex chat cams absolutely free and easy to watch on any device, just
[url=http://remote.ecostm.co.kr/bbs/board.php?bo_table=c1&wr_id=12530]Naked hot webcams w[/url][url=http://www.kiccoltd.co.kr/bbs/board.php?bo_table=free&wr_id=791340]Nude amateur cams[/url] 5b35f32
Find out https://igirls.space for free 🙂
[url=http://thinktoy.net/bbs/board.php?bo_table=customer2&wr_id=398208]Nude amateur webcam[/url][url=http://remote.ecostm.co.kr/bbs/board.php?bo_table=c1&wr_id=12534]Nude hot webcams gi[/url] 6eb7620
самые дешевые проститутки проститутки недорого
buy tiktok account with followers https://tiktok-followers-buy.com
buy 1 million tiktok followers buy tiktok followers tokmatic
отчаянные домохозяйки онлайн качество https://domohozyayki-serial.ru
Homepage von sex live cam
[url=https://sample115.tlogsir.com/bbs/board.php?bo_table=tl_product02&wr_id=540]Nude hot cams girl[/url][url=http://shinyoungwood.co.kr/bbs/board.php?bo_table=free&wr_id=798342]Naked hot webcams m[/url] 56eb762
[b]Привет всем[/b])
Студенческая жизнь прекрасна, пока не приходит время писать диплом, как это случилось со мной. Не стоит отчаиваться, ведь существуют компании, которые помогают с написанием и защитой диплома на высокие оценки!
Сначала я искал информацию по теме: купить диплом в ижевске, купить диплом в севастополе, купить морской диплом, купить диплом в киселевске, купить диплом в рязани, а потом наткнулся на https://forum.shvedun.ru/ucp.php?mode=login, где все мои учебные проблемы были решены!
Хорошей учебы!
Excellent and high-quality camaras de sexo en vivo absolutely free and easy to watch on any device, just
[url=https://sample115.tlogsir.com/bbs/board.php?bo_table=tl_product02&wr_id=541]Nude hot webcams mo[/url][url=http://thinktoy.net/bbs/board.php?bo_table=customer2&wr_id=398750]Naked hot webcams m[/url] eb76201
рио бет казино вход Rio Bet Casino
kijiji bad credit loans A good review will not only inform you about different scams but will also drive in the point that you need to be especially careful about whom you give your personal information to – especially details such as your Social Security Number and your date of birth.
1win казино: стартуйте с дополнительным призом
1win официальный сайт [url=https://xn—-7sbb2afcierdfbl.xn--90ais/]https://xn—-7sbb2afcierdfbl.xn--90ais/[/url] .
бонус драгон мани казино драгон мани казино
Большой выбор игровых автоматов, рабочее зеркало сайта https://fartunaplay.ru играть на реальные деньги онлайн
Discovered a unique article – recommended to acquaint yourself! http://forumjustwoman.getbb.ru/viewtopic.php?f=43&t=971
Качественная и недорогая комплект детской мебели лучшие цены, доставка и сборка.
No deposit bonuses give you the opportunity to play casino games for no cost!
Also visit my blog :: https://lifelifit.com/shake-out-to-burn-up-your-body/
http://www.google.com.ag/url?q=https://subscribe.ru/author/25924851/group/records/?page=47
live sex cams xxx videos absolutely free and easy to watch on any device, just
[url=https://community.katawatbusiness.com/question/nude-hot-webcams-woman-live-porn-show-2/]Nude hot webcams woman live porn show[/url][url=http://www.kiccoltd.co.kr/bbs/board.php?bo_table=free&wr_id=792560]Naked hot webcams m[/url] a3656eb
Note that thee games feature true dealers, real tables, and actual cards.
Feel free to surf to my site; go to This site
https://bs4shop.top/ – blacksprut onion, блек спрут онион
Всем привет! Может кто знает, где почитать разные блоги о недвижимости? Пока нашел https://kolontaevo-club.ru
chat sex live absolutely free and easy to watch on any device, just
[url=http://remote.ecostm.co.kr/bbs/board.php?bo_table=c1&wr_id=12557]Naked hot webcams g[/url][url=http://hantechfa.com/bbs/board.php?bo_table=free&wr_id=18254]Naked amateur webca[/url] 320f3_a
[u][b] Привет![/b][/u]
Сотрудники, у которых имеется высшее образование очень ценятся среди начальства. [b]Диплом[/b] университета будет необходим, чтобы доказать свое мастерство. Он дает понять нанимателю, что работник обладает нужными навыками и знаниями чтобы эффективно выполнить свою задачу. Но как же быть, когда знания есть, а вот соответствующего документа у опытного специалиста нет? [b]Заказ диплома[/b] поможет решить данную проблему. Приобретение диплома любого университета России у нас является надежным процессом, потому что документ будет заноситься в государственный реестр. Печать производится на специальных бланках ГОЗНАКа.
[b]Где купить диплом по необходимой специальности?[/b]
http://autoprajs.ru/15204.html
[b]Успехов в учебе![/b]
Pin Up casino https://pin-up.salexy.kz official website, Pin Up slot machines play for money online, Pin Up mirror working for today.
Slot machines on the official website and mirrors of the Pin Up online casino https://pin-up.tr-kazakhstan.kz are available for free mode, and after registering at Pin Up Casino Ru you can play for money.
Sports in Azerbaijan https://idman-xeberleri.com.az development and popular sports Azerbaijan is a country with rich sports traditions and outstanding achievements on the international stage.
Pin up entry to the official website. Play online casino Pin Up https://pin-up.prostoprosport.ru for real money. Register on the Pin Up Casino website and claim bonuses!
[u][b] Привет, друзья![/b][/u]
Для некоторых людей, заказать [b]диплом[/b] о высшем образовании – это острая потребность, шанс получить достойную работу. Но для кого-то – это разумное желание не терять время на учебу в институте. Что бы ни толкнуло вас на такое решение, мы готовы помочь. Оперативно, качественно и выгодно сделаем диплом нового или старого образца на подлинных бланках с реальными подписями и печатями.
[b]Наши специалисты предлагают[/b] выгодно приобрести диплом, который выполнен на оригинальном бланке и заверен мокрыми печатями, штампами, подписями. Документ способен пройти лубую проверку, даже при использовании специального оборудования. Решайте свои задачи максимально быстро с нашими дипломами.
[b]Превосходства наших документов:[/b]
• используются лишь качественные бланки “Гознак”;
• необходимые подписи должностных лиц;
• настоящие печати ВУЗа;
• водяные знаки, нити и прочие степени защиты;
• безупречное качество оформления – ошибок не бывает;
• любые проверки оригинальности документа.
[b]Где приобрести диплом специалиста?[/b]
https://egais.wiki/index.php?title=???????_?????????_?_?????_???????:_??????_??????_?_??????????_?????????????????_?????????????
[b]Хорошей учебы![/b]
Nice articl! Just check strip chat live sex this out!
[url=http://lashnbrow.kr/bbs/board.php?bo_table=free&wr_id=2393251]Nude hot cams woma[/url][url=http://remote.ecostm.co.kr/bbs/board.php?bo_table=c1&wr_id=12560]Naked amateur cams[/url] bba3656
На сайте https://linii-okraski.ru/ вы сможете заказать линии окраски рулонного металла. Только в этой компании все изделия созданы с использованием революционных технологий и представляют собой уникальную и инновационную разработку, которая обязательно поможет вашему бизнесу. Линии Окраски отличаются отсутствием аналогов, являются особым изобретением. На технику предоставляются гарантии – 24 месяца. При необходимости воспользуйтесь профессиональной технической поддержкой, которая работает в круглосуточном режиме.
Слушатели при помощи взаимной контакта могут порадовать своего любимого https://https://retrofmradio.ru// и заказать композицию.
Nice article, thanks! Just check ebony live sex chat this out.
[url=https://community.katawatbusiness.com/question/naked-amateur-webcams-girls-online-porn-char-3/]Naked amateur webcams girls online porn char[/url][url=https://sample115.tlogsir.com/bbs/board.php?bo_table=tl_product02&wr_id=549]Naked amateur webca[/url] 7a5515b
https://blacksprut-sait.top/ – blacksprut даркнет, блэкспрут 2fa
World of Games https://onlayn-oyunlar.com.az provides the latest news about online games, game reviews, gameplay and ideas, game tactics and tips. The most popular and spectacular
The main sports news of Azerbaijan https://idman.com.az. Your premier source for the latest news, exclusive interviews, in-depth analysis and live coverage of everything happening in sports in Azerbaijan.
UFC in Azerbaijan https://ufc.com.az news, schedule of fights and tournaments 2024, rating of UFC fighters, interviews, photos and videos. Live broadcasts and broadcasts of tournaments, statistics.
NHL (National Hockey League) News https://nhl.com.az the latest and greatest NHL news for today. Sports news – latest NHL news, standings, match results, online broadcasts.
[u][b] Добрый день![/b][/u]
Для многих людей, купить диплом о высшем образовании – это острая необходимость, уникальный шанс получить достойную работу. Впрочем для кого-то – это желание не терять время на учебу в институте. Что бы ни толкнуло вас на это решение, мы готовы помочь. Оперативно, профессионально и по доступной цене изготовим диплом любого ВУЗа и года выпуска на настоящих бланках со всеми необходимыми подписями и печатями.
[b]Заказать документ[/b] института можно в нашей компании. Мы предлагаем документы об окончании любых ВУЗов Российской Федерации. Вы получите необходимый диплом по любым специальностям, включая документы Советского Союза. Гарантируем, что при проверке документа работодателем, каких-либо подозрений не возникнет.
Превосходства наших документов:
• используются настоящие бланки “Гознак”;
• необходимые подписи должностных лиц;
• все печати университета;
• водяные знаки, нити и другие степени защиты;
• безупречное качество оформления – ошибок не бывает;
• любые проверки документа.
[b]Наша компания предлагает[/b] выгодно купить диплом, который выполнен на оригинальном бланке и заверен мокрыми печатями, штампами, подписями. Документ способен пройти любые проверки, даже с использованием профессионального оборудования. Достигайте цели быстро и просто с нашим сервисом.
[b]Где купить диплом специалиста?[/b]
http://recept-food.ru/kupit-diplom-rf-v-moskve-reshenie-dlya-vashey-kareryi
[b]Хорошей учебы![/b]
купить диплом в люберцах [url=https://vm-tver.ru/]купить диплом в люберцах[/url] .
http://aeroviewimage.com/
set limits: establish deposit and withdrawal limits to reserve your betting mostbet in check.
Feel free to visit my web page – https://mosbetuz.com/
Brand video production Dubai
Came across an interesting article, I propose you have a look http://kedu.ru/bitrix/rk.php?goto=https://zoopornsexx.su/
Nice articl! Just check free web cam sex this out!
[url=http://thinktoy.net/bbs/board.php?bo_table=customer2&wr_id=400869]Naked hot cams gir[/url][url=https://sample115.tlogsir.com/bbs/board.php?bo_table=tl_product02&wr_id=552]Naked hot webcams m[/url] 0a7a551
Top sports news https://idman-azerbaycan.com.az photos and blogs from experts and famous athletes, as well as statistics and information about matches of leading championships.
Latest news and details about the NBA in Azerbaijan https://nba.com.az. Hot events, player transfers and the most interesting events. Explore the world of the NBA with us.
Discover the fascinating world of online games with GameHub Azerbaijan https://online-game.com.az. Get the latest news, reviews and tips for your favorite games. Join our gaming community today!
The latest top football news https://futbol.com.az today. Interviews with football players, online broadcasts and match results, analytics and football forecasts, photos and videos.
ремонт стиральных машин в москве адреса [url=www.centr-remonta-stiralnyh-mashin.ru/]www.centr-remonta-stiralnyh-mashin.ru/[/url] .
Safety is paramount when playing online games. Players should ensure they are playing on reputable platforms
aviator game
What’s up it’s me, I am also visiting this web page regularly, this web site is
in fact fastidious and the users are in fact sharing nice thoughts.
Found an enthralling read that I’d recommend – it’s truly fascinating http://p33340zg.beget.tech/2024/07/01/ukrgo-vse-obyavleniya-odessy-v-odnom-meste.html
Homepage von couples sex cam
[url=http://www.kiccoltd.co.kr/bbs/board.php?bo_table=free&wr_id=794846]Naked hot webcams w[/url][url=http://test.aocoolers.co.kr/bbs/board.php?bo_table=pension&wr_id=162]Nude amateur cams[/url] 56eb762
Ищите строительство дома в Сочи и Краснодарском крае под ключ? Зайдите на сайт https://alternativa-sochi.ru/ где вы сможете ознакомиться с проектами домов и портфолио Компании Альтернатива и заказать строительство под ключ – качественные, быстровозводимые, энергоэффективные каркасные дома от фундамента до чистовой отделки. Гарантия, поэтапная оплата, помощь с ипотекой. Подробнее на сайте.
As Mega Millions, the multiplier number is randomly chosen ahead of each and every drawing.
my website: https://woodsrunners.com/index.php/Powerball:_A_Deep_Dive_Into_Winning
[u][b] Здравствуйте![/b][/u]
Для многих людей, купить [b]диплом[/b] университета – это острая потребность, удачный шанс получить отличную работу. Но для кого-то – это желание не терять время на учебу в ВУЗе. Что бы ни толкнуло вас на такой шаг, мы готовы помочь вам. Быстро, профессионально и выгодно сделаем диплом любого года выпуска на настоящих бланках со всеми необходимыми печатями.
[b]Наша компания предлагает[/b] выгодно и быстро приобрести диплом, который выполнен на оригинальной бумаге и заверен печатями, водяными знаками, подписями. Документ способен пройти любые проверки, даже при использовании профессиональных приборов. Достигайте цели быстро и просто с нашим сервисом.
[b]Основные преимущества наших документов:[/b]
• используются настоящие бланки “Гознака”;
• необходимые подписи руководства;
• мокрые печати ВУЗа;
• водяные знаки, нити и прочие степени защиты;
• идеальное заполнение и оформление – ошибок не будет;
• любые проверки документа.
[b]Дипломы и аттестаты об окончании ВУЗов и ССУЗов РФ:[/b]
– Автоматически повышают статус владельца;
– Открывают большие возможности на рынке труда;
– Повышают уважение в глазах обычных граждан;
– Повышают личную самооценку.
[b]Где приобрести диплом по нужной специальности?[/b]
http://censornet.ru/kupit-nastoyashhiy-diplom-o-vyisshem-obrazovanii/
[b]Успехов в учебе![/b]
Most regulated domestic sportsbooks do not give betting on college sports or props in college matches.
Here is my website; https://punt17.blogvivi.com/28338299/secure-sports-betting-sites-in-south-korea
Just check out the best https://sensualflash.com ever!
[url=https://toteblogs.com/posts/Best-Vitamin-C-Serums-for-Brighter-Skin-]Naked amateur cams model live sex char[/url][url=http://thinktoy.net/bbs/board.php?bo_table=customer2&wr_id=401249]Naked hot cams wom[/url] 0a7a551
эскорт услуги от индивидуалок москвы https://prostitutki-213.ru. Вызвать проститутку на любой вкус по низким ценам. Каталог шлюх Москвы
Каталог рейтингов хостингов https://pro-hosting.tech на любой вкус и под любые, даже самые сложные, задачи.
Сантехник — вызов сантехника на дом в Москве и Московской области в удобное для вас время.
Safety and Fair Play
aviator game
Play PUBG Mobile https://pubg-mobile.com.az an exciting world of high-quality mobile battle royale. Unique maps, strategies and intense combat await you in this exciting mobile version of the popular game.
The Dota 2 website https://dota2.com.az Azerbaijan provides the most detailed information about the latest game updates, tournaments and upcoming events. We have all the winning tactics, secrets and important guides.
Это Ксения Ростова, Ольга Малинина, Алексей Тихомиров, Юлия Деточкина, https://https://yumorfmradio.ru// Александр Балашов и другие узнаваемые ведущие.
Discover the best vr sex cam ever for free!
[url=https://community.katawatbusiness.com/question/nude-amateur-cams-model-online-porn-show-3/]Nude amateur cams model online porn show[/url][url=http://remote.ecostm.co.kr/bbs/board.php?bo_table=c1&wr_id=12595]Naked hot cams mod[/url] 1210a7a
[u][b] Здравствуйте![/b][/u]
Для определенных людей, заказать [b]диплом[/b] университета – это острая потребность, шанс получить выгодную работу. Но для кого-то – это желание не терять время на учебу в ВУЗе. С какой бы целью вам это не понадобилось, мы готовы помочь. Максимально быстро, профессионально и выгодно сделаем диплом любого года выпуска на государственных бланках со всеми печатями.
[b]Мы предлагаем[/b] быстро и выгодно купить диплом, который выполняется на оригинальном бланке и заверен печатями, водяными знаками, подписями официальных лиц. Диплом способен пройти любые проверки, даже при использовании специфических приборов. Решайте свои задачи быстро с нашими дипломами.
[b]Основные преимущества наших документов:[/b]
• используем настоящие бланки “Гознак”;
• оригинальные подписи руководства;
• мокрые печати учебного заведения;
• водяные знаки, нити и прочие степени защиты;
• идеальное качество оформления – ошибок не бывает;
• любые проверки документа.
[b]Дипломы и аттестаты об окончании ВУЗов и ССУЗов Российской Федерации:[/b]
– Повышают статус своего владельца;
– Открывают массу возможностей на рынке труда;
– Повышают уважение в глазах окружающих;
– Повышают самооценку.
[b]Где приобрести диплом по актуальной специальности?[/b]
http://gti-club.ru/forum/member.php?u=23001
[b]Успехов в учебе![/b]
купить диплом в астрахани [url=https://vm-tver.ru/]vm-tver.ru[/url] .
Установка VRF-систем Казань
Homepage von hidden cam gay sex
[url=http://remote.ecostm.co.kr/bbs/board.php?bo_table=c1&wr_id=12608]Nude hot cams girl[/url][url=http://thinktoy.net/bbs/board.php?bo_table=customer2&wr_id=401591]Nude amateur cams[/url] 56eb762
Установка кондиционера на лоджии Казань
Хотите сделать в квартире ремонт? Тогда советуем вам посетить сайт https://stroyka-gid.ru, где вы найдете всю необходимую информацию по строительству и ремонту.
Latest news about games for Android https://android-games.com.az, reviews and daily updates. Read now and get the latest information on the most exciting games
Check out the latest news, guides and in-depth reviews of the available options for playing Minecraft Az https://minecraft.com.az. Find the latest information about Minecraft Download, Pocket Edition and Bedrock Edition.
cash-out perfectly.
aviator game
The most popular sports site https://sports.com.az of Azerbaijan, where the latest sports news, forecasts and analysis are collected.
Latest news and analytics of the Premier League https://premier-league.com.az. Detailed descriptions of matches, team statistics and the most interesting football events. EPL Azerbaijan is the best place for football fans.
Europe is increasing into one of the biggest on-line gaming markets
around the globe.
Also visit my web page personalized
https://blacksprut-sait.top/ – блэк спрут ссылка, блэкспрут даркнет
Came across an interesting article, worth a glance https://www.liveinternet.ru/users/laralim/post506212424/
[u][b] Здравствуйте![/b][/u]
Для определенных людей, заказать диплом о высшем образовании – это необходимость, уникальный шанс получить достойную работу. Но для кого-то – это очевидное желание не терять массу времени на учебу в универе. Что бы ни толкнуло вас на это решение, наша фирма готова помочь. Быстро, качественно и по доступной цене изготовим документ нового или старого образца на подлинных бланках со всеми требуемыми подписями и печатями.
[b]Купить документ[/b] о получении высшего образования можно в нашей компании. Мы оказываем услуги по изготовлению и продаже документов об окончании любых ВУЗов РФ. Вы получите необходимый диплом по любой специальности, любого года выпуска, в том числе документы образца СССР. Даем гарантию, что в случае проверки документа работодателями, каких-либо подозрений не появится.
Основные преимущества наших документов:
• используем лишь настоящие бланки “Гознака”;
• подлинные подписи руководства;
• мокрые печати учебного заведения;
• специальные водяные знаки, нити и иные степени защиты;
• идеальное качество оформления – ошибки исключены;
• любая проверка документов.
[b]Мы предлагаем[/b] быстро и выгодно купить диплом, который выполнен на бланке ГОЗНАКа и заверен печатями, водяными знаками, подписями. Диплом пройдет любые проверки, даже с использованием профессионального оборудования. Решите свои задачи быстро и просто с нашей компанией.
[b]Где заказать диплом по актуальной специальности?[/b]
http://c90226sl.beget.tech/2023/08/05/gde-kupit-diplom-v-moskve-s-garantiej-kachestva/
[b]Удачи![/b]
[b]Здравствуйте[/b]!
Задался вопросом: можно ли на самом деле купить диплом государственного образца в Москве? Был приятно удивлен — это реально и легально!
Сначала искал информацию в интернете на тему: купить диплом в владикавказе, купить диплом в улан-удэ, купить диплом в комсомольске-на-амуре, купить диплом в златоусте , купить диплом геодезиста и получил базовые знания. В итоге остановился на материале: http://goblin-film.net/index.php?subaction=userinfo&user=imoceci
Успехов в учебе!
to your liking, and quickly move to the section with xhamster live sex chat on this topic. All categories are packed enough to make
[url=http://hantechfa.com/bbs/board.php?bo_table=free&wr_id=18451]Naked hot webcams m[/url][url=http://thinktoy.net/bbs/board.php?bo_table=customer2&wr_id=401753]Nude amateur cams[/url] f6_36a8
хорошие почитатели огорода советуют разбивать сад с юга на https://xn—-7sbahcidia5fd3ae5rh.xn--p1ai/cat/dekorativnye-kustarniki/sakura/ север.
[u][b] Добрый день![/b][/u]
Мы готовы предложить дипломы любой профессии по приятным тарифам. Цена может зависеть от выбранной специальности, года выпуска и ВУЗа. Всегда стараемся поддерживать для клиентов адекватную ценовую политику.
[b]Где купить диплом по актуальной специальности?[/b]
5-5.ru/index.php?links_exchange=yes&page=501&show_all=yes
[b]Хорошей учебы![/b]
[u][b] Добрый день![/b][/u]
Для определенных людей, приобрести [b]диплом[/b] о высшем образовании – это острая необходимость, возможность получить хорошую работу. Но для кого-то – это желание не терять множество времени на учебу в универе. С какой бы целью вам это не потребовалось, наша компания готова помочь. Максимально быстро, профессионально и по доступной цене изготовим документ любого года выпуска на государственных бланках со всеми необходимыми подписями и печатями.
[b]Наши специалисты предлагают[/b] выгодно приобрести диплом, который выполнен на оригинальной бумаге и заверен печатями, водяными знаками, подписями официальных лиц. Документ пройдет лубую проверку, даже при помощи специального оборудования. Решайте свои задачи быстро и просто с нашим сервисом.
[b]О преимуществах наших документов:[/b]
• используем только настоящие бланки “Гознака”;
• необходимые подписи должностных лиц;
• настоящие печати университета;
• специальные водяные знаки, нити и иные степени защиты;
• безупречное заполнение и оформление – ошибки полностью исключены;
• любая проверка документов.
[b]Где заказать диплом по нужной специальности?[/b]
http://ukrevents.ru/diplom-na-zakaz-individualnyiy-podhod-i-professionalnoe-ispolnenie/
[b]Хорошей учебы![/b]
Greetings I am so excited I found your blog, I really found you by accident, while I was browsing on Bing for something else, Regardless I am here now and would just like to say thanks for a incredible post and a all round thrilling blog (I also love the theme/design), I don’t have time to browse it all at the minute but I have book-marked it and also added in your RSS feeds, so when I have time I will be back to read a lot more, Please do keep up the great job.
Сигнализация с автозапуском на Geely Atlas
Is there a opportunity either lawsuit could eventually prevail and send Florida back to the beginning line?
Look at my web page; https://woodsrunners.com/index.php/Unveiling_Sports_Toto_Sites:_All_You_Need_To_Know
[u][b] Добрый день![/b][/u]
[b]Заказать документ[/b] ВУЗа вы имеете возможность в нашей компании в столице. Мы предлагаем документы об окончании любых ВУЗов России. Вы получите необходимый диплом по любым специальностям, включая документы образца СССР. Даем 100% гарантию, что при проверке документов работодателем, подозрений не появится.
[b]Где приобрести диплом по необходимой специальности?[/b]
https://stonecraft.diary.ru/p221944096_zhelaete-kupit-diplom-universiteta.htm
[b]Хорошей учебы![/b]
instant cash advance 28th street southwest wyoming mi In fact, the Identity Theft Penalty Enhancement Act signed into legislation in 2004 established identity theft as a federal crime.
Hey fantastic blog! Does running a blog such as this take a lot of work?
I have very little knowledge of computer programming however I had been hoping
to start my own blog soon. Anyhow, if you have any suggestions
or techniques for new blog owners please share. I understand this is off subject however I just had to ask.
Thank you!
[u][b] Привет![/b][/u]
Наши специалисты предлагают быстро и выгодно купить диплом, который выполняется на бланке ГОЗНАКа и заверен мокрыми печатями, водяными знаками, подписями должностных лиц. Данный диплом способен пройти лубую проверку, даже с применением профессиональных приборов. Решите свои задачи максимально быстро с нашим сервисом.
[b]Где купить диплом по актуальной специальности?[/b]
http://kingcityrp.moibb.ru/posting.php?mode=post&f=34
[b]Хорошей учебы![/b]
Just check out the best https://sexygirlsnet.com ever!
[url=http://thinktoy.net/bbs/board.php?bo_table=customer2&wr_id=401831]Naked hot cams mod[/url][url=http://test.aocoolers.co.kr/bbs/board.php?bo_table=pension&wr_id=167]Naked amateur webca[/url] 656eb76
Playing the Aviator Game is a thrilling experience. Players place their bets and watch the plane take off, with
aviator game
[u][b] Добрый день![/b][/u]
Приобрести диплом о высшем образовании.
Цена во много раз меньше той, которую потребовалось бы заплатить на очном обучении в ВУЗе
[b]Где заказать диплом специалиста?[/b]
http://allrealtor.ru/threads/1412/
[b]Удачи![/b]
Whats up are using WordPress for your blog platform? I’m new to the blog world but I’m
trying to get started and create my own. Do you need any html coding expertise
to make your own blog? Any help would be really appreciated!
rgbet
Nice article, thanks! Just check indian live sex cam this out.
[url=http://test.aocoolers.co.kr/bbs/board.php?bo_table=pension&wr_id=168]Naked hot cams wom[/url][url=http://thinktoy.net/bbs/board.php?bo_table=customer2&wr_id=401881]Nude hot cams girl[/url] 7620121
When the industry moves, close any position to lock in a profit or cease a loss.
my page: https://www.freiercafe.net/proxy.php?link=https://www.fundable.com/soon-dutcher
На сайте https://lan-union.ru предлагается к покупке сетевое и кабельное оборудование. В каталоге компании вы найдете подробное описание, также характеристики продукции и товаров производителя. На сайте вы можете увидеть сертификаты на продукцию, и детальнее ознакомиться с сервисом. Из преимуществ компании, можно отметить быструю логистику, высочайшее качество оборудования и расширенную гарантию. Для того чтобы быть в курсе акций и новостей компании, подпишитесь на рассылку.
Good answer back in return of this query with genuine arguments and describing the whole thing concerning that.
https://LoveFlover.ru — сайт посвященный комнатным растениям. Предлагает подробные статьи о выборе, выращивании и уходе за различными видами комнатных растений. Здесь можно найти полезные советы по созданию зелёного уголка в доме, руководства по декору и решению распространённых проблем, а также информацию о подходящих горшках и удобрениях. Платформа помогает создавать уютную атмосферу и гармонию в интерьере с помощью растений.
1xbet https://1xbet.best-casino-ar.com with withdrawal without commission. Register online in a few clicks. A large selection of slot machines in mobile applications and convenient transfers in just a few minutes.
Pin Up official https://pin-up.adb-auto.ru website. Login to your personal account and register through the Pin Up mirror. Slot machines for real money at Pinup online casino.
experiences. These communities provide valuable insights and foster a sense of camaraderie among players.
aviator game
Pin-up Casino https://pin-up.admsov.ru/ is an online casino licensed and regulated by the government of Curacao . Founded in 2016, it is home to some of the industry’s leading providers, including NetEnt, Microgaming, Play’n GO and others. This means that you will be spoiled for choice when it comes to choosing a game.
1win зеркало сайта скачать на андроид
Discovered a unique article – recommended to acquaint yourself! https://galantclub.od.ua/member.php?u=27724
https://sexylatinbitches.com absolutely free and easy to watch on any device, just
[url=http://hantechfa.com/bbs/board.php?bo_table=free&wr_id=18495]Naked hot webcams w[/url][url=http://test.aocoolers.co.kr/bbs/board.php?bo_table=pension&wr_id=169]Nude amateur cams[/url] 20f7_b7
https://muhammadcenter.com/saransk/
http://images.google.nr/url?q=https://subscribe.ru/author/25924851/group/records/?page=46
http://xn--hg3b25hm0h.com/bbs/board.php?bo_table=free&wr_id=301812
1win мобильное приложение скачать
навес для двух машины из поликарбоната
Приветствую. Может кто знает, где почитать полезные статьи о недвижимости? Пока нашел https://mcsspb.ru
[u][b] Привет, друзья![/b][/u]
Мы предлагаем быстро и выгодно заказать диплом, который выполняется на оригинальном бланке и заверен печатями, штампами, подписями официальных лиц. Документ способен пройти любые проверки, даже с применением профессионального оборудования. Достигайте свои цели быстро и просто с нашими дипломами.
[b]Где приобрести диплом специалиста?[/b]
https://volnodumie.bbmy.ru/viewtopic.php?id=12332#p25047
[b]Удачи![/b]
Pin Up online casino https://pin-up.webrabota77.ru/ is the official website of a popular gambling establishment for players from the CIS countries. The site features thousands of slot machines, online tables and other branded entertainment from Pin Up casino.
Pin Up Casino https://pin-up.noko39.ru Registration and Login to the Official Pin Up Website. thousands of slot machines, online tables and other branded entertainment from Pin Up casino. Come play and get big bonuses from the Pinup brand today
says:Just check this out, vr sex cam for free!
[url=http://test.aocoolers.co.kr/bbs/board.php?bo_table=pension&wr_id=170]Naked hot cams wom[/url][url=https://sample115.tlogsir.com/bbs/board.php?bo_table=tl_product02&wr_id=573]Naked amateur webca[/url] 3656eb7
https://projectblueberryserver.com/index.php/Saransk
https://okiai.tsubasahayashi.com/bulletin-board/topic/dosaaf
When you register at Wild Casino, you maay get a five-aspect welcome bonus.
Here is my webpage :: Great post to Read
that use encryption and secure payment methods to protect their personal and financial information.
aviator game
[u][b] Добрый день![/b][/u]
Мы можем предложить дипломы любой профессии по доступным ценам.
Мы готовы предложить документы техникумов, которые расположены в любом регионе РФ. Можно приобрести качественно сделанный диплом от любого заведения, за любой год, включая сюда документы СССР. Документы печатаются на бумаге самого высшего качества. Это позволяет делать государственные дипломы, не отличимые от оригиналов. Они заверяются необходимыми печатями и подписями.
[b]Где приобрести диплом специалиста?[/b]
https://dailygram.com/blog/1303546/%D0%B3%D0%B4%D0%B5-%D0%BC%D0%BE%D0%B6%D0%BD%D0%BE-%D0%BA%D1%83%D0%BF%D0%B8%D1%82%D1%8C-%D0%B0%D1%82%D1%82%D0%B5%D1%81%D1%82%D0%B0%D1%82-%D0%B2-%D0%BC%D0%BE%D1%81%D0%BA%D0%B2%D0%B5-%D0%BF%D1%80%D0%BE%D0%B2%D0%B5%D1%80%D0%B5%D0%BD%D0%BD%D1%8B%D0%B5-%D1%81%D0%BF%D0%BE%D1%81%D0%BE%D0%B1%D1%8B/
Реальные анкеты проституток https://prostitutki-213.ru Москвы с проверенными фото – от элитных путан до дешевых шлюх. Каталог всех индивидуалок на каждой станции метро с реальными фотографиями без ретуши и с отзывами реальных клиентов.
Смотрите онлайн сериал Отчаянные домохозяйки https://domohozyayki-serial.ru в хорошем качестве HD 720 бесплатно, рейтинг сериала: 8.058, режиссер сериала: Дэвид Гроссман, Ларри Шоу, Дэвид Уоррен.
Buy TikTok followers https://tiktok-followers-buy.com to get popular and viral with your content. All packages are real and cheap — instant delivery within minutes. HQ followers for your TikTok. 100% real users. The lowest price for TikTok followers on the market
Как диета влияет на акне? – Диета, богатая рафинированными сахарами и молочными продуктами, может усугублять акне, тогда как сбалансированное питание, богатое фруктами, овощами и омега-3 жирными кислотами, может улучшить состояние кожи.
How does diet affect acne? – A diet high in refined sugars and dairy products can exacerbate acne, while a balanced diet rich in fruits, vegetables, and omega-3 fatty acids can improve skin health.
лучшие клиники лечения акне в москве [url=http://www.almedinfo.ru]http://www.almedinfo.ru[/url] .
[b]Привет Друзья[/b]!
Всегда думал что купить диплом о высшем образовании это миф и нереально, но все оказалось не так, изначально искал информацию про: купить технический диплом, купить диплом в азове, купить диплом в элисте, купить дипломы о высшем, купить диплом в ноябрьске, потом про дипломы вузов, подробнее здесь https://fishtrade3000.ru/forum/user/1325/
Оказалось все возможно, официально со специальными условия по упрощенным программам, так и сделал и теперь у меня есть диплом вуза Москвы нового образца, что советую и вам!
Успешной учебы!
Pretty! This was a really wonderful post. Thank you
for providing these details.
Pin Up Casino https://pin-up.sibelshield.ru official online casino website for players from the CIS countries. Login and registration to the Pin Up casino website is open to new users with bonuses and promotional free spins.
Pin Up https://pin-up.fotoevolution.ru казино, которое радует гемблеров в России на протяжении нескольких лет. Узнайте, что оно подготовило посетителям. Описание, бонусы, отзывы о легендарном проекте. Регистрация и вход.
Bons Casino는 다양한 보너스와 매력적인 슬롯 게임을 제공합니다. 본즈 카지노에 가입하고 본즈 보너스 코드를 입력하여 추가 보너스를 받아보세요. 간편한 로그인 절차로 빠르게 게임을 시작할 수 있습니다. BONS 모바일 앱을 통해 언제 어디서나 게임을 즐기세요. 항상 새로운 이벤트와 보너스를 준비하고 있습니다. 본즈
Just check out the best ssexy.net ever!
[url=http://thinktoy.net/bbs/board.php?bo_table=customer2&wr_id=402108]Naked hot webcams g[/url][url=http://remote.ecostm.co.kr/bbs/board.php?bo_table=c1&wr_id=12661]Nude hot cams woma[/url] 5f320f7
We are committed to offering our consumers a comfy and safe practical experience at our wellness center.
my page https://dianemichel.com/index.php/User:JuliusWindham
Ignoring Patterns: Failing to observe and learn from the game’s patterns can reduce your chances of winning.
п»їaviator game
Изготовление памятников и надгробий https://uralmegalit.ru по низким ценам. Собственное производство. Высокое качество, широкий ассортимент, скидки, установка.
Pin Up Casino https://pin-up.ergojournal.ru приглашает игроков зарегистрироваться на официальном сайте и начать играть на деньги в лучшие игровые автоматы, а на зеркалах онлайн казино Пин Ап можно найти аналогичную витрину слотов
Pin-up casino https://pin-up.jes-design.ru популярное онлайн-казино и ставки на спорт. Официальный сайт казино для доступа к играм и другим функциям казино для игры на деньги.
Discover the best Gattino nude before webcam – Live Sex Chat ever for free!
[url=https://sample115.tlogsir.com/bbs/board.php?bo_table=tl_product02&wr_id=576]Naked hot cams mod[/url][url=https://toteblogs.com/posts/Best-Vitamin-C-Serums-for-Brighter-Skin-]Nude hot webcams model live sex char[/url] 5515b35
본즈 카지노 앱을 다운로드하여 모바일에서 편리하게 게임을 즐기세요. Bons Casino는 다양한 슬롯 게임과 bons 보너스를 제공합니다. 간편한 본즈 카지노 로그인을 통해 언제든지 게임에 접속할 수 있습니다. Bons 보너스 코드로 더 많은 혜택을 누리세요. 본즈와 함께 즐거운 게임 시간을 보내세요. 앱을 통해 손쉽게 로그인하고 다양한 게임을 즐길 수 있습니다. bons 카지노 로그인
[b]Здравствуйте[/b]!
Хочу поделиться своим опытом по заказу аттестата ПТУ. Думал, что это невозможно, и начал искать информацию в интернете по теме: купить диплом в новочебоксарске, купить диплом врача, купить диплом в междуреченске, купить свидетельство о рождении ссср, купить диплом в магадане. Постепенно углубляясь, нашел отличный ресурс здесь: http://dimsan.blogspot.com/2009/06/user-profile-hive-cleanup-service.html?m=1, и остался очень доволен!
Теперь у меня есть диплом сварщика о среднем специальном образовании, и я обеспечен на всю жизнь!
Успешной учебы!
Player Reviews and Testimonials
aviator game
Just check out the best gay sex live chat ever!
[url=http://test.aocoolers.co.kr/bbs/board.php?bo_table=pension&wr_id=173]Naked hot cams mod[/url][url=https://trust-used.com/best-gaming-laptop-models/]Nude amateur cams girls live porn show[/url] a7a5515
Dogs Cane Corso in Moscow
cane-corso.moscow
Погрузитесь в мир берців зсу, анализируйте, традиции, Легенды и предания о берцах зсу, магию, Берці зсу: символ силы, смысл, почувствуйте, освойте, в мир, дізнайтесь, значення
берці тактичні зсу [url=https://bercitaktichnizsu.vn.ua/]https://bercitaktichnizsu.vn.ua/[/url] .
plane ascends, the higher the multiplier. For example, if you bet $10 and cash out at a 2x multiplier, you win
aviator game
[u][b] Добрый день![/b][/u]
Где купить диплом по необходимой специальности?
Заказать диплом ВУЗа.
Стоимость в разы ниже[/b] той, которую понадобилось бы платить за обучение в университете
http://camillacastro.us/forums/viewtopic.php?pid=407075#p407075
[b]Удачи![/b]
Nice article, thanks! Just check Stella live chat nude before webcam – Live Chaturbate this out.
[url=http://thinktoy.net/bbs/board.php?bo_table=customer2&wr_id=402299]Nude amateur webcam[/url][url=https://sample115.tlogsir.com/bbs/board.php?bo_table=tl_product02&wr_id=585]Nude hot webcams wo[/url] 5f320f4
https://blacksprut-sait.top – блэк спрут ссылка, blacksprut onion
Откройте тайны берців зсу, значение, освойте, истории, рассмотрите, проникнитесь, истину, Украинские берці зсу: традиции и современность, освойте, Почуйте, як б’ють від Берця зсу, анатомію, значення
берці зсу [url=https://bercitaktichnizsu.vn.ua/]берці зсу[/url] .
Открой мир карточных игр в Pin-Up https://pin-up.porsamedlab.ru казино Блэкджек, Баккара, Хило и другие карточные развлечения. Регистрируйтесь и играйте онлайн!
Официальный сайт Pin Up казино https://pin-up.nasledie-smolensk.ru предлагает широкий выбор игр и щедрые бонусы для игроков. Уникальные бонусные предложения, онлайн регистрация.
https://maps.google.bi/url?q=https://subscribe.ru/author/25924851/group/records/?page=45
ремонт сотовых рядом
Pinup казино https://pin-up.vcabinet.kz это не просто сайт, а целый мир азартных развлечений, где каждый может найти что-то свое. От традиционных игровых автоматов до прогнозов на самые популярные спортивные события.
Latest Diablo news https://diablo.com.az game descriptions and guides. Diablo.az is the largest Diablo portal in the Azerbaijani language.
[url=https://bs4shop.top/]блэкспрут darknet[/url] – блэкспрут сайт, blacksprut onion
Узнайте всю правду о берцах зсу, изучайте, Почему берці зсу считаются священными?, разберитесь в, рассмотрите, мистику, поищите, энергией, Берці зсу: подвиги и традиции, Спробуйте на власній шкірі бути Берцем зсу, символіку, таємниці
літні берці зсу [url=https://bercitaktichnizsu.vn.ua/]https://bercitaktichnizsu.vn.ua/[/url] .
https://bs4shop.top – спрут как попасть на сайт, блек спрут оригинальная ссылка
anal threesome TinyMimi fully naked stripping on cam for online sex video chat
[url=http://test.aocoolers.co.kr/bbs/board.php?bo_table=pension&wr_id=176]Naked amateur cams[/url][url=https://toteblogs.com/posts/Best-Vitamin-C-Serums-for-Brighter-Skin-]Nude hot webcams woman live sex char[/url] 0f4_fed
➦➦ как получить Фриспины в 1хбет? во всех конторах подобный презент дают раз при http://openok.ru/page/pages/ozeravolhovskogobas.html регистрации.
Thank you! Quite a lot of stuff.
Узнайте всю правду о берцах зсу, происхождение, Какова история появления берців зсу?, символике, Берці зсу: символ верности и чести, Берці зсу: путь к мудрости, сущность, почувствуйте, Берці зсу: древние тайны, загляните, анатомію, дізнайтеся
берці літні зсу купити [url=https://bercitaktichnizsu.vn.ua/]берці літні зсу купити[/url] .
balancing the risk of waiting longer for a higher payout against the potential loss if the plane crashes.
aviator game
Откройте тайны берців зсу, изучайте, культуру, Одержимость берцами зсу, проанализируйте, тайны, смысл, погрузитесь, познакомьтесь с, в душу, анатомію, дізнайтеся
нові берці зсу [url=https://bercitaktichnizsu.vn.ua/]https://bercitaktichnizsu.vn.ua/[/url] .
Latest World of Warcraft (WOW) tournament news https://wow.com.az, strategies and game analysis. The most detailed gaming portal in Azerbaijani language
Откройте тайны берців зсу, Почему берці зсу так важны для культуры?, Какова история появления берців зсу?, символике, Берці зсу: символ верности и чести, тайны, Берці зсу: амулет защиты, мощью, культурой, в душу, Берцем зсу було від роду козацького, зрозумійте
берці зсу 2021 [url=https://bercitaktichnizsu.vn.ua/]берці зсу 2021[/url] .
Добрый день!
Ремонт ноутбуков – это услуга, которая требуется многим владельцам техники. Независимо от того, столкнулись ли вы с проблемой экрана или нужно заменить жесткий диск, важно знать, куда обратиться за помощью.
Для организации ремонта ноутбука вы можете выбрать один из следующих вариантов:
Сервисный центр: Вы можете обратиться в специализированный сервисный центр, где ваш ноутбук будет ремонтировать опытный мастер.
Мобильный сервис: Некоторые компании предлагают услуги выездного ремонта ноутбуков. Мастер приедет к вам домой или в офис и починит устройство на месте.
Прокат оборудования: Если вы предпочитаете самостоятельный ремонт, можно арендовать необходимое оборудование и запчасти.
Частные мастера: Можно воспользоваться услугами частных мастеров, которые предлагают ремонт ноутбуков на дому.
Одной из лучших компаний, предоставляющих такие услуги, является https://all-remont-noutbuka.ru, проверено и рекомендовано!
Выбор способа ремонта ноутбука зависит от ваших предпочтений и возможностей, но в любом случае важно доверить свое устройство профессионалам.
[url=https://all-remont-noutbuka.ru]отремонтировать ноутбук в москве[/url]
ремонт ноутбуков в москве рядоммастерская по ремонту ноутбуковсрочно отремонтировать ноутбук
Удачи!
Откройте тайны берців зсу, Какую роль играют берці зсу в обрядах?, традиции, Одержимость берцами зсу, Берці зсу: традиции древних времен, загляните в, Берці зсу: сакральное оружие, мощью, познакомьтесь с, проникнитесь, символіку, вивчіть
купити берці зсу [url=https://bercitaktichnizsu.vn.ua/]купити берці зсу[/url] .
Nice articl! Just check рџ’¦, Sexy Keonaрџ’¦ naked on sex cam for live porn chat this out!
[url=https://trust-used.com/best-gaming-laptop-models/]Nude amateur cams girls online porn char[/url][url=http://remote.ecostm.co.kr/bbs/board.php?bo_table=c1&wr_id=12684]Naked amateur cams[/url] 210a7a5
ремонт сотовых в москве адреса
[url=https://bs4shop.top]blacksprut даркнет[/url] – блэкспрут ссылка тор, блэкспрут 2fa
Погрузитесь в мир берців зсу, Почему берці зсу так важны для культуры?, изучите, символике, красоту, мистику, истину, энергией, традициями, загляните, освійте, вивчіть
берці зсу літні [url=https://bercitaktichnizsu.vn.ua/]https://bercitaktichnizsu.vn.ua/[/url] .
Погрузитесь в мир берців зсу, значение, освойте, Одержимость берцами зсу, красоту, мистику, исследуйте, Берці зсу: духовное наследие Украины, изучите, Як живеться в берцах зсу, Берцем зсу було від роду козацького, вивчіть
берці зсу [url=https://bercitaktichnizsu.vn.ua/]https://bercitaktichnizsu.vn.ua/[/url] .
Azerbaijan NFL https://nfl.com.az News, analysis and topics about the latest experience, victories and records. A portal where the most beautiful NFL games in the world are generally studied.
Discover exciting virtual football in Fortnite https://fortnite.com.az. Your central hub for the latest news, expert strategies and interesting e-sports reports. Collecting points with us!
The latest analysis, tournament reviews and the most interesting features of the Spider-Man game https://spider-man.com.az series in Azerbaijani.
Discover the best http://www.sessotube.pro ever for free!
[url=http://www.globaldream.or.kr/bbs/board.php?bo_table=sub08_02&wr_id=778]Nude hot webcams mo[/url][url=http://thinktoy.net/bbs/board.php?bo_table=customer2&wr_id=402482]Nude amateur webcam[/url] 4_ef9e2
Read the latest Counter-Strike 2 news https://counter-strike.net.az, watch the most successful tournaments and become the best in the world of the game on the CS2 Azerbaijan website.
Player Reviews and Testimonials
aviator game
На сайте https://1080kino.net/ можете смотреть лучшие фильмы онлайн абсолютно бесплатно в хорошем качестве. Организуйте себе прекрасный отдых, чтобы отвлечься от повседневных забот. Мы собрали для вас большую коллекцию фильмов разных жанров. Часто обновляем контент, смотрите новинки прямо сейчас. Фильмы увлекут вас захватывающим сюжетом и разнообразными событиями. Добавляйте наш развлекательный портал в закладки для того, чтобы следить за выходом интересного кино.
payday loans like cfo Adding this characteristic, the lending shop enlarges its customers’ base automatically.
В. – Львів: Магнолія 2006, https://pereviznyk.if.ua/ 2011. – 368 с. профілактика стоматологічних захворювань: навч.
Discover the best live sex chat 1 on 1 ever for free!
[url=http://thinktoy.net/bbs/board.php?bo_table=customer2&wr_id=402546]Naked hot cams wom[/url][url=http://hantechfa.com/bbs/board.php?bo_table=free&wr_id=18614]Naked hot cams mod[/url] a7a5515
Came across an intriguing article – it’s worth your attention, trust me https://www.snipesocial.co.uk/blogs/475522/Free-Video-Chat-Without-Registration
[u][b] Привет![/b][/u]
Мы изготавливаем дипломы психологов, юристов, экономистов и любых других профессий по приятным тарифам.
Мы готовы предложить документы техникумов, которые расположены на территории всей РФ. Можно купить качественно сделанный диплом от любого учебного заведения, за любой год, указав подходящую специальность и хорошие оценки за все дисциплины. Документы печатаются на бумаге высшего качества. Это позволяет делать настоящие дипломы, которые невозможно отличить от оригиналов. Документы будут заверены необходимыми печатями и штампами.
[b]Где купить диплом по нужной специальности?[/b]
http://toyota-porte.ru/forums/index.php?autocom=gallery&req=si&img=2211
This category allows companies to enter established markets with their unique version of https://medium.com/@andrew_burak/strategic-approach-to-product-development-services-in-norway-316121ba7652 – the product.
I got this web site from my pal who told me regarding this website and at the moment
this time I am browsing this web site and reading very informative articles or reviews
here.
dynamic features, and social elements, it offers an engaging experience for players. The game is supported by
п»їaviator game
Discovered an article that’s sure to appeal to you – I recommend checking it out https://www.cardiachill.com/users/cchatruletka
free live sex chat free
[url=http://www.kiccoltd.co.kr/bbs/board.php?bo_table=free&wr_id=798736]Nude amateur cams[/url][url=https://toteblogs.com/posts/Best-Vitamin-C-Serums-for-Brighter-Skin-]Naked hot webcams model live sex show[/url] 7a5515b
Узнайте всю правду о берцах зсу, значение, Какова история появления берців зсу?, Легенды и предания о берцах зсу, магию, мистику, найдите, погрузитесь, традициями, Спробуйте на власній шкірі бути Берцем зсу, анатомію, таємниці
берці літні зсу [url=https://bercitaktichnizsu.vn.ua/]берці літні зсу[/url] .
Latest boxing news https://boks.com.az, Resul Abbasov’s achievements, Tyson Fury’s fights and much more. All in Ambassador Boxing.
Explore the extraordinary journey of Kilian Mbappe https://kilian-mbappe.com.az, from his humble beginnings to global stardom. Delve into his early years, meteoric rise through the ranks, and impact on and off the football field.
Mesut Ozil https://mesut-ozil.com.az latest news, statistics, photos and much more. Get the latest news and information about one of the best football players Mesut Ozil.
Latest news, statistics, photos and much more about Pele https://pele.com.az. Get the latest news and information about football legend Pele.
[u][b] Привет, друзья![/b][/u]
Для определенных людей, приобрести [b]диплом[/b] университета – это необходимость, возможность получить достойную работу. Впрочем для кого-то – это желание не терять массу времени на учебу в ВУЗе. Что бы ни толкнуло вас на такое решение, наша фирма готова помочь вам. Максимально быстро, качественно и по разумной стоимости сделаем документ любого года выпуска на государственных бланках с реальными подписями и печатями.
[b]Наша компания предлагает[/b] выгодно заказать диплом, который выполняется на бланке ГОЗНАКа и заверен мокрыми печатями, водяными знаками, подписями должностных лиц. Документ способен пройти лубую проверку, даже с использованием специальных приборов. Достигайте цели максимально быстро с нашим сервисом.
[b]Преимущества наших дипломов:[/b]
• используем только настоящие бланки “Гознак”;
• все подписи должностных лиц;
• настоящие печати университета;
• специальные водяные знаки, нити и прочие степени защиты;
• идеальное качество оформления – ошибки полностью исключены;
• любая проверка оригинальности документа.
[b]Дипломы и аттестаты об окончании учебных учреждений Российской Федерации:[/b]
– Мгновенно повышают статус своего владельца;
– Открывают огромное количество возможностей на рынке труда;
– Повышают рейтинг в глазах граждан;
– Повышают самооценку.
[b]Где заказать диплом специалиста?[/b]
http://o97765bq.beget.tech/2023/07/18/rasshirte-svoi-gorizonty-poluchite-kachestvennoe-obrazovanie-na-nashem-sayte.html
[b]Удачи![/b]
Sergio Ramos Garcia https://sergio-ramos.com.az Spanish footballer, defender. Former Spanish national team player. He played for 16 seasons as a central defender for Real Madrid, where he captained for six seasons.
[u][b] Привет![/b][/u]
Где купить диплом по актуальной специальности?
Мы готовы предложить дипломы психологов, юристов, экономистов и любых других профессий по доступным тарифам. Стоимость может зависеть от выбранной специальности, года получения и образовательного учреждения.
[b]Заказать диплом ВУЗа[/b]
https://landik-diploms-srednee.ru/kupit-diplom-saratov
[b]Успешной учебы![/b]
[u][b] Добрый день![/b][/u]
Где приобрести диплом по актуальной специальности?
[b]Мы можем предложить документы ВУЗов,[/b] расположенных в любом регионе Российской Федерации. Можно купить качественный диплом от любого учебного заведения, за любой год, в том числе документы СССР. Документы делаются на “правильной” бумаге самого высшего качества. Это дает возможность делать настоящие дипломы, которые невозможно отличить от оригинала. Они будут заверены всеми обязательными печатями и подписями.
https://landik-diploms-srednee.ru
How to Start Playing the Aviator Game?
aviator game
[u][b] Привет, друзья![/b][/u]
Для многих людей, заказать [b]диплом[/b] ВУЗа – это острая необходимость, возможность получить хорошую работу. Но для кого-то – это желание не терять огромное количество времени на учебу в университете. Что бы ни толкнуло вас на такой шаг, наша фирма готова помочь вам. Быстро, профессионально и по разумной цене изготовим диплом любого ВУЗа и любого года выпуска на подлинных бланках с реальными печатями.
[b]Наши специалисты предлагают[/b] выгодно заказать диплом, который выполнен на бланке ГОЗНАКа и заверен мокрыми печатями, штампами, подписями. Диплом способен пройти любые проверки, даже с применением профессиональных приборов. Достигайте своих целей быстро и просто с нашей компанией.
[b]Плюсы наших дипломов:[/b]
• используются настоящие бланки “Гознак”;
• подлинные подписи должностных лиц;
• все печати ВУЗа;
• специальные водяные знаки, нити и иные степени защиты;
• идеальное качество оформления – ошибок не бывает;
• любые проверки документа.
[b]Где купить диплом специалиста?[/b]
http://mynewsport.ru/kupit-diplom-vasha-doroga-k-professionalnomu-priznaniyu
[b]Успешной учебы![/b]
На сайте https://mees.com.ru/ вы сможете ознакомиться со всей необходимой безработному, студенту, школьнику информацией, которая касается поиска работы, интересных вакансий. Здесь размещают резюме соискатели, заинтересованные в поиске проверенных, опытных кадров, которые желают трудиться и зарабатывать деньги. Здесь сможет отыскать для себя работу специалист с различным опытом работы или даже без нее. При необходимости вы сможете подписаться на рассылку для того, чтобы получать самые интересные вакансии. Они обновляются регулярно.
[u][b] Добрый день![/b][/u]
Для некоторых людей, заказать диплом ВУЗа – это острая необходимость, возможность получить достойную работу. Но для кого-то – это банальное желание не терять массу времени на учебу в институте. Что бы ни толкнуло вас на это решение, наша фирма готова помочь вам. Быстро, качественно и по разумной цене сделаем диплом любого года выпуска на настоящих бланках с реальными подписями и печатями.
[b]Заказать документ[/b] о получении высшего образования вы имеете возможность у нас. Мы оказываем услуги по изготовлению и продаже документов об окончании любых университетов Российской Федерации. Вы получите необходимый диплом по любой специальности, включая документы старого образца. Даем гарантию, что в случае проверки документов работодателем, подозрений не возникнет.
Плюсы наших дипломов:
• используются настоящие бланки “Гознака”;
• все подписи руководства;
• настоящие печати учебного заведения;
• водяные знаки, нити и прочие степени защиты;
• идеальное качество оформления – ошибки полностью исключены;
• любые проверки документов.
[b]Мы предлагаем[/b] выгодно заказать диплом, который выполняется на оригинальном бланке и заверен мокрыми печатями, водяными знаками, подписями. Данный диплом пройдет любые проверки, даже при использовании специально предназначенного оборудования. Решайте свои задачи максимально быстро с нашими дипломами.
[b]Где купить диплом специалиста?[/b]
http://crewties.moibb.ru/viewtopic.php?f=2&t=331
[b]Хорошей учебы![/b]
[b]Всем привет[/b])
Будучи студентом, я наслаждался учебой до тех пор, пока не пришло время писать диплом. Но паниковать не стоило, ведь существуют компании, которые помогают с написанием и защитой диплома на отличные оценки!
Изначально я искал информацию по теме: купить диплом, купить диплом строителя, купить диплом в бердске, купить аттестат за 11 класс, купить диплом в магадане, затем наткнулся на https://yo-mi.ru/people/user/4229/blog/1280/, где все мои учебные вопросы были решены!
Успехов в учебе!
Gianluigi Buffon https://buffon.com.az Italian football player, goalkeeper. Considered one of the best goalkeepers of all time. He holds the record for the number of games in the Italian Championship, as well as the number of minutes in this tournament without conceding a goal.
Paulo Bruno Ezequiel Dybala https://dybala.com.az Argentine footballer, striker for the Italian club Roma and the Argentina national team. World champion 2022.
Paul Labille Pogba https://pogba.com.az French footballer, central midfielder of the Italian club Juventus. Currently suspended for doping and unable to play. World champion 2018.
Всем привет! Может кто знает, где найти полезные блоги о недвижимости? Сейчас читаю https://officesaratov.ru
Канал для того, чтобы знания и опыт, могли помочь любому человеку сделать ремонт https://tvin270584.livejournal.com в своем жилище, любой сложности!
Many online platforms host competitive tournaments and events for the Aviator Game. These events offer players
aviator game
Kevin De Bruyne https://kevin-de-bruyne.liverpool-fr.com Belgian footballer, born 28 June 1991 years in Ghent. He has had a brilliant club career and also plays for the Belgium national team. De Bruyne is known for his spectacular goals and brilliant assists.
На сайте https://avto-lombard42.ru/ есть возможность рассчитать займ на специальном калькуляторе, который работает в режиме реального времени. Ломбард работает в круглосуточном режиме, а потому воспользоваться услугами вы сможете в любое время. Здесь вы сможете получить займ под залог ПТС, выкупаются машины самых разных марок. Для того чтобы получить необходимую сумму, следует связаться со специалистом по телефону, уточнить все нюансы. Оценщики произведут осмотр автомобиля, после чего назначат стоимость.
[b]Здравствуйте[/b]!
Хочу рассказать о своем опыте по заказу аттестата пту, думал это не реально и стал искать информацию в сети, про купить диплом медбрата, купить диплом в сыктывкаре, купить диплом моряка, купить диплом в глазове, купить диплом о среднем специальном, постепенно вникая в суть дела нашел отличный материал здесь http://sergei-cheremushkin.blogspot.com/2010/03/blog-post.html и был очень доволен!
Теперь у меня есть диплом столяра о среднем специальном образовании, и я обеспечен на всю жизнь)
Хорошей учебы!
I like reading an article that can make people think.
Also, thank you for allowing for me to comment!
[u][b] Добрый день![/b][/u]
Где приобрести диплом по актуальной специальности?
[b]Заказать документ[/b] о получении высшего образования можно в нашем сервисе. Мы оказываем услуги по изготовлению и продаже документов об окончании любых университетов России. Вы получите необходимый диплом по любым специальностям, включая документы Советского Союза. Даем гарантию, что в случае проверки документов работодателем, подозрений не возникнет.
http://terorizam.listbb.ru/viewtopic.php?f=3&t=54
[b]Успешной учебы![/b]
[u][b] Добрый день![/b][/u]
Мы предлагаем выгодно и быстро купить диплом, который выполнен на оригинальной бумаге и заверен мокрыми печатями, водяными знаками, подписями официальных лиц. Документ способен пройти лубую проверку, даже с применением профессиональных приборов. Решите свои задачи быстро и просто с нашими дипломами.
[b]Где приобрести диплом специалиста?[/b]
http://vared.flyboard.ru/viewtopic.php?f=1&t=485&sid=444fc9e8a353ed91d57b67105fd8821a
[b]Успешной учебы![/b]
Paul Labille Pogba https://paul-pogba.psg-fr.com Footballeur francais, milieu de terrain central du club italien de la Juventus. Champion du monde 2018. Actuellement suspendu pour dopage et incapable de jouer.
Mohamed Salah Hamed Mehrez Ghali https://mohamed-salah.liverpool-fr.com Footballeur egyptien, attaquant du club anglais de Liverpool et l’equipe nationale egyptienne. Considere comme l’un des meilleurs joueurs du monde.
The young talent who conquered Paris Saint-Germain: how Xavi Simons became https://xavi-simons.psg-fr.com leader of a superclub in record time.
[u][b] Привет, друзья![/b][/u]
Где купить диплом по нужной специальности?
Мы готовы предложить документы ВУЗов, расположенных на территории всей России. Документы заверяются необходимыми печатями и подписями.
https://griffinbimpr.59bloggers.com/27987763/????????-??????-????
[b]Хорошей учебы![/b]
[b]Здравствуйте[/b]!
Задался вопросом: можно ли на самом деле купить диплом государственного образца в Москве? Был приятно удивлен — это реально и легально!
Сначала искал информацию в интернете на тему: купить диплом в новотроицке, купить диплом энергетика, купить аттестат за 11 класс, купить диплом в новороссийске , купить диплом логопеда и получил базовые знания. В итоге остановился на материале: http://ashinova.ru/category-5/t-748.html#748
Успешной учебы!
Basic Rules and Objectives
aviator game
[u][b] Привет![/b][/u]
Где заказать диплом по актуальной специальности?
Купить диплом ВУЗа.
[b]Цена намного ниже[/b] нежели понадобилось бы платить на очном обучении в университете
http://cookownfood.blogspot.com/2012/11/cold-bean-thread-noodles-with-spinach.html
[b]Хорошей учебы![/b]
[u][b] Привет![/b][/u]
Для определенных людей, заказать [b]диплом[/b] университета – это острая необходимость, уникальный шанс получить выгодную работу. Впрочем для кого-то – это желание не терять огромное количество времени на учебу в институте. С какой бы целью вам это не потребовалось, наша фирма готова помочь. Быстро, профессионально и по доступной цене изготовим диплом нового или старого образца на подлинных бланках со всеми подписями и печатями.
[b]Мы предлагаем[/b] быстро купить диплом, который выполнен на оригинальной бумаге и заверен печатями, водяными знаками, подписями должностных лиц. Диплом способен пройти любые проверки, даже при помощи профессионального оборудования. Достигайте свои цели быстро и просто с нашим сервисом.
[b]О преимуществах наших дипломов:[/b]
• используем настоящие бланки “Гознак”;
• все подписи должностных лиц;
• мокрые печати учебного заведения;
• водяные знаки, нити и прочие степени защиты;
• безупречное качество оформления – ошибки исключены;
• любая проверка оригинальности документа.
[b]Где приобрести диплом специалиста?[/b]
http://newsofgames.ru/kupit-diplom-ekonomte-vremya-i-dengi
[b]Успехов в учебе![/b]
[u][b] Привет![/b][/u]
Наши специалисты предлагают быстро и выгодно приобрести диплом, который выполнен на оригинальной бумаге и заверен печатями, штампами, подписями. Документ способен пройти любые проверки, даже при помощи профессионального оборудования. Решайте свои задачи быстро и просто с нашими дипломами.
[b]Где заказать диплом специалиста?[/b]
http://reflections.listbb.ru/viewtopic.php?f=45&t=699
[b]Удачи![/b]
[b]Здравствуйте[/b]!
Задумался а действительно можно купить диплом государственного образца в Москве, и был удивлен, все реально и главное официально!
Сначала серфил в сети и искал такие темы как: купить диплом в соликамске, купить диплом штукатура, купить диплом педагога, купить диплом в сарове, купить диплом в керчи, получил базовую информацию.
Остановился в итоге на материале купить диплом в донском, http://cars.teamforum.ru/viewtopic.php?f=2&t=2642&p=3028#p3028
Хорошей учебы!
For hottest information you have to go to see internet and on web I found this web
site as a finest web site for newest updates.
Interactive Interface: Players can interact with the game in real-time, making decisions that impact their
aviator game
Новости, звучащие на Вести fm – это всегда самая свежая и детальная сведения, https://rvestifm.ru/ сопровождающаяся экспертной оценкой.
Greetings from Los angeles! I’m bored at work so I decided to check out your site on my iphone during lunch break.
I love the info you provide here and can’t wait to take a look when I get home.
I’m surprised at how quick your blog loaded on my
phone .. I’m not even using WIFI, just 3G ..
Anyhow, very good blog!
Good day! I simply want to offer you a huge thumbs up for the great information you
have got right here on this post. I will be coming back to your site for more soon.
Feel free to visit my web site :: his explanation
Basic Rules and Objectives
aviator game
[u][b] Здравствуйте![/b][/u]
Где заказать диплом специалиста?
[b]Мы готовы предложить[/b] дипломы любой профессии по невысоким ценам. Цена будет зависеть от той или иной специальности, года получения и образовательного учреждения. Стараемся поддерживать для клиентов адекватную политику тарифов.
http://aromatov.wooden-rock.ru/forum/topic.php?forum=1&topic=14445
[b]Удачи![/b]
[url=https://blacksprut-sait.top/]блэкспрут сайт[/url] – blacksprut onion, спрут как попасть на сайт
Highly energetic post, I liked that a lot.
Will there be a part 2?
у вас есть возможность https://https://radiorecordfm.ru// безвозмездно на ресурсе или установив удобное приложение к себе на телефон.
[u][b] Привет![/b][/u]
Где приобрести диплом по актуальной специальности?
[b]Купить документ[/b] ВУЗа можно у нас в Москве. Мы оказываем услуги по продаже документов об окончании любых университетов Российской Федерации. Вы получите необходимый диплом по любым специальностям, включая документы СССР. Гарантируем, что при проверке документа работодателем, никаких подозрений не возникнет.
http://mboumukvilino.ru/antiterroristicheskaya-bezopasnost/normativnye-pravovye-akty-rossiyskoy-federacii-i-respubliki-krym/
[b]Хорошей учебы![/b]
To start playing the Aviator Game, simply choose a reputable online casino platform that offers the game.
aviator game
Kylian Mbappe https://kylian-mbappe.psg-fr.com Footballeur, attaquant francais. Il joue pour le PSG et l’equipe de France. Ne le 20 decembre 1998 a Paris. Mbappe est francais de nationalite. La taille de l’athlete est de 178 cm.
Изготовление, сборка и ремонт мебели https://shkafy-na-zakaz.blogspot.com для Вас, от эконом до премиум класса.
ремонт стиральных машин [url=www.centr-remonta-stiralnyh-mashin.ru]ремонт стиральных машин[/url] .
Kevin De Bruyne https://liverpool.kevin-de-bruyne-fr.com Belgian footballer, born 28 June 1991 years in Ghent. He has had a brilliant club career and also plays for the Belgium national team. De Bruyne is known for his spectacular goals and brilliant assists.
Paul Pogba https://psg.paul-pogba-fr.com is a world-famous football player who plays as a central midfielder. The player’s career had its share of ups and downs, but he was always distinguished by his perseverance and desire to win.
[url=https://bs4shop.top/]blacksprut onion[/url] – 2fa blacksprut, blacksprut onion
Kylian Mbappe https://psg.kylian-mbappe-fr.com Footballeur, attaquant francais. L’attaquant de l’equipe de France Kylian Mbappe a longtemps refuse de signer un nouveau contrat avec le PSG, l’accord etant en vigueur jusqu’a l’ete 2022.
Visit the website https://gate-a-door.com/ where you can order installation and repair of all types of garage doors and gates. More than 10 years of experience, individual design, guarantee for all services. Electric, automatic, swing, sliding gates and a full range of maintenance services! Visit the website.
you’re in point of fact a excellent webmaster.
The site loading pace is incredible. It sort of feels that
you are doing any unique trick. Also, The contents
are masterwork. you have done a great activity in this subject!
https://blacksprut-sait.top – blacksprut onion, спрут как попасть на сайт
https://maps.google.com.vc/url?q=https://subscribe.ru/author/25924851/group/records/?page=44
продвижение сайтов в москве гугл [url=https://prodvizhenie-sajtov-v-moskve115.ru/]https://prodvizhenie-sajtov-v-moskve115.ru/[/url] .
become more comfortable with the gameplay. Observing patterns and understanding the timing of the plane’s ascent
aviator game
[url=https://blacksprut-sait.top/]блэкспрут даркнет[/url] – блек спрут оригинальная ссылка, блэкспрут ссылка тор
Швеллер: Надежный и Универсальный Строительный Материал
Швеллер – это один из наиболее востребованных и универсальных строительных материалов,
широко используемых в различных областях строительства и промышленности. Благодаря
своей форме и прочностным характеристикам, швеллеры находят применение в каркасном
строительстве, машиностроении, мостостроении и многих других сферах. В этой статье
мы рассмотрим основные особенности швеллера, его виды и области применения.
Что такое швеллер?
Швеллер представляет собой металлическую балку с П-образным профилем, которая изготовлена из стали
путем горячего проката или гибки. Эта форма придает швеллеру высокую жесткость и устойчивость к
нагрузкам, что делает его незаменимым материалом для различных конструкций.
Виды швеллеров
Швеллеры различаются по способу изготовления, размеру и типу профиля. Основные виды швеллеров
включают:
1. Горячекатаные швеллеры: Изготавливаются методом горячей прокатки, что обеспечивает
высокую прочность и однородность материала. Применяются в тяжелых конструкциях,
таких как мосты и здания.
2. Гнутые швеллеры: Производятся методом гибки листового металла. Они легче горячекатаных
швеллеров и чаще используются в легких конструкциях.
3. Швеллеры с параллельными полками: Обеспечивают равномерное распределение нагрузки и
используются в тех конструкциях, где требуется высокая устойчивость.
4. Швеллеры с уклоном внутренних граней полок: Этот тип швеллера имеет уклон полок внутрь,
что придает дополнительную жесткость и позволяет использовать их в специфических конструкциях.
Области применения швеллеров
Благодаря своим уникальным характеристикам, швеллеры находят широкое применение в различных отраслях:
1. Строительство: Швеллеры используются для создания каркасов зданий, мостов, опор и других конструкций,
требующих высокой прочности и устойчивости.
2. Машиностроение: Применяются в производстве различных машин и механизмов, где важны жесткость
и устойчивость к деформациям.
3. Автомобилестроение: Используются для изготовления рам и других несущих конструкций автомобилей.
4. Судостроение: Швеллеры применяются в создании каркасов судов и других морских конструкций.
5. Энергетика: Используются в строительстве опор линий электропередач и других энергетических сооружений.
Преимущества использования швеллеров
Использование швеллеров в строительстве и промышленности имеет ряд преимуществ:
– Прочность и устойчивость: П-образный профиль обеспечивает высокую жесткость и устойчивость к нагрузкам.
– Универсальность: Швеллеры могут использоваться в различных конструкциях и областях.
– Легкость монтажа: Простота и удобство при сборке конструкций.
– Долговечность: Швеллеры изготавливаются из высококачественной стали, что обеспечивает долгий срок службы.
Заключение
Швеллер – это незаменимый материал в современном строительстве и промышленности. Его уникальные характеристики и разнообразие видов позволяют использовать его в самых различных областях, обеспечивая надежность и долговечность конструкций. При выборе швеллера важно учитывать требования конкретного проекта и консультироваться с специалистами для достижения наилучших результатов.
Использование швеллеров в строительстве и промышленности продолжает расти, и этот материал неизменно остается одним из ключевых элементов, обеспечивающих прочность и надежность различных конструкций.
http://www.allshveller.ru/
Thibaut Nicolas Marc Courtois https://thibaut-courtois.real-madrid-ar.com Footballeur belge, gardien de but du Club espagnol “Real Madrid”. Lors de la saison 2010/11, il a ete reconnu comme le meilleur gardien de la Pro League belge, ainsi que comme joueur de l’annee pour Genk. Trois fois vainqueur du Trophee Ricardo Zamora, decerne chaque annee au meilleur gardien espagnol
Forward Rodrigo https://rodrygo.real-madrid-ar.com is now rightfully considered a rising star of Real Madrid. The talented Santos graduate is compared to Neymar and Cristiano Ronaldo, but the young talent does not consider himself a star.
Jude Victor William Bellingham https://jude-bellingham.real-madrid-ar.com English footballer, midfielder of the Spanish club Real Madrid and the England national team. In April 2024, he won the Breakthrough of the Year award from the Laureus World Sports Awards.
по вечерам развлекает https://europaplusradio.ru/ “РАШ”. вечерами развлекает “РАШ”.
[u][b] Здравствуйте![/b][/u]
Наши специалисты предлагают выгодно заказать диплом, который выполняется на оригинальной бумаге и заверен мокрыми печатями, штампами, подписями должностных лиц. Наш документ способен пройти любые проверки, даже при помощи специально предназначенного оборудования. Решайте свои задачи быстро и просто с нашим сервисом.
[b]Где купить диплом специалиста?[/b]
http://vnuci.listbb.ru/viewtopic.php?f=2&t=489
[b]Удачи![/b]
Швеллер: Что это такое и где используется?
Швеллер — это металлический профиль, который обладает высокой
прочностью и жесткостью, благодаря чему находит широкое
применение в различных отраслях строительства и промышленности. Он представляет собой П-образный профиль, изготовленный из стали, алюминия или других металлов, и используется для создания каркасов, опорных конструкций и других элементов, требующих повышенной прочности.
Виды и классификация швеллеров
Швеллеры классифицируются по нескольким параметрам,
включая материал изготовления, метод производства и
геометрические характеристики. Основные виды швеллеров
включают:
1. Горячекатаные швеллеры:
– Изготавливаются методом горячей прокатки.
– Обладают высокой прочностью и устойчивостью к деформациям.
– Применяются в тяжелом строительстве и машиностроении.
2. Холодногнутые швеллеры:
– Производятся путем гибки металлических листов.
– Легче и дешевле в производстве по сравнению с горячекатаными аналогами.
– Используются в легких конструкциях и для декоративных целей.
3. Алюминиевые швеллеры:
– Изготавливаются из алюминия, что делает их легкими и устойчивыми к коррозии.
– Применяются в строительстве, где важен легкий вес и долговечность.
4. Нержавеющие швеллеры:
– Изготавливаются из нержавеющей стали.
– Обладают высокой устойчивостью к коррозии и химическим воздействиям.
– Используются в агрессивных средах и пищевой промышленности.
Применение швеллеров
Швеллеры находят применение в самых различных областях благодаря своим уникальным характеристикам. Основные сферы использования включают:
1. Строительство:
– Каркасы зданий и сооружений.
– Балки и перекрытия.
– Опорные конструкции и фермы.
2. Машиностроение:
– Рамы и шасси транспортных средств.
– Конструктивные элементы промышленных машин и оборудования.
3. Металлоконструкции:
– Производство мостов и эстакад.
– Элементы инженерных сооружений.
4. Промышленное оборудование:
– Рамы и каркасы станков.
– Поддерживающие конструкции для оборудования.
Преимущества использования швеллеров
Использование швеллеров в строительстве и промышленности имеет множество преимуществ:
1. Высокая прочность:
– Швеллеры способны выдерживать значительные нагрузки, что делает их незаменимыми в строительстве крупных объектов.
2. Устойчивость к деформациям:
– Благодаря П-образному профилю, швеллеры обладают высокой жесткостью и устойчивостью к изгибам и деформациям.
3. Универсальность:
– Швеллеры могут использоваться в различных сферах, от строительства до машиностроения.
4. Долговечность:
– Швеллеры, особенно изготовленные из нержавеющей стали или алюминия, обладают высокой устойчивостью к коррозии и долговечностью.
Заключение
Швеллеры — это незаменимый элемент в современном строительстве и промышленности.
Благодаря своим уникальным характеристикам, таким как высокая
прочность, жесткость и устойчивость к деформациям, они
обеспечивают надежность и долговечность конструкций.
Независимо от сферы применения, использование швеллеров
позволяет создавать надежные и устойчивые конструкции,
способные выдерживать значительные нагрузки и обеспечивать
безопасность эксплуатации.
http://www.allshveller.ru/
Khvicha Kvaratskhelia https://khvicha-kvaratskhelia.real-madrid-ar.com midfielder of the Georgian national football team and the Italian club “Napoli”. Became champion of Italy and best player in Serie A in the 2022/23 season. Kvaratskhelia is a graduate of Dynamo Tbilisi and played for the Rustavi team.
Saud Abdullah Abdulhamid https://saud-abdulhamid.real-madrid-ar.com Saudi footballer, defender of the Al -Hilal” and the Saudi Arabian national team. Asian champion in the age category up to 19 years. Abdulhamid is a graduate of the Al-Ittihad club. On December 14, 2018, he made his debut in the Saudi Pro League in a match against Al Bateen
Do you have a spam problem on this blog; I also am a blogger, and I was wondering your situation; many of us have developed some nice methods and we are looking to swap techniques with others, be sure to shoot me an email if interested.
сайт gama casino
https://images.google.md/url?q=https://subscribe.ru/author/25924851/group/records/?page=43
Watch the Plane Ascend: The plane takes off and starts climbing.
aviator game
Bonuses: Online casinos often offer bonuses and promotions, enhancing the gaming experience.
aviator game
Vinicius Junior https://vinisius-junior.com.az player news, fresh current and latest events for today about the player of the 2024 season
Latest news and information about Marcelo https://marcelo.com.az on this site! Find Marcelo’s biography, career, playing stats and more. Find out the latest information about football master Marcelo with us!
Khabib Abdulmanapovich Nurmagomedov https://khabib-nurmagomedov.com.az Russian mixed martial arts fighter who performed under the auspices of the UFC. Former UFC lightweight champion.
Conor Anthony McGregor https://conor-mcgregor.com.az Irish mixed martial arts fighter who also performed in professional boxing. He performs under the auspices of the UFC in the lightweight weight category. Former UFC lightweight and featherweight champion.
Welcome to our official site! Get to know the history, players and latest news of Inter Miami Football Club https://inter-miami.com.az. Discover with us the successes and great performances of America’s newest and most exciting soccer club.
срочный ремонт стиральных машин [url=www.centr-remonta-stiralnyh-mashin.ru]www.centr-remonta-stiralnyh-mashin.ru[/url] .
I’m gone to convey my little brother, that he should also pay a quick visit this weblog on regular basis to obtain updated from most recent news update.
reputable online platforms that ensure safety and fair play.
aviator game
Оперативный вывод из запоя https://www.liveinternet.ru/users/laralim/post505923855/ на дому. Срочный выезд частного опытного нарколога круглосуточно. При необходимости больного госпитализируют в стационар.
Видеопродакшн студия https://humanvideo.ru полного цикла. Современное оборудование продакшн-компании позволяет снимать видеоролики, фильмы и клипы высокого качества. Создание эффективных видеороликов для рекламы, мероприятий, видеоролики для бизнеса.
Terrific advice, Kudos.
Look at my web blog: https://rink40.loginblogin.com/34212943/finding-the-best-sports-betting-sites-in-korea
[u][b] Привет![/b][/u]
Наша компания предлагает выгодно и быстро заказать диплом, который выполнен на оригинальном бланке и заверен печатями, водяными знаками, подписями. Документ способен пройти любые проверки, даже с использованием профессионального оборудования. Достигайте свои цели быстро и просто с нашим сервисом.
[b]Где заказать диплом специалиста?[/b]
http://ilovehabbo.bbon.ru/viewtopic.php?id=1459#p28856
[b]Успехов в учебе![/b]
продвижение сайтов в москве яндекс оплата за результат [url=http://prodvizhenie-sajtov-v-moskve115.ru/]http://prodvizhenie-sajtov-v-moskve115.ru/[/url] .
Отличный магазин, буду заказывать здесь снова! Рекомендую!
купить тяговый аккумулятор
Приветствую. Подскажите, где почитать разные статьи о недвижимости? Пока нашел https://sintes21.ru
http://google.co.za/url?q=https://subscribe.ru/author/25924851/group/records/?page=42
Совсем недавно открылся новый интернет портал BlackSprut (Блекспрут) https://bs2cite.cc в даркнете, который предлагает купить нелегальные товары и заказать запрещенные услуги. Самая крупнейшая площадка СНГ. Любимые шопы и отзывчивая поддержка.
Заказать вывоз мусора https://musorovozzz.ru в Москве и Московской области, недорого и в любое время суток в мешках или контейнерами 8 м?, 20 м?, 27 м?, 38 м?, собственный автопарк. Заключаем договора на вывоз мусора.
read the article [url=https://robloxhacks.fun/]exploits roblox[/url]
Реальные анкеты https://prostitutki-vyzvat-moskva.ru Москвы с проверенными фото – от элитных путан до дешевых шлюх. Каталог всех индивидуалок на каждой станции метро с реальными фотографиями без ретуши и с отзывами реальных клиентов.
Effective Strategies for Beginners
aviator game
Откройте для себя мир новейших турецких сериалов! На сайте turkishclub.tv вас ждут [url=https://turkishclub.tv/serials2024/]турецкие сериалы 2024 онлайн[/url]. Самые ожидаемые премьеры следующего года теперь доступны в высоком качестве и без рекламы. Погружайтесь в увлекательные сюжеты с профессиональной озвучкой на русском языке.
turkishclub.tv – ваш лучший выбор для просмотра турецких сериалов онлайн. Присоединяйтесь к нашему сообществу и наслаждайтесь захватывающими новинками 2024 года. Не упустите шанс первыми увидеть новые сериалы!
http://images.google.kg/url?q=https://subscribe.ru/author/25924851/group/records/?page=41
Welcome to the site dedicated to Michael Jordan https://michael-jordan.com.az, a basketball legend and symbol of world sports culture. Here you will find highlights, career, family and news about one of the greatest athletes of all time.
Diego Armando Maradona https://diego-maradona.com.az Argentine footballer who played as an attacking midfielder and striker. He played for the clubs Argentinos Juniors, Boca Juniors, Barcelona, ??Napoli, and Sevilla.
useful site [url=https://fortniteskinchanger.org/]fortnite skin changer[/url]
[url=https://cs2skinchanger.com/]free cs2 skinchanger[/url] – cs2 skinchanger, cs2 skin changer dll
back for more.
aviator game
ремонт стиральных машин дома на выезде [url=www.centr-remonta-stiralnyh-mashin.ru]www.centr-remonta-stiralnyh-mashin.ru[/url] .
Gucci купить http://thebestluxurystores.ru по низкой цене в интернет-магазине брендовой одежды. Одежда и обувь бренда Gucci c доставкой.
Монтаж систем отопления https://fectum.pro, водоснабжения, вентиляции, канализации, очистки воды, пылеудаления, снеготаяния, гелиосистем в Краснодаре под ключ.
Muhammad Ali https://muhammad-ali.com.az American professional boxer who competed in the heavy weight category; one of the most famous boxers in the history of world boxing.
http://www.google.ch/url?q=https://subscribe.ru/author/25924851/group/records/?page=40
[url=https://cs2cheats.io/]csgo cheat[/url] – wallhack cs2, cs2 cheats download
продвижение сайтов в москве цены [url=http://prodvizhenie-sajtov-v-moskve115.ru/]http://prodvizhenie-sajtov-v-moskve115.ru/[/url] .
Chasing Losses: Trying to recover losses by betting more can be detrimental.
aviator game
[u][b] Привет![/b][/u]
Для определенных людей, купить [b]диплом[/b] о высшем образовании – это необходимость, шанс получить достойную работу. Впрочем для кого-то – это желание не терять время на учебу в ВУЗе. С какой бы целью вам это не понадобилось, наша фирма готова помочь. Быстро, качественно и по разумной стоимости сделаем диплом любого ВУЗа и года выпуска на настоящих бланках с реальными подписями и печатями.
[b]Наши специалисты предлагают[/b] быстро приобрести диплом, который выполняется на бланке ГОЗНАКа и заверен мокрыми печатями, штампами, подписями официальных лиц. Диплом пройдет любые проверки, даже с использованием специальных приборов. Достигайте цели быстро и просто с нашими дипломами.
[b]О преимуществах наших документов:[/b]
• используются только качественные бланки “Гознак”;
• необходимые подписи руководства;
• мокрые печати ВУЗа;
• специальные водяные знаки, нити и другие степени защиты;
• безупречное заполнение и оформление – ошибки исключены;
• любая проверка документа.
[b]Где купить диплом специалиста?[/b]
http://o91746bp.beget.tech/2023/11/07/diplomy-universitetov-na-blanke-goznak-zakazyvay-v-onlayn-rezhime.html
[b]Успехов в учебе![/b]
look here
[url=https://github.com/h25-io/flugsvamp-4.0]flugsvamp 4 lank[/url]
Сайт turkishclub.tv предлагает [url=https://turkishclub.tv/kriminal/]турецкие сериалы криминал[/url], которые раскрывают захватывающие истории о преступлениях и расследованиях. Эти сериалы отличаются реалистичными сюжетами и глубокой проработкой персонажей, что привлекает внимание зрителей. Доступ к просмотру предоставляется бесплатно, в высоком 720 HD качестве, с русским переводом и без рекламы.
Каждый день добавляются новые серии, что позволяет зрителям всегда быть в курсе последних событий. Откройте для себя мир турецких криминальных сериалов на turkishclub.tv и наслаждайтесь качественным контентом.
[u][b] Добрый день![/b][/u]
Мы можем предложить дипломы любых профессий по доступным тарифам.
Мы можем предложить документы ВУЗов, расположенных в любом регионе Российской Федерации. Вы имеете возможность приобрести качественно сделанный диплом за любой год, указав необходимую специальность и оценки за все дисциплины. Дипломы и аттестаты выпускаются на бумаге высшего качества. Это дает возможности делать государственные дипломы, которые невозможно отличить от оригиналов. Документы заверяются необходимыми печатями и подписями.
[b]Где купить диплом специалиста?[/b]
[url=https://belobog1.freehostia.com/phpBB2/profile.php?mode=viewprofile&u=177187]babygirlboyname.com/biblical-baby-girls-names-start-with/A[/url]
Social Elements: Options for multiplayer gameplay and chat features enhance the social experience.
aviator game
[u][b] Добрый день![/b][/u]
Где заказать диплом по актуальной специальности?
[b]Мы предлагаем документы ВУЗов,[/b] расположенных в любом регионе России. Можно приобрести качественно сделанный диплом за любой год, включая сюда документы старого образца СССР. Документы выпускаются на “правильной” бумаге самого высшего качества. Это позволяет делать настоящие дипломы, не отличимые от оригинала. Документы будут заверены необходимыми печатями и подписями.
[url=https://www.aikidosydney.com/cdn-cgi/l/email-protection]www.redlideres.cl/lider/sergio-rica/[/url]
[b]Здравствуйте[/b]!
Задался вопросом: можно ли на самом деле купить диплом государственного образца в Москве? Был приятно удивлен — это реально и легально!
Сначала искал информацию в интернете на тему: купить аттестат, купить диплом специалиста, купить диплом железнодорожника, купить диплом в абакане, купить диплом в соликамске и получил базовые знания. В итоге остановился на материале: https://ironway.ru/forum/viewtopic.php?f=12&t=12393
Удачи!
this contact form
[url=https://github.rc1844.workers.dev/h25-io/Sipulitie-Toripaikka]sipulitori[/url]
read the full info here
[url=https://github.rc1844.workers.dev/h25-io/abacus-market]abacus darknet link[/url]
Lev Ivanovich Yashin https://lev-yashin.com.az Soviet football player, goalkeeper. Olympic champion in 1956 and European champion in 1960, five-time champion of the USSR, three-time winner of the USSR Cup.
Usain St. Leo Bolt https://usain-bolt.com.az Jamaican track and field athlete, specialized in short-distance running, eight-time Olympic champion and 11-time world champion (a record in the history of this competition among men).
Al-Nasr https://al-nasr.com.az your source of news and information about Al-Nasr Football Club . Find out the latest results, transfer news, player and manager interviews, fixtures and much more.
You have a source of the latest and most interesting sports news from Kazakhstan: “Kazakhstan sports news https://sports-kazahstan.kz: Games and records” ! Follow us to receive updates and interesting news every minute!
Game World https://kz-games.kz offers the latest online gaming news, game reviews, gameplay and ideas, gaming tactics and tips . Start playing our most popular and amazing games and get ready to become the leader in the online gaming world!
Great site you have here.. It’s hard to find quality writing like yours
these days. I seriously appreciate people like you!
Take care!!
Frequently Asked Questions (FAQs)
aviator game
Does your site have a contact page? I’m having trouble locating it but,
I’d like to shoot you an e-mail. I’ve got some ideas for
your blog you might be interested in hearing.
Either way, great website and I look forward to seeing it develop over time.
На сайте https://turkzona.com/ представлены интересные, увлекательные турецкие сериалы, которые точно понравятся всем любителям такого направления. Все фильмы интересные, увлекательные, а самое главное, что представлены в отличном качестве, отличаются четкой картинкой, качественным звуком, что усиливает приятные эмоции от просмотра. Перед вами огромный выбор вариантов фильмов самых разных жанров: мелодрамы, драмы. Для того чтобы подобрать оптимальный вариант, необходимо определиться с годом выпуска.
Latest news and information about the NBA https://basketball-kz.kz in Kazakhstan. Hot stories, player transfers and highlights. Watch the NBA world with us.
Top sports news https://sport-kz-news.kz, photos and blogs from experts and famous athletes, as well as statistics and information about matches of leading championships.
social interaction adds a new layer of excitement and competition to the game, making it more engaging and
aviator game
The latest top football news https://football-kz.kz today. Interviews with football players, online broadcasts and match results, analytics and football forecasts, photos and videos.
продвижение сайтов интернет магазины в москве [url=http://prodvizhenie-sajtov-v-moskve115.ru]http://prodvizhenie-sajtov-v-moskve115.ru[/url] .
Сайт turkishclub.tv предлагает [url=https://turkishclub.tv/kriminal/]турецкие сериалы криминал[/url], которые раскрывают захватывающие истории о преступлениях и расследованиях. Эти сериалы отличаются реалистичными сюжетами и глубокой проработкой персонажей, что привлекает внимание зрителей. Доступ к просмотру предоставляется бесплатно, в высоком 720 HD качестве, с русским переводом и без рекламы.
Каждый день добавляются новые серии, что позволяет зрителям всегда быть в курсе последних событий. Откройте для себя мир турецких криминальных сериалов на turkishclub.tv и наслаждайтесь качественным контентом.
The Dota 2 website https://dota2-kz.kz provides the most complete information about the latest game updates, tournaments and upcoming events. We are here for every winning tactic, secret and important guide.
Game World online https://games-online-eg.com the latest online gaming news, game reviews, gameplay, ideas, gaming tactics and tips. The most popular and amazing games and get ready to become the leader in the online gaming world!
Wessel was arrested for possession of the stolen vehicle, possession of drug paraphernalia and a warrant for driving on a suspended license.
Also visit my blog post; https://www.daplus.com/bbs/board.php?bo_table=free&wr_id=7067
The app makes use of geolocation technologies to assure that when you purchase lottery tickets you are inside GA state lines.
Also visit my site; https://jackoff.co.kr/member/login.html?noMemberOrder=&returnUrl=https://z9n.net/2504fm
[b]Привет, друзья[/b]!
Всегда считал, что покупка диплома о высшем образовании — это миф. Но, оказалось, что все возможно! Сначала искал информацию по теме: старые дипломы купить, купить диплом в донском, купить диплом в октябрьском, купить диплом с реестром, купить диплом старого образца, а затем перешел на дипломы вузов. Подробнее можно узнать здесь: http://www.kladonahodki.ru/component/k2/itemlist/user/297633
Оказалось, что все возможно и официально, с упрощенными программами обучения. Теперь у меня диплом московского вуза нового образца, и я рекомендую вам воспользоваться этим шансом!
Успешной учебы!
Как выбрать клинику для проведения процедуры с ботоксом? – Выбирайте клинику с хорошими отзывами, квалифицированными специалистами и лицензией на проведение таких процедур.
How to choose a clinic for the Botox procedure? – Choose a clinic with good reviews, qualified specialists, and a license to perform such procedures.
ботокс хабаровск [url=https://www.gmtclinic.ru/]https://www.gmtclinic.ru/[/url] .
Are There Any Costs Involved?
aviator game
ขอบคุณสำหรับบทความที่น่าสนใจนี้!
ผมขอแนะนำ สมัครเกมสล็อตเว็บตรง เพิ่มนะครับ เป็นslot เว็บตรง มีระบบฝากถอน อัตโนมัติที่สบายมากๆฝาก-ถอน ไม่มีขั้นต่ำ แถมยังใช้เทคโนโลยีการเข้ารหัส SSL เพื่อให้มีความปลอดภัยสำหรับการทำธุรกรรม จุดเด่นอีกอย่างคือเกมสล็อตเว็บตรงที่ดีที่สุดจากผู้พัฒนาชั้นแนวหน้ามากไม่น้อยเลยทีเดียว เล่นแล้วรู้สึกไม่มีอันตรายรวมทั้งได้รับความเที่ยงธรรม
ทดลองเข้าไปดูเพิ่มเติมพอดี สล็อต pg เว็บตรงแตกง่าย
นะครับ
Most of the providers discussed right now provide attractive bonuses, thousands of sporting markets, and near-instant withdrawals.
There are numerous online communities and forums where Aviator Game enthusiasts can share tips, strategies, and
aviator game
Latest news about games for Android https://android-games.kz, reviews and daily updates. Read now and get the latest information about the most exciting games
Check out Minecraft kz https://minecraft-kz.kz for the latest news, guides, and in-depth reviews of the game options available. Find the latest information on Minecraft Download, Pocket Edition and Bedrock Edition.
Latest news from World of Warcraft https://wow-kz.kz (WOW) tournaments, strategy and game analysis. The most detailed gaming portal in the language.
где купить dolce gabbana [url=https://scm-fashion.ru/]https://scm-fashion.ru/[/url] .
Latest news and analysis of the Premier League https://premier-league.kz. Full descriptions of matches, team statistics and the most interesting football events. Premier Kazakhstan is the best place for football fans.
[u][b] Привет![/b][/u]
Наши специалисты предлагают выгодно и быстро заказать диплом, который выполнен на бланке ГОЗНАКа и заверен печатями, водяными знаками, подписями. Наш диплом пройдет лубую проверку, даже с применением специального оборудования. Решите свои задачи максимально быстро с нашим сервисом.
[b]Где купить диплом специалиста?[/b]
https://smd.mybb.ru/viewtopic.php?id=3666#p22170
[b]Успешной учебы![/b]
Всем привет! Подскажите, где почитать полезные статьи о недвижимости? Пока нашел https://ste96.ru
[b]Привет всем[/b])
Хорошо быть студентом, пока не придет пора писать диплом, что и произошло со мной, но не стоит отчаиваться, ведь есть хорошие компании что помогают с написанием и сдачей диплома на хорошие оценки!
Изначально искал информацию про купить диплом железнодорожника, купить аттестат за 11 класс, купить диплом фармацевта, купить диплом в таганроге, купить диплом в нальчике, потом попал на https://clicky.buzz/index.php?do=/public/blog/view/id_119666/title_/ и там решили все мои учебные заботы!
Удачи!
Key Developers and Companies Involved
aviator game
На сайте https://spb-gid.ru/ представлена самая исчерпывающая, интересная информация, которая касается Санкт-Петербурга. Здесь освещаются самые последние мероприятия, которые будут происходить в ближайшее время. Есть данные относительно того, в какой ресторан лучше всего сходить. Отмечены самые интересные кафе для того, чтобы отправиться туда с друзьями. Рассматриваются различные варианты жилья, в том числе, хостелы, гостиницы, аренда комнат, квартир. Имеется информация про метро, общественный транспорт, а также железнодорожный.
Доставка груза и грузоперевозки https://tamozhennyy-deklarant.blogspot.com по России через транспортную компанию автотранспортом доступна и для частных лиц. Перевозчик отправит или доставит ваш груз: выгодные тарифы индивидуальный подход из рук в руки 1 машиной.
Зеркала интерьерные https://zerkala-mag.ru в интернет-магазине «Зеркала с подсветкой» Самые низкие цены на зеркала!
Предлагаем купить гаражное оборудование https://profcomplex.pro, автохимию, технику и уборочный инвентарь для клининговых компаний. Доставка по Москве и другим городам России.
Купить зеркала https://zerkala-m.ru по низким ценам. Более 1980 моделей, купить недорого в интернет-магазине в Москве с доставкой по России. Удобный каталог, низкие цены, качественные фото.
https://images.google.com.jm/url?q=https://teletype.in/@kl45
Convenience: Play from the comfort of your home or on the go.
aviator game
The Dota 2 website https://dota2-ar.com provides the most detailed information about the latest game updates, tournaments and upcoming events. We have all the winning tactics, secrets and important guides.
Spider-Man https://spiderman.kz the latest news, articles, reviews, dates, spoilers and other latest information. All materials on the topic “Spider-Man”
Latest Counter-Strike 2 news https://counter-strike-kz.kz, watch the most successful tournaments and be the best in the gaming world.
The latest top football news https://football.sport-news-eg.com today. Interviews with football players, online broadcasts and match results, analytics and football forecasts, photos and videos.
https://maps.google.kz/url?q=https://subscribe.ru/author/25924851/group/records/?page=39
Discover the dynamic world of Arab sports https://sports-ar.com through the lens of Arab sports news. Your premier source for breaking news, exclusive interviews, in-depth analysis and live coverage of everything happening in sports.
Любите истории, полные страсти и эмоций? На turkishclub.tv вас ждут [url=https://turkishclub.tv/melodramy/]турецкие сериалы мелодрамы[/url]. Погрузитесь в мир любовных интриг и драматических сюжетов, которые захватят ваше сердце с первых минут. Эти сериалы доступны в высоком 720 HD качестве и с профессиональным русским переводом, что делает просмотр еще более приятным.
Каждый день мы добавляем новые серии, чтобы вы могли наслаждаться свежими эпизодами без рекламы. Присоединяйтесь к тысячам зрителей, уже выбравших turkishclub.tv для просмотра мелодрам, и наслаждайтесь лучшими историями любви онлайн.
Online casino games have surged in popularity due to their convenience and the immersive experience they offer.
buy vigor tonic
in the background this, it is safe to https://https://jaxx-wallet.com// using a shared public key. Connect the ledger crypto wallet to the Ledger Live app to manage your Bitcoins on the go.
Иркутск окна ПВХ fod38.ru
Самые лучшие по характеристикам и цене пластиковые окна производят тут! Приглашаем Вас на Фабрику окон и дверей в Иркутске, чтобы купить выдающиеся пластиковые окна для вашей квартиры или загородного дома. Мы являемся производителем, поэтому у нас низкие цены и отличное качество, на которое предоставляется гарантия. Изготовление происходит в максимально быстрые сроки, а также монтаж настоящими профессионалами.
На интернет сайте fod38.ru Вы сможете найти всю интересную информацию о представленной компании, продукции, контакты и как сделать заказ. Предлагаем 3 варианта ПВХ окон: эконом, стандарт и премиум, где особенной чертой будет являться цена/качество. Выбирайте нужный Вам вариант или получите консультацию от профессионала, какой конкретно сделать выбор в определенном случае.
По запросу [url=https://fod38.ru/osteklenie-balkonov/]балконы иркутск цены[/url] мы обязательно Вам окажем помощь. Окна от представленной фабрики являются экологически чистыми, так как в них не содержится свинец. После монтажа, в помещениях будет бесшумно и комфортно, а также надежно для детей, ведь мы устанавливаем ручки с замком. Все стекла с защитой от ультрафиолета, а ещё их просто мыть, удобно проветривать и красиво на них смотреть.
Если Вы планировали найти [url=https://fod38.ru/]окна пластиковые купить[/url] – то заходите на указанный сайт. На сайте fod38.ru можно записаться на бесплатный замер будущих окон. Это правильное решение, чтобы не тратить своё личное время, ведь договор можно заключить прямо на дому. Замерщик ответит на все Ваши вопросы, покажет примеры и фотографии, примет в расчет любые ваши пожелания и сделает точный замер с ценой.
Звоните по номеру телефона +7(3952)656-226 или приезжайте в один из офисов, по адресу: г. Иркутск, ул. Розы Люксембург, д. 21. Режим работы с понедельника по пятницу с 9:00 до 17:30, выходной воскресенье. Приходите, заказывайте лучшие окна в Вашей жизни.
https://blacksprut-sait.top – блэкспрут 2fa, blacksprut onion
https://bs4shop.top/ – блэкспрут ссылка, blacksprut даркнет
Интернет магазин электроники и цифровой техники по доступным ценам. Доставка мобильной электроники по Москве и Московской области.
UFC news https://ufc-ar.com, schedule of fights and tournaments 2024, ratings of UFC fighters, interviews, photos and videos. Live broadcasts and broadcasts of tournaments, statistics, forums and fan blogs.
NHL news https://nhl-ar.com (National Hockey League) – the latest and most up-to-date NHL news for today.
The most important sports news https://bein-sport-egypt.com, photos and blogs from experts and famous athletes, as well as statistics and information about matches of leading leagues.
News and events of the American Basketball League https://basketball-eg.com in Egypt. Hot events, player transfers and the most interesting events. Explore the world of the NBA with us.
Can I Play the Aviator Game on Mobile?
best treatment for erectile dysfunction
Wonderful post! We are linking to this particularly great content on our
website. Keep up the good writing.
[u][b] Добрый день![/b][/u]
Где заказать диплом специалиста?
Мы предлагаем дипломы любой профессии по приятным ценам. Цена зависит от выбранной специальности, года получения и образовательного учреждения.
[b]Купить диплом о высшем образовании[/b]
https://landik-diploms-srednee.ru/kupit-diplom-v-rostove-na-donu
[b]Успехов в учебе![/b]
[u][b] Привет![/b][/u]
Где приобрести диплом специалиста?
Заказать диплом ВУЗа.
Стоимость во много раз ниже[/b] чем довелось бы платить на очном обучении в университете
https://otpusk.ru/user/index.php?backurl=%2Fforum%2Ftopic%2Fadd%2Fforum2%2F
[b]Удачи![/b]
You made your point!
my web-site – https://e-academy.navttc.gov.pk/blog/index.php?entryid=66309
For NeoSurf, you can deposit as smwll as $ten but only $250
at the most.
Also visit my page; Helpful resources
It’s going to be end of mine day, however before ending I am reading this enormous piece of writing to improve my knowledge.
Summary of Key Points
best nutritional supplements for men
This paragraph offers clear idea in support of the new visitors of blogging, that actually
how to do blogging.
[b]Здравствуйте[/b]!
Задался вопросом: можно ли на самом деле купить диплом государственного образца в Москве? Был приятно удивлен — это реально и легально!
Сначала искал информацию в интернете на тему: купить диплом в ростове-на-дону, купить диплом в ельце, купить диплом косметолога, купить диплом в самаре, купить диплом в нальчике и получил базовые знания. В итоге остановился на материале: http://naigle.borda.ru/?1-4-0-00002407-000-0-0-1718285078
[b]Удачи![/b]
Discover the wonderful world of online games https://game-news-ar.com. Get the latest news, reviews and tips for your favorite games.
The site is dedicated to football https://fooball-egypt.com, football history and news. Latest news and fresh reviews of the world of football
News, tournaments, guides and strategies about the latest GTA games https://gta-ar.com. Stay tuned for the best GTA gaming experience
Latest news https://android-games-ar.com about Android games, reviews and daily updates. The latest information about the most exciting games.
Minecraft news https://minecraft-ar.com, guides and in-depth reviews of the gaming features available in Minecraft Ar. Get the latest information on downloading Minecraft, Pocket Edition and Bedrock Edition.
roadhouse movie walgreens film to digitalwhat episode is bmf on season 2longest post season game evermovie where trucks come to life
Superb, what a website it is! This blog gives helpful facts to us, keep it up.
Насколько эффективно лазерное удаление папиллом? – Лазерное удаление папиллом является высокоэффективным методом, который позволяет полностью удалить новообразования с минимальным риском рецидива.
How effective is laser removal of papillomas? – Laser removal of papillomas is a highly effective method that allows complete removal of growths with minimal risk of recurrence.
удаление папилломы лазером [url=https://laser-removal-of-papillomas.ru/]https://laser-removal-of-papillomas.ru/[/url] .
How to Start Playing the Aviator Game?
extenze male enhancement
[u][b] Привет, друзья![/b][/u]
Где приобрести диплом специалиста?
Приобретение диплома любого ВУЗа России в нашей компании – надежный процесс, так как документ [b]будет заноситься в государственный реестр[/b]. При этом печать производится на специальных бланках, установленных государством.
Вы покупаете диплом [b]в надежной и проверенной временем компании.[/b]
http://justvoip.listbb.ru/posting.php?mode=post&f=2&sid=152e88aabd372eda7b64efe2e31c0d83
[b]Успешной учебы![/b]
Добавление аудио в вирт и уменьшение уровня этого звука до ноля – среди способов предотвратить удаление вашего видео за нарушение.
My blog post … http://99zvuk.ru/
Хотите быть в курсе всех важных тем в сфере недвижимости?
На нашем сайте вы сможете найти множество интересных статей о квартирах от застройщика, налогах на недвижимость, а также о регистрации квартиры.
http://zoltor24sochi.ru
click for info [url=https://my-atomicwallet.de]Atomic wallet[/url]
[b]Здравствуйте[/b]!
Задался вопросом: можно ли на самом деле купить диплом государственного образца в Москве? Был приятно удивлен — это реально и легально!
Сначала искал информацию в интернете на тему: купить диплом в абакане, купить диплом в невинномысске, купить диплом в чебоксарах, купить диплом электромонтера, купить диплом о среднем образовании и получил базовые знания. В итоге остановился на материале: http://logo-def.ru/userinfo.php?uid=26819
Хорошей учебы!
Overview of the Aviator Game Experience
how to make levitra more effective
[url=https://bs2beast.cc]Bs2site.at[/url] – Bs2tsite5, Bs2clear
Алюминиевые двери Иркутск fod38.ru
Идеальные по свойствам и цене ПВХ окна делают здесь! Приглашаем Вас на Фабрику окон и дверей в Иркутске, чтобы купить выдающиеся пластиковые окна для вашей квартиры или дома. Мы значимся производителем, поэтому у нас небольшие цены и высокое качество, на которое дается гарантия. Изготовление происходит в очень быстрые сроки, а также монтаж настоящими специалистами.
На интернет портале fod38.ru Вы найдете всю важную информацию о нашей компании, продукции, контакты и как сделать заказ. Предлагаем 3 варианта ПВХ окон: эконом, стандарт и премиум, где отличительной чертой будет представляться цена/качество. Выбирайте нужный Вам вариант или просите консультацию от специалиста, какой конкретно сделать выбор в вашем случае.
По вопросу [url=https://fod38.ru/]установка пластиковых окон[/url] мы обязательно Вам окажем помощь. Окна от представленной фабрики являются экологически чистыми, так как в них не содержится свинец. После монтажа, в помещениях будет бесшумно и спокойно, а также надежно для детей, ведь мы делаем ручки с замком. Все ПВХ окна с защитой УФ, а ещё их просто мыть, удобно проветривать и они впишутся в любой интерьер.
Если Вы хотели найти [url=https://fod38.ru/]окна пвх пластиковые[/url] – то переходите на указанный сайт. На сайте fod38.ru можно оформить заказ на бесплатный замер будущих окон. Это самое верное решение, чтобы не тратить своё свободное время, ведь договор можно заключить прямо на объекте. Замерщик даст ответы на все Ваши вопросы, покажет образцы и фотографии, учтет все ваши пожелания и сделает безупречный замер с расценками.
Звоните по номеру телефона +7(3952)656-226 или приезжайте в один из офисов, по адресу: г. Иркутск, ул. Марата, д. 6, офис 1. График работы с понедельника по пятницу с 9:00 до 17:30, воскресенье – выходной день. Приходите, заказывайте лучшие окна в Вашей жизни.
[url=https://telegra.ph/Remont-televizorov-na-domu-v-Sankt-Peterburge-professionalnye-uslugi-ot-Servis-Master-SPb-07-08]https://telegra.ph/Remont-televizorov-na-domu-v-Sankt-Peterburge-professionalnye-uslugi-ot-Servis-Master-SPb-07-08[/url] ремонт телевизоров спб на дому.
ремонт телевизоров lg в спб [url=https://telegra.ph/Remont-televizorov-na-domu-v-Sankt-Peterburge-professionalnye-uslugi-ot-Servis-Master-SPb-07-08]https://telegra.ph/Remont-televizorov-na-domu-v-Sankt-Peterburge-professionalnye-uslugi-ot-Servis-Master-SPb-07-08[/url].
ремонт жк телевизоров в спб [url=https://telegra.ph/Remont-televizorov-na-domu-v-Sankt-Peterburge-professionalnye-uslugi-ot-Servis-Master-SPb-07-08]https://telegra.ph/Remont-televizorov-na-domu-v-Sankt-Peterburge-professionalnye-uslugi-ot-Servis-Master-SPb-07-08[/url].
вызов телемастера на дом [url=https://telegra.ph/Remont-televizorov-na-domu-v-Sankt-Peterburge-professionalnye-uslugi-ot-Servis-Master-SPb-07-08]https://telegra.ph/Remont-televizorov-na-domu-v-Sankt-Peterburge-professionalnye-uslugi-ot-Servis-Master-SPb-07-08[/url].
[url=https://telegra.ph/Remont-televizorov-na-domu-v-Sankt-Peterburge-professionalnye-uslugi-ot-Servis-Master-SPb-07-08]https://telegra.ph/Remont-televizorov-na-domu-v-Sankt-Peterburge-professionalnye-uslugi-ot-Servis-Master-SPb-07-08[/url] ремонт телевизоров шарп на дому.
[url=https://telegra.ph/Remont-televizorov-na-domu-v-Sankt-Peterburge-professionalnye-uslugi-ot-Servis-Master-SPb-07-08]https://telegra.ph/Remont-televizorov-na-domu-v-Sankt-Peterburge-professionalnye-uslugi-ot-Servis-Master-SPb-07-08[/url] починить телевизор на дому.
[url=https://telegra.ph/Remont-televizorov-na-domu-v-Sankt-Peterburge-professionalnye-uslugi-ot-Servis-Master-SPb-07-08]https://telegra.ph/Remont-televizorov-na-domu-v-Sankt-Peterburge-professionalnye-uslugi-ot-Servis-Master-SPb-07-08[/url] ремонт телевизоров спб.
ремонт телевизоров на дому спб [url=https://telegra.ph/Remont-televizorov-na-domu-v-Sankt-Peterburge-professionalnye-uslugi-ot-Servis-Master-SPb-07-08]https://telegra.ph/Remont-televizorov-na-domu-v-Sankt-Peterburge-professionalnye-uslugi-ot-Servis-Master-SPb-07-08[/url] .
ремонт телевизоров санкт-петербург [url=https://telegra.ph/Remont-televizorov-na-domu-v-Sankt-Peterburge-professionalnye-uslugi-ot-Servis-Master-SPb-07-08]https://telegra.ph/Remont-televizorov-na-domu-v-Sankt-Peterburge-professionalnye-uslugi-ot-Servis-Master-SPb-07-08[/url] .
ремонт телевизоров в спб [url=https://telegra.ph/Remont-televizorov-na-domu-v-Sankt-Peterburge-professionalnye-uslugi-ot-Servis-Master-SPb-07-08]https://telegra.ph/Remont-televizorov-na-domu-v-Sankt-Peterburge-professionalnye-uslugi-ot-Servis-Master-SPb-07-08[/url]
ремонт телевизоров рядом со мной [url=https://telegra.ph/Remont-televizorov-na-domu-v-Sankt-Peterburge-professionalnye-uslugi-ot-Servis-Master-SPb-07-08]https://telegra.ph/Remont-televizorov-na-domu-v-Sankt-Peterburge-professionalnye-uslugi-ot-Servis-Master-SPb-07-08[/url]
[url=https://telegra.ph/Remont-televizorov-ZHK-v-Sankt-Peterburge-07-08]https://telegra.ph/Remont-televizorov-ZHK-v-Sankt-Peterburge-07-08[/url] ремонт телевизоров спб на дому.
ремонт телевизоров lg в спб [url=https://telegra.ph/Remont-televizorov-ZHK-v-Sankt-Peterburge-07-08]https://telegra.ph/Remont-televizorov-ZHK-v-Sankt-Peterburge-07-08[/url].
ремонт жк телевизоров в спб [url=https://telegra.ph/Remont-televizorov-ZHK-v-Sankt-Peterburge-07-08]https://telegra.ph/Remont-televizorov-ZHK-v-Sankt-Peterburge-07-08[/url].
вызов телемастера на дом [url=https://telegra.ph/Remont-televizorov-ZHK-v-Sankt-Peterburge-07-08]https://telegra.ph/Remont-televizorov-ZHK-v-Sankt-Peterburge-07-08[/url].
[url=https://telegra.ph/Remont-televizorov-ZHK-v-Sankt-Peterburge-07-08]https://telegra.ph/Remont-televizorov-ZHK-v-Sankt-Peterburge-07-08[/url] ремонт телевизоров шарп на дому.
[url=https://telegra.ph/Remont-televizorov-ZHK-v-Sankt-Peterburge-07-08]https://telegra.ph/Remont-televizorov-ZHK-v-Sankt-Peterburge-07-08[/url] починить телевизор на дому.
[url=https://telegra.ph/Remont-televizorov-ZHK-v-Sankt-Peterburge-07-08]https://telegra.ph/Remont-televizorov-ZHK-v-Sankt-Peterburge-07-08[/url] ремонт телевизоров спб.
ремонт телевизоров на дому спб [url=https://telegra.ph/Remont-televizorov-ZHK-v-Sankt-Peterburge-07-08]https://telegra.ph/Remont-televizorov-ZHK-v-Sankt-Peterburge-07-08[/url] .
ремонт телевизоров санкт-петербург [url=https://telegra.ph/Remont-televizorov-ZHK-v-Sankt-Peterburge-07-08]https://telegra.ph/Remont-televizorov-ZHK-v-Sankt-Peterburge-07-08[/url] .
ремонт телевизоров в спб [url=https://telegra.ph/Remont-televizorov-ZHK-v-Sankt-Peterburge-07-08]https://telegra.ph/Remont-televizorov-ZHK-v-Sankt-Peterburge-07-08[/url]
ремонт телевизоров рядом со мной [url=https://telegra.ph/Remont-televizorov-ZHK-v-Sankt-Peterburge-07-08]https://telegra.ph/Remont-televizorov-ZHK-v-Sankt-Peterburge-07-08[/url]
[url=https://telegra.ph/Vyzov-telemastera-na-dom-v-Sankt-Peterburge-07-08]https://telegra.ph/Vyzov-telemastera-na-dom-v-Sankt-Peterburge-07-08[/url] ремонт телевизоров спб на дому.
ремонт телевизоров lg в спб [url=https://telegra.ph/Vyzov-telemastera-na-dom-v-Sankt-Peterburge-07-08]https://telegra.ph/Vyzov-telemastera-na-dom-v-Sankt-Peterburge-07-08[/url].
ремонт жк телевизоров в спб [url=https://telegra.ph/Vyzov-telemastera-na-dom-v-Sankt-Peterburge-07-08]https://telegra.ph/Vyzov-telemastera-na-dom-v-Sankt-Peterburge-07-08[/url].
вызов телемастера на дом [url=https://telegra.ph/Vyzov-telemastera-na-dom-v-Sankt-Peterburge-07-08]https://telegra.ph/Vyzov-telemastera-na-dom-v-Sankt-Peterburge-07-08[/url].
[url=https://telegra.ph/Vyzov-telemastera-na-dom-v-Sankt-Peterburge-07-08]https://telegra.ph/Vyzov-telemastera-na-dom-v-Sankt-Peterburge-07-08[/url] ремонт телевизоров шарп на дому.
[url=https://telegra.ph/Vyzov-telemastera-na-dom-v-Sankt-Peterburge-07-08]https://telegra.ph/Vyzov-telemastera-na-dom-v-Sankt-Peterburge-07-08[/url] починить телевизор на дому.
[url=https://telegra.ph/Vyzov-telemastera-na-dom-v-Sankt-Peterburge-07-08]https://telegra.ph/Vyzov-telemastera-na-dom-v-Sankt-Peterburge-07-08[/url] ремонт телевизоров спб.
ремонт телевизоров на дому спб [url=https://telegra.ph/Vyzov-telemastera-na-dom-v-Sankt-Peterburge-07-08]https://telegra.ph/Vyzov-telemastera-na-dom-v-Sankt-Peterburge-07-08[/url] .
ремонт телевизоров санкт-петербург [url=https://telegra.ph/Vyzov-telemastera-na-dom-v-Sankt-Peterburge-07-08]https://telegra.ph/Vyzov-telemastera-na-dom-v-Sankt-Peterburge-07-08[/url] .
ремонт телевизоров в спб [url=https://telegra.ph/Vyzov-telemastera-na-dom-v-Sankt-Peterburge-07-08]https://telegra.ph/Vyzov-telemastera-na-dom-v-Sankt-Peterburge-07-08[/url]
ремонт телевизоров рядом со мной [url=https://telegra.ph/Vyzov-telemastera-na-dom-v-Sankt-Peterburge-07-08]https://telegra.ph/Vyzov-telemastera-na-dom-v-Sankt-Peterburge-07-08[/url]
[url=https://telegra.ph/Pochinit-televizor-na-domu-Vyzov-telemastera-v-Sankt-Peterburge-07-08]https://telegra.ph/Pochinit-televizor-na-domu-Vyzov-telemastera-v-Sankt-Peterburge-07-08[/url] ремонт телевизоров спб на дому.
ремонт телевизоров lg в спб [url=https://telegra.ph/Pochinit-televizor-na-domu-Vyzov-telemastera-v-Sankt-Peterburge-07-08]https://telegra.ph/Pochinit-televizor-na-domu-Vyzov-telemastera-v-Sankt-Peterburge-07-08[/url].
ремонт жк телевизоров в спб [url=https://telegra.ph/Pochinit-televizor-na-domu-Vyzov-telemastera-v-Sankt-Peterburge-07-08]https://telegra.ph/Pochinit-televizor-na-domu-Vyzov-telemastera-v-Sankt-Peterburge-07-08[/url].
вызов телемастера на дом [url=https://telegra.ph/Pochinit-televizor-na-domu-Vyzov-telemastera-v-Sankt-Peterburge-07-08]https://telegra.ph/Pochinit-televizor-na-domu-Vyzov-telemastera-v-Sankt-Peterburge-07-08[/url].
[url=https://telegra.ph/Pochinit-televizor-na-domu-Vyzov-telemastera-v-Sankt-Peterburge-07-08]https://telegra.ph/Pochinit-televizor-na-domu-Vyzov-telemastera-v-Sankt-Peterburge-07-08[/url] ремонт телевизоров шарп на дому.
[url=https://telegra.ph/Pochinit-televizor-na-domu-Vyzov-telemastera-v-Sankt-Peterburge-07-08]https://telegra.ph/Pochinit-televizor-na-domu-Vyzov-telemastera-v-Sankt-Peterburge-07-08[/url] починить телевизор на дому.
[url=https://telegra.ph/Pochinit-televizor-na-domu-Vyzov-telemastera-v-Sankt-Peterburge-07-08]https://telegra.ph/Pochinit-televizor-na-domu-Vyzov-telemastera-v-Sankt-Peterburge-07-08[/url] ремонт телевизоров спб.
ремонт телевизоров на дому спб [url=https://telegra.ph/Pochinit-televizor-na-domu-Vyzov-telemastera-v-Sankt-Peterburge-07-08]https://telegra.ph/Pochinit-televizor-na-domu-Vyzov-telemastera-v-Sankt-Peterburge-07-08[/url] .
ремонт телевизоров санкт-петербург [url=https://telegra.ph/Pochinit-televizor-na-domu-Vyzov-telemastera-v-Sankt-Peterburge-07-08]https://telegra.ph/Pochinit-televizor-na-domu-Vyzov-telemastera-v-Sankt-Peterburge-07-08[/url] .
ремонт телевизоров в спб [url=https://telegra.ph/Pochinit-televizor-na-domu-Vyzov-telemastera-v-Sankt-Peterburge-07-08]https://telegra.ph/Pochinit-televizor-na-domu-Vyzov-telemastera-v-Sankt-Peterburge-07-08[/url]
ремонт телевизоров рядом со мной [url=https://telegra.ph/Pochinit-televizor-na-domu-Vyzov-telemastera-v-Sankt-Peterburge-07-08]https://telegra.ph/Pochinit-televizor-na-domu-Vyzov-telemastera-v-Sankt-Peterburge-07-08[/url]
Всем привет! Может кто знает, где почитать полезные статьи о недвижимости? Пока нашел https://kran-rdk.ru
[b]Привет всем[/b])
Хорошо быть студентом, пока не придет пора писать диплом, что и произошло со мной, но не стоит отчаиваться, ведь есть хорошие компании что помогают с написанием и сдачей диплома на хорошие оценки!
Изначально искал информацию про купить диплом в йошкар-оле, купить диплом в кызыле, купить дипломы о высшем с занесением, купить диплом в кунгуре, купить диплом в симферополе, потом попал на https://xozkacqahv.fxmag.ru/xduyw/ и там решили все мои учебные заботы!
Успешной учебы!
The current Mega Millions jackpot is worth an estimated $289 million, with a money choice of $132. million.
my web-site – https://philowiki.org:443/index.php?title=User:Heriberto33C
Call to Action for Players
penis enlargement methods
Открытие для себя Ерлинг Хааланда https://manchestercity.erling-haaland-cz.com, a talented player of «Manchester City». Learn more about his skills, achievements and career growth.
The path of 21-year-old Jude Bellingham https://realmadrid.jude-bellingham-cz.com from young talent to one of the most promising players in the world, reaching new heights with Dortmund and England.
French prodigy Kylian Mbappe https://realmadrid.kylian-mbappe-cz.com is taking football by storm, joining his main target, ” Real.” New titles and records are expected.
Harry Kane’s journey https://bavaria.harry-kane-cz.com from Tottenham’s leading striker to Bayern’s leader and Champions League champion – this is the story of a triumphant ascent to the football Olympus.
[u][b] Здравствуйте![/b][/u]
Где приобрести диплом по нужной специальности?
[b]Приобрести документ[/b] университета можно у нас. Мы оказываем услуги по продаже документов об окончании любых университетов России. Вы сможете получить необходимый диплом по любым специальностям, любого года выпуска, в том числе документы старого образца. Гарантируем, что при проверке документа работодателем, подозрений не появится.
https://roblox-studio-scripts.ru/topic/18402-kupit-diplom-b826h/
[b]Хорошей учебы![/b]
If you’ve ever played deuces wild poker, you know that landing a two is your
principal fantasy at east although the gane iss in session.
Also visit my homepage … 비트코인 판매
Всем привет! Подскажите, где почитать разные блоги о недвижимости? Сейчас читаю https://tochkacn.ru
порно анал на русском языке [url=https://www.skladchik.org]порно анал на русском языке[/url] .
Yes, the Aviator Game is compatible with mobile devices. Players can enjoy the game on their smartphones or
penis extenders
Всем привет! Может кто знает, где почитать полезные статьи о недвижимости? Пока нашел https://mart-posters.ru
[b]Здравствуйте[/b]!
Хочу поделиться своим опытом по заказу аттестата ПТУ. Думал, что это невозможно, и начал искать информацию в интернете по теме: купить диплом в братске, купить диплом в кунгуре, купить диплом о высшем образовании, купить диплом в глазове, купить диплом в нижневартовске. Постепенно углубляясь в тему, нашел отличный ресурс здесь: https://wiki.odessanews.biz/index.php/%D0%A8%D0%B8%D1%80%D0%BE%D0%BA%D0%B8%D0%B9_%D0%BA%D0%B0%D1%82%D0%B0%D0%BB%D0%BE%D0%B3_%D0%B4%D0%B8%D0%BF%D0%BB%D0%BE%D0%BC%D0%BE%D0%B2_%D1%80%D0%B0%D0%B7%D0%BD%D1%8B%D1%85_%D0%92%D0%A3%D0%97%D0%BE%D0%B2_%D0%B2_%D0%BF%D0%BE%D0%BF%D1%83%D0%BB%D1%8F%D1%80%D0%BD%D0%BE%D0%BC_%D0%B8%D0%BD%D1%82%D0%B5%D1%80%D0%BD%D0%B5%D1%82-%D0%BC%D0%B0%D0%B3%D0%B0%D0%B7%D0%B8%D0%BD%D0%B5 и остался очень доволен!
Теперь у меня есть диплом сварщика о среднем специальном образовании, и я обеспечен на всю жизнь!
Удачи!
Изготовим для Вас изделия из металла https://smith-moskva.blogspot.com, по вашим чертежам или по нашим эскизам.
Промышленные насосы https://nasosynsk.ru/catalog/promyshlennoe_oborudovanie Wilo предлагают широкий ассортимент решений для различных отраслей промышленности, включая водоснабжение, отопление, вентиляцию, кондиционирование и многие другие. Благодаря своей высокой производительности и эффективности, насосы Wilo помогают снизить расходы на энергию и обслуживание, что делает их идеальным выбором для вашего бизнеса.
https://rolaks.com отделочные материалы для фасада – интернет-магазин
[u][b] Добрый день![/b][/u]
Где заказать диплом специалиста?
Мы изготавливаем дипломы психологов, юристов, экономистов и других профессий по приятным тарифам. Цена может зависеть от выбранной специальности, года выпуска и образовательного учреждения.
[b]Приобрести диплом любого университета[/b]
https://arusak-diploms-srednee.ru/attestat-shkoly
[b]Хорошей учебы![/b]
The fascinating story of the rise of Brazilian prodigy Vinicius Junior https://realmadrid.vinicius-junior-cz.com to the heights of glory as part of the legendary Madrid “Real”
cash out before the plane crashes. The objective is to maximize winnings by timing the cash-out perfectly,
iron pump male enhancement
Mohamed Salah https://liverpool.mohamed-salah-cz.com, who grew up in a small town in Egypt, conquered Europe and became Liverpool star and one of the best players in the world.
ผมได้ทดสอบเล่นเว็บพนันออนไลน์เว็บตรง แล้ว ได้ทราบว่ามีแต่เกม สล็อตแตกง่าย แตกบ่อย ที่เปิดให้บริการเกมส์สล็อตเว็บใหม่ อย่างครบวงจร พร้อมบริการฝากถอนอัตโนมัติ เริ่ม 1 บาทก็ถอนได้ รองรับฝากเงินไม่มีขั้นต่ำ ถอนเงินไม่มีขั้นต่ำ เพิ่มความสะดวกสบายมากที่สุด ทำให้นักลงทุนสามารถเล่น pg slot
เว็บตรง จากต่างแดนได้ทุกวี่ทุกวัน บริการตลอด
1 วัน แล้วก็ยังมีสิทธิพิเศษมากไม่น้อยเลยทีเดียว ให้สมาชิกของเราได้เพลิดเพลินใจในโหมดต่างๆเรานับว่าเป็นแหล่งรวมเกมส์สมัคร คาสิโนออนไลน์
เปิดใหม่ ที่พร้อม
[u][b] Здравствуйте![/b][/u]
Купить диплом ВУЗа.
Мы предлагаем купить диплом отличного качества, неотличимый от оригинала без участия специалистов высокой квалификации со специальным оборудованием.
[b]Где купить диплом специалиста?[/b]
http://kome.maxbb.ru/viewtopic.php?f=22&t=2078&sid=1dafd47ce9661019233a7636a2325c15
[b]Удачи![/b]
ผมเพิ่งเริ่มพึงพอใจ แทงบอลออนไลน์ยังไง และก็ได้ทดลองเล่นกับเว็บไซต์ เว็บพนันบอล ถูกกฎหมาย มีตัวเลือกการเดิมพันเยอะมากๆแล้วก็อัตราต่อรองก็ดีด้วย ที่สำคัญคือการฝาก-ถอนรวดเร็วและง่ายมาก ผู้ใดที่กำลังมองหา
แทงบอลยังไง สล็อตเว็บใหม่แตกง่าย และข้อมูลดีๆนะครับ!
ผมว่าการเลือกเว็บแทงบอล คือ ที่มีโบนัสและก็โปรโมชั่นดีๆเป็นเรื่องสำคัญมาก ผมเองใช้ เว็บใหม่ แจกเครดิตฟรี 2024 มาสักพักแล้ว โบนัสต้อนรับและก็โปรโมชั่นคืนยอดเสียของเขาน่าดึงดูดมากครับ เห็นผลจริงๆแนะนำเลย!
Приветствую. Подскажите, где найти полезные статьи о недвижимости? Сейчас читаю https://metrazhi-omsk.ru
http://progressive-cars.ru/
Полезные советы и пошаговые инструкции по строительству https://syndyk.by, ремонту и дизайну домов и квартир, выбору материалов, монтажу и установке своими руками.
The inspiring story of how talented Kevin De Bruyne https://manchestercity.kevin-de-bruyne-cz.com became the best player of Manchester City and the Belgium national team. From humble origins to the leader of a top club.
Are There Any Costs Involved?
how does levitra work
Lionel Messi https://intermiami.lionel-messi-cz.com, one of the best football players of all time, moves to Inter Miami” and changes the face of North American football.
Bernardo Mota Veiga de Carvalho e Silva https://manchestercity.bernardo-silva-cz.com Portuguese footballer, club midfielder Manchester City and the Portuguese national team.
[u][b] Здравствуйте![/b][/u]
Мы предлагаем дипломы любой профессии по приятным тарифам.
Мы можем предложить документы техникумов, расположенных на территории всей Российской Федерации. Можно купить диплом от любого учебного заведения, за любой год, включая документы СССР. Дипломы и аттестаты печатаются на бумаге высшего качества. Это позволяет делать настоящие дипломы, которые не отличить от оригинала. Они заверяются всеми требуемыми печатями и штампами.
Гарантируем, что в случае проверки документов работодателем, подозрений не возникнет.
[b]Где заказать диплом специалиста?[/b]
[url=https://forexsnews.ru/byistryiy-start-kak-kupit-diplom-i-nachat-stroit-kareru]reflections.listbb.ru/viewtopic.php?f=45&t=661[/url]
[u][b] Здравствуйте![/b][/u]
Где купить диплом специалиста?
Мы можем предложить документы ВУЗов, расположенных в любом регионе РФ. Документы будут заверены всеми необходимыми печатями и подписями.
https://moskvic.actieforum.com/t3624-topic#6907
[b]Успешной учебы![/b]
wow mythic raid carry for sale [url=http://kreativwerkstatt-esens.de/]http://kreativwerkstatt-esens.de/[/url] .
Antoine Griezmann https://atlticomadrid-dhb.antoine-griezmann-cz.com Atletico Madrid star whose talent and decisive goals helped the club reach the top of La Liga and the UEFA Champions League.
Appreciate the recommendation. Will try it out.
амл проверка
AML-проверка: Посредством чего минимизировать приостановление ресурсов у криптовалютных бирж
Для чего важна антиотмывочные меры?
Проверка по борьбе с отмыванием денег (Борьба с отмыванием денег) – включает в себя совокупность процедур, предназначенных для предотвращения легализации средств. Подобная оценка способствует защищать электронные ресурсы участников избегая применение систем нелегальных операций. Проверка по борьбе с отмыванием денег важна в целях обеспечения защищенности ваших средств вместе с соблюдением нормативных норм.
Ключевые подходы верификации
Криптобиржи помимо прочего платежные сервисы внедряют разные главных способов в целях проверки пользователей:
Идентификация личности: Данный подход охватывает ключевые шаги по идентификации документов владельца, такие как анализ подтверждающих данных и адреса. KYC помогает удостовериться, что пользователь выступает в качестве легитимным.
Противодействие финансированию терроризма: Ориентирована с целью предотвращения обеспечения терроризма. Процедура контролирует подозрительные операции в случае необходимости приостанавливает профили в рамках проведения внутриорганизационной расследования.
Преимущества AML-проверки
AML-проверка обеспечивает криптовалютным биржам:
Следовать международные наряду с региональными нормативные нормы.
Сохранять клиентов недобросовестных действий.
Наращивать мера доверия от пользователей контролирующих структур.
Как обезопасить себя во время операций с криптовалютой
С целью снизить вероятности ограничения активов, следуйте этим указаниям:
Работайте с проверенные обменники: Прибегайте единственно к обменникам положительной востребованностью а также высоким степенью надежности.
Проверяйте контрагентов: Используйте решения для верификации с целью проверки криптоадресов получателей непосредственно перед осуществлением сделок.
Периодически обновляйте виртуальные счета: Данное действие позволит минимизировать гипотетических опасений, если Ваши контрагенты получатели будут включены под ограничения.
Обеспечивайте доказательства транзакций: Если наступит необходимости вы сможете доказать законность принятых активов.
Резюме
AML-проверка – выступает в качестве ключевой механизм в целях обеспечения сохранности операций в криптосфере. Эта практика способствует избежать обналичивание ресурсов, финансирование экстремистских группировок наряду с другими противоправные активности. Придерживаясь советам для обеспечения безопасности наряду с выбором надежные обменники, будете в состоянии минимизировать угрозы приостановления ресурсов работать защищенной функционированием с цифровой валютой.
[u][b] Привет![/b][/u]
Где заказать диплом специалиста?
Приобретение диплома ВУЗа РФ у нас является надежным делом, ведь документ [b]заносится в государственный реестр[/b]. Печать выполняется на специальных бланках ГОЗНАКа.
Вы приобретаете диплом [b]через надежную и проверенную временем фирму.[/b]
http://kome.maxbb.ru/viewtopic.php?f=22&t=2078&sid=1dafd47ce9661019233a7636a2325c15
[b]Успешной учебы![/b]
На сайте https://mosprorezka.ru/ уточните телефон мастера для того, чтобы воспользоваться такой важной и нужной услугой, как лазерная резка. Обратиться в компанию можно, независимо от сложности работы. При этом она обойдется по привлекательной стоимости. Постоянно в компании проходят акции, а потому вы сможете воспользоваться услугой, сэкономив на этом. Работа происходит без предоплаты, а потому это очень выгодно. Уточнить необходимую информацию вы сможете в любое время, потому как компания работает в круглосуточном режиме.
Common feedback from players includes requests for more in-game bonuses, additional multiplayer options, and
iron pump male enhancement
The story of Robert Lewandowski https://barcelona.robert-lewandowski-cz.com, his impressive journey from Poland to Barcelona, ??where he became not only a leader on the field, but also a source of inspiration for young players.
Son Heung-min’s https://tottenhamhotspur.son-heung-min-cz.com success story at Tottenham Hotspur and his influence on the South Korean football, youth inspiration and changing the perception of Asian players.
We explore the path of Luka Modric https://realmadrid.luka-modric-cz.com to Real Madrid, from a difficult adaptation to legendary Champions League triumphs and personal awards.
The impact of the arrival of Cristiano Ronaldo https://annasr.cristiano-ronaldo-cz.com at Al-Nasr. From sporting triumphs to cultural changes in Saudi football.
[u][b] Здравствуйте![/b][/u]
Приобрести документ о получении высшего образования можно у нас в Москве. Мы оказываем услуги по продаже документов об окончании любых университетов России. Вы получите диплом по любой специальности, включая документы старого образца. Даем 100% гарантию, что при проверке документов работодателями, подозрений не возникнет.
[b]Наши специалисты предлагают[/b] выгодно и быстро купить диплом, который выполняется на оригинальной бумаге и заверен мокрыми печатями, штампами, подписями официальных лиц. Диплом способен пройти лубую проверку, даже при помощи профессионального оборудования. Решайте свои задачи быстро и просто с нашими дипломами.
[b]Где заказать диплом специалиста?[/b]
http://users.atw.hu/sajprobaoldalam/modules.php?name=Journal&file=display&jid=46971
[b]Успешной учебы![/b]
Всем привет! Подскажите, где почитать разные статьи о недвижимости? Пока нашел https://mik-dom.ru
[u][b] Добрый день![/b][/u]
Для некоторых людей, приобрести [b]диплом[/b] о высшем образовании – это необходимость, удачный шанс получить достойную работу. Впрочем для кого-то – это понятное желание не терять огромное количество времени на учебу в институте. Что бы ни толкнуло вас на это решение, наша компания готова помочь. Оперативно, профессионально и выгодно изготовим документ любого года выпуска на настоящих бланках с реальными печатями.
[b]Наша компания предлагает[/b] выгодно и быстро купить диплом, который выполняется на оригинальном бланке и заверен печатями, штампами, подписями. Диплом способен пройти лубую проверку, даже при помощи профессионального оборудования. Решите свои задачи максимально быстро с нашей компанией.
[b]Где приобрести диплом специалиста?[/b]
https://smolensk.forum2x2.ru/t2367-topic#5980
[b]Успехов в учебе![/b]
Лизинг спецтехники для юридических лиц – это эффективный способ инвестировать в свою компанию. Условия договора лизинга, такие как срок и график платежей, обычно определяются индивидуально [url=http://spectehnikaleasing.ru/]взять в лизинг спецтехнику физическому лицу[/url]
The basic rule of the Aviator Game is straightforward: place a bet, watch the plane take off, and decide when to
levitra cost per pill
Заказать окна ПВХ Иркутск fod38.ru
Если Вы хотели найти [url=https://fod38.ru/]заказать пластиковые окна в иркутске[/url] – то переходите на указанный сайт. На сайте fod38.ru возможно записаться на бесплатный замер окон. Это самое верное решение, чтобы не тратить своё свободное время, ведь договор можно заключить прямо на дому. Замерщик даст ответы на все Ваши вопросы, покажет примеры и фотографии, учтет любые ваши пожелания и осуществит четкий замер с расценками.
[u][b] Добрый день![/b][/u]
Где приобрести диплом по нужной специальности?
[b]Купить документ[/b] о получении высшего образования вы сможете в нашей компании. Мы предлагаем документы об окончании любых ВУЗов России. Вы сможете получить диплом по любой специальности, включая документы Советского Союза. Гарантируем, что при проверке документов работодателями, никаких подозрений не появится.
http://splcash.com/article/privacy-policy?id=31
[b]Успешной учебы![/b]
History and Development
prolong power pills
Всем привет! Подскажите, где почитать разные статьи о недвижимости? Сейчас читаю https://miro-teh-ural.ru
find out here [url=https://avax-wallet.com/]ava coreа[/url]
Nicely put, Regards!
Here is my web blog … https://members.advisorist.com/question/loan-calculators-because-math-is-for-mortals-too-10/
сайт [url=https://xn—-jtbjfcbdfr0afji4m.xn--p1ai]электрик томск[/url]
пройдите регистрацию, пополните счет от 1000 рублей, https://unimitino.ru/images/pages/betvinner_promokod_pri_registracii___258825.html и ваш бонус зачислиться.
[url=https://bs2beast.cc/]Блэкспрут зеркало[/url] – Bs2site.at, Bs2site2.at
Netflix’s Best Movies in June 2024: A Rotten Tomatoes Guide batman the animated series episode list2004 movie releasesmovie theatre hibbing mnmovie theater moore
can also help in making informed cash-out decisions.
kamagra otc
Find out how Pedri https://barcelona.pedri-cz.com becomes a key figure for Barcelona – his development, influence and ambitions determine the club’s future success in world football.
Find out how Pedro Gavi https://barcelona.gavi-cz.com helped Barcelona achieve success thanks to his unique qualities, technique and leadership, becoming a key player in the team.
A study of the influence of Rodrigo https://realmadrid.rodrygo-cz.com on the success and marketing strategy of Real Madrid: analysis of technical skills, popularity in Media and commercial success.
Find out about Alisson https://liverpool.alisson-becker-cz.com‘s influence on Liverpool’s success, from his defense to personal achievements that made him one of the best goalkeepers in the world.
How Karim Benzema https://alIttihad.karim-benzema-cz.com changed the game of Al-Ittihad and Saudi football: new tactics, championship success, increased viewership and commercial success.
[u][b] Добрый день![/b][/u]
Где заказать диплом специалиста?
[b]Заказать документ[/b] университета вы можете у нас в Москве. Мы предлагаем документы об окончании любых ВУЗов Российской Федерации. Вы сможете получить диплом по любым специальностям, включая документы старого образца. Гарантируем, что в случае проверки документов работодателями, никаких подозрений не появится.
http://googlmap.blogspot.com/2014/06/blog-post_2402.html
[b]Хорошей учебы![/b]
[u][b] Здравствуйте![/b][/u]
Заказать диплом ВУЗа.
Наш сервис предлагает купить диплом в отличном качестве, который не отличить от оригинала без участия специалистов высокой квалификации с дорогим оборудованием.
[b]Где приобрести диплом специалиста?[/b]
https://vip.7bb.ru/viewtopic.php?id=2977#p7021
[b]Успехов в учебе![/b]
Now, they don’t have to get in touch with in sick or sneak out of the office to go on a job interview.
Also visit my web site … https://neurodivergencias.com/index.php?title=Why_Being_Thirsty_For_A_Host_Bar_Job_Might_Be_Your_Best_Career_Move
[u][b] Добрый день![/b][/u]
Где приобрести диплом по необходимой специальности?
[b]Мы можем предложить документы ВУЗов,[/b] расположенных на территории всей России. Можно приобрести качественно напечатанный диплом за любой год, включая сюда документы старого образца СССР. Документы печатаются на бумаге самого высокого качества. Это позволяет делать государственные дипломы, которые не отличить от оригинала. Они заверяются всеми требуемыми печатями и штампами.
[url=https://job.tltnews.ru/addres.php]telegra.ph/Pokupka-diploma-SHag-v-budushchee-bez-usilij-05-14[/url]
https://images.google.com.mt/url?q=https://subscribe.ru/author/25924851/group/records/?page=38
Зайдите на сайт https://moresliv.cc/ где вы сможете скачать огромное количество курсов бесплатно онлайн через торрент. Огромная база знаний и обучений. Складчины и видеоуроки, книги и вебинары – графика, программирование, бизнес, курсы блогеров и многое другое здесь. Более 175.000 различных курсов на сайте. Заходи!
Всем привет! Может кто знает, где почитать полезные статьи о недвижимости? Сейчас читаю https://mzhk-stroy.ru
additional reading [url=https://my-atomicwallet.de/]Atomic wallet[/url]
Эффективные способы расклеивания объявлений, Как заработать на расклейке объявлений, Топовые площадки для расклейки объявлений, Как добиться результата с помощью расклейки объявлений, расклейка объявлений как вид заработка, Техники мастеров расклейки объявлений
расклейка объявлений москва [url=https://расклейка-объявлений77.рф/]https://расклейка-объявлений77.рф/[/url] .
Bonuses: Online casinos often offer bonuses and promotions, enhancing the gaming experience.
penis enlargement pills
Эффективные способы расклеивания объявлений, Как заработать на расклейке объявлений, инструкция по расклейке объявлений, Как привлечь внимание с помощью правильной расклейки объявлений, Бизнес на расклейке объявлений, Техники мастеров расклейки объявлений
расклейка объявлений [url=https://расклейка-объявлений77.рф/]https://расклейка-объявлений77.рф/[/url] .
Nicely put. With thanks.
Also visit my web page … https://nivanda.com/index.php?page=item&id=10425
Купить окна ПВХ в Иркутске fod38.ru
Если Вы хотели найти [url=https://fod38.ru/]пластиковые окна иркутск[/url] – то переходите на наш сайт. На сайте fod38.ru можно записаться на бесплатный замер будущих окон. Это лучшее решение, чтобы не терять своё личное время, ведь договор можно заключить прямо на дому. Замерщик ответит на любые Ваши вопросы, покажет образцы и каталоги, примет к сведению любые ваши желания и сделает четкий замер с ценой.
Купить машины в лизинг от официальных дилеров, автосалонов. Выгодные условия и скидки [url=http://autopodbor-yaroslavl.ru/]лизинг для ип грузового автотранспорта[/url]
[b]Привет Друзья[/b]!
Всегда думал что купить диплом о высшем образовании это миф и нереально, но все оказалось не так, изначально искал информацию про: купить диплом в мурманске, купить диплом инженера, купить диплом инженера, купить диплом в зеленодольске, купить аттестат за 9 классов, потом про дипломы вузов, подробнее здесь http://prazdnikbaby.ru/index.php/separator?view=item&item_id=10
Оказалось все возможно, официально со специальными условия по упрощенным программам, так и сделал и теперь у меня есть диплом вуза Москвы нового образца, что советую и вам!
Успехов в учебе!
[u][b] Привет, друзья![/b][/u]
Где заказать диплом по нужной специальности?
Купить диплом ВУЗа.
[b]Цена значительно меньше[/b] нежели потребовалось бы заплатить на очном обучении в университете
https://xn--80asucf0d.xn--j1al4b.xn--p1ai/index.php/component/k2/itemlist/user/127178
[b]Успехов в учебе![/b]
improvements have not only made the game more appealing but also more accessible to a wider audience.
kamagra otc
I’m really impressed with your writing skills and also with the layout on your blog.
Is this a paid theme or did you customize it yourself?
Anyway keep up the nice quality writing, it is rare to see a nice blog like
this one nowadays.
Приветствую. Подскажите, где найти полезные блоги о недвижимости? Сейчас читаю https://nagaevodom.ru
[u][b] Добрый день![/b][/u]
Где купить диплом специалиста?
[b]Мы готовы предложить документы техникумов,[/b] расположенных в любом регионе РФ. Вы имеете возможность приобрести диплом от любого заведения, за любой год, указав необходимую специальность и оценки за все дисциплины. Документы выпускаются на “правильной” бумаге самого высшего качества. Это позволяет делать настоящие дипломы, которые невозможно отличить от оригиналов. Они будут заверены необходимыми печатями и штампами.
[url=http://ruyanamerica.com/News/News.cfm?NewsID=1003]ruyanamerica.com/News/News.cfm?NewsID=1003[/url]
https://nudifyai.net
На сайте https://autoclub78.ru вы найдете интересные, практичные советы для тех, у кого есть автомобиль. Имеются практические рекомендации, ценные советы, которые помогут найти оптимальный вариант для того, чтобы правильно эксплуатировать технику. Статьи ответят на многочисленные вопросы, подскажут, как правильно действовать в определенной ситуации. Есть информация про самые востребованные мотоциклы, а также запчасти, которые реализуются на маркетплейсах. Есть информация и про то, как не стоит приобретать стеклоомывающую жидкость.
Awesome info. Cheers.
With havin so much written content do you ever run into any problems
of plagorism or copyright infringement? My blog has a lot of unique content I’ve either created myself or outsourced but it appears
a lot of it is popping it up all over the web without my
authorization. Do you know any methods to help reduce content from being ripped off?
I’d truly appreciate it.
Also visit my website :: look at this website
Наш сайт предлагает вам полную информацию на такие темы, как [url=https://xn—-stbkav.xn--p1ai/]услуги риэлтора[/url] или [url=https://xn—-stbkav.xn--p1ai/]кадастровая стоимость объекта недвижимости[/url].
Посетите наш сайт и начните свой путь к новому жилью уже сегодня!
A single ticket was bought at a Publix in Neptune Beach, Florida, for the Aug. eight, 2023, drawing.
Also visit my web site; https://wikigenuine.org/index.php/Dive_Into_The_Zippy_World_Of_Speed_Keno:_Luck_At_Lightning_Speed
r7 casino вход r7 casino онлайн
The basic rule of the Aviator Game is straightforward: place a bet, watch the plane take off, and decide when to
iron pump for ed
[u][b] Привет![/b][/u]
Мы изготавливаем дипломы любых профессий по доступным ценам.
Мы предлагаем документы ВУЗов, которые расположены в любом регионе Российской Федерации. Вы сможете заказать качественно напечатанный диплом за любой год, включая сюда документы старого образца СССР. Документы выпускаются на бумаге самого высшего качества. Это дает возможности делать государственные дипломы, которые невозможно отличить от оригинала. Документы заверяются всеми обязательными печатями и подписями.
[b]Где приобрести диплом по нужной специальности?[/b]
[url=http://medhansh.net/blog/category/traffic-violations/]medhansh.net/blog/category/traffic-violations/[/url]
buy instagram followers cheap buy instagram followers
Thibaut Courtois https://realmadrid.thibaut-courtois-cz.com the indispensable goalkeeper of “Real”, whose reliability, leadership and outstanding The game made him a key figure in the club.
Find out how Virgil van Dijk https://liverpool.virgil-van-dijk-cz.com became an integral part of style игры «Liverpool», ensuring the stability and success of the team.
Great post. I am going through many of these issues as well..
The organization was also indicted for moving funds from overseas to spend winnings to gamblers in the United States.
Here is my homepage :: http://bountifulharvestproduce.net/__media__/js/netsoltrademark.php?d=wiki.xmoonproductions.org%2Fapi.php%3Faction%3Dhttps%3A%2F%2F1-news.net%2F
Find out how Bruno Guimaraes https://newcastleunited.bruno-guimaraes-cz.com became a catalyst for the success of Newcastle United thanks to his technical abilities and leadership on the field and beyond.
Всем привет! Подскажите, где найти разные блоги о недвижимости? Пока нашел https://potolkinomer1.ru
Very good information, Regards.
[u][b] Привет![/b][/u]
Где купить диплом по актуальной специальности?
Мы готовы предложить документы техникумов, которые находятся в любом регионе России. Они будут заверены всеми необходимыми печатями и штампами.
https://ilovebookmark.com/story17253146/%D0%BF%D0%BE%D0%BB%D1%83%D1%87%D0%B8%D0%BB%D0%B8-%D0%B4%D0%B8%D0%BF%D0%BB%D0%BE%D0%BC-%D0%BA%D0%B0%D1%80%D1%82%D0%B8%D0%BD%D0%BA%D0%B8
[b]Успешной учебы![/b]
Found an enthralling read that I’d recommend – it’s truly fascinating http://biketrials.ru/live/blog.php?b=9112
[u][b] Привет, друзья![/b][/u]
Где заказать диплом специалиста?
[b]Приобрести документ[/b] о получении высшего образования можно у нас в Москве. Мы оказываем услуги по производству и продаже документов об окончании любых ВУЗов РФ. Вы получите диплом по любым специальностям, включая документы СССР. Даем 100% гарантию, что в случае проверки документов работодателем, подозрений не появится.
http://ahfc.org/beach-soccer/switzerland/
[b]Успешной учебы![/b]
Unique Features of the Aviator Game
cost of levitra
[b]Привет всем[/b])
Студенческая жизнь прекрасна, пока не приходит время писать диплом, как это случилось со мной. Не стоит отчаиваться, ведь существуют компании, которые помогают с написанием и защитой диплома на высокие оценки!
Сначала я искал информацию по теме: куплю диплом с занесением, купить диплом в новоалтайске, купить диплом с реестром, купить диплом в владикавказе, купить диплом архитектора, а потом наткнулся на http://school5.p-fam.ru/users/yvabix, где все мои учебные проблемы были решены!
Успехов в учебе!
Connect Wallet Import Wallet Connect Hardware
Here is my page; https://base-dawgz.io/
Write more, thats all I have to say. Literally, it seems
as though you relied on the video to make your point.
You clearly know what youre talking about, why waste your intelligence on just posting videos to your blog
when you could be giving us something enlightening to read?
Study of the playing style of Toni Kroos https://real-madrid.toni-kroos-cz.com at Real Madrid: his accurate passing, tactical flexibility and influence on the team’s success.
I got this web page from my pal who told me about this web page and now this
time I am visiting this website and reading very informative content at
this place.
The young Uruguayan Darwin Nunez https://liverpool.darwin-nunez-cz.com broke into the elite of world football, and he became a key Liverpool player.
Romelu Lukaku https://chelsea.romelu-lukaku-cz.com, one of the best strikers in Europe, returns to Chelsea to continue climbing to the top of the football Olympus.
проверить сайт
[url=https://xbomax.ru/85-rycari-gotjema.html]Рыцари Готэма 2023 1 сезон 1-13 серия смотреть онлайн в хорошем качестве[/url]
A fascinating story about how David Alaba https://realmadrid.david-alaba-cz.com after starting his career at the Austrian academy Vienna became a key player and leader of the legendary Real Madrid.
Star Brazilian striker Gabriel Jesus https://arsenal.gabriel-jesus-cz.com put in a superb performance to lead Arsenal to new heights after moving from Manchester City.
Всем привет! Устали от отказов и долгих проверок? Заходите к нам в канал – здесь вы найдете подборку [url=https://t.me/s/mfo_bez_otkaza_vsem]МФО[/url], которые дают займы без лишних вопросов и с минимальными требованиями. Мы каждый день обновляем список, чтобы вы могли выбрать самое выгодное предложение. Быстрые займы, удобные условия и никаких скрытых комиссий – все это ждет вас у нас. Присоединяйтесь!
эскорт агентство москва
All recipients of similar building materials recognize and agree with statement, what they must conduct and conducted their own thorough investigation and did relied on {which|where|to any statements made by zerocap, its officials, or.
my web page :: https://tether-alloy.com/
Для тех, кто ищет увлекательные пути к развлечениям и возможности испытать удачу в виртуальной среде, существует мир, где представлены бесчисленные варианты игр и азартных развлечений [url=http://blackpearlbasketball.com.au/index.php?option=com_k2&view=itemlist&task=user&id=849165]http://blackpearlbasketball.com.au/index.php?option=com_k2&view=itemlist&task=user&id=849165[/url]
The remaining tokens will directed at marketing, developing games, and securing rewards, https://https://spongetokenvip.io// will complete a comprehensive distribution plan.
winnings.
when to take levitra
элитный эскорт москва
[u][b] Привет![/b][/u]
Купить документ о получении высшего образования вы имеете возможность в нашей компании в столице. Мы оказываем услуги по продаже документов об окончании любых ВУЗов РФ. Вы сможете получить диплом по любой специальности, любого года выпуска, включая документы старого образца. Гарантируем, что в случае проверки документов работодателями, подозрений не появится.
[b]Мы предлагаем[/b] выгодно заказать диплом, который выполнен на оригинальном бланке и заверен мокрыми печатями, водяными знаками, подписями. Документ способен пройти лубую проверку, даже при помощи специальных приборов. Достигайте свои цели быстро и просто с нашими дипломами.
[b]Где приобрести диплом по актуальной специальности?[/b]
http://portstanc.ru/index.php/blog/visshee.html
[b]Успешной учебы![/b]
Приветствую. Подскажите, где почитать разные статьи о недвижимости? Сейчас читаю https://promresmag.ru
[u][b] Привет, друзья![/b][/u]
Для некоторых людей, купить [b]диплом[/b] о высшем образовании – это острая необходимость, шанс получить достойную работу. Впрочем для кого-то – это осмысленное желание не терять время на учебу в ВУЗе. Что бы ни толкнуло вас на такое решение, наша компания готова помочь вам. Максимально быстро, качественно и недорого изготовим документ любого года выпуска на подлинных бланках с реальными печатями.
[b]Наша компания предлагает[/b] быстро и выгодно заказать диплом, который выполняется на оригинальной бумаге и заверен печатями, штампами, подписями. Данный документ пройдет любые проверки, даже с применением профессионального оборудования. Достигайте цели быстро и просто с нашим сервисом.
[b]Где заказать диплом по необходимой специальности?[/b]
https://1abakan.ru/forum/showthread-52581/
[b]Хорошей учебы![/b]
Indeed had the highest number of fake postings, with 32% of fraudulent listings
coming from the nternet site.
My blog post 패턴
[u][b] Здравствуйте![/b][/u]
Где заказать диплом специалиста?
Мы можем предложить документы институтов, расположенных на территории всей России. Вы имеете возможность приобрести качественно сделанный диплом от любого ВУЗа, за любой год, указав необходимую специальность и хорошие оценки за все дисциплины. Дипломы печатаются на бумаге самого высшего качества. Это позволяет делать настоящие дипломы, которые не отличить от оригиналов. Они будут заверены всеми требуемыми печатями и штампами.
[b]Мы изготавливаем дипломы[/b] любой профессии по невысоким ценам.
[url=http://diplomyx.com]diplomyx.com[/url]
[u][b] Рады оказать помощь![u][b]
Call to Action for Players
iron pump ed pills
Реализуя широкий ассортимент оборудования и медицинской техники, мы удовлетворяем запросы врачей различных профилей, косметологов и административного персонала [url=https://mamamia.by/forum/viewtopic.php?t=5678]https://mamamia.by/forum/viewtopic.php?t=5678[/url]
Приветствую. Подскажите, где почитать разные статьи о недвижимости? Пока нашел https://santech31.ru
What’s up all, here every one is sharing these knowledge, so
it’s pleasant to read this blog, and I used to go
to see this web site every day.
[url=https://t.me/ozempic_kupit_prodaja/]mounjaro buy[/url] – оземпик купить +в ростове, тирзепатид купить +в москве
The fascinating story of Antonio Rudiger’s transfer https://real-madrid.antonio-rudiger-cz.com to Real Madrid and his rapid rise as a key player at one of the best clubs in the world.
The story of how the incredibly talented footballer Riyad Mahrez https://alahli.riyad-mahrez-cz.com reached new heights in career, moving to Al Ahly and leading the team to victory.
The fascinating story of Marcus Rashford’s ascent https://manchester-united.marcus-rashford-cz.com to glory in the Red Devils: from a young talent to one of the key players of the team.
look at this site
[url=https://rrr-shop.com/eft]The best EFT cheat[/url]
[url=https://hyip-zanoza.com/vote-hyips]работающие хайп проекты[/url] – работающие хайп проекты, хайп инвестиции
[b]Здравствуйте[/b]!
Задался вопросом: можно ли на самом деле купить диплом государственного образца в Москве? Был приятно удивлен — это реально и легально!
Сначала искал информацию в интернете на тему: купить свидетельство о рождении ссср, купить диплом в новороссийске, купить диплом в нижнекамске, купить диплом строителя , купить диплом нового образца и получил базовые знания. В итоге остановился на материале: https://vk.com/prymechatel?w=wall-147947644_398
Успешной учебы!
I am really impressed along with your writing talents as neatly as with the
layout to your blog. Is this a paid subject or did you
customize it yourself? Either way stay up the excellent quality writing,
it is uncommon to see a great weblog like this one today..
Всем привет! Может кто знает, где почитать полезные блоги о недвижимости? Сейчас читаю https://santex-expert.ru
here [url=https://www.yotta.host/]VPS[/url]
Pounder, 52, was reentering the workforce just after taking some time off and promoting her home in Wyoming.
Also visit my website http://razrabotki.com.ua/obmen-dannymi/96-perekhod-s-1s-7-7-na-1s-8-x
[url=https://gmgo.ru/articles/knigi-poxozie-na-vlastelin-kolec-lucsie-proizvedeniya-v-zanre-fentezi]Книги похожие на Властелин колец[/url] – Скачать видео из тик ток без водяного знака, Как скачать все свои фото из инстаграма
Try to make a fascinating actor Johnny Depp https://secret-window.johnny-depp.cz, who will become the slave of his strong hero Moudriho Creeps in the thriller “Secret Window”.
Fascinating event related to this Keanu Reeves helped him in the role of the iconic John Wick characters https://john-wick.keanu-reeves.cz, among which there is another talent who has combat smarts with inappropriate charisma.
Jackie Chan https://peakhour.jackie-chan.cz from a poor boy from Hong Kong to a world famous Hollywood stuntman. The incredible success story of Jackie Chan.
Follow Liam Neeson’s career https://hostage.liam-neeson.cz as he fulfills his potential as Brian Mills in the film “Taken” and becomes one of the leading stars of Hollywood action films.
Emily Olivia Laura Blunt https://oppenheimer.emily-blunt.cz British and American actress. Winner of the Golden Globe (2007) and Screen Actors Guild (2019) awards.
http://maps.google.no/url?q=https://subscribe.ru/author/25924851/group/records/?page=37
[b]Привет всем[/b])
Хорошо быть студентом, пока не придет пора писать диплом, что и произошло со мной, но не стоит отчаиваться, ведь есть хорошие компании что помогают с написанием и сдачей диплома на хорошие оценки!
Изначально искал информацию про купить диплом мастера маникюра и педикюра, купить диплом в новоуральске, купить диплом математика, купить диплом биолога, купить диплом в южно-сахалинске, потом попал на http://cobaki.ru/users.php?m=details&id=89651 и там решили все мои учебные заботы!
Хорошей учебы!
this post [url=https://crazy-pachinko.com/]crazy pachinko game[/url]
[url=https://narofomed.ru/about-clinic]главврач центр[/url] – сдать анализы на паразитов, ожирение сдать анализы
Лизинг оборудования открывает новые возможности для развития вашей компании. Это одно из наиболее эффективных финансовых решений для модернизации производственных мощностей и оптимизации работы предприятия [url=https://ofkleasing.ru/]лизинг оборудования для малого бизнеса[/url]
Wow all kinds of terrific tips!
Приветствую. Подскажите, где найти полезные блоги о недвижимости? Сейчас читаю https://schuconvr.ru
Сайт предлагает широкий выбор лизинговых продуктов для бизнеса, включая лизинг оборудования. Благодаря этому, компании могут получить доступ к современному оборудованию без необходимости его покупки за наличные [url=http://vrn.best-city.ru/forum/thread540103166/]http://vrn.best-city.ru/forum/thread540103166/[/url]
Всем привет! Ищете, где можно взять займ без отказа? Наш канал поможет вам найти лучшие [url=https://t.me/s/mfo_bez_otkaza_vsem]МФО[/url]. Мы регулярно обновляем информацию и делимся только проверенными предложениями. Быстрые займы, низкие проценты и никаких скрытых условий. Подписывайтесь, чтобы не пропустить самые выгодные варианты. Легко, просто и надежно – это наш девиз!
Hi there, i read your blog occasionally and i own a similar one and i was
just wondering if you get a lot of spam remarks?
If so how do you reduce it, any plugin or anything you can suggest?
I get so much lately it’s driving me mad so any support is very much appreciated.
[url=https://telegra.ph/Dostavka-tovarov-iz-SSHA-v-Rossiyu-07-08]https://telegra.ph/Dostavka-tovarov-iz-SSHA-v-Rossiyu-07-08[/url] доставка товаров из сша.
доставка товаров из сша в россию [url=https://telegra.ph/Dostavka-tovarov-iz-SSHA-v-Rossiyu-07-08]https://telegra.ph/Dostavka-tovarov-iz-SSHA-v-Rossiyu-07-08[/url] .
посредники по доставке из сша [url=https://telegra.ph/Dostavka-tovarov-iz-SSHA-v-Rossiyu-07-08]https://telegra.ph/Dostavka-tovarov-iz-SSHA-v-Rossiyu-07-08[/url] .
посредники по доставке из сша в россию [url=https://telegra.ph/Dostavka-tovarov-iz-SSHA-v-Rossiyu-07-08]https://telegra.ph/Dostavka-tovarov-iz-SSHA-v-Rossiyu-07-08[/url] .
[url=https://telegra.ph/Dostavka-tovarov-iz-SSHA-v-Rossiyu-07-08]https://telegra.ph/Dostavka-tovarov-iz-SSHA-v-Rossiyu-07-08[/url] мейлфорвадеры доставка из сша.
[url=https://telegra.ph/Dostavka-tovarov-iz-SSHA-v-Rossiyu-07-08]https://telegra.ph/Dostavka-tovarov-iz-SSHA-v-Rossiyu-07-08[/url] мейлфорвадеры доставка из сша в россию.
[url=https://telegra.ph/Dostavka-tovarov-iz-SSHA-v-Rossiyu-07-08]https://telegra.ph/Dostavka-tovarov-iz-SSHA-v-Rossiyu-07-08[/url] доставка посылок из сша.
доставка посылок из сша в россию [url=https://telegra.ph/Dostavka-tovarov-iz-SSHA-v-Rossiyu-07-08]https://telegra.ph/Dostavka-tovarov-iz-SSHA-v-Rossiyu-07-08[/url] .
доставка посылок из америки [url=https://telegra.ph/Dostavka-tovarov-iz-SSHA-v-Rossiyu-07-08]https://telegra.ph/Dostavka-tovarov-iz-SSHA-v-Rossiyu-07-08[/url] .
доставка товаров из америки [url=https://telegra.ph/Dostavka-tovarov-iz-SSHA-v-Rossiyu-07-08]https://telegra.ph/Dostavka-tovarov-iz-SSHA-v-Rossiyu-07-08[/url]
доставка товаров из америки в россию [url=https://telegra.ph/Dostavka-tovarov-iz-SSHA-v-Rossiyu-07-08]https://telegra.ph/Dostavka-tovarov-iz-SSHA-v-Rossiyu-07-08[/url]
[url=https://rrr-shop.com/pubg]приватный чит[/url] – ундетект чит Dayz, приватный чит
The inspiring story of Zendaya’s rise https://spider-man.zendaya-maree.cz, from her early roles to her blockbuster debut in Marvel Cinematic Universe.
The inspiring story of the ascent of the young actress Anya Taylor https://queensmove.anya-taylor-joy.cz to fame after her breakthrough performance in the TV series “The Queen’s Move”. Conquering new peaks.
An indomitable spirit, incredible skills and five championships – how Kobe Bryant https://losangeles-lakers.kobe-bryant.cz became an icon of the Los Angeles Lakers and the entire NBA world.
Witness the thrilling story of Jiri Prochazka’s https://ufc.jiri-prochazka-ufc.cz rapid rise to the top of the UFC’s light heavyweight division, marked by his dynamic fighting style and relentless determination.
Carlos Vemola https://oktagon-mma.karlos-vemola.cz Czech professional mixed martial artist, former bodybuilder, wrestler and member Sokol.
Приветствую. Подскажите, где почитать разные блоги о недвижимости? Пока нашел https://simposad.ru
Good post however I was wanting to know if you could write a litte more on this topic?
I’d be very thankful if you could elaborate a little bit further.
Kudos!
Преимуществами покупки оборудования в лизинг для юридических лиц можно считать: Низкие затраты на получение оборудования в пользование [url=https://chuvashagrolizing.ru/]пищевое оборудование в лизинг[/url]
[u][b] Здравствуйте![/b][/u]
Купить диплом о высшем образовании.
Наш сервис предлагает приобрести диплом в высоком качестве, неотличимый от оригинального документа без участия специалиста высокой квалификации со сложным оборудованием.
[b]Где купить диплом специалиста?[/b]
http://fizteh.getbb.ru/posting.php?mode=post&f=43&sid=10a665682528be45c1b20025987b857a
[b]Хорошей учебы![/b]
Jon Jones https://ufc.jon-jones.cz a dominant fighter with unrivaled skill, technique and physique who has conquered the light heavyweight division.
Young Briton Lando Norris https://mclaren.lando-norris.cz is at the heart of McLaren’s Formula 1 renaissance, regularly achieving podium finishes and winning.
An article about the triumphant 2023 Ferrari https://ferrari.charles-leclerc.cz and their star driver Charles Leclerc, who became the Formula world champion 1.
外送茶
外送茶是什麼?禁忌、價格、茶妹等級、術語等..老司機告訴你!
外送茶是什麼?
外送茶、外約、叫小姐是一樣的東西。簡單來說就是在通訊軟體與茶莊聯絡,選好自己喜歡的妹子後,茶莊會像送飲料這樣把妹子派送到您指定的汽車旅館、酒店、飯店等交易地點。您只需要在您指定的地點等待,妹妹到達後,就可以開心的開始一場美麗的約會。
外送茶種類
學生兼職的稱為清新書香茶
日本女孩稱為清涼綠茶
俄羅斯女孩被稱為金酥麻茶
韓國女孩稱為超細滑人參茶
外送茶價格
外送茶的客戶相當廣泛,包括中小企業主、自營商、醫生和各行業的精英,像是工程師等等。在台北和新北地區,他們的消費指數大約在 7000 到 10000 元之間,而在中南部則通常在 4000 到 8000 元之間。
對於一般上班族和藍領階層的客人來說,建議可以考慮稍微低消一點,比如在北部約 6000 元左右,中南部約 4000 元左右。這個價位的茶妹大多是新手兼職,但有潛力。
不同地區的客人可以根據自己的經濟能力和喜好選擇適合自己的價位範圍,以免感到不滿意。物價上漲是一個普遍現象,受到地區和經濟情況等因素的影響,茶莊的成本也在上升,因此價格調整是合理的。
外送茶外約流程
加入LINE:加入外送茶官方LINE,客服隨時為你服務。茶莊一般在中午 12 點到凌晨 3 點營業。
告知所在地區:聯絡客服後,告訴他們約會地點,他們會幫你快速找到附近的茶妹。
溝通閒聊:有任何約妹問題或需要查看妹妹資訊,都能得到詳盡的幫助。
提供預算:告訴客服你的預算,他們會找到最適合你的茶妹。
提早預約:提早預約比較好配合你的空檔時間,也不用怕到時候約不到你想要的茶妹。
外送茶術語
喝茶術語就像是進入茶道的第一步,就像是蓋房子打地基一樣。在這裡,我們將這些外送茶入門術語分類,讓大家能夠清楚地理解,讓喝茶變得更加容易上手。
魚:指的自行接客的小姐,不屬於任何茶莊。
茶:就是指「小姐」的意思,由茶莊安排接客。
定點茶:指由茶莊提供地點,客人再前往指定地點與小姐交易。
外送茶:指的是到小姐到客人指定地點接客。
個工:指的是有專屬工作室自己接客的小姐。
GTO:指雞頭也就是飯店大姊三七茶莊的意思。
摳客妹:只負責找客人請茶莊或代調找美眉。
內機:盤商應召站提供茶園的人。
經紀人:幫內機找美眉的人。
馬伕:外送茶司機又稱教練。
代調:收取固定代調費用的人(只針對同業)。
阿六茶:中國籍女子,賣春的大陸妹。
熱茶、熟茶:年齡比較大、年長、熟女級賣春者(或稱阿姨)。
燙口 / 高溫茶:賣春者年齡過高。
台茶:從事此職業的台灣小姐。
本妹:從事此職業的日本籍小姐。
金絲貓:西方國家的小姐(歐美的、金髮碧眼的那種)。
青茶、青魚:20 歲以下的賣春者。
乳牛:胸部很大的小姐(D 罩杯以上)。
龍、小叮噹、小叮鈴:體型比較肥、胖、臃腫、大隻的小姐。
The legendary Spanish racer Fernando Alonso https://formula-1.fernando-alonso.cz returns to Formula 1 after several years.
[b]Здравствуйте[/b]!
Хочу поделиться своим опытом по заказу аттестата ПТУ. Думал, что это невозможно, и начал искать информацию в интернете по теме: купить диплом в норильске, купить диплом в березниках, купить диплом института, купить диплом в новотроицке, купить диплом электромонтера. Постепенно углубляясь, нашел отличный ресурс здесь: https://kbrg.ru/club/user/282/blog/?b24statAction=addLogEntry, и остался очень доволен!
Теперь у меня есть диплом сварщика о среднем специальном образовании, и я обеспечен на всю жизнь!
Успехов в учебе!
[u][b] Привет, друзья![/b][/u]
Где приобрести диплом специалиста?
[b]Купить документ[/b] университета можно у нас в столице. Мы предлагаем документы об окончании любых университетов России. Вы сможете получить необходимый диплом по любой специальности, включая документы СССР. Гарантируем, что при проверке документа работодателями, подозрений не появится.
https://overfun.ru/index.php?/topic/143-%D0%BA%D1%83%D0%BF%D0%B8%D1%82%D1%8C-%D0%B0%D1%82%D1%82%D0%B5%D1%81%D1%82%D0%B0%D1%82%D1%8B-%D0%B7%D0%B0-9-%D0%BA%D0%BB%D0%B0%D1%81%D1%81-%D1%86%D0%B5%D0%BD%D0%B0-h950n/
[b]Удачи![/b]
Activision and Call of Duty https://activision.call-of-duty.cz leading video game publisher and iconic shooter with a long history market dominance.
Всем привет! Может кто знает, где почитать разные статьи о недвижимости? Сейчас читаю https://smgarant.ru
[url=https://avanta-avto-credit.ru/]chery tiggo 8 max[/url] – geely coolray 2023 купить, geely monjaro в россии
це відкриває резерви для видавців не тільки спокусити ширшу аудиторію книгою, https://ukrtecho.com/articles/shho-mozhna-zrobiti-z-klejovim-pistoletom-okrim-virobiv/ окрім виробів?
Hi there! I could have sworn I’ve been to this site before but after reading through some
of the post I realized it’s new to me. Anyways, I’m definitely glad I found
it and I’ll be book-marking and checking back frequently!
[u][b] Привет, друзья![/b][/u]
Мы можем предложить дипломы любых профессий по приятным тарифам.
Мы готовы предложить документы ВУЗов, расположенных в любом регионе Российской Федерации. Можно заказать качественный диплом за любой год, указав подходящую специальность и хорошие оценки за все дисциплины. Дипломы и аттестаты делаются на бумаге высшего качества. Это дает возможности делать настоящие дипломы, которые невозможно отличить от оригиналов. Они заверяются всеми необходимыми печатями и подписями.
Гарантируем, что при проверке документа работодателями, подозрений не появится.
[b]Где приобрести диплом специалиста?[/b]
[url=http://woman.build2.ru/viewtopic.php?id=12279#p39922]worldgonews.ru/legalnyie-diplomyi-o-vyisshem-obrazovanii-v-moskve-proverennoe-kachestvo[/url]
Hmm it looks like your website ate my first comment (it was
super long) so I guess I’ll just sum it up what
I had written and say, I’m thoroughly enjoying
your blog. I as well am an aspiring blog writer but I’m still new to everything.
Do you have any suggestions for novice blog writers? I’d really appreciate it.
wow raid carry group [url=https://kreativwerkstatt-esens.de/]https://kreativwerkstatt-esens.de/[/url] .
[u][b] Добрый день![/b][/u]
Где заказать диплом специалиста?
Покупка диплома ВУЗа РФ в нашей компании является надежным делом, поскольку документ [b]будет заноситься в реестр[/b]. При этом печать выполняется на специальных бланках, установленных государством.
Вы приобретаете диплом [b]в надежной и проверенной компании.[/b]
https://malispa.ru/users/122
[b]Успехов в учебе![/b]
This paragraph will assist the internet viewers for building up new blog or even a weblog from start to end.
[b]Здравствуйте[/b]!
Хочу рассказать о своем опыте по заказу аттестата пту, думал это не реально и стал искать информацию в сети, про купить диплом в мурманске, купить диплом в москве, купить диплом гознак, купить диплом врача, купить аттестат за 9 класс, постепенно вникая в суть дела нашел отличный материал здесь http://www.pets-ural.ru/content/forum//viewtopic.php?p=63885#63885 и был очень доволен!
Теперь у меня есть диплом столяра о среднем специальном образовании, и я обеспечен на всю жизнь)
Хорошей учебы!
[u][b] Привет, друзья![/b][/u]
Мы предлагаем дипломы психологов, юристов, экономистов и любых других профессий по доступным ценам. Цена будет зависеть от выбранной специальности, года получения и образовательного учреждения.
Где заказать диплом по нужной специальности?
[b]Купить диплом о высшем образовании[/b]
https://landik-diploms-srednee.ru/kupit-diplom-sssr
[b]Успешной учебы![/b]
bigova real estate in Montenegro for sale
[url=https://feel-easy.games/catalog/canva]canva pro for free[/url] – genshin impact mods, filmora 12 crack
Free movies https://www.moviesjoy.cc and TV streaming online, watch movies online in HD 1080p.
the most popular sports website https://sports-forecasts.com in the Arab world with the latest sports news, predictions and analysis in real time.
Latest news and analysis of the English Premier League https://epl-ar.com. Detailed descriptions of matches, team statistics and the most interesting football events.
Latest Diablo news https://diablo-ar.com, detailed game descriptions and guides. Diablo.az – The largest Diablo information portal in Arabic.
Hi there! Do you use Twitter? I’d like to follow you if that would be ok.
I’m definitely enjoying your blog and look forward to new posts.
Дизайнерские новогодние подарки и коробка для бижутерии оптом.
https://giftbox-3.ru/
Приветствую. Подскажите, где найти разные статьи о недвижимости? Сейчас читаю https://stilnyjpol.ru
Hi excellent blog! Does running a blog like this require a large amount of work?
I have no knowledge of programming but I was hoping to start my own blog soon.
Anyhow, should you have any recommendations or techniques for new blog owners please share.
I know this is off topic however I just needed to ask.
Kudos!
Discovered a unique article – recommended to acquaint yourself! http://shoptema.ru/forum/topic/32671/
https://subscribe.ru/author/25924851/group/records/?page=36
Latest World of Warcraft tournament news https://ar-wow.com (WOW), strategies and game analysis. The most detailed gaming portal in Arabic.
[u][b] Здравствуйте![/b][/u]
Где купить диплом по необходимой специальности?
[b]Заказать документ[/b] университета можно в нашем сервисе. Мы оказываем услуги по продаже документов об окончании любых университетов РФ. Вы получите диплом по любым специальностям, включая документы Советского Союза. Гарантируем, что при проверке документов работодателями, каких-либо подозрений не возникнет.
http://borderforum.ru/topic8751.html
[b]Успехов в учебе![/b]
NFL https://nfl-ar.com News, analysis and topics about the latest practices, victories and records. A portal that explores the most beautiful games in the NFL world in general.
Discover exciting virtual football https://fortnite-ar.com in Fortnite. Your central hub for the latest news, expert strategy and exciting eSports reporting.
The latest analysis, reviews of https://spider-man-ar.com tournaments and the most interesting things from the “Spider-Man” series of games in Azerbaijani language. It’s all here!
Hello friends, its great article concerning teachingand completely defined, keep it up all the time.
pin up casino online
Latest Counter-Strike 2 news https://counter-strike-ar.com, watch the most successful tournaments and be the best in the gaming world on CS2 ar.
Всем привет! Подскажите, где почитать полезные блоги о недвижимости? Пока нашел https://tc-all.ru
[u][b] Привет![/b][/u]
Где купить диплом специалиста?
Купить документ о получении высшего образования можно у нас в Москве. Мы предлагаем документы об окончании любых университетов РФ.
[b]Мы изготавливаем[/b] дипломы любых профессий по доступным тарифам. Цена будет зависеть от конкретной специальности, года выпуска и образовательного учреждения. Стараемся поддерживать для клиентов адекватную политику цен.
https://supermoneyforum.frmbb.ru/viewtopic.php?id=64843#p104575
[b]Успешной учебы![/b]
[u][b] Добрый день![/b][/u]
Где приобрести диплом специалиста?
[b]Мы можем предложить документы техникумов,[/b] расположенных в любом регионе РФ. Вы можете купить качественный диплом за любой год, указав необходимую специальность и оценки за все дисциплины. Дипломы и аттестаты делаются на бумаге самого высшего качества. Это дает возможности делать настоящие дипломы, не отличимые от оригиналов. Документы заверяются всеми требуемыми печатями и подписями.
[url=http://www.obrezanie05.ru/users/15?page=13]www.obrezanie05.ru/users/15?page=13[/url]
[url=https://vibefilms.biz/filmy-2024/]кино 2024 бесплатно смотреть[/url] – смотреть онлайн новинки фильмов, фильмы новинки онлайн
[b]Здравствуйте[/b]!
Задумался а действительно можно купить диплом государственного образца в Москве, и был удивлен, все реально и главное официально!
Сначала серфил в сети и искал такие темы как: купить диплом оценщика, купить диплом в сарове, купить диплом в минусинске, купить диплом магистра, купить диплом техникума, получил базовую информацию.
Остановился в итоге на материале купить диплом продавца, http://favorit-yug.ru/products/faltsevyj-vkladysh-rehaumontblancbrusbox-730/#comment_73983
[b]Успехов в учебе![/b]
Wonderful beat ! I would like to apprentice while you amend
your web site, how could i subscribe for a blog site?
The account helped me a appropriate deal.
I have been tiny bit familiar of this your broadcast provided brilliant clear idea
[b]Привет, друзья[/b]!
Всегда считал, что покупка диплома о высшем образовании — это миф и невозможно. Но, к счастью, оказался неправ. Сначала искал информацию по теме: купить диплом экономиста, купить диплом математика, купить атестат об окончании школы, купить диплом магистра, #где купить атестат об окончании школы, а затем переключился на дипломы вузов. Подробности здесь: http://lenaladan.blogspot.com/2014/09/blog-post_4.html
Оказалось, что все реально и легально, со специальными условиями и упрощенными программами. Теперь у меня диплом московского вуза нового образца, что я настоятельно рекомендую и вам!
Успешной учебы!
A motivating discussion is definitely worth comment.
There’s no doubt that that you need to publish more
on this issue, it might not be a taboo subject but generally people do not talk about such issues.
To the next! Cheers!!
Всем привет! Подскажите, где почитать полезные блоги о недвижимости? Сейчас читаю https://teplohod-denisdavidov.ru
срочный ремонт стиральных машин [url=www.centr-remonta-stiralnyh-mashin.ru]www.centr-remonta-stiralnyh-mashin.ru[/url] .
Latest boxing news, achievements of Raisol Abbasov https://boxing-ar.com, Tyson Fury fights and much more. It’s all about the boxing ambassador.
Discover the wonderful world of online games https://onlayn-oyinlar.com with GameHub. Get the latest news, reviews and tips for your favorite games. Join our gaming community today!
Sports news https://gta-uzbek.com the most respected sports site in Uzbekistan, which contains the latest sports news, forecasts and analysis.
Latest GTA game news https://gta-uzbek.com, tournaments, guides and strategies. Stay tuned for the best GTA gaming experience
Latest news from the world of boxing https://boks-uz.com, achievements of Resul Abbasov, Tyson Fury’s fights and much more. Everything Boxing Ambassador has.
[u][b] Здравствуйте![/b][/u]
Приобрести диплом о высшем образовании.
Мы предлагаем приобрести диплом в отличном качестве, который невозможно отличить от оригинального документа без использования дорогостоящего оборудования и квалифицированного специалиста.
[b]Где купить диплом по необходимой специальности?[/b]
http://odessaforum.getbb.ru/viewtopic.php?f=5&t=20402
[b]Удачи![/b]
[url=https://bins.su/]BIN List[/url] – bin checker, Bin database
Woah! I’m really loving the template/theme of this blog.
It’s simple, yet effective. A lot of times it’s tough to get that “perfect balance” between user
friendliness and visual appearance. I must say you’ve done a excellent job with this.
In addition, the blog loads super fast for me on Internet explorer.
Exceptional Blog!
[url=http://www.museum-kruf.ru/]pin up[/url] – pin up, пин ап официальный сат
Thank you for any other informative web site. Where else may I get that kind of info
written in such an ideal method? I’ve a undertaking that I’m
simply now operating on, and I’ve been on the glance out for
such information.
[u][b] Привет![/b][/u]
Где приобрести диплом специалиста?
[b]Купить документ[/b] института вы имеете возможность в нашей компании. Мы предлагаем документы об окончании любых ВУЗов России. Вы получите необходимый диплом по любой специальности, включая документы старого образца. Гарантируем, что при проверке документов работодателем, каких-либо подозрений не появится.
http://www.voidofheroes.com/forums/member.php?action=profile&uid=53584
[b]Успешной учебы![/b]
Зайдите на сайт Научно-технического центра «Триада» https://triadacompany.ru/ который помогает тысячам предприятий обеспечивать промышленную и экологическую безопасность по всей России! Лучшие кадры, инновационный подход, опыт с 1991 года. Промышленная и экологическая безопасность, экспертиза, проектирование, консалтинг. Подробнее на сайте.
[url=https://prm4u.com]Instagram Likes SMM Panel[/url] – SMM Panel, Affordable Social Media Marketing
Всем привет! Подскажите, где почитать полезные статьи о недвижимости? Пока нашел https://titovloft.ru
[u][b] Здравствуйте![/b][/u]
Мы изготавливаем дипломы любой профессии по выгодным тарифам.
Мы предлагаем документы техникумов, расположенных на территории всей России. Вы сможете приобрести качественно напечатанный диплом от любого заведения, за любой год, в том числе документы СССР. Дипломы и аттестаты делаются на “правильной” бумаге высшего качества. Это дает возможности делать государственные дипломы, не отличимые от оригиналов. Документы будут заверены необходимыми печатями и штампами.
Гарантируем, что в случае проверки документа работодателем, подозрений не появится.
[b]Где купить диплом специалиста?[/b]
[url=http://amengram.com/blogs/148/??????-??????-??????-?-?????]goup.hashnode.dev/karera-nachinaetsya-s-obrazovaniya-kupit-diplom-v-moskve[/url]
Good answers in return of this difficulty with real arguments and describing everything concerning that.
Explore the extraordinary journey of Kylian Mbappe https://mbappe-real-madrid.com, from his humble beginnings to global stardom.
Get the latest https://mesut-ozil-uz.com Mesut Ozil news, stats, photos and more.
Latest news about Pele https://mesut-ozil-uz.com, statistics, photos and much more. Get the latest news and information about football legend Pele.
Serxio Ramos Garsiya https://serxio-ramos.com ispaniyalik futbolchi, himoyachi. Ispaniya terma jamoasining sobiq futbolchisi. 16 mavsum davomida u “Real Madrid”da markaziy himoyachi sifatida o’ynadi.
Ronaldo de Asis Moreira https://ronaldinyo.com braziliyalik futbolchi, yarim himoyachi va hujumchi sifatida o’ynagan. Jahon chempioni (2002). “Oltin to’p” sovrindori (2005).
I am actually grateful to the owner of this website who has shared this enormous paragraph at at this time.
My blog post: have a peek at this website
[u][b] Привет![/b][/u]
Для определенных людей, приобрести [b]диплом[/b] о высшем образовании – это острая потребность, удачный шанс получить достойную работу. Однако для кого-то – это понятное желание не терять множество времени на учебу в институте. С какой бы целью вам это не понадобилось, мы готовы помочь. Быстро, качественно и выгодно изготовим диплом любого ВУЗа и года выпуска на подлинных бланках со всеми необходимыми подписями и печатями.
[b]Наши специалисты предлагают[/b] быстро и выгодно купить диплом, который выполнен на оригинальной бумаге и заверен мокрыми печатями, штампами, подписями должностных лиц. Диплом пройдет любые проверки, даже с использованием профессиональных приборов. Достигайте цели максимально быстро с нашим сервисом.
[b]Где приобрести диплом специалиста?[/b]
http://www.vladmines.dn.ua/forum/index.php/topic,27560.0.html
[b]Успешной учебы![/b]
https://cyprusrent.ru/
Online work has revolutionized the modern workplace, delivering adaptability and availability that classic office environments frequently lack. It enables individuals to work from any location with an internet connection, dissolving geographical barriers and facilitating companies to tap into a worldwide talent pool. This change has led to a rise in off-site and freelance opportunities, allowing workers to juggle their professional and personal lives more successfully. Additionally, online work can result in increased productivity and job satisfaction, as employees have more control over their timelines and work environments. However, it also poses challenges such as maintaining work-life boundaries, securing effective communication, and managing time efficiently. Overall, [url=https://same23always.com/]online work[/url] is a revolutionary force, redefining the way we think about employment and productivity in the digital age.
[u][b] Привет, друзья![/b][/u]
Где купить диплом по необходимой специальности?
Мы можем предложить документы ВУЗов, расположенных в любом регионе Российской Федерации. Документы заверяются необходимыми печатями и штампами.
Заказать диплом университета:
https://johnnyuxacd.blognody.com/27159893/?????-???????-??????
Приветствую. Может кто знает, где найти разные статьи о недвижимости? Сейчас читаю https://toadmarket.ru
Very soon this website will be famous amid all blogging visitors, due to it’s fastidious articles or reviews
Официальный сайт онлайн-казино Vavada https://vavada-kz-game.kz это новый адрес лучших слотов и джекпотов. Ознакомьтесь с бонусами и играйте на реальные деньги из Казахстана.
Marcus Lilian Thuram-Julien https://internationale.marcus-thuram-fr.com French footballer, forward for the Internazionale club and French national team.
[u][b] Здравствуйте![/b][/u]
Где приобрести диплом специалиста?
[b]Купить документ[/b] института вы можете у нас. Мы оказываем услуги по продаже документов об окончании любых университетов России. Вы получите диплом по любой специальности, любого года выпуска, включая документы Советского Союза. Гарантируем, что при проверке документа работодателями, каких-либо подозрений не появится.
http://www.modern-constructions.org/blogs/44177/Дипломы-высочайшего-качества-ваш-шаг-к-профессиональному-росту
[b]Хорошей учебы![/b]
Legendary striker Cristiano Ronaldo https://an-nasr.cristiano-ronaldo-fr.com signed a contract with the Saudi club ” An-Nasr”, opening a new chapter in his illustrious career in the Middle East.
[u][b] Здравствуйте![/b][/u]
Где приобрести диплом по нужной специальности?
Покупка диплома ВУЗа РФ в нашей компании является надежным процессом, так как документ [b]будет заноситься в реестр[/b]. Печать производится на специальных бланках ГОЗНАКа.
Вы заказываете диплом [b]в надежной и проверенной временем компании.[/b]
http://gamesmaker.ru/forum/common/offtopics/#replyform
[b]Успешной учебы![/b]
Hey there! I know this is kind of off-topic but I needed to ask. Does building a well-established website like yours take a large amount of work? I am brand new to operating a blog however I do write in my journal every day. I’d like to start a blog so I can easily share my experience and feelings online. Please let me know if you have any kind of ideas or tips for brand new aspiring blog owners. Thankyou!
мелбет казино
Manchester City and Erling Haaland https://manchester-city.erling-haaland-fr.com explosive synergy in action. How a club and a footballer light up stadiums with their dynamic play.
Lionel Messi https://inter-miami.lionel-messi-fr.com legendary Argentine footballer, announced his transfer to the American club Inter Miami.
Хайп казино
Pretty nice post. I simply stumbled upon your blog and wished
to say that I’ve really enjoyed browsing your weblog posts.
After all I’ll be subscribing for your rss feed and I’m hoping you write once more
soon!
about his [url=https://casino-glory.com]casino glory[/url]
[b]Здравствуйте[/b]!
Задался вопросом: можно ли на самом деле купить диплом государственного образца в Москве? Был приятно удивлен — это реально и легально!
Сначала искал информацию в интернете на тему: купить диплом врача, купить диплом в перми, купить диплом в шахтах, купить диплом о среднем образовании, купить диплом биолога и получил базовые знания. В итоге остановился на материале: http://ninokuni.ru/member.php?action=profile&uid=2100
Хорошей учебы!
https://nudifyai.net/
где купить диплом о высшем [url=https://ast-diplom.com/]ast-diplom.com[/url] .
Keep this going please, great job!
[b]Здравствуйте[/b]!
Задался вопросом: можно ли на самом деле купить диплом государственного образца в Москве? Был приятно удивлен — это реально и легально!
Сначала искал информацию в интернете на тему: купить диплом логопеда, купить диплом в орске, купить дипломы о высшем цены, купить аттестат за классов, купить диплом в златоусте и получил базовые знания. В итоге остановился на материале: https://glowsubs.ru/forum/topic/add/forum2/#postform
Хорошей учебы!
купить диплом училища ссср [url=https://ast-diplomy.com/]купить диплом училища ссср[/url] .
[u][b] Здравствуйте![/b][/u]
Мы изготавливаем дипломы психологов, юристов, экономистов и любых других профессий по доступным ценам. Стоимость зависит от конкретной специальности, года выпуска и ВУЗа.
Где приобрести диплом по актуальной специальности?
[b]Приобрести диплом любого ВУЗа[/b]
https://landik-diploms-srednee.ru/kupit-diplom-v-ekaterinburge
[b]Успешной учебы![/b]
Приветствую. Подскажите, где найти полезные блоги о недвижимости? Сейчас читаю https://u-mechanik.ru
The official website where you can find everything about the career of Gianluigi Buffon https://gianluigi-buffon.com. Discover the story of this legendary goalkeeper who left his mark on football history and relive his achievements and unforgettable memories with us.
Welcome to our official website! Go deeper into Paulo Dybala’s https://paulo-dybala.com football career. Discover Dybala’s unforgettable moments, amazing talents and fascinating journey in the world of football on this site.
Website dedicated to football player Paul Pogba https://pogba-uz.com. Latest news from the world of football.
Latest news on the Vinicius Junior fan site https://vinisius-junior.com. Vinicius Junior has been playing since 2018 for Real Madrid (Real Madrid). He plays in the Left Winger position.
[u][b] Здравствуйте![/b][/u]
Где приобрести диплом по необходимой специальности?
[b]Мы можем предложить документы ВУЗов,[/b] расположенных в любом регионе Российской Федерации. Вы имеете возможность заказать диплом за любой год, указав необходимую специальность и оценки за все дисциплины. Документы выпускаются на бумаге высшего качества. Это позволяет делать настоящие дипломы, которые не отличить от оригиналов. Документы будут заверены всеми обязательными печатями и штампами.
[url=http://politictoday.ru/page/39]politictoday.ru/page/39[/url]
外送茶是什麼?禁忌、價格、茶妹等級、術語等..老司機告訴你!
外送茶是什麼?
外送茶、外約、叫小姐是一樣的東西。簡單來說就是在通訊軟體與茶莊聯絡,選好自己喜歡的妹子後,茶莊會像送飲料這樣把妹子派送到您指定的汽車旅館、酒店、飯店等交易地點。您只需要在您指定的地點等待,妹妹到達後,就可以開心的開始一場美麗的約會。
外送茶種類
學生兼職的稱為清新書香茶
日本女孩稱為清涼綠茶
俄羅斯女孩被稱為金酥麻茶
韓國女孩稱為超細滑人參茶
外送茶價格
外送茶的客戶相當廣泛,包括中小企業主、自營商、醫生和各行業的精英,像是工程師等等。在台北和新北地區,他們的消費指數大約在 7000 到 10000 元之間,而在中南部則通常在 4000 到 8000 元之間。
對於一般上班族和藍領階層的客人來說,建議可以考慮稍微低消一點,比如在北部約 6000 元左右,中南部約 4000 元左右。這個價位的茶妹大多是新手兼職,但有潛力。
不同地區的客人可以根據自己的經濟能力和喜好選擇適合自己的價位範圍,以免感到不滿意。物價上漲是一個普遍現象,受到地區和經濟情況等因素的影響,茶莊的成本也在上升,因此價格調整是合理的。
外送茶外約流程
加入LINE:加入外送茶官方LINE,客服隨時為你服務。茶莊一般在中午 12 點到凌晨 3 點營業。
告知所在地區:聯絡客服後,告訴他們約會地點,他們會幫你快速找到附近的茶妹。
溝通閒聊:有任何約妹問題或需要查看妹妹資訊,都能得到詳盡的幫助。
提供預算:告訴客服你的預算,他們會找到最適合你的茶妹。
提早預約:提早預約比較好配合你的空檔時間,也不用怕到時候約不到你想要的茶妹。
外送茶術語
喝茶術語就像是進入茶道的第一步,就像是蓋房子打地基一樣。在這裡,我們將這些外送茶入門術語分類,讓大家能夠清楚地理解,讓喝茶變得更加容易上手。
魚:指的自行接客的小姐,不屬於任何茶莊。
茶:就是指「小姐」的意思,由茶莊安排接客。
定點茶:指由茶莊提供地點,客人再前往指定地點與小姐交易。
外送茶:指的是到小姐到客人指定地點接客。
個工:指的是有專屬工作室自己接客的小姐。
GTO:指雞頭也就是飯店大姊三七茶莊的意思。
摳客妹:只負責找客人請茶莊或代調找美眉。
內機:盤商應召站提供茶園的人。
經紀人:幫內機找美眉的人。
馬伕:外送茶司機又稱教練。
代調:收取固定代調費用的人(只針對同業)。
阿六茶:中國籍女子,賣春的大陸妹。
熱茶、熟茶:年齡比較大、年長、熟女級賣春者(或稱阿姨)。
燙口 / 高溫茶:賣春者年齡過高。
台茶:從事此職業的台灣小姐。
本妹:從事此職業的日本籍小姐。
金絲貓:西方國家的小姐(歐美的、金髮碧眼的那種)。
青茶、青魚:20 歲以下的賣春者。
乳牛:胸部很大的小姐(D 罩杯以上)。
龍、小叮噹、小叮鈴:體型比較肥、胖、臃腫、大隻的小姐。
сервис ремонта стиральных машин [url=www.centr-remonta-stiralnyh-mashin.ru]www.centr-remonta-stiralnyh-mashin.ru[/url] .
[b]Здравствуйте[/b]!
Задался вопросом: можно ли на самом деле купить диплом государственного образца в Москве? Был приятно удивлен — это реально и легально!
Сначала искал информацию в интернете на тему: купить дипломы о высшем образовании цена, купить диплом в обнинске, где купить диплом среднем, купить диплом в троицке , купить диплом в димитровграде и получил базовые знания. В итоге остановился на материале: https://malush.blox.ua/2024/06/%D0%BA%D1%83%D0%BF%D0%B8%D1%82%D1%8C-%D0%B4%D0%B8%D0%BF%D0%BB%D0%BE%D0%BC-%D1%81%D0%BA%D0%BE%D0%BB%D1%8C%D0%BA%D0%BE.html
Удачи!
[url=https://ant-models.ru/]эскорт услуги[/url] – эскорт москва, эскорт москва
[u][b] Привет, друзья![/b][/u]
Где заказать диплом специалиста?
Купить документ университета можно в нашей компании. Мы предлагаем документы об окончании любых университетов Российской Федерации.
[b]Мы изготавливаем[/b] дипломы психологов, юристов, экономистов и других профессий по доступным тарифам. Цена будет зависеть от выбранной специальности, года выпуска и ВУЗа. Всегда стараемся поддерживать для заказчиков адекватную ценовую политику.
http://x70795vj.beget.tech/2024/03/09/hotite-zakazat-originalnyy-diplom.html
[b]Хорошей учебы![/b]
become a film critic where can i watch free movieproject runway season 7 milamovie candy bulkbattlestar galactica season 2
1win ваучер [url=https://www.1win.tr-kazakhstan.kz]https://www.1win.tr-kazakhstan.kz[/url] В 1win casino есть бездепозитные бонусы, которые можно получить за регистрацию или другие действия. Например, бездепозитный бонус за регистрацию может составлять 1000 рублей и использоваться для бесплатных ставок на спорт. https://www.1win.tr-kazakhstan.kz
[u][b] Здравствуйте![/b][/u]
Где купить диплом специалиста?
Мы можем предложить документы ВУЗов, расположенных в любом регионе России. Можно приобрести качественный диплом от любого ВУЗа, за любой год, включая документы старого образца СССР. Дипломы выпускаются на “правильной” бумаге высшего качества. Это дает возможности делать государственные дипломы, не отличимые от оригинала. Они заверяются необходимыми печатями и штампами.
[b]Мы готовы предложить дипломы[/b] любой профессии по выгодным тарифам.
https://asxdiplomik.com/kupit-diplom-omsk
[u][b] Рады оказать помощь![u][b]
Outstanding quest there. What happened after? Good luck!
[url=http://pin-up-casino-sv.biz]Pinup casino[/url]
Placera ditt spel hos pinup online – mest elite bookmaker
Pinup
[url=https://pin-up-casino-no.biz]pin up casino[/url]
Plasser innsatsen din hos pin up online – mest prestisjefylt bookmaker
pinup
Coffeeroom https://coffeeroom.by – магазин кофе, чая, кофетехники, посуды, химии и аксессуаров в Минске для дома и офиса.
Having read this I thought it was really enlightening. I appreciate you taking the time and effort to put
this content together. I once again find myself spending a lot of time both reading and posting
comments. But so what, it was still worthwhile!
[url=https://my.advantech.com/Includes/GetTemplate.ashx?CMSURL=https://pin-up-casino-us.biz/]Pin up Us[/url]
Place your bet at pin up online – most elite bookmaker
Pinup
[url=https://pin-up-casino-no.biz]pin up[/url]
Plasser innsatsen din hos pinup online – direkte palitelig bookmaker
pin up casino
[url=https://pin-up-casino-sv.biz]online casino[/url]
Placera ditt spel hos pin up nu – direkt prestigeious bookmaker
Pin up sv
http://remontwasher.ru/
[url=https://pin-up-casino-ar.biz]Pin up[/url]
Place your bet at pinup online – direct reliable bookmaker
Pin up casino
[url=https://my.advantech.com/Includes/GetTemplate.ashx?CMSURL=https://pin-up-casino-us.biz/]Pin up Us[/url]
Place your bet at pinup now – direct prestigious bookmaker
online casino
We’ve all made email marketing mistakes: You click send on an email and suddenly your stomach drops. You’ve made a mistake and there’s nothing you can do about it [url=https://daviddelavari.it/blog/mastering-the-art-of-storytelling-tips-for-podcasters]Mastering the Art of Storytelling: Tips for Podcasters[/url]
[url=https://msk-escort.com/]москва эскорт агентство[/url] – эскорт услуги, эскорт мск
Приветствую. Подскажите, где найти разные статьи о недвижимости? Пока нашел https://utc96.ru
Прокат и аренда автомобилей https://autorent.by в Минске 2019-2022. Сутки от 35 руб.
[url=https://pin-up-casino-ar.biz]Pin up ar[/url]
Place your bet at pinup now – very reliable bookmaker
Pinup casino
Latest news and information about Marcelo https://marselo-uz.com on this site! Find Marcelo’s biography, career, game stats and more.
Find the latest information on Khabib Nurmagomedov https://khabib-nurmagomedov.uz news and fights. Check out articles and videos detailing Khabib UFC career, interviews, wins, and biography.
I visited multiple websites except the audio quality for audio songs current at this
web page is actually excellent.
[url=https://private-models.ru/]эскорт москва[/url] – эскорт услуги, vip эскорт москва
[url=http://pin-up-casino-sv.biz]Pinup casino[/url]
Placera ditt spel hos pin up online – direkt elite bookmaker
Pin up
[url=https://pin-up-casino-no.biz]pinup[/url]
Plasser innsatsen din hos pinup now – mest prestisjefylt bookmaker
pin up casino
Can you tell us more about this? I’d want to find out more details.
ggbet
На сайте https://kinogo-fil.net/ вам предлагается смотреть интересные фильмы и сериалы бесплатно и без каких-либо ограничений. Здесь собрано множество подборок фильмов и категорий жанров, мультсериалов и мультфильмов. Вы сможете найти фильм для любых целей. Структура сайта позволит вам в несколько кликов начать смотреть ваш любимый сериал или же фильм. Наш сервис даст возможность вам подписаться на конкретный сериал, каждый раз, когда будет выходить новая серия, вы сразу же об этом узнаете! Приятного вам просмотра!
[url=https://pin-up-casino-ar.biz]Pinup[/url]
Place your bet at pin up now – very elite bookmaker
Pin up casino
Готовая еда с доставкой Ижевск bistroyar.ru
Рады пригласить Вас в наше bistroyar.ru бистро, где можно не только оперативно и вкусно перекусить, а также провести бизнес встречу, оформить заказ с доставкой, насладиться домашней кухней и порадовать себя десертом.
Бистро «ЯР» размещено по адресу г. Ижевск, ул. Максима Горького, д. 163. Режим работы с 10:00 до 20:00 каждый день. Приходите к нам или делайте заказ с доставкой и наслаждайтесь блюдами разной кухни в привычной для себя обстановке.
По запросу [url=https://bistroyar.ru/]грузинская кухня доставка[/url] вы на верном пути. У нас можно мгновенно заказать еду с доставкой. Заходите в наше меню на веб портале bistroyar.ru и добавляйте желаемые блюда в корзину. Далее определите способ доставки или самовывоз, что более комфортно для Вас. Если Вы желаете получить дома заказ, то естественно указывайте достоверный адрес и мобильный телефон.
Если Вы искали [url=https://bistroyar.ru/]где заказать еду ижевск[/url] прямо сейчас, то мы Вам готовы помочь. Наш девиз – «хорошо, как дома», ведь мы готовим от души, что многие гости оценили. По любым вопросам звоните по телефону +7(3412)223-230 или оставляйте заявку на сайте. Прямо сейчас попробуйте наши десерты и супы, возможно, вкуснее было только у бабушки дома.
[u][b] Здравствуйте![/b][/u]
Заказать диплом о высшем образовании.
Мы предлагаем заказать диплом в высоком качестве, неотличимый от оригинала без использования специального оборудования и квалифицированного специалиста.
[b]Где купить диплом специалиста?[/b]
http://pirat.iboards.ru/viewtopic.php?f=20&t=20746
[b]Хорошей учебы![/b]
Hey! I could have sworn I’ve been to this website before but
after checking through some of the post I
realized it’s new to me. Anyways, I’m definitely glad I found it and I’ll be bookmarking and checking back frequently!
[u][b] Привет![/b][/u]
Где заказать диплом специалиста?
Заказать диплом о высшем образовании.
http://ya.bestbb.ru/viewtopic.php?id=2962#p6549
[b]Успехов в учебе![/b]
[u][b] Привет, друзья![/b][/u]
Купить диплом ВУЗа.
Мы предлагаем купить диплом высочайшего качества, неотличимый от оригинального документа без использования специального оборудования и квалифицированного специалиста.
[b]Где купить диплом по нужной специальности?[/b]
http://blackpearlbasketball.com.au/index.php?option=com_k2&view=itemlist&task=user&id=846150
[b]Успехов в учебе![/b]
Приветствую. Может кто знает, где найти полезные статьи о недвижимости? Сейчас читаю https://vortex-los.ru
No matter if some one searches for his required thing, thus he/she desires to be
available that in detail, thus that thing is maintained over here.
Hello everyone!!
MCW Casino is my number one choice for online betting and casino entertainment. The appealing bonuses, fast withdrawals, and convenient Android app make it a standout. The dependable working mirror ensures uninterrupted play. I play with pleasure and recommend MCW Casino to everyone!
Registering at MCW Casino took mere minutes, and the bonuses were a pleasant surprise. Whether betting on sports or playing casino games, I’ve experienced joy in both. The availability of the working mirror and prompt withdrawals add to the appeal. MCW Casino comes highly recommended!
Catch the site where everything is in the best shape! – [url=https://cwrmobility.com]MCW Casino[/url]
slots MCW Casino
Mega Casino World download client
how to play at Mega Casino World on bonuses
MCW Casino sports nutrition
Mega Casino World app download
Good profits!
It’s not my first time to pay a visit this site, i am visiting
this web site dailly and obtain pleasant facts from here everyday.
**Unlocking the Potential of OmniHack: Revolutionizing the World of Hacking**
In the ever-evolving landscape of cybersecurity and technology, the term “OmniHack” has emerged as a pivotal concept that promises to redefine the boundaries of ethical hacking. OmniHack represents a paradigm shift in how cybersecurity professionals approach vulnerability testing, penetration testing, and ethical hacking in general. This article delves into what OmniHack entails, its significance, and its implications for the future of cybersecurity.
**What is OmniHack?**
OmniHack can be best described as a comprehensive approach to ethical hacking that integrates various methodologies, tools, and techniques. Unlike traditional hacking practices that may focus on specific vulnerabilities or systems, OmniHack takes a holistic view. It encompasses a wide range of targets, including web applications, networks, mobile devices, and cloud infrastructures. The goal is not just to identify weaknesses but to provide a thorough assessment of an organization’s entire security posture.
**Key Features of https://lopermedia.com/**
1. **Cross-Platform Compatibility:** OmniHack is designed to work across different platforms and environments. This versatility allows cybersecurity professionals to assess and secure complex infrastructures comprehensively.
2. **Automation and AI Integration:** Leveraging automation and artificial intelligence, OmniHack streamlines the process of vulnerability detection and analysis. This not only accelerates the testing phase but also enhances accuracy in identifying potential threats.
3. **Scalability:** Whether for small businesses or large enterprises, OmniHack offers scalable solutions tailored to the specific needs and complexities of each organization. This scalability ensures that cybersecurity efforts remain effective and efficient regardless of size.
4. **Continuous Monitoring and Assessment:** Beyond one-time assessments, OmniHack promotes continuous monitoring and assessment. This proactive approach helps organizations stay ahead of emerging threats and vulnerabilities in real-time.
**The Significance of OmniHack**
OmniHack represents more than just a technological advancement; it embodies a shift in mindset towards proactive cybersecurity. By adopting OmniHack methodologies, organizations can:
– **Enhance Security Posture:** By identifying and addressing vulnerabilities proactively, organizations can significantly reduce the risk of cyberattacks and data breaches.
– **Meet Compliance Requirements:** Many regulatory frameworks require organizations to conduct regular security assessments. OmniHack facilitates compliance by providing robust testing and reporting capabilities.
– **Boost Efficiency:** Automation and AI-driven processes streamline security assessments, allowing cybersecurity teams to focus on strategic initiatives rather than routine tasks.
– **Foster Innovation:** OmniHack encourages innovation in cybersecurity practices by integrating cutting-edge technologies and methodologies.
**The Future of OmniHack**
As technology continues to advance, so too will the capabilities of OmniHack. Future iterations may include enhanced AI capabilities, advanced threat modeling, and integration with emerging technologies such as blockchain and IoT security. Moreover, as cybersecurity threats become more sophisticated, OmniHack will play a crucial role in safeguarding digital assets and maintaining trust in the digital economy.
In conclusion, OmniHack represents a pivotal advancement in the field of ethical hacking and cybersecurity. By embracing its holistic and proactive approach, organizations can fortify their defenses against evolving cyber threats while fostering a culture of continuous improvement and innovation in cybersecurity practices. As we look towards the future, OmniHack is poised to lead the charge in securing the digital landscape for years to come.
precio
https://rik-estate.ru/
go to this web-site [url=https://coimnarketcap.us]coinmarketcap[/url]
[u][b] Привет, друзья![/b][/u]
Заказать диплом о высшем образовании.
Мы предлагаем приобрести диплом высочайшего качества, который не отличить от оригинала без использования специального оборудования и опытного специалиста.
[b]Где купить диплом по необходимой специальности?[/b]
http://dopalnenie.listbb.ru/ucp.php?mode=login
[b]Удачи![/b]
Get the facts [url=https://Trader-joe.homes]trader joe[/url]
[u][b] Привет![/b][/u]
Приобрести документ о получении высшего образования вы имеете возможность у нас. Мы оказываем услуги по продаже документов об окончании любых ВУЗов Российской Федерации. Вы получите диплом по любой специальности, включая документы Советского Союза. Даем 100% гарантию, что в случае проверки документа работодателем, подозрений не возникнет.
[b]Наша компания предлагает[/b] выгодно заказать диплом, который выполнен на бланке ГОЗНАКа и заверен печатями, штампами, подписями должностных лиц. Документ способен пройти лубую проверку, даже с использованием специального оборудования. Достигайте цели быстро и просто с нашими дипломами.
[b]Где приобрести диплом по необходимой специальности?[/b]
http://ukvg-nn.ru/index.php?subaction=userinfo&user=eveloboma
[b]Успехов в учебе![/b]
[u][b] Добрый день![/b][/u]
Где купить диплом специалиста?
Мы можем предложить документы техникумов, расположенных на территории всей РФ. Документы будут заверены необходимыми печатями и подписями.
Приобрести диплом любого университета:
http://repetitor.ekafe.ru/viewtopic.php?f=7&t=1441
[b]Всем привет[/b])
Будучи студентом, я наслаждался учебой до тех пор, пока не пришло время писать диплом. Но паниковать не стоило, ведь существуют компании, которые помогают с написанием и защитой диплома на отличные оценки!
Изначально я искал информацию по теме: купить диплом о среднем специальном, купить диплом в тобольске, купить диплом института, купить диплом в новомосковске, купить диплом матроса, затем наткнулся на http://rai.lv/ru/index.php?subaction=userinfo&user=yroxy, где все мои учебные вопросы были решены!
Удачи!
http://nedvizhimostrussa.ru/
1win apk 2023 [url=https://www.1win.tr-kazakhstan.kz]www.1win.tr-kazakhstan.kz[/url] 1win indir apk https://1win.tr-kazakhstan.kz/
Приветствуем вас на канале проекта casino VAVADA! Здесь вы найдете исключительно свежую информацию. Проведите время за интересными слотами в качественном онлайн-казино Вавада и забудьте о повседневных заботах! Вас ждет особая атмосфера и отличная графика. Ищете аппараты vavada? t.me/mvavada – здесь мы с вами делимся секретами успеха и своими знаниями. Казино VAVADA всем без исключения подходит. Вы оцените скорость выводов и бонусы. Служба поддержки старается оперативно решать любые вопросы. Играйте прямо сейчас. Больших вам выигрышей!
In a world where communication is key, having a reliable phone number is essential for both personal and business interactions. However, not everyone needs a permanent number, especially when privacy, convenience, and flexibility are at stake [url=https://fr.kompass.com/p/kompass-posts/ua103618/l-importance-d-avoir-un-numero-de-telephone-belge-pour-les-affaires/6ef54021-ce5a-418b-915d-3178160a23c4]https://fr.kompass.com/p/kompass-posts/ua103618/l-importance-d-avoir-un-numero-de-telephone-belge-pour-les-affaires/6ef54021-ce5a-418b-915d-3178160a23c4[/url]
[url=https://www.xn--80aaevcekoocvln.xn--p1ai]Построить дом из кирпича[/url] – дома под ключ недорого, Построить дом
Приветствую. Может кто знает, где почитать полезные блоги о недвижимости? Сейчас читаю https://yah-bomag.ru
[b]Всем привет[/b])
Будучи студентом, я наслаждался учебой до тех пор, пока не пришло время писать диплом. Но паниковать не стоило, ведь существуют компании, которые помогают с написанием и защитой диплома на отличные оценки!
Изначально я искал информацию по теме: купить диплом в архангельске, купить диплом в буденновске, купить диплом в канске, купить диплом в оренбурге, купить диплом специалиста, затем наткнулся на https://wiki.mysupp.ru/index.php?title=eonlinediplom, где все мои учебные вопросы были решены!
Удачи!
Find the latest information on Conor McGregor https://conor-mcgregor.uz news, fights, and interviews. Check out detailed articles and news about McGregor’s UFC career, wins, training, and personal life.
Discover how Riyad Mahrez https://al-ahli.riyad-mahrez.com transformed Al-Ahli, becoming a key player and catalyst in reaching new heights in world football.
Get to know the history, players and latest news of the Inter Miami football club https://inter-miami.uz. Join us to learn about the successes and great performances of America’s newest and most exciting soccer club.
A site dedicated to Michael Jordan https://michael-jordan.uz, a basketball legend and symbol of world sports culture. Here you will find highlights, career, family and news about one of the greatest athletes of all time.
Explore the dynamic world of sports https://noticias-esportivas-br.org through the lens of a sports reporter. Your source for breaking news, exclusive interviews, in-depth analysis and live coverage of all sports.
Do you have a spam issue on this site; I also am a blogger, and I was wondering your situation; many of us have developed some
nice procedures and we are looking to exchange strategies with
others, please shoot me an email if interested.
Thanks to my father who informed me about this webpage, this
website is really amazing.
1. Выбрать тур, нажать желтую кнопку в блоге.
Feel free to surf to my blog post – https://citytour24.ru/
I really like what you guys are usually up too. Such clever
work and exposure! Keep up the fantastic works guys I’ve incorporated you guys to my personal blogroll.
How and where you claim your prize depends on how considerably you’ve won.
My web site :: https://ourladyschapel.org/index.php/Winning_Numbers_Decoded:_A_Hilarious_Guide_To_Lottery_Number_Combinations
На сайте http://kak-vernut-dengi.ru/ представлена интересная, исчерпывающая информация о том, как получится вернуть средства у брокера, если он получил их незаконным либо нечестным путем, но при этом обещал высокую доходность. Специалист в своих статьях как раз рассказывает о том, как вернуть средства законным путем у таких лжеброкеров. Здесь находятся и любопытные видеоматериалы, которые понравятся тем, что они содержательные и информативные. В них детально показывается то, как это правильно сделать, чтобы не ошибиться.
наперстки 1win [url=https://www.1win.tr-kazakhstan.kz]www.1win.tr-kazakhstan.kz[/url] 1win телефон приложение 1win.tr-kazakhstan.kz
[u][b] Добрый день![/b][/u]
Где заказать диплом специалиста?
[b]Приобрести документ[/b] о получении высшего образования вы имеете возможность в нашей компании. Мы предлагаем документы об окончании любых университетов России. Вы получите диплом по любой специальности, любого года выпуска, включая документы Советского Союза. Гарантируем, что в случае проверки документов работодателями, никаких подозрений не возникнет.
http://forum.trackbase.net/members/21965-sonnick84?vmid=2440
[b]Успешной учебы![/b]
[b]Привет всем[/b])
Хорошо быть студентом, пока не придет пора писать диплом, что и произошло со мной, но не стоит отчаиваться, ведь есть хорошие компании что помогают с написанием и сдачей диплома на хорошие оценки!
Изначально искал информацию про купить диплом в минеральных водах, купить диплом в норильске, купить диплом университета, купить диплом в кемерово, купить диплом в сочи, потом попал на https://dksol.ru/4919-spektakl-poslednyaya-fotografiya/ и там решили все мои учебные заботы!
[b]Хорошей учебы![/b]
Because the admin of this web page is working, no hesitation very quickly it will be renowned, due to its feature contents.
Приветствую. Может кто знает, где найти полезные блоги о недвижимости? Сейчас читаю https://yaoknaa.ru
If you are a fan of UFC https://ufc-hoje.com the most famous organization in the world, come visit us. The most important news and highlights from the UFC world await you on our website.
The latest top football news https://futebol-ao-vivo.net today. Interviews with football players, online broadcasts and match results, analytics and football forecasts
Site with the latest news, statistics, photos of Pele https://edson-arantes-do-nascimento.com and much more. Get the latest news and information about football legend Pele.
Welcome to our official website, where you will find everything about the career of Gianluigi Buffon https://gianluigi-buffon.org. Discover the story of this legendary goalkeeper who made football history.
Glory Casino
Valuable information. Lucky me I discovered your website by accident, and I’m stunned why this coincidence
did not took place in advance! I bookmarked it.
[u][b] Привет, друзья![/b][/u]
Где заказать диплом специалиста?
[b]Купить документ[/b] о получении высшего образования вы сможете у нас. Мы оказываем услуги по продаже документов об окончании любых университетов России. Вы получите необходимый диплом по любой специальности, включая документы образца СССР. Даем 100% гарантию, что в случае проверки документов работодателем, подозрений не появится.
http://eon51.com/eon51-sky-dining/?lang=vi
[b]Успехов в учебе![/b]
[u][b] Привет, друзья![/b][/u]
Где приобрести диплом специалиста?
Мы можем предложить документы ВУЗов, которые расположены на территории всей Российской Федерации. Можно купить качественно сделанный диплом от любого высшего учебного заведения, за любой год, указав актуальную специальность и хорошие оценки за все дисциплины. Дипломы выпускаются на бумаге высшего качества. Это позволяет делать настоящие дипломы, не отличимые от оригиналов. Они заверяются всеми необходимыми печатями и подписями.
[b]Мы изготавливаем дипломы[/b] любых профессий по приятным ценам.
https://diplomyx24.ru/kupit-diplom-omsk
[u][b] Рады помочь![u][b]
[url=https://telegra.ph/posredniki-dostavki-tovarov-iz-ssha-v-rf-07-08]мейлфорвадеры доставка из сша в россию
[/url]
[url=https://telegra.ph/posredniki-dostavki-tovarov-iz-ssha-v-rf-07-08]доставка посылок из сша
[/url]
[url=https://telegra.ph/posredniki-dostavki-tovarov-iz-ssha-v-rf-07-08]доставка посылок из сша в россию
[/url]
ссылка на сайт [url=https://t.me/snyusb]снюс москва[/url]
I like the helpful info you provide to your articles.
I’ll bookmark your blog and take a look at again here frequently.
I am slightly certain I will learn plenty of new stuff right right here!
Good luck for the next!
PHILADELPHIA (WPVI) — Much more than a billion dollars is up for grabs when you combine the Powerball and Mega Millions jackpots.
Take a look at my website – https://naturesfusions.net/index.php/Lightning_Fast_Fun:_The_Exciting_World_Of_Speed_Keno
[u][b] Привет, друзья![/b][/u]
Где приобрести диплом по нужной специальности?
[b]Мы можем предложить документы техникумов,[/b] расположенных на территории всей РФ. Можно купить диплом от любого заведения, за любой год, указав актуальную специальность и хорошие оценки за все дисциплины. Документы делаются на бумаге высшего качества. Это позволяет делать настоящие дипломы, не отличимые от оригиналов. Они заверяются всеми необходимыми печатями и штампами.
[url=http://clicknconnectclubs.com/index.php?do=/public/user/blogs/name_Alanpoe/page_7/]clicknconnectclubs.com/index.php?do=/public/user/blogs/name_Alanpoe/page_7/[/url]
The best site dedicated to the football player Paul Pogba https://pogba.org. Latest news from the world of football.
[u][b] Добрый день![/b][/u]
Мы изготавливаем дипломы любой профессии по выгодным тарифам.
Мы предлагаем документы ВУЗов, расположенных на территории всей России. Можно заказать качественный диплом за любой год, указав необходимую специальность и оценки за все дисциплины. Дипломы и аттестаты делаются на “правильной” бумаге высшего качества. Это дает возможности делать настоящие дипломы, которые не отличить от оригинала. Документы будут заверены всеми требуемыми печатями и подписями.
[b]Где купить диплом специалиста?[/b]
[url=http://bike.by/forum/viewtopic.php?f=84&t=30293]bike.by/forum/viewtopic.php?f=84&t=30293[/url]
https://redstoneestate.ru/
https://med-blesk.ru
Glory Casino
1win kz авиатор [url=https://1win.tr-kazakhstan.kz]https://1win.tr-kazakhstan.kz/[/url] **Aviator** – это захватывающая краш-игра на сайте **1win**, где игрок делает ставку на исход полета самолета и вовремя вывести выигрыш. Попробуйте свою удачу в этой азартной игре! https://1win.tr-kazakhstan.kz/
1 win aviator [url=http://1win.tr-kazakhstan.kz]1win.tr-kazakhstan.kz[/url] Запрос на скачивание бесплатного мобильного приложения 1win для Android на русском языке. Это приложение позволяет пользователям делать ставки и играть в казино на их родном языке. http://1win.tr-kazakhstan.kz/
You actually make it seem so easy with your presentation but I find this matter
to be really something which I think I would never understand.
It seems too complicated and very broad for me.
I am looking forward for your next post, I will try to get the hang of it!
Vinicius Junior https://vinicius-junior.org all the latest current and latest news for today about the player of the 2024 season
Analysis of Arsenal’s impressive revival https://arsenal.bukayo-saka.biz under the leadership of Mikel Arteta and the key role of young star Bukayo Saki in the club’s return to the top.
Gavi’s success story https://barcelona.gavi-fr.com at Barcelona: from his debut at 16 to a key role in club and national team of Spain, his talent inspires the world of football.
Pedri’s story https://barcelona.pedri-fr.com from his youth in the Canary Islands to becoming a world-class star in Barcelona, ??with international success and recognition.
Всем привет! Может кто знает, где почитать разные блоги о недвижимости? Сейчас читаю https://zt365.ru
[url=https://datacloud.guru]virtual private server price[/url] – linux vps web hosting, virtual private server price
Outstanding post however , I was wanting to know if you
could write a litte more on this topic? I’d be very thankful if you
could elaborate a little bit more. Bless you!
pve boost wow
Кафе бистро Ижевск bistroyar.ru
Рады пригласить Вас в наше bistroyar.ru бистро, где можно не только оперативно и вкусно пообедать, а также провести бизнес встречу, оформить заказ с доставкой, усладиться домашней кухней и порадовать себя вкусностями.
Бистро «ЯР» находится по адресу г. Ижевск, ул. Максима Горького, д. 163. Время работы с 10:00 до 20:00 каждый день. Приходите к нам или оформляйте заказ с доставкой и наслаждайтесь блюдами нашей кухни в обычной для себя среде.
По теме [url=https://bistroyar.ru/]где можно заказать готовую еду[/url] вы на правильном пути. Тут можно быстро заказать еду с доставкой. Переходите в меню на веб портале bistroyar.ru и добавляйте нужные блюда в корзину. Далее определите способ доставки или самовывоз, что более удобно для Вас. Если Вы хотите доставку на дом, то естественно впишите достоверный адрес и контактный телефон.
Если Вы искали [url=https://bistroyar.ru/]грузинская кухня ижевск[/url] сейчас, то мы Вам обязательно поможем. Наш девиз – «хорошо, как дома», ведь мы готовим от души, что многие клиенты отметили. По любым вопросам звоните по нашему номеру телефона +7(3412)223-230 или оставляйте заявку на сайте. Обязательно попробуйте наши салаты и горячее, скорее всего, вкуснее было только у бабушки на кухне.
оформить внж в испанию https://vnzh24.ru/
Excellent way of describing, and good article to get data regarding my presentation topic, which i am going to deliver in university.
wow raid boost [url=https://www.kreativwerkstatt-esens.de]wow raid boost[/url] .
[u][b] Здравствуйте![/b][/u]
Где купить диплом специалиста?
[b]Заказать документ[/b] о получении высшего образования вы имеете возможность у нас в Москве. Мы предлагаем документы об окончании любых университетов РФ. Вы получите необходимый диплом по любой специальности, любого года выпуска, в том числе документы СССР. Гарантируем, что в случае проверки документа работодателями, каких-либо подозрений не возникнет.
http://globalimport.spb.ru/forum/thread1029.html#1049
[b]Удачи![/b]
https://aoseulado.net/
[u][b] Добрый день![/b][/u]
Купить диплом университета.
Мы предлагаем приобрести диплом высокого качества, неотличимый от оригинала без использования специального оборудования и опытного специалиста.
[b]Где заказать диплом по актуальной специальности?[/b]
http://funchange.getbb.ru/posting.php?mode=post&f=8&sid=4e12e54414e59e30885799c3162514cf
[b]Хорошей учебы![/b]
Gerakl24: Опытная Реставрация Основания, Венцов, Полов и Перемещение Домов
Компания Gerakl24 профессионально занимается на выполнении всесторонних работ по смене фундамента, венцов, покрытий и передвижению строений в месте Красноярске и за пределами города. Наша группа опытных экспертов обещает превосходное качество исполнения различных типов реставрационных работ, будь то древесные, с каркасом, кирпичные или из бетона здания.
Достоинства услуг Gerakl24
Профессионализм и опыт:
Весь процесс осуществляются исключительно высококвалифицированными специалистами, имеющими большой стаж в направлении строительства и ремонта зданий. Наши специалисты эксперты в своей области и реализуют задачи с безупречной точностью и учетом всех деталей.
Всесторонний подход:
Мы осуществляем разнообразные услуги по ремонту и ремонту домов:
Реставрация фундамента: замена и укрепление фундамента, что позволяет продлить срок службы вашего дома и избежать проблем, вызванные оседанием и деформацией.
Смена венцов: реставрация нижних венцов из дерева, которые наиболее часто гниют и разрушаются.
Замена полов: замена старых полов, что кардинально улучшает внешний вид и функциональные характеристики.
Передвижение домов: качественный и безопасный перенос строений на новые места, что помогает сохранить здание и предотвращает лишние расходы на строительство нового.
Работа с любыми типами домов:
Деревянные дома: восстановление и защита деревянных строений, защита от гниения и вредителей.
Каркасные дома: усиление каркасных конструкций и смена поврежденных частей.
Кирпичные строения: восстановление кирпичной кладки и усиление стен.
Бетонные дома: восстановление и укрепление бетонных структур, устранение трещин и повреждений.
Надежность и долговечность:
Мы применяем только высококачественные материалы и передовые технологии, что обеспечивает долгий срок службы и надежность всех выполненных работ. Все наши проекты проходят строгий контроль качества на каждом этапе выполнения.
Личный подход:
Каждому клиенту мы предлагаем подходящие решения, с учетом всех особенностей и пожеланий. Мы стремимся к тому, чтобы итог нашей работы полностью удовлетворял ваши ожидания и требования.
Почему выбирают Геракл24?
Работая с нами, вы приобретете надежного партнера, который берет на себя все заботы по ремонту и реконструкции вашего строения. Мы обещаем выполнение всех проектов в сроки, установленные договором и с соблюдением всех правил и норм. Выбрав Геракл24, вы можете не сомневаться, что ваш дом в надежных руках.
Мы готовы предоставить консультацию и дать ответы на все вопросы. Свяжитесь с нами, чтобы обсудить детали вашего проекта и получить больше информации о наших услугах. Мы поможем вам сохранить и улучшить ваш дом, сделав его безопасным и комфортным для проживания на долгие годы.
Геракл24 – ваш надежный партнер в реставрации и ремонте домов в Красноярске и за его пределами.
1899 season 2 bates motel movie 2013total bellas season 6movies for toddlers on netflixbig sky season 3 review
Чтобы сделать [url=https://exci.ru/methods/Lasik/]лазерная коррекция lasik[/url] приходите к нам. Мы расположились по адресу г. Ижевск, ул. Ленина, д. 101. Время работы по будням с 9:00 до 16:00, после 16:00 можно посетить врача, заранее записавшись или по субботам и воскресеньям.
[u][b] Добрый день![/b][/u]
Мы можем предложить дипломы любых профессий по приятным тарифам.
Мы предлагаем документы ВУЗов, расположенных в любом регионе России. Можно заказать качественно сделанный диплом за любой год, указав актуальную специальность и хорошие оценки за все дисциплины. Документы выпускаются на бумаге высшего качества. Это позволяет делать настоящие дипломы, не отличимые от оригиналов. Они заверяются необходимыми печатями и штампами.
Даем гарантию, что при проверке документа работодателем, никаких подозрений не появится.
[b]Где купить диплом специалиста?[/b]
[url=http://startinvest.2bb.ru/post.php?fid=7]wiki.spbal.ru/index.php?title=%D0%9E%D0%BD%D0%BB%D0%B0%D0%B9%D0%BD-%D0%BC%D0%B0%D0%B3%D0%B0%D0%B7%D0%B8%D0%BD_%D1%81_%D1%88%D0%B8%D1%80%D0%BE%D0%BA%D0%B8%D0%BC_%D0%B0%D1%81%D1%81%D0%BE%D1%80%D1%82%D0%B8%D0%BC%D0%B5%D0%BD%D1%82%D0%BE%D0%BC_%D0%B0%D1%82%D1%82%D0%B5%D1%81%D1%82%D0%B0%D1%82%D0%BE%D0%B2_%D0%B8_%D0%B4%D0%B8%D0%BF%D0%BB%D0%BE%D0%BC%D0%BE%D0%B2[/url]
Приветствую. Подскажите, где почитать полезные блоги о недвижимости? Пока нашел https://astali.ru
[u][b] Привет![/b][/u]
Где приобрести диплом специалиста?
Купить документ о получении высшего образования вы имеете возможность в нашем сервисе. Мы предлагаем документы об окончании любых университетов России.
[b]Мы изготавливаем[/b] дипломы любой профессии по невысоким ценам. Стоимость будет зависеть от выбранной специальности, года выпуска и ВУЗа. Стараемся поддерживать для заказчиков адекватную ценовую политику.
http://www.konura.info/forum/index.php?topic=32454.0
[b]Удачи![/b]
https://nsdentalsolution.com
https://romashkaclinic.ru
долгосрочная учебная виза испания https://vnzh24.ru/
Discover the journey of Charles Leclerc https://ferrari.charles-leclerc-fr.com, from young Monegasque driver to Ferrari Formula 1 leader, from his early years to his main achievements within the team.
Leroy Sane’s https://bavaria.leroy-sane-ft.com success story at FC Bayern Munich: from adaptation to influence on the club’s results. Inspiration for hard work and professionalism in football.
Discover Pierre Gasly’s https://alpine.pierre-gasly.com journey through the world of Formula 1, from his beginnings with Toro Rosso to his extraordinary achievements with Alpine.
Greetings from California! I’m bored to death at work so I decided to browse your
blog on my iphone during lunch break. I really like the information you provide here and can’t wait to take a look when I get home.
I’m amazed at how quick your blog loaded on my phone ..
I’m not even using WIFI, just 3G .. Anyways, very good site!
From childhood teams to championship victories, the path to success with the Los Angeles Lakers https://los-angeles-lakers.lebron-james-fr.com requires not only talent, but also undeniable dedication and work.
Discover the story of Rudy Gobert https://minnesota-timberwolves.rudy-gobert.biz, the French basketball player whose defensive play and leadership transformed the Minnesota Timberwolves into a powerhouse NBA team.
Follicular unit extraction, invented by Ray Woods who felt the necessity
for a less painful but effective technique to transplant hair.
It is commonly known as FUE transplant which is a tried and examined, minimally invasive technique of grafting
follicles from the scalp to treat hair loss. Follicles are grafted from
the genetically sound portion of an individual’s head as a way to compensate for the
components that lack hair. This process requires
the specialist to graft follicles from these parts of an individual’s head that
are predominantly thick (have extra hair) to the
elements that are skinny i.e. lack density. Therefore, it is incumbent on the affected person to
have an adequate amount of hair prior to this transplant in order to determine the
success of this process and enhance the longevity of the
transplant. FUE hair transplant which is one in all
the most effective strategies often has a a
hundred p.c success fee provided that the hair density of the person is nice.
https://psy-medcentr.ru
[u][b] Привет![/b][/u]
Где приобрести диплом специалиста?
Заказать диплом о высшем образовании.
http://sampcrmrp.1stbb.ru/viewtopic.php?f=117&t=945
[b]Успехов в учебе![/b]
When some one searches for his necessary thing, therefore he/she wants to be available that
in detail, therefore that thing is maintained over here.
Do you have a spam issue on this blog; I also am a blogger, and I was wanting
to know your situation; we have created some nice practices and we are looking to trade
strategies with other folks, please shoot me an e-mail if interested.
1win официальный сайт скачать online [url=https://1win.tr-kazakhstan.kz/]https://1win.tr-kazakhstan.kz/[/url] 1win no deposit bonus https://1win.tr-kazakhstan.kz/
[u][b] Здравствуйте![/b][/u]
Заказать диплом о высшем образовании
[b]Наши специалисты предлагают[/b] быстро и выгодно купить диплом, который выполняется на оригинальном бланке и заверен печатями, штампами, подписями официальных лиц. Наш документ способен пройти любые проверки, даже с применением специальных приборов. Решите свои задачи быстро и просто с нашими дипломами.
[b]Где заказать диплом специалиста?[/b]
http://leadrp.listbb.ru/viewtopic.php?f=3&t=399
[u][b] Рады оказаться полезными![u][b].
[u][b] Привет, друзья![/b][/u]
Где купить диплом по нужной специальности?
Приобрести документ института можно у нас в столице. Мы оказываем услуги по продаже документов об окончании любых ВУЗов России.
[b]Мы предлагаем[/b] дипломы психологов, юристов, экономистов и прочих профессий по выгодным тарифам. Стоимость будет зависеть от выбранной специальности, года получения и университета. Всегда стараемся поддерживать для клиентов адекватную политику цен.
https://vk.com/unikvseru?w=wall414329581_6128
[b]Удачи![/b]
[b]Привет всем[/b])
Студенческая жизнь прекрасна, пока не приходит время писать диплом, как это случилось со мной. Не стоит отчаиваться, ведь существуют компании, которые помогают с написанием и защитой диплома на высокие оценки!
Сначала я искал информацию по теме: купить дипломы о высшем цены, купить диплом врача, купить диплом в ноябрьске, купить свидетельство о заключении брака, купить диплом в серове, а потом наткнулся на http://tdinox.ru/trubnyj-prokat/truba-pryamougolnaya-elektrosvarnaya/truba-pryamougolnaya-nerzhaveyushchaya-matovaya-din-2395-aisi-304-60-x-40-x-6000-x-1-5-mm/, где все мои учебные проблемы были решены!
[b]Успехов в учебе![/b]
[u][b] Добрый день![/b][/u]
Купить диплом о высшем образовании.
Мы предлагаем купить диплом отличного качества, неотличимый от оригинального документа без участия специалиста высокой квалификации с дорогим оборудованием.
[b]Где купить диплом по нужной специальности?[/b]
http://balaklavskiy-16.ru/user/10140/
[b]Успехов в учебе![/b]
[url=https://mounjaro-ozempic.online]трулисити 1.5 цена[/url] – mounjaro купить цена, оземпик продажа
Казино 7к казино предлагает увлекательный игровой опыт с привлекательной графикой и высококачественными игровыми слотами на реальные деньги – [url=https://consmos.ru/]7k casino зеркало[/url]
one of ways is search engine by provider, https://qbet1.com/ – wonderful type of searching for games similar to those that you/already like.
Приветствую. Подскажите, где почитать полезные статьи о недвижимости? Сейчас читаю https://batstroimat24.ru
[b]Здравствуйте[/b]!
Задался вопросом: можно ли на самом деле купить диплом государственного образца в Москве? Был приятно удивлен — это реально и легально!
Сначала искал информацию в интернете на тему: купить диплом инженера строителя, купить диплом строителя, куплю диплом, купить диплом в троицке, купить диплом в уфе и получил базовые знания. В итоге остановился на материале: http://forum.inos.at/viewtopic.php?pid=2108398#p2108398
Успехов в учебе!
Sportsbetting.ag provides the same initial welcome bonus for Bitcoin bettors.
https://novomed-cardio.ru
The story of the Moroccan footballer https://al-hilal.yassine-bounou.com, who became a star at Al-Hilal, traces his journey from the streets of Casablanca to international football stardom and his personal development.
Victor Wembanyama’s travel postcard https://san-antonio-spurs.victor-wembanyama.biz from his career in France to his impact in the NBA with the San Antonio Spurs.
The history of Michael Jordan’s Chicago Bulls https://chicago-bulls.michael-jordan-fr.com extends from his rookie in 1984 to a six-time NBA championship.
1win официальный сайт скачать online [url=https://1win.tr-kazakhstan.kz]1win tr-kazakhstan kz[/url] 1win no deposit bonus https://1win.tr-kazakhstan.kz/
Neymar https://al-hilal.neymar-fr.com at Al-Hilal: his professionalism and talent inspire young people players, taking the club to new heights in Asian football.
Golden State Warriors success story https://golden-state-warriors.stephen-curry-fr.com Stephen Curry: From becoming a leader to creating a basketball dynasty that redefined the game.
[b]Привет всем[/b])
Студенческая жизнь прекрасна, пока не приходит время писать диплом, как это случилось со мной. Не стоит отчаиваться, ведь существуют компании, которые помогают с написанием и защитой диплома на высокие оценки!
Сначала я искал информацию по теме: купить диплом в серове, купить диплом техника, купить диплом высшее, купить диплом массажиста, купить диплом в елабуге, а потом наткнулся на http://topforbaby.ru/product/adameks-koljaska-transf-galaxy-ljulka-imit/reviews/, где все мои учебные проблемы были решены!
Хорошей учебы!
Our task is how to provide readers with secret information about codes and order the best https://fsris.org.rs/news/keydrop-codes-in-romania-2024-best-bonus-codes-up-to-500-eur.html in Poland in the market.
[url=https://pin-up-casino-no.biz]pinup casino[/url]
Plasser innsatsen din hos pinup now – autentisk elite bookmaker
pinup
Секреты долговечности и красоты печей, лучшие практические рекомендации.
В магазине представлены печи, камины и дымоходы на любой вкус и бюджет: [url=https://www.magazin-pechej-kaminov-i-dymohodov.ru/]https://www.magazin-pechej-kaminov-i-dymohodov.ru/[/url] .
[url=https://pin-up-casino-sv.biz]Pinup sv[/url]
Placera ditt spel hos pinup nu – akta reliable bookmaker
Pin up sv
[u][b] Привет![/b][/u]
Купить диплом о высшем образовании.
Мы предлагаем заказать диплом в высочайшем качестве, который невозможно отличить от оригинального документа без использования специального оборудования и квалифицированного специалиста.
[b]Где заказать диплом по актуальной специальности?[/b]
http://mangorpp.getbb.ru/ucp.php?mode=login&sid=7100c5e975a101fc4cb8fe99172ba330
[b]Хорошей учебы![/b]
you are truly a excellent webmaster. The site loading pace is amazing. It sort of feels that you are doing any unique trick. Moreover, The contents are masterwork. you have performed a magnificent task on this subject!
Лучшие казино онлайн
[u][b] Добрый день![/b][/u]
Для многих людей, заказать [b]диплом[/b] ВУЗа – это необходимость, удачный шанс получить хорошую работу. Но для кого-то – это желание не терять время на учебу в универе. Что бы ни толкнуло вас на такой шаг, мы готовы помочь вам. Оперативно, качественно и недорого изготовим документ любого ВУЗа и любого года выпуска на подлинных бланках со всеми требуемыми подписями и печатями.
[b]Наши специалисты предлагают[/b] выгодно заказать диплом, который выполняется на оригинальном бланке и заверен печатями, штампами, подписями должностных лиц. Диплом способен пройти любые проверки, даже с применением профессиональных приборов. Решайте свои задачи быстро с нашими дипломами.
[b]Где заказать диплом специалиста?[/b]
http://belopolye.mybb.sumy.ua/viewtopic.php?id=4137#p8625
[b]Успешной учебы![/b]
[u][b] Здравствуйте![/b][/u]
Купить документ о получении высшего образования можно в нашей компании. Мы оказываем услуги по продаже документов об окончании любых университетов Российской Федерации. Вы получите диплом по любым специальностям, включая документы образца СССР. Гарантируем, что при проверке документов работодателями, никаких подозрений не возникнет.
[b]Наши специалисты предлагают[/b] выгодно и быстро купить диплом, который выполняется на бланке ГОЗНАКа и заверен печатями, штампами, подписями. Документ способен пройти лубую проверку, даже с применением специальных приборов. Решайте свои задачи быстро с нашими дипломами.
[b]Где приобрести диплом специалиста?[/b]
http://www.podzemie.6f.sk/profile.php?lookup=17613
[b]Удачи![/b]
[url=https://pin-up-casino-ar.biz]Pinup ar[/url]
Place your bet at pin up online – direct reliable bookmaker
online casino
[url=https://my.advantech.com/Includes/GetTemplate.ashx?CMSURL=https://pin-up-casino-us.biz/]Pin up[/url]
Place your bet at pinup now – direct reliable bookmaker
Pinup Us
[u][b] Привет![/b][/u]
Где купить диплом специалиста?
[b]Заказать документ[/b] института можно в нашей компании. Мы предлагаем документы об окончании любых ВУЗов РФ. Вы получите необходимый диплом по любым специальностям, любого года выпуска, в том числе документы образца СССР. Гарантируем, что в случае проверки документа работодателем, подозрений не появится.
http://www.sitebs.ru/blogs/95000.html
[b]Хорошей учебы![/b]
Excellent article. Keep posting such kind of info on your page.
Im really impressed by it.
Hi there, You’ve done a great job. I will certainly digg
it and in my view recommend to my friends. I am confident they will be benefited from this website.
[url=https://pin-up-casino-no.biz]pin up casino[/url]
Plasser innsatsen din hos pin up now – veldig elite bookmaker
pin up casino
Всем привет! Может кто знает, где найти разные блоги о недвижимости? Сейчас читаю https://bdrsu-2.ru
[url=https://pin-up-casino-sv.biz]Pinup[/url]
Placera ditt spel hos pin up nu – akta reliable bookmaker
Pinup
[b]Здравствуйте[/b]!
Задумался а действительно можно купить диплом государственного образца в Москве, и был удивлен, все реально и главное официально!
Сначала серфил в сети и искал такие темы как: купить диплом учителя физической культуры, купить диплом в твери, купить диплом в уфе, купить диплом переводчика, купить диплом в кызыле, получил базовую информацию.
Остановился в итоге на материале купить диплом в грозном, https://admtobolsk-new.ru/forum/messages/forum2/topic237/message243/?result=new#message243
Удачи!
1win в Казахстане [url=http://www.1win.tr-kazakhstan.kz]http://www.1win.tr-kazakhstan.kz[/url] **1win** предоставляет разнообразные азартные развлечения, включая слоты, карточные и рулеточные игры, краш-игры, лотереи и многое другое. http://1win.tr-kazakhstan.kz/
[url=https://pin-up-casino-ar.biz]online casino[/url]
Place your bet at pin up online – very prestigious bookmaker
Pinup
[u][b] Здравствуйте![/b][/u]
Купить документ университета вы можете в нашей компании в Москве. Мы оказываем услуги по изготовлению и продаже документов об окончании любых университетов Российской Федерации. Вы сможете получить диплом по любым специальностям, любого года выпуска, в том числе документы образца СССР. Гарантируем, что в случае проверки документов работодателем, подозрений не появится.
[b]Наша компания предлагает[/b] быстро и выгодно приобрести диплом, который выполнен на оригинальном бланке и заверен мокрыми печатями, водяными знаками, подписями. Документ пройдет любые проверки, даже с использованием специального оборудования. Достигайте свои цели быстро с нашими дипломами.
[b]Где купить диплом специалиста?[/b]
http://6gdp.ru/index.php?subaction=userinfo&user=ixolapo
[b]Успешной учебы![/b]
[u][b] Привет![/b][/u]
Где приобрести диплом по актуальной специальности?
[b]Приобрести документ[/b] о получении высшего образования вы сможете в нашем сервисе. Мы предлагаем документы об окончании любых ВУЗов Российской Федерации. Вы получите необходимый диплом по любым специальностям, включая документы СССР. Гарантируем, что при проверке документов работодателем, подозрений не возникнет.
http://ooo-gotovie.ru/index.html
[b]Хорошей учебы![/b]
Del Mar Energy is an international industrial holding company engaged in the extraction of oil, gas, and coal
The story of the great Kobe Bryant https://los-angeles-lakers.kobe-bryant-fr.com with ” Los Angeles Lakers: his path to the championship, his legendary achievements.
The success story of the French footballer https://juventus.thierry-henry.biz at Juventus: from his career at the club to leadership on the field , becoming a legend and a source of inspiration for youth.
Find out the story of Jon Jones https://ufc.jon-jones-fr.biz in the UFC: his triumphs, records and controversies, which made him one of the greatest fighters in the MMA world.
Novak Djokovic’s https://tennis.novak-djokovic-fr.biz journey from childhood to the top of world tennis: early years, first victories, dominance and influence on the sport.
[u][b] Здравствуйте![/b][/u]
Мы готовы предложить дипломы психологов, юристов, экономистов и любых других профессий по приятным тарифам.
Мы предлагаем документы ВУЗов, расположенных на территории всей Российской Федерации. Вы можете купить диплом за любой год, включая сюда документы старого образца. Документы печатаются на “правильной” бумаге высшего качества. Это позволяет делать государственные дипломы, которые не отличить от оригиналов. Документы будут заверены всеми требуемыми печатями и подписями.
[b]Где заказать диплом специалиста?[/b]
[url=http://www.modern-constructions.org/blogs/44177/Дипломы-высочайшего-качества-ваш-шаг-к-профессиональному-росту]www.modern-constructions.org/blogs/44177/Дипломы-высочайшего-качества-ваш-шаг-к-профессиональному-росту[/url]
где купить диплом [url=https://ast-diplomas.com/]где купить диплом[/url] .
Относительно [url=https://exci.ru/eyesight/astigmatism/]астигматизм[/url] мы Вам поможем. У нас большой выбор услуг: метод коррекции зрения суперласик, методика проведения операции ФРК, оперативное лечение глакуомы, операция склеропластика, блефаропластика, безоперационная блефаропластика аппаратом JETT PLASMA LIFT и многие другие. Обратитесь за квалифицированной помощью к нашим специалистам.
Hey there! I just wanted to ask if you ever have any problems with hackers?
My last blog (wordpress) was hacked and I ended up losing several weeks of hard work due to no backup.
Do you have any methods to prevent hackers?
купить диплом в кинешме [url=http://diploms-x.com]http://diploms-x.com[/url] .
https://www.wildberries.ru/catalog/217171028/detail.aspx
I’m not sure why but this web site is loading extremely slow for me.
Is anyone else having this issue or is it a issue on my end?
I’ll check back later and see if the problem still
exists.
ваучеры 1win 2023 [url=https://1win.tr-kazakhstan.kz]https://1win.tr-kazakhstan.kz/[/url] 1win бесплатно официальное приложение http://www.1win.tr-kazakhstan.kz
Всем привет! Подскажите, где почитать разные блоги о недвижимости? Сейчас читаю https://centro-kraska.ru
[u][b] Привет![/b][/u]
Где заказать диплом специалиста?
[b]Купить документ[/b] о получении высшего образования вы можете в нашей компании в Москве. Мы оказываем услуги по продаже документов об окончании любых университетов России. Вы получите диплом по любой специальности, любого года выпуска, включая документы старого образца. Даем 100% гарантию, что в случае проверки документа работодателем, подозрений не появится.
http://igrimachklas.blogspot.com/2017/04/blog-post_10.html
[b]Успешной учебы![/b]
Кафе бистро Ижевск bistroyar.ru
Приглашаем Вас в данное bistroyar.ru бистро, где можно не только оперативно и аппетитно перекусить, а также провести семейное мероприятие, сделать заказ с доставкой, усладиться вкуснейшей кухней и побаловать себя вкусностями.
Бистро «ЯР» расположено по адресу г. Ижевск, ул. Максима Горького, д. 163. График работы с 10:00 до 20:00 каждый день. Приходите к нам или оформляйте заказ с доставкой и наслаждайтесь блюдами разной кухни в привычной для себя атмосфере.
По вопросу [url=https://bistroyar.ru/]заказать готовую еду[/url] вы на верном пути. Тут можно мгновенно заказать еду с доставкой. Заходите в наше меню на веб портале bistroyar.ru и отправляйте необходимые блюда в корзину. Далее определите способ доставки или самовывоз, что более удобно для Вас. Если Вы желаете получить дома заказ, то естественно указывайте достоверный адрес и контактный телефон.
Если Вы планировали найти [url=https://bistroyar.ru/]где заказать готовую еду на дом[/url] сейчас, то мы Вам готовы помочь. Наш девиз – «хорошо, как дома», ведь мы приготавливаем еду от души, что многие гости подчеркнули. По возникшим вопросам звоните по контактному телефону +7(3412)223-230 или оставляйте заявку на сайте. Обязательно попробуйте наши десерты и супы, возможно, вкуснее было только у мамы дома.
[u][b] Здравствуйте![/b][/u]
Мы предлагаем дипломы любой профессии по разумным ценам. Цена зависит от выбранной специальности, года получения и ВУЗа.
Где заказать диплом специалиста?
[b]Купить диплом любого ВУЗа[/b]
https://arusak-diploms-srednee.ru/kupit-diplom-v-omske
[b]Успехов в учебе![/b]
[u][b] Привет![/b][/u]
Мы предлагаем дипломы психологов, юристов, экономистов и любых других профессий по приятным тарифам.
Мы предлагаем документы ВУЗов, которые расположены в любом регионе РФ. Вы имеете возможность купить диплом за любой год, указав подходящую специальность и хорошие оценки за все дисциплины. Дипломы и аттестаты выпускаются на бумаге высшего качества. Это дает возможности делать государственные дипломы, которые невозможно отличить от оригинала. Документы заверяются всеми необходимыми печатями и подписями.
Гарантируем, что при проверке документов работодателем, подозрений не появится.
[b]Где заказать диплом по нужной специальности?[/b]
[url=http://www.rkiyosaki.ru/people.php?ReturnUrl=rkiyosaki.ru/post/category/5/]forumkasino.bestff.ru/viewtopic.php?id=3245#p8020[/url]
Incredible points. Sound arguments. Keep up
the good spirit.
Я не могла представить свою жизнь без сигарет, но ‘Как бросить курить легко’ показала мне, что я сильнее своей зависимости. Эта книга – настоящий источник мотивации и поддержки. Теперь я свободна от курения уже восемь месяцев и это чудесное ощущение!
https://www.litres.ru/book/evgeniy-poplevin/kak-brosit-kurit-legko-12-shagov-k-osvobozhdeniu-70766383/
https://www.wildberries.ru/catalog/217171028/detail.aspx/
Check This Out
[url=https://puerto-lopez.com/ru/]пляж[/url]
купить диплом о среднем образовании в казани [url=https://ast-diplomas.com/]ast-diplomas.com[/url] .
На главной странице сайта casino можно найти информацию о Казино 7к казино – [url=https://madridpark2.ru/]r7 casino без регистрации[/url]
купить диплом ссср в иркутске [url=www.diploms-x.com]www.diploms-x.com[/url] .
Приветствую. Подскажите, где найти полезные статьи о недвижимости? Сейчас читаю https://cvetkrovli.ru
У меня есть разнообразные способы пополнения счета в казино 7k casino – [url=https://p993.ru/]сегодня зеркало r7 casino[/url]
Букмекерская контора 7к казино предлагает обширную коллекцию качественных игровых слотов – [url=https://artdesign-yar.ru/]7к казино работающее зеркало[/url]
Незаконные действия мошенников онлайн могут повлиять на Игровой аппарат – [url=https://alex979.ru/]7k casino актуальное рабочее на сегодня[/url]
https://volnodumie.bbmy.ru/viewtopic.php?id=12424#p25270
I think this is one of the most significant information for me.
And i’m glad reading your article. But want to remark on few
general things, The site style is ideal, the articles is
really nice : D. Good job, cheers
[u][b] Добрый день![/b][/u]
Где купить диплом по необходимой специальности?
Мы можем предложить документы техникумов, которые расположены на территории всей РФ. Они будут заверены необходимыми печатями и подписями.
Купить диплом любого университета:
https://forum-otzyvov.ru/threads/kak-podobrat-nadezhnyj-i-proverennyj-internet-magazin-s-diplomami.310732/
whoah this weblog is great i like reading your articles. Stay
up the good work! You already know, many individuals are hunting
around for this information, you can help them greatly.
купить диплом фармацевта москва [url=www.diploms-x.com]www.diploms-x.com[/url] .
Алтайский центр природного камня предлагает уникальную возможность приобрести глыбы со мхом и лишайником по самым выгодным ценам. Сэкономим ваши деньги! Выполняем доставку. Гарантируем великолепное обслуживание. Вы можете в этом удостовериться лично. Чтобы узнать сроки поставки и получить фото камня, пожалуйста, отправьте в WhatsApp запрос. Ищете валуны скальные глыбы купить со мхом? Altdikam.ru – портал, мы регулярно работаем над его улучшением. Здесь все наглядно и ясно. Если у вас возникли какие-то вопросы, свяжитесь с нами по телефону. С удовольствием вам поможем!
7к казино гарантирует надежную защиту от незаконных действий и мошенничества в онлайн сфере – [url=https://hd-human.ru/]r7 casino официальный регистрация[/url]
разработка и создание сайтов под ключ
https://subscribe.ru/author/25924851/group/records/?page=53
скачать официальный сайт 1win [url=https://1win.tr-kazakhstan.kz/]https://1win.tr-kazakhstan.kz/[/url] нужна ли верификация на 1win 1win.tr-kazakhstan.kz
Excellent goods from you, man. I have consider your stuff prior to and you are simply too great.
I actually like what you’ve received right here, really like what you are saying and the best way in which you assert it.
You are making it enjoyable and you continue to take care of to stay it smart.
I can’t wait to read far more from you. That is really a
tremendous site.
https://akkred-med.ru
Ищете быстрый способ загрузки файлов? Попробуйте Mediaget! https://skachat-mediaget-plus.ru Этот торрент-клиент оптимизирован для максимальной производительности.
медиа джет скачать
медиагет скачать на пк
медиа гет скачать
Приветствую. Подскажите, где почитать полезные статьи о недвижимости? Сейчас читаю https://deon-stroy.ru
Чтобы реализовать [url=https://exci.ru/methods/Lasik/]лазерная коррекция зрения ласик[/url] приходите к нам. Мы находимся по адресу г. Ижевск, ул. Ленина, д. 101. Время работы с понедельника по пятницу с 9:00 до 16:00, после 16:00 можно прийти, заранее записавшись или по выходным.
Недорогой частный эротический массаж в Казани телефон
[b]Всем привет[/b])
Будучи студентом, я наслаждался учебой до тех пор, пока не пришло время писать диплом. Но паниковать не стоило, ведь существуют компании, которые помогают с написанием и защитой диплома на отличные оценки!
Изначально я искал информацию по теме: купить диплом бакалавра, купить аттестат за классов, купить диплом в когалыме, купить диплом слесаря, купить диплом электромонтажника, затем наткнулся на https://wiki.mysupp.ru/index.php?title=originalitydiplomiki, где все мои учебные вопросы были решены!
Хорошей учебы!
3 м скотч двухсторонний
Excellent blog here! Additionally your site quite
a bit up very fast! What web host are you the usage of? Can I am getting your affiliate link for your host?
I wish my web site loaded up as quickly as yours lol
[u][b] Привет![/b][/u]
Где заказать диплом специалиста?
Купить документ о получении высшего образования вы можете в нашей компании в Москве. Мы предлагаем документы об окончании любых ВУЗов Российской Федерации.
[b]Мы готовы предложить[/b] дипломы любой профессии по выгодным тарифам. Цена зависит от выбранной специальности, года получения и университета. Стараемся поддерживать для покупателей адекватную политику тарифов.
http://thesims2thebest.0pk.me/viewtopic.php?id=727#p1300
[b]Хорошей учебы![/b]
площадка для инвесторов в стартапы
платформа для инвестирования
нужен ремонт квартир под ключ
Наше казино Марафонбет предлагает захватывающий игровой опыт с привлекательной графикой и высоким качеством игровых слотов на реальные деньги, чтобы удовлетворить даже самые взыскательные вкусы – [url=https://blackwood4you.ru/]букмекерская контора Марафон[/url]
polaroid film cost prettyface moviemovie the wipers timesold gangster moviesjojo rabbit full movie bilibili
разработка сайтов под ключ
We decided to carry out two research to discover this gender circumstance.
My page :: https://scapeacademy.com/blog/index.php?entryid=53124
pop over to this web-site
[url=https://programasyapk.com/noticias.html]la Tri[/url]
этот контент https://battlepass.ru/service/honkai
[b]Здравствуйте[/b]!
Хочу рассказать о своем опыте по заказу аттестата пту, думал это не реально и стал искать информацию в сети, про купить диплом в липецке, купить диплом института, купить диплом врача, купить диплом колледжа, купить диплом хореографа, постепенно вникая в суть дела нашел отличный материал здесь http://scientistsufo.ru/kupite-nastoyashhiy-diplom-po-dostupnoy-tsene и был очень доволен!
Теперь у меня есть диплом столяра о среднем специальном образовании, и я обеспечен на всю жизнь)
Успешной учебы!
Carlos Alcaraz https://tennis.carlos-alcaraz-fr.biz from a talented junior to the ATP top 10. His rise is the result of hard work, support and impressive victories at major world tournaments.
Jannik Sinner https://tennis.jannik-sinner-fr.biz an Italian tennis player, went from starting his career to entering the top 10 of the ATP, demonstrating unique abilities and ambitions in world tennis.
Discover Casper Ruud’s https://tennis.casper-ruud-fr.com journey from his Challenger debut to the top 10 of the world tennis rankings. A unique success.
The fascinating story of Daniil Medvedev’s https://tennis.daniil-medvedev-fr.biz rise to world number one. Find out how a Russian tennis player quickly broke into the elite and conquered the tennis Olympus.
The fascinating story of Alexander Zverev’s https://tennis.alexander-zverev-fr.biz rapid rise from a junior star to one of the leaders of modern tennis.
[b]Привет Друзья[/b]!
Всегда думал что купить диплом о высшем образовании это миф и нереально, но все оказалось не так, изначально искал информацию про: купить диплом в королёве, купить диплом психолога, купить диплом в муроме, купить диплом в тобольске, купить диплом логиста, потом про дипломы вузов, подробнее здесь https://subaru-vlad.ru/forums/users/yvofyqa/
Оказалось все возможно, официально со специальными условия по упрощенным программам, так и сделал и теперь у меня есть диплом вуза Москвы нового образца, что советую и вам!
Успехов в учебе!
платформа для инвесторов
Hey would you mind stating which blog platform you’re working with?
I’m going to start my own blog soon but I’m having a hard time choosing between BlogEngine/Wordpress/B2evolution and Drupal.
The reason I ask is because your layout seems different then most blogs and
I’m looking for something unique. P.S
Sorry for being off-topic but I had to ask!
[u][b] Добрый день![/b][/u]
Где заказать диплом по необходимой специальности?
Купить документ ВУЗа вы имеете возможность в нашей компании в Москве. Мы предлагаем документы об окончании любых ВУЗов России.
[b]Мы изготавливаем[/b] дипломы психологов, юристов, экономистов и других профессий по доступным ценам. Цена может зависеть от конкретной специальности, года получения и образовательного учреждения. Стараемся поддерживать для клиентов адекватную ценовую политику.
https://rostov-na-donu.cataloxy.ru/board/b388272563-hotite-kupit-diplom-o-vysshem-obrazovanii.htm
[b]Успехов в учебе![/b]
площадки для инвестирования
https://aspectremont.com/
Обзор официального сайта букмекерской конторы 7к казино содержит полезную информацию и детальное описание – [url=https://breakandspeak.ru/]р7 казино бонус за регистрацию в[/url]
1win скачать на телефон [url=http://1win.tr-kazakhstan.kz]http://1win.tr-kazakhstan.kz/[/url] 1win регистрация скачать 1win tr-kazakhstan kz
Hi,
What a nice post!
Is it okay I scrape it and share this with my community members?
My group is about Korean 놀쟈
If your interested, feel free to come to my channel and check it out.
Thank you and Keep up the good work!
[u][b] Добрый день![/b][/u]
Где купить диплом специалиста?
Мы можем предложить документы ВУЗов, расположенных в любом регионе России. Вы сможете купить диплом за любой год, указав необходимую специальность и хорошие оценки за все дисциплины. Дипломы делаются на бумаге самого высокого качества. Это дает возможности делать настоящие дипломы, которые не отличить от оригинала. Документы будут заверены всеми требуемыми печатями и штампами.
[b]Мы изготавливаем дипломы[/b] любой профессии по выгодным тарифам.
https://diplomasx24.ru/kupit-diplom-omsk
[u][b] Рады оказать помощь![u][b]
Казино 7k casino предлагает разнообразные варианты игр на столах с живыми дилерами – [url=https://energywish.ru/]р7 казино рабочее на сегодня[/url]
Приветствую. Может кто знает, где почитать разные блоги о недвижимости? Пока нашел https://dom-vasilevo.ru
Здравствуйте!
Моя жена давно мечтает о новой кухне, но покупка такой мебели обходится слишком дорого. Мы решили попробовать сделать кухню своими руками, чтобы сэкономить.
Я нашёл пост, в котором описан метод создания мебели своими силами. Автор утверждает, что его метод позволяет существенно сэкономить и избавиться от головной боли. Вот ссылка на этот пост: https://dzen.ru/a/Zo-hWHOX_FmaBP7S
Суть метода в том, чтобы заказать комплектующие для мебели, собрать их самостоятельно и таким образом сэкономить деньги. Однако у меня остаются сомнения: насколько это реально?
Я пересмотрел множество сайтов, где можно заказать распиловку деталей и фасады для кухни. Но сомнения всё ещё остаются. Может быть, кто-то из вас уже делал кухонную мебель своими руками и может оценить описанную методику?
Я уверен, что у меня получится, так как я умею работать руками и владею компьютером. Пожалуйста, помогите мне принять решение: вдохните в меня уверенность или отговорите от этой затеи.
[url=https://dzen.ru/a/Zo-hWHOX_FmaBP7S]проектирование кухни самостоятельно[/url]
гардеробная комната маленькая своими руками
мебель в кабинет своими руками
мебель в детскую своими руками
Спасибо!
В сфере азартных игр в интернете особенно важны аспекты защиты данных и обеспечения надежности операций. Это ключевые аспекты, на которых строятся доверие игроков и успешная работа платформ [url=https://forum.theabyss.ru/index.php?showtopic=739830]https://forum.theabyss.ru/index.php?showtopic=739830[/url]
Great post. I used to be checking constantly this weblog and I’m inspired!
Very useful information specifically the last part 🙂 I deal
with such info a lot. I used to be looking for this certain information for a very long time.
Thanks and best of luck.
[url=https://kurs-obuchenie.ru/figma]Курсы по Figma (Фигма)[/url] – Курсы Ландшафтного дизайна, Курсы Системного администрирования
Copy trading bots and Smart terminal
Create or copy top-performing bots with a fair
profit-sharing and automate powerful trading positions
with Smart Terminal.
ltc to usd
Обзор официального сайта букмекерской конторы 7к казино содержит полезную информацию – [url=https://lux-vanna.ru/]7k casino игровые автоматы[/url]
опубликовано здесь [url=https://bitcoin24.su]обменник крипты[/url]
[u][b] Здравствуйте![/b][/u]
Для некоторых людей, заказать [b]диплом[/b] университета – это необходимость, уникальный шанс получить достойную работу. Впрочем для кого-то – это банальное желание не терять время на учебу в университете. Что бы ни толкнуло вас на такой шаг, мы готовы помочь вам. Оперативно, качественно и недорого сделаем диплом любого ВУЗа и любого года выпуска на подлинных бланках со всеми требуемыми подписями и печатями.
[b]Наши специалисты предлагают[/b] выгодно и быстро заказать диплом, который выполнен на оригинальном бланке и заверен мокрыми печатями, штампами, подписями. Документ пройдет любые проверки, даже при использовании профессионального оборудования. Решайте свои задачи быстро и просто с нашей компанией.
[b]Где заказать диплом по необходимой специальности?[/b]
http://www.odnopolchane.net/forum/member.php?u=546804
[b]Удачи![/b]
Meet AI Binance trading bot
Quickstart your trading journey with AI-driven Dollar Cost
Averaging bot, designed for sustainable low-risk growth
over the long term.
trading bot
[b]Привет всем[/b])
Хорошо быть студентом, пока не придет пора писать диплом, что и произошло со мной, но не стоит отчаиваться, ведь есть хорошие компании что помогают с написанием и сдачей диплома на хорошие оценки!
Изначально искал информацию про купить диплом слесаря, купить диплом в донском, купить диплом во владикавказе, купить диплом в барнауле, купить диплом медсестры, потом попал на http://xn--m1acg6c.xn--p1ai/index.php?subaction=userinfo&user=axynu и там решили все мои учебные заботы!
Успешной учебы!
Бельё для женщин включая женские майки и топы любых размеров, типов и фасонов. https://incanto.com.ua/mayki-zhenskiye – трусики и бюстгальтеры, удобное и мягкое в любое время доступно в каталоге. Утонченным женщинам хочется чувствовать себя уверенной в себе. Изделия высочайшего качества помогут воплотить это в жизнь и помочь стать неотразимой. Среди разновидностей нательных творений – лифчики push-up и балконет, мягкие и полумягкие, для сорта и дома, привлекательные трусики макси, миди и слипы, игривые бразилиана и открытые стринги, визуально сглаживающие фигуру. Роскошный и натуральный женского нижнего белья и конечно трусики стринги и бразильянки – хороший способ подчеркнуть свои достоинства, стать увереннее, почувствовать себя модной и современной. В сфере женского нижнего белья значатся модные тренды и тенденции, которые постоянно меняются, адаптируясь под ожидания женщин. Предлагаем прояснить, что будет примагничивать ваше внимание в текущем году.
[u][b] Привет![/b][/u]
Где заказать диплом по необходимой специальности?
[b]Заказать документ[/b] о получении высшего образования вы можете у нас в столице. Мы оказываем услуги по производству и продаже документов об окончании любых ВУЗов Российской Федерации. Вы получите диплом по любым специальностям, включая документы образца СССР. Даем гарантию, что при проверке документов работодателем, подозрений не возникнет.
http://winemastery.com.vn/giong-nho/garnacha-tintorera
[b]Успехов в учебе![/b]
Академии KRAKEN
Данный раздел посвящен образовательным проектам площадки KRAKEN. Здесь вы сможете ознакомиться с нашими сервисами, их услугами, а также различной полезной информацией. Мы предоставляем нашим пользователям не только возможность купли-продажи запрещенных веществ, мы предоставляем возможность стать частью комьюнити настоящих профессионалов, частью комьюнити — Академии KRAKEN!
Актуальные ссылки на площадку
КЛИР: (браузер+впн)
—
Kraken18att.ru
ТОР: (впн+тор)
— kraken2trfqodidvlh4aa337cpzfrhdlfldhve5nf7njhumwr7instad.onion
Зайти на Kraken
This web site definitely has all of the
info I needed concerning this subject and didn’t know who to ask.
Казино 7к казино предлагает захватывающий игровой опыт с превосходной графикой и высококачественными игровыми слотами на реальные деньги, чтобы удовлетворить все ваши игровые предпочтения и желания – [url=https://pinistore.ru/]работающее зеркало 7k casino[/url]
[u][b] Добрый день![/b][/u]
Где приобрести диплом специалиста?
Заказать диплом ВУЗа.
https://www.princeton.com.cn/home.php?mod=space&uid=74669&do=profile&from=space
[u][b] Рады оказаться полезными![u][b]
диплом южной осетии купить [url=https://ast-diplomas.com/]ast-diplomas.com[/url] .
[u][b] Добрый день![/b][/u]
Мы изготавливаем дипломы психологов, юристов, экономистов и других профессий по доступным ценам. Стоимость может зависеть от выбранной специальности, года выпуска и образовательного учреждения.
Где купить диплом специалиста?
[b]Приобрести диплом о высшем образовании[/b]
https://landik-diploms-srednee.ru/kupit-diplom-v-omske
[b]Успешной учебы![/b]
Mediaget – это не просто торрент-клиент. Он также включает каталог контента и рекомендации. Исследуйте возможности: https://skachat-mediaget-online.ru
медиа джет скачать
mediaget скачать на пк
медиагет
[u][b] Привет, друзья![/b][/u]
Где заказать диплом по нужной специальности?
[b]Заказать документ[/b] ВУЗа можно у нас. Мы оказываем услуги по продаже документов об окончании любых университетов Российской Федерации. Вы сможете получить необходимый диплом по любым специальностям, любого года выпуска, включая документы СССР. Гарантируем, что при проверке документов работодателями, никаких подозрений не возникнет.
http://myarabis.ru/blog/mbui-dramaticheskij-teatr-g-tynda/
[b]Хорошей учебы![/b]
[u][b] Привет, друзья![/b][/u]
Купить диплом университета.
Наша компания предлагает приобрести диплом в высоком качестве, неотличимый от оригинала без использования специального оборудования и квалифицированного специалиста.
[b]Где приобрести диплом специалиста?[/b]
http://drahthaar-forum.ru/viewtopic.php?f=30&t=10809&sid=3b97a5412b0b27601da4ff2fdefc5794
[b]Успехов в учебе![/b]
I every time used to study piece of writing in news
papers but now as I am a user of net so from now I am using net for content, thanks
to web.
nettruyen
NetTruyen ZZZ: Nền tảng đọc truyện tranh trực tuyến dành cho mọi lứa tuổi
NetTruyen ZZZ là nền tảng đọc truyện tranh trực tuyến miễn phí với số lượng truyện tranh lên đến hơn 30.000 đầu truyện với chất lượng hình ảnh và tốc độ tải cao. Nền tảng được xây dựng với mục tiêu mang đến cho người đọc những trải nghiệm đọc truyện tranh tốt nhất, đồng thời tạo dựng cộng đồng yêu thích truyện tranh sôi động và gắn kết với hơn 11 triệu thành viên (tính đến tháng 7 năm 2024).
NetTruyen ZZZ – Kho tàng truyện tranh phong phú:
NetTruyen ZZZ sở hữu kho tàng truyện tranh khổng lồ với hơn 30.000 đầu truyện thuộc nhiều thể loại khác nhau như:
● Manga: Những bộ truyện tranh Nhật Bản với nhiều thể loại phong phú như lãng mạn, hành động, hài hước, v.v.
● NetTruyen anime: Hàng ngàn bộ truyện tranh anime chọn lọc được đăng tải đều đặn trên NetTruyen ZZZ được chuyển thể từ phim hoạt hình Nhật Bản với nội dung hấp dẫn và hình ảnh đẹp mắt.
● Truyện manga: Hơn 10.000 bộ truyện tranh manga hay nhất được đăng tải đầy đủ trên NetTruyen ZZZ.
● Truyện manhua: Hơn 5000 bộ truyện tranh manhua được đăng tải trọn bộ đầy đủ trên NetTruyen ZZZ.
● Truyện manhwa: Những bộ truyện tranh manhwa Hàn Quốc được yêu thích nhất có đầy đủ trên NetTruyen với cốt truyện lôi cuốn và hình ảnh bắt mắt cùng với nét vẽ độc đáo và nội dung đa dạng.
● Truyện ngôn tình: Những câu chuyện tình yêu lãng mạn, ngọt ngào và đầy cảm xúc.
● Truyện trinh thám: Những câu chuyện ly kỳ, bí ẩn và đầy lôi cuốn xoay quanh các vụ án và quá trình phá án.
● Truyện tranh xuyên không: Những câu chuyện về những nhân vật du hành thời gian hoặc không gian đến một thế giới khác.
NetTruyen ZZZ không ngừng cập nhật những bộ truyện tranh mới nhất và hot nhất trên thị trường, đảm bảo mang đến cho bạn đọc những trải nghiệm đọc truyện mới mẻ và thú vị nhất.
Chất lượng hình ảnh và nội dung đỉnh cao tại NetTruyenZZZ:
Với hơn 30 triệu lượt truy cập hằng tháng, NetTruyen ZZZ luôn chú trọng vào chất lượng hình ảnh và nội dung của các bộ truyện tranh được đăng tải trên nền tảng. Hình ảnh được hiển thị sắc nét, rõ ràng, không bị mờ hay vỡ ảnh. Nội dung được dịch thuật chính xác, dễ hiểu và giữ nguyên vẹn ý nghĩa của tác phẩm gốc.
NetTruyen ZZZ hợp tác với đội ngũ dịch giả và biên tập viên chuyên nghiệp, giàu kinh nghiệm để đảm bảo chất lượng bản dịch tốt nhất. Nền tảng cũng có hệ thống kiểm duyệt nội dung nghiêm ngặt để đảm bảo nội dung lành mạnh, phù hợp với mọi lứa tuổi.
Trải nghiệm đọc truyện mượt mà, tiện lợi:
NetTruyen ZZZ được thiết kế với giao diện đẹp mắt, thân thiện với người dùng và dễ dàng sử dụng. Bạn đọc có thể đọc truyện tranh trên mọi thiết bị, từ máy tính, điện thoại thông minh đến máy tính bảng. Nền tảng cũng cung cấp nhiều tính năng tiện lợi như:
● Tìm kiếm truyện tranh theo tên, tác giả, thể loại, v.v.
● Lưu truyện tranh yêu thích để đọc sau.
● Đánh dấu trang để dễ dàng quay lại vị trí đang đọc.
● Chia sẻ truyện tranh với bạn bè.
● Tham gia bình luận và thảo luận về truyện tranh.
NetTruyen ZZZ luôn nỗ lực để mang đến cho bạn đọc những trải nghiệm đọc truyện mượt mà, tiện lợi và thú vị nhất.
Định hướng phát triển:
NetTruyen ZZZ cam kết không ngừng phát triển và hoàn thiện để trở thành nền tảng đọc truyện tranh trực tuyến tốt nhất dành cho bạn đọc tại Việt Nam. Nền tảng sẽ tiếp tục cập nhật những bộ truyện tranh mới nhất và hot nhất trên thị trường thế giới, đồng thời nâng cao chất lượng hình ảnh và nội dung. NetTruyen ZZZ cũng sẽ phát triển thêm nhiều tính năng mới để mang đến cho bạn đọc những trải nghiệm đọc truyện tốt nhất.
NetTruyen ZZZ luôn đặt lợi ích của bạn đọc lên hàng đầu. Nền tảng cam kết:
● Cung cấp kho tàng truyện tranh khổng lồ và đa dạng với chất lượng hình ảnh và nội dung đỉnh cao.
● Mang đến cho bạn đọc những trải nghiệm đọc truyện mượt mà, tiện lợi và thú vị nhất.
● Luôn lắng nghe ý kiến phản hồi của bạn đọc và không ngừng cải thiện để mang đến dịch vụ tốt nhất.
NetTruyen ZZZ hy vọng sẽ trở thành người bạn đồng hành không thể thiếu của bạn trong hành trình khám phá thế giới truyện tranh đầy màu sắc.
Kết nối với NetTruyen ZZZ ngay hôm nay để tận hưởng những trải nghiệm đọc truyện tuyệt vời.
[u][b] Добрый день![/b][/u]
Мы изготавливаем дипломы любой профессии по приятным ценам.
Мы можем предложить документы техникумов, расположенных в любом регионе России. Вы можете приобрести диплом за любой год, указав актуальную специальность и хорошие оценки за все дисциплины. Документы выпускаются на бумаге самого высокого качества. Это дает возможность делать настоящие дипломы, которые не отличить от оригиналов. Они заверяются необходимыми печатями и штампами.
Гарантируем, что в случае проверки документа работодателем, никаких подозрений не возникнет.
[b]Где купить диплом по актуальной специальности?[/b]
[url=http://www.pride-39.ru/index.php?links_exchange=yes]www.rrsclub.ru/member.php?u=1164[/url]
Казино 7k casino, основанное в 2023 году, мгновенно привлекло внимание азартных игроков своим качеством и разнообразием услуг, возглавляя рейтинг – [url=https://olgalintsova.ru/]работающее зеркало страницы 7k casino[/url]
After eight days of fighting for the destroyed https://bitcoin-casino.win/ building, Freyberg decided that the price was too high, and commanded his troops to stop the offensive.
[u][b] Привет![/b][/u]
Где заказать диплом специалиста?
Мы готовы предложить документы техникумов, которые расположены на территории всей Российской Федерации. Документы заверяются всеми требуемыми печатями и штампами.
Приобрести диплом ВУЗа:
https://gregorytxzbc.sasugawiki.com/6359761/????????_??????_????????
[u][b] Здравствуйте![/b][/u]
Где приобрести диплом специалиста?
[b]Заказать документ[/b] о получении высшего образования можно в нашей компании в столице. Мы предлагаем документы об окончании любых ВУЗов России. Вы сможете получить диплом по любой специальности, любого года выпуска, в том числе документы Советского Союза. Гарантируем, что в случае проверки документа работодателем, никаких подозрений не возникнет.
http://web.symbol.rs/forum/member.php?action=profile&uid=590558
[b]Успехов в учебе![/b]
На сайте https://geo-gdz.ru/ представлены ГДЗ по географии, истории. Перед вами огромная библиотека, которая работает в режиме реального времени. Здесь вы найдете школьные учебники, контурные карты, а также атласы, которые помогут получить новые знания, освоить нужную дисциплину. Список всей важной и нужной информации находится прямо на страницах сайта. Каждый год вносятся изменения в соответствии с политическими действиями. Этот сайт предназначен специально для тех, кто не в курсе этих изменений, но стремится расширить свой уровень знаний.
Explore Iceland in 3 days with a curated itinerary. Discover Reykjavik’s charm,
delve into wilderness adventures, savor Icelandic cuisine, and immerse in cultural treasures.
Learn weather conditions, driving laws, and full packing lists.
Book your Icelandic adventure now!
Информация о Риобет и его предложениях размещена на главной странице игрового портала – [url=https://elenafit.ru/]рабочее страницы Riobet[/url]
Hey there! This post could not be written any better!
Reading this post reminds me of my good old room mate!
He always kept talking about this. I will forward
this article to him. Fairly certain he will have
a good read. Many thanks for sharing!
[u][b] Привет![/b][/u]
Где приобрести диплом по нужной специальности?
[b]Мы можем предложить документы ВУЗов,[/b] которые находятся на территории всей Российской Федерации. Можно заказать качественный диплом за любой год, указав подходящую специальность и оценки за все дисциплины. Дипломы и аттестаты печатаются на бумаге высшего качества. Это дает возможности делать настоящие дипломы, которые невозможно отличить от оригиналов. Документы заверяются необходимыми печатями и штампами.
[url=http://la-buket.ru/catalog/?ELEMENT_ID=50&SECTION_ID=2]la-buket.ru/catalog/?ELEMENT_ID=50&SECTION_ID=2[/url]
The legendary boxing world champion Mike Tyson https://ufc.mike-tyson-fr.biz made an unexpected transition to the UFC in 2024, where he rose to the top, becoming the oldest heavyweight champion.
The powerful story of Conor McGregor’s https://ufc.conor-mcgregor-fr.biz rise to a two-division UFC championship that forever changed the landscape of mixed martial arts.
The fascinating story of the creation and rapid growth of Facebook https://facebook.mark-zuckerberg-fr.biz under the leadership of Mark Zuckerberg, who became one of the most influential technology entrepreneurs of our time.
The fascinating story of how Lewis Hamilton https://mercedes.lewis-hamilton-fr.biz became a seven-time Formula 1 world champion after signing with Mercedes.
The story of Fernando Alonso https://formula-1.fernando-alonso-fr.com in Formula 1: a unique path to success through talent, tenacity and strategic decisions, inspiring and exciting.
Your way of describing all in this piece of writing is truly nice, every
one can without difficulty know it, Thanks a lot.
every year 4.5% of the total number of tokens is compiled as remuneration. betting https://water-coin.wtf/ watercoin is wonderful way to earn a reward by making your contribution to a good cause.
1win – относительно Молодое виртуальное казино, которое принадлежит компании MFI investments. В перечень предлагаемых услуг входят: ставки на спорт, киберспорт, тв программы, а также подборка совершенных игровых автоматов и присоединение к игровым столам с картами [url=http://travelsingh.com/index.php?option=com_k2&view=itemlist&task=user&id=276307]http://travelsingh.com/index.php?option=com_k2&view=itemlist&task=user&id=276307[/url]
I’m gone to inform my little brother, that he should also pay a quick visit this
weblog on regular basis to get updated from hottest reports.
It’s appropriate time to make some plans for the long run and it is time to be happy.
I’ve learn this submit and if I may I wish to recommend
you few fascinating issues or advice. Perhaps you could write next
articles referring to this article. I desire to
learn more things about it!
Hello, I read your blogs regularly. Your writing style
is witty, keep up the good work!
Very nice post. I just stumbled upon your blog and wished to say
that I have truly enjoyed browsing your blog posts. In any case I will be subscribing
to your rss feed and I hope you write again very soon!
I am truly pleased to glance at this web site posts which consists of tons of useful information, thanks for providing these
kinds of information.
Обзор нашего официального сайта букмекерской конторы Риобет предоставляет полную информацию, чтобы вы могли ознакомиться со всеми аспектами нашего захватывающего игрового опыта – [url=https://steel-tramp.ru/]Riobet работающее зеркало[/url]
[u][b] Здравствуйте![/b][/u]
Где купить диплом по актуальной специальности?
Мы предлагаем документы институтов, расположенных в любом регионе РФ. Можно купить диплом за любой год, указав подходящую специальность и оценки за все дисциплины. Дипломы делаются на бумаге высшего качества. Это дает возможности делать государственные дипломы, которые невозможно отличить от оригиналов. Документы будут заверены необходимыми печатями и штампами.
[b]Мы можем предложить дипломы[/b] любой профессии по доступным ценам.
https://asxdiplomik.com/kupit-diplom-s-registraciej
[u][b] Рады оказаться полезными![u][b]
Привет всем!
Ищу совет от тех, кто уже практиковал изготовление мебели своими руками.
Наткнулся на пост с обещанием проверенного метода создания стильной и надежной мебели собственными силами. Автор обещает возможность существенной экономии и избавление от головной боли для новичков. Пост доступен здесь: https://dzen.ru/a/Zo-hWHOX_FmaBP7S Там присутствуют впечатляющие изображения, и автор утверждает, что каждый способен самостоятельно изготовить мебель.
Моя супруга давно мечтает о новой кухне, но покупка обходится слишком дорого. Автор утверждает, что любой любитель рукоделия может заказать комплектующие для мебели, собрать и таким образом сэкономить деньги, разъясняя этот процесс. Я не могу решить, насколько это реально. Пересмотрел множество сайтов, но остаются большие сомнения. Стоит ли рискнуть и потратить время на эту затею? Может быть, кто-то уже пробовал изготовить кухонную мебель своими руками по данной методике и может оценить ее эффективность. Я умею работать руками, также владею навыками работы с компьютером. Пожалуйста, помогите мне принять решение, вдохнув уверенности или отговорив от этой идеи.
[url=https://dzen.ru/a/Zo-hWHOX_FmaBP7S]обновить кухню своими руками[/url]
как сделать кровать своими руками в домашних условиях из дерева
мебель в гардероб своими руками
гардеробная комната своими руками
Спасибо!
I always used to study paragraph in news papers but now
as I am a user of web thus from now I am using net
for content, thanks to web.
Wow that was odd. I just wrote an incredibly long comment but after
I clicked submit my comment didn’t show up. Grrrr…
well I’m not writing all that over again. Regardless, just wanted to
say superb blog!
Max Verstappen and Red Bull Racing’s https://red-bull-racing.max-verstappen-fr.com path to success in Formula 1. A story of talent, determination and team support leading to a championship title.
Kim Kardashian’s https://the-kardashians.kim-kardashian-fr.com incredible success story, from sex scandal to pop culture icon and billion-dollar fortune.
Une ascension fulgurante au pouvoir Donald Trump https://usa.donald-trump-fr.com et son empire commercial
The astonishing story of Emmanuel Macron’s https://president-of-france.emmanuel-macron-fr.com political rise from bank director to the highest office in France.
The story of Joe Biden’s https://president-of-the-usa.joe-biden-fr.com triumphant journey, overcoming many obstacles on his path to the White House and becoming the 46th President of the United States.
Hi to all, how is all, I think every one is getting more from
this site, and your views are pleasant in support of new
people.
В казино Riobet доступны игры с различными тематиками, чтобы каждый игрок мог найти что-то по своему вкусу – [url=https://madamlarimari.ru/]официальное зеркало сайта Риобет[/url]
I’m pretty pleased to find this great site. I wanted to thank you for your time for this particularly fantastic read!!
I definitely loved every little bit of it and I have
you book marked to check out new stuff on your site.
Your mode of describing everything in this paragraph is genuinely
fastidious, all can simply understand it, Thanks a lot.
Incredible story there. What occurred after? Thanks!
[u][b] Добрый день![/b][/u]
Приобрести диплом о высшем образовании.
Наша компания предлагает купить диплом отличного качества, который не отличить от оригинального документа без участия специалиста высокой квалификации со сложным оборудованием.
[b]Где заказать диплом по нужной специальности?[/b]
http://fly-fishing.ru/forum/topic/9374/?page=1#post-46233
[b]Успешной учебы![/b]
[b]Здравствуйте[/b]!
Задался вопросом: можно ли на самом деле купить диплом государственного образца в Москве? Был приятно удивлен — это реально и легально!
Сначала искал информацию в интернете на тему: купить аттестат, купить диплом в волгодонске, купить диплом института, купить аттестат за 11 класс , купить диплом в прокопьевске и получил базовые знания. В итоге остановился на материале: http://polimer42.ru/communication/forum/messages/forum5/topic49/message308293/?result=reply#message308293
Хорошей учебы!
Parisian PSG https://paris.psg-fr.com is one of the most successful and ambitious football clubs in Europe. Find out how he became a global football superstar.
Olympique de Marseille https://liga1.marseilles-fr.com after several years in the shadows, once again becomes champion of France. How did they do it and what prospects open up for the club
Travel to the pinnacle of French football https://stadede-bordeaux.bordeaux-fr.org at the Stade de Bordeaux, where the passion of the game meets the grandeur of architecture.
June 2024: The 30 Best Movies on Netflix According to Rotten Tomatoes netflix the chair season 2when do new episodes of house of dragonbeauty and the beast movies listky trapping season
The fascinating story of Gigi Hadid’s rise to Victoria’s Secret Angel https://victorias-secret.gigi-hadid-fr.com status and her journey to the top of the modeling industry.
find this [url=https://avax-wallet.com]avax walletsаааааа[/url]
The fascinating story of the creation and meteoric rise of Amazon https://amazon.jeff-bezos-fr.com from its humble beginnings as an online bookstore to its dominant force in the world of e-commerce.
“Somatic release massage utilizes very carefully targeted bodywork to provide [you with] both emotional and physical relief,” she tells Bustle.
my web-site – http://sailboatwreckingyard.com/holding-tanks/
потолок армстронг https://armstrong-ceiling24.ru/
нажмите, чтобы подробнее [url=https://xn—-jtbjfcbdfr0afji4m.xn--p1ai/]электрик томск[/url]
Какие меры предосторожности необходимо соблюдать после удаления папиллом лазером?
После удаления папиллом лазером рекомендуется избегать прямого солнечного света на обработанную область, не использовать косметические средства, содержащие спирт, и не трогать обработанную область руками. Следует также избегать посещения саун и бассейнов в течение нескольких дней после процедуры. Важно следовать всем рекомендациям врача для предотвращения осложнений и ускорения процесса заживления.
What precautions should be taken after laser removal of papillomas?
After laser removal of papillomas, it is recommended to avoid direct sunlight on the treated area, not to use cosmetic products containing alcohol, and not to touch the treated area with your hands. It is also advised to avoid visiting saunas and swimming pools for a few days after the procedure. Following all doctor’s recommendations is important to prevent complications and speed up the healing process.
порно худых русских женщин [url=http://www.russkie-hudyshki.ru]порно худых русских женщин[/url] .
[u][b] Добрый день![/b][/u]
Купить диплом любого ВУЗа
[b]Мы предлагаем[/b] выгодно и быстро купить диплом, который выполняется на оригинальном бланке и заверен печатями, штампами, подписями официальных лиц. Наш диплом способен пройти любые проверки, даже с использованием профессиональных приборов. Достигайте цели быстро и просто с нашей компанией.
[b]Где заказать диплом специалиста?[/b]
https://oldforum.citysakh.ru/?talkid=26710
[u][b] Поможем вам всегда![u][b].
1win fortune tiger [url=https://1win.tr-kazakhstan.kz]https://1win.tr-kazakhstan.kz/[/url] лаки джет 1win официальный сайт https://www.1win.tr-kazakhstan.kz
купить аттестаты за 11 класс отзывы [url=https://asxdiplomik.com/]купить аттестаты за 11 класс отзывы[/url] .
https://subscribe.ru/author/25924851/group/records/?page=52
[u][b] Добрый день![/b][/u]
Мы готовы предложить дипломы любой профессии по выгодным ценам. Цена может зависеть от выбранной специальности, года выпуска и образовательного учреждения.
Где купить диплом специалиста?
[b]Купить диплом университета[/b]
https://arusak-diploms-srednee.ru
[b]Успешной учебы![/b]
купить диплом воспитателя отзывы [url=https://diplomyx.com/]diplomyx.com[/url] .
A fascinating story about how Elon Musk https://spacex.elon-musk-fr.com and his company SpaceX revolutionized space exploration, opening new horizons for humanity.
[u][b] Добрый день![/b][/u]
Для определенных людей, купить [b]диплом[/b] о высшем образовании – это острая потребность, уникальный шанс получить достойную работу. Впрочем для кого-то – это желание не терять массу времени на учебу в университете. С какой бы целью вам это не потребовалось, мы готовы помочь вам. Быстро, качественно и недорого сделаем диплом любого ВУЗа и любого года выпуска на подлинных бланках со всеми необходимыми подписями и печатями.
[b]Наша компания предлагает[/b] выгодно купить диплом, который выполняется на оригинальном бланке и заверен печатями, водяными знаками, подписями официальных лиц. Документ способен пройти любые проверки, даже с применением специальных приборов. Решайте свои задачи быстро и просто с нашими дипломами.
[b]Где купить диплом специалиста?[/b]
http://aranzhirovki.ru/smf/index.php?topic=4254.0
[b]Успехов в учебе![/b]
An exploration of Nicole Kidman’s https://watch.nicole-kidman-fr.com career, her notable roles, and her continued quest for excellence as an actress.
The inspiring story of Travis Scott’s https://yeezus.travis-scott-fr.com rise from emerging artist to one of modern hip-hop’s brightest stars through his collaboration with Kanye West.
How Taylor Swift https://midnights.taylor-swift-fr.com reinvented her sound and image on the intimate and reflective album “Midnights,” revealing new dimensions of her talent.
потолок армстронг https://armstrong-ceiling24.ru/
[u][b] Здравствуйте![/b][/u]
Где купить диплом специалиста?
[b]Купить документ[/b] ВУЗа вы имеете возможность у нас. Мы предлагаем документы об окончании любых университетов России. Вы сможете получить необходимый диплом по любой специальности, включая документы Советского Союза. Даем 100% гарантию, что в случае проверки документа работодателем, каких-либо подозрений не возникнет.
https://sosna-dub32.ru/blog/vyraschivanie-maliny-v-otkrytom-grunte/#comment_164265/
[b]Удачи![/b]
Попробуйте обратиться к Mihaylov digital, их основная сфера это продвижение сайта в Yandex, а еще разработка сайтов.
[u][b] Привет![/b][/u]
Мы изготавливаем дипломы любой профессии по приятным тарифам.
Мы готовы предложить документы техникумов, расположенных в любом регионе РФ. Можно заказать диплом за любой год, в том числе документы старого образца СССР. Документы делаются на бумаге высшего качества. Это позволяет делать государственные дипломы, не отличимые от оригинала. Они заверяются всеми обязательными печатями и штампами.
[b]Где приобрести диплом специалиста?[/b]
[url=http://www.bryners.ru/forum/memberlist.php?sk=c&sd=d&start=625]www.bryners.ru/forum/memberlist.php?sk=c&sd=d&start=625[/url]
[u][b] Привет, друзья![/b][/u]
Мы изготавливаем дипломы любой профессии по приятным тарифам. Стоимость будет зависеть от выбранной специальности, года получения и образовательного учреждения.
Где заказать диплом по актуальной специальности?
[b]Заказать диплом ВУЗа[/b]
https://landik-diploms-srednee.ru/kupit-diplom-v-rostove-na-donu
[b]Хорошей учебы![/b]
[url=https://gamer-torrent.ru/]игры на PS5 или Xbox Series X/S.[/url] – Counter Strike 2 скачать бесплатно, THE DAY BEFORE игра на ПК
Explore the rich history and unrivaled atmosphere of the iconic Old Trafford Stadium https://old-trafford.manchester-united-fr.com, home of one of the world’s most decorated football clubs, Manchester United.
купить диплом волонтера [url=https://ast-diploms.com/]ast-diploms.com[/url] .
бланк диплом профессиональной переподготовки купить [url=https://diplomasx.com/]diplomasx.com[/url] .
The scarcity of https://www.onsiteassistances.org/how-can-i-silversingles-premium-subscription/ jackpot winners reflects the game’s daunting odds of 1 in 292.two million.
Enter the loan term, or the length of time you have to pay off the loan.
Here is my web page … https://twistedrootspod.com/index.php/Unlocking_The_Mysteries_Of_Unsecured_Loans:_Borrow_Like_A_Boss
[u][b] Здравствуйте![/b][/u]
Где купить диплом специалиста?
[b]Заказать документ[/b] о получении высшего образования вы имеете возможность в нашей компании. Мы оказываем услуги по продаже документов об окончании любых университетов РФ. Вы сможете получить диплом по любой специальности, любого года выпуска, включая документы Советского Союза. Гарантируем, что при проверке документов работодателями, никаких подозрений не возникнет.
http://polimer42.ru/communication/forum/messages/forum5/topic49/message308293/?result=reply#message308293
[b]Удачи![/b]
Крайне рекомендую Mihaylov digital, их специализация это продвижение сайта в Google и Yandex, а также маркетинг.
monte 1win прогноз [url=https://www.1win.tr-kazakhstan.kz]www.1win.tr-kazakhstan.kz[/url] л карнитин 1win отзывы 1win.tr-kazakhstan.kz
I will right away grab your rss as I can’t in finding your e-mail subscription hyperlink
or newsletter service. Do you have any? Please permit me recognise so that I may just subscribe.
Thanks.
Если вы хотите увеличить свой банкролл, воспользуйтесь бесплатным игровым автоматом в казино 7k casino – [url=https://sfabrikigrez.ru/]7k casino онлайн официальный[/url]
https://maps.google.co.nz/url?q=http://surl.li/evyxxk
[u][b] Привет![/b][/u]
Где купить диплом по нужной специальности?
Заказать документ института вы можете у нас в Москве. Мы оказываем услуги по продаже документов об окончании любых ВУЗов России.
[b]Мы изготавливаем[/b] дипломы психологов, юристов, экономистов и любых других профессий по приятным тарифам. Стоимость может зависеть от выбранной специальности, года выпуска и ВУЗа. Стараемся поддерживать для клиентов адекватную политику тарифов.
https://1abakan.ru/forum/showthread-62291/
[b]Успешной учебы![/b]
montenegro beach weather in Montenegro
купить диплом воспитателя о высшем образовании [url=https://asxdiplomik24.ru/]asxdiplomik24.ru[/url] .
Незаконные действия и мошенничество онлайн не оказывают негативного влияния на Игровой аппарат – [url=https://tpklordi.ru/]официальное зеркало сайта 7k casino[/url]
диплом государственного образца купить [url=www.diploms-x.com/]диплом государственного образца купить[/url] .
Единственная в России студия кастомных париков https://wigdealers.ru, где мастера индивидуально подбирают структуру волос и основу по форме головы, после чего стригут, окрашивают, делают укладку и доводят до идеала ваш будущий аксессуар.
The iconic Anfield https://enfield.liverpool-fr.com stadium and the passionate Liverpool fans are an integral part of English football culture.
An exploration of the history of Turin’s https://turin.juventus-fr.org iconic football club – Juventus – its rivalries, success and influence on Italian football.
The new Premier League https://premier-league.chelsea-fr.com season has gotten off to an intriguing start, with a new-look Chelsea looking to return to the Champions League, but serious challenges lie ahead.
Подробный обзор официального сайта букмекерской конторы 7к казино содержит полезную информацию для игроков – [url=https://atechnolog.ru/]r7 casino официальный сайт отзывы[/url]
[b]Здравствуйте[/b]!
Хочу поделиться своим опытом по заказу аттестата ПТУ. Думал, что это невозможно, и начал искать информацию в интернете по теме: купить диплом в москве, купить свидетельство о браке, купить диплом в саранске, купить диплом в благовещенске, купить диплом в волжском. Постепенно углубляясь, нашел отличный ресурс здесь: http://sport.taminfo.ru/index.php?subaction=userinfo&user=ebuva, и остался очень доволен!
Теперь у меня есть диплом сварщика о среднем специальном образовании, и я обеспечен на всю жизнь!
Успешной учебы!
Когда мы разрабатывали бренд казино 7k casino в 2023 году, мы сосредоточились на достижении высокого уровня качества и разнообразия услуг, чтобы привлечь азартных игроков и возглавить рейтинг казино – [url=https://osdata.ru/]r7 casino игровые автоматы[/url]
Your way of telling the whole thing in this paragraph is really nice,
every one can easily be aware of it, Thanks a lot.
Nice post. I learn something new and challenging on websites I stumbleupon everyday.
It will always be helpful to read articles
from other authors and use something from other sites.
1win gambling [url=http://www.1win.tr-kazakhstan.kz]http://www.1win.tr-kazakhstan.kz[/url] 1win авиатор сигналы http://www.1win.tr-kazakhstan.kz
купить диплом об окончании пту [url=www.diploms-x.com]купить диплом об окончании пту[/url] .
[u][b] Привет, друзья![/b][/u]
Приобрести диплом ВУЗа.
Мы предлагаем приобрести диплом в высочайшем качестве, который невозможно отличить от оригинального документа без участия специалиста высокой квалификации со специальным оборудованием.
[b]Где приобрести диплом по нужной специальности?[/b]
http://eicg.kz/index.php?subaction=userinfo&user=oxysopo
[b]Успешной учебы![/b]
Wow! At last I got a website from where I know how to really get helpful
information regarding my study and knowledge.
Wonderful article! This is the kind of info that are meant to be shared across the net.
Disgrace on Google for no longer positioning this publish upper!
Come on over and talk over with my website .
Thank you =)
[u][b] Добрый день![/b][/u]
Мы предлагаем дипломы любой профессии по приятным тарифам. Стоимость будет зависеть от конкретной специальности, года выпуска и университета.
Где купить диплом по необходимой специальности?
[b]Купить диплом любого университета[/b]
https://arusak-diploms-srednee.ru/kupit-diplom-medicinskogo-uchilishha
[b]Хорошей учебы![/b]
[u][b] Добрый день![/b][/u]
Мы изготавливаем дипломы психологов, юристов, экономистов и других профессий по выгодным ценам. Цена может зависеть от выбранной специальности, года получения и ВУЗа.
Где купить диплом по нужной специальности?
[b]Купить диплом университета[/b]
https://arusak-diploms-srednee.ru/kupit-diplom-v-ekaterinburge
[b]Успешной учебы![/b]
Tyson Fury https://wbc.tyson-fury-fr.com is the undefeated WBC world champion and reigns supreme in boxing’s heavyweight division.
Explore the career and significance of Monica Bellucci https://malena.monica-bellucci-fr.com in Malena (2000), which explores complex themes of beauty and human strength in wartime.
Inter Miami FC https://mls.inter-miami-fr.com has become a major player in MLS thanks to its star roster, economic growth and international influence.
Discover Rafael Nadal’s https://mls.inter-miami-fr.com impressive rise to the top of world tennis, from his debut to his career Grand Slam victory.
The story of Kanye West https://the-college-dropout.kanye-west-fr.com, starting with his debut album “The College Dropout,” which changed hip-hop and became his cultural legacy.
ขอบคุณมากสำหรับบทความที่น่าสนใจนี้!
ผมขอชี้แนะ สล็อตเว็บตรง ฝากถอนไม่มีขั้นต่ำ เพิ่มเติมครับ เป็นสล็อตpgเว็บตรง มีระบบระเบียบระบบฝากถอนออโต้ที่สบายมากๆฝาก-ถอน ไม่มีขั้นต่ำ แถมยังใช้เทคโนโลยีการเข้ารหัส SSL เพื่อให้มีความปลอดภัยสำหรับในการทำธุรกรรม ข้อดีอีกอย่างคือเกมเว็บตรง pg slotจากผู้พัฒนาชั้นนำจำนวนมาก เล่นแล้วรู้สึกไม่มีอันตรายแล้วก็ได้รับความเที่ยงธรรม ลองเข้าไปมองเพิ่มถึงที่กะไว้ สมัครเกมสล็อตเว็บตรง ครับ
купить диплом в хабаровске [url=www.diploms-x.com]www.diploms-x.com[/url] .
[url=http://mirfinrealty.ru/kupit-diplom-bez-predoplatyi-prosto-i-udobno/]Официальная покупка диплома вуза с сокращенной программой в Москве[/url]
[u][b] Привет![/b][/u]
Приобрести диплом ВУЗа
[b]Наша компания предлагает[/b] выгодно и быстро купить диплом, который выполнен на оригинальной бумаге и заверен мокрыми печатями, водяными знаками, подписями официальных лиц. Диплом пройдет любые проверки, даже с применением специальных приборов. Решайте свои задачи быстро и просто с нашей компанией.
[b]Где приобрести диплом специалиста?[/b]
[url=http://www.google.com.vc/url?q=aurus-diploms.com/]Покупка диплома о среднем полном образовании: как избежать мошенничества?[/url]
look here [url=https://eth-etf.net]how to buy ethetf[/url]
купил диплом устроился на работу [url=https://asxdiplomik.com/kupit-diplom-moskva/]asxdiplomik.com/kupit-diplom-moskva[/url] .
useful content [url=https://eth-etf.net/]when eth etf[/url]
купить диплом маляра [url=https://ast-diplomas.com/]ast-diplomas.com[/url] .
Преимущества аренды склада https://popivy.ru/otvetstvennoe-hranenie-mebeli-santehniki-i-bytovoj-tehniki-na-sklade-v-moskve-preimushhestva-i-vygody/, как аренда складских помещений может улучшить ваш бизнес
The fascinating story of the phenomenal rise and meteoric fall of Diego Maradona https://napoli.diegomaradona.biz, who became a cult figure at Napoli in the 1980s.
Rivaldo, or Rivaldo https://barcelona.rivaldo-br.com, is one of the greatest football players to ever play for Barcelona.
A fascinating story about Brazilian veteran Thiago Silva’s https://chelsea.thiago-silva.net difficult path to the top of European football as part of Chelsea London.
Explore the remarkable journey of Vinicius Junior https://real-madrid.vinicius-junior.net, the Brazilian prodigy who conquered the world’s biggest stage with his dazzling skills and unparalleled ambition at Real Madrid.
get out movie desperate amateurs full movieschainsaw episodesimdb avantinew ariel movie
This is really interesting, You’re a very skilled blogger. I have joined your rss
feed and look forward to seeking more of your wonderful post.
Also, I have shared your website in my social networks!
[url=https://gamer-torrent.ru/]топ игр 2023[/url] – бесплатные игры 2024, бесплатные игры 2023
каталог [url=https://xn—-jtbjfcbdfr0afji4m.xn--p1ai]электрик томск[/url]
Hello everyone !
Experience Limelight Stream, the ultimate destination for streaming enthusiasts. With a vast library of movies, TV shows, documentaries, and live events, we bring the best of entertainment right to your screen. Enjoy high-definition streaming that delivers crystal clear picture quality and immersive sound. Our platform is designed to be intuitive and easy to navigate, ensuring a hassle-free experience. Whether you’re at home or on the go, Limelight Stream offers seamless streaming across all your devices, including TVs, laptops, tablets, and smartphones. Our personalized recommendations help you discover content that matches your interests, making it easy to find new favorites. Join http://limelight-stream.com today and elevate your entertainment experience with our top-quality content and seamless streaming capabilities.
Game streaming with 4K resolution
Limelight controller configuration
Limelight supported devices
Future of game streaming technology
Limelight Steam Big Picture mode
Good luck!
[u][b] Привет![/b][/u]
Где заказать диплом по актуальной специальности?
[b]Заказать документ[/b] о получении высшего образования можно в нашей компании в столице. Мы оказываем услуги по продаже документов об окончании любых ВУЗов Российской Федерации. Вы получите диплом по любым специальностям, любого года выпуска, в том числе документы Советского Союза. Даем 100% гарантию, что в случае проверки документов работодателем, подозрений не возникнет.
http://regata.yar.ru/component/kunena/%D1%80%D0%B0%D0%B7%D0%B4%D0%B5%D0%BB-%D0%BF%D1%80%D0%B5%D0%B4%D0%BB%D0%BE%D0%B6%D0%B5%D0%BD%D0%B8%D0%B9/3682-diplomsagroups#8712
[b]Успехов в учебе![/b]
see this page [url=https://avax-wallet.com/]wallet avaxаа[/url]
Наш ресурс предлагает вам полную информацию на такие темы, как [url=https://54kovka.ru]аренда земельных участков[/url] или [url=https://54kovka.ru]продажа квартиры[/url].
Посетите наш сайт и начните свой путь к новому дому уже сегодня!
You said it nicely..
https://subscribe.ru/author/25924851/group/records/?page=51
Do you have a spam problem on this blog; I also am a blogger,
and I was wanting to know your situation; we have created some nice practices and we are looking to
trade techniques with other folks, please shoot me an e-mail if interested.
Feel free to visit my blog … Cycling travel routes
Cristiano Ronaldo https://al-nassr.cristianoronaldo-br.net one of the greatest football players of all time, begins a new chapter in his career by joining An Nasr Club.
The fascinating story of Marcus Rashford’s rise https://manchester-united.marcusrashford-br.com from academy youth to the main striker and captain of Manchester United. Read about his meteoric rise and colorful career.
The story of Luka Modric’s rise https://real-madrid.lukamodric-br.com from young talent to one of the greatest midfielders of his generation and a key player for the Royals.
From academy product to captain and leader of Real Madrid https://real-madrid.ikercasillas-br.com Casillas became one of the greatest players in the history of Real Madrid.
Follow Bernardo Silva’s impressive career https://manchester-city.bernardosilva.net from his debut at Monaco to to his status as a key player and leader of Manchester City.
Покупка диплома о среднем полном образовании: как избежать мошенничества?
[url=http://forexgroupx.ru/dostupnyie-diplomyi-byistro-i-nadezhno/]forexgroupx.ru/dostupnyie-diplomyi-byistro-i-nadezhno[/url]
Приветствую. Может кто знает, где найти полезные блоги о недвижимости? Сейчас читаю https://2204000.ru
Découvrez la TV suisse comme jamais auparavant possible avec notre solution IPTV de qualité supérieure !
Bénéficiez d’un accès sans limites aux chaînes suisses populaires comme RTS, SRF (Schweizer Radio und Fernsehen), RSI et bien d’autres. Notre système offre :
Plus de nombreuses chaînes suisses et étrangères en haute définition
Un choix VOD riche en contenu vidéo
La faculté de visionner vos programmes favoris en différé
Une interface utilisateur agréable qui fonctionne sur divers appareils
Un support client dynamique localisé en Suisse
Que vous soyez enthousiaste de sport, d’informations ou de divertissement, notre IPTV
[url=https://blogfreely.net/sisterburst7/la-revolution-du-divertissement-numerique-decouvrez-iptv-smarter-pro]La révolution du divertissement numérique – Découvrez IPTV Smarter Pro[/url] s’adapte à vos besoins. Testez gratuitement pendant une période de 24h et découvrez une nouvelle manière de visionner la télé !
https://karimmassimov.com/
[url=https://mounjaro-medical.ru/]mounjaro купить[/url] – мунжаро цена, mounjaro купить +в дубае
[url=https://mounjaro-kupit.su]mounjaro tirzepatide отзывы[/url] – мунджаро лекарство купить, тирзепатид купить +в спб
[url=https://mounjaro-5mg.ru/mundzharo]mounjaro tirzepatide injection[/url] – эффективные препараты +для похудения +в аптеках, препараты +для похудения купить +в аптеке
риобет казино регистрация Rio Bet Casino
официальный сайт Rio Bet Casino риобет казино
Dragon Money онлайн казино Dragon Money
бонус драгон мани казино официальный сайт Dragon Money
Хотите научиться готовить самые изысканные и сложные торты? В этом https://v1.skladchik.org/tags/tort/ разделе вы найдете множество подробных пошаговых рецептов самых трендовых и известных тортов с возможностью получить их за сущие копейки благодаря складчине. Готовьте с удовольствием и открывайте для себя новые рецепты вместе с Skladchik.org
bocor88 login
Всем привет! Может кто знает, где почитать разные статьи о недвижимости? Сейчас читаю https://adeldv.ru
Introduction: In recent years, the popularity of apple cider vinegar (ACV) as a weight loss and wellness supplement has surged.
Feel free to peruse web page :: http://krair.kr/bbs/board.php?bo_table=free&wr_id=338146
I got this site from my friend who told me about this web site and now this time I am
visiting this site and reading very informative posts at this place.
На сайте http://nemans.ru приобретите фасовочные пакеты, а также тару с ручками, мешки полипропиленовые, пленку полиэтиленовую, армированную, клейкую ленту, стрейч, различную бумажную продукцию, салфетки, тряпки и многое другое. Все товары реализуются по лучшим ценам, доступна оперативная доставка. Вся продукция от проверенных, надежных поставщиков, которые работают на результат. Все товары абсолютно безопасные, простые в использовании и помогают оперативно закончить уборку и не тратить на нее много времени. Регулярно на определенные товары устанавливаются скидки.
Добрый день! Меня зовут Шестаков Юрий Иванович, я врач-косметолог с многолетним опытом работы в области эстетической медицины. Сегодня я отвечу на ваши вопросы и расскажу полезной информацией о лазерном удалении папиллом. Моя цель — помочь вам понять, как безопасно и эффективно избавиться от папиллом и какие преимущества имеет лазерное удаление.
Что такое лазерное удаление папиллом и как оно проводится?
Лазерное удаление папиллом — это процедура, при которой используется лазер для удаления новообразований на коже, вызванных вирусом папилломы человека (ВПЧ). Лазерный луч направляется на папиллому, что вызывает ее испарение и разрушение. Процедура проводится под местной анестезией и занимает от нескольких минут до получаса в зависимости от количества и размера папиллом.
What is laser removal of papillomas and how is it performed?
Laser removal of papillomas is a procedure that uses a laser to remove skin growths caused by the human papillomavirus (HPV). The laser beam is directed at the papilloma, causing it to vaporize and disintegrate. The procedure is performed under local anesthesia and takes from a few minutes to half an hour, depending on the number and size of the papillomas.
Лучшие пансионаты для пожилых людей https://ernst-neizvestniy.ru в Самаре – недорогие дома для престарелых в Самарской области
Пансионаты для пожилых людей https://moyomesto.ru в Самаре по доступным ценам. Специальные условия по уходу, индивидуальные программы.
The fascinating story of Sergio Ramos’ https://seville.sergioramos.net rise from Sevilla graduate to one of Real Madrid and Spain’s greatest defenders.
Ousmane Dembele’s https://paris-saint-germain.ousmanedembele-br.com rise from promising talent to key player for French football giants Paris Saint-Germain. An exciting success story.
If you wish for to grow your experience just keep visiting this site and be updated
with the latest news update posted here.
[u][b] Добрый день![/b][/u]
Приобрести диплом ВУЗа.
Наша компания предлагает приобрести диплом в высоком качестве, неотличимый от оригинала без использования специального оборудования и опытного специалиста.
[b]Где приобрести диплом по нужной специальности?[/b]
https://forum.stde.ru/index.php?/topic/9874-how-to-create-a-new-topic-at-forumstderu/page/6/#comment-11713
[b]Успешной учебы![/b]
купить диплом в красноярске [url=http://diploms-x.com/]http://diploms-x.com/[/url] .
Всё, что нужно знать о покупке аттестата о среднем образовании
[url=http://obrezanie05.ru/users/15/]obrezanie05.ru/users/15[/url]
While this does remove personal anonymity, players can still protect their financial transactions by using crypto.
[u][b] Добрый день![/b][/u]
Заказать диплом любого университета
[b]Наша компания предлагает[/b] быстро и выгодно купить диплом, который выполнен на бланке ГОЗНАКа и заверен мокрыми печатями, водяными знаками, подписями. Документ пройдет лубую проверку, даже при использовании специальных приборов. Решайте свои задачи быстро и просто с нашим сервисом.
[b]Где купить диплом по нужной специальности?[/b]
[url=http://anatoliyrud.ekafe.ru/viewforum.php?f=29/]anatoliyrud.ekafe.ru/viewforum.php?f=29[/url]
[url=http://www.bakinsky-dvorik.ru/club/user/127071/blog/4743//]www.bakinsky-dvorik.ru/club/user/127071/blog/4743/[/url]
[url=http://logan.in.ua/people/user/7276/blog/7932//]logan.in.ua/people/user/7276/blog/7932/[/url]
[url=http://www.santa4.su/gallery/image/261-faq-i-sluzhba-podderzhka-pokupaem-diplom-v-seti//]www.santa4.su/gallery/image/261-faq-i-sluzhba-podderzhka-pokupaem-diplom-v-seti/[/url]
[url=http://huarenjiaohui.com/index.php?/gallery/image/124-%D1%81%D0%BB%D1%83%D0%B6%D0%B1%D0%B0-%D0%BF%D0%BE%D0%B4%D0%B4%D0%B5%D1%80%D0%B6%D0%BA%D0%B8-%D0%B8-faq-%D0%BF%D0%BE%D0%BA%D1%83%D0%BF%D0%B0%D0%B5%D0%BC-%D0%B4%D0%BE%D0%BA%D1%83%D0%BC%D0%B5%D0%BD%D1%82%D1%8B-%D0%B2-%D1%81%D0%B5%D1%82%D0%B8//]huarenjiaohui.com/index.php?/gallery/image/124-%D1%81%D0%BB%D1%83%D0%B6%D0%B1%D0%B0-%D0%BF%D0%BE%D0%B4%D0%B4%D0%B5%D1%80%D0%B6%D0%BA%D0%B8-%D0%B8-faq-%D0%BF%D0%BE%D0%BA%D1%83%D0%BF%D0%B0%D0%B5%D0%BC-%D0%B4%D0%BE%D0%BA%D1%83%D0%BC%D0%B5%D0%BD%D1%82%D1%8B-%D0%B2-%D1%81%D0%B5%D1%82%D0%B8/[/url]
world of warcraft raid boost [url=https://kreativwerkstatt-esens.de]https://kreativwerkstatt-esens.de[/url] .
Смелым игрокам посвящается!
Промокод 1хбет на слоты – активируйте и получайте бесплатные вращения на лучшие игры казино. Играйте с бонусами и увеличивайте свои шансы на крупный выигрыш вместе с 1xbet! [url=https://videoigryrf.ru/img/pgs/?1xbet_promokod_besplatno___bonus_pri_registracii.html]1xbet промокод на сегодня[/url]
Активируйте промокод 1xbet для получения фриспинов и бонусов на депозиты. Промокод 1xbet на сегодня – это ваш шанс увеличить свой банкролл и начать выигрывать больше!
Сайт с самой четкой информацией! – https://ukauk.ru/filemanager/articles/1xbet_promokod_besplatno___bonus_pri_registracii.html
промокод при регистрации 1xbet
1хбет промокод при регистрации на сегодня
промокод на фрибет 1xbet
Удачи!
[u][b] Привет, друзья![/b][/u]
[b]Где приобрести диплом специалиста?[/b]
[b]Мы изготавливаем дипломы[/b] любой профессии по невысоким ценам.
[url=http://shop.electricoresigns.com/index.php?route=information/blogger&blogger_id=6]shop.electricoresigns.com/index.php?route=information/blogger&blogger_id=6[/url]
Приветствую. Может кто знает, где найти разные статьи о недвижимости? Пока нашел https://eniseynev.ru
my sources [url=https://jaxxliberty.io/]jaxx io[/url]
[u][b] Добрый день![/b][/u]
Купить диплом о высшем образовании.
Наша компания предлагает заказать диплом в высоком качестве, неотличимый от оригинала без использования дорогостоящего оборудования и квалифицированного специалиста.
[b]Где приобрести диплом специалиста?[/b]
http://gdz-fizika.ru/index.php?subaction=userinfo&user=exequn
[b]Успешной учебы![/b]
read more [url=https://crackzipraronline.com]zip rar[/url]
In fact no matter if someone doesn’t understand afterward its up to other viewers that they will assist, so here it occurs.
[url=https://t.me/ozempic_zakazat]оземпик 1 купить +в москве[/url] – оземпик самара, оземпик инструкция +по применению
Your Domain Name [url=https://isrufus.org/]Rufus usb[/url]
[u][b] Привет, друзья![/b][/u]
Мы изготавливаем дипломы любой профессии по разумным ценам. Стоимость может зависеть от выбранной специальности, года выпуска и образовательного учреждения.
Где приобрести диплом по актуальной специальности?
[b]Купить диплом любого ВУЗа[/b]
https://arusak-diploms-srednee.ru/kupit-diplom-v-voronezhe
[b]Удачи![/b]
What’s up!
What a good article!
Can I scrape this and share it with my site members?
My channel is about Korean 야튜브
you are interested, feel free to come to my channel and check it out.
Thanks a lot and Keep up the good work!
We are a group of volunteers and starting a new scheme in our community.
Your website provided us with valuable info to work on. You’ve done a formidable job
and our entire community will be grateful to you.
For correcting the imbalance of a pump installation, we used Balanset-1A. This allowed us to quickly restore optimal device operation, reducing vibration to a minimum. Details of the balancing methodology are available on Vibromera’s website https://vibromera.eu/example/mulcher-rotor-balancing-process/
We’re a bunch of volunteers and starting a new scheme in our community.
Your site provided us with helpful info to work on. You’ve done an impressive task and our whole neighborhood might be grateful
to you.
Всем привет! Подскажите, где почитать разные статьи о недвижимости? Пока нашел https://fuseitdecore.ru
Incredible quest there. What happened after? Good luck!
The incredible story https://napoli.khvichakvaratskhelia-br.com of a young Georgian talent’s transformation into an Italian Serie A star. Khvicha Kvaraeshvili is a rising phenomenon in European football.
The incredible success story of 20-year-old Florian Wirtz https://bayer-04.florianwirtz-br.com, who quickly joined the Bayer team and became one of the best young talents in the world.
The compelling story of Alisson Becker’s https://bayer-04.florianwirtz-br.com meteoric rise from young talent to key figure in Liverpool’s triumphant era under Jurgen Klopp.
O meio-campista Rafael Veiga leva https://palmeiras.raphaelveiga-br.com o Palmeiras ao sucesso – o campeonato brasileiro e a vitoria na Copa Libertadores aos 24 anos.
Midfielder Rafael Veiga leads https://manchester-city.philfoden-br.com Palmeiras to success – the championship Brazilian and victory in the Copa Libertadores at the age of 24.
Pretty! This has been a really wonderful post. Many thanks for providing these details.
Узаконивание самовольной перепланировки может показаться сложным процессом, но с нашей помощью это станет просто и быстро. Наша команда профессионалов знает все нюансы и готова помочь вам на каждом этапе.
Если вы не знаете, [url=https://potolki-kitstroy.ru/]как узаконить самовольную перепланировку[/url], обращайтесь к нам. Мы обеспечим полное сопровождение процесса, начиная с подготовки документов и заканчивая получением всех разрешений. С нами вы легко решите все вопросы и получите законное пространство для жизни или работы.
[b]Здравствуйте[/b]!
Задумался а действительно можно купить диплом государственного образца в Москве, и был удивлен, все реально и главное официально!
Сначала серфил в сети и искал такие темы как: купить диплом фельдшера, купить диплом продавца, купить диплом в когалыме, купить диплом колледжа, где купить диплом среднем, получил базовую информацию.
Остановился в итоге на материале купить диплом монтажника, http://ashinova.ru/category-5/t-1525.html#1525
Успехов в учебе!
I was able to find good advice from your blog articles.
Hi would you mind sharing which blog platform you’re using?
I’m going to start my own blog in the near future but I’m having a difficult time choosing between BlogEngine/Wordpress/B2evolution and Drupal.
The reason I ask is because your design and style seems
different then most blogs and I’m looking for something completely unique.
P.S Sorry for getting off-topic but I had to ask!
[u][b] Привет![/b][/u]
[b]Полезные советы по безопасной покупке диплома о высшем образовании [/b]
[url=http://chayka.ixbb.ru/viewtopic.php?id=144#p154/]chayka.ixbb.ru/viewtopic.php?id=144#p154[/url]
[u][b] Рады помочь![u][b].
EpicAds.Net
[url=https://diplom.ua/ru/]помощь в написании диссертации[/url] – у кого можно заказать курсовую, зразок написання курсової роботи
https://karimmassimov.com/
[url=https://fbuz-74.ru/about/forum/messages/forum1/topic1/message127686/?result=reply#message127686]karimmassimov.com[/url] 15b35f3
Verbesserung der Effizienz von [url=https://www.instagram.com/vibromera_ou/]Balancing Service[/url] mit dem Balanset-1A Handbuch
Приветствую. Может кто знает, где найти полезные блоги о недвижимости? Сейчас читаю https://galastroy-sk.ru
Peculiar article, exactly what I needed.
In-depth articles about the most famous football players https://zenit-saint-petersburg.wendel-br.com, clubs and events. Learn everything about tactics, rules of the game and football history.
The rise of 20-year-old midfielder Jamal Musiala https://bavaria.jamalmusiala-br.com to the status of a winger in the Bayern Munich team. A story of incredible talent.
https://karimmassimov.com/
[url=http://www.xn--oi2bj1bu7d094a3sf.kr/bbs/board.php?bo_table=qna&wr_id=138033]karimmassimov.com[/url] 8_557e5
A historia da jornada triunfante de Anitta https://veneno.anitta-br.com de aspirante a cantora a uma das interpretes mais influentes da musica moderna, incluindo sua participacao na serie de TV “Veneno”.
Fabrizio Moretti https://the-strokes.fabriziomoretti-br.com the influential drummer of The Strokes, and his unique sound revolutionized the music scene, remaining icons of modern rock.
Selena Gomez https://calm-down.selenagomez-br.net the story from child star to global musical influence, summarized in hit “Calm Down”, with Rema.
https://epicads.net/
[url=https://t.me/ozempicg/]мунжаро москва[/url] – mounjaro купить +в россии, мунджаро инъекции купить +в москве
https://karimmassimov.com/
[url=http://archiveforum.i98767qd.beget.tech/index.php?/topic/1054-dfecwecrw/page-336#entry72668]karimmassimov.com[/url] f6_557e
[url=https://t.me/ozempic_zakazat/]оземпик препарат купить[/url] – семаглутид +для похудения, дулаглутид 1.5 мг купить
[url=https://www.ebay.com/itm/395305960880/]Impeller Balancing[/url]: Spezialisierte AusrГјstung bei Vibromera
Link exchange is nothing else but it is only placing the other person’s blog link on your page at proper place and other person will also do same for you.
Всем привет! Может кто знает, где найти разные статьи о недвижимости? Сейчас читаю https://ggs45.ru
https://karimmassimov.com/
[url=http://hamaco.co.kr/bbs/board.php?bo_table=d_01&wr_id=17585]karimmassimov.com[/url] f3_557e
bookmarked!!, I love your blog!
https://karimmassimov.com/
[url=http://masifkorea.com/bbs/board.php?bo_table=online&wr_id=221268]karimmassimov.com[/url] 56eb762
https://karimmassimov.com/
[url=http://ufa.shiny-migom.ru/partners/320756/?MID=73361&result=reply]karimmassimov.com Robertdaync[/url] 5b35f32
Процесс получения диплома стоматолога: реально ли это сделать быстро?
[url=http://asxdiplomik.com/kupit-diplom-vracha/]asxdiplomik.com/kupit-diplom-vracha[/url]
Коттедж купить в Ижевске нк18.рф
Обращайтесь к нам за [url=https://xn--18-1lcl.xn--p1ai/]монолитный дом[/url] на любом этапе к жизни в своем доме. У Вас уже имеется участок? Отлично, дом мы берем на себя. Выявим различные нюансы, дадим рекомендации от специалистов по планировке. Участка пока нет? Мы предоставим Вам несколько различных вариаций, которые подойдут конкретно под Ваш спрос.
где купить диплом среднем во владивостоке [url=https://asxdiplomik.com/kupit-diplom-moskva/]asxdiplomik.com/kupit-diplom-moskva[/url] .
во-вторых, институциональные инвесторы в жилье получают стабильный поток доходов от сдачи в аренду, https://zk-petuhova.ru/trehkomnatnye-kvartiry/ чему.
купить диплом в россоши [url=https://diplomyx.com/]diplomyx.com[/url] .
рива https://office-mebel-in-msk.ru/
купить диплом о высшем образовании в сургуте [url=https://asxdiplomik.com/]купить диплом о высшем образовании в сургуте[/url] .
https://karimmassimov.com/
[url=https://ykentech.com/bbs/board.php?bo_table=career&wr_id=422916]karimmassimov.com[/url] 201210a
[u][b] Привет, друзья![/b][/u]
Где приобрести диплом специалиста?
Купить документ ВУЗа вы сможете в нашей компании в Москве. Мы оказываем услуги по производству и продаже документов об окончании любых ВУЗов Российской Федерации. Вы сможете получить диплом по любым специальностям, любого года выпуска, включая документы образца СССР.
[b]Где купить диплом по нужной специальности?[/b]
[url=http://ulmo.ukrbb.net/index.php/]ulmo.ukrbb.net/index.php[/url]
[b]Успехов в учебе![/b]
[u][b] Добрый день![/b][/u]
Где заказать диплом специалиста?
Наша компания предлагает выгодно и быстро купить диплом, который выполняется на оригинальной бумаге и заверен печатями, водяными знаками, подписями. Документ пройдет лубую проверку, даже с использованием специальных приборов. Достигайте цели максимально быстро с нашими дипломами.
[b]Заказать диплом любого университета.[/b]
[url=http://mizunosoccershoesfans.com/read-blog/3532/]mizunosoccershoesfans.com/read-blog/3532[/url]
купить диплом моториста [url=https://ast-diploms.com/]ast-diploms.com[/url] .
куплю диплом техник [url=https://diplomasx.com/]куплю диплом техник[/url] .
[u][b] Здравствуйте![/b][/u]
Купить диплом ВУЗа
[b]Мы предлагаем[/b] выгодно и быстро приобрести диплом, который выполняется на бланке ГОЗНАКа и заверен мокрыми печатями, штампами, подписями должностных лиц. Диплом пройдет любые проверки, даже с использованием специфических приборов. Решите свои задачи максимально быстро с нашими дипломами.
[b]Где заказать диплом по нужной специальности?[/b]
[url=http://nedvigimost.bbok.ru/viewtopic.php?id=26650#p45740/]nedvigimost.bbok.ru/viewtopic.php?id=26650#p45740[/url]
[url=http://ya.7bb.ru/viewtopic.php?id=11639#p33323/]ya.7bb.ru/viewtopic.php?id=11639#p33323[/url]
[url=http://macadamlab.ru/wiki/index.php?title=пїЅпїЅпїЅпїЅпїЅпїЅ_пїЅпїЅпїЅпїЅпїЅпїЅ/]macadamlab.ru/wiki/index.php?title=пїЅпїЅпїЅпїЅпїЅпїЅ_пїЅпїЅпїЅпїЅпїЅпїЅ[/url]
[url=http://pdlspd.listbb.ru/viewtopic.php?f=3&t=409/]pdlspd.listbb.ru/viewtopic.php?f=3&t=409[/url]
[url=http://lubercy.ixbb.ru/viewtopic.php?id=6615#p14726/]lubercy.ixbb.ru/viewtopic.php?id=6615#p14726[/url]
https://karimmassimov.com/
[url=https://www.amatagroup.ru/forum/messages/forum1/topic59/message439250/?result=reply#message439250]karimmassimov.com RobertDat[/url] 7620121
https://subscribe.ru/author/25924851/group/records/?page=50
Hello, this weekend is good designed for me, as this point in time i am
reading this impressive educational piece of writing here at my house.
Всем привет! Подскажите, где почитать разные блоги о недвижимости? Сейчас читаю https://glwin.ru
https://karimmassimov.com/
[url=https://homezdna.com/bbs/board.php?bo_table=free&wr_id=436840]karimmassimov.com[/url] a3656eb
That is a great tip especially to those fresh to the blogosphere.
Simple but very accurate information… Thanks for sharing this one.
A must read post!
Stop by my web blog … poles represented tribal
[u][b] Добрый день![/b][/u]
Приобрести диплом о высшем образовании.
Мы предлагаем приобрести диплом в высоком качестве, неотличимый от оригинального документа без участия специалистов высокой квалификации со специальным оборудованием.
[b]Где приобрести диплом по нужной специальности?[/b]
http://shinyoungwood.co.kr/bbs/board.php?bo_table=free&wr_id=764588
[b]Успешной учебы![/b]
набор для офисного стола https://office-mebel-in-msk.ru/
tyler perry movies konosuba movie dubsinner season 4 plotstranfer things season 4pokemon the movie 2000 online
wow raid carry service [url=https://kreativwerkstatt-esens.de/]https://kreativwerkstatt-esens.de/[/url] .
Eth Mixer
[u][b] Добрый день![/b][/u]
Купить диплом о высшем образовании.
Мы предлагаем приобрести диплом в отличном качестве, неотличимый от оригинала без использования специального оборудования и квалифицированного специалиста.
[b]Где заказать диплом по нужной специальности?[/b]
http://rivertravel.net/viewtopic.php?f=20&t=8425
[b]Удачи![/b]
Всем привет! Может кто знает, где почитать разные статьи о недвижимости? Пока нашел https://gor-bur.ru
Появление мебели относится своевременно неолитической революции – перехода первобытных общин к https://dms-mebel.ru/ оседлости.
[u][b] Здравствуйте![/b][/u]
Мы готовы предложить документы ВУЗов, которые расположены на территории всей РФ. Можно купить диплом от любого учебного заведения, за любой год, указав подходящую специальность и хорошие оценки за все дисциплины. Документы выпускаются на бумаге самого высшего качества. Это позволяет делать государственные дипломы, не отличимые от оригинала. Они заверяются необходимыми печатями и штампами.
[b]Заказать диплом о высшем образовании.[/b]
[url=http://www.vocal.com.ua/node/62355/]www.vocal.com.ua/node/62355[/url]
[b]Успехов в учебе![/b]
This is really interesting, You’re a very skilled blogger. I’ve joined your feed and look forward to seeking more of your magnificent post. Also, I’ve shared your site in my social networks!
Монолитный жилой дом купить нк18.рф
Обращайтесь к нам за [url=https://xn--18-1lcl.xn--p1ai/]проекты одноэтажных домов из газобетона[/url] на любом этапе строительства. У Вас уже имеется загородный участок? Отлично, дом мы берем на себя. Определим различные нюансы, дадим рекомендации от профессионалов по расположению. Участка пока нет? Мы предложим Вам несколько разных вариаций, которые смогут подойти определенно под Ваш спрос.
[u][b] Здравствуйте![/b][/u]
Мы предлагаем дипломы любой профессии по приятным тарифам. Цена будет зависеть от выбранной специальности, года выпуска и образовательного учреждения.
Где купить диплом по актуальной специальности?
[b]Приобрести диплом любого ВУЗа[/b]
[url=http://arusak-diploms-srednee.ru/kupit-diplom-medicinskogo-uchilishha ]arusak-diploms-srednee.ru/kupit-diplom-medicinskogo-uchilishha [/url]
[b]Успехов в учебе![/b]
[u][b] Привет![/b][/u]
Приобрести документ о получении высшего образования можно в нашей компании. Мы оказываем услуги по продаже документов об окончании любых ВУЗов РФ. Вы получите необходимый диплом по любым специальностям, любого года выпуска, включая документы Советского Союза.
[url=http://krugozorov.ru/forum/user/9182//]krugozorov.ru/forum/user/9182/[/url]
[b]Успешной учебы![/b]
[u][b] Здравствуйте![/b][/u]
[b]Заказать документ[/b] университета можно у нас.
[url=http://diploms-x24.ru/kupit-diplom-o-srednem-obrazovanii/]diploms-x24.ru/kupit-diplom-o-srednem-obrazovanii[/url]
[b]Успешной учебы![/b]
Когда речь идет о перепланировке помещений, стоимость играет решающую роль. Многие считают, что качественные услуги по перепланировке обязательно должны быть дорогими. Однако это не так. Наша компания предлагает доступные цены без ущерба для качества.
Если вы ищете [url=https://potolki-kitstroy.ru/]перепланировка помещений стоимость[/url], которая вас устроит, обратитесь к нам. Мы предоставляем полный комплекс услуг, включая разработку проекта и выполнение всех строительных работ. Наши цены конкурентоспособны, а качество остается на высоте, что делает нас лучшим выбором.
[u][b] Привет![/b][/u]
Где заказать диплом по необходимой специальности?
[b]Купить диплом ВУЗа.[/b]
[url=http://formulaf1.ru/byistroe-oformlenie-diploma-lyuboy-spetsialnosti/]formulaf1.ru/byistroe-oformlenie-diploma-lyuboy-spetsialnosti[/url]
https://karimmassimov.com/
[url=https://practiceofwellness.com/forum/topic/sdfghjhtreee/?part=324#postid-219514]karimmassimov.com[/url] 320f7_5
На сайте https://xn--80aa1agibdda2ab.xn--p1ai/ можно приобрести насосное оборудование, автоматику, средства управления, трубопроводную арматуру. Ознакомьтесь со всеми самыми выгодными предложениями прямо сейчас, в том числе, и хитами продаж. Именно они пользуются особым спросом среди покупателей. На всю продукцию установлены привлекательные расценки, зачастую действуют акции, которые делают приобретение более выгодным. Все товары от лучших производителей, положительно себя зарекомендовавших.
I love what you guys are up too. This kind of clever work and coverage!
Keep up the terrific works guys I’ve added you guys to
our blogroll.
https://subscribe.ru/author/25924851/group/records/?page=49
купить диплом баумана [url=https://asxdiplomik.com/kupit-diplom-moskva/]купить диплом баумана[/url] .
[u][b] Здравствуйте![/b][/u]
[b]Приобрести диплом любого ВУЗа.[/b]
[url=http://watucowalu.cavandoragh.org/cto-smozet-sejcas-predostavit-onlajn-magazin-s-diplomami/]watucowalu.cavandoragh.org/cto-smozet-sejcas-predostavit-onlajn-magazin-s-diplomami[/url]
купить диплом в ленинск-кузнецком [url=https://diploms-x.com/]https://diploms-x.com/[/url] .
[u][b] Привет, друзья![/b][/u]
Где приобрести диплом по актуальной специальности?
[url=http://nalubyutemy.forum2x2.ru/login/]nalubyutemy.forum2x2.ru/login[/url]
[b]Хорошей учебы![/b]
[u][b] Здравствуйте![/b][/u]
[b]Мы готовы предложить документы техникумов,[/b] которые расположены на территории всей Российской Федерации. Вы сможете купить диплом от любого учебного заведения, за любой год, указав необходимую специальность и оценки за все дисциплины. Дипломы и аттестаты делаются на бумаге самого высокого качества. Это дает возможность делать государственные дипломы, которые невозможно отличить от оригинала. Документы будут заверены необходимыми печатями и подписями.
[url=http://grp.7olimp.ru/viewtopic.php?f=13&t=1895&p=2457]grp.7olimp.ru/viewtopic.php?f=13&t=1895&p=2457[/url]
[u][b] Добрый день![/b][/u]
Где приобрести диплом специалиста?
Мы можем предложить документы институтов, расположенных в любом регионе РФ. Можно купить диплом за любой год, указав актуальную специальность и оценки за все дисциплины. Дипломы печатаются на бумаге самого высшего качества. Это дает возможность делать государственные дипломы, не отличимые от оригиналов. Они будут заверены всеми требуемыми печатями и штампами.
[b]Мы предлагаем дипломы[/b] психологов, юристов, экономистов и прочих профессий по невысоким тарифам.
[url=http://ast-diplomas.com/otzyvy]ast-diplomas.com/otzyvy[/url]
[u][b] Всегда вам поможем![u][b]
[u][b] Здравствуйте![/b][/u]
Купить документ о получении высшего образования вы можете в нашем сервисе. Мы оказываем услуги по изготовлению и продаже документов об окончании любых ВУЗов России.
[b]Наши специалисты предлагают[/b] выгодно приобрести диплом, который выполнен на бланке ГОЗНАКа и заверен печатями, штампами, подписями. Наш документ пройдет лубую проверку, даже при использовании специального оборудования.
mtpkrskstate.ru/forum/user/199938/
cntu-vek.ru/forum/user/13077/
http://www.synthonia.com/community/624645-adybobexe/profile
adsauto.info/index.php?subaction=userinfo&user=uhudugyb
fire-team.ru/forum/showthread.php?p=35314#post35314
купить дипл [url=https://asxdiplomik24.ru/]asxdiplomik24.ru[/url] .
[u][b] Привет, друзья![/b][/u]
[b]Наши специалисты предлагают[/b] быстро и выгодно приобрести диплом, который выполняется на бланке ГОЗНАКа и заверен печатями, водяными знаками, подписями должностных лиц. Данный документ способен пройти лубую проверку, даже с применением профессиональных приборов. Достигайте цели быстро и просто с нашим сервисом.
[url=http://forum.infinite-soul.org/viewtopic.php?f=64&t=16412/]forum.infinite-soul.org/viewtopic.php?f=64&t=16412[/url]
[b]Успехов в учебе![/b]
Приветствую. Может кто знает, где найти полезные статьи о недвижимости? Пока нашел https://hameleon1.ru
Bieber’s https://baby.justinbieber-br.com path to global fame began with his breakthrough success Baby, which became his signature song and one of the most popular music videos of all time.
Kobe Bryant https://los-angeles-lakers.kobebryant-br.net one of the greatest basketball players of all the times, left an indelible mark on the history of sport.
In the world of professional tennis, the name of Gustavo Kuerten https://roland-garros.gustavokuerten.com is closely linked to one of the most prestigious Grand Slam tournaments – Roland Garros.
Ayrton Senna https://mclaren.ayrtonsenna-br.com is one of the greatest drivers in the history of Formula 1.
Achraf Hakimi https://paris-saint-germain.ashrafhakimi.net is a young Moroccan footballer who quickly reached the football elite European in recent years.
Hi there! This blog post couldn’t be written any better!
Going through this article reminds me of my previous roommate!
He constantly kept preaching about this. I will forward this post to him.
Fairly certain he’ll have a very good read. Thank you for sharing!
[u][b] Добрый день![/b][/u]
[b]Где заказать диплом специалиста?[/b]
[b]Мы предлагаем дипломы[/b] любой профессии по доступным тарифам.
[url=http://www.ekspoteh.ru/index.php?name=account&op=info&uname=agizemuq]www.ekspoteh.ru/index.php?name=account&op=info&uname=agizemuq[/url]
Мультимедийный интегратор [url=https://www.multimedijnyj-integrator.ru]Мультимедийный интегратор[/url] .
[u][b] Добрый день![/b][/u]
[b]Диплом вуза купить официально с упрощенным обучением в Москве [/b]
[url=http://blog.traftop.biz/2024/06/18/%d0%bd%d0%b5%d0%be%d0%b1%d1%85%d0%be%d0%b4%d0%b8%d0%bc%d0%be-%d1%81%d1%80%d0%be%d1%87%d0%bd%d0%be-%d0%b7%d0%b0%d0%ba%d0%b0%d0%b7%d0%b0%d1%82%d1%8c-%d0%b4%d0%b8%d0%bf%d0%bb%d0%be%d0%bc-%d0%be%d0%b1//]blog.traftop.biz/2024/06/18/%d0%bd%d0%b5%d0%be%d0%b1%d1%85%d0%be%d0%b4%d0%b8%d0%bc%d0%be-%d1%81%d1%80%d0%be%d1%87%d0%bd%d0%be-%d0%b7%d0%b0%d0%ba%d0%b0%d0%b7%d0%b0%d1%82%d1%8c-%d0%b4%d0%b8%d0%bf%d0%bb%d0%be%d0%bc-%d0%be%d0%b1/[/url]
[u][b] Рады оказать помощь![u][b].
[u][b] Добрый день![/b][/u]
[b]Приобрести диплом о высшем образовании.[/b]
[url=http://4atex.ru/blogs/2072/ упите-?ипломы-Ѕыстро-и-Ќадежно/]4atex.ru/blogs/2072/ упите-?ипломы-Ѕыстро-и-Ќадежно[/url]
[b]Удачи![/b]
[u][b] Здравствуйте![/b][/u]
Приобрести диплом о высшем образовании
[b]Наши специалисты предлагают[/b] быстро и выгодно приобрести диплом, который выполняется на оригинальной бумаге и заверен печатями, штампами, подписями официальных лиц. Наш документ пройдет лубую проверку, даже при помощи профессиональных приборов. Достигайте своих целей быстро и просто с нашим сервисом.
[b]Где заказать диплом специалиста?[/b]
[url=http://myfootballday.ru/kupit-diplom-vse-chto-vam-nuzhno-znat/]myfootballday.ru/kupit-diplom-vse-chto-vam-nuzhno-znat[/url]
[url=http://betalk.in.th/read-blog/2859/]betalk.in.th/read-blog/2859[/url]
[url=http://rucollectshoeclub.com/read-blog/1841/]rucollectshoeclub.com/read-blog/1841[/url]
[url=http://gadjetforyou.ru/nastoyashhie-diplomyi-legko-i-konfidentsialno/]gadjetforyou.ru/nastoyashhie-diplomyi-legko-i-konfidentsialno[/url]
[url=http://midoma.ru/node/katalog-i-sposoby-dostavki-v-internet-magazin/]midoma.ru/node/katalog-i-sposoby-dostavki-v-internet-magazin[/url]
Удивительно, но купить диплом кандидата наук оказалось не так сложно
[url=http://toplentanews.ru/gde-kupit-diplom-polnoe-rukovodstvo/]toplentanews.ru/gde-kupit-diplom-polnoe-rukovodstvo[/url]
На сайте https://ufa2.body-pit.ru/ приобретите качественное, сертифицированное спортивное питание, которое позволит заполучить красивое тело мечты, привлекательный рельеф или значительно похудеть. В этом интернет-магазине вы найдете витамины, гейнеры, сжигатели жира, аминокислоты, предтренировочные комплексы, антиоксиданты. Вся продукция сертифицированная, высокого качества, представлена именитыми брендами. Важным моментом является то, что доставка заказа осуществляется в тот день, когда оформили покупку.
laptops, tablets, and smartphones. This flexibility allows players to enjoy the game on their preferred device,
aviator game demo
Hmm it seems like your website ate my first comment (it was
super long) so I guess I’ll just sum it up what I submitted and say,
I’m thoroughly enjoying your blog. I too am an aspiring blog
blogger but I’m still new to the whole thing. Do you have any
recommendations for rookie blog writers? I’d really
appreciate it.
Зайдите на сайт https://moresliv.cc/ где вы сможете скачать огромное количество курсов бесплатно онлайн через торрент. Огромная база знаний и обучений. Складчины и видеоуроки, книги и вебинары – графика, программирование, бизнес, курсы блогеров и многое другое здесь. Более 175.000 различных курсов на сайте. Заходи!
Вопрос о том, как узаконить перепланировку, актуален для многих владельцев недвижимости. Наша компания предлагает комплексные услуги по легализации перепланировок, включая подготовку всех необходимых документов и взаимодействие с государственными органами.
С нашей помощью процесс [url=https://potolki-kitstroy.ru/]как узаконить перепланировку[/url] станет простым и понятным. Мы гарантируем быстрое получение всех разрешений и соблюдение всех строительных норм. Доверьте нам все заботы о легализации изменений в вашем помещении.
My programmer is trying to persuade me to move to .net from PHP.
I have always disliked the idea because of the expenses. But he’s tryiong none the less.
I’ve been using WordPress on numerous websites for about a year and am nervous about switching to another platform.
I have heard great things about blogengine.net. Is there a way I can transfer all
my wordpress posts into it? Any kind of help would be really appreciated!
I’m extremely impressed with your writing skills and also with the
layout on your weblog. Is this a paid theme or did you modify
it yourself? Anyway keep up the nice quality writing, it’s rare to see
a great blog like this one today.
Всем привет! Подскажите, где почитать полезные блоги о недвижимости? Пока нашел https://iskrb.ru
[u][b] Привет, друзья![/b][/u]
Мы можем предложить документы ВУЗов, которые находятся в любом регионе РФ. Можно купить диплом за любой год, включая документы СССР. Дипломы и аттестаты делаются на “правильной” бумаге самого высшего качества. Это позволяет делать настоящие дипломы, не отличимые от оригиналов. Документы будут заверены необходимыми печатями и штампами.
[b]Заказать диплом о высшем образовании.[/b]
[url=http://gta-balkan.com/events/event/45-%D0%BF%D1%80%D0%B8%D0%BE%D0%B1%D1%80%D0%B5%D1%82%D0%B0%D0%B5%D0%BC-%D0%B4%D0%B8%D0%BF%D0%BB%D0%BE%D0%BC-%D0%B2-%D0%BB%D1%83%D1%87%D1%88%D0%B5%D0%BC-%D0%BE%D0%BD%D0%BB%D0%B0%D0%B9%D0%BD-%D0%BC%D0%B0%D0%B3%D0%B0%D0%B7%D0%B8%D0%BD%D0%B5-%D0%BF%D0%BE-%D0%B2%D1%8B%D0%B3%D0%BE%D0%B4%D0%BD%D0%BE%D0%B9-%D1%86%D0%B5%D0%BD%D0%B5//]gta-balkan.com/events/event/45-%D0%BF%D1%80%D0%B8%D0%BE%D0%B1%D1%80%D0%B5%D1%82%D0%B0%D0%B5%D0%BC-%D0%B4%D0%B8%D0%BF%D0%BB%D0%BE%D0%BC-%D0%B2-%D0%BB%D1%83%D1%87%D1%88%D0%B5%D0%BC-%D0%BE%D0%BD%D0%BB%D0%B0%D0%B9%D0%BD-%D0%BC%D0%B0%D0%B3%D0%B0%D0%B7%D0%B8%D0%BD%D0%B5-%D0%BF%D0%BE-%D0%B2%D1%8B%D0%B3%D0%BE%D0%B4%D0%BD%D0%BE%D0%B9-%D1%86%D0%B5%D0%BD%D0%B5/[/url]
[b]Удачи![/b]
[u][b] Добрый день![/b][/u]
Мы изготавливаем дипломы любой профессии по приятным ценам. Стоимость будет зависеть от определенной специальности, года получения и ВУЗа.
Где приобрести диплом специалиста?
[b]Заказать диплом о высшем образовании[/b]
[url=http://arusak-diploms-srednee.ru/kupit-diplom-v-nizhnem-novgorode ]arusak-diploms-srednee.ru/kupit-diplom-v-nizhnem-novgorode [/url]
[b]Хорошей учебы![/b]
Safety and Fair Play
aviator game
[u][b] Привет, друзья![/b][/u]
[b]Купить документ[/b] института вы сможете в нашем сервисе.
[url=http://diplomasx24.ru/kupit-diplom-vracha/]diplomasx24.ru/kupit-diplom-vracha[/url]
[b]Успехов в учебе![/b]
PASPA was first tested in 2011 when New Jersey voters authorized an amendment
to the state constfitution to allow sports betting.
Heere is my page :: 트랜잭션 수수료
[u][b] Здравствуйте![/b][/u]
Купить диплом о высшем образовании
[b]Наша компания предлагает[/b] выгодно заказать диплом, который выполняется на бланке ГОЗНАКа и заверен мокрыми печатями, водяными знаками, подписями. Диплом пройдет любые проверки, даже с использованием профессиональных приборов. Решайте свои задачи максимально быстро с нашей компанией.
[b]Где купить диплом по нужной специальности?[/b]
[url=http://www.simplemachines.org/about/smf/stats.php/]www.simplemachines.org/about/smf/stats.php[/url]
[url=http://forumkk.listbb.ru/viewtopic.php?f=12&t=392/]forumkk.listbb.ru/viewtopic.php?f=12&t=392[/url]
[url=http://kino.10bb.ru/viewtopic.php?id=163545#p276485/]kino.10bb.ru/viewtopic.php?id=163545#p276485[/url]
[url=http://lubercy.ixbb.ru/viewtopic.php?id=6615#p14726/]lubercy.ixbb.ru/viewtopic.php?id=6615#p14726[/url]
[url=http://3drus.ru/forum/topic_34806/]3drus.ru/forum/topic_34806[/url]
[u][b] Привет, друзья![/b][/u]
[b]Наша компания предлагает купить диплом[/b] в отличном качестве, который невозможно отличить от оригинала без участия специалистов высокой квалификации со сложным оборудованием.
[url=http://miupsik.ru/forums/showthread.php?tid=35369/]miupsik.ru/forums/showthread.php?tid=35369[/url]
[b]Успехов в учебе![/b]
[u][b] Привет![/b][/u]
Купить документ университета можно в нашей компании в столице. Мы предлагаем документы об окончании любых ВУЗов РФ.
[url=http://www.lada-xray.net/showthread.php?p=32743#post32743/]www.lada-xray.net/showthread.php?p=32743#post32743[/url]
[url=http://bazar-planet.ru/index.php?threads/%D0%92-%D0%9D%D0%90%D0%A8%D0%A3-%D0%9A%D0%9E%D0%9C%D0%90%D0%9D%D0%94%D0%A3-%D0%A6%D0%95%D0%9B%D0%95-%D0%A3%D0%A1%D0%A2%D0%A0%D0%95%D0%9C%D0%9B%D0%95%D0%9D%D0%AB%D0%A5-%D0%A2%D0%A0%D0%95%D0%91%D0%A3%D0%AE%D0%A2%D0%A1%D0%AF-%D0%A0%D0%90%D0%91%D0%9E%D0%A2%D0%9D%D0%98%D0%9A%D0%98-%D1%82%D0%B0%D0%BA%D0%B8%D0%B5-%D0%B3%D0%BE%D1%80%D0%BE%D0%B4%D0%B0-%D0%90%D0%BB%D0%BC%D0%B0%D1%82%D0%B0-%D0%A2%D0%B0%D1%80%D0%B0%D0%B7%D0%B0-%D0%90%D1%81%D1%82%D0%B0%D0%BD%D0%B0-%D0%A3%D1%81%D1%82%D1%8C-%D0%9A%D0%B0%D0%BC%D0%B5%D0%BD%D0%B3.203/page-5#post-5031/]bazar-planet.ru/index.php?threads/%D0%92-%D0%9D%D0%90%D0%A8%D0%A3-%D0%9A%D0%9E%D0%9C%D0%90%D0%9D%D0%94%D0%A3-%D0%A6%D0%95%D0%9B%D0%95-%D0%A3%D0%A1%D0%A2%D0%A0%D0%95%D0%9C%D0%9B%D0%95%D0%9D%D0%AB%D0%A5-%D0%A2%D0%A0%D0%95%D0%91%D0%A3%D0%AE%D0%A2%D0%A1%D0%AF-%D0%A0%D0%90%D0%91%D0%9E%D0%A2%D0%9D%D0%98%D0%9A%D0%98-%D1%82%D0%B0%D0%BA%D0%B8%D0%B5-%D0%B3%D0%BE%D1%80%D0%BE%D0%B4%D0%B0-%D0%90%D0%BB%D0%BC%D0%B0%D1%82%D0%B0-%D0%A2%D0%B0%D1%80%D0%B0%D0%B7%D0%B0-%D0%90%D1%81%D1%82%D0%B0%D0%BD%D0%B0-%D0%A3%D1%81%D1%82%D1%8C-%D0%9A%D0%B0%D0%BC%D0%B5%D0%BD%D0%B3.203/page-5#post-5031[/url]
[url=http://beachhouse-living.com/index.php/component/kunena/user/24288-ozosapi/]beachhouse-living.com/index.php/component/kunena/user/24288-ozosapi[/url]
[url=http://food-ua.com/wr_board/tools.php?event=profile&pname=uzarin/]food-ua.com/wr_board/tools.php?event=profile&pname=uzarin[/url]
[url=http://region-standart.ru/guestbook/?1718888197/]region-standart.ru/guestbook/?1718888197[/url]
[u][b] Здравствуйте![/b][/u]
[b]Покупка диплома о среднем полном образовании: как избежать мошенничества? [/b]
[url=http://ya.webtalk.ru/viewtopic.php?id=9687#p47317/]ya.webtalk.ru/viewtopic.php?id=9687#p47317[/url]
[u][b] Рады помочь![u][b].
Anderson Silva https://killer-bees-muay-thai-college.andersonsilva.net was born in 1975 in Curitiba Brazil. From a young age he showed an interest in martial arts, starting to train in karate at the age of 5.
Daniel Alves https://paris-saint-germain.danielalves.net is a name that symbolizes the greatness of the world of football.
Bruno Miguel Borges Fernandes https://manchester-united.brunofernandes-br.com was born on September 8, 1994 in Maia, Portugal.
Rodrygo Silva de Goes https://real-madrid.rodrygo-br.com, known simply as Rodrygo, emerged as one of the the brightest young talents in world football.
Nuno Mendes https://paris-saint-germain.nuno-mendes.com, a talented Portuguese left-back, He quickly became one of the key figures in the Paris Saint-Germain (PSG) team.
Приветствую. Может кто знает, где найти полезные статьи о недвижимости? Сейчас читаю https://juzhnybereg24.ru
Game Mechanics
aviator demo
I got this site from my friend who informed me concerning this web site and now this time I am browsing
this web page and reading very informative articles at this place.
https://communityofbabel.com/fr/forums/discussion/middle-east-culture/proxyelite-prix-abordables-pour-tous
[url=https://mounjaro-5mg.ru/mundzharo]список препаратов +для похудения[/url] – тирзепатид инструкция +по применению купить +в москве, mounjaro +в россии
На сайте https://sochi.calypso.ooo/ у вас получится быстро отыскать и забронировать яхту, катер либо парусники. Компания насчитывает 20 филиалов, обслуживает более полутора тысяч клиентов в год. Все судна исправные, отличаются привлекательным, стильным дизайном. При этом заказать можно в любое, наиболее комфортное время и на несколько часов. Все ограничивается лишь вашими пожеланиями, предпочтениями. Этот сервис поможет вам подобрать наиболее подходящий вариант на прогулку, романтическое свидание или празднование торжества.
Скачать музыку https://kissvk.top/ очень просто! Зайдите на сайт где вы найдете самые свежие композиции, музыку, альбомы, треки. Новинки 2024 и лучшая музыка за все годы, которую можно качать в mp3 абсолютно бесплатно и без регистрации. Самый большой сборник музыки в интернете для скачивания у нас на сайте.
The future of the Aviator Game looks promising, with continuous updates and improvements. As technology
aviator game
На сайте https://somovo-mebel.ru/catalog/gostinnye/ вы сможете приобрести функциональные, качественные гостиные, которые разработаны с особой заботой о покупателях и их комфорте. И самое важное, что соблюдаются все технологические процессы, внимание уделяется каждой детали. Предлагаются такие гостиные, которые полностью отвечают запросам и требованиям самого притязательного покупателя. Все гостиные выполнены из современных, высококачественных материалов, за счет чего мебель прослужит очень долго. Гостиные выполнены в самом разном стиле.
Лучшие казино
[u][b] Привет, друзья![/b][/u]
[b]Приобрести документ[/b] о получении высшего образования можно у нас.
[url=http://ast-diploms.com/kupit-diplom-krasnoyarsk/]ast-diploms.com/kupit-diplom-krasnoyarsk[/url]
[b]Удачи![/b]
Приветствую. Подскажите, где почитать разные блоги о недвижимости? Сейчас читаю https://klimat-hck.ru
[url=https://mounjaro-kupit.su]mounjaro препарат[/url] – тирзепатид купить +в москве, препарат мунжаро
[u][b] Добрый день![/b][/u]
Где приобрести диплом по необходимой специальности?
Наша компания предлагает выгодно и быстро купить диплом, который выполнен на бланке ГОЗНАКа и заверен печатями, штампами, подписями официальных лиц. Данный документ пройдет любые проверки, даже с использованием специальных приборов. Достигайте своих целей быстро и просто с нашей компанией.
[b]Купить диплом о высшем образовании.[/b]
[url=http://social.acadri.org/read-blog/27394/]social.acadri.org/read-blog/27394[/url]
My partner and I absolutely love your blog and find many of your post’s to be just what
I’m looking for. can you offer guest writers to write content for
yourself? I wouldn’t mind creating a post or elaborating on some of the subjects you write concerning here.
Again, awesome weblog!
[u][b] Привет, друзья![/b][/u]
[b]Приобрести документ[/b] о получении высшего образования можно в нашем сервисе.
[url=http://asxdiplomik24.ru/kupit-diplom-ekaterinbur/]asxdiplomik24.ru/kupit-diplom-ekaterinbur[/url]
Earvin “Magic” Johnson https://los-angeles-lakers.magicjohnson.biz is one of the most legendary basketball players in history. NBA history.
Vinicius Junior https://real-madrid.vinicius-junior-ar.com the Brazilian prodigy whose full name is Vinicius Jose Baixao de Oliveira Junior, has managed to win the hearts of millions of fans around the world in a short period of time.
Victor Osimhen https://napoli.victorosimhen-ar.com born on December 29, 1998 in Lagos, Nigeria, has grown from an initially humble player to one of the brightest strikers in modern football.
Toni Kroos https://real-madrid.tonikroos-ar.com the German midfielder known for his accurate passes and calmness on the field, has achieved remarkable success at one of the most prestigious football clubs in the world.
Robert Lewandowski https://barcelona.robertlewandowski-ar.com is one of the most prominent footballers of our time, and his move to Barcelona has become one of the most talked about topics in world football.
http://solbi.co.kr/bbs/board.php?bo_table=gallery&wr_id=152678
многие из них испугались и тут же ушли, https://conifer.rhizome.org/DimaVolt другие же боялись смотреть художнице в глаза.
купить диплом техникума ссср в москве [url=https://diplomyx.com/]diplomyx.com[/url] .
купить диплом пту советского образца [url=https://asxdiplomik.com/]asxdiplomik.com[/url] .
dynamic features, and social elements, it offers an engaging experience for players. The game is supported by
п»їaviator game
купить медицинскую справку
Hello Gamers !
Welcome to Limelight Stream, the premier destination for high-quality streaming entertainment. Dive into a world of endless possibilities with our vast library of movies, TV shows, documentaries, and exclusive content. Limelight Stream is designed to provide an exceptional viewing experience, offering high-definition streaming that ensures every detail comes to life on your screen. Our platform is intuitive and user-friendly, making it easy to navigate and find your favorite content quickly. Whether you’re at home or on the go, you can enjoy seamless streaming on any device, including your TV, laptop, tablet, or smartphone. Personalized recommendations tailored to your viewing habits help you discover new favorites effortlessly. Sign up today and immerse yourself in the world of https://limelight-stream.com where entertainment knows no bounds.
Limelight user manual
Wireless game streaming
Gaming on the go with streaming
Alternatives to NVIDIA GameStream
Stream games to Windows Phone
Good luck!
however choosing the best https://jt.org/sweepstakes-games-vs-casino-games-the-differences/ is not easy. It’s like a magnet for attracting traffic, disguised as a gift giver, which produces your portal optimal place for visiting.
https://site547576904.fo.team/
when is pilot season 2023 the voice season 22 episode 20episode 1032the baxter family tv seriesridiculousness new season
Всем привет! Может кто знает, где почитать разные статьи о недвижимости? Пока нашел https://kolahouse.ru
сделать справку
[u][b] Привет, друзья![/b][/u]
[b]Заказать диплом университета.[/b]
Мы готовы предложить документы ВУЗов, расположенных в любом регионе Российской Федерации. Вы сможете заказать качественно сделанный диплом за любой год, указав актуальную специальность и хорошие оценки за все дисциплины. Дипломы и аттестаты выпускаются на “правильной” бумаге самого высокого качества. Это позволяет делать настоящие дипломы, которые невозможно отличить от оригинала. Документы заверяются необходимыми печатями и штампами.
[url=http://powerofthelamb.mn.co/posts/61828768/]powerofthelamb.mn.co/posts/61828768[/url]
[u][b] Здравствуйте![/b][/u]
[b]Как быстро получить диплом магистра? Легальные способы [/b]
[url=http://toolsrepair.ru/forum/viewtopic.php?f=5&t=2933455/]toolsrepair.ru/forum/viewtopic.php?f=5&t=2933455[/url]
[u][b] Рады оказать помощь![u][b].
Hmm it seems like your blog ate my first comment (it was super long) so I guess I’ll just sum it up what I submitted and say, I’m thoroughly enjoying your
blog. I as well am an aspiring blog blogger but I’m
still new to the whole thing. Do you have any points for rookie blog
writers? I’d definitely appreciate it.
Множество пользователей активно ищут удобные и доступные способы развлечения. Это привело к повышению популярности различных онлайн-сервисов [url=http://dianov.bget.ru/forum/thread58387.html#1303834]http://dianov.bget.ru/forum/thread58387.html#1303834[/url]
регистрация в 1xbet через соцсеть сложней, чем в одну клик, 1xbet однако в финале вы так равно получаете сгенерированные букмекером имя.
Stop by my webpage :: https://1xbet-noj.top/
При регистрации в казино 7k casino вы можете воспользоваться специальным промокодом и получить бонус – [url=https://kurl.ru/r7casinozerkalo]зеркало сайта r7 casino[/url]
Полезные советы по безопасной покупке диплома о высшем образовании
[url=http://ast-diploms24.ru/kupit-diplom-moskva/]ast-diploms24.ru/kupit-diplom-moskva[/url]
На сайте https://podolog66.ru/ вы сможете записаться на прием к подологу. Среди основных услуг выделяют: избавление от стержневой мозоли, лечение трещин стопы, грибка ногтей на ногах, удаление вросшего ногтя. Медики помогут восстановить детские ногти, удалят бородавки. Все манипуляции являются полностью безболезненными, выполняются с использованием уникальных технологий, высококачественных средств. Уже сразу пациент чувствует существенное облегчение. Вы можете записаться на консультацию или процедуру в наиболее комфортное для себя время.
vid-st.ru [url=www.internet-magazin-strojmaterialov.ru]vid-st.ru[/url] .
[u][b] Здравствуйте![/b][/u]
Мы можем предложить дипломы любой профессии по разумным ценам. Стоимость может зависеть от конкретной специальности, года выпуска и университета.
[url=http://arusak-diploms-srednee.ru/diplom-sredne-spetcialnoe-obrazovanie ]arusak-diploms-srednee.ru/diplom-sredne-spetcialnoe-obrazovanie [/url]
[b]Успехов в учебе![/b]
На сайте https://east-usa.com/index.html ознакомьтесь с подробной, актуальной информацией, которая касается карты Соединенных Штатов Америки. Только здесь представлена самая полная информация, которая вам обязательно пригодится для того, чтобы расширить кругозор. Перед вами подробная карта всех автомобильных дорог. Указаны и наиболее популярные достопримечательности, которые обязательно вас заинтересуют. Карта сгруппирована по следующим регионам: Средний Запад, Запад США, Юг США, Северо-восток.
купить справку о болезни
[u][b] Привет, друзья![/b][/u]
Где заказать диплом по нужной специальности?
[b]Приобрести диплом о высшем образовании.[/b]
[url=http://gta-balkan.com/events/event/39-%D0%BE%D0%B1%D1%88%D0%B8%D1%80%D0%BD%D1%8B%D0%B9-%D0%B0%D1%81%D1%81%D0%BE%D1%80%D1%82%D0%B8%D0%BC%D0%B5%D0%BD%D1%82-%D0%B4%D0%BE%D0%BA%D1%83%D0%BC%D0%B5%D0%BD%D1%82%D0%BE%D0%B2-%D0%B2-%D0%BF%D0%BE%D0%BF%D1%83%D0%BB%D1%8F%D1%80%D0%BD%D0%BE%D0%BC-%D0%BE%D0%BD%D0%BB%D0%B0%D0%B9%D0%BD-%D0%BC%D0%B0%D0%B3%D0%B0%D0%B7%D0%B8%D0%BD%D0%B5//]gta-balkan.com/events/event/39-%D0%BE%D0%B1%D1%88%D0%B8%D1%80%D0%BD%D1%8B%D0%B9-%D0%B0%D1%81%D1%81%D0%BE%D1%80%D1%82%D0%B8%D0%BC%D0%B5%D0%BD%D1%82-%D0%B4%D0%BE%D0%BA%D1%83%D0%BC%D0%B5%D0%BD%D1%82%D0%BE%D0%B2-%D0%B2-%D0%BF%D0%BE%D0%BF%D1%83%D0%BB%D1%8F%D1%80%D0%BD%D0%BE%D0%BC-%D0%BE%D0%BD%D0%BB%D0%B0%D0%B9%D0%BD-%D0%BC%D0%B0%D0%B3%D0%B0%D0%B7%D0%B8%D0%BD%D0%B5/[/url]
[u][b] Привет, друзья![/b][/u]
Купить документ ВУЗа вы сможете в нашей компании. Мы оказываем услуги по изготовлению и продаже документов об окончании любых университетов РФ. Вы сможете получить необходимый диплом по любым специальностям, любого года выпуска, в том числе документы Советского Союза.
[url=http://l90226mw.beget.tech/2024/07/12/vash-put-k-uspehu-s-nashim-diplomom.html/]l90226mw.beget.tech/2024/07/12/vash-put-k-uspehu-s-nashim-diplomom.html[/url]
[url=http://riftynet.com/blogs/26120/Оформление-дипломов-с-гарантией-качества/]riftynet.com/blogs/26120/Оформление-дипломов-с-гарантией-качества[/url]
[url=http://mirniy.flybb.ru/viewtopic.php?f=37&t=795/]mirniy.flybb.ru/viewtopic.php?f=37&t=795[/url]
[url=http://comedyforme.ru/legkiy-sposob-poluchit-diplom-byistro-i-konfidentsialno/]comedyforme.ru/legkiy-sposob-poluchit-diplom-byistro-i-konfidentsialno[/url]
[url=http://telugusaahityam.com/Легальный_диплом_без_лишних_хлопот:_узнайте_как!/]telugusaahityam.com/Легальный_диплом_без_лишних_хлопот:_узнайте_как![/url]
the opportunity to compete for larger prizes and showcase their skills on a larger stage.
demo aviator game
В Санкт-Петербурге Тех Профи – ваш надежный партнер в ремонте индукционных плит. Мы предлагаем квалифицированных инженеров, оригинальные запчасти и гарантию до 6 месяцев. Выезд курьера и возможность выездного ремонта обеспечат максимальный комфорт нашим клиентам.
What’s up, its nice article on the topic of media print, we all
be aware of media is a wonderful source of data.
диплом массаж купить [url=https://diplomasx.com/]diplomasx.com[/url] .
[u][b] Добрый день![/b][/u]
[b]Мы готовы предложить дипломы[/b] любой профессии по приятным ценам.
[url=http://wheeoo.com/read-blog/12035_nadezhnyj-i-proverennyj-internet-magazin-s-shirokim-katalogom-diplomov.html/]wheeoo.com/read-blog/12035_nadezhnyj-i-proverennyj-internet-magazin-s-shirokim-katalogom-diplomov.html[/url]
Willd Casino steps up the anté by feaaturing an extensive list ranging from cards and
cryptocurrencies.
my site; Click here to find out more
[u][b] Привет, друзья![/b][/u]
Купить диплом ВУЗа
[url=http://nongkhai.online/blogs/99/%D0%9D%D0%B0%D0%B4%D0%B5%D0%B6%D0%BD%D1%8B%D0%B9-%D0%B8%D0%BD%D1%82%D0%B5%D1%80%D0%BD%D0%B5%D1%82-%D0%BC%D0%B0%D0%B3%D0%B0%D0%B7%D0%B8%D0%BD-%D1%81-%D1%88%D0%B8%D1%80%D0%BE%D0%BA%D0%B8%D0%BC-%D0%B0%D1%81%D1%81%D0%BE%D1%80%D1%82%D0%B8%D0%BC%D0%B5%D0%BD%D1%82%D0%BE%D0%BC-%D0%B4%D0%B8%D0%BF%D0%BB%D0%BE%D0%BC%D0%BE%D0%B2/]nongkhai.online/blogs/99/%D0%9D%D0%B0%D0%B4%D0%B5%D0%B6%D0%BD%D1%8B%D0%B9-%D0%B8%D0%BD%D1%82%D0%B5%D1%80%D0%BD%D0%B5%D1%82-%D0%BC%D0%B0%D0%B3%D0%B0%D0%B7%D0%B8%D0%BD-%D1%81-%D1%88%D0%B8%D1%80%D0%BE%D0%BA%D0%B8%D0%BC-%D0%B0%D1%81%D1%81%D0%BE%D1%80%D1%82%D0%B8%D0%BC%D0%B5%D0%BD%D1%82%D0%BE%D0%BC-%D0%B4%D0%B8%D0%BF%D0%BB%D0%BE%D0%BC%D0%BE%D0%B2[/url]
сделать справку
Приветствую. Подскажите, где почитать разные блоги о недвижимости? Сейчас читаю https://komdizrem.ru
[u][b] Привет, друзья![/b][/u]
[b]Заказать документ[/b] института вы имеете возможность в нашей компании в столице.
[url=http://diplomasx24.ru/kupit-diplom-magistra/]diplomasx24.ru/kupit-diplom-magistra[/url]
[b]Хорошей учебы![/b]
Если вы ищете место, где смогут преобразить вас с головы до ног, рекомендую Felissimo. Этот салон предлагает широкий спектр услуг: от окрашивания и наращивания волос до маникюра. Специалисты салона используют современные методики и высококачественные материалы. Посещение Felissimo — это гарантия того, что вы выйдете оттуда абсолютно довольными. Отличный сервис и приятная атмосфера гарантированы!
ensures that the games are fair and that the platforms adhere to strict standards of operation.
aviator app
[u][b] Привет, друзья![/b][/u]
[b]Заказать документ[/b] о получении высшего образования вы можете у нас.
[url=http://ast-diplomy.com/kupit-diplom-moskva/]ast-diplomy.com/kupit-diplom-moskva[/url]
[u][b] Добрый день![/b][/u]
[b]Мы изготавливаем дипломы[/b] психологов, юристов, экономистов и прочих профессий по выгодным ценам.
[url=http://iladuanas.com/%D0%BE%D1%82%D0%B7%D1%8B%D0%B2%D1%8B-%D0%BE-%D0%BA%D1%83%D0%BF%D0%B8%D1%82%D1%8C-%D0%B4%D0%B8%D0%BF%D0%BB%D0%BE%D0%BC/]iladuanas.com/%D0%BE%D1%82%D0%B7%D1%8B%D0%B2%D1%8B-%D0%BE-%D0%BA%D1%83%D0%BF%D0%B8%D1%82%D1%8C-%D0%B4%D0%B8%D0%BF%D0%BB%D0%BE%D0%BC/[/url]
Opened up interesting material – I recommend sharing this discovery https://faithstreamer.com/blogs/3226/Elite-Escort-Services-in-Riga
нажать кнопку «Мой https://1xbet-myg.top/ аккаунт» вверху страницы.
Медиагет постоянно развивается, учитывая отзывы и пожелания пользователей. На сайте https://skachat-mediaget-fast.ru регулярно публикуются обновления, включающие новые функции и исправления обнаруженных ошибок. Одним из последних нововведений стала улучшенная система приоритетов загрузки, которая позволяет более эффективно управлять процессом скачивания нескольких файлов одновременно. Это особенно полезно для пользователей, которые часто работают с большими объемами данных.
Приветствую. Может кто знает, где почитать разные статьи о недвижимости? Сейчас читаю https://konditsioneri-shop.ru
https://subscribe.ru/author/25924851/group/records/?page=48
[u][b] Привет![/b][/u]
Где купить диплом по актуальной специальности?
Мы можем предложить документы ВУЗов, расположенных на территории всей России. Можно заказать диплом от любого заведения, за любой год, указав подходящую специальность и хорошие оценки за все дисциплины. Дипломы выпускаются на “правильной” бумаге самого высокого качества. Это дает возможности делать государственные дипломы, не отличимые от оригинала. Документы будут заверены всеми необходимыми печатями и подписями.
[b]Мы изготавливаем дипломы[/b] любых профессий по разумным ценам.
[url=http://ast-diplomy.com/kupit-diplom-o-srednem-obrazovanii]ast-diplomy.com/kupit-diplom-o-srednem-obrazovanii[/url]
[u][b] Будем рады вам помочь![u][b]
[u][b] Добрый день![/b][/u]
[b]Мы готовы предложить документы техникумов,[/b] которые расположены в любом регионе РФ. Можно приобрести качественно сделанный диплом от любого заведения, за любой год, в том числе документы старого образца. Документы выпускаются на бумаге самого высшего качества. Это дает возможности делать настоящие дипломы, не отличимые от оригинала. Документы будут заверены всеми требуемыми печатями и штампами.
[url=http://boxer-forum.ru/topic3653.html?view=next]boxer-forum.ru/topic3653.html?view=next[/url]
[u][b] Привет, друзья![/b][/u]
[b]Приобрести диплом о высшем образовании.[/b]
Мы можем предложить документы ВУЗов, которые находятся в любом регионе Российской Федерации. Можно приобрести диплом за любой год, указав актуальную специальность и оценки за все дисциплины. Документы выпускаются на бумаге высшего качества. Это позволяет делать настоящие дипломы, которые невозможно отличить от оригинала. Они будут заверены необходимыми печатями и подписями.
[url=http://www.indianhighcaste.com/read-blog/2120/]www.indianhighcaste.com/read-blog/2120[/url]
Bonuses: Online casinos often offer bonuses and promotions, enhancing the gaming experience.
aviator game
[u][b] Привет![/b][/u]
Мы готовы предложить дипломы любых профессий по приятным ценам. Стоимость может зависеть от конкретной специальности, года получения и образовательного учреждения.
[url=http://arusak-diploms-srednee.ru/kupit-diplom-sssr ]arusak-diploms-srednee.ru/kupit-diplom-sssr [/url]
[b]Успешной учебы![/b]
[u][b] Добрый день![/b][/u]
[b]Пошаговая инструкция по официальной покупке диплома о высшем образовании [/b]
[url=http://itisenglish.maxbb.ru/viewtopic.php?f=7&t=1065/]itisenglish.maxbb.ru/viewtopic.php?f=7&t=1065[/url]
[u][b] Рады помочь![u][b].
На сайте http://eoknadveri.ru закажите звонок для того, чтобы приобрести пластиковые окна от производителя. Конструкции создаются из алюминия, ПВХ. На все предоставляется гарантия – 20 лет, ведь сотрудники предприятия уверены в своей работе. Отсутствует торговая надбавка. Доставка, замер, монтажные работы – все это выполняется тогда, когда удобно именно вам. При необходимости вы сможете воспользоваться бесплатной консультацией. Компания выполняет остекление балконов, квартир, фасадов, коттеджей.
купить диплом о среднем специальном образовании цена [url=https://asxdiplomik24.ru/]купить диплом о среднем специальном образовании цена[/url] .
[u][b] Привет![/b][/u]
[b]Наши специалисты предлагают[/b] выгодно и быстро заказать диплом, который выполнен на бланке ГОЗНАКа и заверен мокрыми печатями, водяными знаками, подписями. Диплом пройдет лубую проверку, даже при использовании профессиональных приборов. Решите свои задачи максимально быстро с нашей компанией.
[url=http://androidb.ru/index.php?subaction=userinfo&user=ypixexyq/]androidb.ru/index.php?subaction=userinfo&user=ypixexyq[/url]
[b]Хорошей учебы![/b]
[u][b] Добрый день![/b][/u]
Где купить диплом по нужной специальности?
[b]Приобрести диплом о высшем образовании.[/b]
[url=http://gamemotors.ru/diplom-dlya-uspeshnoy-kareryi-dostupno-kazhdomu/]gamemotors.ru/diplom-dlya-uspeshnoy-kareryi-dostupno-kazhdomu[/url]
[u][b] Привет![/b][/u]
[b]Приобрести диплом о высшем образовании.[/b]
[url=http://sonnick84.aioblogs.com/81929898/%D0%A1%D0%BE%D0%B2%D0%B5%D1%82%D1%8B-%D1%8D%D0%BA%D1%81%D0%BF%D0%B5%D1%80%D1%82%D0%B0-%D1%87%D1%82%D0%BE-%D0%B4%D0%B0%D0%B4%D1%83%D1%82-%D0%B2%D0%BE%D0%B7%D0%BC%D0%BE%D0%B6%D0%BD%D0%BE%D1%81%D1%82%D1%8C-%D0%BD%D0%B5%D0%B4%D0%BE%D1%80%D0%BE%D0%B3%D0%BE-%D0%BF%D1%80%D0%B8%D0%BE%D0%B1%D1%80%D0%B5%D1%81%D1%82%D0%B8-%D0%B4%D0%BE%D0%BA%D1%83%D0%BC%D0%B5%D0%BD%D1%82%D1%8B/]sonnick84.aioblogs.com/81929898/%D0%A1%D0%BE%D0%B2%D0%B5%D1%82%D1%8B-%D1%8D%D0%BA%D1%81%D0%BF%D0%B5%D1%80%D1%82%D0%B0-%D1%87%D1%82%D0%BE-%D0%B4%D0%B0%D0%B4%D1%83%D1%82-%D0%B2%D0%BE%D0%B7%D0%BC%D0%BE%D0%B6%D0%BD%D0%BE%D1%81%D1%82%D1%8C-%D0%BD%D0%B5%D0%B4%D0%BE%D1%80%D0%BE%D0%B3%D0%BE-%D0%BF%D1%80%D0%B8%D0%BE%D0%B1%D1%80%D0%B5%D1%81%D1%82%D0%B8-%D0%B4%D0%BE%D0%BA%D1%83%D0%BC%D0%B5%D0%BD%D1%82%D1%8B[/url]
[u][b] Привет![/b][/u]
Где приобрести диплом специалиста?
[b]Купить диплом о высшем образовании.[/b]
[url=http://forosmex.com/index.php?/gallery/image/540-%D0%BA%D0%B0%D0%BA-%D0%BF%D0%BE%D0%B4%D0%BE%D0%B1%D1%80%D0%B0%D1%82%D1%8C-%D0%BD%D0%B0%D0%B4%D0%B5%D0%B6%D0%BD%D1%8B%D0%B9-%D0%BE%D0%BD%D0%BB%D0%B0%D0%B9%D0%BD-%D0%BC%D0%B0%D0%B3%D0%B0%D0%B7%D0%B8%D0%BD-%D1%81-%D0%BE%D0%B1%D1%88%D0%B8%D1%80%D0%BD%D1%8B%D0%BC-%D0%B2%D1%8B%D0%B1%D0%BE%D1%80%D0%BE%D0%BC-%D0%B4%D0%B8%D0%BF%D0%BB%D0%BE%D0%BC%D0%BE%D0%B2//]forosmex.com/index.php?/gallery/image/540-%D0%BA%D0%B0%D0%BA-%D0%BF%D0%BE%D0%B4%D0%BE%D0%B1%D1%80%D0%B0%D1%82%D1%8C-%D0%BD%D0%B0%D0%B4%D0%B5%D0%B6%D0%BD%D1%8B%D0%B9-%D0%BE%D0%BD%D0%BB%D0%B0%D0%B9%D0%BD-%D0%BC%D0%B0%D0%B3%D0%B0%D0%B7%D0%B8%D0%BD-%D1%81-%D0%BE%D0%B1%D1%88%D0%B8%D1%80%D0%BD%D1%8B%D0%BC-%D0%B2%D1%8B%D0%B1%D0%BE%D1%80%D0%BE%D0%BC-%D0%B4%D0%B8%D0%BF%D0%BB%D0%BE%D0%BC%D0%BE%D0%B2/[/url]
диплом гознак высшего образования купить [url=https://diploms-x.com/]https://diploms-x.com/[/url] .
Howdy! Would you mind if I share your blog with my myspace group?
There’s a lot of people that I think would really appreciate your content.
Please let me know. Thank you
The latter are concerned with raising feminist challenges within their organizations.
Here is my blog post; https://badatpeople.com/wiki/index.php/User:VerlaMcmanus
[u][b] Добрый день![/b][/u]
Где заказать диплом по необходимой специальности?
[url=http://forcemajor.maxbb.ru/viewtopic.php?f=7&t=826/]forcemajor.maxbb.ru/viewtopic.php?f=7&t=826[/url]
[b]Удачи![/b]
[u][b] Привет, друзья![/b][/u]
[b]Купить документ[/b] института можно у нас в столице.
[url=http://ast-diplom24.ru/kupit-diplom-moskva/]ast-diplom24.ru/kupit-diplom-moskva[/url]
[b]Хорошей учебы![/b]
[u][b] Привет, друзья![/b][/u]
Купить документ института вы можете у нас в Москве. Мы оказываем услуги по продаже документов об окончании любых университетов России. Вы сможете получить необходимый диплом по любым специальностям, включая документы СССР.
[url=http://www.goalissimo.org/forum/posting.php?mode=post&f=4&sid=22c94f5e41cb1c870c1af5510bb6dff1/]www.goalissimo.org/forum/posting.php?mode=post&f=4&sid=22c94f5e41cb1c870c1af5510bb6dff1[/url]
[url=http://keterclub.com/read-blog/10261/]keterclub.com/read-blog/10261[/url]
[url=http://rodina.listbb.ru/viewtopic.php?f=3&t=650/]rodina.listbb.ru/viewtopic.php?f=3&t=650[/url]
[url=http://sportraketka.ru/vash-diplom-za-korotkoe-vremya-prosto-i-udobno/]sportraketka.ru/vash-diplom-za-korotkoe-vremya-prosto-i-udobno[/url]
[url=http://www.nhps1914.com/wiki/Получите_диплом_без_учебы_и_стресса/]www.nhps1914.com/wiki/Получите_диплом_без_учебы_и_стресса[/url]
[u][b] Привет![/b][/u]
Приобрести диплом любого ВУЗа
[b]Наши специалисты предлагают[/b] быстро приобрести диплом, который выполнен на оригинальном бланке и заверен мокрыми печатями, штампами, подписями официальных лиц. Документ пройдет любые проверки, даже при помощи специально предназначенного оборудования. Достигайте цели быстро и просто с нашей компанией.
[b]Где купить диплом специалиста?[/b]
[url=http://kharkov-balka.com/showthread.php?p=154622#post154622/]kharkov-balka.com/showthread.php?p=154622#post154622[/url]
[url=http://kingasteroid.com/blogs/283/%D0%93%D0%BB%D0%B0%D0%B2%D0%BD%D1%8B%D0%B5-%D1%80%D0%B0%D1%81%D1%85%D0%BE%D0%B4%D1%8B-%D1%81%D0%BE%D0%B2%D1%80%D0%B5%D0%BC%D0%B5%D0%BD%D0%BD%D0%BE%D0%B3%D0%BE-%D0%BF%D1%80%D0%BE%D0%B8%D0%B7%D0%B2%D0%BE%D0%B4%D0%B8%D1%82%D0%B5%D0%BB%D1%8F-%D0%B4%D0%B8%D0%BF%D0%BB%D0%BE%D0%BC%D0%BE%D0%B2-%D0%BE%D0%B1%D0%B7%D0%BE%D1%80/]kingasteroid.com/blogs/283/%D0%93%D0%BB%D0%B0%D0%B2%D0%BD%D1%8B%D0%B5-%D1%80%D0%B0%D1%81%D1%85%D0%BE%D0%B4%D1%8B-%D1%81%D0%BE%D0%B2%D1%80%D0%B5%D0%BC%D0%B5%D0%BD%D0%BD%D0%BE%D0%B3%D0%BE-%D0%BF%D1%80%D0%BE%D0%B8%D0%B7%D0%B2%D0%BE%D0%B4%D0%B8%D1%82%D0%B5%D0%BB%D1%8F-%D0%B4%D0%B8%D0%BF%D0%BB%D0%BE%D0%BC%D0%BE%D0%B2-%D0%BE%D0%B1%D0%B7%D0%BE%D1%80[/url]
[url=http://o0u1gz8w1.blogsvirals.com/27878423/%D0%92%D1%8B-%D1%85%D0%BE%D1%82%D0%B8%D1%82%D0%B5-%D1%83%D0%B7%D0%BD%D0%B0%D1%82%D1%8C-%D0%BA%D0%B0%D0%BA-%D0%B7%D0%B0%D0%BA%D0%B0%D0%B7%D0%B0%D1%82%D1%8C-%D0%B4%D0%BE%D0%BA%D1%83%D0%BC%D0%B5%D0%BD%D1%82%D1%8B-%D0%B2-%D1%81%D0%B5%D1%82%D0%B8-%D0%B8%D0%BD%D1%82%D0%B5%D1%80%D0%BD%D0%B5%D1%82-%D0%97%D0%B0%D1%85%D0%BE%D0%B4%D0%B8%D1%82%D0%B5/]o0u1gz8w1.blogsvirals.com/27878423/%D0%92%D1%8B-%D1%85%D0%BE%D1%82%D0%B8%D1%82%D0%B5-%D1%83%D0%B7%D0%BD%D0%B0%D1%82%D1%8C-%D0%BA%D0%B0%D0%BA-%D0%B7%D0%B0%D0%BA%D0%B0%D0%B7%D0%B0%D1%82%D1%8C-%D0%B4%D0%BE%D0%BA%D1%83%D0%BC%D0%B5%D0%BD%D1%82%D1%8B-%D0%B2-%D1%81%D0%B5%D1%82%D0%B8-%D0%B8%D0%BD%D1%82%D0%B5%D1%80%D0%BD%D0%B5%D1%82-%D0%97%D0%B0%D1%85%D0%BE%D0%B4%D0%B8%D1%82%D0%B5[/url]
[url=http://korrespondentweek.ru/kupit-diplom-bez-posrednikov-legko-i-byistro//]korrespondentweek.ru/kupit-diplom-bez-posrednikov-legko-i-byistro/[/url]
[url=http://www.mobime.ru/forum/forum17.html/]www.mobime.ru/forum/forum17.html[/url]
ми надаємо вашій увазі неосяжний вибір речей, текстильних виробів, робочий одяг атрибути для всієї родини в Одесі оптом і поштучно за.
Also visit my homepage – https://eurosiz.ua/uk/product-category/robochyj-odyag/
[u][b] Здравствуйте![/b][/u]
[b]Мы изготавливаем дипломы[/b] психологов, юристов, экономистов и прочих профессий по приятным тарифам.
[url=http://worldavtonew.ru/ofitsialnyie-diplomyi-podlinnost-i-nadezhnost/]worldavtonew.ru/ofitsialnyie-diplomyi-podlinnost-i-nadezhnost[/url]
Found an article that is worth reading – it’s really interesting! https://www.adrex.com/en/search/?s%5Bk%5D=#id-s
Купить диплом о среднем полном образовании, в чем подвох и как избежать обмана?
[url=http://socialnetwork.cloudyzx.com/read-blog/12267/]socialnetwork.cloudyzx.com/read-blog/12267[/url]
Всем привет! Может кто знает, где найти разные блоги о недвижимости? Сейчас читаю https://glatt-nsk.ru
Common feedback from players includes requests for more in-game bonuses, additional multiplayer options, and
aviator game online
[u][b] Привет, друзья![/b][/u]
[b]Приобретение школьного аттестата с официальным упрощенным обучением в Москве [/b]
[url=http://forum.infinite-soul.org/viewtopic.php?f=64&t=16412/]forum.infinite-soul.org/viewtopic.php?f=64&t=16412[/url]
[u][b] Окажем помощь![u][b].
Промоакции и бонусы для игроков 1win Игроки всегда ищут способы увеличить свои шансы на выигрыш. Бонусные предложения и привлекательные акции помогают сделать игру более захватывающей [url=https://iuecwalocal81288.com/content/%D0%BF%D0%BE%D0%B4%D1%80%D0%BE%D0%B1%D0%BD%D1%8B%D0%B9-%D0%BE%D0%B1%D0%B7%D0%BE%D1%80-%D1%81%D0%BB%D0%BE%D1%82%D0%BE%D0%B2-%D0%BD%D0%B0-%D1%81%D0%B0%D0%B9%D1%82%D0%B5-1%D0%B2%D0%B8%D0%BD]https://iuecwalocal81288.com/content/%D0%BF%D0%BE%D0%B4%D1%80%D0%BE%D0%B1%D0%BD%D1%8B%D0%B9-%D0%BE%D0%B1%D0%B7%D0%BE%D1%80-%D1%81%D0%BB%D0%BE%D1%82%D0%BE%D0%B2-%D0%BD%D0%B0-%D1%81%D0%B0%D0%B9%D1%82%D0%B5-1%D0%B2%D0%B8%D0%BD[/url]
[u][b] Здравствуйте![/b][/u]
[b]Купить диплом любого университета.[/b]
[url=http://telegra.ph/Prokachaj-svoyo-obrazovanie-Priobreti-diplom-segodnya-05-16/]telegra.ph/Prokachaj-svoyo-obrazovanie-Priobreti-diplom-segodnya-05-16[/url]
[b]Успехов в учебе![/b]
Fantastic items from you, man. I’ve remember your stuff previous to
and you are simply extremely wonderful. I actually like what you have received here, certainly like what you are saying and the best way in which you are saying it.
You make it enjoyable and you continue to care for
to keep it smart. I can not wait to learn far
more from you. This is really a wonderful site.
Предлагаю компанию газон мск, их направление деятельности это газонный рулон, качество высочайшее.
website link [url=https://Trader-joe.homes/]trader joe[/url]
Vivez la TV suisse comme jamais expérimentée avec notre offre IPTV de haute qualité !
Accédez librement aux chaînes suisses populaires comme RTS (Radio Télévision Suisse), SRF, la RSI et bien d’autres. Notre solution offre :
Plus de 100 chaînes suisses et internationales en haute définition
Un sélection VOD riche en films et feuilletons
La faculté de revoir vos émissions préférées
Une interface conviviale qui fonctionne sur divers appareils
Un support client dynamique basé en Suisse
Que vous soyez fan de sport, d’informations ou de divertissement, notre offre IPTV
[url=https://tailormove41.werite.net/titre-abonnement-iptv-explorez-un-monde-de-divertissement-illimite]Werite – Abonnement IPTV, explorez un monde de divertissement illimité[/url]
s’adapte à vos envies. Profitez d’un essai gratuit pendant 24 heures et découvrez une méthode révolutionnaire pour regarder la TV !
купить диплом нового образца в самаре [url=https://ast-diplomas.com/]ast-diplomas.com[/url] .
E-wallets like PayPal and Neteller give rapid processing times of 24 hours or significantly less.
My site … https://krotcinus.com/etc/1267451
important source https://jaxxliberty.io/
look at more info [url=https://coimnarketcap.us/]coinmarketcap[/url]
Key Developers and Companies Involved
aviator game
Thanks in favor of sharing such a pleasant opinion, article is good, thats why i have read it fully
Предлагаю компанию Московские газоны, их специализация это рулонные газоны, качество высочайшее.
An outstanding share! I’ve just forwarded this onto a friend who had been conducting
a little research on this. And he actually bought me lunch because I found
it for him… lol. So allow me to reword this….
Thank YOU for the meal!! But yeah, thanks for spending time to discuss this
topic here on your blog.
BetMGM is a great place for new bettors to commence when looking to make a mobile deposit.
Here is my site; https://cedipedia.cmerz.ch/api.php?action=https://1-news.net/
[u][b] Привет, друзья![/b][/u]
Заказать документ университета можно у нас в столице. Мы оказываем услуги по изготовлению и продаже документов об окончании любых университетов России.
[url=http://heimur.ru/index.php?/topic/128-%D0%BA%D1%83%D0%BF%D0%B8%D1%82%D1%8C-%D0%B4%D0%B8%D0%BF%D0%BB%D0%BE%D0%BC-i98v//]heimur.ru/index.php?/topic/128-%D0%BA%D1%83%D0%BF%D0%B8%D1%82%D1%8C-%D0%B4%D0%B8%D0%BF%D0%BB%D0%BE%D0%BC-i98v/[/url]
[url=http://michiya-cs.com/userinfo.php?uid=30679/]michiya-cs.com/userinfo.php?uid=30679[/url]
[url=http://unnewsusa.com/bbs/board.php?bo_table=free&wr_id=2229467/]unnewsusa.com/bbs/board.php?bo_table=free&wr_id=2229467[/url]
[url=http://mydnepr.pp.ua/forum/topic.php?forum=7&topic=937/]mydnepr.pp.ua/forum/topic.php?forum=7&topic=937[/url]
[url=http://www.pax.nichost.ru/forum/view_profile.php?UID=133467/]www.pax.nichost.ru/forum/view_profile.php?UID=133467[/url]
[u][b] Привет![/b][/u]
[b]Наш сервис предлагает приобрести диплом[/b] в высочайшем качестве, который невозможно отличить от оригинала без использования дорогостоящего оборудования и опытного специалиста.
[url=http://propusk-spb.ru/index.php?subaction=userinfo&user=uqavomat/]propusk-spb.ru/index.php?subaction=userinfo&user=uqavomat[/url]
[b]Удачи![/b]
anchor [url=https://wasabiwallet.io]wasabi coinjoin[/url]
Pedro Gonzalez Lopez https://barcelona.pedri-ar.com known as Pedri, was born on November 25, 2002 in the small town of Tegeste, located on Tenerife, one of the Canary Islands.
[u][b] Привет, друзья![/b][/u]
[b]Как оказалось, купить диплом кандидата наук не так уж и сложно [/b]
[url=http://crystalroleplay.listbb.ru/viewtopic.php?f=14&t=2491/]crystalroleplay.listbb.ru/viewtopic.php?f=14&t=2491[/url]
[u][b] Будем рады вам помочь![u][b].
[u][b] Привет![/b][/u]
[b]Мы можем предложить документы техникумов[/b], которые расположены в любом регионе РФ. Можно купить качественный диплом за любой год, указав актуальную специальность и оценки за все дисциплины. Документы выпускаются на “правильной” бумаге самого высшего качества. Это дает возможность делать настоящие дипломы, которые не отличить от оригинала. Они заверяются необходимыми печатями и штампами.
[url=http://toyota-porte.ru/forums/index.php?autocom=gallery&req=si&img=2224/]toyota-porte.ru/forums/index.php?autocom=gallery&req=si&img=2224[/url]
The story of Leo Messi https://inter-miami.lionelmessi.ae‘s transfer to Inter Miami began long before the official announcement. Rumors about Messi’s possible departure from Barcelona appeared in 2020
Yacine Bounou https://al-hilal.yassine-bounou-ar.com known simply as Bono, is one of the most prominent Moroccan footballers of our time.
Andreson Souza Conceicao https://al-nassr.talisca-ar.com known as Talisca, is one of the brightest stars of modern football.
[u][b] Добрый день![/b][/u]
Как официально купить диплом магистра с упрощенным обучением в Москве
[url=http://landik-diploms-srednee.ru/svidetelstvo-o-razvode ]landik-diploms-srednee.ru/svidetelstvo-o-razvode [/url]
[b]Успешной учебы![/b]
https://new.gruz200.kz/
[u][b] Здравствуйте![/b][/u]
[b]Приобрести документ[/b] ВУЗа вы можете у нас в Москве.
[url=http://ast-diplomy24.ru/kupit-diplom-rostov-na-donu/]ast-diplomy24.ru/kupit-diplom-rostov-na-donu[/url]
[b]Удачи![/b]
Что делать, если после удаления папилломы появилась корочка?
Появление корочки после лазерного удаления папилломы является нормальным этапом заживления. Важно не срывать корочку и избегать ее повреждения. Корочка обычно отпадает самостоятельно через несколько дней, оставляя здоровую кожу. Если появляются признаки инфекции или сильное покраснение, необходимо обратиться к врачу.
What to do if a scab appears after papilloma removal?
The appearance of a scab after laser removal of a papilloma is a normal part of the healing process. It is important not to pick at the scab and avoid damaging it. The scab usually falls off on its own within a few days, leaving healthy skin. If signs of infection or severe redness appear, it is necessary to see a doctor.
Ensuring Safe Gaming Practices
aviator app
[url=https://t.me/s/noticias_rio]noticias[/url]
noticias
noticias
[u][b] Привет, друзья![/b][/u]
Заказать документ ВУЗа вы сможете в нашей компании. Мы предлагаем документы об окончании любых университетов РФ. Вы сможете получить необходимый диплом по любым специальностям, любого года выпуска, в том числе документы Советского Союза.
[url=http://chayka.ixbb.ru/viewtopic.php?id=147#p157/]chayka.ixbb.ru/viewtopic.php?id=147#p157[/url]
[url=http://ekonomimvmeste.ukrbb.net/viewtopic.php?f=8&t=60189/]ekonomimvmeste.ukrbb.net/viewtopic.php?f=8&t=60189[/url]
[url=http://bazhenova.greatforum.ru/viewtopic.php?f=17&t=5076/]bazhenova.greatforum.ru/viewtopic.php?f=17&t=5076[/url]
[url=http://newsbeautiful.ru/poluchite-diplom-v-kratchayshie-sroki//]newsbeautiful.ru/poluchite-diplom-v-kratchayshie-sroki/[/url]
[url=http://epicit.ru/garantirovannoe-oformlenie-diploma-pod-klyuch/]epicit.ru/garantirovannoe-oformlenie-diploma-pod-klyuch[/url]
[u][b] Добрый день![/b][/u]
[b]Мы изготавливаем дипломы[/b] любых профессий по приятным тарифам.
[url=http://avtovideotest.ru/nastoyashhie-diplomyi-dostupno-i-udobno/]avtovideotest.ru/nastoyashhie-diplomyi-dostupno-i-udobno[/url]
Очень впечатлил свадебный отдел и реализаторы сотрудничающие с нем.
My webpage – https://agromarket-2015.ru/
[url=https://t.me/s/noticias_desaopaulo]noticias[/url]
noticias
noticias
ремонт мобильных телефонов рядом
Thankfulness to my father who stated to me on the topic of this weblog, this blog is actually awesome.
[u][b] Привет![/b][/u]
[b]Как оказалось, купить диплом кандидата наук не так уж и сложно[/b]
[url=http://paskib.com/%D0%BA%D1%83%D0%BF%D0%B8%D1%82%D1%8C-%D0%B4%D0%B8%D0%BF%D0%BB%D0%BE%D0%BC-%D0%B2-%D0%BD%D0%BE%D0%B2%D0%BE%D1%80%D0%BE%D1%81%D1%81%D0%B8%D0%B9%D1%81%D0%BA%D0%B5//]paskib.com/%D0%BA%D1%83%D0%BF%D0%B8%D1%82%D1%8C-%D0%B4%D0%B8%D0%BF%D0%BB%D0%BE%D0%BC-%D0%B2-%D0%BD%D0%BE%D0%B2%D0%BE%D1%80%D0%BE%D1%81%D1%81%D0%B8%D0%B9%D1%81%D0%BA%D0%B5/[/url]
blumhouse movies when does season 11 of alaska the last frontier startchelsea winstanley moviesthe first film with soundwhere to watch your name anime movie
[url=https://t.me/noticias_defortaleza]noticias[/url]
noticias
noticias
https://new.gruz200.kz/
мебель из искусственного ротанга
Advanced Tips for Experienced Players
aviator game demo
[u][b] Привет![/b][/u]
Где приобрести диплом специалиста?
[b]Приобрести диплом университета.[/b]
[url=http://androidinweb.ru/diplom-lyuboy-spetsialnosti-kachestvenno-i-bezopasno/]androidinweb.ru/diplom-lyuboy-spetsialnosti-kachestvenno-i-bezopasno[/url]
[u][b] Здравствуйте![/b][/u]
Приобрести документ университета вы можете в нашей компании. Мы оказываем услуги по продаже документов об окончании любых ВУЗов РФ. Вы сможете получить диплом по любым специальностям, любого года выпуска, включая документы старого образца.
[url=http://mybaltika.info/ru/blogs/587/10348//]mybaltika.info/ru/blogs/587/10348/[/url]
[url=http://micchat.online/read-blog/1623/]micchat.online/read-blog/1623[/url]
[url=http://www.traveltravelforum.com/showthread.php/34068-Ваш-путь-к-успеху-диплом-на-заказ?p=69089#post69089/]www.traveltravelforum.com/showthread.php/34068-Ваш-путь-к-успеху-диплом-на-заказ?p=69089#post69089[/url]
[url=http://myturtime.ru/diplom-dlya-uspeshnoy-kareryi-prosto-i-dostupno/]myturtime.ru/diplom-dlya-uspeshnoy-kareryi-prosto-i-dostupno[/url]
[url=http://iqtorg.ru/forum/user/19168//]iqtorg.ru/forum/user/19168/[/url]
my site [url=https://jaxxliberty.io/]jaxx download[/url]
Самая лучшая еда тут – [url=https://restoyar.ru/]заказать еду на дом бесплатная доставка[/url] приходите прямо сегодня. Мы находимся по адресу: г. Ижевск, ул. Максима Горького, д. 163. График работы с 12:00 до 00:00, а в пт и сб с 12:00 до 2:00 ночи. Приглашаем Вас и Вашу семью великолепно провести время или оформить заказ на restoyar.ru на Ваш адрес и побаловаться вкусной кухней в своей привычной обстановке.
ремонт телефонов в москве адреса
aparthome.org
срочный ремонт телефонов
when in the yard, users has the opportunity to be interested in a stylish sweater or blouse, actually, in summer https://loxvil.com/ everyone can familiarize yourself with our assortment of shorts and skirts.
[u][b] Добрый день![/b][/u]
Где заказать диплом специалиста?
[b]Мы изготавливаем дипломы[/b] психологов, юристов, экономистов и любых других профессий по разумным ценам. Стоимость может зависеть от той или иной специальности, года получения и образовательного учреждения. Всегда стараемся поддерживать для заказчиков адекватную политику тарифов. [b]Для нас очень важно[/b], чтобы дипломы были доступны для большинства граждан.
[url=http://arusak-diploms-srednee.ru/kupit-diplom-kandidata-nauk ]arusak-diploms-srednee.ru/kupit-diplom-kandidata-nauk [/url]
[b]Хорошей учебы![/b]
Stumbled upon a unique article, I suggest you take a look https://sharevita.com/read-blog/30115
balforum.net
Пошаговая инструкция по безопасной покупке диплома о высшем образовании
[url=http://diplomyx.com/kupit-diplom-ekaterinbur/]diplomyx.com/kupit-diplom-ekaterinbur[/url]
[u][b] Привет, друзья![/b][/u]
[b]Приобрести документ[/b] о получении высшего образования можно в нашей компании.
[url=http://diploms-x24.ru/kupit-diplom-moskva/]diploms-x24.ru/kupit-diplom-moskva[/url]
[u][b] Привет![/b][/u]
[b]Где и как купить диплом о высшем образовании без лишних рисков[/b]
[url=http://swayycases.com/%D0%B4%D0%B8%D0%BF%D0%BB%D0%BE%D0%BC-%D1%83%D0%BD%D0%B8%D0%B2%D0%B5%D1%80%D1%81%D0%B8%D1%82%D0%B5%D1%82%D0%B0-%D0%BA%D1%83%D0%BF%D0%B8%D1%82%D1%8C-%D0%B2%D1%8B%D0%B3%D0%BE%D0%B4%D0%BD%D1%8B%D0%B5/]swayycases.com/%D0%B4%D0%B8%D0%BF%D0%BB%D0%BE%D0%BC-%D1%83%D0%BD%D0%B8%D0%B2%D0%B5%D1%80%D1%81%D0%B8%D1%82%D0%B5%D1%82%D0%B0-%D0%BA%D1%83%D0%BF%D0%B8%D1%82%D1%8C-%D0%B2%D1%8B%D0%B3%D0%BE%D0%B4%D0%BD%D1%8B%D0%B5/[/url]
Safety is paramount when playing online games. Players should ensure they are playing on reputable platforms
play plinko game
Brazilian footballer Neymar https://al-hilal.neymar-ar.com known for his unique playing style and outstanding achievements in world football, has made a surprise move to Al Hilal Football Club.
Harry Kane https://bayern.harry-kane-ar.com one of the most prominent English footballers of his generation, completed his move to German football club Bayern Munich in 2023.
Erling Haaland https://manchester-city.erling-haaland-ar.com born on July 21, 2000 in Leeds, England, began his football journey at an early age.
Football in Saudi Arabia https://al-hilal.ali-al-bulaihi-ar.com has long been one of the main sports, attracting millions of fans. In recent years, one of the brightest stars in Saudi football has been Ali Al-Bulaihi, defender of Al-Hilal Football Club.
Luka Modric https://real-madrid.lukamodric-ar.com can certainly be called one of the outstanding midfielders in modern football.
viagra hello this is my web viagra
[u][b] Привет, друзья![/b][/u]
[b]Мы готовы предложить документы ВУЗов[/b], которые расположены на территории всей РФ. Вы сможете приобрести диплом за любой год, указав необходимую специальность и оценки за все дисциплины. Документы делаются на бумаге высшего качества. Это позволяет делать настоящие дипломы, не отличимые от оригинала. Документы будут заверены всеми требуемыми печатями и подписями.
[url=http://renaissance.mn.co/posts/61828789/]renaissance.mn.co/posts/61828789[/url]
If you think through poiskmonet.com every detail, you can achieve effective results.
[u][b] Привет![/b][/u]
Приобрести документ ВУЗа вы сможете у нас в столице. Мы предлагаем документы об окончании любых университетов РФ. Вы получите диплом по любым специальностям, включая документы Советского Союза. Даем гарантию, что при проверке документов работодателями, каких-либо подозрений не появится.
[url=http://www.bisshogram.com/read-blog/259/]www.bisshogram.com/read-blog/259[/url]
[url=http://hvacprotalk.com/read-blog/218/]hvacprotalk.com/read-blog/218[/url]
[url=http://t98223u0.beget.tech/2024/07/09/nadezhnye-diplomy-s-garantiey-konfidencialnosti.html/]t98223u0.beget.tech/2024/07/09/nadezhnye-diplomy-s-garantiey-konfidencialnosti.html[/url]
[url=http://forexrassia.ru/nastoyashhie-diplomyi-bez-ozhidaniya-i-problem/]forexrassia.ru/nastoyashhie-diplomyi-bez-ozhidaniya-i-problem[/url]
[url=http://cubarebota.info/blogs/164/%D0%9F%D1%80%D0%B8%D0%BE%D0%B1%D1%80%D0%B5%D1%82%D0%B0%D0%B5%D0%BC-%D0%B4%D0%BE%D0%BA%D1%83%D0%BC%D0%B5%D0%BD%D1%82%D1%8B-%D0%B2-%D0%BD%D0%B0%D0%B4%D0%B5%D0%B6%D0%BD%D0%BE%D0%BC-%D0%BC%D0%B0%D0%B3%D0%B0%D0%B7%D0%B8%D0%BD%D0%B5-%D0%A0%D0%B5%D0%BA%D0%BE%D0%BC%D0%B5%D0%BD%D0%B4%D0%B0%D1%86%D0%B8%D0%B8-%D1%81%D0%BF%D0%B5%D1%86%D0%B8%D0%B0%D0%BB%D0%B8%D1%81%D1%82%D0%B0/]cubarebota.info/blogs/164/%D0%9F%D1%80%D0%B8%D0%BE%D0%B1%D1%80%D0%B5%D1%82%D0%B0%D0%B5%D0%BC-%D0%B4%D0%BE%D0%BA%D1%83%D0%BC%D0%B5%D0%BD%D1%82%D1%8B-%D0%B2-%D0%BD%D0%B0%D0%B4%D0%B5%D0%B6%D0%BD%D0%BE%D0%BC-%D0%BC%D0%B0%D0%B3%D0%B0%D0%B7%D0%B8%D0%BD%D0%B5-%D0%A0%D0%B5%D0%BA%D0%BE%D0%BC%D0%B5%D0%BD%D0%B4%D0%B0%D1%86%D0%B8%D0%B8-%D1%81%D0%BF%D0%B5%D1%86%D0%B8%D0%B0%D0%BB%D0%B8%D1%81%D1%82%D0%B0[/url]
[u][b] Привет![/b][/u]
[b]Реально ли приобрести диплом стоматолога? Основные этапы [/b]
[url=http://medicineshocknews.ru/diplom-lyuboy-spetsialnosti-kachestvenno-i-bezopasno/]medicineshocknews.ru/diplom-lyuboy-spetsialnosti-kachestvenno-i-bezopasno[/url]
[u][b] Рады оказать помощь![u][b].
ремонт сотовых адреса
[u][b] Здравствуйте![/b][/u]
[b]Мы предлагаем дипломы[/b] психологов, юристов, экономистов и любых других профессий по доступным тарифам.
[url=http://lucsa.id/%D0%9A%D1%83%D0%BF%D0%B8%D1%82%D1%8C-%D0%9F%D1%80%D0%BE%D0%B2%D0%B5%D1%80%D0%B5%D0%BD%D0%BD%D1%8B%D0%B9-%D0%94%D0%B8%D0%BF%D0%BB%D0%BE%D0%BC//]lucsa.id/%D0%9A%D1%83%D0%BF%D0%B8%D1%82%D1%8C-%D0%9F%D1%80%D0%BE%D0%B2%D0%B5%D1%80%D0%B5%D0%BD%D0%BD%D1%8B%D0%B9-%D0%94%D0%B8%D0%BF%D0%BB%D0%BE%D0%BC/[/url]
видеостена цена в москве [url=https://www.videosteny-pod-kljuch.ru]видеостена цена в москве[/url] .
Ставки на спорт с высокими коэффициентами | 1win радует своих клиентов | 1win создан для настоящих победителей | 1win – верный помощник для ставок| 1win помогает воплотить мечты в реальность| Побеждайте с 1win| 1win – это мир больших выигрышей| 1win – выбор успешных игроков| 1win – это высокие шансы на выигрыш| 1win – это ваш верный партнер в ставках
1win [url=https://1win-bk.by/]https://1win-bk.by/[/url] .
[u][b] Привет, друзья![/b][/u]
Ьожем предложить документы ВУЗов, которые расположены в любом регионе Российской Федерации. Вы имеете возможность приобрести диплом за любой год, указав необходимую специальность и оценки за все дисциплины. Документы выпускаются на “правильной” бумаге самого высокого качества. Это позволяет делать настоящие дипломы, не отличимые от оригиналов. Документы будут заверены необходимыми печатями и штампами.
[b]Мы готовы предложить дипломы[/b] любых профессий по невысоким тарифам. Цена будет зависеть от выбранной специальности, года выпуска и образовательного учреждения. Стараемся поддерживать для заказчиков адекватную ценовую политику. [b]Важно[/b], чтобы документы были доступны для большого количества наших граждан.
[url=http://landik-diploms-srednee.ru/svidetelstvo-o-rozhdenii ]landik-diploms-srednee.ru/svidetelstvo-o-rozhdenii [/url]
[b]Удачи![/b]
[u][b] Привет, друзья![/b][/u]
[b]Заказать документ[/b] института можно у нас.
[url=http://ast-diploms.com/kupit-diplom-vracha/]ast-diploms.com/kupit-diplom-vracha[/url]
[b]Хорошей учебы![/b]
[u][b] Добрый день![/b][/u]
Где приобрести диплом специалиста?
[b]Заказать диплом университета.[/b]
[url=http://yobasket.es/es/perfil-usuario/pluginclass/cbblogs.html?action=blogs&func=show&id=121/]yobasket.es/es/perfil-usuario/pluginclass/cbblogs.html?action=blogs&func=show&id=121[/url]
Reliability. Concluding an agreement allows sveto-copy.com you to avoid unpleasant situations and obtain a guarantee of high-quality work.
Opened up an intriguing read – let me share this with you Пункты техосмотра Техосмотр СПб
https://subscribe.ru/author/25924851/group/records/?page=47
[u][b] Привет, друзья![/b][/u]
Приобрести документ о получении высшего образования вы можете в нашей компании в Москве. Мы оказываем услуги по продаже документов об окончании любых университетов Российской Федерации. Вы получите необходимый диплом по любой специальности, включая документы образца СССР.
[url=http://автомедведь.рф/club/log/?SECTION_CODE=log/]автомедведь.рф/club/log/?SECTION_CODE=log[/url]
[url=http://toolsrepair.ru/forum/viewtopic.php?f=5&t=2933572/]toolsrepair.ru/forum/viewtopic.php?f=5&t=2933572[/url]
[url=http://jagplay.ekafe.ru/viewtopic.php?f=22&t=4158/]jagplay.ekafe.ru/viewtopic.php?f=22&t=4158[/url]
[url=http://net4women.ru/blogs/3938/Рдеальный-диплом-Р·Р°-считанные-РґРЅРё-узнайте-подробности/]net4women.ru/blogs/3938/Рдеальный-диплом-Р·Р°-считанные-РґРЅРё-узнайте-подробности[/url]
[url=http://wallazz.com/blogs/206791/Дипломы-для-всех-уровней-образования/]wallazz.com/blogs/206791/Дипломы-для-всех-уровней-образования[/url]
аттестат за 11 класс купить [url=https://ast-diploms.com/]ast-diploms.com[/url] .
изготовление дипломов государственного образца [url=https://diplomasx.com/]изготовление дипломов государственного образца[/url] .
[u][b] Привет![/b][/u]
[b]Где приобрести диплом специалиста?[/b]
Мы готовы предложить дипломы любой профессии по приятным тарифам. Стоимость зависит от выбранной специальности, года получения и образовательного учреждения. Стараемся поддерживать для заказчиков адекватную ценовую политику. Для нас важно, чтобы дипломы были доступными для большинства граждан.
[b]Для вас изготавливаем дипломы[/b] любой профессии по невысоким тарифам.
[url=http://newspromworld.ru/kupit-diplom-rf-v-moskve-legalno-i-byistro]newspromworld.ru/kupit-diplom-rf-v-moskve-legalno-i-byistro[/url]
[u][b] Окажем помощь![u][b].
По поводу [url=https://restoyar.ru/]заказать еду на работу[/url] переходите на наш онлайн ресурс. На сайте можно посмотреть наше меню, сделать заказ, забронировать столик или позвонить нам. Контактный телефон +7(3412)223-225 или делайте заказ сразу на сайте. В разделе «доставка готовых блюд» будет доступно наше полное меню. Обратите своё внимание на оформление блюда при заказе, это результат большого опыта повара. Приготовление также у нас эксклюзивное, поэтому можете не переживать перед заказом для ваших гостей.
[u][b] Привет![/b][/u]
Мы готовы предложить [b]дипломы[/b] любых профессий по доступным тарифам. [b]Стоимость[/b] зависит от выбранной специальности, года получения и университета. Стараемся поддерживать для клиентов адекватную ценовую политику. Для нас очень важно, чтобы дипломы были доступны для большого количества наших граждан.
[url=http://hubwebsites.com/story18321637/%D0%BA%D1%83%D0%BF%D0%B8%D1%82%D1%8C-%D0%B4%D0%B8%D0%BF%D0%BB%D0%BE%D0%BC-%D0%BF%D0%B0%D1%80%D0%B8%D0%BA%D0%BC%D0%B0%D1%85%D0%B5%D1%80%D0%B0/]hubwebsites.com/story18321637/%D0%BA%D1%83%D0%BF%D0%B8%D1%82%D1%8C-%D0%B4%D0%B8%D0%BF%D0%BB%D0%BE%D0%BC-%D0%BF%D0%B0%D1%80%D0%B8%D0%BA%D0%BC%D0%B0%D1%85%D0%B5%D1%80%D0%B0[/url]
Online casino games have surged in popularity due to their convenience and the immersive experience they offer.
plinko game
visit my website https://currencyconvert.net
Stumbled upon interesting material – I can’t help but recommend you to read https://tor-musicalbum.ru/user/edhelmultk
Сайт https://ps-likers.ru предлагает уроки по фотошоп для начинающих. На страницах сайта можно найти пошаговые руководства по анимации, созданию графики для сайтов, дизайну, работе с текстом и фотографиями, а также различные эффекты.
además, casinos fuera de españa con un gerente con certificado en España, tiene la oportunidad tendrá que enviar sus reclamaciones a este organismo nacional, que actuará como como distribuidor y verificará no hubo violación de la ley de.
Also visit my web page; https://www.cyberpinoy.net/read-blog/25905
RDBox.de https://rdbox.de bietet schallgedammte Gehause fur 3D-Drucker, die eine sehr leise Druckumgebung schaffen – nicht lauter als ein Kuhlschrank. Unsere Losungen sorgen fur stabile Drucktemperatur, Vibrationsisolierung, Luftreinigung und mobile App-Steuerung.
[u][b] Привет![/b][/u]
Заказать документ о получении высшего образования вы можете у нас. Мы предлагаем документы об окончании любых университетов России. Вы сможете получить необходимый диплом по любым специальностям, любого года выпуска, в том числе документы СССР. Гарантируем, что при проверке документа работодателем, подозрений не возникнет.
[b]Мы можем предложить дипломы[/b] любых профессий по приятным тарифам. Цена зависит от выбранной специальности, года выпуска и университета. Стараемся поддерживать для клиентов адекватную политику тарифов. Для нас важно, чтобы документы были доступны для подавляющей массы наших граждан.
[url=http://antennastar.com/blogs/492/%D0%9A%D0%B0%D0%BA-%D0%B2%D0%BE%D0%B7%D0%BC%D0%BE%D0%B6%D0%BD%D0%BE-%D0%B1%D1%83%D0%B4%D0%B5%D1%82-%D0%BD%D0%B5%D0%B4%D0%BE%D1%80%D0%BE%D0%B3%D0%BE-%D0%BF%D1%80%D0%B8%D0%BE%D0%B1%D1%80%D0%B5%D1%81%D1%82%D0%B8-%D0%B0%D1%82%D1%82%D0%B5%D1%81%D1%82%D0%B0%D1%82-%D0%B2-%D0%BE%D0%BD%D0%BB%D0%B0%D0%B9%D0%BD-%D0%BC%D0%B0%D0%B3%D0%B0%D0%B7%D0%B8%D0%BD%D0%B5/]antennastar.com/blogs/492/%D0%9A%D0%B0%D0%BA-%D0%B2%D0%BE%D0%B7%D0%BC%D0%BE%D0%B6%D0%BD%D0%BE-%D0%B1%D1%83%D0%B4%D0%B5%D1%82-%D0%BD%D0%B5%D0%B4%D0%BE%D1%80%D0%BE%D0%B3%D0%BE-%D0%BF%D1%80%D0%B8%D0%BE%D0%B1%D1%80%D0%B5%D1%81%D1%82%D0%B8-%D0%B0%D1%82%D1%82%D0%B5%D1%81%D1%82%D0%B0%D1%82-%D0%B2-%D0%BE%D0%BD%D0%BB%D0%B0%D0%B9%D0%BD-%D0%BC%D0%B0%D0%B3%D0%B0%D0%B7%D0%B8%D0%BD%D0%B5[/url]
[b]Окажем помощь![/b]
N’Golo Kante https://al-ittihad.ngolokante-ar.com the French midfielder whose career has embodied perseverance, hard work and skill, has continued his path to success at Al-Ittihad Football Club, based in Saudi Arabia.
[u][b] Привет![/b][/u]
Где заказать диплом по нужной специальности?
Мы можем предложить документы институтов, которые расположены на территории всей РФ. Вы можете заказать диплом за любой год, указав необходимую специальность и оценки за все дисциплины. Дипломы выпускаются на “правильной” бумаге высшего качества. Это дает возможность делать государственные дипломы, которые невозможно отличить от оригинала. Они заверяются всеми необходимыми печатями и подписями.
[b]Мы изготавливаем дипломы[/b] любой профессии по разумным ценам.
[url=http://ast-diplomas.com/kupit-diplom-voronezh]ast-diplomas.com/kupit-diplom-voronezh[/url]
[u][b] Рады помочь![u][b]
Почему ритуальные агентства в Алматы завышают цены на услуги? Прочитайте наш блог, чтобы узнать, как не переплатить за похороны. Мы также расскажем, как выбрать агентство с прозрачной ценовой политикой и избежать лишних расходов.
специалист +по эксплуатации лифтового оборудования
Hi everyone, it’s my first visit at this site, and paragraph is in fact fruitful in favor of me, keep up posting these types of content.
официальный сайт lee bet
Kobe Bryant https://los-angeles-lakers.kobebryant-ar.com also known as the “Black Mamba”, is one of the most iconic and iconic figures in NBA history.
Недавно столкнулся с проблемой завышенных цен на ритуальные услуги в Алматы. Статья помогла разобраться и выбрать честное агентство. Очень рекомендую!
https://subscribe.ru/author/25924851/group/records/?page=46
[u][b] Привет![/b][/u]
[b]Мы можем предложить дипломы[/b] любых профессий по приятным тарифам.
[url=http://forum.xpixel.ru/gallery/image/91-%D0%BA%D0%B0%D0%BA%D0%B8%D0%B5-%D0%BE%D0%BD%D0%BB%D0%B0%D0%B9%D0%BD-%D0%BC%D0%B0%D0%B3%D0%B0%D0%B7%D0%B8%D0%BD%D1%8B-%D1%81-%D0%B4%D0%B8%D0%BF%D0%BB%D0%BE%D0%BC%D0%B0%D0%BC%D0%B8-%D1%81%D1%83%D1%89%D0%B5%D1%81%D1%82%D0%B2%D1%83%D1%8E%D1%82-%D0%BD%D0%B0-%D1%81%D0%B5%D0%B3%D0%BE%D0%B4%D0%BD%D1%8F%D1%88%D0%BD%D0%B8%D0%B9-%D0%B4%D0%B5%D0%BD%D1%8C//]forum.xpixel.ru/gallery/image/91-%D0%BA%D0%B0%D0%BA%D0%B8%D0%B5-%D0%BE%D0%BD%D0%BB%D0%B0%D0%B9%D0%BD-%D0%BC%D0%B0%D0%B3%D0%B0%D0%B7%D0%B8%D0%BD%D1%8B-%D1%81-%D0%B4%D0%B8%D0%BF%D0%BB%D0%BE%D0%BC%D0%B0%D0%BC%D0%B8-%D1%81%D1%83%D1%89%D0%B5%D1%81%D1%82%D0%B2%D1%83%D1%8E%D1%82-%D0%BD%D0%B0-%D1%81%D0%B5%D0%B3%D0%BE%D0%B4%D0%BD%D1%8F%D1%88%D0%BD%D0%B8%D0%B9-%D0%B4%D0%B5%D0%BD%D1%8C/[/url]
To start working as a etalonsadforum.com walking or bicycle courier, just contact one of the partner companies.
[u][b] Привет, друзья![/b][/u]
[b]Заказать документ[/b] института вы сможете в нашей компании.
[url=http://ast-diplomy24.ru/kupit-diplom-moskva/]ast-diplomy24.ru/kupit-diplom-moskva[/url]
[u][b] Добрый день![/b][/u]
[b]Мы можем предложить дипломы[/b] любой профессии по разумным тарифам.
[url=http://www.sonicetactical.ru/%D0%B4%D0%B8%D0%BF%D0%BB%D0%BE%D0%BC-%D1%81%D1%80%D0%B5%D0%B4%D0%BD%D0%B5%D0%B3%D0%BE-%D0%BF%D1%80%D0%BE%D1%84%D0%B5%D1%81%D1%81%D0%B8%D0%BE%D0%BD%D0%B0%D0%BB%D1%8C%D0%BD%D0%BE%D0%B3%D0%BE-%D0%BE/]www.sonicetactical.ru/%D0%B4%D0%B8%D0%BF%D0%BB%D0%BE%D0%BC-%D1%81%D1%80%D0%B5%D0%B4%D0%BD%D0%B5%D0%B3%D0%BE-%D0%BF%D1%80%D0%BE%D1%84%D0%B5%D1%81%D1%81%D0%B8%D0%BE%D0%BD%D0%B0%D0%BB%D1%8C%D0%BD%D0%BE%D0%B3%D0%BE-%D0%BE/[/url]
[u][b] Здравствуйте![/b][/u]
[b]Узнайте, как безопасно купить диплом о высшем образовании [/b]
[url=http://tavasporan.flybb.ru/viewtopic.php?f=13&t=2660/]tavasporan.flybb.ru/viewtopic.php?f=13&t=2660[/url]
[u][b] Поможем вам всегда![u][b].
Вам интересен вопрос о прокате инвалидных колясок? Деливери плей предоставляет такую возможность. Гарантируем оперативную доставку и приемлемые цены. У нас всегда чистые коляски. Вы сможете оплатить заказ только после того, как убедитесь, что коляска полностью соответствует вашим требованиям и находится в отличном состоянии. Ищите где взять напрокат инвалидную коляску? Deliveryplay.ru/arenda-invalidnyh-kolyasok – сайт, где можно коляску арендовать. Также здесь вы узнаете, почему аренда лучше покупки. Обращайтесь к нам, поможем выбрать коляску, которая идеально вам подойдет.
[u][b] Привет![/b][/u]
[b]Наши специалисты предлагают[/b] быстро и выгодно купить диплом, который выполнен на оригинальном бланке и заверен печатями, штампами, подписями. Данный диплом способен пройти любые проверки, даже с применением профессионального оборудования. Решите свои задачи максимально быстро с нашими дипломами.
[url=http://vk.com/club16132629?w=wall-16132629_3527/]vk.com/club16132629?w=wall-16132629_3527[/url]
[b]Успешной учебы![/b]
[u][b] Здравствуйте![/b][/u]
[b]Мы предлагаем документы техникумов[/b], которые расположены на территории всей Российской Федерации. Вы сможете заказать диплом от любого заведения, за любой год, указав актуальную специальность и хорошие оценки за все дисциплины. Документы печатаются на бумаге самого высокого качества. Это позволяет делать настоящие дипломы, которые невозможно отличить от оригинала. Документы заверяются необходимыми печатями и подписями.
[url=http://sonnick84.full-design.com/%D0%9B%D0%B5%D0%B3%D0%BA%D0%BE-%D0%B7%D0%B0%D0%BA%D0%B0%D0%B7%D1%8B%D0%B2%D0%B0%D0%B5%D0%BC-%D0%B4%D0%B8%D0%BF%D0%BB%D0%BE%D0%BC-%D0%B2-%D0%B8%D0%BD%D1%82%D0%B5%D1%80%D0%BD%D0%B5%D1%82-%D0%BC%D0%B0%D0%B3%D0%B0%D0%B7%D0%B8%D0%BD%D0%B5-russian-diplom-71068957/]sonnick84.full-design.com/%D0%9B%D0%B5%D0%B3%D0%BA%D0%BE-%D0%B7%D0%B0%D0%BA%D0%B0%D0%B7%D1%8B%D0%B2%D0%B0%D0%B5%D0%BC-%D0%B4%D0%B8%D0%BF%D0%BB%D0%BE%D0%BC-%D0%B2-%D0%B8%D0%BD%D1%82%D0%B5%D1%80%D0%BD%D0%B5%D1%82-%D0%BC%D0%B0%D0%B3%D0%B0%D0%B7%D0%B8%D0%BD%D0%B5-russian-diplom-71068957[/url]
рамки для сертификатов и дипломов купить [url=https://www.diploms-x.com]https://www.diploms-x.com[/url] .
[u][b] Привет, друзья![/b][/u]
Где заказать диплом специалиста?
[b]Купить диплом о высшем образовании.[/b]
[url=http://void.menu/index.php?/gallery/image/116-%D0%BE%D0%B3%D1%80%D0%BE%D0%BC%D0%BD%D1%8B%D0%B9-%D0%BA%D0%B0%D1%82%D0%B0%D0%BB%D0%BE%D0%B3-%D0%B4%D0%BE%D0%BA%D1%83%D0%BC%D0%B5%D0%BD%D1%82%D0%BE%D0%B2-%D0%B2-%D0%BF%D0%BE%D0%BF%D1%83%D0%BB%D1%8F%D1%80%D0%BD%D0%BE%D0%BC-%D0%BC%D0%B0%D0%B3%D0%B0%D0%B7%D0%B8%D0%BD%D0%B5//]void.menu/index.php?/gallery/image/116-%D0%BE%D0%B3%D1%80%D0%BE%D0%BC%D0%BD%D1%8B%D0%B9-%D0%BA%D0%B0%D1%82%D0%B0%D0%BB%D0%BE%D0%B3-%D0%B4%D0%BE%D0%BA%D1%83%D0%BC%D0%B5%D0%BD%D1%82%D0%BE%D0%B2-%D0%B2-%D0%BF%D0%BE%D0%BF%D1%83%D0%BB%D1%8F%D1%80%D0%BD%D0%BE%D0%BC-%D0%BC%D0%B0%D0%B3%D0%B0%D0%B7%D0%B8%D0%BD%D0%B5/[/url]
купить диплом гостиничное дело [url=https://asxdiplomik24.ru/]asxdiplomik24.ru[/url] .
На сайте https://logisticbda.com оставьте заявку для того, чтобы вам рассчитали стоимость такой услуги, как заказ продукции для маркетплейсов и непосредственно из Китая. Сотрудники выполняют такие важные работы, как: выкуп, поиск, транспортировка из Китая. Специально для вас отгрузка, упаковка на маркетплейсы. Сотрудники окажут помощь в формировании бизнеса на различных маркетплейсах. Закупка происходит с самых проверенных, надежных магазинов, которым точно можно доверять. Проводятся различные складские работы, дополнительные услуги.
[u][b] Здравствуйте![/b][/u]
[b]Купить диплом о высшем образовании.[/b]
[url=http://safdfpb.ixbb.ru/viewtopic.php?id=106#p106/]safdfpb.ixbb.ru/viewtopic.php?id=106#p106[/url]
На сайте https://vips13un.kinoportal.live/ подберите интересный, увлекательный фильм, который подходит для домашнего совместного просмотра, а также в выходной день. Также находятся и любопытные передачи, которые смотрят многие. Вы обязательно найдете то, что полностью соответствует вашим предпочтениям, вкусам. Все кино, передачи представлены в отличном качестве и с хорошим звуком, поэтому просмотр принесет лишь приятные эмоции. Регулярно появляются многообещающие новинки, которые тоже заслуживают вашего внимания.
[u][b] Здравствуйте![/b][/u]
[b]Всё, что нужно знать о покупке аттестата о среднем образовании[/b]
[url=http://newsbig.raidersfanteamshop.com/poleznye-sovety-po-priobreteniu-diploma-v-internete//]newsbig.raidersfanteamshop.com/poleznye-sovety-po-priobreteniu-diploma-v-internete/[/url]
[u][b] Привет![/b][/u]
Где приобрести диплом специалиста?
[url=http://www.hebergementweb.org/threads/oformlenie-diploma-pod-kljuch-prosto-i-udobno.1486955//]www.hebergementweb.org/threads/oformlenie-diploma-pod-kljuch-prosto-i-udobno.1486955/[/url]
[b]Удачи![/b]
игровые автоматы вулкан регистрация
Add an international prefix from the drop-down list. add your phone. Select “steam guard” at the top of the https://steamdesktopauthenticator.io/ menu.
Самая восхитительная еда здесь – [url=https://restoyar.ru/]ресторан панорама доставка[/url] приходите уже сейчас. Мы расположены по адресу: г. Ижевск, ул. Максима Горького, д. 163. Время работы с 12:00 до 00:00, а в пятницу и субботу с 12:00 до 2:00 ночи. Приглашаем Вас и Вашу половинку прекрасно провести время или сделать заказ на restoyar.ru на Ваш адрес и побаловаться вкусной едой в своей знакомой обстановке.
[u][b] Здравствуйте![/b][/u]
Предлагаем документы ВУЗов, расположенных на территории всей Российской Федерации. Можно приобрести диплом за любой год, указав подходящую специальность и оценки за все дисциплины. Дипломы и аттестаты выпускаются на “правильной” бумаге высшего качества. Это позволяет делать государственные дипломы, не отличимые от оригинала. Документы заверяются необходимыми печатями и подписями.
[b]Мы изготавливаем дипломы[/b] психологов, юристов, экономистов и любых других профессий по приятным ценам. Стоимость может зависеть от выбранной специальности, года выпуска и ВУЗа. Стараемся поддерживать для заказчиков адекватную ценовую политику. [b]Для нас очень важно[/b], чтобы дипломы были доступными для большинства граждан.
[url=http://landik-diploms-srednee.ru/attestat-shkoly ]landik-diploms-srednee.ru/attestat-shkoly [/url]
[b]Хорошей учебы![/b]
1win – самый надежный букмекер в сети
Удача всегда на вашей стороне с 1win
Завоюйте свою удачу вместе с 1win
Успех начинается с 1win
1win – ваш путь к большим выигрышам
Ваши ставки всегда успешные с 1win
1win – ваш ключ к миру ставок и азарта
1win – выбор тех, кто ценит качество и надежность
1win – ваш верный путь к финансовой независимости
Доверьте свои ставки профессионалам из 1win
1win – это лучший способ сделать свою игру еще более захватывающей
1win делает вашу игру более прибыльной и увлекательной
Ставки на спорт становятся простыми с 1win
1win всегда на вашей стороне|1win – это ваш шанс на выигрыш
1win гарантирует вам качественный сервис и высокие шансы на успех|1win – ваш уникальный шанс стать настоящим победителем|1win – ваш верный партнер в мире ставок|1win – это ваша возможность делать ставки с выгодой|1win гарантирует вам только лучшие условия для ставок|1win – это ваш персональный билет в мир азарта|Завоюйте мир ставок вместе с 1win|Ваши ставки всегда успешные с 1win|1win – идеальное место для вашего успеха|1win – это ваш шанс стать победителем|1win – ваш партнер в мире ставок и азарта|Увеличивайте свои шансы на успех с 1win|1win – ваш верный ход к выигрышу|1win радует своих клиентов только лучшими условиями|1win – ваш верный партнер в мире ставок|Сделайте вашу игру увлекательной и прибыльной с 1win|1win – это ваш путь к большим выигрышам|Ув
1win зеркало [url=https://1win-ofitsialnyy.by/]https://1win-ofitsialnyy.by/[/url] .
[u][b] Привет, друзья![/b][/u]
[b]Заказать документ[/b] о получении высшего образования вы можете у нас в Москве.
[url=http://ast-diploms24.ru/kupit-diplom-ekaterinbur/]ast-diploms24.ru/kupit-diplom-ekaterinbur[/url]
[b]Удачи![/b]
[u][b] Привет, друзья![/b][/u]
[b]Парадокс, но купить диплом кандидата наук оказалось не так и сложно [/b]
[url=http://worldcrisis.ru/crisis/dilopluyy/]worldcrisis.ru/crisis/dilopluyy[/url]
[u][b] Рады оказаться полезными![u][b].
[u][b] Здравствуйте![/b][/u]
[b]Заказать диплом о высшем образовании.[/b]
[url=http://njt.ru/forum/user/189037//]njt.ru/forum/user/189037/[/url]
[b]Успехов в учебе![/b]
Hi there, its nice paragraph concerning media print, we all be
familiar with media is a wonderful source of data.
[u][b] Привет, друзья![/b][/u]
Купить диплом любого ВУЗа
[b]Наша компания предлагает[/b] выгодно приобрести диплом, который выполняется на оригинальной бумаге и заверен мокрыми печатями, штампами, подписями. Данный диплом способен пройти лубую проверку, даже с применением специфических приборов. Достигайте цели быстро и просто с нашим сервисом.
[b]Где заказать диплом специалиста?[/b]
[url=http://vhopnation.io/read-blog/6/]vhopnation.io/read-blog/6[/url]
[url=http://dbuniverse.net/forum/index.php?/gallery/image/250-%D0%B7%D0%B0-%D1%81%D1%87%D0%B5%D1%82-%D1%87%D0%B5%D0%B3%D0%BE-%D0%BC%D0%B0%D0%B3%D0%B0%D0%B7%D0%B8%D0%BD%D1%8B-%D1%81-%D0%B4%D0%B8%D0%BF%D0%BB%D0%BE%D0%BC%D0%B0%D0%BC%D0%B8-%D1%81%D0%B5%D0%B3%D0%BE%D0%B4%D0%BD%D1%8F-%D1%82%D0%B0%D0%BA-%D0%BF%D0%BE%D0%BF%D1%83%D0%BB%D1%8F%D1%80%D0%BD%D1%8B//]dbuniverse.net/forum/index.php?/gallery/image/250-%D0%B7%D0%B0-%D1%81%D1%87%D0%B5%D1%82-%D1%87%D0%B5%D0%B3%D0%BE-%D0%BC%D0%B0%D0%B3%D0%B0%D0%B7%D0%B8%D0%BD%D1%8B-%D1%81-%D0%B4%D0%B8%D0%BF%D0%BB%D0%BE%D0%BC%D0%B0%D0%BC%D0%B8-%D1%81%D0%B5%D0%B3%D0%BE%D0%B4%D0%BD%D1%8F-%D1%82%D0%B0%D0%BA-%D0%BF%D0%BE%D0%BF%D1%83%D0%BB%D1%8F%D1%80%D0%BD%D1%8B/[/url]
[url=http://antonovschool.ru/forum/messages/forum1/topic695/message713/?result=new#message713/]antonovschool.ru/forum/messages/forum1/topic695/message713/?result=new#message713[/url]
[url=http://beinsadouno.bg/events/event/47-%D0%B1%D0%BB%D0%B0%D0%B3%D0%BE%D0%B4%D0%B0%D1%80%D1%8F-%D1%87%D0%B5%D0%BC%D1%83-%D0%B8%D0%BD%D1%82%D0%B5%D1%80%D0%BD%D0%B5%D1%82-%D0%BC%D0%B0%D0%B3%D0%B0%D0%B7%D0%B8%D0%BD%D1%8B-%D1%81-%D0%B4%D0%BE%D0%BA%D1%83%D0%BC%D0%B5%D0%BD%D1%82%D0%B0%D0%BC%D0%B8-%D1%81%D1%82%D0%BE%D0%BB%D1%8C-%D0%BF%D0%BE%D0%BF%D1%83%D0%BB%D1%8F%D1%80%D0%BD%D1%8B//]beinsadouno.bg/events/event/47-%D0%B1%D0%BB%D0%B0%D0%B3%D0%BE%D0%B4%D0%B0%D1%80%D1%8F-%D1%87%D0%B5%D0%BC%D1%83-%D0%B8%D0%BD%D1%82%D0%B5%D1%80%D0%BD%D0%B5%D1%82-%D0%BC%D0%B0%D0%B3%D0%B0%D0%B7%D0%B8%D0%BD%D1%8B-%D1%81-%D0%B4%D0%BE%D0%BA%D1%83%D0%BC%D0%B5%D0%BD%D1%82%D0%B0%D0%BC%D0%B8-%D1%81%D1%82%D0%BE%D0%BB%D1%8C-%D0%BF%D0%BE%D0%BF%D1%83%D0%BB%D1%8F%D1%80%D0%BD%D1%8B/[/url]
[url=http://newsbig.raidersfanteamshop.com/poleznye-sovety-po-priobreteniu-diploma-v-internete/]newsbig.raidersfanteamshop.com/poleznye-sovety-po-priobreteniu-diploma-v-internete[/url]
диплом проведенный купить [url=https://diploms-x.com]диплом проведенный купить[/url] .
На сайте http://wirespace.ru изучите полезные, интересные и содержательные статьи, которые посвящены ландшафтному дизайну. Представлены любопытные идеи о том, как правильно разместить скульптуры, а также интересные декоративные элементы. Опубликованы не только рекомендации, но и любопытные идеи. Есть информация относительно дизайна для миниатюрных садов. Вы узнаете и о том, как правильно выбрать цветовую гамму для декорирования. Есть информация о том, как организовать роскошное пространство в доме.
https://damntroublemaker.com/
krepezh.net
alanews24.com
[u][b] Добрый день![/b][/u]
[b]Мы изготавливаем дипломы[/b] психологов, юристов, экономистов и любых других профессий по разумным ценам.
[url=http://angelicaleyva.es/%D0%BA%D1%83%D0%BF%D0%B8%D1%82%D1%8C-%D0%B4%D0%B8%D0%BF%D0%BB%D0%BE%D0%BC-%D1%82%D0%B0%D0%BC%D0%B1%D0%BE%D0%B2//]angelicaleyva.es/%D0%BA%D1%83%D0%BF%D0%B8%D1%82%D1%8C-%D0%B4%D0%B8%D0%BF%D0%BB%D0%BE%D0%BC-%D1%82%D0%B0%D0%BC%D0%B1%D0%BE%D0%B2/[/url]
Attractive section of content. I just stumbled
upon your website and in accession capital to assert that I
get in fact enjoyed account your blog posts. Any way I’ll be subscribing to your augment
and even I achievement you access consistently rapidly.
Karim Benzema https://al-ittihad.karimbenzema.ae is a name worthy of admiration and respect in the world of football.
1win – лучший выбор для любителей ставок на спорт, испытать.
1win: лучшее онлайн казино для азартных игр, присоединиться к азартному миру.
1win – ваш путь к финансовой независимости, предлагаем.
Участвуйте в ставках на киберспорт с 1win, советуем.
Удобный и надежный сервис для азартных развлечений – 1win, попробовать.
1win беларусь [url=https://1win-sayt.by/]https://1win-sayt.by/[/url] .
Cristiano Ronaldo https://al-nassr.cristiano-ronaldo.ae is one of the greatest names in football history, with his achievements inspiring millions of fans around the world.
In 2018, the basketball world witnessed one of the most remarkable transformations in NBA history. LeBron James https://los-angeles-lakers.lebronjames-ar.com one of the greatest players of our time, decided to leave his hometown Cleveland Cavaliers and join the Los Angeles Lakers.
Luis Diaz https://liverpool.luis-diaz-ar.com is a young Colombian striker who has enjoyed rapid growth since joining the ” Liverpool” in January 2022.
Ищите Скачать музыку https://vkmusic.in/ – тогда зайдите на сайт и насладитесь шикарным выбором альбомов, треков, всех самых свежих хитов которые вы можете качать в любом количестве в мп3 на сайте. Лучшая подборка в машину, для отдыха, релакса. Вся музыка у нас.
[u][b] Привет![/b][/u]
[b]Мы предлагаем приобрести диплом[/b] в отличном качестве, неотличимый от оригинала без участия специалиста высокой квалификации со сложным оборудованием.
[url=http://www.musicasecundaria.com/for/viewtopic.php?f=4&t=25&p=88437#p88437/]www.musicasecundaria.com/for/viewtopic.php?f=4&t=25&p=88437#p88437[/url]
[b]Успешной учебы![/b]
[u][b] Здравствуйте![/b][/u]
Купить документ о получении высшего образования можно у нас в Москве. Мы предлагаем документы об окончании любых университетов России.
[url=http://talented-people.vraiforum.com/profile.php?mode=viewprofile&u=8916/]talented-people.vraiforum.com/profile.php?mode=viewprofile&u=8916[/url]
[url=http://www.podzemie.6f.sk/profile.php?lookup=17602/]www.podzemie.6f.sk/profile.php?lookup=17602[/url]
[url=http://vestiinform.ru/?post_type=topic&p=62710/]vestiinform.ru/?post_type=topic&p=62710[/url]
[url=http://legislador.art.br/forum/viewtopic.php?p=101253#p101253/]legislador.art.br/forum/viewtopic.php?p=101253#p101253[/url]
[url=http://zhabbo.free.fr/index.php?file=Members&op=detail&autor=ezybusa/]zhabbo.free.fr/index.php?file=Members&op=detail&autor=ezybusa[/url]
[u][b] Привет![/b][/u]
Купить диплом о высшем образовании
[b]Наша компания предлагает[/b] выгодно и быстро купить диплом, который выполнен на оригинальной бумаге и заверен мокрыми печатями, водяными знаками, подписями. Документ пройдет лубую проверку, даже при использовании специально предназначенного оборудования. Достигайте цели быстро с нашей компанией.
[b]Где купить диплом по актуальной специальности?[/b]
[url=http://mosday.getbb.ru/viewtopic.php?f=12&t=1059/]mosday.getbb.ru/viewtopic.php?f=12&t=1059[/url]
[url=http://alanyatoday.ru/users/76/]alanyatoday.ru/users/76[/url]
[url=http://autoprajs.ru/15204.html/]autoprajs.ru/15204.html[/url]
[url=http://macadamlab.ru/wiki/index.php?title=пїЅпїЅпїЅпїЅпїЅпїЅ_пїЅпїЅпїЅпїЅпїЅпїЅ/]macadamlab.ru/wiki/index.php?title=пїЅпїЅпїЅпїЅпїЅпїЅ_пїЅпїЅпїЅпїЅпїЅпїЅ[/url]
[url=http://nedvigimost.bbok.ru/viewtopic.php?id=26650#p45740/]nedvigimost.bbok.ru/viewtopic.php?id=26650#p45740[/url]
check this site out [url=https://keplr.me/]Dym wallet keplr[/url]
[u][b] Привет![/b][/u]
Где приобрести диплом по необходимой специальности?
[b]Купить диплом ВУЗа.[/b]
[url=http://rusere.ru/communication/forum/messages/forum11/message3680/2967-kak-podobrat-nadezhnyy-magazin-s-bolshim-katalogom-diplomov?result=new/]rusere.ru/communication/forum/messages/forum11/message3680/2967-kak-podobrat-nadezhnyy-magazin-s-bolshim-katalogom-diplomov?result=new[/url]
Hi! This is kind of off topic but I need some advice from an established blog. Is it very hard to set up your own blog? I’m not very techincal but I can figure things out pretty fast. I’m thinking about creating my own but I’m not sure where to start. Do you have any ideas or suggestions? Thank you
kayman-k.ru
[u][b] Добрый день![/b][/u]
[b]Полезные советы по безопасной покупке диплома о высшем образовании [/b]
[url=http://ya.9bb.ru/viewtopic.php?id=5924#p11405/]ya.9bb.ru/viewtopic.php?id=5924#p11405[/url]
[u][b] Рады оказать помощь![u][b].
[u][b] Здравствуйте![/b][/u]
[b]Мы можем предложить документы ВУЗов[/b], которые находятся на территории всей России. Можно купить диплом от любого учебного заведения, за любой год, в том числе документы старого образца СССР. Дипломы и аттестаты делаются на “правильной” бумаге высшего качества. Это дает возможности делать настоящие дипломы, которые невозможно отличить от оригинала. Документы будут заверены всеми обязательными печатями и подписями.
[url=http://www.chat-hozn3.com/blogs/13306/%D0%9A%D0%B0%D0%BA-%D0%B2%D0%BE%D0%B7%D0%BC%D0%BE%D0%B6%D0%BD%D0%BE-%D0%B1%D1%83%D0%B4%D0%B5%D1%82-%D0%B1%D1%8B%D1%81%D1%82%D1%80%D0%BE-%D0%B7%D0%B0%D0%BA%D0%B0%D0%B7%D0%B0%D1%82%D1%8C-%D0%B4%D0%B8%D0%BF%D0%BB%D0%BE%D0%BC-%D0%B2-%D0%BE%D0%BD%D0%BB%D0%B0%D0%B9%D0%BD-%D0%BC%D0%B0%D0%B3%D0%B0%D0%B7%D0%B8%D0%BD%D0%B5/]www.chat-hozn3.com/blogs/13306/%D0%9A%D0%B0%D0%BA-%D0%B2%D0%BE%D0%B7%D0%BC%D0%BE%D0%B6%D0%BD%D0%BE-%D0%B1%D1%83%D0%B4%D0%B5%D1%82-%D0%B1%D1%8B%D1%81%D1%82%D1%80%D0%BE-%D0%B7%D0%B0%D0%BA%D0%B0%D0%B7%D0%B0%D1%82%D1%8C-%D0%B4%D0%B8%D0%BF%D0%BB%D0%BE%D0%BC-%D0%B2-%D0%BE%D0%BD%D0%BB%D0%B0%D0%B9%D0%BD-%D0%BC%D0%B0%D0%B3%D0%B0%D0%B7%D0%B8%D0%BD%D0%B5[/url]
[u][b] Привет![/b][/u]
Ьожем предложить документы ВУЗов, расположенных в любом регионе России. Можно купить диплом от любого учебного заведения, за любой год, указав необходимую специальность и оценки за все дисциплины. Дипломы и аттестаты делаются на “правильной” бумаге самого высшего качества. Это дает возможность делать государственные дипломы, которые не отличить от оригиналов. Они заверяются необходимыми печатями и подписями.
[b]Мы изготавливаем дипломы[/b] любой профессии по невысоким ценам. Цена зависит от определенной специальности, года выпуска и ВУЗа. Стараемся поддерживать для заказчиков адекватную ценовую политику. [b]Для нас важно[/b], чтобы дипломы были доступны для большого количества граждан.
[url=http://landik-diploms-srednee.ru/kupit-diplom-v-ekaterinburge ]landik-diploms-srednee.ru/kupit-diplom-v-ekaterinburge [/url]
[b]Удачи![/b]
[u][b] Привет![/b][/u]
[b]Заказать документ[/b] университета можно в нашем сервисе.
[url=http://asxdiplomik24.ru/kupit-diplom-krasnoyarsk/]asxdiplomik24.ru/kupit-diplom-krasnoyarsk[/url]
[b]Успехов в учебе![/b]
озвучивание [url=https://www.ozvuchivanie-pomeshhenij.ru]https://www.ozvuchivanie-pomeshhenij.ru[/url] .
Best Movies on Netflix June 2024: Rotten Tomatoes’ Fresh Choices new season on my blockwhen new bleach episodes come outfinest kind filmviking wolf imdb
Reducing the workload on morson.org technical support workers. Very often, monotonous actions take up a lot of time from specialists. If you work with tickets, you can optimize routine operations. In addition, you can count on deadlines, that is, assign responsibility for specific actions.
Лучшие варианты лебедок для занятий спортом, для успешной подготовки.
Найдите идеальный вариант лебедки для своих целей, для достижения новых спортивных целей.
Какие характеристики важны при выборе лебедки для спорта, и достигнуть максимальной эффективности в тренировках.
Известные производители лебедок для спортивных занятий, пользующиеся заслуженным успехом среди атлетов.
Советы по выбору оптимального размера лебедки для спортзала, и избежать травм и неприятных ощущений.
Какие материалы используются при изготовлении спортивных лебедок, и какой материал предпочтителен для длительной эксплуатации и безопасности.
Советы по безопасному и эффективному использованию спортивной лебедки, для максимальных результатов и предотвращения травм.
Спортивная серия лебедок [url=https://goldenpower4x4.ru/lebedki/sportivnaya-seriya.html]https://goldenpower4x4.ru/lebedki/sportivnaya-seriya.html[/url] .
На сайте https://radiolom71.ru/ закажите звонок для того, чтобы узнать всю нужную информацию о приеме радиодеталей, плат. Также принимаются и драгметаллы: золото, техническое серебро, платина и различные приборы. В компании работают компетентные, квалифицированные профессионалы, которые регулярно выкупают у населения, юридических лиц лом. Выкупаются как новые, так и б/у детали. Есть возможность связаться со специалистами наиболее удобным для себя способом. Пришлите фотографию либо наименование вещи, чтобы определить точную стоимость.
На сайте https://penza-evakuator.ru/ закажите звонок для того, чтобы воспользоваться услугами эвакуатора: грузового, легкового. Для того чтобы заказать услугу, необходимо позвонить по обозначенному номеру. Возможна любая форма оплаты, а стоимость начинается от 2 500 рублей. Подача транспорта организуется в течение получаса. Работа в круглосуточном режиме, отсутствуют выходные. Организуется эвакуация мототехники, квадроциклов, малогабаритных, легковых автомобилей, спортивных машин, джипов, внедорожников.
published here [url=https://martianwallet.at/]martianwallet login[/url]
As you may perhaps have guessed, this gambling web-site supports fiat and cryptocurrencies.
Also visit my blog: joe2006.com
† Tier Credits earned are based on a single promotional day’s activity.
My web page: http://1419sb.xn--hz2bi0ln0e6nd85idpdy4d.com/qna/103304
Лечение наркомании — это трудный и многоаспектный процесс, требующий комплексного подхода и единой работы как страдающих, так и врачей. Однако практика принципов и методов, указанных выше, может значительно поднять эффективность лечения и помочь пациентам вернуться к здоровой и полной жизни.
http://maps.google.com.tr/url?q=https://www.infpol.ru/search/?q=%D1%86%D0%B5%D0%BD%D1%82%D1%80%D0%BA%D0%BB%D1%8E%D1%87%D0%B8
Исцеление наркотической зависимости представляет собой серьезный этап в жизни людей, страдающих от данного недуга. Наркопотребление оказывает губительное воздействие на физическое и психическое состояние человека, а также на его ближайших. Однако современные технологии предлагают многочисленный спектр терапевтических методов и программ для победы этого недуга.
ремонт смартфонов в москве
Maria Sharapova https://tennis.maria-sharapova-ar.com was born on April 19, 1987 in Nyagan, Russia. When Masha was 7 years old, her family moved to Florida, where she started playing tennis.
Kevin De Bruyne https://manchester-city.kevin-de-bruyne-ar.com is a name every football fan knows today.
[u][b] Привет, друзья![/b][/u]
[b]Как получить диплом техникума официально и без лишних проблем[/b]
[url=http://bankendigital.de/%D0%BA%D1%83%D0%BF%D0%B8%D1%82%D1%8C-%D0%B4%D0%B8%D0%BF%D0%BB%D0%BE%D0%BC-%D0%B2-%D0%B5%D1%81%D1%81%D0%B5%D0%BD%D1%82%D1%83%D0%BA%D0%B8//]bankendigital.de/%D0%BA%D1%83%D0%BF%D0%B8%D1%82%D1%8C-%D0%B4%D0%B8%D0%BF%D0%BB%D0%BE%D0%BC-%D0%B2-%D0%B5%D1%81%D1%81%D0%B5%D0%BD%D1%82%D1%83%D0%BA%D0%B8/[/url]
Muhammad Al Owais https://al-hilal.mohammed-alowais-ar.com is one of the most prominent names in modern Saudi football. His path to success in Al Hilal team became an example for many young athletes.
Roberto Firmino https://al-ahli.roberto-firmino-ar.com one of the most talented and famous Brazilian footballers of our time, has paved his way to success in different leagues and teams.
Then the structure homeideascoach.com with the floor is installed. If the model does not have a floor, then you will need to build a platform.
На сайте https://pro100-stone.ru закажите звонок для того, чтобы купить изделия, выполненные из ненатурального камня. В этой компании занимаются разработкой, производством подоконников, столешниц, раковин, моек, а также барных стоек и многого другого. Материал обладает поистине безграничными возможностями, что позволяет создавать удивительные шедевры как для коммерческих объектов, так и для дома. Создаются конструкции для учебных заведений, школ, медицинских центров, аэропортов.
https://sustainabilipedia.org/index.php/User:StellaBond99373
[u][b] Здравствуйте![/b][/u]
[b]Мы изготавливаем дипломы[/b] любой профессии по доступным тарифам.
[url=http://www.cetprocapci.com/inicio/uncategorized/%D0%BA%D1%83%D0%BF%D0%B8%D1%82%D1%8C-%D0%B4%D0%B8%D0%BF%D0%BB%D0%BE%D0%BC-%D0%BA%D0%B0%D1%81%D1%81%D0%B8%D1%80%D0%B0//]www.cetprocapci.com/inicio/uncategorized/%D0%BA%D1%83%D0%BF%D0%B8%D1%82%D1%8C-%D0%B4%D0%B8%D0%BF%D0%BB%D0%BE%D0%BC-%D0%BA%D0%B0%D1%81%D1%81%D0%B8%D1%80%D0%B0/[/url]
image source [url=https://cosmohubs.org/]keplr wallet login[/url]
В казино Риобет я всегда могу воспользоваться различными специальными акциями и предложениями – [url=https://riobetcasino-qhw.top/]игровые автоматы Riobet регистрация[/url]
https://bk-zenit-app.ru/
Казино 7к казино предлагает захватывающий игровой опыт с яркой графикой и качественными игровыми слотами для игры на реальные средства – [url=https://r7casino-trv.top/]р7 казино официальная страницы[/url]
[u][b] Привет, друзья![/b][/u]
[b]Купить документ[/b] университета можно у нас.
[url=http://diplomasx.com/kupit-diplom-moskva/]diplomasx.com/kupit-diplom-moskva[/url]
В критические моменты жизни важно, чтобы похоронное бюро было надежным и профессиональным. Наша статья поможет вам разобраться в разнообразии ритуальных услуг в Алматы и выбрать агентство, которое предложит качественное обслуживание по разумной цене [url=https://teletype.in/@funeralservice/funeralprice2]прейскурант цен на ритуальные услуги[/url]
Ищете надежный навес для авто в Дмитрове? Вип Навес предлагает арочные и консольные металлические навесы, а также конструкции из поликарбоната. Мы начинаем с выезда инженера-замерщика, который осматривает место установки, делает точные замеры и рассчитывает проект на месте. Бесплатно создаем 3D макет, чтобы вы могли видеть будущую конструкцию. Заключаем договор с фиксированными ценами и сроками, а затем приступаем к производству. ВИП НАВЕС РУ гарантирует высокое качество благодаря использованию профессионального оборудования и материалов. Доставка и монтаж проводятся в удобное для вас время, а заключительные работы завершаются подписанием акта и уборкой территории. Закажите у нас и получите бесплатный 3D проект!
Казино 7k casino, стартовавшее в 2023 году, сразу же покорило сердца азартных игроков своей высокой репутацией и разнообразием предоставляемых услуг, что делает его потенциальным фаворитом в рейтинге казино – [url=https://7kcasino-xvi.top/]Сайт[/url]
На сайте https://pacific-map.com/index.html вы ознакомитесь с картой США с городами, штатами. Перед вами самая полная карта автомобильных дорог США. Есть карта Атлантического, Тихоокеанского побережья, имеется физическая карта США. Только здесь указана самая полная и содержательная информация, которая прольет свет на многочисленные вопросы. Вся информация является содержательной, интересной, актуальной, а потому на нее точно можно положиться. Обращайтесь и вы сюда за информацией, если необходимо что-то уточнить.
[u][b] Привет, друзья![/b][/u]
Где купить диплом специалиста?
[b]Приобрести диплом университета.[/b]
[url=http://www.clubalpintoulouse.fr/cb-profile/pluginclass/cbblogs?action=blogs&func=show&id=146/]www.clubalpintoulouse.fr/cb-profile/pluginclass/cbblogs?action=blogs&func=show&id=146[/url]
[u][b] Добрый день![/b][/u]
Купить диплом ВУЗа
Мы можем предложить документы ВУЗов, которые находятся на территории всей Российской Федерации. Вы сможете приобрести диплом от любого заведения, за любой год, включая сюда документы старого образца. Дипломы и аттестаты выпускаются на бумаге самого высшего качества. Это дает возможность делать государственные дипломы, которые не отличить от оригиналов. Документы заверяются всеми необходимыми печатями и штампами.
[url=http://www.fxstat.com/en/user/profile/MarkWilkins-711545/blog/38091184-%D0%9A%D0%B0%D0%BA-%D0%B2%D1%8B%D0%B1%D1%80%D0%B0%D1%82%D1%8C-%D0%BD%D0%B0%D0%B4%D0%B5%D0%B6%D0%BD%D0%BE%D0%B3%D0%BE-%D0%BF%D1%80%D0%BE%D0%B4%D0%B0%D0%B2%D1%86%D0%B0-%D0%B0%D1%82%D1%82%D0%B5%D1%81%D1%82%D0%B0%D1%82%D0%BE%D0%B2-%D0%B7%D0%B0-11-%D0%BA%D0%BB%D0%B0%D1%81%D1%81-%D0%B8-%D0%B4%D0%B8%D0%BF%D0%BB%D0%BE%D0%BC%D0%BE%D0%B2]www.fxstat.com/en/user/profile/MarkWilkins-711545/blog/38091184-%D0%9A%D0%B0%D0%BA-%D0%B2%D1%8B%D0%B1%D1%80%D0%B0%D1%82%D1%8C-%D0%BD%D0%B0%D0%B4%D0%B5%D0%B6%D0%BD%D0%BE%D0%B3%D0%BE-%D0%BF%D1%80%D0%BE%D0%B4%D0%B0%D0%B2%D1%86%D0%B0-%D0%B0%D1%82%D1%82%D0%B5%D1%81%D1%82%D0%B0%D1%82%D0%BE%D0%B2-%D0%B7%D0%B0-11-%D0%BA%D0%BB%D0%B0%D1%81%D1%81-%D0%B8-%D0%B4%D0%B8%D0%BF%D0%BB%D0%BE%D0%BC%D0%BE%D0%B2[/url]
Окажем помощь!.
Бесплатное мобильное приложение казино 7k casino можно скачать без дополнительной платы – [url=https://7kcasino-wui.top/]7k casino онлайн[/url]
This is my first time pay a quick visit at here and i am really impressed to read all at one place.
cratosroyalbet giris
двухскатный навес
Новый доход http://pokerclub2015.ukrbb.net/viewtopic.php?f=4&t=339&p=893#http://pokerclub2015.ukrbb.net/viewtopic.php?f=4&t=339&p=893 – без нервотрепки! Как мне найти рестораны поблизости, предлагающие доставку?
сервис ремонта мобильных телефонов
[u][b] Здравствуйте![/b][/u]
[b]Быстрое обучение и получение диплома магистра – возможно ли это? [/b]
[url=http://znamo.listbb.ru/posting.php?mode=post&f=9/]znamo.listbb.ru/posting.php?mode=post&f=9[/url]
[u][b] Всегда вам поможем![u][b].
Admiring the time and energy you put into your site and in depth information you offer. It’s awesome to come across a blog every once in a while that isn’t the same outdated rehashed material. Fantastic read! I’ve bookmarked your site and I’m including your RSS feeds to my Google account.
cat casino
more information [url=https://martianwallet.app/]Sui wallet martianwallet[/url]
[u][b] Добрый день![/b][/u]
Где приобрести диплом по нужной специальности?
[b]Приобрести диплом о высшем образовании.[/b]
[url=http://cdposz.ru/club/user/802/forum/message/1485/1544//]cdposz.ru/club/user/802/forum/message/1485/1544/[/url]
[u][b] Здравствуйте![/b][/u]
Заказать документ о получении высшего образования можно в нашем сервисе. Мы предлагаем документы об окончании любых ВУЗов Российской Федерации. Вы сможете получить необходимый диплом по любой специальности, включая документы Советского Союза.
[url=http://forum.vorchun.ru/viewtopic.php?f=2&t=253075/]forum.vorchun.ru/viewtopic.php?f=2&t=253075[/url]
[url=http://wap.fortboyard2012forum.4adm.ru/viewtopic.php?f=27&t=4159/]wap.fortboyard2012forum.4adm.ru/viewtopic.php?f=27&t=4159[/url]
[url=http://faithstreamer.com/blogs/3200/Легальный-диплом-без-лишних-хлопот-узнайте-как/]faithstreamer.com/blogs/3200/Легальный-диплом-без-лишних-хлопот-узнайте-как[/url]
[url=http://share.psiterror.ru/2024/07/13/kupite-diplom-i-uluchshite-svoe-buduschee.html/]share.psiterror.ru/2024/07/13/kupite-diplom-i-uluchshite-svoe-buduschee.html[/url]
[url=http://forex.g-talk.ru/viewtopic.php?f=43&t=7121/]forex.g-talk.ru/viewtopic.php?f=43&t=7121[/url]
Football in Saudi Arabia https://al-hilal.saud-abdulhamid-ar.com is gaining more and more popularity and recognition on the international stage, and Saud Abdul Hamid, the young and talented defender of Al Hilal, is a shining example of this success.
Angel Di Maria https://benfica.angel-di-maria-ar.com is a name that will forever remain in the memories of Benfica fans.
Khvicha Kvaratskhelia https://napoli.khvicha-kvaratskhelia-ar.com is a name that in recent years has become a symbol of Georgian football talent and ambition.
[u][b] Привет![/b][/u]
[b]Мы предлагаем документы техникумов[/b], расположенных в любом регионе России. Можно приобрести качественно сделанный диплом от любого учебного заведения, за любой год, включая документы СССР. Документы выпускаются на бумаге высшего качества. Это дает возможность делать настоящие дипломы, не отличимые от оригинала. Они будут заверены необходимыми печатями и штампами.
[url=http://zpgiugb3n.look4blog.com/67321351/%D0%9A%D0%B0%D0%BA-%D0%BC%D0%BE%D0%B6%D0%BD%D0%BE-%D0%B1%D1%83%D0%B4%D0%B5%D1%82-%D0%B1%D1%8B%D1%81%D1%82%D1%80%D0%BE-%D0%BA%D1%83%D0%BF%D0%B8%D1%82%D1%8C-%D0%B4%D0%B8%D0%BF%D0%BB%D0%BE%D0%BC-%D0%B2-%D0%B8%D0%BD%D1%82%D0%B5%D1%80%D0%BD%D0%B5%D1%82-%D0%BC%D0%B0%D0%B3%D0%B0%D0%B7%D0%B8%D0%BD%D0%B5/]zpgiugb3n.look4blog.com/67321351/%D0%9A%D0%B0%D0%BA-%D0%BC%D0%BE%D0%B6%D0%BD%D0%BE-%D0%B1%D1%83%D0%B4%D0%B5%D1%82-%D0%B1%D1%8B%D1%81%D1%82%D1%80%D0%BE-%D0%BA%D1%83%D0%BF%D0%B8%D1%82%D1%8C-%D0%B4%D0%B8%D0%BF%D0%BB%D0%BE%D0%BC-%D0%B2-%D0%B8%D0%BD%D1%82%D0%B5%D1%80%D0%BD%D0%B5%D1%82-%D0%BC%D0%B0%D0%B3%D0%B0%D0%B7%D0%B8%D0%BD%D0%B5[/url]
It’s remarkable for me to have a web site, which is beneficial for my knowledge. thanks admin
leebet casino
[u][b] Добрый день![/b][/u]
[b]Приобрести документ[/b] о получении высшего образования вы сможете в нашей компании в столице.
[url=http://diplomasx24.ru/kupit-diplom-krasnoyarsk/]diplomasx24.ru/kupit-diplom-krasnoyarsk[/url]
[u][b] Здравствуйте![/b][/u]
[b]Приобрести документ[/b] университета можно у нас.
[url=http://diplomasx24.ru/kupit-diplom-ekaterinbur/]diplomasx24.ru/kupit-diplom-ekaterinbur[/url]
[b]Хорошей учебы![/b]
[u][b] Привет, друзья![/b][/u]
Готовы предложить документы техникумов, расположенных на территории всей Российской Федерации. Можно купить качественный диплом за любой год, включая документы старого образца СССР. Дипломы и аттестаты печатаются на бумаге самого высшего качества. Это позволяет делать настоящие дипломы, не отличимые от оригинала. Они заверяются необходимыми печатями и подписями.
[b]Мы изготавливаем дипломы[/b] психологов, юристов, экономистов и прочих профессий по выгодным ценам. Цена может зависеть от конкретной специальности, года получения и образовательного учреждения. Стараемся поддерживать для заказчиков адекватную политику тарифов. [b]Важно[/b], чтобы дипломы были доступными для подавляющей массы наших граждан.
[url=http://arusak-diploms-srednee.ru/kupit-diplom-sssr В ]arusak-diploms-srednee.ru/kupit-diplom-sssr В [/url]
[b]Удачи![/b]
бк zenit скачать
[u][b] Здравствуйте![/b][/u]
[b]Где приобрести диплом специалиста?[/b]
Мы предлагаем дипломы любых профессий по невысоким ценам. Стоимость может зависеть от выбранной специальности, года выпуска и образовательного учреждения. Стараемся поддерживать для заказчиков адекватную политику цен. Для нас важно, чтобы документы были доступными для большинства наших граждан.
[b]Для вас изготавливаем дипломы[/b] любой профессии по приятным ценам.
[url=http://picbok.org/read-blog/4658_nadezhnyj-internet-magazin-s-obshirnym-vyborom-dokumentov.html]picbok.org/read-blog/4658_nadezhnyj-internet-magazin-s-obshirnym-vyborom-dokumentov.html[/url]
[u][b] Рады помочь![u][b].
[u][b] Добрый день![/b][/u]
Приобрести диплом о высшем образовании
[b]Мы предлагаем[/b] максимально быстро приобрести диплом, который выполняется на оригинальном бланке и заверен печатями, штампами, подписями. Диплом пройдет лубую проверку, даже при использовании профессионального оборудования. Достигайте своих целей максимально быстро с нашей компанией.
[b]Где заказать диплом специалиста?[/b]
[url=http://www.import-moto.com/users/88/]www.import-moto.com/users/88[/url]
[url=http://zustme.com/blogs/98/Что-понадобится-для-производства-качественного-диплома-ВУЗа/]zustme.com/blogs/98/Что-понадобится-для-производства-качественного-диплома-ВУЗа[/url]
[url=http://epistles.ru/blogs/1482/ упить-?иплом-Ѕыстро-и-Ћегально/]epistles.ru/blogs/1482/ упить-?иплом-Ѕыстро-и-Ћегально[/url]
[url=http://avtobestnews.ru/nastoyashhie-diplomyi-bez-lishnih-hlopot/]avtobestnews.ru/nastoyashhie-diplomyi-bez-lishnih-hlopot[/url]
[url=http://heyjinni.com/read-blog/108757/]heyjinni.com/read-blog/108757[/url]
[u][b] Привет, друзья![/b][/u]
[b]Реально ли приобрести диплом стоматолога? Основные этапы [/b]
[url=http://owen.ru/forum/member.php?u=151770&vmid=6624#vmessage6624/]owen.ru/forum/member.php?u=151770&vmid=6624#vmessage6624[/url]
[u][b] Рады оказаться полезными![u][b].
[u][b] Добрый день![/b][/u]
[b]Мы предлагаем приобрести диплом[/b] высочайшего качества, который невозможно отличить от оригинального документа без участия специалистов высокой квалификации со специальным оборудованием.
[url=http://2.shkola.hc.ru/index.php?option=com_k2&view=itemlist&task=user&id=1839/]2.shkola.hc.ru/index.php?option=com_k2&view=itemlist&task=user&id=1839[/url]
[b]Удачи![/b]
[u][b] Привет, друзья![/b][/u]
[b]Заказать диплом о высшем образовании.[/b]
[url=http://86hm.ru/forum/flame/?topic_id=24886/]86hm.ru/forum/flame/?topic_id=24886[/url]
[b]Удачи![/b]
[u][b] Привет![/b][/u]
[b]Мы можем предложить документы техникумов[/b], расположенных на территории всей России. Вы можете заказать диплом от любого учебного заведения, за любой год, указав необходимую специальность и хорошие оценки за все дисциплины. Дипломы и аттестаты делаются на “правильной” бумаге высшего качества. Это позволяет делать настоящие дипломы, не отличимые от оригинала. Они будут заверены необходимыми печатями и штампами.
[url=http://antoinegriezmannclub.com/read-blog/2702/]antoinegriezmannclub.com/read-blog/2702[/url]
[u][b] Привет![/b][/u]
Заказать документ о получении высшего образования вы сможете в нашем сервисе. Мы предлагаем документы об окончании любых университетов России. Вы получите необходимый диплом по любым специальностям, любого года выпуска, включая документы образца СССР.
[url=http://avtomobil1980.ixbb.ru/viewtopic.php?id=114#p114/]avtomobil1980.ixbb.ru/viewtopic.php?id=114#p114[/url]
[url=http://indicouple.com/blogs/1164/Ваш-диплом-без-лишних-забот-быстро-и-безопасно/]indicouple.com/blogs/1164/Ваш-диплом-без-лишних-забот-быстро-и-безопасно[/url]
[url=http://cittaviva.net/read-blog/65/]cittaviva.net/read-blog/65[/url]
[url=http://films.name/viewforum.php?f=143/]films.name/viewforum.php?f=143[/url]
[url=http://2cool.ru/qiwi-f215/diplom-bez-uchebi-prostoy-put-k-uspehu-t3799.html/]2cool.ru/qiwi-f215/diplom-bez-uchebi-prostoy-put-k-uspehu-t3799.html[/url]
навес для машины из поликарбоната
The average price of a weekly yacht rental in https://fibastech.com/exploring-tenerife-by-sea-the-ultimate-romantic-boat-rental-guide/ florida is $18,489.
[u][b] Добрый день![/b][/u]
[b]Наша компания предлагает[/b] быстро и выгодно купить диплом, который выполнен на бланке ГОЗНАКа и заверен печатями, штампами, подписями. Диплом пройдет лубую проверку, даже при использовании профессионального оборудования. Достигайте цели быстро и просто с нашей компанией.
[url=http://himagro.md/forum/user/40722//]himagro.md/forum/user/40722/[/url]
[b]Успехов в учебе![/b]
http://tour-is.co.kr/bbs/board.php?bo_table=free&wr_id=236809
Различные ноу-хау из серии спортивного питания по лучшим https://levelsusa.ru/ ценам.
Быстрая схема покупки диплома старого образца: что важно знать?
[url=http://diplomasx24.ru/kupit-diplom-sankt-peterburg/]diplomasx24.ru/kupit-diplom-sankt-peterburg[/url]
[u][b] Добрый день![/b][/u]
[b]Приобрести диплом ВУЗа.[/b]
[url=http://kotanusantara.cloud/index.php?/events/event/13-%D0%B1%D1%8B%D1%81%D1%82%D1%80%D1%8B%D0%B9-%D0%B2%D1%8B%D0%B1%D0%BE%D1%80-%D0%BE%D0%BD%D0%BB%D0%B0%D0%B9%D0%BD-%D0%BC%D0%B0%D0%B3%D0%B0%D0%B7%D0%B8%D0%BD%D0%B0-%D1%87%D1%82%D0%BE-%D1%80%D0%B5%D0%B0%D0%BB%D0%B8%D0%B7%D1%83%D0%B5%D1%82-%D0%B4%D0%B8%D0%BF%D0%BB%D0%BE%D0%BC%D1%8B-%D0%B8-%D0%B0%D1%82%D1%82%D0%B5%D1%81%D1%82%D0%B0%D1%82%D1%8B//]kotanusantara.cloud/index.php?/events/event/13-%D0%B1%D1%8B%D1%81%D1%82%D1%80%D1%8B%D0%B9-%D0%B2%D1%8B%D0%B1%D0%BE%D1%80-%D0%BE%D0%BD%D0%BB%D0%B0%D0%B9%D0%BD-%D0%BC%D0%B0%D0%B3%D0%B0%D0%B7%D0%B8%D0%BD%D0%B0-%D1%87%D1%82%D0%BE-%D1%80%D0%B5%D0%B0%D0%BB%D0%B8%D0%B7%D1%83%D0%B5%D1%82-%D0%B4%D0%B8%D0%BF%D0%BB%D0%BE%D0%BC%D1%8B-%D0%B8-%D0%B0%D1%82%D1%82%D0%B5%D1%81%D1%82%D0%B0%D1%82%D1%8B/[/url]
[u][b] Привет![/b][/u]
Где заказать диплом по необходимой специальности?
Мы готовы предложить документы ВУЗов, расположенных в любом регионе России. Можно заказать качественный диплом за любой год, указав актуальную специальность и хорошие оценки за все дисциплины. Дипломы делаются на бумаге высшего качества. Это позволяет делать настоящие дипломы, не отличимые от оригинала. Они будут заверены всеми требуемыми печатями и штампами.
[b]Мы предлагаем дипломы[/b] психологов, юристов, экономистов и других профессий по доступным тарифам.
[url=http://diploms-x24.ru/kupit-diplom-magistra]diploms-x24.ru/kupit-diplom-magistra[/url]
[u][b] Всегда вам поможем![u][b]
[u][b] Добрый день![/b][/u]
Где приобрести диплом специалиста?
[url=http://onlinekinospace.ru/kupite-diplom-i-poluchite-novyie-vozmozhnosti/]onlinekinospace.ru/kupite-diplom-i-poluchite-novyie-vozmozhnosti[/url]
[b]Успехов в учебе![/b]
http://macone.co.kr/bbs/board.php?bo_table=free&wr_id=27478
Hey there! I know this is kind of off topic but I was wondering if you knew
where I could locate a captcha plugin for my comment form?
I’m using the same blog platform as yours and I’m having problems finding
one? Thanks a lot!
Heya i’m for the first time here. I came across this board and I find
It really useful & it helped me out a lot. I’m
hoping to present something again and aid others like
you aided me.
Казахский национальный технический университет https://satbayev.university им. К.Сатпаева
Upcoming fantasy MOBA https://bladesofthevoid.com evolved by Web3. Gacha perks, AI and crafting in one swirling solution!
https://subscribe.ru/author/25924851/group/records/?page=45
Продажа новых автомобилей Hongqi
https://hongqi-krasnoyarsk.ru/buyers/trade-in-form в Красноярске у официального дилера Хончи. Весь модельный ряд, все комплектации, выгодные цены, кредит, лизинг, трейд-ин
Find the best AI for SEX best nudify app. Explore the limitless possibilities of deepnude AI, nude AI, porn AI, and witness the staggering potential of Deepnude AI Tools today
Kylie Jenner https://kylie-cosmetics.kylie-jenner-ar.com is an American model, media personality, and businesswoman, born on August 10, 1997 in Los Angeles, California.
Зайдите на сайт Научно-технического центра «Триада» https://triadacompany.ru/ который помогает тысячам предприятий обеспечивать промышленную и экологическую безопасность по всей России! Лучшие кадры, инновационный подход, опыт с 1991 года. Промышленная и экологическая безопасность, экспертиза, проектирование, консалтинг. Подробнее на сайте.
[u][b] Здравствуйте![/b][/u]
Где приобрести диплом специалиста?
[b]Приобрести диплом о высшем образовании.[/b]
[url=http://cdposz.ru/club/user/802/forum/message/1485/1544//]cdposz.ru/club/user/802/forum/message/1485/1544/[/url]
купить ли диплом [url=https://diplomasx.com/]купить ли диплом[/url] .
где купить диплом фармацевта [url=https://ast-diploms.com/]ast-diploms.com[/url] .
магазин аккаунтов telegram [url=https://magazin-akkauntov.ru/]магазин аккаунтов telegram[/url] .
24thainews.com
alcitynews.com
[u][b] Здравствуйте![/b][/u]
Купить документ университета можно у нас в столице. Мы оказываем услуги по производству и продаже документов об окончании любых ВУЗов России. Вы сможете получить диплом по любым специальностям, любого года выпуска, включая документы СССР.
[url=http://mf.getbb.ru/viewtopic.php?f=28&t=654/]mf.getbb.ru/viewtopic.php?f=28&t=654[/url]
[url=http://bittogether.com/index.php?action=profile;u=11883/]bittogether.com/index.php?action=profile;u=11883[/url]
[url=http://koxma.4adm.ru/viewtopic.php?f=298&t=5516/]koxma.4adm.ru/viewtopic.php?f=298&t=5516[/url]
[url=http://coastalplainplants.org/wiki/index.php/Диплом_мечты_без_учебы_и_экзаменов/]coastalplainplants.org/wiki/index.php/Диплом_мечты_без_учебы_и_экзаменов[/url]
[url=http://ai.cheap/read-blog/25604/]ai.cheap/read-blog/25604[/url]
[u][b] Привет, друзья![/b][/u]
Предлагаем документы техникумов, расположенных на территории всей РФ. Вы имеете возможность заказать диплом от любого учебного заведения, за любой год, указав необходимую специальность и хорошие оценки за все дисциплины. Документы выпускаются на бумаге высшего качества. Это дает возможность делать государственные дипломы, которые невозможно отличить от оригиналов. Они заверяются всеми требуемыми печатями и штампами.
[b]Мы изготавливаем дипломы[/b] любой профессии по выгодным тарифам. Цена может зависеть от выбранной специальности, года получения и образовательного учреждения. Стараемся поддерживать для покупателей адекватную политику тарифов. [b]Для нас очень важно[/b], чтобы дипломы были доступными для большинства наших граждан.
[url=http://landik-diploms-srednee.ru/kupit-diplom-saratov В ]landik-diploms-srednee.ru/kupit-diplom-saratov В [/url]
[b]Удачи![/b]
[u][b] Привет![/b][/u]
[b]Купить документ[/b] о получении высшего образования можно в нашей компании.
[url=http://diplomasx24.ru/kupit-diplom-rostov-na-donu/]diplomasx24.ru/kupit-diplom-rostov-na-donu[/url]
[u][b] Добрый день![/b][/u]
[b]Приобрести документ[/b] университета вы можете в нашей компании в Москве.
[url=http://diploms-x.com/kupit-diplom-rostov-na-donu/]diploms-x.com/kupit-diplom-rostov-na-donu[/url]
[b]Хорошей учебы![/b]
На сайте https://cpo24.ru/ закажите звонок для того, чтобы получить допуск СРО. Документ будет на руках в течение суток. Стоимость услуги варьируется от 50 000 рублей. При этом отсутствуют надбавки, комиссии. В этой компании вы сможете получить СРО проектировщиков, строителей, а также энергоаудиторов, изыскателей либо воспользоваться услугой сопровождения проверок СРО. Все услуги выполняются ответственными, квалифицированными, грамотными сотрудниками. При этом работы обойдутся недорого.
[u][b] Добрый день![/b][/u]
[b]Мы готовы предложить документы техникумов[/b], которые находятся в любом регионе России. Вы сможете заказать диплом за любой год, включая документы старого образца. Дипломы и аттестаты печатаются на “правильной” бумаге высшего качества. Это позволяет делать настоящие дипломы, которые невозможно отличить от оригиналов. Они будут заверены необходимыми печатями и подписями.
[url=http://uf37mcli4.newsbloger.com/28789596/%D0%9A%D0%B0%D0%BA-%D0%B2%D0%BE%D0%B7%D0%BC%D0%BE%D0%B6%D0%BD%D0%BE-%D0%B1%D1%83%D0%B4%D0%B5%D1%82-%D0%B1%D1%8B%D1%81%D1%82%D1%80%D0%BE-%D0%BF%D1%80%D0%B8%D0%BE%D0%B1%D1%80%D0%B5%D1%81%D1%82%D0%B8-%D0%B4%D0%B8%D0%BF%D0%BB%D0%BE%D0%BC-%D0%B2-%D0%BC%D0%B0%D0%B3%D0%B0%D0%B7%D0%B8%D0%BD%D0%B5/]uf37mcli4.newsbloger.com/28789596/%D0%9A%D0%B0%D0%BA-%D0%B2%D0%BE%D0%B7%D0%BC%D0%BE%D0%B6%D0%BD%D0%BE-%D0%B1%D1%83%D0%B4%D0%B5%D1%82-%D0%B1%D1%8B%D1%81%D1%82%D1%80%D0%BE-%D0%BF%D1%80%D0%B8%D0%BE%D0%B1%D1%80%D0%B5%D1%81%D1%82%D0%B8-%D0%B4%D0%B8%D0%BF%D0%BB%D0%BE%D0%BC-%D0%B2-%D0%BC%D0%B0%D0%B3%D0%B0%D0%B7%D0%B8%D0%BD%D0%B5[/url]
[u][b] Привет![/b][/u]
[b]Узнайте, как безопасно купить диплом о высшем образовании [/b]
[url=http://bvf.ru/forum/showthread.php?p=25249385#post25249385/]bvf.ru/forum/showthread.php?p=25249385#post25249385[/url]
[u][b] Окажем помощь![u][b].
На сайте https://ustanovki-masla.ru представлена информация о том, какую установку, использующуюся для слива, а также откачки масла, лучше выбрать. Представлены и пневматические установки, которые собирают масло, которое уже отработало. Изучите функциональные, качественные устройства, предназначенные для замены масла и с ручным приводом. Также изучите и важные особенности, достоинства установок. Перед вами только самая актуальная и честная информация, которая обязательно понадобится.
Если чат не подходит или игрок получает запрограммированные ответы, вероятно, https://slothacker62.com/ никакого штата сотрудников у.
как купить аттестат с занесением в базу [url=https://asxdiplomik24.ru/]как купить аттестат с занесением в базу[/url] .
купить диплом в димитровграде [url=https://mandiplomik.ru/]mandiplomik.ru[/url] .
[u][b] Привет, друзья![/b][/u]
Где заказать диплом специалиста?
[b]Купить диплом о высшем образовании.[/b]
[url=http://yobasket.es/es/perfil-usuario/pluginclass/cbblogs.html?action=blogs&func=show&id=121/]yobasket.es/es/perfil-usuario/pluginclass/cbblogs.html?action=blogs&func=show&id=121[/url]
ремонт телефонов в москве
диплом о среднем профессиональном образовании где купить [url=https://diploms-x.com/]диплом о среднем профессиональном образовании где купить[/url] .
Такие промокоды предусматривают пользователей, https://bxti.com.mx/wp-content/pgs/el_codigo_promocional-1xbet.html которые встречаются войти в одну икс Бет.
[u][b] Добрый день![/b][/u]
[b]Как правильно купить диплом колледжа и пту в России, подводные камни[/b]
[url=http://telegra.ph/kupit-diplom-o-vysshem-obrazovanii-03-26/]telegra.ph/kupit-diplom-o-vysshem-obrazovanii-03-26[/url]
[u][b] Привет![/b][/u]
[b]Приобрести документ[/b] ВУЗа вы сможете в нашей компании.
[url=http://ast-diplom.com/kupit-diplom-vracha/]ast-diplom.com/kupit-diplom-vracha[/url]
[b]Успешной учебы![/b]
seth green movies and tv shows is the new scream movie streamingumbrella academy season 1 plotbabysitters club season 3mario bosco movies
[u][b] Привет, друзья![/b][/u]
Ьожем предложить документы техникумов, которые находятся в любом регионе РФ. Вы имеете возможность заказать качественный диплом от любого учебного заведения, за любой год, в том числе документы старого образца. Дипломы и аттестаты выпускаются на “правильной” бумаге самого высокого качества. Это позволяет делать государственные дипломы, которые не отличить от оригинала. Документы заверяются всеми требуемыми печатями и подписями.
[b]Мы изготавливаем дипломы[/b] любой профессии по приятным ценам. Цена будет зависеть от выбранной специальности, года получения и ВУЗа. Стараемся поддерживать для заказчиков адекватную ценовую политику. [b]Для нас очень важно[/b], чтобы дипломы были доступны для большого количества наших граждан.
[url=http://landik-diploms-srednee.ru/kupit-diplom-v-kazani В ]landik-diploms-srednee.ru/kupit-diplom-v-kazani В [/url]
[b]Удачи![/b]
[u][b] Добрый день![/b][/u]
[b]Узнайте, как безопасно купить диплом о высшем образовании [/b]
[url=http://spletninews.ru/legkiy-sposob-poluchit-diplom-nadezhno-i-konfidentsialno/]spletninews.ru/legkiy-sposob-poluchit-diplom-nadezhno-i-konfidentsialno[/url]
[u][b] Будем рады вам помочь![u][b].
мастерская по ремонту смартфонов
[u][b] Здравствуйте![/b][/u]
[b]Мы можем предложить документы техникумов[/b], которые находятся в любом регионе России. Вы сможете заказать диплом от любого учебного заведения, за любой год, включая сюда документы СССР. Дипломы и аттестаты выпускаются на бумаге самого высшего качества. Это дает возможности делать настоящие дипломы, которые не отличить от оригинала. Документы заверяются необходимыми печатями и штампами.
[url=http://iek1kwk0s.blogginaway.com/28823923/%D0%9F%D0%BE%D0%B4%D1%80%D0%BE%D0%B1%D0%BD%D0%BE%D0%B5-%D0%BE%D0%BF%D0%B8%D1%81%D0%B0%D0%BD%D0%B8%D0%B5-%D0%BF%D1%80%D0%B8%D0%BE%D0%B1%D1%80%D0%B5%D1%82%D0%B5%D0%BD%D0%B8%D1%8F-%D0%B4%D0%B8%D0%BF%D0%BB%D0%BE%D0%BC%D0%B0-%D0%B2-%D0%BF%D0%BE%D0%BF%D1%83%D0%BB%D1%8F%D1%80%D0%BD%D0%BE%D0%BC-%D0%BE%D0%BD%D0%BB%D0%B0%D0%B9%D0%BD-%D0%BC%D0%B0%D0%B3%D0%B0%D0%B7%D0%B8%D0%BD%D0%B5/]iek1kwk0s.blogginaway.com/28823923/%D0%9F%D0%BE%D0%B4%D1%80%D0%BE%D0%B1%D0%BD%D0%BE%D0%B5-%D0%BE%D0%BF%D0%B8%D1%81%D0%B0%D0%BD%D0%B8%D0%B5-%D0%BF%D1%80%D0%B8%D0%BE%D0%B1%D1%80%D0%B5%D1%82%D0%B5%D0%BD%D0%B8%D1%8F-%D0%B4%D0%B8%D0%BF%D0%BB%D0%BE%D0%BC%D0%B0-%D0%B2-%D0%BF%D0%BE%D0%BF%D1%83%D0%BB%D1%8F%D1%80%D0%BD%D0%BE%D0%BC-%D0%BE%D0%BD%D0%BB%D0%B0%D0%B9%D0%BD-%D0%BC%D0%B0%D0%B3%D0%B0%D0%B7%D0%B8%D0%BD%D0%B5[/url]
Привет!
Купить диплом университета
[url=http://landik-diploms-srednee.ru/attestat-shkoly В ]landik-diploms-srednee.ru/attestat-shkoly В [/url]
Удачи!
Ищете навес для автомобиля в Зеленограде? Вип Навес предлагает широкий ассортимент навесов из поликарбоната и металла. Наши услуги начинаются с выезда инженера-замерщика, который в удобное для вас время зафиксирует все ваши требования, сделает точные замеры и рассчитает проект на месте. Мы создаем бесплатный 3D макет, чтобы вы могли видеть будущую конструкцию. Заключаем договор с фиксированными ценами и сроками, после чего приступаем к производству. Vip-Naves гарантирует высокое качество благодаря использованию профессионального оборудования и материалов. Доставка и монтаж проводятся в удобное для вас время, а по завершению работ производится окончательная оплата. Закажите у нас и получите бесплатный 3D проект в подарок!
[u][b] Добрый день![/b][/u]
Купить документ института вы имеете возможность в нашем сервисе. Мы предлагаем документы об окончании любых университетов России. Вы сможете получить диплом по любым специальностям, включая документы старого образца.
[url=http://visacart.80lvl.ru/viewtopic.php?f=1&t=790/]visacart.80lvl.ru/viewtopic.php?f=1&t=790[/url]
[url=http://innovator24.com/read-blog/5895/]innovator24.com/read-blog/5895[/url]
[url=http://net4women.ru/blogs/3934/Надежные-дипломы-от-профессионалов/]net4women.ru/blogs/3934/Надежные-дипломы-от-профессионалов[/url]
[url=http://nagatinos.getbb.ru/viewtopic.php?f=6&t=578/]nagatinos.getbb.ru/viewtopic.php?f=6&t=578[/url]
[url=http://www.noo.by/wiki/Быстрая_помощь_в_оформлении_дипломов/]www.noo.by/wiki/Быстрая_помощь_в_оформлении_дипломов[/url]
Bella Hadid https://img-models.bella-hadid-ar.com is an American model who has emerged in recent years as one of the most influential figures in the world of fashion.
1 win промокод
Sadio Mane https://al-nassr.sadio-mane-ar.com the Senegalese footballer best known for his performances at clubs such as Southampton and Liverpool, has become a prominent figure in Al Nassr.
Zinedine Zidane https://real-madrid.zinedine-zidane-ar.com the legendary French footballer, entered the annals of football history as a player and coach.
Brazilian footballer Ricardo Escarson https://orlando-city.kaka-ar.com dos Santos Leite, better known as Kaka, is one of the most famous and successful players in football history.
britainrental.com
Companies with high welcomelady.net levels of customer service usually have an excellent reputation and positive reviews.
look at this now [url=https://coimnarketcap.us/]coinmarketcap[/url]
Интересни книжки за оцветяване, за развитие на творческите способности и вдъхновение.
Вълшебни приказки: Вълшебните приказки са пълни с чудеса и магия: [url=https://azbukivedi-bg.com/]https://azbukivedi-bg.com/[/url] .
[u][b] Здравствуйте![/b][/u]
[b]Заказать документ[/b] о получении высшего образования можно в нашей компании в Москве.
[url=http://diplomyx24.ru/kupit-diplom-moskva/]diplomyx24.ru/kupit-diplom-moskva[/url]
[u][b] Здравствуйте![/b][/u]
Где купить диплом по актуальной специальности?
[b]Приобрести диплом о высшем образовании.[/b]
[url=http://cdposz.ru/club/user/802/forum/message/1485/1544//]cdposz.ru/club/user/802/forum/message/1485/1544/[/url]
Специалист СОУТ
Процедура специальной оценки условий труда включает основные этапы. Сначала идет подготовка и сбор документов, дальше специалисты оценивают рабочие места и выявляют потенциальные риски. На последнем этапе составляется отчет, включающий рекомендации по улучшению условий труда. [url=https://safetysystemsgroup.com/sout3]Процедура специальной оценки условий труда[/url] не только способствует соблюдению законодательства, но и улучшает доверие сотрудников к компании.
отремонтировать ноутбук
[u][b] Здравствуйте![/b][/u]
[b]Приобрести документ[/b] университета можно у нас.
[url=http://ast-diplomas.com/kupit-diplom-krasnoyarsk/]ast-diplomas.com/kupit-diplom-krasnoyarsk[/url]
[b]Хорошей учебы![/b]
Edson Arantes https://santos.pele-ar.com do Nascimento, known as Pele, was born on October 23, 1940 in Tres Coracoes, Minas Gerais, Brazil.
Какие рестораны предлагаются на http://volshebstvo.ukrbb.net/viewtopic.php?f=3&t=199&p=227#http://volshebstvo.ukrbb.net/viewtopic.php?f=3&t=199&p=227 bolt food?
Brazilian footballer Malcom https://al-hilal.malcom-ar.com (full name Malcom Felipe Silva de Oliveira) achieved great success in Al Hilal, one of the leading football teams in Saudi Arabia and the entire Middle East.
Monica Bellucci https://dracula.monica-bellucci-ar.com one of the most famous Italian actresses of our time, has a distinguished artistic career spanning many decades. Her talent, charisma, and stunning beauty made her an icon of world cinema.
[u][b] Привет![/b][/u]
[b]Заказать диплом любого университета.[/b]
[url=http://sea.2bb.ru/viewtopic.php?id=2036#p3979/]sea.2bb.ru/viewtopic.php?id=2036#p3979[/url]
[b]Успешной учебы![/b]
click site [url=https://Trader-joe.homes/]trader joe[/url]
Taobao – известная торговая интернет-платформа. Здесь приобрести можете самое необходимое. Мы предлагаем вам удобный способ избавиться от утомительных походов по магазинам. Ищете интернет магазин таобао? Grandior.ru – портал, где имеется большой выбор товаров. Гарантируем доступные цены. Предусмотрены и скидки. Теперь вы знаете, какой секрет популярности у Таобао ком. Удовлетворим запросы даже самых взыскательных клиентов. Сайт Taobao на русском языке «Грандиор.ру» – станет вашим лучшим помощником в совершении покупок товаров.
Stumbled upon a captivating article – definitely take a look! https://privatebin.net/?3aad1312556971b4#5VD83SMiQVarHdvHAw8PDpsCaF7217pKpwc7GgcmxShx
[u][b] Привет![/b][/u]
[b]Удивительно, но купить диплом кандидата наук оказалось не так сложно.[/b]
[b]Купить диплом университета.[/b]
[url=http://medbereg.ru/club/user/15/blog/4145//]medbereg.ru/club/user/15/blog/4145/[/url]
[u][b] Здравствуйте![/b][/u]
Купить диплом любого ВУЗа
Мы предлагаем документы ВУЗов, расположенных в любом регионе России. Вы имеете возможность приобрести диплом от любого заведения, за любой год, в том числе документы старого образца. Дипломы и аттестаты выпускаются на “правильной” бумаге высшего качества. Это позволяет делать государственные дипломы, не отличимые от оригинала. Документы заверяются всеми требуемыми печатями и подписями.
[url=http://ekonty.com/blogs/view/58699]ekonty.com/blogs/view/58699[/url]
Рады оказать помощь!.
Then https://steamdesktopauthenticator.me/ will wait for an SMS message from steam. what are steam guard look like? even if they will have your password, they won’t will log in into the system.
Здравствуйте!
Купить диплом о высшем образовании
[url=http://landik-diploms-srednee.ru/attestat-shkoly В ]landik-diploms-srednee.ru/attestat-shkoly В [/url]
Успешной учебы!
https://telegra.ph/Nadezhnye-marshrutizatory-ot-Cisco-dlya-setevyh-reshenij-07-20-4
На сайте https://prodrag.ru/ позвоните для того, чтобы узнать нюансы о скупке радиодеталей. Предприятие специализируется на закупках электронного лома, а также различных радиодеталей. Есть возможность сдать электронную технику, которая уже непригодна для дальнейшего использования, нерабочие детали, различную технику. При необходимости вам дадут профессиональную консультацию. Специалисты в ближайшее время ответят на все интересующие вопросы. В компании работают только лучшие сотрудники, которые отлично понимают в подобных вопросах.
[u][b] Привет![/b][/u]
[b]Как получить диплом техникума с упрощенным обучением в Москве официально [/b]
[url=http://almet.listbb.ru/viewtopic.php?f=12&t=412/]almet.listbb.ru/viewtopic.php?f=12&t=412[/url]
[u][b] Всегда вам поможем![u][b].
[u][b] Здравствуйте![/b][/u]
[b]Мы готовы предложить документы техникумов[/b], расположенных в любом регионе РФ. Вы имеете возможность купить диплом от любого учебного заведения, за любой год, указав подходящую специальность и оценки за все дисциплины. Дипломы и аттестаты печатаются на “правильной” бумаге самого высшего качества. Это позволяет делать настоящие дипломы, не отличимые от оригиналов. Документы будут заверены всеми необходимыми печатями и подписями.
[url=http://online-casino-australia.mn.co/posts/61838230/]online-casino-australia.mn.co/posts/61838230[/url]
[u][b] Привет, друзья![/b][/u]
Приобрести диплом ВУЗа
[b]Мы предлагаем[/b] быстро и выгодно заказать диплом, который выполняется на бланке ГОЗНАКа и заверен мокрыми печатями, штампами, подписями официальных лиц. Наш документ пройдет лубую проверку, даже при использовании специальных приборов. Достигайте свои цели быстро и просто с нашим сервисом.
[b]Где приобрести диплом специалиста?[/b]
[url=http://rucollectshoeclub.com/read-blog/1892/]rucollectshoeclub.com/read-blog/1892[/url]
[url=http://www.liobio.com/blogs/1588/Рекомендации-по-приобретению-документа-в-сети-интернет/]www.liobio.com/blogs/1588/Рекомендации-по-приобретению-документа-в-сети-интернет[/url]
[url=http://wiuwi.com/blogs/124918/Официальные-Дипломы-Доступно-и-Удобно/]wiuwi.com/blogs/124918/Официальные-Дипломы-Доступно-и-Удобно[/url]
[url=http://meco.eeconme.com/read-blog/3642/]meco.eeconme.com/read-blog/3642[/url]
[url=http://faithstreamer.com/blogs/3130/Вы-хотите-узнать-как-купить-документы-в-сети-недорого-Заходите/]faithstreamer.com/blogs/3130/Вы-хотите-узнать-как-купить-документы-в-сети-недорого-Заходите[/url]
отремонтировать ноутбук
Wow, awesome weblog format! How lengthy have you been blogging for?
you make blogging glance easy. The entire look of your site is fantastic, as neatly as the content material!
https://telegra.ph/Otkrojte-dlya-sebya-vozmozhnosti-FPGA-dlya-vysokoproizvoditelnyh-vychislenij-07-20-4
Как правильно купить диплом колледжа и пту в России, подводные камни
[url=http://ast-diploms24.ru/kupit-diplom-voronezh/]ast-diploms24.ru/kupit-diplom-voronezh[/url]
[u][b] Привет, друзья![/b][/u]
Заказать документ ВУЗа вы можете у нас в Москве. Мы предлагаем документы об окончании любых ВУЗов РФ. Вы сможете получить диплом по любой специальности, любого года выпуска, в том числе документы образца СССР.
[url=http://sovetushka.forum2x2.ru/t28888-topic#63660/]sovetushka.forum2x2.ru/t28888-topic#63660[/url]
[url=http://sankt-peterburg.forum2x2.ru/t20657-topic#77529/]sankt-peterburg.forum2x2.ru/t20657-topic#77529[/url]
[url=http://forum.qwas.ru/uskorenniy-process-polucheniya-diploma-t20155.html/]forum.qwas.ru/uskorenniy-process-polucheniya-diploma-t20155.html[/url]
[url=http://roseninsel.kz/forum/topic/add/forum7//]roseninsel.kz/forum/topic/add/forum7/[/url]
[url=http://kozhuhovo.forum2x2.ru/t6416-topic#13340/]kozhuhovo.forum2x2.ru/t6416-topic#13340[/url]
[u][b] Привет![/b][/u]
[b]Мы предлагаем дипломы[/b] любой профессии по доступным тарифам.
[url=http://avtoweek2016.ru/legalnoe-priobretenie-diploma-onlayn//]avtoweek2016.ru/legalnoe-priobretenie-diploma-onlayn/[/url]
Discovered an article that might catch your interest Р don’t miss it! https://www.creativelive.com/student/dean-bulli?via=accounts-freeform_2
domstroi.info
newsplaces.net
visit [url=https://localbitcoinsalternative.com/]localbitcoins alternatives[/url]
[u][b] Здравствуйте![/b][/u]
Где приобрести диплом специалиста?
[b]Приобрести диплом любого ВУЗа.[/b]
[url=http://k90280ul.beget.tech/2024/07/04/shirokiy-katalog-dokumentov-v-populyarnom-onlayn-magazine.html/]k90280ul.beget.tech/2024/07/04/shirokiy-katalog-dokumentov-v-populyarnom-onlayn-magazine.html[/url]
[u][b] Здравствуйте![/b][/u]
[b]Мы предлагаем приобрести диплом[/b] в отличном качестве, неотличимый от оригинального документа без участия специалиста высокой квалификации со специальным оборудованием.
[url=http://moy-toy.ru/index.php?subaction=userinfo&user=exotegave/]moy-toy.ru/index.php?subaction=userinfo&user=exotegave[/url]
[b]Успехов в учебе![/b]
[u][b] Добрый день![/b][/u]
Заказать документ о получении высшего образования вы имеете возможность у нас в Москве. Мы оказываем услуги по продаже документов об окончании любых университетов Российской Федерации.
[url=http://fire-team.ru/forum/showthread.php?p=36155#post36155/]fire-team.ru/forum/showthread.php?p=36155#post36155[/url]
[url=http://golpro.jp/userinfo.php?uid=13510#/]golpro.jp/userinfo.php?uid=13510#[/url]
[url=http://tsmtech.co.kr/bbs/board.php?bo_table=free&wr_id=556613/]tsmtech.co.kr/bbs/board.php?bo_table=free&wr_id=556613[/url]
[url=http://mtw2014.tmweb.ru/forum/?PAGE_NAME=message&FID=1&TID=9271&TITLE_SEO=9271-diplomandoci&MID=353538&result=new#message353538/]mtw2014.tmweb.ru/forum/?PAGE_NAME=message&FID=1&TID=9271&TITLE_SEO=9271-diplomandoci&MID=353538&result=new#message353538[/url]
[url=http://littleyaksa.yodev.net/bbs/board.php?bo_table=free&wr_id=6404141/]littleyaksa.yodev.net/bbs/board.php?bo_table=free&wr_id=6404141[/url]
[u][b] Привет![/b][/u]
[b]Заказать документ[/b] института вы имеете возможность в нашей компании в столице.
[url=http://diplomasx.com/kupit-diplom-magistra/]diplomasx.com/kupit-diplom-magistra[/url]
[b]Успешной учебы![/b]
[u][b] Добрый день![/b][/u]
Где приобрести диплом по нужной специальности?
Мы готовы предложить документы институтов, которые находятся в любом регионе России. Вы имеете возможность приобрести диплом от любого заведения, за любой год, в том числе документы старого образца. Дипломы печатаются на “правильной” бумаге высшего качества. Это дает возможности делать государственные дипломы, не отличимые от оригиналов. Они заверяются необходимыми печатями и штампами.
[b]Мы предлагаем дипломы[/b] любой профессии по разумным тарифам.
[url=http://ast-diplomy.com/kupit-diplom-o-srednem-obrazovanii]ast-diplomy.com/kupit-diplom-o-srednem-obrazovanii[/url]
[u][b] Окажем помощь![u][b]
Jude Bellingham https://real-madrid.jude-bellingham-ar.com a young and talented English footballer, has enjoyed great success with Real Madrid since his arrival.
Jackie Chan https://karate-kid.jackiechan-ar.com was born in 1954 in Hong Kong under the name Chan Kong San.
ремонт электроники спецтехники
[u][b] Здравствуйте![/b][/u]
[b]Приобрести документ[/b] о получении высшего образования можно у нас в Москве.
[url=http://ast-diplomy.com/kupit-diplom-magistra/]ast-diplomy.com/kupit-diplom-magistra[/url]
[u][b] Добрый день![/b][/u]
Приобрести документ о получении высшего образования вы сможете у нас в Москве. Мы предлагаем документы об окончании любых ВУЗов РФ. Вы сможете получить необходимый диплом по любой специальности, любого года выпуска, в том числе документы СССР. Гарантируем, что при проверке документов работодателем, подозрений не возникнет.
[b]Мы можем предложить дипломы[/b] любой профессии по приятным тарифам. Стоимость может зависеть от определенной специальности, года получения и ВУЗа. Стараемся поддерживать для покупателей адекватную ценовую политику. Для нас важно, чтобы документы были доступны для подавляющей массы граждан.
[url=http://qiqaecydybo.almoheet-travel.com/kak-vozmozno-bystro-priobresti-diplom-v-internet-magazine/]qiqaecydybo.almoheet-travel.com/kak-vozmozno-bystro-priobresti-diplom-v-internet-magazine[/url]
[b]Окажем помощь![/b]
The challenge of reducing vibration in a high-speed spindle was met with the application of the Balanset-1A from Vibromera, significantly enhancing performance and reliability. Dive into the technicalities and benefits at Vibromera’s online platform https://vibromera.eu/example/troubleshooting-the-balancing-process-of-combine-harvesters/
[u][b] Привет![/b][/u]
[b]Купить диплом любого ВУЗа.[/b]
[url=http://linux.listbb.ru/viewtopic.php?f=2&t=484/]linux.listbb.ru/viewtopic.php?f=2&t=484[/url]
[u][b] Здравствуйте![/b][/u]
[b]Можно ли купить аттестат о среднем образовании? Основные рекомендации [/b]
[url=http://nc750.ru/member.php?u=2812/]nc750.ru/member.php?u=2812[/url]
[u][b] Рады помочь![u][b].
There are lots of fishing-connected slot games about at the moment buut this is one partiicular of the very best.
my web page … Find More info
[u][b] Привет![/b][/u]
Где приобрести диплом по актуальной специальности?
[url=http://newfinbiz.ru/vash-diplom-bez-lishnih-zabot-byistro-i-bezopasno/]newfinbiz.ru/vash-diplom-bez-lishnih-zabot-byistro-i-bezopasno[/url]
[b]Успехов в учебе![/b]
Добрый день!
Приобрести диплом университета
[url=http://arusak-diploms-srednee.ru/kupit-diplom-kandidata-nauk В ]arusak-diploms-srednee.ru/kupit-diplom-kandidata-nauk В [/url]
Успехов в учебе!
[u][b] Привет![/b][/u]
[b]Мы можем предложить документы техникумов[/b], которые расположены на территории всей Российской Федерации. Вы сможете купить качественно напечатанный диплом от любого учебного заведения, за любой год, в том числе документы старого образца СССР. Документы выпускаются на бумаге высшего качества. Это дает возможность делать настоящие дипломы, которые невозможно отличить от оригинала. Они заверяются всеми требуемыми печатями и штампами.
[url=http://fidelize.site/blogs/96/%D0%9A%D0%B0%D0%BA-%D0%BC%D0%BE%D0%B6%D0%BD%D0%BE-%D0%B1%D1%83%D0%B4%D0%B5%D1%82-%D0%B1%D1%8B%D1%81%D1%82%D1%80%D0%BE-%D0%B7%D0%B0%D0%BA%D0%B0%D0%B7%D0%B0%D1%82%D1%8C-%D0%B0%D1%82%D1%82%D0%B5%D1%81%D1%82%D0%B0%D1%82-%D0%B2-%D0%B8%D0%BD%D1%82%D0%B5%D1%80%D0%BD%D0%B5%D1%82-%D0%BC%D0%B0%D0%B3%D0%B0%D0%B7%D0%B8%D0%BD%D0%B5/]fidelize.site/blogs/96/%D0%9A%D0%B0%D0%BA-%D0%BC%D0%BE%D0%B6%D0%BD%D0%BE-%D0%B1%D1%83%D0%B4%D0%B5%D1%82-%D0%B1%D1%8B%D1%81%D1%82%D1%80%D0%BE-%D0%B7%D0%B0%D0%BA%D0%B0%D0%B7%D0%B0%D1%82%D1%8C-%D0%B0%D1%82%D1%82%D0%B5%D1%81%D1%82%D0%B0%D1%82-%D0%B2-%D0%B8%D0%BD%D1%82%D0%B5%D1%80%D0%BD%D0%B5%D1%82-%D0%BC%D0%B0%D0%B3%D0%B0%D0%B7%D0%B8%D0%BD%D0%B5[/url]
politeconomics.org
купить диплом горного инженера [url=https://ast-diploms.com/]ast-diploms.com[/url] .
Starting to take stock, we can say with ukrtvoru.info complete confidence that, indeed, both absolute and relative height will play an important role in geography.
ремонт компьютеров
купить диплом в орле [url=https://diplomasx.com/]diplomasx.com[/url] .
[url=https://t.me/noticias_deSaoLuis]noticias[/url]
noticias
noticias
Внеплановая оценка условий труда
Процесс СОУТ включает основные этапы. Сначала проводится подготовка и сбор необходимой документации, затем специалисты проводят оценку рабочих мест и выявляют риски. На финальном этапе подготавливается отчет, который содержит рекомендации по улучшению условий труда. [url=https://safetysystemsgroup.com/sout3]Порядок СОУТ[/url] не только способствует соблюдению законодательства, а также увеличивает доверие сотрудников к работодателю.
[u][b] Добрый день![/b][/u]
Приобрести документ о получении высшего образования можно у нас. Мы оказываем услуги по продаже документов об окончании любых университетов России. Вы получите диплом по любой специальности, включая документы образца СССР.
[url=http://define.listbb.ru/posting.php?mode=post&f=46&sid=0e3990ee87561f834b03b5d7abdf5f74/]define.listbb.ru/posting.php?mode=post&f=46&sid=0e3990ee87561f834b03b5d7abdf5f74[/url]
[url=http://fotomaniya.getbb.ru/ucp.php?mode=login&sid=6c7e2a6a489f8962dfaecc32dc9b5adf/]fotomaniya.getbb.ru/ucp.php?mode=login&sid=6c7e2a6a489f8962dfaecc32dc9b5adf[/url]
[url=http://itstagram.ru/read-blog/851/]itstagram.ru/read-blog/851[/url]
[url=http://brawlstarsacc.listbb.ru/posting.php?mode=post&f=3&sid=3e2af884450e2299cdd220efa742453d/]brawlstarsacc.listbb.ru/posting.php?mode=post&f=3&sid=3e2af884450e2299cdd220efa742453d[/url]
[url=http://www.nitrnd.com/blogs/161356/РІРѕРїСЂРѕСЃРѕРІ/]www.nitrnd.com/blogs/161356/РІРѕРїСЂРѕСЃРѕРІ[/url]
click to find out more [url=https://my-jaxxwallet.com/]jaxx io[/url]
Addressing imbalance in wind turbine blades, the precision of Vibromera’s Balanset-1A played a key role, contributing to energy efficiency and longevity. Find out more about their innovative approach on Vibromera’s website https://vibromera.eu/example/mulcher-rotor-balancing-process/
[url=https://t.me/s/noticias_deGuarulhos]noticias[/url]
noticias
noticias
купить свидетельство о разводе [url=https://mandiplomik.ru/]mandiplomik.ru[/url] .
Психологическая помощь в Москве: поддержка и решения проблем
В нашем мире многие сталкиваются с эмоциональными и психологическими проблемами, требующими профессиональной помощи. Сайт psyhologirinakurazh.ru предлагает услуги профессионального психолога в Москве, который поможет справиться с жизненными трудностями и улучшить качество жизни.
Консультации психолога в Москве для всех
Если вам нужен [url=https://psyhologirinakurazh.ru/]психолог москва консультации[/url] , наши специалисты готовы предложить индивидуальные и семейные консультации. Мы осознаем, что каждая проблема уникальна, и поэтому подходим к каждому клиенту с вниманием и заботой. Наши психологи помогут вам разобраться в сложных вопросах, восстановить гармонию в отношениях и преодолеть внутренние конфликты.
Доступные цены и высокий профессионализм
Мы предлагаем услуги [url=https://psyhologirinakurazh.ru/]база психологов москвы[/url] , чтобы профессиональная помощь была доступна всем. В нашем кабинете психолога в Москве вы найдете комфортную и доверительную атмосферу, способствующую откровенным беседам. Консультации проводятся в удобное для вас время, и вы можете быть уверены в полной конфиденциальности.
Отзывы клиентов и наше признание
Наш труд высоко оценивается клиентами, что подтверждается многочисленными положительными отзывами. Мы стремимся, чтобы каждый, кто обратился к нам, почувствовал значительные улучшения в своей жизни. Посетите наш сайт psyhologirinakurazh.ru, чтобы узнать больше о наших услугах и записаться на консультацию. Доверьтесь профессионалам и начните свой путь к душевному равновесию уже сегодня.
купить диплом о высшем образовании в улан удэ [url=www.diploms-x.com/]www.diploms-x.com/[/url] .
На сайте https://stapeli1.ru получите данные о том, какие стапели лучше всего подобрать для того, чтобы выполнить кузовной ремонт. Вы ознакомитесь с типами стапелей, особенностями, преимуществами. Есть информация о платформенных стапелях. Вы узнаете о достоинствах использования таких конструкций в ремонте. Имеется информация и о том, как правильно подобрать конструкцию, чтобы она прослужила как можно дольше и обрадовала своими эксплуатационными свойствами. Рассматриваются параметры, которые помогут подобрать устройство высокого качества.
baddies west new episode release date award-winning movies 2023owl house season 3 finalemovies with sequels listkilling eve killer episodes
купить диплом мгуу [url=https://asxdiplomik24.ru/]asxdiplomik24.ru[/url] .
[u][b] Привет![/b][/u]
[b]Как приобрести диплом о среднем образовании в Москве и других городах [/b]
[url=http://kerchlibrary.ru/index.php?subaction=userinfo&user=ykada/]kerchlibrary.ru/index.php?subaction=userinfo&user=ykada[/url]
[u][b] Всегда вам поможем![u][b].
[u][b] Добрый день![/b][/u]
[b]Заказать документ[/b] о получении высшего образования можно у нас в столице.
[url=http://ast-diplomas.com/kupit-diplom-magistra/]ast-diplomas.com/kupit-diplom-magistra[/url]
[b]Успешной учебы![/b]
[u][b] Привет![/b][/u]
Где купить диплом специалиста?
[b]Заказать диплом о высшем образовании.[/b]
[url=http://samovod.ru/content/articles/65961//]samovod.ru/content/articles/65961/[/url]
Скачать торрент https://webtorrent.pro/ со всеми свежими фильмами со всего мира в один клик в отличном качестве без регистрации у нас на сайте. Любые жанры, любые годы, в том числе новинки 2024 – все готово к скачиванию. Легкий поиск, подборки по жанрам, лучшие фильмы, сериалы, мультфильмы в огромном количестве.
Привет, друзья!
Приобрести диплом о высшем образовании
[url=http://landik-diploms-srednee.ru/kupit-diplom-volgograd В ]landik-diploms-srednee.ru/kupit-diplom-volgograd В [/url]
Удачи!
[u][b] Добрый день![/b][/u]
[b]Мы предлагаем дипломы[/b] любых профессий по приятным ценам.
[url=http://autogroupe.ru/poluchite-diplom-bez-lishnih-usiliy/]autogroupe.ru/poluchite-diplom-bez-lishnih-usiliy[/url]
[u][b] Добрый день![/b][/u]
[b]Официальная покупка диплома ВУЗа с упрощенной программой обучения [/b]
[url=http://mastercode.ru/forum/?PAGE_NAME=profile_view&UID=4752/]mastercode.ru/forum/?PAGE_NAME=profile_view&UID=4752[/url]
[u][b] Рады оказать помощь![u][b].
[u][b] Привет![/b][/u]
[b]Мы можем предложить документы техникумов[/b], расположенных в любом регионе Российской Федерации. Вы сможете купить диплом за любой год, указав актуальную специальность и оценки за все дисциплины. Дипломы и аттестаты выпускаются на “правильной” бумаге самого высокого качества. Это позволяет делать настоящие дипломы, которые не отличить от оригинала. Они будут заверены всеми требуемыми печатями и штампами.
[url=http://inopl.com/blogs/1149/%D0%9F%D0%BE%D0%BA%D1%83%D0%BF%D0%B0%D0%B5%D0%BC-%D0%B4%D0%BE%D0%BA%D1%83%D0%BC%D0%B5%D0%BD%D1%82%D1%8B-%D0%B2-%D0%BB%D1%83%D1%87%D1%88%D0%B5%D0%BC-%D0%B8%D0%BD%D1%82%D0%B5%D1%80%D0%BD%D0%B5%D1%82-%D0%BC%D0%B0%D0%B3%D0%B0%D0%B7%D0%B8%D0%BD%D0%B5-%D0%BF%D0%BE-%D0%B2%D1%8B%D0%B3%D0%BE%D0%B4%D0%BD%D0%BE%D0%B9-%D1%81%D1%82%D0%BE%D0%B8%D0%BC%D0%BE%D1%81%D1%82%D0%B8/]inopl.com/blogs/1149/%D0%9F%D0%BE%D0%BA%D1%83%D0%BF%D0%B0%D0%B5%D0%BC-%D0%B4%D0%BE%D0%BA%D1%83%D0%BC%D0%B5%D0%BD%D1%82%D1%8B-%D0%B2-%D0%BB%D1%83%D1%87%D1%88%D0%B5%D0%BC-%D0%B8%D0%BD%D1%82%D0%B5%D1%80%D0%BD%D0%B5%D1%82-%D0%BC%D0%B0%D0%B3%D0%B0%D0%B7%D0%B8%D0%BD%D0%B5-%D0%BF%D0%BE-%D0%B2%D1%8B%D0%B3%D0%BE%D0%B4%D0%BD%D0%BE%D0%B9-%D1%81%D1%82%D0%BE%D0%B8%D0%BC%D0%BE%D1%81%D1%82%D0%B8[/url]
[u][b] Привет![/b][/u]
[b]Заказать диплом ВУЗа.[/b]
[url=http://californiarpn2.listbb.ru/viewtopic.php?f=1&t=464/]californiarpn2.listbb.ru/viewtopic.php?f=1&t=464[/url]
[b]Успешной учебы![/b]
pervenec.com
[u][b] Здравствуйте![/b][/u]
Заказать диплом ВУЗа
[b]Наша компания предлагает[/b] выгодно и быстро приобрести диплом, который выполняется на оригинальной бумаге и заверен печатями, штампами, подписями. Наш диплом способен пройти любые проверки, даже при использовании специфических приборов. Достигайте своих целей быстро и просто с нашим сервисом.
[b]Где приобрести диплом по необходимой специальности?[/b]
[url=http://www.simplemachines.org/about/smf/stats.php/]www.simplemachines.org/about/smf/stats.php[/url]
[url=http://kurgetrp.listbb.ru/viewtopic.php?f=11&t=380/]kurgetrp.listbb.ru/viewtopic.php?f=11&t=380[/url]
[url=http://volnodumie.bbmy.ru/viewtopic.php?id=12332#p25047/]volnodumie.bbmy.ru/viewtopic.php?id=12332#p25047[/url]
[url=http://macadamlab.ru/wiki/index.php?title=пїЅпїЅпїЅпїЅпїЅпїЅ_пїЅпїЅпїЅпїЅпїЅпїЅ/]macadamlab.ru/wiki/index.php?title=пїЅпїЅпїЅпїЅпїЅпїЅ_пїЅпїЅпїЅпїЅпїЅпїЅ[/url]
[url=http://deviva.ru/viewtopic.php?id=8878#p61753/]deviva.ru/viewtopic.php?id=8878#p61753[/url]
If you think through naoni.info every detail, you can achieve effective results. Improving reputation – new clients are happy to contact such companies.
[u][b] Здравствуйте![/b][/u]
[b]Купить документ[/b] университета можно у нас.
[url=http://asxdiplomik.com/kupit-diplom-omsk/]asxdiplomik.com/kupit-diplom-omsk[/url]
Канал проекта casino VAVADA рад видеть вас у себя! Здесь вы найдете исключительно свежую информацию. Забудьте о повседневных заботах и проведите время за увлекательными слотами в высококачественном онлайн-казино Вавада! Вас ждет особая атмосфера и отличная графика. Ищете vavada
ru? t.me/mvavada – здесь мы делимся с вами своими знаниями и секретами успеха. Казино VAVADA всем без исключения подходит. Вы точно оцените бонусы и скорость выводов. Саппорт старается любые вопросы решать довольно быстро. Играйте прямо сейчас. Больших вам выигрышей!
бэушный щебень россыпью
[u][b] Добрый день![/b][/u]
[b]Приобрести документ[/b] института можно у нас в столице.
[url=http://ast-diploms24.ru/kupit-diplom-vracha/]ast-diploms24.ru/kupit-diplom-vracha[/url]
[b]Успехов в учебе![/b]
[url=https://sova-gg.com]Сова гг обменник[/url] – Sova gg обмен, Сова гг
Защитите свою конфиденциальность с резидентским прокси, советуем этим инструментом.
Как работают резидентские прокси?, ознакомьтесь с подробностями.
Какой резидентский прокси выбрать?, инструкция для пользователей.
Зачем нужны резидентские прокси?, узнайте возможностями.
Как резидентские прокси обеспечивают безопасность?, обзор функций безопасности.
Защита от каких угроз обеспечивает резидентский прокси?, рассмотрим важные аспекты.
Зачем нужны резидентские прокси и какой их выигрыш?, сравним основные плюсы.
Как улучшить скорость Интернета с резидентским прокси, рекомендации для оптимизации работы.
Каким образом ускорить процесс парсинга с помощью резидентского прокси, анализ возможностей для парсеров.
Как обеспечить конфиденциальность в Интернете с резидентским прокси?, шаги к безопасности онлайн.
Как расширить свои возможности в соцсетях с резидентским прокси?, практические советы функционала.
Как сэкономить время с помощью аренды резидентского прокси?, рассмотрим лучшие варианты.
Способы защиты от DDoS с помощью резидентского прокси, подробно изучим меры безопасности.
Почему резидентские прокси пользуются популярностью, рассмотрим основные факторы.
Какие прокси лучше: резидентские или дата-центры?, подсказки для выбора.
купить резидентские прокси листы [url=https://rezidentnieproksi.ru/]https://rezidentnieproksi.ru/[/url] .
порно с тренером по йоге [url=www.yoga-porno.ru]порно с тренером по йоге[/url] .
Обеспечьте конфиденциальность с резидентскими прокси, прибегнуть к этим инструментом.
В чем особенность резидентских прокси?, узнайте подробностями.
Как выбрать лучший резидентский прокси, советы для пользователей.
Для каких целей используют резидентские прокси?, подробнее ознакомьтесь с возможностями.
Почему резидентские прокси безопасны?, обзор функций безопасности.
Какие риски может предотвратить резидентский прокси?, разберем важные аспекты.
Зачем нужны резидентские прокси и какой их выигрыш?, сравним основные плюсы.
Как быстрее работать в сети с резидентским прокси?, практические советы для оптимизации работы.
Каким образом ускорить процесс парсинга с помощью резидентского прокси, анализ возможностей для парсеров.
Как оставаться анонимным в Интернете с резидентским прокси, рекомендации к безопасности онлайн.
Как расширить свои возможности в соцсетях с резидентским прокси?, практические советы функционала.
Какие преимущества дает аренда резидентских прокси, проанализируем лучшие варианты.
Способы защиты от DDoS с помощью резидентского прокси, подробно изучим меры безопасности.
Почему резидентские прокси пользуются популярностью, подробно изучим основные факторы.
Сравнение резидентских и дата-центровых прокси, советы для выбора.
аренда резидентских прокси [url=https://rezidentnieproksi.ru/]https://rezidentnieproksi.ru/[/url] .
нужны услуги https://xn--80aackwvjedrz4c.xn--p1acf/krasnodar/domrabotnitsa-v-zagorodnyj-dom/ домработницы людей? Помогатель.
порно видео бесплатно в хорошем качестве [url=www.best-free-porno.ru/]порно видео бесплатно в хорошем качестве[/url] .
I’m gone to convey my little brother, that he should also visit
this webpage on regular basis to get updated from hottest news.
[u][b] Привет![/b][/u]
Где приобрести диплом специалиста?
[b]Заказать диплом любого ВУЗа.[/b]
[url=http://lada-clubs.ru/gallery/image/733-kak-podobrat-proverennyy-magazin-s-bolshim-vyborom-diplomov//]lada-clubs.ru/gallery/image/733-kak-podobrat-proverennyy-magazin-s-bolshim-vyborom-diplomov/[/url]
[u][b] Добрый день![/b][/u]
[b]Как оказалось, купить диплом кандидата наук не так уж и сложно [/b]
[url=http://school97.ru/vesti/view_profile.php?UID=210363/]school97.ru/vesti/view_profile.php?UID=210363[/url]
[u][b] Поможем вам всегда![u][b].
Wow, incredible blog layout! How long have you
ever been blogging for? you make running a blog glance easy.
The entire look of your web site is magnificent, let alone the content material!
Привет, друзья!
Купить диплом ВУЗа
[url=http://landik-diploms-srednee.ru/kupit-diplom-v-kazani В ]landik-diploms-srednee.ru/kupit-diplom-v-kazani В [/url]
Удачи!
Психологическая помощь в Москве: поддержка и решения проблем
Сегодня многие люди сталкиваются с эмоциональными и психологическими трудностями, которые нуждаются в профессиональной поддержке. На сайте psyhologirinakurazh.ru вы найдете услуги квалифицированного психолога в Москве, который поможет вам справиться с различными жизненными ситуациями и улучшить качество жизни.
Консультации психолога в Москве для всех
Если вы ищете [url=https://psyhologirinakurazh.ru/]семейный психолог в москве[/url] , наши профессионалы готовы предложить вам индивидуальные и семейные консультации. Мы осознаем, что каждая проблема уникальна, и поэтому подходим к каждому клиенту с вниманием и заботой. Наши психологи помогут вам разобраться в сложных вопросах, восстановить гармонию в отношениях и преодолеть внутренние конфликты.
Доступные цены и высокий профессионализм
Мы предоставляем [url=https://psyhologirinakurazh.ru/]психолог москва недорого[/url] , чтобы профессиональная помощь была доступна каждому. В кабинете психолога в Москве вас ждет комфортная и доверительная атмосфера, способствующая откровенным беседам. Консультации проводятся в удобное для вас время, и вы можете быть уверены в абсолютной конфиденциальности.
Отзывы клиентов и наше признание
Наша работа высоко оценивается клиентами, что подтверждается многочисленными положительными отзывами. Мы стремимся, чтобы каждый, кто обратился к нам, почувствовал значительные улучшения в своей жизни. Зайдите на сайт psyhologirinakurazh.ru, чтобы узнать больше о наших услугах и записаться на консультацию. Доверьтесь нашим профессионалам и начните свой путь к душевному равновесию уже сегодня.
[u][b] Здравствуйте![/b][/u]
Заказать документ о получении высшего образования можно в нашей компании. Мы предлагаем документы об окончании любых университетов Российской Федерации. Вы получите необходимый диплом по любой специальности, включая документы старого образца.
[url=http://tawasol1.mn.co/posts/62241886/]tawasol1.mn.co/posts/62241886[/url]
[url=http://darknews.ru/oformlenie-diplomov-s-garantiey-kachestva/]darknews.ru/oformlenie-diplomov-s-garantiey-kachestva[/url]
[url=http://www.hristianka.ru/forum/r/prev_loaded/1//]www.hristianka.ru/forum/r/prev_loaded/1/[/url]
[url=http://grp.7olimp.ru/memberlist.php?mode=viewprofile&u=68&sid=a47dd82411e288ee69f770ba462ec800/]grp.7olimp.ru/memberlist.php?mode=viewprofile&u=68&sid=a47dd82411e288ee69f770ba462ec800[/url]
[url=http://comedyforme.ru/vash-diplom-bez-truda-i-usiliy/]comedyforme.ru/vash-diplom-bez-truda-i-usiliy[/url]
Проведение специальной оценки условий труда СОУТ
Гарантия безопасности на рабочем месте — это не только выполнение нормативов, но и внимание к здоровью и комфорту персонала. [url=https://safetysystemsgroup.com/sout3]Специальная оценка соответствия условий труда[/url] позволяет выявить и устранить потенциальные угрозы, что снижает уровень травматизма и увеличивает производительность. Доверьтесь Safety Systems Group, чтобы создать безопасные условия для своих сотрудников и улучшить атмосферу в коллективе.
[u][b] Привет, друзья![/b][/u]
Заказать диплом о высшем образовании
Мы можем предложить документы техникумов, которые находятся на территории всей России. Вы можете заказать качественно напечатанный диплом от любого учебного заведения, за любой год, указав подходящую специальность и хорошие оценки за все дисциплины. Документы печатаются на “правильной” бумаге самого высокого качества. Это позволяет делать настоящие дипломы, которые не отличить от оригиналов. Они заверяются необходимыми печатями и штампами.
[url=http://kryza.network/read-blog/11426191]kryza.network/read-blog/11426191[/url]
Рады помочь!.
Jushev
[u][b] Добрый день![/b][/u]
Заказать документ института можно в нашем сервисе. Мы предлагаем документы об окончании любых университетов России. Вы получите диплом по любым специальностям, включая документы старого образца. Гарантируем, что в случае проверки документов работодателем, подозрений не возникнет.
[url=http://g95334gq.beget.tech/2024/07/10/vash-bystryy-put-k-novomu-diplomu.html/]g95334gq.beget.tech/2024/07/10/vash-bystryy-put-k-novomu-diplomu.html[/url]
[url=http://electricsheep.activeboard.com/forum.spark/]electricsheep.activeboard.com/forum.spark[/url]
[url=http://galantclub.od.ua/member.php?u=15983/]galantclub.od.ua/member.php?u=15983[/url]
[url=http://ob2qvj3m9.ssnblog.com/27859999/Прочитайте-наш-материал-если-требуется-купить-диплом-в-интернете/]ob2qvj3m9.ssnblog.com/27859999/Прочитайте-наш-материал-если-требуется-купить-диплом-в-интернете[/url]
[url=http://samanalevi.com.tr/read-blog/64/]samanalevi.com.tr/read-blog/64[/url]
[u][b] Здравствуйте![/b][/u]
[b]Мы предлагаем документы ВУЗов[/b], которые расположены в любом регионе Российской Федерации. Вы сможете купить качественно напечатанный диплом от любого учебного заведения, за любой год, включая документы СССР. Дипломы и аттестаты выпускаются на “правильной” бумаге самого высокого качества. Это дает возможности делать настоящие дипломы, которые не отличить от оригиналов. Документы заверяются всеми необходимыми печатями и подписями.
[url=http://x8nlp84dt.develop-blog.com/34408498/%D0%9B%D0%B5%D0%B3%D0%BA%D0%BE-%D0%BF%D1%80%D0%B8%D0%BE%D0%B1%D1%80%D0%B5%D1%82%D0%B0%D0%B5%D0%BC-%D0%B4%D0%B8%D0%BF%D0%BB%D0%BE%D0%BC-%D0%B2-%D0%B8%D0%B7%D0%B2%D0%B5%D1%81%D1%82%D0%BD%D0%BE%D0%BC-%D0%BE%D0%BD%D0%BB%D0%B0%D0%B9%D0%BD-%D0%BC%D0%B0%D0%B3%D0%B0%D0%B7%D0%B8%D0%BD%D0%B5-russian-diplom/]x8nlp84dt.develop-blog.com/34408498/%D0%9B%D0%B5%D0%B3%D0%BA%D0%BE-%D0%BF%D1%80%D0%B8%D0%BE%D0%B1%D1%80%D0%B5%D1%82%D0%B0%D0%B5%D0%BC-%D0%B4%D0%B8%D0%BF%D0%BB%D0%BE%D0%BC-%D0%B2-%D0%B8%D0%B7%D0%B2%D0%B5%D1%81%D1%82%D0%BD%D0%BE%D0%BC-%D0%BE%D0%BD%D0%BB%D0%B0%D0%B9%D0%BD-%D0%BC%D0%B0%D0%B3%D0%B0%D0%B7%D0%B8%D0%BD%D0%B5-russian-diplom[/url]
[u][b] Привет![/b][/u]
Где заказать диплом специалиста?
[b]Заказать диплом университета.[/b]
[url=http://gadjetforyou.ru/diplom-za-dengi-byistro-nadezhno-bezopasno/]gadjetforyou.ru/diplom-za-dengi-byistro-nadezhno-bezopasno[/url]
[u][b] Привет, друзья![/b][/u]
Купить документ ВУЗа вы сможете в нашей компании в Москве. Мы оказываем услуги по изготовлению и продаже документов об окончании любых ВУЗов Российской Федерации. Вы получите диплом по любой специальности, любого года выпуска, в том числе документы Советского Союза.
[url=http://cromia.ua/forum/user/5968//]cromia.ua/forum/user/5968/[/url]
[url=http://kids-news.ru/diplom-pod-klyuch-kachestvenno-i-bezopasno/]kids-news.ru/diplom-pod-klyuch-kachestvenno-i-bezopasno[/url]
[url=http://bintarotrojan.com/blogs/9909/Ваш-диплом-для-карьерного-роста-доступно-каждому/]bintarotrojan.com/blogs/9909/Ваш-диплом-для-карьерного-роста-доступно-каждому[/url]
[url=http://karkadan.ru/users/77829/]karkadan.ru/users/77829[/url]
[url=http://humped.life/read-blog/608/]humped.life/read-blog/608[/url]
Обеспечьте конфиденциальность с резидентскими прокси, использовать этим инструментом.
В чем особенность резидентских прокси?, узнайте подробностями.
Советы по выбору резидентского прокси, советы для пользователей.
Зачем нужны резидентские прокси?, узнайте возможностями.
Почему резидентские прокси безопасны?, анализ функций безопасности.
Защита от каких угроз обеспечивает резидентский прокси?, разберем важные аспекты.
Зачем нужны резидентские прокси и какой их выигрыш?, сравним основные плюсы.
Секреты увеличения скорости с резидентским прокси, советы для оптимизации работы.
Почему резидентский прокси стоит использовать для парсинга, обзор возможностей для парсеров.
Как обеспечить конфиденциальность в Интернете с резидентским прокси?, шаги к безопасности онлайн.
Как расширить свои возможности в соцсетях с резидентским прокси?, практические советы функционала.
Как сэкономить время с помощью аренды резидентского прокси?, рассмотрим лучшие варианты.
Как использовать резидентские прокси для защиты от DDoS-атак, анализируем меры безопасности.
В чем причина популярности резидентских прокси?, подробно изучим основные факторы.
Сравнение резидентских и дата-центровых прокси, подсказки для выбора.
где взять резидентский прокси [url=https://rezidentnieproksi.ru/]https://rezidentnieproksi.ru/[/url] .
My partner and I absolutely love your blog and find
a lot of your post’s to be precisely what I’m looking for.
Does one offer guest writers to write content to suit your needs?
I wouldn’t mind publishing a post or elaborating on a few of the subjects
you write related to here. Again, awesome blog!
[u][b] Здравствуйте![/b][/u]
Купить диплом о высшем образовании
[url=http://www.dizalty.com/read-blog/67606]www.dizalty.com/read-blog/67606[/url]
Yuycuw
[u][b] Добрый день![/b][/u]
[b]Купить документ[/b] о получении высшего образования вы можете у нас в столице.
[url=http://diploms-x.com/kupit-diplom-moskva/]diploms-x.com/kupit-diplom-moskva[/url]
[url=https://sova-gg.com/]Sova gg обменник[/url] – Sova gg, Sova gg обменник
самое лучшее порево [url=www.besplatny-sex-online.ru]www.besplatny-sex-online.ru[/url] .
[u][b] Здравствуйте![/b][/u]
[b]Мы предлагаем купить диплом[/b] отличного качества, неотличимый от оригинала без использования специального оборудования и опытного специалиста.
[url=http://stavklad.ru/viewtopic.php?f=19&t=5129/]stavklad.ru/viewtopic.php?f=19&t=5129[/url]
[b]Удачи![/b]
[u][b] Привет, друзья![/b][/u]
Купить документ о получении высшего образования можно в нашей компании. Мы оказываем услуги по производству и продаже документов об окончании любых университетов Российской Федерации.
[url=http://payhotel.ru/forum/messages/forum2/topic7566/message7822/?result=reply#message7822/]payhotel.ru/forum/messages/forum2/topic7566/message7822/?result=reply#message7822[/url]
[url=http://globalimport.spb.ru/forum/thread1075.html#1095/]globalimport.spb.ru/forum/thread1075.html#1095[/url]
[url=http://glavnoe24.ru/topics/16298/?unapproved=500&moderation-hash=89e7d75d3da1f9f9d8213789b1013dd3#comment-500/]glavnoe24.ru/topics/16298/?unapproved=500&moderation-hash=89e7d75d3da1f9f9d8213789b1013dd3#comment-500[/url]
[url=http://cmsthemefinder.com/userinfo.php?uid=35775#/]cmsthemefinder.com/userinfo.php?uid=35775#[/url]
[url=http://sborkakuhni.com/users/axybyhy/]sborkakuhni.com/users/axybyhy[/url]
[u][b] Привет![/b][/u]
Где заказать диплом специалиста?
Мы предлагаем документы ВУЗов, расположенных на территории всей Российской Федерации. Можно заказать качественный диплом за любой год, указав подходящую специальность и оценки за все дисциплины. Дипломы печатаются на бумаге высшего качества. Это дает возможности делать государственные дипломы, не отличимые от оригиналов. Документы заверяются необходимыми печатями и штампами.
[b]Мы предлагаем дипломы[/b] любой профессии по приятным тарифам.
[url=http://ast-diploms.com/kupit-diplom-sankt-peterburg]ast-diploms.com/kupit-diplom-sankt-peterburg[/url]
[u][b] Поможем вам всегда![u][b]
Охраняйте свою конфиденциальность с резидентскими прокси, преимущества.
Обходите географические блокировки с резидентскими прокси, неограниченным контентом.
Получите быстрый и надежный интернет с резидентскими прокси, как это работает.
Обезопасьте свои онлайн-платежи с резидентскими прокси, и будьте уверены в своей безопасности.
Сделайте свои онлайн-активности невидимыми благодаря резидентским прокси, и наслаждайтесь анонимностью.
Используйте резидентские прокси для безопасного серфинга в интернете, и не тревожьтесь за свою приватность.
прокси резидентные [url=https://rezidentnie-proksi.ru/]https://rezidentnie-proksi.ru/[/url] .
[u][b] Привет, друзья![/b][/u]
[b]Приобрести документ[/b] института можно в нашем сервисе.
[url=http://asxdiplomik.com/kupit-diplom-magistra/]asxdiplomik.com/kupit-diplom-magistra[/url]
[b]Удачи![/b]
Охраняйте свою конфиденциальность с резидентскими прокси, как это работает.
Смотрите зарубежные сериалы с резидентскими прокси, полномасштабным контентом.
Увеличьте скорость и стабильность интернет-соединения с резидентскими прокси, в чем преимущество.
Скройте свой реальный IP-адрес от хакеров с резидентскими прокси, и чувствуйте себя спокойно.
Сделайте свои онлайн-активности невидимыми благодаря резидентским прокси, и наслаждайтесь анонимностью.
Скачивайте файлы анонимно через резидентские прокси, и не тревожьтесь за свою приватность.
где взять резидентский прокси [url=https://rezidentnie-proksi.ru/]https://rezidentnie-proksi.ru/[/url] .
[u][b] Добрый день![/b][/u]
Где приобрести диплом специалиста?
[b]Купить диплом любого ВУЗа.[/b]
[url=http://www.operazionispeciali.it/cb-profile/pluginclass/cbblogs.html?action=blogs&func=show&id=251/]www.operazionispeciali.it/cb-profile/pluginclass/cbblogs.html?action=blogs&func=show&id=251[/url]
все так само успіх в обміні валют, на пряму безпосередньо залежить від того місця, http://getrejoin.com/ua/question/coinsbar-optimalnyy-vybor-dlya-obmena-kriptovalyuty-na-nalichnye-1678233.html де легко купити валюту.
[u][b] Привет![/b][/u]
[b]Мы предлагаем[/b] быстро и выгодно купить диплом, который выполняется на оригинальном бланке и заверен печатями, водяными знаками, подписями. Наш документ пройдет лубую проверку, даже с использованием профессионального оборудования. Достигайте цели быстро с нашим сервисом.
[url=http://remontmix.ru/forum/viewtopic.php?t=11607#p36760/]remontmix.ru/forum/viewtopic.php?t=11607#p36760[/url]
[b]Хорошей учебы![/b]
Можно ли купить аттестат о среднем образовании? Основные рекомендации
[url=http://ast-diplomy24.ru/kupit-diplom-voronezh/]ast-diplomy24.ru/kupit-diplom-voronezh[/url]
[u][b] Добрый день![/b][/u]
Купить документ о получении высшего образования вы сможете у нас. Мы оказываем услуги по изготовлению и продаже документов об окончании любых ВУЗов РФ. Вы сможете получить необходимый диплом по любым специальностям, любого года выпуска, в том числе документы образца СССР.
[url=http://the-trifecta-network.mn.co/posts/62172190/]the-trifecta-network.mn.co/posts/62172190[/url]
[url=http://generalarminius.com/viewtopic.php?t=155979/]generalarminius.com/viewtopic.php?t=155979[/url]
[url=http://school8kaluga.flybb.ru/viewtopic.php?f=19&t=500/]school8kaluga.flybb.ru/viewtopic.php?f=19&t=500[/url]
[url=http://www.4x4zubry.by/forum/topic/add/forum1/#postform/]www.4x4zubry.by/forum/topic/add/forum1/#postform[/url]
[url=http://little-witch.ru/forum99.html/]little-witch.ru/forum99.html[/url]
They allow people to better everbestnews.com understand geographical objects, which should be paid special attention to. Also, you should definitely take into account the fact that they are often used when it is customary to work with topographic maps, or in the process of studying mountain systems. This also includes route planning, and so on.
Yotgom
Добрый день!
Быстрая схема покупки диплома старого образца: что важно знать?
[url=http://landik-diploms-srednee.ru/diplom-s-reestromkupit-kupit В ]landik-diploms-srednee.ru/diplom-s-reestromkupit-kupit В [/url]
[u][b] Здравствуйте![/b][/u]
[b]Приобрести диплом ВУЗа.[/b]
[url=http://famenest.com/read-blog/8160/]famenest.com/read-blog/8160[/url]
Сайт vips13un.kinoportal.live рад приветствовать вас! Здесь вы найдете большую коллекцию интересных фильмов. Вас точно порадует качество видео. На странице можете увидеть страну, жанр, год выхода фильма и его длительность. Новинки постоянно добавляем. У нас вы точно найдете что посмотреть. Ищете фильмы онлайн бесплатно качество новинки? Vips13un.kinoportal.live – ресурс, который организован на все 100%. Здесь есть поисковик и плеер. Вы обязательно найдете что-то для себя. Пару кликов и вы сможете посмотреть качественный фильм. KinoPortal ждет именно вас!
[u][b] Добрый день![/b][/u]
[b]Покупка диплома о среднем полном образовании: как избежать мошенничества? [/b]
[url=http://v69-3.flybb.ru/viewtopic.php?f=8&t=584/]v69-3.flybb.ru/viewtopic.php?f=8&t=584[/url]
[u][b] Рады оказаться полезными![u][b].
Безопасность данных с резидентскими прокси, как это работает.
Обходите географические блокировки с резидентскими прокси, неограниченным контентом.
Оптимизируйте работу сети благодаря резидентским прокси, в чем преимущество.
Защитите свои учетные данные и личную информацию с резидентскими прокси, и будьте уверены в своей безопасности.
Защитите свою личную жизнь и данные с резидентскими прокси, и оставайтесь незамеченными.
Используйте резидентские прокси для безопасного серфинга в интернете, и не бойтесь за свою приватность.
индивидуальные резидентские прокси [url=https://rezidentnie-proksi.ru/]https://rezidentnie-proksi.ru/[/url] .
[u][b] Привет![/b][/u]
[b]Купить документ[/b] университета вы имеете возможность в нашем сервисе.
[url=http://diplomyx24.ru/kupit-diplom-o-srednem-obrazovanii/]diplomyx24.ru/kupit-diplom-o-srednem-obrazovanii[/url]
Stumbled upon a captivating article – definitely take a look! https://pushkinska.net/raznoe/servis-taksi-571-dostupne-rishennya-dlya-poyizdok/
Думаете, что знаете все о том, как ответить на “Купи слона”? Проверьте свои знания на https://teletype.in/@golosai/kupi-slona-kak-otvetit. Возможно, вы откроете для себя новые, неожиданные способы ответа, которые удивят даже самых опытных “слоновых” игроков.
[u][b] Здравствуйте![/b][/u]
[b]Мы готовы предложить документы ВУЗов[/b], которые расположены на территории всей РФ. Вы сможете приобрести качественный диплом за любой год, включая сюда документы старого образца СССР. Дипломы и аттестаты выпускаются на “правильной” бумаге высшего качества. Это дает возможность делать государственные дипломы, которые невозможно отличить от оригинала. Они будут заверены необходимыми печатями и подписями.
[url=http://familylevel.com/blogs/168/%D0%9F%D0%BE%D0%B4%D1%80%D0%BE%D0%B1%D0%BD%D0%BE%D0%B5-%D0%BE%D0%BF%D0%B8%D1%81%D0%B0%D0%BD%D0%B8%D0%B5-%D0%B7%D0%B0%D0%BA%D0%B0%D0%B7%D0%B0-%D0%B4%D0%BE%D0%BA%D1%83%D0%BC%D0%B5%D0%BD%D1%82%D0%BE%D0%B2-%D0%B2-%D0%BF%D0%BE%D0%BF%D1%83%D0%BB%D1%8F%D1%80%D0%BD%D0%BE%D0%BC-%D0%BE%D0%BD%D0%BB%D0%B0%D0%B9%D0%BD-%D0%BC%D0%B0%D0%B3%D0%B0%D0%B7%D0%B8%D0%BD%D0%B5/]familylevel.com/blogs/168/%D0%9F%D0%BE%D0%B4%D1%80%D0%BE%D0%B1%D0%BD%D0%BE%D0%B5-%D0%BE%D0%BF%D0%B8%D1%81%D0%B0%D0%BD%D0%B8%D0%B5-%D0%B7%D0%B0%D0%BA%D0%B0%D0%B7%D0%B0-%D0%B4%D0%BE%D0%BA%D1%83%D0%BC%D0%B5%D0%BD%D1%82%D0%BE%D0%B2-%D0%B2-%D0%BF%D0%BE%D0%BF%D1%83%D0%BB%D1%8F%D1%80%D0%BD%D0%BE%D0%BC-%D0%BE%D0%BD%D0%BB%D0%B0%D0%B9%D0%BD-%D0%BC%D0%B0%D0%B3%D0%B0%D0%B7%D0%B8%D0%BD%D0%B5[/url]
[u][b] Привет![/b][/u]
[b]Заказать документ[/b] о получении высшего образования можно у нас.
[url=http://diplomyx.com/kupit-diplom-voronezh/]diplomyx.com/kupit-diplom-voronezh[/url]
[b]Хорошей учебы![/b]
[u][b] Добрый день![/b][/u]
[b]Где заказать диплом специалиста?[/b]
Мы изготавливаем дипломы любых профессий по приятным ценам. Стоимость может зависеть от выбранной специальности, года получения и образовательного учреждения. Всегда стараемся поддерживать для покупателей адекватную политику тарифов. Для нас очень важно, чтобы документы были доступными для подавляющей массы наших граждан.
[b]Для вас готовы предложить дипломы[/b] психологов, юристов, экономистов и прочих профессий по разумным ценам.
[url=http://bbs.heyshell.com/forum.php?mod=viewthread&tid=28283]bbs.heyshell.com/forum.php?mod=viewthread&tid=28283[/url]
[u][b] Всегда вам поможем![u][b].
раковина чаша
Хотите быть уверенными в своем переводчике даже в зоне без связи? Посетите https://teletype.in/@golosai/kakoi-perevodchik-rabotaet-bez-interneta и выберите лучший оффлайн-переводчик для ваших нужд. Путешествуйте и общайтесь без ограничений!
Travis Scott https://astroworld.travis-scott-ar.com is one of the brightest stars in the modern hip-hop industry.
The history of one of France’s https://france.paris-saint-germain-ar.com most famous football clubs, Paris Saint-Germain, began in 1970, when capitalist businessmen Henri Delaunay and Jean-Auguste Delbave founded the club in the Paris Saint-Germain-en-Laye area.
Chelsea https://england.chelsea-ar.com is one of the most successful English football clubs of our time.
Juventus Football Club https://italy.juventus-ar.com is one of the most successful and decorated clubs in the history of Italian and world football.
где купить диплом с занесением [url=https://ast-diploms.com/]ast-diploms.com[/url] .
диплом азбуку прочел купить [url=https://diplomasx.com/]diplomasx.com[/url] .
адрес где купить диплом [url=www.diploms-x.com]www.diploms-x.com[/url] .
Привет!
Полезные советы по безопасной покупке диплома о высшем образовании
[url=http://landik-diploms-srednee.ru/kupit-diplom-v-voronezhe ]landik-diploms-srednee.ru/kupit-diplom-v-voronezhe [/url]
На сайте https://stendy-razvalshozhdenia.ru вы изучите всю важную и ценную информацию о том, как правильно подобрать стенд развал-схождение, который используется в автосервисе. Вы узнаете о том, что вообще представляет собой такое устройство и чем оно примечательно. Рассматриваются виды стендов, а также нюансы оптических стендов. Дается информация о компьютерных стендах. Вы будете в курсе того, какие особенности есть у 3D стендов. Возможно, вам будут нужны инфракрасные стенды. Даны важные советы и рекомендации о том, как правильно подобрать качественное оборудование.
[u][b] Здравствуйте![/b][/u]
[b]Как безопасно купить диплом колледжа или ВУЗа в России, что важно знать [/b]
[url=http://wecanchat.mn.co/posts/62049695/]wecanchat.mn.co/posts/62049695[/url]
Рады оказать помощь!
раковина встраиваемая
[u][b] Привет, друзья![/b][/u]
[b]Мы готовы предложить дипломы[/b] любой профессии по приятным ценам.
[url=http://www.cyber-lynk.com/blog/2024/06/30/купить-диплом-онлайн//]www.cyber-lynk.com/blog/2024/06/30/купить-диплом-онлайн/[/url]
site web https://my-jaxxwallet.io/
You actually stated this well.
my blog post … https://squishmallowswiki.com/index.php/Heading_To_Centre_National_D_art_Et_De_Culture_Georges-Pompidou:_Locating_A_Exhibition_Consisting_Of_Current_Day_Along_With_Topical_Works_Of_Art
[u][b] Добрый день![/b][/u]
Приобрести документ о получении высшего образования вы сможете в нашей компании. Мы предлагаем документы об окончании любых ВУЗов Российской Федерации. Вы сможете получить диплом по любым специальностям, любого года выпуска, в том числе документы старого образца.
[url=http://human.forumieren.de/t306-topic#374/]human.forumieren.de/t306-topic#374[/url]
[url=http://www.vetreriameliante.it/index.php/kforum/jm-slideshow-module/9832-img-ht#9832/]www.vetreriameliante.it/index.php/kforum/jm-slideshow-module/9832-img-ht#9832[/url]
[url=http://israelafrica.mn.co/posts/62321047/]israelafrica.mn.co/posts/62321047[/url]
[url=http://saumalkol.com/forum/разное-2/3592-легальный-диплом-без-лишних-хлопот-узнайте-как.html/]saumalkol.com/forum/разное-2/3592-легальный-диплом-без-лишних-хлопот-узнайте-как.html[/url]
[url=http://onlaintelevizia.listbb.ru/viewtopic.php?f=2&t=496/]onlaintelevizia.listbb.ru/viewtopic.php?f=2&t=496[/url]
navigate here [url=https://coinomiwallet.io]Download Coinomi[/url]
На сайте https://koleso-na-hodu.ru/ каждый желающий получает возможность приобрести шины больших, а также редких размеров с оперативной доставкой по всему городу, области. Непосредственно на сайте у вас получится подобрать шины, исходя из таких параметров, как: ширина, высота профиля, диаметр, стоимость, производитель, сезонность. Вся продукция сертифицированная, качественная, оригинальная. Если остались вопросы, то заполните специальную форму со своими данными, чтобы менеджер перезвонил для уточнения определенных моментов.
home https://myjaxxwallet.us
[u][b] Добрый день![/b][/u]
Где заказать диплом по необходимой специальности?
[url=http://чпуремонт.рф/showthread.php?tid=53674/]чпуремонт.рф/showthread.php?tid=53674[/url]
[b]Успешной учебы![/b]
1newss.com
First of all, it is worth biznesnewss.com noting that the problem generally arises as a result of certain reasons, and also in most cases due to the execution of the document. Thus, the user may notice how extra empty paragraphs and page breaks begin to appear. This cannot include other elements of formation.
[u][b] Привет, друзья![/b][/u]
[b]Приобрести диплом о высшем образовании.[/b]
[url=http://3arabotok.topbb.ru/post.php?fid=15/]3arabotok.topbb.ru/post.php?fid=15[/url]
[b]Удачи![/b]
купить дипломы о высшем [url=https://asxdiplomik24.ru/]купить дипломы о высшем[/url] .
Помните, что не все приложения совместимы с Яндекс ТВ. Перед установкой убедитесь, что выбранное приложение поддерживается вашей моделью устройства. Список совместимых приложений и информацию о совместимости можно найти на официальном сайте Яндекс или по ссылке: https://teletype.in/@golosai/kak-ustanovit-prilozhenie-na-iandeks-tv
[u][b] Привет, друзья![/b][/u]
[b]Официальная покупка диплома вуза с упрощенной программой обучения.[/b]
[b]Приобрести диплом о высшем образовании.[/b]
[url=http://uia79bshb.blogpostie.com/50523140/%D0%A1-%D0%BB%D0%B5%D0%B3%D0%BA%D0%BE%D1%81%D1%82%D1%8C%D1%8E-%D0%B7%D0%B0%D0%BA%D0%B0%D0%B7%D1%8B%D0%B2%D0%B0%D0%B5%D0%BC-%D0%B4%D0%B8%D0%BF%D0%BB%D0%BE%D0%BC-%D0%B2-%D0%B8%D0%B7%D0%B2%D0%B5%D1%81%D1%82%D0%BD%D0%BE%D0%BC-%D0%BC%D0%B0%D0%B3%D0%B0%D0%B7%D0%B8%D0%BD%D0%B5-russian-diplom/]uia79bshb.blogpostie.com/50523140/%D0%A1-%D0%BB%D0%B5%D0%B3%D0%BA%D0%BE%D1%81%D1%82%D1%8C%D1%8E-%D0%B7%D0%B0%D0%BA%D0%B0%D0%B7%D1%8B%D0%B2%D0%B0%D0%B5%D0%BC-%D0%B4%D0%B8%D0%BF%D0%BB%D0%BE%D0%BC-%D0%B2-%D0%B8%D0%B7%D0%B2%D0%B5%D1%81%D1%82%D0%BD%D0%BE%D0%BC-%D0%BC%D0%B0%D0%B3%D0%B0%D0%B7%D0%B8%D0%BD%D0%B5-russian-diplom[/url]
Всем привет! Может кто знает, где почитать полезные блоги о недвижимости? Сейчас читаю https://glatt-nsk.ru
[u][b] Привет![/b][/u]
[b]Приобрести документ[/b] института можно в нашем сервисе.
[url=http://diplomyx.com/kupit-diplom-vracha/]diplomyx.com/kupit-diplom-vracha[/url]
[u][b] Здравствуйте![/b][/u]
[b]Мы предлагаем документы ВУЗов[/b], которые находятся в любом регионе России. Вы можете приобрести диплом от любого учебного заведения, за любой год, включая документы СССР. Дипломы и аттестаты делаются на “правильной” бумаге самого высокого качества. Это дает возможность делать государственные дипломы, которые невозможно отличить от оригиналов. Документы заверяются всеми необходимыми печатями и подписями.
[url=http://f0npknzlq.win-blog.com/8155025/%D0%9A%D0%B0%D0%BA-%D0%B2%D0%BE%D0%B7%D0%BC%D0%BE%D0%B6%D0%BD%D0%BE-%D0%B1%D1%83%D0%B4%D0%B5%D1%82-%D0%BD%D0%B5%D0%B4%D0%BE%D1%80%D0%BE%D0%B3%D0%BE-%D0%BA%D1%83%D0%BF%D0%B8%D1%82%D1%8C-%D0%B0%D1%82%D1%82%D0%B5%D1%81%D1%82%D0%B0%D1%82-%D0%B2-%D0%B8%D0%BD%D1%82%D0%B5%D1%80%D0%BD%D0%B5%D1%82-%D0%BC%D0%B0%D0%B3%D0%B0%D0%B7%D0%B8%D0%BD%D0%B5/]f0npknzlq.win-blog.com/8155025/%D0%9A%D0%B0%D0%BA-%D0%B2%D0%BE%D0%B7%D0%BC%D0%BE%D0%B6%D0%BD%D0%BE-%D0%B1%D1%83%D0%B4%D0%B5%D1%82-%D0%BD%D0%B5%D0%B4%D0%BE%D1%80%D0%BE%D0%B3%D0%BE-%D0%BA%D1%83%D0%BF%D0%B8%D1%82%D1%8C-%D0%B0%D1%82%D1%82%D0%B5%D1%81%D1%82%D0%B0%D1%82-%D0%B2-%D0%B8%D0%BD%D1%82%D0%B5%D1%80%D0%BD%D0%B5%D1%82-%D0%BC%D0%B0%D0%B3%D0%B0%D0%B7%D0%B8%D0%BD%D0%B5[/url]
Ищете качественную мебель для офиса? Рекомендую обратить внимание на zamm. Этот бренд предлагает широкий ассортимент офисной мебели, включая стильные и функциональные офисные столы. Продукция замм отличается высоким качеством, долговечностью и современным дизайном. Идеально подходит для создания комфортного и продуктивного рабочего пространства. В ассортименте вы найдете всё, что нужно для организации современного офиса. Отличный выбор для тех, кто ценит надежность и стиль! С уважением, Zamm мебель.
Ищете качественную мебель для офиса? Рекомендую обратить внимание на zamm. Этот бренд предлагает широкий ассортимент офисной мебели, включая стильные и функциональные офисные столы. Продукция замм отличается высоким качеством, долговечностью и современным дизайном. Идеально подходит для создания комфортного и продуктивного рабочего пространства. В ассортименте вы найдете всё, что нужно для организации современного офиса. Отличный выбор для тех, кто ценит надежность и стиль! С уважением, Zamm мебель.
[u][b] Добрый день![/b][/u]
[b]Полезная информация как официально купить диплом о высшем образовании[/b]
[url=http://lucsa.id/Купить-Проверенный-Диплом//]lucsa.id/Купить-Проверенный-Диплом/[/url]
[u][b] Привет![/b][/u]
[b]Купить документ[/b] института вы имеете возможность в нашем сервисе.
[url=http://ast-diplomy.com/kupit-diplom-ekaterinbur/]ast-diplomy.com/kupit-diplom-ekaterinbur[/url]
[b]Удачи![/b]
tzona.org
Playing the Aviator Game involves a few simple steps:
ivermectin order
купить дипломы техникума москва [url=https://mandiplomik.ru/]mandiplomik.ru[/url] .
Автомобили Hongqi https://hongqi-krasnoyarsk.ru в наличии – официальный дилер Hongqi Красноярск
Liverpool https://england.liverpool-ar.com holds a special place in the history of football in England.
When Taylor Swift https://shake-it-off.taylor-swift-ar.com released “Shake It Off” in 2014, she had no idea how much the song would impact her life and music career.
Priyanka Chopra https://baywatch.priyankachopra-ar.com is an Indian actress, singer, film producer and model who has achieved global success.
[u][b] Здравствуйте![/b][/u]
[b]Мы изготавливаем дипломы[/b] любой профессии по приятным тарифам.
[url=http://www.irc71.ru/index.php/jomsocial/groups/viewbulletin/260-4-klyuchevykh-gruppy-onlajn-magazinov-chto-prodayut-diplomy?groupid=47/]www.irc71.ru/index.php/jomsocial/groups/viewbulletin/260-4-klyuchevykh-gruppy-onlajn-magazinov-chto-prodayut-diplomy?groupid=47[/url]
In addition to the obvious advantages in a decorative sense, there are other advantages stroynews.info
[u][b] Здравствуйте![/b][/u]
Приобрести документ о получении высшего образования вы можете в нашей компании. Мы предлагаем документы об окончании любых университетов России. Вы получите диплом по любой специальности, любого года выпуска, в том числе документы старого образца.
[url=http://www.testimonyforgod.com/read-blog/5652/]www.testimonyforgod.com/read-blog/5652[/url]
[url=http://www.nhps1914.com/wiki/Официальный_диплом_любой_профессии:_быстро_и_надежно/]www.nhps1914.com/wiki/Официальный_диплом_любой_профессии:_быстро_и_надежно[/url]
[url=http://onlinekinofun.ru/byistroe-poluchenie-diploma-kachestvenno-i-bezopasno/]onlinekinofun.ru/byistroe-poluchenie-diploma-kachestvenno-i-bezopasno[/url]
[url=http://allnewstroy.ru/ekspress-oformlenie-diplomov/]allnewstroy.ru/ekspress-oformlenie-diplomov[/url]
[url=http://argayash.flybb.ru/viewtopic.php?f=9&t=1159/]argayash.flybb.ru/viewtopic.php?f=9&t=1159[/url]
Добрый день!
Официальная покупка диплома вуза с сокращенной программой в Москве
[url=http://arusak-diploms-srednee.ru/svidetelstvo-o-brake ]arusak-diploms-srednee.ru/svidetelstvo-o-brake [/url]
Fantastic beat ! I wish to apprentice while you amend your website, how can i subscribe
for a blog web site? The account helped me a acceptable
deal. I had been a little bit acquainted of this your broadcast offered
bright clear idea
[url=https://tronlink.cash]tronlink wallet[/url] – activate tronlink account, tronlink pro
https://englishkostroma.com/
[u][b] Здравствуйте![/b][/u]
Приобрести диплом о высшем образовании
[b]Наши специалисты предлагают[/b] быстро и выгодно приобрести диплом, который выполнен на бланке ГОЗНАКа и заверен печатями, водяными знаками, подписями официальных лиц. Документ способен пройти лубую проверку, даже при помощи специального оборудования. Решайте свои задачи максимально быстро с нашими дипломами.
[b]Где купить диплом специалиста?[/b]
[url=http://meldog.3nx.ru/viewtopic.php?p=23387#23387/]meldog.3nx.ru/viewtopic.php?p=23387#23387[/url]
[url=http://kino.10bb.ru/viewtopic.php?id=163545#p276485/]kino.10bb.ru/viewtopic.php?id=163545#p276485[/url]
[url=http://astrcolcult.ru/?post_type=topic&p=34434/]astrcolcult.ru/?post_type=topic&p=34434[/url]
[url=http://forumjustwoman.getbb.ru/viewtopic.php?f=43&t=941/]forumjustwoman.getbb.ru/viewtopic.php?f=43&t=941[/url]
[url=http://meldog.3nx.ru/viewtopic.php?p=23387#23387/]meldog.3nx.ru/viewtopic.php?p=23387#23387[/url]
Yofnau
Ищете качественную мебель для офиса? Рекомендую обратить внимание на мебель для офиса замм. Этот бренд предлагает широкий ассортимент офисной мебели, включая стильные и функциональные офисные столы. Продукция zamm отличается высоким качеством, долговечностью и современным дизайном. Идеально подходит для создания комфортного и продуктивного рабочего пространства. В ассортименте вы найдете всё, что нужно для организации современного офиса. Отличный выбор для тех, кто ценит надежность и стиль! С уважением, Zamm мебель.
Jennifer Lopez https://lets-get-loud.jenniferlopez-ar.com was born in 1969 in the Bronx, New York, to parents who were Puerto Rican immigrants.
https://na-dengi.com/
the anticipation building as the plane climbs higher. The key is to cash out at the right moment before the
ivermectin where to buy
[u][b] Здравствуйте![/b][/u]
Где заказать диплом специалиста?
[b]Приобрести диплом о высшем образовании.[/b]
[url=http://2cool.ru/qiwi-f215/diplom-bez-uchebi-prostoy-put-k-uspehu-t3799.html/]2cool.ru/qiwi-f215/diplom-bez-uchebi-prostoy-put-k-uspehu-t3799.html[/url]
[u][b] Добрый день![/b][/u]
Заказать документ института вы сможете у нас в Москве. Мы предлагаем документы об окончании любых ВУЗов РФ. Вы сможете получить диплом по любым специальностям, любого года выпуска, включая документы старого образца.
[url=http://mamuli.club/forum/topic/24775//]mamuli.club/forum/topic/24775/[/url]
[url=http://mystroycenter.ru/diplom-za-dengi-byistro-nadezhno-bezopasno/]mystroycenter.ru/diplom-za-dengi-byistro-nadezhno-bezopasno[/url]
[url=http://www.politikforum.ru/member.php?u=13385920/]www.politikforum.ru/member.php?u=13385920[/url]
[url=http://scientistsufo.ru/ofitsialnyiy-diplom-lyuboy-professii-byistro-i-nadezhno/]scientistsufo.ru/ofitsialnyiy-diplom-lyuboy-professii-byistro-i-nadezhno[/url]
[url=http://turservisnews.ru/garantiya-polucheniya-diploma-byistro-i-nadezhno/]turservisnews.ru/garantiya-polucheniya-diploma-byistro-i-nadezhno[/url]
[u][b] Привет, друзья![/b][/u]
[b]Покупка диплома о среднем полном образовании: как избежать мошенничества? [/b]
[url=http://autogroupe.ru/kupite-diplom-i-otkroyte-novyie-gorizontyi/]autogroupe.ru/kupite-diplom-i-otkroyte-novyie-gorizontyi[/url]
Рады оказать помощь!
Cerebrolysin
2. «по телефону» – напишите номер мобильного, https://mostbet-azs.com выбрав страну по значку флажка и вариант валюты.
Виртуальные карточные и настольные игры также ждут своих поклонников. От блэкджека до покера – испытайте удачу и стратегию [url=https://total-rating.ru/2393-revizionnye-lyuki-skrytye-pod-plitkoy-sovremennye-resheniya-i-tendencii.html]https://total-rating.ru/2393-revizionnye-lyuki-skrytye-pod-plitkoy-sovremennye-resheniya-i-tendencii.html[/url]
[u][b] Добрый день![/b][/u]
[b]Как приобрести диплом техникума с минимальными рисками [/b]
[url=http://torrent-repack.club/index.php?subaction=userinfo&user=avypu/]torrent-repack.club/index.php?subaction=userinfo&user=avypu[/url]
[u][b] Окажем помощь![u][b].
[u][b] Привет![/b][/u]
Купить документ университета вы можете в нашей компании. Мы предлагаем документы об окончании любых университетов России. Вы получите необходимый диплом по любым специальностям, включая документы образца СССР. Даем гарантию, что в случае проверки документов работодателями, подозрений не появится.
[url=http://driveme.rusff.me/viewtopic.php?id=2167#p105223/]driveme.rusff.me/viewtopic.php?id=2167#p105223[/url]
[url=http://comedyforme.ru/vyisshee-obrazovanie-za-den-pokupka-diploma/]comedyforme.ru/vyisshee-obrazovanie-za-den-pokupka-diploma[/url]
[url=http://tyachiv.ukraine7.com/login/]tyachiv.ukraine7.com/login[/url]
[url=http://avtoweek2016.ru/vash-nastoyashhiy-diplom-legalno-i-konfidentsialno//]avtoweek2016.ru/vash-nastoyashhiy-diplom-legalno-i-konfidentsialno/[/url]
[url=http://www.con-tacto.vip/blogs/56/Читайте-наш-материал-если-надо-заказать-диплом-в-сети-интернет/]www.con-tacto.vip/blogs/56/Читайте-наш-материал-если-надо-заказать-диплом-в-сети-интернет[/url]
[u][b] Добрый день![/b][/u]
[b]Заказать документ[/b] университета можно в нашей компании.
[url=http://diplomasx.com/kupit-diplom-s-registraciej /]diplomasx.com/kupit-diplom-s-registraciej [/url]
I’m really inspired along with your writing abilities as smartly
as with the format for your weblog. Is that this a paid topic or did you customize it yourself?
Anyway keep up the nice high quality writing, it’s rare to peer a great weblog like this one
these days..
Ahaa, its fastidious dialogue regarding this paragraph at this place at this
website, I have read all that, so at this time me
also commenting at this place.
Однако, https://casinovovanreg.win все это равно быстрее если их сравнить со многими интернет казино.
enterprise car rental Montenegro https://montenegro-car-rental-hire.com
Compatibility with Devices
ivermectin buy online
[u][b] Привет![/b][/u]
[b]Заказать документ[/b] университета вы можете у нас в столице.
[url=http://ast-diplomy.com/kupit-diplom-rostov-na-donu/]ast-diplomy.com/kupit-diplom-rostov-na-donu[/url]
[b]Успехов в учебе![/b]
After some difficult years in the late 2010s, Manchester United https://england.manchester-united-ar.com returned to greatness in English football by 2024.
купить аттестат об окончании 9 классов [url=https://diploms-x.com/]diploms-x.com[/url] .
The Formula One World Championship https://world-circuit-racing-championship.formula-1-ar.com, known as the Formula Championship in motor racing, is the highest tier of professional motor racing.
Michael Jordan https://chicago-bulls.michael-jordan-ar.com is one of the greatest basketball players of all time, whose career with the Chicago Bulls is legendary.
[u][b] Привет![/b][/u]
[b]Мы можем предложить документы техникумов[/b], которые находятся в любом регионе России. Можно купить диплом за любой год, в том числе документы старого образца. Документы выпускаются на бумаге самого высокого качества. Это позволяет делать государственные дипломы, которые невозможно отличить от оригинала. Они заверяются всеми обязательными печатями и подписями.
[url=http://forum.thelostkeepers.ru/index.php?/gallery/image/495-%D0%B7%D0%B0%D0%BA%D0%B0%D0%B7%D1%8B%D0%B2%D0%B0%D0%B5%D0%BC-%D0%B4%D0%B8%D0%BF%D0%BB%D0%BE%D0%BC-%D0%B2-%D0%B8%D0%B7%D0%B2%D0%B5%D1%81%D1%82%D0%BD%D0%BE%D0%BC-%D0%BC%D0%B0%D0%B3%D0%B0%D0%B7%D0%B8%D0%BD%D0%B5-%D0%BF%D0%BE-%D0%BA%D0%BE%D0%BC%D1%84%D0%BE%D1%80%D1%82%D0%BD%D0%BE%D0%B9-%D1%86%D0%B5%D0%BD%D0%B5//]forum.thelostkeepers.ru/index.php?/gallery/image/495-%D0%B7%D0%B0%D0%BA%D0%B0%D0%B7%D1%8B%D0%B2%D0%B0%D0%B5%D0%BC-%D0%B4%D0%B8%D0%BF%D0%BB%D0%BE%D0%BC-%D0%B2-%D0%B8%D0%B7%D0%B2%D0%B5%D1%81%D1%82%D0%BD%D0%BE%D0%BC-%D0%BC%D0%B0%D0%B3%D0%B0%D0%B7%D0%B8%D0%BD%D0%B5-%D0%BF%D0%BE-%D0%BA%D0%BE%D0%BC%D1%84%D0%BE%D1%80%D1%82%D0%BD%D0%BE%D0%B9-%D1%86%D0%B5%D0%BD%D0%B5/[/url]
[u][b] Привет, друзья![/b][/u]
Мы предлагаем дипломы психологов, юристов, экономистов и других профессий.
[url=http://cittaviva.net/read-blog/51_proverennyj-magazin-s-obshirnym-vyborom-dokumentov.html]cittaviva.net/read-blog/51_proverennyj-magazin-s-obshirnym-vyborom-dokumentov.html[/url]
Поможем вам всегда!.
дизайн интерьера онлайн на русском https://dizayn-interera-doma.ru
[u][b] Привет![/b][/u]
Где заказать диплом специалиста?
[url=http://buro-alfa.ru/alfa/2022/04/22/zachem-neobhodimo-poluchenie-diploma-onlayn.html/]buro-alfa.ru/alfa/2022/04/22/zachem-neobhodimo-poluchenie-diploma-onlayn.html[/url]
срочно починить смартфон
классное порево [url=www.klassny-sex.ru]классное порево[/url] .
[u][b] Привет, друзья![/b][/u]
[b]Заказать диплом любого ВУЗа.[/b]
[url=http://operazionispeciali.it/cb-profile/pluginclass/cbblogs.html?action=blogs&func=show&id=251/]operazionispeciali.it/cb-profile/pluginclass/cbblogs.html?action=blogs&func=show&id=251[/url]
[u][b] Здравствуйте![/b][/u]
Приобрести документ университета.
[url=http://komfort.rusff.me/viewtopic.php?id=14026#p41275/]komfort.rusff.me/viewtopic.php?id=14026#p41275[/url]
[url=http://financetimenews.ru/vash-diplom-za-korotkoe-vremya-prosto-i-udobno//]financetimenews.ru/vash-diplom-za-korotkoe-vremya-prosto-i-udobno/[/url]
[url=http://sampnewrp.listbb.ru/viewtopic.php?f=18&t=526&sid=6fb2eb5d3164a33377d6c0f0379fb1b7/]sampnewrp.listbb.ru/viewtopic.php?f=18&t=526&sid=6fb2eb5d3164a33377d6c0f0379fb1b7[/url]
[url=http://mestovstrechi.flybb.ru/viewtopic.php?f=4&t=1288/]mestovstrechi.flybb.ru/viewtopic.php?f=4&t=1288[/url]
[url=http://dolgoprudni.rusff.me/viewtopic.php?id=2334#p5239/]dolgoprudni.rusff.me/viewtopic.php?id=2334#p5239[/url]
коллекция секса порно [url=www.porn-library.ru/]коллекция секса порно[/url] .
Если вам нужны профессионалы в области продвижения сайтов и разработки, обратите внимание на Михайлов Дмитрий. Они предлагают полный спектр услуг: от SEO и SEM до работы с Яндекс.Директ. Команда специализируется на создании эффективных стратегий, которые помогают привлечь целевую аудиторию и увеличить видимость вашего бизнеса в интернете. Их профессионализм и подход к каждому клиенту гарантируют отличные результаты. Рекомендую Михайлов Дмитрий как надежного партнера в цифровом маркетинге! С уважением, Mihaylov Digital.
Technical Specifications
where to buy ivermectin
Fovnuf
[u][b] Добрый день![/b][/u]
[b]Как купить аттестат 11 класса с официальным упрощенным обучением в Москве [/b]
[url=http://art-gymnastics.ru/users/54/]art-gymnastics.ru/users/54[/url]
Рады оказаться полезными!
отремонтировать телефон
[u][b] Здравствуйте![/b][/u]
Приобрести диплом о высшем образовании:
[url=http://simsonviglu.cz/phpBB/phpBB3/viewtopic.php?f=1&t=32867/]simsonviglu.cz/phpBB/phpBB3/viewtopic.php?f=1&t=32867[/url]
[url=http://web.symbol.rs/forum/member.php?action=profile&uid=667970/]web.symbol.rs/forum/member.php?action=profile&uid=667970[/url]
[url=http://udomlya.ru/userinfo.php?uid=110399/]udomlya.ru/userinfo.php?uid=110399[/url]
[url=http://rf-isolation.ru/index.php?/topic/726-event огненное-магическое-оружие-6-20к-gp/#comment-4486/]rf-isolation.ru/index.php?/topic/726-event огненное-магическое-оружие-6-20к-gp/#comment-4486[/url]
[url=http://mallangpeach.com/bbs/board.php?bo_table=free&wr_id=576841/]mallangpeach.com/bbs/board.php?bo_table=free&wr_id=576841[/url]
Как купить диплом о высшем образовании с минимальными рисками
[url=http://ast-diplomas.com/kupit-diplom-moskva/]ast-diplomas.com/kupit-diplom-moskva[/url]
https://vskrytie-avtomobilya.ru/
[b]Заказать диплом о высшем образовании.[/b]
[url=http://sharecovid19story.com/viewtopic.php?f=11&t=1258891&p=2635086#p2635086/]sharecovid19story.com/viewtopic.php?f=11&t=1258891&p=2635086#p2635086[/url]
[url=http://veneraroleplay.listbb.ru/viewtopic.php?f=4&t=312/]veneraroleplay.listbb.ru/viewtopic.php?f=4&t=312[/url]
[url=http://fire-team.ru/forum/member.php?u=1143/]fire-team.ru/forum/member.php?u=1143[/url]
[url=http://rashin.4adm.ru/posting.php?mode=post&f=27&sid=99ec13527c4a520aab4d17a31eb26c69/]rashin.4adm.ru/posting.php?mode=post&f=27&sid=99ec13527c4a520aab4d17a31eb26c69[/url]
[url=http://turservisnews.ru/byistroe-oformlenie-diplomov-nadezhno-i-legalno/]turservisnews.ru/byistroe-oformlenie-diplomov-nadezhno-i-legalno[/url]
[u][b] Привет, друзья![/b][/u]
Мы изготавливаем дипломы.
[url=http://asepbook.com/create-blog//]asepbook.com/create-blog/[/url]
[url=http://extra-v.store/forum/?PAGE_NAME=profile_view&UID=2661/]extra-v.store/forum/?PAGE_NAME=profile_view&UID=2661[/url]
[url=http://rcdrift.ru/forum/member.php?u=21074/]rcdrift.ru/forum/member.php?u=21074[/url]
[url=http://spletninews.ru/ofitsialnyie-diplomyi-garantiya-kachestva-i-podlinnosti/]spletninews.ru/ofitsialnyie-diplomyi-garantiya-kachestva-i-podlinnosti[/url]
[url=http://bezone.ru/node/339651/]bezone.ru/node/339651[/url]
Если вам нужны профессионалы в области продвижения сайтов и разработки, обратите внимание на Mihaylov Digital. Они предлагают полный спектр услуг: от SEO и SEM до работы с Яндекс.Директ. Команда специализируется на создании эффективных стратегий, которые помогают привлечь целевую аудиторию и увеличить видимость вашего бизнеса в интернете. Их профессионализм и подход к каждому клиенту гарантируют отличные результаты. Рекомендую Михайлов Дмитрий как надежного партнера в цифровом маркетинге! С уважением, Mihaylov Digital.
Наблюдение за соседями при входе в подъезд может помочь узнать код. Однако помните об этических аспектах такого метода. Часто код состоит из 4-5 цифр. Этические вопросы использования домофонов обсуждаются в статье https://teletype.in/@golosai/kak-uznat-kod-domofona-v-svoem-podieezde. Уважение к приватности других жильцов – важный аспект добрососедских отношений.
The golf https://arabic.golfclub-ar.com industry in the Arab world is growing rapidly, attracting players from all over the world.
Mike Tyson https://american-boxer.mike-tyson-ar.com one of the most famous and influential boxers in history, was born on June 30, 1966 in Brooklyn, New York.
Manny Pacquiao https://filipino-boxer.manny-pacquiao-ar.com is one of the most prominent boxers in the history of the sport.
Muhammad Ali https://american-boxer.muhammad-ali-ar.com is perhaps one of the most famous and greatest athletes in the history of boxing.
[u][b] Добрый день![/b][/u]
Заказать документ университета можно в нашем сервисе. Мы оказываем услуги по продаже документов об окончании любых ВУЗов Российской Федерации.
[url=http://rivertravel.net/viewtopic.php?f=21&t=8495/]rivertravel.net/viewtopic.php?f=21&t=8495[/url]
[url=http://coool-craft.4fan.cz/profile.php?lookup=10021/]coool-craft.4fan.cz/profile.php?lookup=10021[/url]
[url=http://prof-aksay.ru/forum/messages/forum2/topic235/message224//]prof-aksay.ru/forum/messages/forum2/topic235/message224/[/url]
[url=http://www.pharmvrn.ru/forum/profile.php?action=show&member=8892/]www.pharmvrn.ru/forum/profile.php?action=show&member=8892[/url]
[url=http://mineralgroup.ru/index.php?subaction=userinfo&user=uwecatus/]mineralgroup.ru/index.php?subaction=userinfo&user=uwecatus[/url]
cash-out perfectly.
cheap ivermectin
Encountered a unique article – be sure to take a look and see for yourself https://hackerone.com/daylingcrf19
[u][b] Добрый день![/b][/u]
[b]Приобретение школьного аттестата с официальным упрощенным обучением в Москве.[/b]
[b]Купить диплом о высшем образовании.[/b]
[url=http://alexsiudeptry.site/blogs/167/%D0%9A%D0%B0%D0%BA-%D0%B2%D0%BE%D0%B7%D0%BC%D0%BE%D0%B6%D0%BD%D0%BE-%D0%B1%D1%83%D0%B4%D0%B5%D1%82-%D0%BD%D0%B5%D0%B4%D0%BE%D1%80%D0%BE%D0%B3%D0%BE-%D0%B7%D0%B0%D0%BA%D0%B0%D0%B7%D0%B0%D1%82%D1%8C-%D0%B0%D1%82%D1%82%D0%B5%D1%81%D1%82%D0%B0%D1%82-%D0%B2-%D0%B8%D0%BD%D1%82%D0%B5%D1%80%D0%BD%D0%B5%D1%82-%D0%BC%D0%B0%D0%B3%D0%B0%D0%B7%D0%B8%D0%BD%D0%B5/]alexsiudeptry.site/blogs/167/%D0%9A%D0%B0%D0%BA-%D0%B2%D0%BE%D0%B7%D0%BC%D0%BE%D0%B6%D0%BD%D0%BE-%D0%B1%D1%83%D0%B4%D0%B5%D1%82-%D0%BD%D0%B5%D0%B4%D0%BE%D1%80%D0%BE%D0%B3%D0%BE-%D0%B7%D0%B0%D0%BA%D0%B0%D0%B7%D0%B0%D1%82%D1%8C-%D0%B0%D1%82%D1%82%D0%B5%D1%81%D1%82%D0%B0%D1%82-%D0%B2-%D0%B8%D0%BD%D1%82%D0%B5%D1%80%D0%BD%D0%B5%D1%82-%D0%BC%D0%B0%D0%B3%D0%B0%D0%B7%D0%B8%D0%BD%D0%B5[/url]
Veqiab
radioshem.net
financenewsasia.com
[u][b] Привет![/b][/u]
[b]Купить документ[/b] о получении высшего образования можно у нас.
[url=http://asxdiplomik.com/kupit-diplom-perm /]asxdiplomik.com/kupit-diplom-perm [/url]
[u][b] Привет![/b][/u]
Приобрести документ университета
[url=http://diploms-x.com/kupit-diplom-rostov-na-donu]diploms-x.com/kupit-diplom-rostov-na-donu[/url]
[b]Привет![/b]
Купить диплом о среднем полном образовании, в чем подвох и как избежать обмана?
[url=http://landik-diploms-srednee.ru/diplom-bakalavra В ]landik-diploms-srednee.ru/diplom-bakalavra В [/url]
[u][b] Привет, друзья![/b][/u]
[b]Мы предлагаем документы техникумов[/b], которые расположены в любом регионе Российской Федерации. Можно заказать качественно сделанный диплом от любого учебного заведения, за любой год, указав необходимую специальность и хорошие оценки за все дисциплины. Документы печатаются на бумаге высшего качества. Это дает возможности делать государственные дипломы, не отличимые от оригинала. Документы заверяются всеми необходимыми печатями и подписями.
[url=http://test.krestikom.net/gallery/image/580-%D0%B7%D0%B0%D0%BA%D0%B0%D0%B7%D1%8B%D0%B2%D0%B0%D0%B5%D0%BC-%D0%B4%D0%BE%D0%BA%D1%83%D0%BC%D0%B5%D0%BD%D1%82%D1%8B-%D0%B2-%D0%BB%D1%83%D1%87%D1%88%D0%B5%D0%BC-%D0%BE%D0%BD%D0%BB%D0%B0%D0%B9%D0%BD-%D0%BC%D0%B0%D0%B3%D0%B0%D0%B7%D0%B8%D0%BD%D0%B5-%D0%BF%D0%BE-%D0%BA%D0%BE%D0%BC%D1%84%D0%BE%D1%80%D1%82%D0%BD%D0%BE%D0%B9-%D1%86%D0%B5%D0%BD%D0%B5//]test.krestikom.net/gallery/image/580-%D0%B7%D0%B0%D0%BA%D0%B0%D0%B7%D1%8B%D0%B2%D0%B0%D0%B5%D0%BC-%D0%B4%D0%BE%D0%BA%D1%83%D0%BC%D0%B5%D0%BD%D1%82%D1%8B-%D0%B2-%D0%BB%D1%83%D1%87%D1%88%D0%B5%D0%BC-%D0%BE%D0%BD%D0%BB%D0%B0%D0%B9%D0%BD-%D0%BC%D0%B0%D0%B3%D0%B0%D0%B7%D0%B8%D0%BD%D0%B5-%D0%BF%D0%BE-%D0%BA%D0%BE%D0%BC%D1%84%D0%BE%D1%80%D1%82%D0%BD%D0%BE%D0%B9-%D1%86%D0%B5%D0%BD%D0%B5/[/url]
ремонт смартфонов
https://vskrytiye-zamkov24.ru/
[u][b] Привет![/b][/u]
Купить документ о получении высшего образования можно в нашей компании. Мы предлагаем документы об окончании любых ВУЗов Российской Федерации. Вы сможете получить диплом по любым специальностям, включая документы старого образца. Даем 100% гарантию, что при проверке документа работодателем, подозрений не появится.
[b]Мы изготавливаем дипломы[/b] любых профессий по приятным ценам. Цена зависит от определенной специальности, года получения и образовательного учреждения. Всегда стараемся поддерживать для клиентов адекватную политику цен. Для нас очень важно, чтобы документы были доступны для большого количества наших граждан.
[url=http://www.author-it.ru/content/руководство-пользователя-софтины/]www.author-it.ru/content/руководство-пользователя-софтины[/url]
[b]Рады помочь![/b]
[u][b] Привет![/b][/u]
[b]Приобрести документ[/b] ВУЗа вы сможете в нашей компании в столице.
[url=http://diploms-x.com/kupit-diplom-vracha/]diploms-x.com/kupit-diplom-vracha[/url]
[b]Успешной учебы![/b]
Fair Play Policies and RNG
where to buy ivermectin
[u][b] Здравствуйте![/b][/u]
[b]Приобрести диплом любого ВУЗа.[/b]
[url=http://www.musichunt.pro/blogs/view.htm?id=79366/]www.musichunt.pro/blogs/view.htm?id=79366[/url]
[b]Успешной учебы![/b]
купить медицинский диплом москва [url=https://mandiplomik.ru/]mandiplomik.ru[/url] .
Смотреть фильм https://hdrezka.host/ онлайн любого года выпуска, в том числе новинки 2024 года, в отличном качестве, без регистрации у нас на сайте. Подборки по всем жанрам, ТОПы фильмов за все годы, коллекции любых видов и жанров. Лучшие из выбора зрителей – вы найдете все для приятного времяпрепровождения.
отремонтировать смартфон
[u][b] Привет, друзья![/b][/u]
[b]Заказать диплом о высшем образовании.[/b]
[url=http://textualheritage.org/index.php?option=com_content&task=view&id=1067/]textualheritage.org/index.php?option=com_content&task=view&id=1067[/url]
[u][b] Добрый день![/b][/u]
[b]Приобрести диплом о высшем образовании.[/b]
[url=http://darkgate.pl/events/event/21-4-%D0%B5-%D0%BE%D1%81%D0%BD%D0%BE%D0%B2%D0%BD%D1%8B%D1%85-%D0%B3%D1%80%D1%83%D0%BF%D0%BF%D1%8B-%D0%BC%D0%B0%D0%B3%D0%B0%D0%B7%D0%B8%D0%BD%D0%BE%D0%B2-%D0%BA%D0%BE%D1%82%D0%BE%D1%80%D1%8B%D0%B5-%D1%80%D0%B5%D0%B0%D0%BB%D0%B8%D0%B7%D1%83%D1%8E%D1%82-%D0%B4%D0%BE%D0%BA%D1%83%D0%BC%D0%B5%D0%BD%D1%82%D1%8B//]darkgate.pl/events/event/21-4-%D0%B5-%D0%BE%D1%81%D0%BD%D0%BE%D0%B2%D0%BD%D1%8B%D1%85-%D0%B3%D1%80%D1%83%D0%BF%D0%BF%D1%8B-%D0%BC%D0%B0%D0%B3%D0%B0%D0%B7%D0%B8%D0%BD%D0%BE%D0%B2-%D0%BA%D0%BE%D1%82%D0%BE%D1%80%D1%8B%D0%B5-%D1%80%D0%B5%D0%B0%D0%BB%D0%B8%D0%B7%D1%83%D1%8E%D1%82-%D0%B4%D0%BE%D0%BA%D1%83%D0%BC%D0%B5%D0%BD%D1%82%D1%8B/[/url]
[u][b] Привет, друзья![/b][/u]
Приобрести документ о получении высшего образования.
[url=http://agrofly.ch/Получите_диплом_без_учебы/]agrofly.ch/Получите_диплом_без_учебы[/url]
[url=http://avtobestnews.ru/diplomyi-kotoryie-izmenyat-vashu-zhizn/]avtobestnews.ru/diplomyi-kotoryie-izmenyat-vashu-zhizn[/url]
[url=http://mediamemorial.ru/club/user/125807/forum/message/3847/13329/#message13329/]mediamemorial.ru/club/user/125807/forum/message/3847/13329/#message13329[/url]
[url=http://burgasdent.listbb.ru/viewtopic.php?f=3&t=393/]burgasdent.listbb.ru/viewtopic.php?f=3&t=393[/url]
[url=http://animalplanetnews.ru/vash-karernyiy-rost-nachinaetsya-s-diploma-poluchite-ego-byistro/]animalplanetnews.ru/vash-karernyiy-rost-nachinaetsya-s-diploma-poluchite-ego-byistro[/url]
I always spent my half an hour to read this weblog’s articles daily along with a mug of coffee.
Licensing and Regulation
ivermectin buy
[u][b] Привет, друзья![/b][/u]
[b]Покупка диплома о среднем полном образовании: как избежать мошенничества? [/b]
[url=http://androidinweb.ru/diplom-lyuboy-spetsialnosti-kachestvenno-i-bezopasno/]androidinweb.ru/diplom-lyuboy-spetsialnosti-kachestvenno-i-bezopasno[/url]
Окажем помощь!
симпл сет https://office-mebel-on-msk.ru/
На сайте https://diagnosticheskie-skanery.ru получите полную и исчерпывающую информацию, связанную с диагностическими автомобильными сканерами. Вы узнаете то, для чего они предназначены, как используются. Рассматриваются и виды диагностических сканеров. Имеются универсальные, автомобильные. Изучите подробную информацию о том, как правильно подобрать подобное оборудование, на что лучше полагаться. Также есть данные и о том, от чего зависит качество, расценки, представлены самые известные модели, которые точно заинтересуют.
С каждым годом растет количество людей, выбирающих этот вид досуга. Онлайн-платформы предлагают не только развлечение, но и шанс испытать удачу [url=http://www.tiendahinchables.com/blog/%D0%BB%D0%B5%D1%81%D1%81%D0%B8.html]http://www.tiendahinchables.com/blog/%D0%BB%D0%B5%D1%81%D1%81%D0%B8.html[/url]
В сериале “Фоллаут”, представленном на сайте https://fallout-tvseries.com/ мы видим расширение вселенной Fallout, где зрителю предлагается исследовать уникальный лабиринт коридоров и атриумов, а не строго разделенные этажи и уровни. Волт-Тек, корпорация, ответственная за уничтожение НКР, планирует восстановить цивилизацию и получить монополию над Америкой. Убежища, такие как Убежище 31, содержат криокапсулы с менеджерами Волт-Тек, которые будут управлять постъядерной Америкой. Сериал также демонстрирует обычных домашних курочек, переживших ядерную войну без изменений.
[u][b] Привет![/b][/u]
[b]Купить документ[/b] о получении высшего образования можно у нас.
[url=http://ast-diplomas24.ru/kupit-diplom-voronezh/]ast-diplomas24.ru/kupit-diplom-voronezh[/url]
[b]Успешной учебы![/b]
Concepts in geography such domfenshuy.net as absolute relative height are probabilities. If you begin to delve into the intricacies of this issue, you will understand what exactly they, in fact, allow, helping to describe geographical objects, understanding what they are.
Compatibility with Devices
ivermectin for sale
На сайте https://yogatot.ru/ запишитесь в студию йоги. Здесь самые разные практики, включая хатха-йогу, йогатерапию, аэройогу. Все практики максимально полезны для души и тела. Они помогают расслабиться, получить гармонию с собой и окружающим миром. В студиях царит приятная атмосфера, все настроено на получение ярких, приятных эмоций. Вы сразу же почувствуете, что настроение улучшилось, появилось умиротворение. Также всем желающим доступна и «горячая йога», которая проходит в теплом, уютном зале.
сиденье для офисного стула купить отдельно https://office-mebel-on-msk.ru/
auto-kar.net
[u][b] Добрый день![/b][/u]
[b]Мы предлагаем документы ВУЗов[/b], которые находятся в любом регионе РФ. Вы можете заказать диплом за любой год, указав подходящую специальность и хорошие оценки за все дисциплины. Дипломы и аттестаты выпускаются на бумаге самого высшего качества. Это дает возможности делать государственные дипломы, которые невозможно отличить от оригиналов. Они будут заверены всеми необходимыми печатями и подписями.
[url=http://www.gamerlaunch.com/community/users/blog/6443244/2286742/%D0%BF%D1%80%D0%B8%D0%BE%D0%B1%D1%80%D0%B5%D1%81%D1%82%D0%B8-%D0%B4%D0%B8%D0%BF%/?gid=535/]www.gamerlaunch.com/community/users/blog/6443244/2286742/%D0%BF%D1%80%D0%B8%D0%BE%D0%B1%D1%80%D0%B5%D1%81%D1%82%D0%B8-%D0%B4%D0%B8%D0%BF%/?gid=535[/url]
порно видео смотреть [url=http://apteka-porno.ru/]порно видео смотреть[/url] .
На сайте https://profmosreshetka.ru вы сможете получить всю необходимую информацию, которая касается заказа решеток на окна. Все конструкции выполняются из качественных, современных материалов. А замер, доставка решений осуществляются абсолютно бесплатно. С расценками ознакомьтесь прямо сейчас. Все цены снижены до конца июля, а потому спешите воспользоваться услугами прямо сейчас. Компания отличается большим опытом работы – более 10 лет. А если закажете 2 решетки, то вам будет предоставлена скидка в 20%.
In recent years, the leading positions in the Spanish https://spanish-championship.laliga-ar.com championship have been firmly occupied by two major giants – Barcelona and Real Madrid.
The road to the Premier League https://english-championship.premier-league-ar.com begins long before a team gets promoted to the English Premier League for the first time
I used to be recommended this website by way of my cousin. I’m not positive
whether this submit is written by way of him as nobody else realize such specified approximately
my difficulty. You’re amazing! Thank you!
The Italian football championship https://italian-championship.serie-a-ar.com known as Serie A, has seen an impressive revival in recent years.
In the German football https://german-championship.bundesliga-football-ar.com championship known as the Bundesliga, rivalries between clubs have always been intense.
https://7zet.ru/professionalnaya-pomoshh-vstrecha-s-travmatologom/
[u][b] Добрый день![/b][/u]
[b]Официальная покупка школьного аттестата с упрощенным обучением в Москве [/b]
[url=http://mastrerkon.ru/forum/viewtopic.php?f=10&t=27394/]mastrerkon.ru/forum/viewtopic.php?f=10&t=27394[/url]
[u][b] Рады оказаться полезными![u][b].
[u][b] Добрый день![/b][/u]
Купить документ университета.
[url=http://dopalnenie.listbb.ru/viewtopic.php?f=3&t=717/]dopalnenie.listbb.ru/viewtopic.php?f=3&t=717[/url]
[url=http://ya.webtalk.ru/viewtopic.php?id=9711#p47359/]ya.webtalk.ru/viewtopic.php?id=9711#p47359[/url]
[url=http://terios2.ru/forums/index.php?autocom=gallery&req=si&img=3048/]terios2.ru/forums/index.php?autocom=gallery&req=si&img=3048[/url]
[url=http://mirfinrealty.ru/vasha-karera-s-nashim-diplomom/]mirfinrealty.ru/vasha-karera-s-nashim-diplomom[/url]
[url=http://worksale777.blogspot.com/2024/07/blog-post_81.html/]worksale777.blogspot.com/2024/07/blog-post_81.html[/url]
Advanced Tips for Experienced Players
ivermectin purchase
Increased sales. High-quality customer 360o.info service stimulates additional sales. The average check increases, sales volume increases.
Models of hydraulic motors with a working volume of up to 400 and 1000 cubic cm are considered basic mmo5.info
Если вам нужны профессионалы в области продвижения сайтов и разработки, обратите внимание на ООО”МД”. Они предлагают полный спектр услуг: от SEO и SEM до работы с Яндекс.Директ. Команда специализируется на создании эффективных стратегий, которые помогают привлечь целевую аудиторию и увеличить видимость вашего бизнеса в интернете. Их профессионализм и подход к каждому клиенту гарантируют отличные результаты. Рекомендую ООО”МД” как надежного партнера в цифровом маркетинге! С уважением, Mihaylov Digital.
[u][b] Привет![/b][/u]
Приобрести документ о получении высшего образования вы можете у нас в столице. Мы оказываем услуги по продаже документов об окончании любых ВУЗов РФ. Вы сможете получить диплом по любым специальностям, включая документы СССР. Даем гарантию, что в случае проверки документов работодателем, никаких подозрений не появится.
[url=http://d6plus1.co.uk/read-blog/9927/]d6plus1.co.uk/read-blog/9927[/url]
[url=http://comedyforme.ru/kak-kupit-diplom-bez-lishnih-hlopot-2/]comedyforme.ru/kak-kupit-diplom-bez-lishnih-hlopot-2[/url]
[url=http://anahnu.club/jomsocial/groups/viewbulletin/10118-каталог-и-методы-доставки-в-интернет-магазине-покупаем-аттестат.html?groupid=1/]anahnu.club/jomsocial/groups/viewbulletin/10118-каталог-и-методы-доставки-в-интернет-магазине-покупаем-аттестат.html?groupid=1[/url]
[url=http://mymink.5bb.ru/viewtopic.php?id=8913#p455031/]mymink.5bb.ru/viewtopic.php?id=8913#p455031[/url]
[url=http://yexanin202.ixbb.ru/viewtopic.php?id=111#p111/]yexanin202.ixbb.ru/viewtopic.php?id=111#p111[/url]
https://tezfiles.cc/
[u][b] Добрый день![/b][/u]
[b]Полезные советы по безопасной покупке диплома о высшем образовании [/b]
[url=http://ya.webtalk.ru/viewtopic.php?id=9687#p47317/]ya.webtalk.ru/viewtopic.php?id=9687#p47317[/url]
Будем рады вам помочь!
гостиница промокод
Забудьте о долгих ожиданиях и отказах! С каналом [url=https://t.me/s/mfo_bez_otkaza_vsem]Быстрые деньги без отказа – Telegram[/url] вы всегда найдете нужную сумму на карту. Мы собрали самые выгодные предложения от МФО, готовых предложить займы без процентов и лишних проверок. Хотите знать, какие новые МФО предоставляют лучшие условия? Подписывайтесь на [url=https://t.me/s/zaim_mfo_online]Новые МФО 2024 – Telegram[/url] и будьте в курсе всех актуальных предложений. Ваше финансовое благополучие — в наших руках!
Good Post. Are you new to the world of clash royal and want to dominate clash royale like pro? If so, The key to success in this game lies in building powerful decks in clash royale that can handle various situations. Clash Royale Decks Builder is a tool for gamers to help them build their Decks. It provides 8 decks and different cards with their capabilities and costs. Visit the linked site for additional insights.
Центр Тех Профи в Волгограде предлагает качественный ремонт кофемашин с гарантией до 6 месяцев. Наши мастера с многолетним опытом работы выполнят ремонт в кратчайшие сроки, используя оригинальные запчасти. Доступны услуги выездного ремонта и доставки техники курьером, а также бесплатная диагностика.
https://vmenopauze.ru/aptechka/kompyuternaya-tomografiya-vnutrennego-uha-zaglyani-vnutr-s-pomoschyu-tehnologiy.html/
EuroAvia24.com – Cheap flights, hotels and transfers around the world!
The Saudi Football League https://saudi-arabian-championship.saudi-pro-league-ar.com known as the Saudi Professional League, is one of the most competitive and dynamic leagues in the world.
Rodrigo Goes https://real-madrid.rodrygo-ar.com better known as Rodrigo, is one of the brightest young talents in modern football.
In an era when many young footballers struggle to find their place at elite clubs, Javi’s https://barcelona.gavi-ar.com story at Barcelona stands out as an exceptional one.
[u][b] Привет, друзья![/b][/u]
Купить диплом ВУЗа
[b]Наши специалисты предлагают[/b] выгодно и быстро заказать диплом, который выполнен на оригинальном бланке и заверен мокрыми печатями, водяными знаками, подписями официальных лиц. Данный диплом способен пройти любые проверки, даже с использованием специальных приборов. Решите свои задачи быстро с нашим сервисом.
[b]Где купить диплом специалиста?[/b]
[url=http://alik.forumrpg.ru/viewtopic.php?id=6639#p275762/]alik.forumrpg.ru/viewtopic.php?id=6639#p275762[/url]
[url=http://ya.10bb.ru/viewtopic.php?id=3615#p6544/]ya.10bb.ru/viewtopic.php?id=3615#p6544[/url]
[url=http://forumkk.listbb.ru/viewtopic.php?f=12&t=392/]forumkk.listbb.ru/viewtopic.php?f=12&t=392[/url]
[url=http://vip.9bb.ru/viewtopic.php?id=5959#p9901/]vip.9bb.ru/viewtopic.php?id=5959#p9901[/url]
[url=http://www.simplemachines.org/about/smf/stats.php/]www.simplemachines.org/about/smf/stats.php[/url]
Arsenal https://arsenal.mesut-ozil-ar.com made a high-profile signing in 2013, signing star midfielder Mesut Ozil from Real Madrid.
[u][b] Привет, друзья![/b][/u]
Купить документ института можно в нашем сервисе. Мы оказываем услуги по продаже документов об окончании любых ВУЗов РФ. Вы получите диплом по любым специальностям, включая документы старого образца.
[url=http://newrealgames.ru/diplom-lyuboy-spetsialnosti-kachestvenno-i-bezopasno/]newrealgames.ru/diplom-lyuboy-spetsialnosti-kachestvenno-i-bezopasno[/url]
[url=http://1abakan.ru/forum/showthread-218496//]1abakan.ru/forum/showthread-218496/[/url]
[url=http://roving.club/read-blog/1464/]roving.club/read-blog/1464[/url]
[url=http://iaescortsmap.ixbb.ru/viewtopic.php?id=108#p108/]iaescortsmap.ixbb.ru/viewtopic.php?id=108#p108[/url]
[url=http://forum.qwas.ru/garantiya-kachestva-vash-diplom-na-zakaz-t20134.html/]forum.qwas.ru/garantiya-kachestva-vash-diplom-na-zakaz-t20134.html[/url]
[u][b] Здравствуйте![/b][/u]
[b]Заказать документ[/b] о получении высшего образования вы сможете в нашей компании в Москве.
[url=http://diploms-x.com/kupit-diplom-s-registraciej /]diploms-x.com/kupit-diplom-s-registraciej [/url]
site link [url=https://myjaxxwallet.us]jaxx classic[/url]
include welcome bonuses, loyalty rewards, and special promotions that provide additional chances to win and
cost of ivermectin
In recent years, online casinos have surged in popularity, becoming a major force in the world of digital entertainment. These platforms offer a convenient and accessible way for people to enjoy a variety of gambling activities from the comfort of their homes.
7slots
Excellent post. Keep posting such kind of info on your blog.
Im really impressed by it.
Hi there, You’ve performed an excellent job. I will definitely digg it and in my view suggest to my friends.
I’m sure they’ll be benefited from this web site.
https://helixlight.website/
My brother suggested I would possibly like this blog.
He was entirely right. This publish truly made my day.
You can not consider just how a lot time I had spent for this information! Thanks!
Hello to all, how is everything, I think every one is getting more from this site, and your views are good in favor of new visitors.
https://thetvdb.plex.tv/movies/real-gangsters
[u][b] Здравствуйте![/b][/u]
[b]Приобрести документ[/b] ВУЗа можно в нашей компании.
[url=http://ast-diploms24.ru/kupit-diplom-o-srednem-obrazovanii/]ast-diploms24.ru/kupit-diplom-o-srednem-obrazovanii[/url]
[b]Успехов в учебе![/b]
[u][b] Привет![/b][/u]
[b]Мы предлагаем документы ВУЗов[/b], которые находятся на территории всей России. Можно приобрести качественный диплом за любой год, указав актуальную специальность и хорошие оценки за все дисциплины. Дипломы и аттестаты выпускаются на бумаге высшего качества. Это дает возможности делать настоящие дипломы, которые невозможно отличить от оригиналов. Документы заверяются необходимыми печатями и подписями.
[url=http://humped.life/read-blog/561/]humped.life/read-blog/561[/url]
It’s remarkable in support of me to have a web site, which is beneficial in support of my experience. thanks admin
вход lee bet
Luis Suarez https://inter-miami.luis-suarez-ar.com the famous Uruguayan footballer, ended his brilliant career in European clubs and decided to try his hand at a new challenge – Major League Soccer.
Since its inception, the Aviator Game has undergone numerous updates and enhancements. Technological
ivermectin online
Bayern Munich’s https://bayern.jamal-musiala-ar.com young midfielder, Jamal Musiala, has become one of the brightest talents in European football.
https://www.themoviedb.org/movie/261903-real-gangsters
Станьте финансово независимыми с каналом [url=https://t.me/s/zaim_mfo_online]Telegram – займ на карту за несколько минут[/url] ! Мы собрали для вас самые выгодные предложения от МФО, которые предоставляют займы на карту без долгих проверок. Узнайте, где можно получить деньги без процентов для новых клиентов и какие малоизвестные компании готовы выдать займ на лучших условиях. Наш канал — ваш надежный источник информации о микрозаймах. Подпишитесь на [url=https://t.me/s/zaim_srochno_30_mfo]Telegram – лучшие предложения по займам на карту[/url] и наслаждайтесь финансовой свободой уже сегодня!
купить диплом юридический в уфе [url=https://diploms-x.com/]diploms-x.com[/url] .
грузовой строительный подъемник пмг производство подъемного оборудования
visit our website [url=https://my-jaxxwallet.io/]jaxx liberty wallet[/url]
https://detali-na-avto.ru/index.php?route=journal3%2Fblog%2Fpost&journal_blog_post_id=9
[u][b] Привет, друзья![/b][/u]
[b]Мы изготавливаем дипломы[/b] любых профессий по доступным тарифам.
[url=http://energypowerworld.co.uk/read-blog/6337_proverennyj-onlajn-magazin-s-obshirnym-vyborom-diplomov.html/]energypowerworld.co.uk/read-blog/6337_proverennyj-onlajn-magazin-s-obshirnym-vyborom-diplomov.html[/url]
Fair Play Policies and RNG
cost of ivermectin
tennessee affiliate broker licensing exam [url=http://www.realestatelicensengdfdgh.com]www.realestatelicensengdfdgh.com[/url] how long does it take to become realtor https://realestatelicensengdfdgh.com .
https://altinsatirpastirma.com/blog/greece-travel
page [url=https://coinomiwallet.io/]coinomi download[/url]
[url=https://tronlink.cash/]tronlink[/url] – tronlink pro, tron link
[u][b] Привет, друзья![/b][/u]
[b]Как не стать жертвой мошенников при покупке диплома о среднем полном образовании [/b]
[url=http://coup.forum2x2.ru/t3793-topic#10043/]coup.forum2x2.ru/t3793-topic#10043[/url]
Поможем вам всегда!
вспомогательным предельно немаловажным моментом является бодрый настрой няни для особого ребёнка.
Review my web-site :: https://paracetamol.pro/novosti/mnogozadachnaya-pomoschnitsa-pochemu-nyanya-guvernantka-mozhet-stat-idealnym-partnerom-dlya-shkolnika/
Хотите получить онлайн займ на карту без отказа? Канал [url=https://t.me/s/zaim_srochno_30_mfo]Telegram – займы на карту без работы[/url] поможет вам! Мы собрали актуальные предложения от малоизвестных МФО, которые дают займы даже с плохой кредитной историей и просрочками. Быстрые и круглосуточные займы от 1 до 30 тысяч рублей доступны всем: от 18 лет, пенсионерам и безработным. Узнайте, где можно получить займ под 0% для новых клиентов и какие компании предлагают самые выгодные условия. Подпишитесь на канал [url=https://t.me/s/new_mfo_2024]Telegram – займы на карту от проверенных компаний[/url] и получайте деньги без лишних вопросов!
диплом среднем образовании купить [url=https://mandiplomik.ru/]диплом среднем образовании купить[/url] .
Know-how the glee of pet care in KinitoPET https://articlescad.com/kinitopet-a-world-of-pets-and-adventure-675461.html, where players focus on nurturing and training pets. The just is to insist on pets’ health and happiness while progressing to the core divergent levels and tasks.
Al-Nasr https://saudi.al-nassr-ar.com is one of the most famous football teams in the Kingdom of Saudi Arabia.
Al-Nasr Club https://saudi.al-hilal-ar.com from Riyadh has a rich history of success, but its growth has been particularly impressive in recent years.
[u][b] Привет![/b][/u]
Приобрести документ института можно у нас. Мы оказываем услуги по изготовлению и продаже документов об окончании любых университетов Российской Федерации.
[url=http://dinskoi-raion.ru/forum/?PAGE_NAME=profile_view&UID=64229/]dinskoi-raion.ru/forum/?PAGE_NAME=profile_view&UID=64229[/url]
[url=http://geolan-ksl.ru/forum/user/85791//]geolan-ksl.ru/forum/user/85791/[/url]
[url=http://videopro.ru/xenforo/index.php?threads/Тестовая-тема-закреплённая.1/page-114#post-4182/]videopro.ru/xenforo/index.php?threads/Тестовая-тема-закреплённая.1/page-114#post-4182[/url]
[url=http://talented-people.vraiforum.com/profile.php?mode=viewprofile&u=8995/]talented-people.vraiforum.com/profile.php?mode=viewprofile&u=8995[/url]
[url=http://hondaikmciledug.co.id/HRIS/member.php?action=profile&uid=121057/]hondaikmciledug.co.id/HRIS/member.php?action=profile&uid=121057[/url]
Al-Ittihad https://saudi.al-ittihad-ar.com is one of the most famous football clubs in Saudi Arabia. Founded in 1927, the Saudi football giant has come a long way to the pinnacle of success.
[u][b] Здравствуйте![/b][/u]
[b]Купить документ[/b] университета можно в нашем сервисе.
[url=http://ast-diploms.com/kupit-diplom-bakalavra-ili-specialista /]ast-diploms.com/kupit-diplom-bakalavra-ili-specialista [/url]
[u][b] Добрый день![/b][/u]
Где приобрести диплом специалиста?
[url=http://dzone.com/users/5166875/leonardchambers.html/]dzone.com/users/5166875/leonardchambers.html[/url]
[u][b] Здравствуйте![/b][/u]
[b]Заказать документ[/b] института вы можете в нашей компании.
[url=http://ast-diplomy.com/kupit-diplom-ekaterinbur/]ast-diplomy.com/kupit-diplom-ekaterinbur[/url]
[b]Удачи![/b]
This article will assist the internet viewers for building up new blog or even a weblog from start to
end.
plane crashes, making it a game of both luck and timing. This dynamic gameplay keeps players engaged and coming
where to buy ivermectin
219news.com
investnews24.net
На сайте https://doramalive.me/ посмотрите дорамы абсолютно бесплатно и в любое время. Напротив каждой серии имеется дата выхода и вся необходимая информация. Все фильмы отличаются интересным, непредсказуемым сюжетом, удивительной актерской игрой, которая завораживает. Все серии отличного качества, а потому подарят только восторг. Вы сможете просматривать фильм за фильмом или продолжить просмотр там, где остановились в прошлый раз. Есть самые горячие дорамы, выхода которых ждали давно. Постоянно появляются новинки.
диплом я знаю азбуку купить [url=https://mandiplomik.ru/]mandiplomik.ru[/url] .
FC Barcelona https://spain.fc-barcelona-ar.com is undoubtedly one of the most famous and well-known football clubs in the world.
Vid-Stroy [url=www.internet-magazin-strojmaterialov.ru/]www.internet-magazin-strojmaterialov.ru/[/url] .
[u][b] Привет, друзья![/b][/u]
Приобрести диплом ВУЗа:
[url=http://nedv-revda.ru/index.php?subaction=userinfo&user=ylugil/]nedv-revda.ru/index.php?subaction=userinfo&user=ylugil[/url]
[url=http://funemulator.free.fr/index.php?file=Members&op=detail&autor=uqyru/]funemulator.free.fr/index.php?file=Members&op=detail&autor=uqyru[/url]
[url=http://193.16.101.6/index.php?title=gosznacdiplomy/]193.16.101.6/index.php?title=gosznacdiplomy[/url]
[url=http://tiendahinchables.com/blog/цеден.html/]tiendahinchables.com/blog/цеден.html[/url]
[url=http://forum.e4pool.com/viewtopic.php?p=6722#p6722/]forum.e4pool.com/viewtopic.php?p=6722#p6722[/url]
[u][b] Добрый день![/b][/u]
[b]Как приобрести диплом о среднем образовании в Москве и других городах[/b]
[url=http://gadjetforyou.ru/kupit-diplomyi-s-byistroy-dostavkoy/]gadjetforyou.ru/kupit-diplomyi-s-byistroy-dostavkoy[/url]
[u][b] Привет, друзья![/b][/u]
[b]Мы готовы предложить документы техникумов[/b], расположенных на территории всей Российской Федерации. Вы можете приобрести диплом за любой год, включая сюда документы СССР. Документы делаются на “правильной” бумаге самого высшего качества. Это дает возможности делать настоящие дипломы, не отличимые от оригиналов. Документы будут заверены необходимыми печатями и штампами.
[url=http://zustme.com/blogs/99/%D0%91%D1%8B%D1%81%D1%82%D1%80%D0%BE-%D0%B7%D0%B0%D0%BA%D0%B0%D0%B7%D1%8B%D0%B2%D0%B0%D0%B5%D0%BC-%D0%B4%D0%BE%D0%BA%D1%83%D0%BC%D0%B5%D0%BD%D1%82%D1%8B-%D0%B2-%D0%BE%D0%BD%D0%BB%D0%B0%D0%B9%D0%BD-%D0%BC%D0%B0%D0%B3%D0%B0%D0%B7%D0%B8%D0%BD%D0%B5-Russian-Diplom/]zustme.com/blogs/99/%D0%91%D1%8B%D1%81%D1%82%D1%80%D0%BE-%D0%B7%D0%B0%D0%BA%D0%B0%D0%B7%D1%8B%D0%B2%D0%B0%D0%B5%D0%BC-%D0%B4%D0%BE%D0%BA%D1%83%D0%BC%D0%B5%D0%BD%D1%82%D1%8B-%D0%B2-%D0%BE%D0%BD%D0%BB%D0%B0%D0%B9%D0%BD-%D0%BC%D0%B0%D0%B3%D0%B0%D0%B7%D0%B8%D0%BD%D0%B5-Russian-Diplom[/url]
[u][b] Привет![/b][/u]
[b]Приобрести диплом о высшем образовании.[/b]
[url=http://ya.9bb.ru/viewtopic.php?id=5545#p10847/]ya.9bb.ru/viewtopic.php?id=5545#p10847[/url]
[b]Хорошей учебы![/b]
[u][b] Здравствуйте![/b][/u]
[b]Мы можем предложить дипломы[/b] любой профессии по невысоким тарифам.
[url=http://foro.rune-nifelheim.com/general-ragnarok-m/diplomy-ot-veduschih-vuzov-strany//]foro.rune-nifelheim.com/general-ragnarok-m/diplomy-ot-veduschih-vuzov-strany/[/url]
газобетон рядом https://gazobeton-moskow.ru/
Легальная покупка школьного аттестата с упрощенной программой обучения
[url=http://diplomyx.com/kupit-diplom-moskva/]diplomyx.com/kupit-diplom-moskva[/url]
[b]Купить диплом университета.[/b]
[url=http://magazin.orgsoft.ru/communication/forum/index.php?PAGE_NAME=profile_view&UID=190505/]magazin.orgsoft.ru/communication/forum/index.php?PAGE_NAME=profile_view&UID=190505[/url]
[url=http://wiki.why42.ru/wiki/Высшее_Образование_для_Вас:_Легально_и_Доступно/]wiki.why42.ru/wiki/Высшее_Образование_для_Вас:_Легально_и_Доступно[/url]
[url=http://forum.7x.ru/member.php?u=16498/]forum.7x.ru/member.php?u=16498[/url]
[url=http://armit.ru/social/user/42552/forum/message/1598/1600/#message1600/]armit.ru/social/user/42552/forum/message/1598/1600/#message1600[/url]
[url=http://artrp.5nx.ru/viewtopic.php?f=3&t=9528/]artrp.5nx.ru/viewtopic.php?f=3&t=9528[/url]
Ищите торговлю бинарными опционами? Зайдите на сайт https://binrm.online/ и получите доступ к торговле более 100 мировыми торговыми активами. Узнайте больше о наших преимуществах Binarium – быстрые выводы, круглосуточная торговля, мгновенная поддержка, а также все о нашем приложении для любых мобильных устройств.
На сайте https://autoclub78.ru вы найдете интересные, практичные советы для тех, у кого есть автомобиль. Имеются практические рекомендации, ценные советы, которые помогут найти оптимальный вариант для того, чтобы правильно эксплуатировать технику. Статьи ответят на многочисленные вопросы, подскажут, как правильно действовать в определенной ситуации. Есть информация про самые востребованные мотоциклы, а также запчасти, которые реализуются на маркетплейсах. Есть информация и про то, как не стоит приобретать стеклоомывающую жидкость.
Добрый день!
Печати для бизнес-центров
Бизнес-центры часто нуждаются в специальных печатях для оформления деловой документации и пропусков. Мы предлагаем изготовление печатей для бизнес-центров, которые помогут вам быстро и эффективно оформлять документы. Наши печати изготавливаются из качественных материалов и обеспечивают чёткие оттиски, что делает их идеальным выбором для бизнес-центров. Обеспечьте порядок и организацию работы вашего бизнес-центра с нашими печатями!
Более подробно на сайте – https://www.moipechati.ru/pechati-i-shtampi/
заказ печати в москве
таблички фасадные
печать врач
заказ печатей и штампов москва
заказать печать в москве с доставкой недорого
[url=https://www.moipechati.ru/pechati-i-shtampi/latunnye/]изготовление металлических печатей[/url]
Удачи!
[u][b] Здравствуйте![/b][/u]
Мы изготавливаем дипломы.
[url=http://kherson.forum2x2.ru/login/]kherson.forum2x2.ru/login[/url]
[url=http://skazka.g-talk.ru/posting.php?mode=post&f=1/]skazka.g-talk.ru/posting.php?mode=post&f=1[/url]
[url=http://serialforfree.ru/vyisshee-obrazovanie-za-den-prosto-i-legalno/]serialforfree.ru/vyisshee-obrazovanie-za-den-prosto-i-legalno[/url]
[url=http://ukrevent.ru/kupit-diplom-onlayn-byistro-i-legko//]ukrevent.ru/kupit-diplom-onlayn-byistro-i-legko/[/url]
[url=http://sampnl.listbb.ru/viewtopic.php?f=3&t=478/]sampnl.listbb.ru/viewtopic.php?f=3&t=478[/url]
the opportunity to compete for larger prizes and showcase their skills on a larger stage.
ivermectin where to buy
Locowin en España
Ковтун, https://t.me/s/leon_zerkalo_bk Евгений Вячеславович. legal regulation of gambling in former ussr countries.
Регистрация на различных ресурсах, форумах или интернет-магазинах сегодня осуществляется только с применением номера телефона. Ранее для этой цели могла использоваться электронная почта, но сегодня правила изменены [url=https://qame.info/ru/news/game/kupite-virtualnyj-nomer-armenii-i-prinimajte-vyzovy-v-lyuboj-tochke-mira/]https://qame.info/ru/news/game/kupite-virtualnyj-nomer-armenii-i-prinimajte-vyzovy-v-lyuboj-tochke-mira/[/url]
The minimum limit is also very low and will be just 0.0005btc, in a bygone era how the maximum limit depends on the https://ecuador-btc-mixers.com/ and reserves in real time.
[u][b] Привет, друзья![/b][/u]
Приобрести документ о получении высшего образования.
[url=http://nec.phorum.pl/posting.php?mode=newtopic&f=27&sid=b63a6b177997fd7a8d269632d7b56c97/]nec.phorum.pl/posting.php?mode=newtopic&f=27&sid=b63a6b177997fd7a8d269632d7b56c97[/url]
[url=http://zarabotok.forumrpg.ru/viewtopic.php?id=70820#p154023/]zarabotok.forumrpg.ru/viewtopic.php?id=70820#p154023[/url]
[url=http://boltushka.flybb.ru/viewtopic.php?f=14&t=1513/]boltushka.flybb.ru/viewtopic.php?f=14&t=1513[/url]
[url=http://inteam.maxbb.ru/viewtopic.php?f=1&t=1547/]inteam.maxbb.ru/viewtopic.php?f=1&t=1547[/url]
[url=http://newsofgames.ru/garantirovannoe-oformlenie-diploma-bezopasno-i-nadezhno/]newsofgames.ru/garantirovannoe-oformlenie-diploma-bezopasno-i-nadezhno[/url]
Записаться к врачу в Москве cecilplus.ru
В современное время медицина в Российской Федерации развивается семимильными шагами. Это очень хорошо, но также стало работать много клиник, которые предоставляют некачественные услуги. Представляем Вашему вниманию «Сесиль», которая работает уже более двадцати лет, имеет превосходную репутацию и штат настоящих профессионалов.
По поводу [url=https://cecilplus.ru/medicalservices/detail/urologiya/]записаться к урологу[/url] мы Вам с удовольствием окажем помощь. Предлагаем консультации, программное лечение и диагностику по множественным направлениям. В том числе: геронтология, кардиология, невролгия-нейрофизиология, рефлексотерапия, психиатрия и многие другие. По возникшим вопросам звоните по номеру телефона +7(499)302-63-62 или закажите обратный звонок на интернет портале cecilplus.ru уже сегодня. Также есть онлайн запись и оплата консультации для Вашего комфорта.
Мы расположены по адресу: г. Москва, ул. Чаплыгина, д. 6, м. Чистые пруды. Режим работы с пн по сб с 9:00 до 21:00. Также на указанном сайте Вы можете посмотреть цены на оказываемые услуги. Многие услуги могут быть представлены с выездом к Вам домой, необходимо уточнить у специалиста.
Если Вы хотели найти [url=https://cecilplus.ru/medicalservices/detail/urologiya/]прием уролога[/url] в сети интернет, то вы на правильном пути. Наши врачи на cecilplus.ru обязательно Вам окажут помощь, ведь у них большой опыт и регулярные повышения квалификации. Будем счастливы Вам оказать помощь обрести здоровое тело, побороть недуг и жить счастливой жизнью!
[u][b] Здравствуйте![/b][/u]
[b]Вопросы и ответы: можно ли быстро купить диплом старого образца? [/b]
[url=http://tokmak.pp.ua/forum/vyacheslav-abaza/8238-nuzhno-srochno-zakazat-diplom-poluchenii-obrazovaniya.html#8253/]tokmak.pp.ua/forum/vyacheslav-abaza/8238-nuzhno-srochno-zakazat-diplom-poluchenii-obrazovaniya.html#8253[/url]
[u][b] Поможем вам всегда![u][b].
[u][b] Здравствуйте![/b][/u]
[b]Вопросы и ответы: можно ли быстро купить диплом старого образца? [/b]
[url=http://l-avt.ru/support/dialog/?PAGE_NAME=profile_view&UID=70177/]l-avt.ru/support/dialog/?PAGE_NAME=profile_view&UID=70177[/url]
Рады оказать помощь!
газобетон плотность 400 https://gazobeton-moskow.ru/
וגברים נשואים. ועל מנת להעניק שירות לקהל אקסקלוסיבי זה, הן מקפידות על דיסקרטיות ופרטיות של לקוחותיהם. הן מגיעות ונותנות שירות שבו אתה תוכל לשכוח מכל הדאגות ופשוט לעבור רגעים מושלמים של אושר. רגעים של פינוק אינסופי ופורקן עמוק ומשחרר. דירות דיסקרטיות read article
how to obtain a real estate license in nevada [url=https://realestatelicensengdfdgh.com/states/north-carolina-real-estate-license/]realestatelicensengdfdgh.com/states/north-carolina-real-estate-license/[/url] is it hard to get your real estate license realestatelicensengdfdgh.com/states/massachusetts-real-estate-license/ .
[u][b] Привет, друзья![/b][/u]
[b]Заказать диплом о высшем образовании.[/b]
[url=http://crowd-out.social/read-blog/154/]crowd-out.social/read-blog/154[/url]
https://locowin-casino.site/
Key Developers and Companies Involved
ivermectin price
[u][b] Добрый день![/b][/u]
Купить документ университета
[url=http://asxdiplomik24.ru/kupit-diplom-rostov-na-donu]asxdiplomik24.ru/kupit-diplom-rostov-na-donu[/url]
What’s up Dear, are you in fact visiting this web page regularly, if so then you will absolutely obtain nice knowledge.
[b]Привет, друзья![/b]
Можно ли купить аттестат о среднем образовании? Основные рекомендации
[url=http://arusak-diploms-srednee.ru/kupit-diplom-v-cheliabinske В ]arusak-diploms-srednee.ru/kupit-diplom-v-cheliabinske В [/url]
את החלומות. דירות דיסקרטיות בבאר שבע לגבר שמעז ליהנות מהחיים זו לא תוצאה של נסיבות, זו תוצאה של החלטה. בשביל שגבר ייהנה בדירות הדיסקרטיות תוכל למצוא נערות בעלות מראה שיגרום לך להתרגש. לכולן גוף סקסי ומפתה, מהסוג שאתה רגיל לראות רק בסרטים. ולא רק דירה דיסקרטית בראשון
להזמין את הנערות לביתם או לבית המלון ולשמור על פרטיות מלאה. להגשים פנטזיות עם נערות ליווי בתל אביב לכל גבר יש את הפנטזיות להיות בביתך או בבית המלון. והן מייד דואגות שיהיה לך טוב ונעים. הן מתמקדות בדבר שאתה הכי אוהב והכי צריך כרגע. הבילוי הנעים דירות דיסקרטיות בעפולה
how to get real estate license idaho [url=https://realestatelicensengdfdgh.com/states/tennessee-real-estate-license/]realestatelicensengdfdgh.com/states/tennessee-real-estate-license/[/url] how to get a realtor license realestatelicensengdfdgh.com/states/georgia-real-estate-license/ .
[u][b] Добрый день![/b][/u]
[b]Купить документ[/b] университета вы сможете у нас.
[url=http://ast-diplomy.com/kupit-diplom-sankt-peterburg/]ast-diplomy.com/kupit-diplom-sankt-peterburg[/url]
[b]Успехов в учебе![/b]
Vagina hello this is my web Vagina
Yes, the Aviator Game is compatible with mobile devices. Players can enjoy the game on their smartphones or
cheap ivermectin
Приветствую. Может кто знает, где почитать полезные статьи о недвижимости? Сейчас читаю https://gor-bur.ru
[u][b] Здравствуйте![/b][/u]
[b]Мы можем предложить документы ВУЗов[/b], которые расположены в любом регионе России. Можно купить качественно сделанный диплом от любого заведения, за любой год, указав актуальную специальность и хорошие оценки за все дисциплины. Документы выпускаются на “правильной” бумаге высшего качества. Это дает возможности делать настоящие дипломы, которые не отличить от оригинала. Они будут заверены необходимыми печатями и штампами.
[url=http://viewfromabove.mn.co/posts/61838379/]viewfromabove.mn.co/posts/61838379[/url]
אקסקלוסיבי המעניק פתרון לגברים שרוצים בילוי מפנק ואינטימי, מעכשיו לעכשיו. כל גבר יכול ליהנות מהשירותים הללו, כך אחד בזמן ובמקום כל סודות הגוף והן יגרמו לך להנאה רבה. אתה תרגיש את הגבריות שלך בשיא עצמתה, ובעודך נהנה מהנשיות המושלמת של הנערות. גופך ינוע דירה סקס
breakingnews77.com
Advantages of wooden gazebos, in addition to the obvious advantages in a decorative sense olympic-school.com, there are other advantages.
read the full info here [url=https://coimnarketcap.us/]coinmarketcap[/url]
секс училки и ученика [url=http://sex-s-uchilkami.ru]http://sex-s-uchilkami.ru[/url] .
порно тренер трахает [url=http://www.pornotrenery.ru]порно тренер трахает[/url] .
rent a boat Tivat Montenegro rent boat
Montenegro yacht charter Budva yacht rental
FC Bayern Munich (Munich) https://germany.bayern-munchen-ar.com is one of the most famous and recognized football clubs in Germany and Europe
Real Madrid’s https://spain.real-madrid-ar.com history goes back more than a century. The club was founded in 1902 by a group of football enthusiasts led by Juan Padilla
Arsenal https://england.arsenal-ar.com is one of the most famous and successful football clubs in the history of English football.
Приветствую. Подскажите, где почитать разные статьи о недвижимости? Сейчас читаю https://konditsioneri-shop.ru
[url=https://kraken103.at]kraken форум ссылка[/url] – kraken актуальная ссылка onion kraken2web com, kraken ссылка зеркало krakentor site
The Aviator Game includes various in-game bonuses and rewards to enhance the player’s experience. These can
ivermectin for sale
[u][b] Привет![/b][/u]
Купить документ института
[url=http://machineintelligence.mn.co/posts/61828791/]machineintelligence.mn.co/posts/61828791[/url]
[url=http://medlink.live/read-blog/129/]medlink.live/read-blog/129[/url]
[url=http://wefriends.fun/read-blog/208/]wefriends.fun/read-blog/208[/url]
[url=http://xrated.social/blogs/149/Детальное-описание-заказа-аттестата-в-интернет-магазине/]xrated.social/blogs/149/Детальное-описание-заказа-аттестата-в-интернет-магазине[/url]
[url=http://friend24.in/blogs/2847/Хотите-приобрести-диплом-Заходите-в-наш-онлайн-магазин/]friend24.in/blogs/2847/Хотите-приобрести-диплом-Заходите-в-наш-онлайн-магазин[/url]
男子
getting a real estate license in wisconsin [url=http://www.realestatelicensengdfdgh.com]www.realestatelicensengdfdgh.com[/url] where to get a real estate license realestatelicensengdfdgh.com/states/tennessee-real-estate-license/ .
ok real estate license [url=https://realestatelicensengdfdgh.com/states/north-carolina-real-estate-license/]realestatelicensengdfdgh.com/states/north-carolina-real-estate-license/[/url] how long to become a real estate agent realestatelicensengdfdgh.com/states/nevada-island-real-estate-license/ .
[u][b] Добрый день![/b][/u]
Купить документ о получении высшего образования.
[url=http://danceway74.ru/users/36/]danceway74.ru/users/36[/url]
[url=http://sportraketka.ru/vash-diplom-za-korotkoe-vremya-prosto-i-udobno/]sportraketka.ru/vash-diplom-za-korotkoe-vremya-prosto-i-udobno[/url]
[url=http://2cool.ru/qiwi-f215/poluchite-diplom-za-schitannie-dni-t3803.html/]2cool.ru/qiwi-f215/poluchite-diplom-za-schitannie-dni-t3803.html[/url]
[url=http://ya.webtalk.ru/viewtopic.php?id=9704#p47341/]ya.webtalk.ru/viewtopic.php?id=9704#p47341[/url]
[url=http://cartagena.activeboard.com/forum.spark/]cartagena.activeboard.com/forum.spark[/url]
[u][b] Привет![/b][/u]
Мы готовы предложить документы ВУЗов
[url=http://stpos.ru/forum/user/36989//]stpos.ru/forum/user/36989/[/url]
[url=http://psorum.ru/member.php?u=4348/]psorum.ru/member.php?u=4348[/url]
[url=http://peaceofficial.5nx.ru/posting.php?mode=post&f=111&sid=d4866bda1a098dc4a544e09cc8148f4e/]peaceofficial.5nx.ru/posting.php?mode=post&f=111&sid=d4866bda1a098dc4a544e09cc8148f4e[/url]
[url=http://cocapal.com/read-blog/1133/]cocapal.com/read-blog/1133[/url]
[url=http://draiv.flybb.ru/viewtopic.php?f=2&t=753/]draiv.flybb.ru/viewtopic.php?f=2&t=753[/url]
[u][b] Привет![/b][/u]
[b]Мы изготавливаем дипломы[/b] любой профессии по доступным ценам.
[url=http://startspresto.ru/cb-profile/pluginclass/cbblogs?action=blogs&func=show&id=149/]startspresto.ru/cb-profile/pluginclass/cbblogs?action=blogs&func=show&id=149[/url]
[url=http://toyota-porte.ru/forums/index.php?autocom=gallery&req=si&img=2216/]toyota-porte.ru/forums/index.php?autocom=gallery&req=si&img=2216[/url]
[url=http://luckybookies.com/blogs/1106/На-что-обращать-внимание-при-покупки-диплома-в-сети/]luckybookies.com/blogs/1106/На-что-обращать-внимание-при-покупки-диплома-в-сети[/url]
[url=http://bondhusova.com/blogs/60411/Грамотно-приобретаем-диплом-в-сети-интернет-авторский-обзор/]bondhusova.com/blogs/60411/Грамотно-приобретаем-диплом-в-сети-интернет-авторский-обзор[/url]
[url=http://ja360.fun/read-blog/18/]ja360.fun/read-blog/18[/url]
[u][b] Добрый день![/b][/u]
[b]Купить документ[/b] университета можно в нашей компании.
[url=http://diploms-x.com/kupit-diplom-kazan /]diploms-x.com/kupit-diplom-kazan [/url]
父母
[u][b] Привет![/b][/u]
[b]Купить документ[/b] о получении высшего образования можно у нас.
[url=http://diplomasx24.ru/kupit-diplom-sankt-peterburg/]diplomasx24.ru/kupit-diplom-sankt-peterburg[/url]
[b]Успешной учебы![/b]
emergate.net
If we consider the absolute height, then this is the height above sea level 214rentals.com
Thai Company Directory https://thaicorporates.com List of companies and business information.
типография официальный сайт печать этикеток
Консультация акушера гинеколога в Москве cecilplus.ru
В настоящий момент медицина в России развивается очень быстро. Это весьма хорошо, но также стало работать много поликлиник, которые оказывают сомнительные услуги. Представляем Вашему вниманию «Сесиль», которая работает уже более 20-ти лет, имеет превосходную репутацию и штат настоящих специалистов.
По запросу [url=https://cecilplus.ru/medicalservices/detail/urologiya/]первичный прием уролога[/url] мы Вам с удовольствием поможем. Оказываем консультации, полное лечение и диагностику по множественным направлениям. В их числе: гинекология, кардиология, невролгия-нейрофизиология, ревматология, эндокринология и многие другие. По оставшимся вопросам звоните по телефону +7(499)705-04-19 или оформите обратный звонок на интернет сайте cecilplus.ru прямо сейчас. Ещё присутствует интернет запись и оплата консультации для Вашего удобства.
Мы расположены по адресу: г. Москва, ул. Чаплыгина, д. 6, м. Чистые пруды. График работы с понедельника по субботу с 9:00 до 21:00. Вдобавок на указанном сайте Вы можете посмотреть цены на наши услуги. Многие услуги могут быть представлены с выездом к Вам домой, следует детализировать у специалиста.
Если Вы искали [url=https://cecilplus.ru/medicalservices/detail/urologiya/]врач уролог андролог в москве[/url] в интернете, то вы на верном пути. Наши врачи на cecilplus.ru обязательно Вам окажут помощь, ведь у них огромный опыт и регулярные повышения в своей сфере. Будем счастливы Вам оказать помощь обрести здоровье, побороть болезнь и жить полной жизнью!
The Aviator Game offers multiplayer options that allow players to compete against each other in real-time. This
ivermectin price
Ремонт плоской кровли https://remontiruem-krovly.ru в Москве, цена работы за 1 м?. Прайс лист на работы под ключ, отзывы и фото.
AC Milan https://italy.milan-ar.com is one of the most successful and decorated football clubs in the world.
й¤ђеЋ…
from this source [url=https://Trader-joe.homes/]trader joe[/url]
Best Bitcoin Mixer
смотреть порно видео гимнастками [url=https://sexygimnastky.ru/]sexygimnastky.ru[/url] .
Лечение наркомании
[u][b] Здравствуйте![/b][/u]
[b]Купить диплом о высшем образовании.[/b]
[url=http://livestockkenya.com/index.php/cb-profile/pluginclass/cbblogs?action=blogs&func=show&id=244/]livestockkenya.com/index.php/cb-profile/pluginclass/cbblogs?action=blogs&func=show&id=244[/url]
וגברים נשואים. ועל מנת להעניק שירות לקהל אקסקלוסיבי זה, הן מקפידות על דיסקרטיות ופרטיות של לקוחותיהם. הן מגיעות ונותנות שירות והאינטימי שהגוף שלך צריך. כאשר אתה תראה את הנערות אתה פשוט תשתגע. מדובר בנערות היפות ביותר שאפשר למצוא בעיר. כולן מציגות heelp
男孩
祖父
Glory Casino
https://www.publico.es/sociedad/publico.es-nancy-fraser-no-dejar-temor-ultraderecha-lleve-feminismo-liberal.html
[u][b] Привет![/b][/u]
Купить диплом о высшем образовании
[b]Наша компания предлагает[/b] максимально быстро заказать диплом, который выполняется на оригинальном бланке и заверен печатями, штампами, подписями. Диплом способен пройти лубую проверку, даже с применением специального оборудования. Решайте свои задачи максимально быстро с нашей компанией.
[b]Где купить диплом по нужной специальности?[/b]
[url=http://www.hristianka.ru/forum/r/prev_loaded/1//]www.hristianka.ru/forum/r/prev_loaded/1/[/url]
[url=http://vaeaem.profiforum.ru/t3822-topic#7107/]vaeaem.profiforum.ru/t3822-topic#7107[/url]
[url=http://burgasdent.listbb.ru/viewtopic.php?f=3&t=355/]burgasdent.listbb.ru/viewtopic.php?f=3&t=355[/url]
[url=http://3drus.ru/forum/topic_34806/]3drus.ru/forum/topic_34806[/url]
[url=http://nedvigimost.bbok.ru/viewtopic.php?id=26650#p45740/]nedvigimost.bbok.ru/viewtopic.php?id=26650#p45740[/url]
[url=https://kraken102.at]kraken зеркало krakentor site[/url] – kraken сайт kraken2krnvkatkrnkv2torat com, kraken ссылка kraken zerkalo xyz
купить диплом 1999 года выпуска [url=https://mandiplomik.ru/]mandiplomik.ru[/url] .
[u][b] Добрый день![/b][/u]
Диплом для вас
[url=http://bery-optom.ru/forum/?PAGE_NAME=profile_view&UID=11335/]bery-optom.ru/forum/?PAGE_NAME=profile_view&UID=11335[/url]
[url=http://mangorpp.getbb.ru/viewtopic.php?f=3&t=472/]mangorpp.getbb.ru/viewtopic.php?f=3&t=472[/url]
[url=http://lapd.getbb.ru/viewtopic.php?f=5&t=457/]lapd.getbb.ru/viewtopic.php?f=5&t=457[/url]
[url=http://grp.7olimp.ru/viewforum.php?f=1/]grp.7olimp.ru/viewforum.php?f=1[/url]
[url=http://place-e.ru/index.php/Легко_и_быстро_оформите_диплом/]place-e.ru/index.php/Легко_и_быстро_оформите_диплом[/url]
[u][b] Привет, друзья![/b][/u]
Купить диплом университета
[url=http://ericos.ru/forum/index.php?PAGE_NAME=profile_view&UID=10808/]ericos.ru/forum/index.php?PAGE_NAME=profile_view&UID=10808[/url]
[url=http://fabnews.ru/forum/showthread.php?p=80241#post80241/]fabnews.ru/forum/showthread.php?p=80241#post80241[/url]
[url=http://smolensk.forum2x2.ru/t3052-topic#6962/]smolensk.forum2x2.ru/t3052-topic#6962[/url]
[url=http://domovou.3nx.ru/viewtopic.php?p=7092#7092/]domovou.3nx.ru/viewtopic.php?p=7092#7092[/url]
[url=http://paning.flybb.ru/viewtopic.php?f=7&t=1241/]paning.flybb.ru/viewtopic.php?f=7&t=1241[/url]
[u][b] Добрый день![/b][/u]
[b]Как получить диплом техникума с упрощенным обучением в Москве официально[/b]
[url=http://wegoflc.com/купить-диплом-в-тольятти//]wegoflc.com/купить-диплом-в-тольятти/[/url]
Can I Play the Aviator Game on Mobile?
ivermectin online
女子
real estate missouri license [url=https://realestatelicensengdfdgh.com/states/tennessee-real-estate-license/]realestatelicensengdfdgh.com/states/tennessee-real-estate-license/[/url] what you need to become a real estate agent realestatelicensengdfdgh.com/states/new-jersey-real-estate-license/ .
女е©
На сайте https://singapore-company.ru/ уточните информацию относительно того, как правильно произвести регистрацию своей компании в Сингапуре. Это государство выбирают по той причине, что оно является одним из самых развитых, в нем особая инфраструктура. Компания поможет вам открыть бизнес, даст профессиональную консультацию. Здесь работают компетентные, лучшие специалисты, которые знают, как вам открыть свое дело. В разделе вы найдете данные о том, как правильно зарегистрировать предприятие и какие документы для этого понадобятся.
[u][b] Привет, друзья![/b][/u]
Купить документ университета.
[url=http://forum.gorodsalavat.ru/posting.php?mode=post&f=28&sid=cdfd1ce30c6495a4e14079a1473da287/]forum.gorodsalavat.ru/posting.php?mode=post&f=28&sid=cdfd1ce30c6495a4e14079a1473da287[/url]
[url=http://mmix.ukrbb.net/viewtopic.php?f=23&t=22586/]mmix.ukrbb.net/viewtopic.php?f=23&t=22586[/url]
[url=http://profit.hutt.live/viewtopic.php?id=1985#p4285/]profit.hutt.live/viewtopic.php?id=1985#p4285[/url]
[url=http://forum.hi-def.ru/index.php?showtopic=38594/]forum.hi-def.ru/index.php?showtopic=38594[/url]
[url=http://mastergrad.getbb.ru/viewtopic.php?f=12&t=2286/]mastergrad.getbb.ru/viewtopic.php?f=12&t=2286[/url]
https://indibeti.in is a premier online casino offering a wide array of games including slots, table games, and live dealer options. Renowned for its user-friendly interface and robust security measures, Indibet ensures a top-notch gaming experience with exciting bonuses and 24/7 customer support.
In the world of football, Atletico Madrid https://spain.atletico-madrid-ar.com has long been considered the second most important club in Spain after the dominant, Real Madrid.
Galatasaray https://turkey.galatasaray-ar.com is one of the most famous football clubs in Turkiye, with a glorious and eventful history.
זורמות עם הגבר. אז מה התכניות שלך להערב? להיות לבד או לעשות משהו טוב למען עצמך? נראה לנו שאתה יודע את התשובה! הזמן נערה ותגשים בילוי אחד ויחיד שמאפשר לגבר להירגע. את אותו בילוי שמשקיט את המחשבות ומרפא את הגוף. כלומר זוהי הזדמנות למצוא גם סביבת בילוי נערות ליווי בחולון
The future football star Shabab Al-Ahly https://dubai.shabab-al-ahli-ar.com was born in Dubai in 2000. From a young age, he showed exceptional football abilities and joined the youth academy of one of the UAE’s leading clubs, Shabab Al-Ahly.
The fascinating story of Ja Morant’s https://spain.atletico-madrid-ar.com meteoric rise, from status from rookie to leader of the Memphis Grizzlies and rising NBA superstar.
儿子
купить диплом без [url=https://mandiplomik.ru/]mandiplomik.ru[/url] .
I am curious to find out what blog system you happen to be using?
I’m having some small security issues with my latest website and
I would like to find something more safeguarded. Do you have any
suggestions?
[u][b] Здравствуйте![/b][/u]
Заказать документ о получении высшего образования
[url=http://ls.monetka.in.ua/2024/07/09/priobretaem-dokumenty-v-proverennom-magazine-po-vygodnoy-cene.html/]ls.monetka.in.ua/2024/07/09/priobretaem-dokumenty-v-proverennom-magazine-po-vygodnoy-cene.html[/url]
[url=http://guyspages.com/read-blog/764/]guyspages.com/read-blog/764[/url]
[url=http://followmylive.com/read-blog/619/]followmylive.com/read-blog/619[/url]
[url=http://xbcbjlp5c.csublogs.com/34399881/Как-можно-будет-недорого-заказать-диплом-в-интернет-магазине/]xbcbjlp5c.csublogs.com/34399881/Как-можно-будет-недорого-заказать-диплом-в-интернет-магазине[/url]
[url=http://мкр-красногорский.рф/gallery/image/1500-аттестаты-дипломы-и-справки-в-лучшем-интернет-магазине/?context=new/]мкр-красногорский.рф/gallery/image/1500-аттестаты-дипломы-и-справки-в-лучшем-интернет-магазине/?context=new[/url]
[u][b] Добрый день![/b][/u]
Заказать диплом университета
[url=http://cartagena.activeboard.com/forum.spark/]cartagena.activeboard.com/forum.spark[/url]
[url=http://medium.com/@oximus777/надежные-дипломы-от-профессионалов-2cb2e64f4f54/]medium.com/@oximus777/надежные-дипломы-от-профессионалов-2cb2e64f4f54[/url]
[url=http://forumjustwoman.getbb.ru/viewtopic.php?f=43&t=1020/]forumjustwoman.getbb.ru/viewtopic.php?f=43&t=1020[/url]
[url=http://autogroupe.ru/vash-diplom-vash-uspeh/]autogroupe.ru/vash-diplom-vash-uspeh[/url]
[url=http://realtyintellect.ru/vash-diplom-bez-lishnih-hlopot/]realtyintellect.ru/vash-diplom-bez-lishnih-hlopot[/url]
[u][b] Добрый день![/b][/u]
[b]Заказать диплом о высшем образовании.[/b]
[url=http://iaescortsmap.ixbb.ru/viewtopic.php?id=66#p66/]iaescortsmap.ixbb.ru/viewtopic.php?id=66#p66[/url]
[b]Успешной учебы![/b]
[u][b] Добрый день![/b][/u]
Диплом юриста
[url=http://cv53297-livestreet-1.tw1.ru/2024/07/22/nadezhnye-diplomy-ot-professionalov.html/]cv53297-livestreet-1.tw1.ru/2024/07/22/nadezhnye-diplomy-ot-professionalov.html[/url]
[url=http://forum.fiat-club.ru/blog_post.php?do=updateblog&blogid=/]forum.fiat-club.ru/blog_post.php?do=updateblog&blogid=[/url]
[url=http://1abakan.ru/forum/showthread-232435//]1abakan.ru/forum/showthread-232435/[/url]
[url=http://dog-ola.ru/viewtopic.php?f=28&t=7511/]dog-ola.ru/viewtopic.php?f=28&t=7511[/url]
[url=http://spartakmeb.ru/forum/user/31864//]spartakmeb.ru/forum/user/31864/[/url]
家庭
[u][b] Привет![/b][/u]
Мы предлагаем документы техникумов
[url=http://angelladydety.getbb.ru/posting.php?mode=post&f=46&sid=bbb45a8391cf6e73b1d6ca3e2ad66b81/]angelladydety.getbb.ru/posting.php?mode=post&f=46&sid=bbb45a8391cf6e73b1d6ca3e2ad66b81[/url]
[url=http://dachaweek.ru/diplomyi-dlya-professionalnogo-rosta/]dachaweek.ru/diplomyi-dlya-professionalnogo-rosta[/url]
[url=http://grot.getbb.ru/viewtopic.php?f=6&t=1071/]grot.getbb.ru/viewtopic.php?f=6&t=1071[/url]
[url=http://samara.listbb.ru/viewtopic.php?f=3&t=381/]samara.listbb.ru/viewtopic.php?f=3&t=381[/url]
[url=http://rabotavinternete.forum2x2.ru/t55653-topic#138456/]rabotavinternete.forum2x2.ru/t55653-topic#138456[/url]
Safety and Fair Play
cheap ivermectin
[u][b] Здравствуйте![/b][/u]
Мы изготавливаем дипломы любой профессии.
[url=http://picbok.org/read-blog/4658_nadezhnyj-internet-magazin-s-obshirnym-vyborom-dokumentov.html]picbok.org/read-blog/4658_nadezhnyj-internet-magazin-s-obshirnym-vyborom-dokumentov.html[/url]
Рады оказать помощь!.
get real estate license kansas [url=https://realestatelicensengdfdgh.com]https://realestatelicensengdfdgh.com[/url] how to get your real estate license realestatelicensengdfdgh.com/states/california-real-estate-license/ .
Wonderful article! We are linking to this great content on our site.
Keep up the great writing.
Regards! A lot of write ups.
[u][b] Здравствуйте![/b][/u]
[b]Заказать документ[/b] о получении высшего образования можно у нас в столице.
[url=http://ast-diplom.com/kupit-diplom-kandidata-nauk /]ast-diplom.com/kupit-diplom-kandidata-nauk [/url]
爸爸
жЉ¤еЈ«
Hi this is kind of of off topic but I was wondering if blogs use WYSIWYG editors or if you have to manually code with HTML. I’m starting a blog soon but have no coding knowledge so I wanted to get advice from someone with experience. Any help would be greatly appreciated!
Dragon Money Casino
купить новую квартиру застройщик https://kvartira-new43.ru
квартиры от застройщика https://kvartiranew43.ru
купить однокомнатную квартиру в новостройке купить новостройку цены застройщика
[u][b] Здравствуйте![/b][/u]
[b]Возможно ли купить диплом стоматолога, и как это происходит [/b]
[url=http://himagro.md/forum/user/40722//]himagro.md/forum/user/40722/[/url]
[u][b] Всегда вам поможем![u][b].
Сдать анализы в Москве cecilplus.ru
Если Вы хотели найти [url=https://cecilplus.ru/medicalservices/detail/urologiya/]урология[/url] в интернете, то вы на верном пути. Наши специалисты на cecilplus.ru обязательно Вам помогут, ведь у них огромный опыт и постоянные повышения в своей сфере. Будем счастливы Вам помочь обрести здоровое тело, побороть недуг и жить полной жизнью!
coindarwin web3 academy
The Untold Tale Regarding Solana Creator Yakovenko’s Achievement
Following 2 Portions of Coffees with a Pint
Yakovenko, the visionary the mastermind behind Solana, initiated his path with a routine practice – coffee and beer. Little did he realize, these occasions would ignite the gears of fate. Today, Solana stands as a significant competitor in the crypto world, featuring a worth in billions.
Ethereum ETF First Sales
The Ethereum ETF just made its debut with an impressive trade volume. This significant event witnessed numerous spot Ethereum ETFs from multiple issuers begin trading on U.S. exchanges, bringing extraordinary activity into the usually calm ETF trading environment.
Ethereum ETF Approval by SEC
The Commission has formally approved the Ethereum Spot ETF for listing. Being a cryptographic asset with smart contracts, Ethereum is expected to significantly impact the crypto industry thanks to this approval.
Trump’s Crypto Maneuver
As the election approaches, Trump portrays himself as the ‘Crypto President,’ constantly highlighting his backing of the crypto sector to attract voters. His approach is different from Biden’s strategy, seeking to capture the interest of the digital currency community.
Elon Musk’s Influence
Elon Musk, a prominent figure in the cryptocurrency space and a backer of Trump’s agenda, shook things up once again, driving a meme coin connected to his actions. His participation keeps shaping the market landscape.
Binance Developments
Binance’s unit, BAM, has been permitted to channel customer funds in U.S. Treasuries. Furthermore, Binance marked its seventh anniversary, highlighting its development and achieving several compliance licenses. Meanwhile, the company also disclosed plans to remove several major crypto trading pairs, affecting different market players.
AI and Market Trends
Goldman Sachs’ top stock analyst recently observed that AI is unlikely to cause a major economic changeHere’s the spintax version of the provided text with possible synonyms
丈夫
Thanks for every other excellent article. The place else could anyone
get that kind of info in such an ideal method of writing?
I have a presentation next week, and I am at the search for such information.
leeds-welcome.com
how to get real estate license idaho [url=https://realestatelicensengdfdgh.com/states/florida-real-estate-license/]realestatelicensengdfdgh.com/states/florida-real-estate-license/[/url] how to get a realtor license realestatelicensengdfdgh.com/states/new-jersey-real-estate-license/ .
For beginners, the key to success in the Aviator Game is to start with small bets and gradually increase as you
ivermectin buy online
[u][b] Добрый день![/b][/u]
[b]Купить диплом университета.[/b]
[url=http://lastdemo.primepix.ru/club/user/88/blog/8745//]lastdemo.primepix.ru/club/user/88/blog/8745/[/url]
dominicanrental.com
[u][b] Добрый день![/b][/u]
Где купить диплом специалиста?
[url=http://ukrlenta.ru/preodolenie-prepyatstviy-pochemu-kupit-diplom-eto-razumnoe-reshenie/]ukrlenta.ru/preodolenie-prepyatstviy-pochemu-kupit-diplom-eto-razumnoe-reshenie[/url]
на всех сайтах есть система поощрений игроков за активность и лояльность.
Feel free to visit my blog :: https://1win-vhha.buzz/
белый список капперов телеграмм [url=https://rejting-kapperov12.ru]https://rejting-kapperov12.ru[/url] .
What’s up colleagues, how is all, and what you want to say on the topic of this piece of writing, in my view its truly awesome in favor of me.
xslot
оборудование для конференц залов [url=www.oborudovanie-dlja-konferenc-zalov.ru]оборудование для конференц залов[/url] .
realtor license ohio [url=https://realestatelicensengdfdgh.com/states/indiana-real-estate-license/]realestatelicensengdfdgh.com/states/indiana-real-estate-license/[/url] realtor licence realestatelicensengdfdgh.com/states/new-jersey-real-estate-license/ .
Ищите скачать фильмы на телефон https://anwap.im/ – тогда зайдите к нам. Скачивайте фильмы, сериалы, мультики прямо на телефон и смотрите, когда вам удобно. Никакой регистрации, бесплатно. Коллекции нашего сайта в любых жанрах и годов выпуска позавидует любой сайт. Все фильмы для телефона в одном месте.
You actually make it appear so easy along with your presentation but
I in finding this matter to be really something which I
think I’d by no means understand. It sort of feels too complicated and very large for me.
I am looking forward for your next post, I’ll attempt to
get the dangle of it!
[u][b] Привет, друзья![/b][/u]
Купить диплом о высшем образовании:
[url=http://ноутбук-ремонт.рф/forum/viewtopic.php?t=3308/]ноутбук-ремонт.рф/forum/viewtopic.php?t=3308[/url]
[url=http://knx-fr.com/member.php?action=profile&uid=10130/]knx-fr.com/member.php?action=profile&uid=10130[/url]
[url=http://zamok.druzya.org/index.php?/topic/64137-купить-диплом-цена-s445w//]zamok.druzya.org/index.php?/topic/64137-купить-диплом-цена-s445w/[/url]
[url=http://miupsik.ru/forums/showthread.php?tid=37964/]miupsik.ru/forums/showthread.php?tid=37964[/url]
[url=http://ledsoft.ru/forum/?PAGE_NAME=message&FID=5&TID=13698&TITLE_SEO=13698-diplomandoci&MID=14490&result=new#message14490/]ledsoft.ru/forum/?PAGE_NAME=message&FID=5&TID=13698&TITLE_SEO=13698-diplomandoci&MID=14490&result=new#message14490[/url]
жіЁж„Џ
It is appropriate time to make some plans for the future and it’s time to be
happy. I have read this post and if I could I wish
to suggest you some interesting things or tips.
Perhaps you can write next articles referring to this
article. I wish to read even more things about it!
ליווי בחיפה אז עם סיבה או בלי סיבה, פשוט הזמן עכשיו נערות ליווי בחיפה והן ידאגו שיהיה לך טוב. הנערות מגיעות עד אלייך, וזה יכול שתתפרק מרוב עונג. ואתה יודע מה הכי כיף? ניתן ליהנות מהשירות של דירות דיסקרטיות בבאר שבע בכל יום ובכל שעה. לא משנה אם זה סוף דירות דיסקרטיות אתיופיות
Hey! I could have sworn I’ve been to this blog before but
after reading through some of the post I realized it’s new to me.
Nonetheless, I’m definitely delighted I found it and I’ll be
bookmarking and checking back frequently!
符號
微笑
Как официально купить аттестат 11 класса с упрощенным обучением в Москве
[url=http://diplomyx.com/kupit-diplom-magistra/]diplomyx.com/kupit-diplom-magistra[/url]
иЃІйџі
[b]Приобрести диплом о высшем образовании.[/b]
[url=http://galantclub.od.ua/member.php?u=15983/]galantclub.od.ua/member.php?u=15983[/url]
[url=http://kharkov-balka.com/member.php?u=5538/]kharkov-balka.com/member.php?u=5538[/url]
[url=http://ya.webtalk.ru/viewtopic.php?id=9651#p47259/]ya.webtalk.ru/viewtopic.php?id=9651#p47259[/url]
[url=http://volnodumie.bbmy.ru/viewtopic.php?id=12978#p26528/]volnodumie.bbmy.ru/viewtopic.php?id=12978#p26528[/url]
[url=http://allsportime.ru/kak-kupit-diplom-bez-lishnih-hlopot/]allsportime.ru/kak-kupit-diplom-bez-lishnih-hlopot[/url]
Зайдите на сайт BinTradeClub https://bintradeclub.space/ – надежного брокера бинарных опционов, который, если у вас нет опыта, начать торговлю и даст знания, в ом числе демо счет. А если вы опытный трейдер – предоставит все необходимые инструменты для выгодной торговли. Подробнее на сайте.
[u][b] Привет, друзья![/b][/u]
Купить документ о получении высшего образования
[url=http://loveyou.az/read-blog/151/]loveyou.az/read-blog/151[/url]
[url=http://sonnick84.blogdiloz.com/27749916/Выбираем-надежный-и-проверенный-онлайн-магазин-для-покупки-диплома/]sonnick84.blogdiloz.com/27749916/Выбираем-надежный-и-проверенный-онлайн-магазин-для-покупки-диплома[/url]
[url=http://refine.live/events/event/15-быстрый-поиск-магазина-что-реализует-дипломы-и-аттестаты//]refine.live/events/event/15-быстрый-поиск-магазина-что-реализует-дипломы-и-аттестаты/[/url]
[url=http://savico.com.br/read-blog/247/]savico.com.br/read-blog/247[/url]
[url=http://sonnick84.is-blog.com/34475153/Отличный-магазин-с-выгодными-по-цене-документами/]sonnick84.is-blog.com/34475153/Отличный-магазин-с-выгодными-по-цене-документами[/url]
[u][b] Добрый день![/b][/u]
Мы предлагаем дипломы.
[url=http://motmarket.ru/forum/user/25091//]motmarket.ru/forum/user/25091/[/url]
[url=http://shuvalduet.getbb.ru/viewtopic.php?f=3&t=570/]shuvalduet.getbb.ru/viewtopic.php?f=3&t=570[/url]
[url=http://fabnews.ru/forum/showthread.php?p=79708#post79708/]fabnews.ru/forum/showthread.php?p=79708#post79708[/url]
[url=http://forum54.4adm.ru/viewtopic.php?f=69&t=8433/]forum54.4adm.ru/viewtopic.php?f=69&t=8433[/url]
[url=http://funchange.getbb.ru/viewtopic.php?f=8&t=1351/]funchange.getbb.ru/viewtopic.php?f=8&t=1351[/url]
[u][b] Добрый день![/b][/u]
Заказать документ ВУЗа вы сможете в нашей компании. Мы оказываем услуги по изготовлению и продаже документов об окончании любых ВУЗов России.
[url=http://ssd-astra.ru/forum/viewtopic.php?f=14&t=7009/]ssd-astra.ru/forum/viewtopic.php?f=14&t=7009[/url]
[url=http://www.fromearth.kr/bbs/board.php?bo_table=free&wr_id=447850/]www.fromearth.kr/bbs/board.php?bo_table=free&wr_id=447850[/url]
[url=http://ekopromkonsalt.ru/index.php?subaction=userinfo&user=asyqitum/]ekopromkonsalt.ru/index.php?subaction=userinfo&user=asyqitum[/url]
[url=http://www.amatagroup.ru/forum/messages/forum1/topic59/message357308/?result=reply#message357308/]www.amatagroup.ru/forum/messages/forum1/topic59/message357308/?result=reply#message357308[/url]
[url=http://wwassociation.ru/user/11432/]wwassociation.ru/user/11432[/url]
[u][b] Привет, друзья![/b][/u]
Заказать документ института.
[url=http://spletninews.ru/garantirovannoe-oformlenie-diploma-pod-klyuch/]spletninews.ru/garantirovannoe-oformlenie-diploma-pod-klyuch[/url]
[url=http://jeepgarage.ru/forum/topic.php?forum=24&topic=764/]jeepgarage.ru/forum/topic.php?forum=24&topic=764[/url]
[url=http://mymotospeed.ru/uspeh-bez-usiliy-poluchite-diplom-uzhe-segodnya/]mymotospeed.ru/uspeh-bez-usiliy-poluchite-diplom-uzhe-segodnya[/url]
[url=http://o91707v5.beget.tech/2024/07/15/diplomy-s-garantiey-oficialnosti.html/]o91707v5.beget.tech/2024/07/15/diplomy-s-garantiey-oficialnosti.html[/url]
[url=http://yaoisennari.ekafe.ru/viewtopic.php?f=169&t=1787/]yaoisennari.ekafe.ru/viewtopic.php?f=169&t=1787[/url]
ењ°ж–№
בדירות הדיסקרטיות תוכל למצוא נערות בעלות מראה שיגרום לך להתרגש. לכולן גוף סקסי ומפתה, מהסוג שאתה רגיל לראות רק בסרטים. ולא רק בילוי כפי שגברים אוהבים, וזה בדיוק מה שאתה צריך עכשיו. שמירה על אורח חיים בריא זה לא רק לעשות ספורט ולאכול ירקות. שמירה על try this
The Hidden Account Regarding Solana’s Architect Toly Yakovenko’s Success
Post A Couple of Servings of Java plus a Beer
Toly Yakovenko, the mastermind behind Solana, began his venture with a simple ritual – coffee and beer. Unbeknownst to him, these occasions would trigger the cogs of his journey. At present, Solana stands as a significant participant in the cryptocurrency sphere, with a worth in billions.
Initial Ethereum ETF Sales
The Ethereum exchange-traded fund just started with an impressive trade volume. This significant event experienced various spot Ethereum ETFs from several issuers be listed on American exchanges, injecting significant activity into the generally calm ETF trading market.
Ethereum ETF Approval by SEC
The Securities and Exchange Commission has sanctioned the Ethereum ETF for listing. Being a cryptographic asset featuring smart contracts, Ethereum is anticipated to deeply influence on the cryptocurrency industry due to this approval.
Trump’s Crypto Maneuver
With the upcoming election, Trump positions himself as the ‘Cryptocurrency President,’ repeatedly showing his support for the cryptocurrency industry to garner votes. His strategy contrasts with Biden’s approach, targeting the interest of the blockchain community.
Elon Musk’s Crypto Moves
Elon, a prominent figure in the blockchain world and a proponent of Trump’s agenda, shook things up once again, driving a meme coin connected to his actions. His participation keeps influencing the market environment.
Binance’s Latest Moves
Binance’s subsidiary, BAM, has been permitted to invest customer funds in U.S. Treasury securities. In addition, Binance marked its 7th year, showcasing its journey and acquiring several compliance licenses. At the same time, the company also disclosed plans to remove several major crypto trading pairs, affecting different market players.
AI and Economic Trends
Goldman Sachs’ top stock analyst recently observed that artificial intelligence won’t lead to an economic revolution
ж©џе™Ё
з™Ѕи‰Ізљ„
йЂІйљЋзљ„
Записаться на прием к урологу Москва cecilplus.ru
Если Вы хотели найти [url=https://cecilplus.ru/medicalservices/detail/nevrologiya/]неврология в москве[/url] в сети интернет, то вы на правильном пути. Наши специалисты на cecilplus.ru обязательно Вам помогут, ведь у них большой опыт и регулярные повышения в своей сфере. Будем рады Вам оказать помощь обрести здоровое тело, побороть болезнь и жить счастливой жизнью!
Ищите хоккейную экипировку? Зайдите на https://first-hockey.ru/ где вы сможете выбрать из широкого ассортимента, пол лучшим ценам и купить с доставкой в интернет магазине Первый-Хоккейный: клюшки, коньки, нагрудники хоккейные, налокотники, краги, шлемы и щитки хоккейные и многое другое. Доставка по всей России.
Glory Casino
[u][b] Добрый день![/b][/u]
Мы предлагаем документы ВУЗов
[url=http://shoptema.ru/forum/topic/32739//]shoptema.ru/forum/topic/32739/[/url]
[url=http://vseogirls.ru/byistroe-poluchenie-diploma-onlayn/]vseogirls.ru/byistroe-poluchenie-diploma-onlayn[/url]
[url=http://kizm.flybb.ru/viewtopic.php?f=34&t=656/]kizm.flybb.ru/viewtopic.php?f=34&t=656[/url]
[url=http://grot.getbb.ru/viewtopic.php?f=6&t=1074/]grot.getbb.ru/viewtopic.php?f=6&t=1074[/url]
[url=http://dimitrii.flybb.ru/viewtopic.php?f=29&t=964/]dimitrii.flybb.ru/viewtopic.php?f=29&t=964[/url]
עצמינו. ויש גם את הרגעים שבהם אנו שמחים ומאושרים, ורוצים עוד יותר להרים את מצב הרוח. נראה כי בשני המקרים תרצו לבלות עם נערות בתל אביב פותחות בפניך דלת לעולם חדש – עולם של הנאה אין סופית והגשמת פנטזיות. זוהי המומחיות שלהן והן עושות זאת בתשוקה רבה. הן visit this website
жІ’жњ‰д»Ђйєј
Future of the Aviator Game
where to buy ivermectin
[u][b] Привет, друзья![/b][/u]
[b]Купить документ[/b] университета вы сможете в нашей компании.
[url=http://ast-diplomy24.ru/kupit-diplom-vracha/]ast-diplomy24.ru/kupit-diplom-vracha[/url]
[b]Успехов в учебе![/b]
зЁ±е‘ј
[u][b] Добрый день![/b][/u]
[b]Как официально купить аттестат 11 класса с упрощенным обучением в Москве[/b]
[url=http://www.manchestercityclubs.com/read-blog/256_kak-kupit-nedorogo-neotlichimyj-ot-podlinnika-diplom-v-internete.html?mode=night/]www.manchestercityclubs.com/read-blog/256_kak-kupit-nedorogo-neotlichimyj-ot-podlinnika-diplom-v-internete.html?mode=night[/url]
一般的
й›ўй–‹
hop over to here [url=https://hamsterkombat.zone]hamster kombat coin[/url]
חשבון גבר, נכון שמתחשק לך לבלות וליהנות ולא לעשות חשבון לכל העולם? בדיוק בשביל זה ישנן דירות דיסקרטיות בתל אביב. מידי יום שום מחויבות. נערות ליווי בחיפה לרגעים יפים בחיים אז גבר ספר לנו איך אתה מרגיש היום? לא בא לך לבלות עם נערות ליווי בחיפה? made my day
how to become a real estate agent illinois [url=https://realestatelicensengdfdgh.com/states/ohio-real-estate-license/]realestatelicensengdfdgh.com/states/ohio-real-estate-license/[/url] how do i get a real estate license realestatelicensengdfdgh.com/states/oregon-island-real-estate-license/ .
ж‹”е‡є
[u][b] Добрый день![/b][/u]
[b]Мы можем предложить дипломы[/b] любой профессии по невысоким тарифам.
[url=http://pdbsoftware.com/2024/06/23/купить-диплом-в-новочеркасске//]pdbsoftware.com/2024/06/23/купить-диплом-в-новочеркасске/[/url]
[u][b] Привет, друзья![/b][/u]
Заказать документ университета
[url=http://diplomasx.com/kupit-diplom-rostov-na-donu]diplomasx.com/kupit-diplom-rostov-na-donu[/url]
[b]Привет![/b]
Официальная покупка диплома вуза с сокращенной программой в Москве
[url=http://arusak-diploms-srednee.ru/kupit-diplom-v-rostove-na-donu В ]arusak-diploms-srednee.ru/kupit-diplom-v-rostove-na-donu В [/url]
еёё
жњЂеѕЊзљ„
Woah! I’m really enjoying the template/theme of this site.
It’s simple, yet effective. A lot of times it’s very difficult to get
that “perfect balance” between user friendliness and visual
appearance. I must say you have done a superb job with this.
Also, the blog loads very quick for me on Opera.
Excellent Blog!
е‡єзЏѕ
На сайте https://mpmgr.ru воспользуйтесь специальным менеджером маркетплейсов для того, чтобы вы автоматизировали и упростили работу с такими маркетплейсами, как Ozon, Wildberries, Яндекс.Маркет. Здесь специально для вас рассчитают поставки, а также будут эффективно управлять рекламой, ответят на отзывы клиентов, отследят товары, помогут рассчитать скидку. Такая услуга сэкономит время специалистов, они смогут заняться более серьезными, ответственными делами. Происходит оптимизация расходов для вашей большей прибыли.
Обеспечьте конфиденциальность с резидентскими прокси, прибегнуть к этим инструментом.
Какие преимущества у резидентских прокси?, узнайте подробностями.
Какой резидентский прокси выбрать?, инструкция для пользователей.
Какие задачи решают резидентские прокси?, узнайте возможностями.
В чем преимущество безопасности резидентских прокси?, обзор функций безопасности.
Как резидентские прокси защищают от опасностей?, рассмотрим важные аспекты.
Как резидентский прокси помогает повысить эффективность?, сравним основные плюсы.
Как быстрее работать в сети с резидентским прокси?, практические советы для оптимизации работы.
Зачем использовать резидентский прокси для сбора информации?, обзор возможностей для парсеров.
Секреты анонимности с резидентским прокси, шаги к безопасности онлайн.
Как расширить свои возможности в соцсетях с резидентским прокси?, подробный обзор функционала.
Зачем арендовать резидентские прокси и какие бонусы?, сравним лучшие варианты.
Способы защиты от DDoS с помощью резидентского прокси, анализируем меры безопасности.
Почему резидентские прокси пользуются популярностью, рассмотрим основные факторы.
Сравнение резидентских и дата-центровых прокси, советы для выбора.
купить резидентские прокси листы [url=https://rezidentnieproksi.ru/]https://rezidentnieproksi.ru/[/url] .
Glory Casino
laptops, tablets, and smartphones. This flexibility allows players to enjoy the game on their preferred device,
cheap ivermectin
иµ·еєЉ
й и…¦
и©©дєє
е№ійќњењ°
купить 2 квартиру новостройке https://kvartirukupit43.ru
купить новую квартиру застройщик купить новую квартиру в новостройке
купить квартиру новостройке застройщика цены недвижимость купить квартиру
africanownews.com
недвижимость новостройки купить купить квартиру в новостройке недорого
квартиры от застройщика жк https://novyekvartiry2.ru
[u][b] Здравствуйте![/b][/u]
[b]Заказать диплом любого университета.[/b]
[url=http://balans.kz/bonus//]balans.kz/bonus/[/url]
[u][b] Привет, друзья![/b][/u]
Приобрести документ института.
[url=http://rodina.listbb.ru/viewtopic.php?f=3&t=650/]rodina.listbb.ru/viewtopic.php?f=3&t=650[/url]
[url=http://forum.stosstrupp-gold-germany.de/viewtopic.php?f=10&t=150043/]forum.stosstrupp-gold-germany.de/viewtopic.php?f=10&t=150043[/url]
[url=http://pc2163.com/viewtopic.php?t=250243/]pc2163.com/viewtopic.php?t=250243[/url]
[url=http://crewties.moibb.ru/viewtopic.php?f=2&t=423/]crewties.moibb.ru/viewtopic.php?f=2&t=423[/url]
[url=http://fbadult.com/blogs/3111/Оформление-диплома-под-ключ-безопасно-и-просто/]fbadult.com/blogs/3111/Оформление-диплома-под-ключ-безопасно-и-просто[/url]
birminghamnews24.com
texas real estate exam [url=http://realestatelicensengdfdgh.com]realestatelicensengdfdgh.com[/url] how can i become a realtor realestatelicensengdfdgh.com/states/ohio-real-estate-license/ .
оборудование для конференц зала купить [url=www.oborudovanie-konferenc-zalov.ru]оборудование для конференц зала купить[/url] .
е»ўи©±
Lottery tickets are deemed to be bearer instruments and the Louisiana State Lottery is not responsible for lost or broken tickets.
My web blog: http://pencilnotes.com/__media__/js/netsoltrademark.php?d=csv.cx%2Fp325h
[u][b] Добрый день![/b][/u]
Приобрести документ института
[url=http://topbazz.com/read-blog/6502_proverennyj-i-nadezhnyj-onlajn-magazin-s-bolshim-vyborom-diplomov.html/]topbazz.com/read-blog/6502_proverennyj-i-nadezhnyj-onlajn-magazin-s-bolshim-vyborom-diplomov.html[/url]
[url=http://menaharia.com/read-blog/2292/]menaharia.com/read-blog/2292[/url]
[url=http://meco.eeconme.com/read-blog/3642/]meco.eeconme.com/read-blog/3642[/url]
[url=http://lebanonhub.app/blogs/2403/Как-можно-будет-быстро-приобрести-аттестат-в-интернет-магазине/]lebanonhub.app/blogs/2403/Как-можно-будет-быстро-приобрести-аттестат-в-интернет-магазине[/url]
[url=http://skoolyard.biz//read-blog/61/]skoolyard.biz//read-blog/61[/url]
ж•ёдЅЌ
еї«йЂџењ°
Лечение наркомании — это сложный и многосторонний процесс, требующий обширного подхода и коллективных усилий как страдающих, так и со стороны специалистов. Однако использование принципов и методов, приведенных выше, может значительно усилить эффективность лечения и помочь пациентам вернуться к здоровой и полноценной жизни.
http://google.ms/url?q=https://mymink.5bb.ru/viewtopic.php?id=8819#p454911
Медицинское лечение наркомании начинается с детоксикации – процедуры очищения организма от наркотических веществ. Этот этап может сопровождаться использованием специальных медикаментов, направленных на уменьшение симптомов отмены и облегчение процесса улучшения. Для поддержания стабильного состояния и снижения привыкания к употреблению наркотиков часто используется заместительная терапия.
更多的
Numerous online casino platforms offer the Aviator Game. These platforms provide a secure and regulated
ivermectin purchase online
[u][b] Привет![/b][/u]
[b]Купить документ[/b] о получении высшего образования вы сможете в нашем сервисе.
[url=http://ast-diplom.com/kupit-diplom-bakalavra-ili-specialista /]ast-diplom.com/kupit-diplom-bakalavra-ili-specialista [/url]
Hiya! I know this is kinda off topic however , I’d
figured I’d ask. Would you be interested in exchanging links or maybe
guest writing a blog post or vice-versa? My blog goes over a lot
of the same topics as yours and I believe we could greatly benefit
from each other. If you are interested feel free to shoot me an e-mail.
I look forward to hearing from you! Excellent blog by the way!
е†·йќњзљ„
[u][b] Здравствуйте![/b][/u]
Заказать диплом университета
[b]Наша компания предлагает[/b] быстро купить диплом, который выполняется на бланке ГОЗНАКа и заверен мокрыми печатями, водяными знаками, подписями. Данный документ способен пройти любые проверки, даже с использованием специального оборудования. Достигайте свои цели максимально быстро с нашим сервисом.
[b]Где купить диплом по нужной специальности?[/b]
[url=http://notebooks.ru/forum/user/65349//]notebooks.ru/forum/user/65349/[/url]
[url=http://shockmusik.ru/nastoyashhie-diplomyi-kachestvo-i-bezopasnost/]shockmusik.ru/nastoyashhie-diplomyi-kachestvo-i-bezopasnost[/url]
[url=http://uconnect.ae/read-blog/81309/]uconnect.ae/read-blog/81309[/url]
[url=http://letterboxd.com/sonnick84/list/filmlist:48603192//]letterboxd.com/sonnick84/list/filmlist:48603192/[/url]
[url=http://breyerhorses.ru/personal/profile/?register=yes/]breyerhorses.ru/personal/profile/?register=yes[/url]
и»Љ
жµ·
На сайте https://travamana.ru/ представлены ароматные, приятные травяные чаи. Они полностью натуральные, приготовлены из редких и популярных растений, трав, которые произрастают в России. В уютном магазинчике можно приобрести специи, подарки, зарядиться приятными и положительными эмоциями, ощутить радость и покой. Компетентные консультанты дадут совет, что лучше всего приобрести в каждом конкретном случае. Есть успокаивающие сборы, для иммунитета, гинекологические. Если вы подбираете подарок для близкого человека, то здесь вы найдете все самое необходимое.
Bonus bez depozytu lub innymi slowami darmowy bonus to nic innego jak gratis oferowany przez kasyna online dla swoich graczy [url=https://polscekasyno.pl/bonusy-bez-depozytu/bonus-bez-depozytu-100-ds/]vavada darmowe spiny[/url]
На сайте https://thailand-company.ru/ вы узнаете о том, как правильно открыть компанию в Таиланде и какие ресурсы необходимо для этого использовать. При этом владелец компании в Таиланде может быть с любым гражданством. К важным преимуществам открытия бизнеса в Таиланде относят то, что здесь всегда растущий рынок, а регистрация не требует большого количества документов и не занимает много времени. Компания, которая зарегистрирована в Таиланде, идеальна для ведения международного бизнеса. На сайте вы узнаете и о самом процессе регистрации.
見面
[u][b] Здравствуйте![/b][/u]
Мы можем предложить документы техникумов
[url=http://uktuliza.ru/forum/?PAGE_NAME=profile_view&UID=17802/]uktuliza.ru/forum/?PAGE_NAME=profile_view&UID=17802[/url]
[url=http://eurodelo.ru/poluchite-diplom-bez-lishnih-hlopot/]eurodelo.ru/poluchite-diplom-bez-lishnih-hlopot[/url]
[url=http://kolhos.listbb.ru/viewtopic.php?f=2&t=637/]kolhos.listbb.ru/viewtopic.php?f=2&t=637[/url]
[url=http://toursoul.ru/?p=19237/]toursoul.ru/?p=19237[/url]
[url=http://2cool.ru/qiwi-f215/bistroe-oformlenie-diplomov-na-zakaz-t3829.html/]2cool.ru/qiwi-f215/bistroe-oformlenie-diplomov-na-zakaz-t3829.html[/url]
купить квартиру в новостройке с ремонтом квартиру новостройку жк купить
купить квартиру недорого https://zastroyshikekb54.ru
[u][b] Здравствуйте![/b][/u]
[b]Мы изготавливаем дипломы[/b] любой профессии по выгодным ценам.
[url=http://www.hhicecream.com/2024/06/речной-диплом-купить//]www.hhicecream.com/2024/06/речной-диплом-купить/[/url]
This ensures you have access to the really finest in terms of worth and fairness.
Look into my web site :: 토토친구
купить новостройку недорого квартиры от застройщика цены жк
הזדמנות עבור הגבר לנקות את הראש, להיפטר מכל הלחצים ופשוט ליהנות ממה שיש לחיים האלו להציע. והחיים האלו מציעים לך הרבה מאוד, לסמוך על הדיסקרטיות, לא סתם מכנים אותן דירות דיסקרטיות בתל אביב. ניתן להגיע ולבלות כאן מבלי לחשוש. אם מגיעים לכאן גברים נשואים איתור שירותי ליווי אילת בהתאמה אישית
[u][b] Здравствуйте![/b][/u]
[b]Приобрести документ[/b] университета вы сможете в нашем сервисе.
[url=http://asxdiplomik.com/kupit-diplom-o-srednem-obrazovanii/]asxdiplomik.com/kupit-diplom-o-srednem-obrazovanii[/url]
[b]Успешной учебы![/b]
й‡Ќй‡Џ
[url=https://all3dp.com.ua/filament-plastik-dlya-3d-printera]Филамент пластик для 3Д принтера[/url] – 3D-принтери FDM, тпу пластик
Staying Calm: Keeping a cool head and avoiding impulsive decisions during gameplay.
ivermectin buy
купить квартиру в новостройке https://kvartira-novostroi.ru
купить квартиру от застройщика https://kvartiranovostroi2.ru
[u][b] Добрый день![/b][/u]
[b]Как получить диплом техникума с упрощенным обучением в Москве официально [/b]
[url=http://vk.com/prymechatel?w=wall-147947644_398/]vk.com/prymechatel?w=wall-147947644_398[/url]
[u][b] Рады помочь![u][b].
[u][b] Привет, друзья![/b][/u]
[b]Мы предлагаем дипломы[/b] любой профессии по приятным тарифам.
[url=http://naya.social/read-blog/81/]naya.social/read-blog/81[/url]
[url=http://ourfamilylync.com/read-blog/4419/]ourfamilylync.com/read-blog/4419[/url]
[url=http://hulu-com-forgot.mn.co/posts/61724499/]hulu-com-forgot.mn.co/posts/61724499[/url]
[url=http://forum.mulegendreload.net/index.php?/gallery/image/214-почему-гораздо-дешевле-будет-приобрести-диплом-вуза//]forum.mulegendreload.net/index.php?/gallery/image/214-почему-гораздо-дешевле-будет-приобрести-диплом-вуза/[/url]
[url=http://datasphere.ru/club/user/12/blog/4362//]datasphere.ru/club/user/12/blog/4362/[/url]
Because the business is so competitive, these platforms must continually develop their promotional packages to draw and keep gamers.
their website https://hamsterkombat.zone
I seriously love your site.. Pleasant colors & theme. Did you make this web site yourself?
Please reply back as I’m trying to create my own blog and
would like to learn where you got this from or exactly what the theme is called.
Cheers!
Les jeux de casino gratuits sont également un excellent moyen de se divertir et de passer du bon temps.
оснащение переговорных комнат [url=www.oborudovanie-dlja-peregovornoj-komnaty.ru]оснащение переговорных комнат[/url] .
אתה תוכל ליהנות מגופן במהלך בילוי אינטימי עמוק ובלתי נשכח. זהו בדיוק הבילוי שאתה צריך עכשיו, זה מה שהגוף שלך מבקש עכשיו. נערות שחזרו הביתה לסוף השבוע ורוצים קצת לפרוק את הלחץ מהצבא. לפעמים אלו הם גברים נשואים שקיבלו סוף סוף חופש מהאישה ונותרו לבד בביתם. מספרים של זונות
https://www.d.umn.edu/itss/training/online/webdesign/tools.html
What i do not realize is in fact how you’re no longer really
much more smartly-appreciated than you might be right now.
You’re very intelligent. You realize therefore considerably in relation to this topic, made me in my opinion imagine it
from a lot of numerous angles. Its like women and men aren’t involved except it is something
to do with Girl gaga! Your personal stuffs nice. At all times
care for it up!
Variety: Access to a wide range of betting options and gameplay modes.
ivermectin cheap
жі•еѕ‹
As soon as you land on tthe bettinng site page, you
will be prompted to choose your state and sign-up.
my page; pt.wiki.guifi.net
купить 2 комнатную квартиру квартира в новостройке от застройщика
Помощь в решении задач https://zadachireshaem-online.ru. Опытные авторы с профессиональной подготовкой окажут консультацию в решении задач на заказ недорого, быстро, качественно
Заказать контрольную работу https://kontrolnye-reshim.ru, недорого, цены. Решение контрольных работ на заказ срочно.
[u][b] Привет, друзья![/b][/u]
[b]Приобрести диплом о высшем образовании.[/b]
[url=http://arikkeu.com/g5/bbs/board.php?bo_table=arikkeu1234_&wr_id=82313/]arikkeu.com/g5/bbs/board.php?bo_table=arikkeu1234_&wr_id=82313[/url]
[url=http://obozrevatelevents.ru/page/3//]obozrevatelevents.ru/page/3/[/url]
[url=http://thesocialmusic.co.uk/blogs/7254/Основные-затраты-российского-производителя-дипломов-обзор//]thesocialmusic.co.uk/blogs/7254/Основные-затраты-российского-производителя-дипломов-обзор/[/url]
[url=http://tonythang.dev/blogs/94/Что-нужно-для-изготовления-неотличимого-от-оригинала-диплома?lang=fr_fr/]tonythang.dev/blogs/94/Что-нужно-для-изготовления-неотличимого-от-оригинала-диплома?lang=fr_fr[/url]
[url=http://designlight.co.kr/g5/bbs/board.php?bo_table=ieahqtqy2g&wr_id=2271/]designlight.co.kr/g5/bbs/board.php?bo_table=ieahqtqy2g&wr_id=2271[/url]
еЅ±еѓЏ
I was very happy to uncover this website. I want to to
thank you for your time for this fantastic read!!
I definitely liked every part of it and i also have you book-marked to check out
new stuff in your website.
ијѓе°‘зљ„
жЃђжЂ–
I used to be suggested this website by means of my cousin.
I’m not certain whether or not this put up is written by him as nobody
else realize such special about my problem. You are incredible!
Thanks!
переговорная комната под ключ [url=http://www.oborudovanie-peregovornyh-komnat.ru]переговорная комната под ключ[/url] .
[u][b] Добрый день![/b][/u]
[b]Приобрести диплом любого университета.[/b]
[url=http://anamaliya.ru/otzyvy/shirokiy-assortiment-dokumentov-v-populyarnom-onlayn-magazine/]anamaliya.ru/otzyvy/shirokiy-assortiment-dokumentov-v-populyarnom-onlayn-magazine[/url]
в личном кабинете удобнее сразу указать недостающие данные: имя, фамилию, дату рождения, адрес проживания, зеркало покердом телефонный.
Here is my site; https://mywallart.com.vn/pokerdom-promokody-obzory-i-bonusy-v-kazino/
Заказать курсовую работу https://kursovye-napishem.ru в Москве: цены на написание и выполнение, недорого
е ґж™Ї
Заказать дипломную работу https://diplomzakazat-oline.ru недорого. Дипломные работы на заказ с гарантией.
I just like the valuable information you provide in your articles.
I’ll bookmark your blog and take a look at
again here frequently. I am rather certain I’ll learn many
new stuff right right here! Best of luck for the following!
иѓЅ
[u][b] Здравствуйте![/b][/u]
Как не попасть впросак при покупке диплома колледжа или ПТУ в России
[url=http://property25.org/где-купить-диплом-о-высшем-образовани//]property25.org/где-купить-диплом-о-высшем-образовани/[/url]
Всегда вам поможем!.
жњЂеѕЊзљ„
[u][b] Здравствуйте![/b][/u]
Приобрести диплом ВУЗа
[url=http://fire-team.ru/forum/member.php?u=1143/]fire-team.ru/forum/member.php?u=1143[/url]
[url=http://arsenal.listbb.ru/viewtopic.php?f=14&t=472/]arsenal.listbb.ru/viewtopic.php?f=14&t=472[/url]
[url=http://refine.live/events/event/17-большая-популярность-интернет-магазинов-что-предлагают-дипломы//]refine.live/events/event/17-большая-популярность-интернет-магазинов-что-предлагают-дипломы/[/url]
[url=http://pdlspd.listbb.ru/viewtopic.php?f=3&t=462/]pdlspd.listbb.ru/viewtopic.php?f=3&t=462[/url]
[url=http://chumcity.xyz/read-blog/1608/]chumcity.xyz/read-blog/1608[/url]
Аттестат 11 класса купить официально с упрощенным обучением в Москве
[url=http://derivsocial.org/read-blog/2583/]derivsocial.org/read-blog/2583[/url]
[url=http://hvacprotalk.com/read-blog/220/]hvacprotalk.com/read-blog/220[/url]
[url=http://cartagena.activeboard.com/forum.spark/]cartagena.activeboard.com/forum.spark[/url]
[url=http://mazafakas.com/user/profile/3954619/]mazafakas.com/user/profile/3954619[/url]
[url=http://turservisnews.ru/garantiya-polucheniya-diploma-byistro-i-nadezhno/]turservisnews.ru/garantiya-polucheniya-diploma-byistro-i-nadezhno[/url]
еЏёжњє
mosesolmos.com
The Aviator Game boasts several unique features that set it apart from other online casino games:
ivermectin for sale
angliannews.com
[u][b] Здравствуйте![/b][/u]
[b]Заказать документ[/b] о получении высшего образования вы сможете в нашем сервисе.
[url=http://diplomasx.com/kupit-diplom-krasnoyarsk/]diplomasx.com/kupit-diplom-krasnoyarsk[/url]
[b]Успехов в учебе![/b]
[url=https://mellanin.ru/categories/nizhnee-bele]магазин купальников[/url] – купальник женский купить в москве, фиолетовые купальники купить
מרוכז בתחושת הנעימות של הגוף. אז אם בא לך ליהנות הלילה, ולהרגיש חלק מאותו מועדון אקסקלוסיבי של גברים אשר יודעים ליהנות מהחיים, מזמינים את הנערות היפות, הן נותנות את כל מה שהן יכולות על מנת לגרום לגבר עונג. הן משתמשות בכל גופן על מנת לרגש את הגבר. ויש להן try this
[u][b] Здравствуйте![/b][/u]
[b]Купить документ[/b] о получении высшего образования вы имеете возможность у нас в столице.
[url=http://diploms-x.com/kupit-diplom-specialista /]diploms-x.com/kupit-diplom-specialista [/url]
й›ўй–‹
купить диплом физрука [url=https://mandiplomik.ru/]mandiplomik.ru[/url] .
[u][b] Добрый день![/b][/u]
Мы предлагаем документы техникумов
[url=http://noo.by/wiki/Ваш_успех_начинается_с_диплома/]noo.by/wiki/Ваш_успех_начинается_с_диплома[/url]
[url=http://deadreckoninggame.com/index.php/диплом_о_высшем_образовании:_ваши_новые_перспективы/]deadreckoninggame.com/index.php/диплом_о_высшем_образовании:_ваши_новые_перспективы[/url]
[url=http://veneraroleplay.listbb.ru/viewtopic.php?f=4&t=329/]veneraroleplay.listbb.ru/viewtopic.php?f=4&t=329[/url]
[url=http://lapd.getbb.ru/viewtopic.php?f=5&t=458/]lapd.getbb.ru/viewtopic.php?f=5&t=458[/url]
[url=http://mindclub.online/wiki/index.php/дипломы_всех_уровней_по_доступным_ценам/]mindclub.online/wiki/index.php/дипломы_всех_уровней_по_доступным_ценам[/url]
規則
Accessibility Team Meeting Notes https://make.wordpress.org/accessibility/2021/06/11/accessibility-team-meeting-notes-june-11-2021
Красивая музыка https://melodia.space для души слушать онлайн.
еЏЌе°Ќ
科еёзљ„
Уролог в Москве cecilplus.ru
Если Вы искали [url=https://cecilplus.ru/medicalservices/detail/urologiya/]уролог в москве цены[/url] в сети интернет, то вы на нужном пути. Наши специалисты на cecilplus.ru обязательно Вам окажут помощь, ведь у них колоссальный опыт и регулярные повышения в своей сфере. Будем счастливы Вам оказать помощь обрести здоровье, побороть недуг и жить полной жизнью!
Играете на мобильных устройствах и хотите получать щедрые бонусы? Telegram канал [url=https://t.me/s/topcasino_rus]лучшие онлайн казино для мобильных устройств[/url] представляет лучшие мобильные казино, где дают 100% бонус к депозиту. Играйте на рубли с мгновенным выводом на любую карту банка РФ. Все казино имеют лицензию и обеспечивают честные выигрыши.
Эти платформы предлагают удобные мобильные версии и приложения. Подписывайтесь на канал, чтобы узнавать о лучших предложениях и наслаждаться игрой в мобильных казино с реальными выигрышами!
שבע הן סביבה נעימה שבה ישנן נערות סקסיות ברמה בינלאומית. והן מביאות איתן הרבה קסם נשי וחושניות, ומבטאות זאת בטיפולי גוף מענגים דירות דיסקרטיות בחיפה הן לא סתם מקום שאתה רוצה להיות בו. זהו המקום שבו אתה פשוט חייב להיות. נערות ליווי בתל אביב להנאה more info here
еђ‘дё‹
Puis, il suffit de vous rendre dans la section caisse, solde ou paiement de ce compte joueur.
הגבר הנשוי שבא לו לגוון ולבלות עם בחורה צעירה, אבל אין לו את ההזדמנות לעשות זאת בגלל המשפחה שבבית. ולפעמים אלו הם חיילים צעירים מהם. אבל יש רק סוג אחד של בילוי שבאמת גורם לגבר להיות רגוע. יש רק בילוי אחד שיודע לנקות את הראש ממחשבות, ולהרפות את הגוף. navigate to this web-site
иЂЃдєє
зњ‹
The scoring system in the Aviator Game is based on the multiplier at the time of cashing out. The higher the
ivermectin purchase online
жЎ‘
להזמין את הנערות לביתם או לבית המלון ולשמור על פרטיות מלאה. להגשים פנטזיות עם נערות ליווי בתל אביב לכל גבר יש את הפנטזיות בילוי עם נערות ליווי מתאים לכל רגע בחיים. יש את הרגעים שאנו מרגישים קצת למטה, הרגעים שבהם אנו קצת עצובים ולא יודעים מה לעשות עם look these up
Охраняйте свою конфиденциальность с резидентскими прокси, для чего это нужно.
Получите доступ к контенту из других стран с резидентскими прокси, пользуйтесь контентом.
Увеличьте скорость и стабильность интернет-соединения с резидентскими прокси, как это работает.
Скройте свой реальный IP-адрес от хакеров с резидентскими прокси, и будьте уверены в своей безопасности.
Прячьте свою локацию и IP-адрес с резидентскими прокси, и чувствуйте себя невидимкой.
Скачивайте файлы анонимно через резидентские прокси, и не тревожьтесь за свою приватность.
резидентский прокси [url=https://rezidentnie-proksi.ru/]https://rezidentnie-proksi.ru/[/url] .
Помощь студентам в выполнении рефератов https://referatkupit-oline.ru. Низкие цены и быстрое написание рефератов!
seo реклама заказать продвижение сайта сео
сколько стоит продвижение сайта и оптимизация сайта продвижение сайта казань
สล็อตเว็บตรง
特別的
[u][b] Добрый день![/b][/u]
Купить диплом академии
[url=http://newsato.ru/byistroe-poluchenie-diploma-bez-byurokratii-2/]newsato.ru/byistroe-poluchenie-diploma-bez-byurokratii-2[/url]
[url=http://o91746bp.beget.tech/2024/07/19/vash-put-k-uspehu-s-diplomom.html/]o91746bp.beget.tech/2024/07/19/vash-put-k-uspehu-s-diplomom.html[/url]
[url=http://d91652pj.beget.tech/2024/07/18/diplomy-s-garantiey-kachestva-i-nadezhnosti.html/]d91652pj.beget.tech/2024/07/18/diplomy-s-garantiey-kachestva-i-nadezhnosti.html[/url]
[url=http://montrealpal.com/read-blog/1150/]montrealpal.com/read-blog/1150[/url]
[url=http://markusragger.at/chess/index.php/kforum/jm-corporate-template/654128-xbmila-8-as-well-as-symptoms-and-furthermore-joins/]markusragger.at/chess/index.php/kforum/jm-corporate-template/654128-xbmila-8-as-well-as-symptoms-and-furthermore-joins[/url]
жњ‰зЅЄзљ„
駕駛
ואולי אפילו אסייתיות. ולכל נערה גישה ייחודית שבא היא מפנקת את הגבר. לכל הנערות גוף יפה ומושלם שאותו הן מטפחות במיוחד עבורך. מזמינים את הנערות היפות, הן נותנות את כל מה שהן יכולות על מנת לגרום לגבר עונג. הן משתמשות בכל גופן על מנת לרגש את הגבר. ויש להן נערות ליווי מבוגרות
еѕ€еї«
е–Љ
דירות דיסקרטיות בבאר שבע, תוכל למצוא בהן נערות חינניות ומלאות ביופי. אתה תוכל לבחור את הנערה שאיתה תרצה לבלות, ויחדיו תוכלו מעניקות בילוי נעים ומפנק לגברים, ודואגות כמובן לשמור על הדיסקרטיות. רמת השירות בתל אביב היא רמה גבוהה. ניתן למצוא כאן נערות i loved this
whether at home or on the go.
ivermectin cheap
еѕ€е¤љ
еЅ·еЅї
ж•µдєє
[u][b] Здравствуйте![/b][/u]
Купить документ о получении высшего образования.
[url=http://l90226mw.beget.tech/2024/07/15/ekspress-oformlenie-diplomov.html/]l90226mw.beget.tech/2024/07/15/ekspress-oformlenie-diplomov.html[/url]
[url=http://wheeoo.com/read-blog/14457/]wheeoo.com/read-blog/14457[/url]
[url=http://brawlstarsacc.listbb.ru/viewtopic.php?f=3&t=487/]brawlstarsacc.listbb.ru/viewtopic.php?f=3&t=487[/url]
[url=http://crystalroleplay.listbb.ru/viewtopic.php?f=14&t=2499/]crystalroleplay.listbb.ru/viewtopic.php?f=14&t=2499[/url]
[url=http://590909.ru/users/74/]590909.ru/users/74[/url]
สำหรับแฟนบอล ที่ต้องการติดตามการแข่งขันฟุตบอลแบบสด ๆ ไม่ควรพลาด doofootball (http://molbiol.ru/).asia เว็บไซต์ที่ได้รับความนิยมสำหรับการสตรีมมิ่งฟุตบอล
แพลตฟอร์มนี้ให้บริการการรับชมฟุตบอลที่มีคุณภาพ พร้อมกับข้อมูลการแข่งขัน ที่อัปเดตตลอดเวลา ผู้ชมสามารถเพลิดเพลินกับเกมการแข่งขันจากลีกชั้นนำทั่วโลก
เข้าชมได้เลย เข้าไปที่ doofootball.asia วันนี้ เพื่อค้นพบประสบการณ์การรับชมฟุตบอลที่เหนือชั้น ติดตามทุกนัดที่คุณชื่นชอบ
з•ўз«џ
Считаете, что играть на смартфоне неудобно? Telegram канал [url=https://t.me/s/topcasino_rus]лучшие онлайн казино с бонусами и лицензией[/url] разрушит ваши стереотипы! Эти лучшие онлайн казино для смартфонов предлагают не только удобный интерфейс, но и мгновенные выплаты с 100% бонусом к депозиту.
Играйте на рубли и выводите выигрыши на карты банков РФ мгновенно. Более 10 проверенных казино ждут вас с лучшими предложениями. Не упустите шанс оценить удобство мобильной игры и щедрость бонусов!
еѕЊйЂЂ
[u][b] Привет, друзья![/b][/u]
Купить документ ВУЗа вы сможете у нас. Мы оказываем услуги по изготовлению и продаже документов об окончании любых ВУЗов Российской Федерации.
[url=http://vip-forum.com/threads/kupit-diplom-o-vysshem-obrazovanii-k35o.1803//]vip-forum.com/threads/kupit-diplom-o-vysshem-obrazovanii-k35o.1803/[/url]
[url=http://www.ekspoteh.ru/index.php?name=account&op=info&uname=enora/]www.ekspoteh.ru/index.php?name=account&op=info&uname=enora[/url]
[url=http://knigigo.ru/forums/topic/kupit-diplom-f30o//]knigigo.ru/forums/topic/kupit-diplom-f30o/[/url]
[url=http://www.sskyn.com/home-uid-83477.html/]www.sskyn.com/home-uid-83477.html[/url]
[url=http://forum.teens4greece.com/main3/viewtopic.php?f=31&t=2&p=1671#p1671/]forum.teens4greece.com/main3/viewtopic.php?f=31&t=2&p=1671#p1671[/url]
熱的
еЃњз•™
Convenience: Play from the comfort of your home or on the go.
ivermectin buy
и¬ќи¬ќ
иЂіжњµ
[u][b] Добрый день![/b][/u]
Купить диплом о высшем образовании:
[url=http://dvnshu.com/index.php?subaction=userinfo&user=exytuviwi/]dvnshu.com/index.php?subaction=userinfo&user=exytuviwi[/url]
[url=http://cargo-200.ru/index.php?subaction=userinfo&user=oqotyhyx/]cargo-200.ru/index.php?subaction=userinfo&user=oqotyhyx[/url]
[url=http://g95183sh.bget.ru/users/yvogugo/]g95183sh.bget.ru/users/yvogugo[/url]
[url=http://doktorpishet.ru/index.php?subaction=userinfo&user=oniliti/]doktorpishet.ru/index.php?subaction=userinfo&user=oniliti[/url]
[url=http://dianov.bget.ru/forum/thread57506.html#1281078/]dianov.bget.ru/forum/thread57506.html#1281078[/url]
[u][b] Привет, друзья![/b][/u]
[b]Купить документ[/b] о получении высшего образования вы можете у нас в столице.
[url=http://diplomasx.com/kupit-diplom-sankt-peterburg/]diplomasx.com/kupit-diplom-sankt-peterburg[/url]
[b]Удачи![/b]
д»Јж›ї
дёЂз™ѕ
Бесплатный сервис по подбору и ведению сделок с недвижимостью в новостройках Москвы и Московской области! Новые квартиры для жизни, дохода или инвестирования от топовых застройщиков с защитой государства [url=https://www.nedvigimost-1.ru/]услуги брокера по недвижимости[/url]
On the website https://intracorp.com.sg/ you will be able to use all the services offered by Intracorp. In Singapore, you can start your own business and live in a big way. This state is the center of commerce, as well as finance, and therefore whatever business you open, it will definitely bear fruit. The team that works in this company is as customer-oriented as possible. She is distinguished by her deep knowledge and understanding of all the nuances. At the same time, the transaction will be accompanied at every stage.
[u][b] Привет, друзья![/b][/u]
Где заказать диплом специалиста?
[url=http://obt.social/blogs/21773/Where-to-buy-a-diploma-at-an-adequate-price?lang=ar_sa/]obt.social/blogs/21773/Where-to-buy-a-diploma-at-an-adequate-price?lang=ar_sa[/url]
דיסקרטיות בתל אביב ונהנים מהחוויה המתוקה והמשחררת. ניתן למצוא דירות ממש מעבר לפינה, והן מציעות לגברים סביבת בילוי בטוחה עם תמצאו בשום מכון ספא יוקרתי – גברים צריכים אישה שיודעת לעבוד על גוף הגבר ולפנק אותו בצורה חזקה ואותנטית עד שיחווה שחרור אמתי. Order erotic massage in Tel Aviv and sex
Thank you for sharing your info. I truly appreciate your efforts and I will be waiting for your further write ups thanks once again.
[u][b] Привет![/b][/u]
Мы можем предложить документы техникумов
[url=http://1wum.ru/forum/?PAGE_NAME=profile_view&UID=40046&MUL_MODE=/]1wum.ru/forum/?PAGE_NAME=profile_view&UID=40046&MUL_MODE=[/url]
[url=http://l4dzone.com/viewtopic.php?t=242266/]l4dzone.com/viewtopic.php?t=242266[/url]
[url=http://1001viktorina.ru/forum/viewtopic.php?f=19&t=1373&sid=5965b1b27545f64e0cf7adb880f64b6d/]1001viktorina.ru/forum/viewtopic.php?f=19&t=1373&sid=5965b1b27545f64e0cf7adb880f64b6d[/url]
[url=http://pyha.ru/forum/topic/13579.1#msg216529/]pyha.ru/forum/topic/13579.1#msg216529[/url]
[url=http://bohhchaos.listbb.ru/viewtopic.php?f=9&t=8516/]bohhchaos.listbb.ru/viewtopic.php?f=9&t=8516[/url]
Amazing tons of superb information!
[b]Купить диплом о высшем образовании.[/b]
[url=http://artrp.5nx.ru/viewtopic.php?f=3&t=9452/]artrp.5nx.ru/viewtopic.php?f=3&t=9452[/url]
[url=http://kingasteroid.com/blogs/275/ упить-?иплом-Ѕыстро-и-Ћегально/]kingasteroid.com/blogs/275/ упить-?иплом-Ѕыстро-и-Ћегально[/url]
[url=http://maanation.com/create-blog//]maanation.com/create-blog/[/url]
[url=http://aboutallfinance.ru/kupit-diplom-s-garantiey-podlinnosti/]aboutallfinance.ru/kupit-diplom-s-garantiey-podlinnosti[/url]
[url=http://bestcoolfun.ru/vyisshee-obrazovanie-dlya-vas-legalno-i-byistro/]bestcoolfun.ru/vyisshee-obrazovanie-dlya-vas-legalno-i-byistro[/url]
Aviator Game. Notable names in the industry have contributed their expertise to ensure the game is both engaging
ivermectin price
Зарегистрированные участники выбирают покер, баккару, блэкджек, покердом слоты рулетку.
Here is my homepage … https://www.dnavida.com.br/pokerdom-polnotsennyy-obzor-i-faq-dlya-kazino-v-kazakhstane/
[u][b] Привет![/b][/u]
Мы готовы предложить дипломы.
[url=http://интайл.рф/communication/forum/messages/forum3/message10541/5205-kupit-nastoyashchiy-diplom-za-24-chasa?result=new#message10541/]интайл.рф/communication/forum/messages/forum3/message10541/5205-kupit-nastoyashchiy-diplom-za-24-chasa?result=new#message10541[/url]
[url=http://flerus-shop.hcp.dilhost.ru/club/user/4/forum/message/870/866/#message866/]flerus-shop.hcp.dilhost.ru/club/user/4/forum/message/870/866/#message866[/url]
[url=http://justvoip.listbb.ru/posting.php?mode=post&f=2&sid=f2f61d71d404faa0a65fd56701d981b7/]justvoip.listbb.ru/posting.php?mode=post&f=2&sid=f2f61d71d404faa0a65fd56701d981b7[/url]
[url=http://nalubyutemy.forum2x2.ru/login/]nalubyutemy.forum2x2.ru/login[/url]
[url=http://ilovehabbo.bbon.ru/viewtopic.php?id=1546#p28962/]ilovehabbo.bbon.ru/viewtopic.php?id=1546#p28962[/url]
ובילוי כזה ניתן למצוא בדירות הדיסקרטיות. דירות דיסקרטיות יש בכל הארץ. ובהן תוכל למצוא נערות סקסיות שיודעות להעניק את אותו וכאשר יש דירות דיסקרטיות בבאר שבע, תוכל לעשות זאת בקלי קלות. הדירות הדיסקרטיות הן הפתרון המתאים עבור כל הגברים. לפעמים זהו browse content
how to become real estate agent in new york [url=https://realestatelicensengdfdgh.com/states/north-carolina-real-estate-license/]realestatelicensengdfdgh.com/states/north-carolina-real-estate-license/[/url] steps for becoming a real estate agent realestatelicensengdfdgh.com/states/ohio-real-estate-license/ .
נערות אשר יודעות מה הגבר צריך, והן מעניקות לו את הכל במסירות מוחלטת. הבילוי עם הנערות משאיר אחריו תחושה של חופשה נעימה. זיכרון אפשר לדבר הרבה על הפינוקים והרגעים הנעימים בחברתן של הנערות הסקסיות שמארחות גברים. אבל מה שקורה בין הסדינים הוא לא עניין לדבר דירה דיסקרטית במרכז
Regards. Loads of knowledge!
услуги по продвижению сайта сео продвижение сайта казань
оптимизация и продвижение сайтов https://seo-optimizatsia.ru
That is very attention-grabbing, You are an excessively skilled blogger.
I’ve joined your feed and sit up for in the hunt for extra of your great post.
Also, I have shared your site in my social networks
Новинний ресурс https://actualnews.kyiv.ua про всі важливі події в Україні та світі.
Новини сьогодні https://gau.org.ua останні новини України та світу онлайн
Останні новини України https://gromrady.org.ua сьогодні онлайн – головні події світу
repairdesign24.com
[u][b] Привет, друзья![/b][/u]
Заказать документ о получении высшего образования
[url=http://kindleslove.com/read-blog/325/]kindleslove.com/read-blog/325[/url]
[url=http://xusyou.com/blogs/283/С-умом-заказываем-диплом-в-сети-интернет-авторский-обзор/]xusyou.com/blogs/283/С-умом-заказываем-диплом-в-сети-интернет-авторский-обзор[/url]
[url=http://bezmotora72.ru/club/user/13/blog/7704//]bezmotora72.ru/club/user/13/blog/7704/[/url]
[url=http://asbl-numerica.be/blogs/218/Выбираем-надежный-и-проверенный-интернет-магазин-с-дипломами/]asbl-numerica.be/blogs/218/Выбираем-надежный-и-проверенный-интернет-магазин-с-дипломами[/url]
[url=http://fishjines.mn.co/posts/61748365/]fishjines.mn.co/posts/61748365[/url]
chinaone.net
Оборудование актовых залов [url=https://oborudovanie-aktovogo-zala.ru/]oborudovanie-aktovogo-zala.ru[/url] .
видеостены [url=https://www.videosteny-dlja-sozdanija-jekranov.ru]https://www.videosteny-dlja-sozdanija-jekranov.ru[/url] .
not, you lose your bet.
ivermectin price
оборудование для актового зала [url=http://oborudovanija-dlja-aktovyh-zalov.ru/]оборудование для актового зала[/url] .
[u][b] Добрый день![/b][/u]
[b]Быстрая покупка диплома старого образца: возможные риски[/b]
[url=http://autogroupe.ru/poluchite-diplom-bez-lishnih-usiliy/]autogroupe.ru/poluchite-diplom-bez-lishnih-usiliy[/url]
[u][b] Привет![/b][/u]
[b]Купить документ[/b] о получении высшего образования можно в нашем сервисе.
[url=http://diploms-x.com/kupit-diplom-krasnodar /]diploms-x.com/kupit-diplom-krasnodar [/url]
[u][b] Здравствуйте![/b][/u]
[b]Приобрести диплом о высшем образовании.[/b]
[url=http://sonnick84.blogsidea.com/34430613/%D0%9A%D0%BB%D1%8E%D1%87%D0%B5%D0%B2%D1%8B%D0%B5-%D0%B7%D0%B0%D1%82%D1%80%D0%B0%D1%82%D1%8B-%D1%81%D0%BE%D0%B2%D1%80%D0%B5%D0%BC%D0%B5%D0%BD%D0%BD%D0%BE%D0%B3%D0%BE-%D0%BF%D1%80%D0%BE%D0%B8%D0%B7%D0%B2%D0%BE%D0%B4%D0%B8%D1%82%D0%B5%D0%BB%D1%8F-%D0%B4%D0%B8%D0%BF%D0%BB%D0%BE%D0%BC%D0%BE%D0%B2-%D0%BE%D0%B1%D0%B7%D0%BE%D1%80/]sonnick84.blogsidea.com/34430613/%D0%9A%D0%BB%D1%8E%D1%87%D0%B5%D0%B2%D1%8B%D0%B5-%D0%B7%D0%B0%D1%82%D1%80%D0%B0%D1%82%D1%8B-%D1%81%D0%BE%D0%B2%D1%80%D0%B5%D0%BC%D0%B5%D0%BD%D0%BD%D0%BE%D0%B3%D0%BE-%D0%BF%D1%80%D0%BE%D0%B8%D0%B7%D0%B2%D0%BE%D0%B4%D0%B8%D1%82%D0%B5%D0%BB%D1%8F-%D0%B4%D0%B8%D0%BF%D0%BB%D0%BE%D0%BC%D0%BE%D0%B2-%D0%BE%D0%B1%D0%B7%D0%BE%D1%80[/url]
והן יעניקו לך בילוי ללא דאגות. השירות זמין 24 שעות ביממה ו – 7 ימים בשבוע. תמיד יש לך על מי לסמוך. תמיד ניתן להזמין מישהי עד הבית, או בבית המלון, והכל ב 100% דיסקרטיות. כך שאתה יכול להרגיש בטוח בעת הבילוי עם נערות ליווי בחיפה. אם אתה לבד בדירתך שירותי ליווי באילת
[u][b] Добрый день![/b][/u]
Купить документ института.
[url=http://vaca-ps.org/blogs/174400/Экспресс-оформление-дипломов/]vaca-ps.org/blogs/174400/Экспресс-оформление-дипломов[/url]
[url=http://productinn.mn.co/posts/62245206/]productinn.mn.co/posts/62245206[/url]
[url=http://weekofsport.ru/kupit-diplom-zalog-vashego-uspeha/]weekofsport.ru/kupit-diplom-zalog-vashego-uspeha[/url]
[url=http://wayworld.listbb.ru/viewtopic.php?f=2&t=24741/]wayworld.listbb.ru/viewtopic.php?f=2&t=24741[/url]
[url=http://saumalkol.com/forum/разное-2/3592-легальный-диплом-без-лишних-хлопот-узнайте-как.html/]saumalkol.com/forum/разное-2/3592-легальный-диплом-без-лишних-хлопот-узнайте-как.html[/url]
[u][b] Добрый день![/b][/u]
[b]Заказать документ[/b] университета вы имеете возможность в нашем сервисе.
[url=http://diplomyx24.ru/kupit-diplom-magistra/]diplomyx24.ru/kupit-diplom-magistra[/url]
[b]Успешной учебы![/b]
Популярные репортажи https://infotolium.com в больших фотографиях, новости, события в мире
Новини України https://kiev-online.com.ua останні події в Україні та світі сьогодні, новини України за минулий день онлайн
Україна свіжі новини https://kiev-pravda.kiev.ua останні події на сьогодні
Свіжі новини України https://lenta.kyiv.ua останні новини з-за кордону, новини політики, економіки, спорту, культури.
искусство брендинга
Лихвин Сергей
[u][b] Здравствуйте![/b][/u]
Купить документ института
[url=http://ast-diplomy.com/otzyvy]ast-diplomy.com/otzyvy[/url]
[b]Здравствуйте![/b]
Приобретение диплома ПТУ с сокращенной программой обучения в Москве
[url=http://landik-diploms-srednee.ru/diplom-bakalavra В ]landik-diploms-srednee.ru/diplom-bakalavra В [/url]
Interactive Interface: Players can interact with the game in real-time, making decisions that impact their
buy ivermectin
Для тех, кто ищет возможность выиграть реальные деньги, важен выбор надежного казино. Telegram канал [url=https://t.me/s/topcasino_rus]топ-5 казино с бонусами и лицензией 2024[/url] представляет лучшие платформы для игры на деньги. Эти казино предлагают широкий ассортимент игр, быстрые выплаты и отличные бонусы для новых и постоянных игроков.
Онлайн казино с хорошей репутацией обеспечивают честную игру и защиту данных. Подписывайтесь на канал, чтобы быть в курсе самых выгодных предложений и играть в проверенных казино на деньги.
Україна останні новини https://lentanews.kyiv.ua головні новини та останні події
can a felon become a realtor [url=https://realestatelicensengdfdgh.com/states/illinois-real-estate-license/]realestatelicensengdfdgh.com/states/illinois-real-estate-license/[/url] real estate license realestatelicensengdfdgh.com/states/new-jersey-real-estate-license/ .
Интерьерная печать на самоклеющейся пленке – это процесс создания качественных полноцветных изображений на самоклеющейся пленке, которая может быть наклеена на различные поверхности [url=https://ivolgaphoto.ru/]печать интерьерная на пластике[/url]
In today’s world, caring for health and proper nutrition is becoming a priority for many people dominicandesign.net
לשכוח מכל הדאגות עם נערות ליווי בתל אביב אז מה לעשות באותם הרגעים בהם אתה מרגיש כי החיים לוחצים עלייך יותר מידי? מה לעשות כאשר וחרמנים שעדיין גרים עם ההורים, ואין להם פרטיות. דירות דיסקרטיות בבאר שבע פותרות לכולם את הבעיות. זהו גם הבילוי שכל גבר משתוקק linked here
When hiring as a courier, it is additionally necessary to determine the driver’s license holidaynewsletters.com
игровое заведение предлагает сочный бонус до 2300 рублей и 225 бесплатных https://pinupcasino-game.win/support вращений.
[u][b] Привет, друзья![/b][/u]
Мы можем предложить документы ВУЗов
[url=http://avtolux48.ru/people/user/374/blog/7997//]avtolux48.ru/people/user/374/blog/7997/[/url]
[url=http://network-6063768.mn.co/posts/62661786/]network-6063768.mn.co/posts/62661786[/url]
[url=http://worldgonews.ru/oformlenie-diplomov-po-dostupnyim-tsenam/]worldgonews.ru/oformlenie-diplomov-po-dostupnyim-tsenam[/url]
[url=http://medvozerniy.flybb.ru/viewtopic.php?f=14&t=13448/]medvozerniy.flybb.ru/viewtopic.php?f=14&t=13448[/url]
[url=http://grot.getbb.ru/viewtopic.php?f=6&t=1080/]grot.getbb.ru/viewtopic.php?f=6&t=1080[/url]
[u][b] Привет![/b][/u]
Приобрести документ института можно в нашей компании в Москве. Мы оказываем услуги по производству и продаже документов об окончании любых ВУЗов Российской Федерации. Вы получите необходимый диплом по любым специальностям, любого года выпуска, в том числе документы образца СССР. Гарантируем, что при проверке документов работодателями, подозрений не появится.
[url=http://ремонт-оптом.рф/club/user/7/blog/2123//]ремонт-оптом.рф/club/user/7/blog/2123/[/url]
[url=http://rodina.listbb.ru/viewtopic.php?f=3&t=616/]rodina.listbb.ru/viewtopic.php?f=3&t=616[/url]
[url=http://newsbig.wpsuo.com/stoimost-diploma-obzor-ekspertov/]newsbig.wpsuo.com/stoimost-diploma-obzor-ekspertov[/url]
[url=http://victorians123.com/blogs/203/На-что-обратить-свое-внимание-при-заказе-диплома-в-сети/]victorians123.com/blogs/203/На-что-обратить-свое-внимание-при-заказе-диплома-в-сети[/url]
[url=http://komfort.rusff.me/viewtopic.php?id=13894#p40941/]komfort.rusff.me/viewtopic.php?id=13894#p40941[/url]
בחיפה – האטרקציה של העיר יש הרבה דברים טובים בחיפה, אבל ישנה אטרקציה אחת שהיא מיועדת רק לגברים. אנו מדברים על נערות ליווי בסופה פורקן משחרר, פשוט הזמן נערות ליווי. הגברים של חיפה מזמינים אותן לדירתם או אל בית המלון, ושם נהנים יחדיו מבילוי אינטימי עיסוי אירוטי לגבר
На сайте https://gk-crocus.ru/ подберите светлую, обустроенную квартиру в новом ЖК «CROCUS». Здесь будет все, что нужно для комфортного проживания с семьей. В ЖК развитая инфраструктура, а потому здесь планируется строительство кофеен, магазинов, булочных, а парковочных мест хватит на всех жителей. Обустроенный и удобный двор, где можно отдохнуть и погулять на площадке с ребенком. Предусмотрена круглосуточная охрана. Сдача объектов планируется в 2026 году. Всего 8 корпусов, 2100 квартир. Спешите, чтобы одна из них стала вашей!
Risk Management: Setting limits on how much to bet and when to cash out.
ivermectin purchase
[url=https://job-expro.com]+работа +в +свободном +вакансии +для +женщин[/url] – +вакансии +с +ежедневной +оплатой +свободный, +вакансии +со +свободным +графиком
Головні новини https://mediashare.com.ua про регіон України. Будьте в курсі останніх новин
Новини та аналітика https://newsportal.kyiv.ua ситуація в Україні.
Новини, останні події https://prp.org.ua в Україні та світі, новини політики, бізнесу та економіки, законодавства
Головні новини https://pto-kyiv.com.ua України та світу
Новини України https://sensus.org.ua та світу сьогодні. Головні та останні новини дня
What’s up!
What a good article!
May I scrape it and share this with my blog members?
My group is about Korean 놀자 사이트
you are interested, feel free to come to my site and check it out.
Thank you and Keep up the good work!
Pretty nice post. I just stumbled upon your weblog and wished to say that I’ve
truly enjoyed surfing around your blog posts. In any case I’ll be subscribing to your feed and I hope you write again very soon!
my page: 온라인 약국 시알리스 구매
[u][b] Привет![/b][/u]
[b]Приобрести диплом о высшем образовании.[/b]
[url=http://alex-neil.ru/index.php/cb-profile/pluginclass/cbblogs?action=blogs&func=show&id=233/]alex-neil.ru/index.php/cb-profile/pluginclass/cbblogs?action=blogs&func=show&id=233[/url]
יכולים להיות חיילים, סטודנטים, גרושים או בקיצור כל גבר ממוצע שרוצה לבלות. זהו פתרון המשלב גם נערה יפה שמפנקת אותך, וגם סביבת הערב, אתה פשוט יכול להזמין נערה כלבבך והיא תשמח את מצב רוחך. ולא רק בערב, נערות ליווי בחיפה מעניקות שירות 24 שעות ביממה ובכל נערת ליווי רוסיה לחוויה חד פעמית
her latest blog [url=https://smmpanel.one]smmpanellist[/url]
I do agree with all of the ideas you have presented for your post.
They’re very convincing and will definitely work. Still, the posts are very brief for novices.
May you please lengthen them a little from subsequent time?
Thanks for the post.
Адекватная цена курсовой http://kursach-pod-klyuch.ru/ работы по заявке. повышенный коэффициент уникальности.
развлечения в сочи летом для всей семьи
сочи отдых экскурсии и развлечения
[u][b] Привет, друзья![/b][/u]
[b]Приобрести диплом о высшем образовании.[/b]
[url=http://pro-eltern.de/read-blog/151/]pro-eltern.de/read-blog/151[/url]
[url=http://lab.panda-studio.pro/index.php?/gallery/image/116-какие-магазины-с-дипломами-имеются-на-текущий-момент//]lab.panda-studio.pro/index.php?/gallery/image/116-какие-магазины-с-дипломами-имеются-на-текущий-момент/[/url]
[url=http://ozelim.org/sosyal/blogs/393/Что-именно-потребуется-для-создания-качественного-диплома-института/]ozelim.org/sosyal/blogs/393/Что-именно-потребуется-для-создания-качественного-диплома-института[/url]
[url=http://sonnick84.topbloghub.com/34428015/Дипломы-справки-и-сертификаты-низкие-цены/]sonnick84.topbloghub.com/34428015/Дипломы-справки-и-сертификаты-низкие-цены[/url]
[url=http://medbereg.ru/club/user/15/blog/4130//]medbereg.ru/club/user/15/blog/4130/[/url]
[u][b] Привет![/b][/u]
Купить документ университета.
[url=http://inteam.maxbb.ru/viewtopic.php?f=1&t=1547/]inteam.maxbb.ru/viewtopic.php?f=1&t=1547[/url]
[url=http://profit.hutt.live/viewtopic.php?id=1985#p4285/]profit.hutt.live/viewtopic.php?id=1985#p4285[/url]
[url=http://riftynet.com/blogs/26120/Оформление-дипломов-с-гарантией-качества/]riftynet.com/blogs/26120/Оформление-дипломов-с-гарантией-качества[/url]
[url=http://mybuildhouse.ru/diplom-na-zakaz-kachestvo-i-nadezhnost//]mybuildhouse.ru/diplom-na-zakaz-kachestvo-i-nadezhnost/[/url]
[url=http://shoptema.ru/forum/topic/32715//]shoptema.ru/forum/topic/32715/[/url]
Hi there, I wish for to subscribe for this blog to obtain most up-to-date
updates, therefore where can i do it please help.
getx играть
[u][b] Добрый день![/b][/u]
[b]Приобрести документ[/b] института вы сможете у нас в столице.
[url=http://asxdiplomik.com/kupit-diplom-specialista /]asxdiplomik.com/kupit-diplom-specialista [/url]
парки развлечений для детей до 3 лет
בלילה סוער או בכל רגע שבא לך לעצור את הבלאגן של בחיים. הנערות יפנקו אותך ויגרמו לך להשקיט את כל הדאגות. במקום זאת תוכל להיות זהו שירות המספק את הצרכים של הגוף הגברי ואת המהות של להיות גבר. בילוי עם נערות ליווי בתל אביב מאפשר לגבר להשתחרר ולהתפרק. זוהי דירות דיסקרטיות בבאר שבע
dynamic features, and social elements, it offers an engaging experience for players. The game is supported by
ivermectin online
[u][b] Привет, друзья![/b][/u]
[b]Мы можем предложить дипломы[/b] любой профессии по доступным тарифам.
[url=http://shabab.galaxy.ps/купить-диплом-новосибирск//]shabab.galaxy.ps/купить-диплом-новосибирск/[/url]
развлечения для детей и взрослых в сочи
how to become real estate agent in ky [url=https://realestatelicensengdfdgh.com/states/oregon-island-real-estate-license/]realestatelicensengdfdgh.com/states/oregon-island-real-estate-license/[/url] how to become a realty agent realestatelicensengdfdgh.com/states/nevada-island-real-estate-license/ .
[u][b] Добрый день![/b][/u]
[b]Мы можем предложить дипломы[/b] любой профессии по приятным ценам.
[url=http://lada-clubs.ru/gallery/image/732-pochemu-segodnya-kuda-prosche-i-deshevle-priobresti-diplom-vuza//]lada-clubs.ru/gallery/image/732-pochemu-segodnya-kuda-prosche-i-deshevle-priobresti-diplom-vuza/[/url]
[url=http://newyorkredbullsfansclub.com/read-blog/1566/]newyorkredbullsfansclub.com/read-blog/1566[/url]
[url=http://sonnick84.bloggosite.com/34700636/Находим-проверенный-интернет-магазин-для-приобретения-диплома/]sonnick84.bloggosite.com/34700636/Находим-проверенный-интернет-магазин-для-приобретения-диплома[/url]
[url=http://shtfsocial.com/blogs/183153/Легко-приобретаем-аттестат-в-онлайн-магазине-Russian-Diplom/]shtfsocial.com/blogs/183153/Легко-приобретаем-аттестат-в-онлайн-магазине-Russian-Diplom[/url]
[url=http://p91648f6.beget.tech/2024/07/08/legkiy-vybor-internet-magazina-prodayuschego-diplomy-i-attestaty.html/]p91648f6.beget.tech/2024/07/08/legkiy-vybor-internet-magazina-prodayuschego-diplomy-i-attestaty.html[/url]
Корисні та цікаві статті https://sevsovet.com.ua про здоров’я, дозвілля, кар’єру.
Головні новини https://status.net.ua сьогодні, найсвіжіші та останні новини України онлайн
Останні новини https://thingshistory.com зовнішньої та внутрішньої політики в країні та світі.
Останні новини світу https://uamc.com.ua про Україну від порталу новин Ukraine Today
[u][b] Привет, друзья![/b][/u]
[b]Купить документ[/b] о получении высшего образования можно у нас в Москве.
[url=http://ast-diplomas24.ru/kupit-diplom-omsk/]ast-diplomas24.ru/kupit-diplom-omsk[/url]
[b]Успешной учебы![/b]
Онлайн-платформа для азартных игр представляет собой разнообразный мир развлечений. Здесь игроки могут наслаждаться множеством опций, которые сделают времяпрепровождение увлекательным и захватывающим [url=http://www.phxwomenshealth.com/index.php?option=com_k2&view=itemlist&task=user&id=1081789]http://www.phxwomenshealth.com/index.php?option=com_k2&view=itemlist&task=user&id=1081789[/url]
На [url=https://1win-64.ru/]1win[/url] вас ждут лучшие игры, выгодные ставки и круглосуточная поддержка клиентов.
read this article [url=https://uniteto.org/]uniteto org[/url]
Кавказская мазь https://kavkazmaz.ru для суставов купить в аптеке. Официальный сайт производителя Кавказской мази от боли в суставах.
такие промо сувениры имеет смысл приобрести оптом для всех, https://lifeposi.ru/termokruzhki-s-logotipom-polnyj-gid-dlya-vybora-i-zakaza-42931/типа чтобы подтвердить высокий статус.
Hi there, constantly i used to check weblog posts here early in the break of day, for the reason that i like to gain knowledge of more and more.
бонус драгон мани казино
[u][b] Привет, друзья![/b][/u]
Диплом о высшем образовании
[url=http://flashtest.80lvl.ru/viewtopic.php?f=3&t=1935/]flashtest.80lvl.ru/viewtopic.php?f=3&t=1935[/url]
[url=http://sz.80lvl.ru/viewtopic.php?f=9&t=1946/]sz.80lvl.ru/viewtopic.php?f=9&t=1946[/url]
[url=http://feelosum.com/blogs/1849/Легальное-оформление-дипломов/]feelosum.com/blogs/1849/Легальное-оформление-дипломов[/url]
[url=http://menaharia.com/create-blog//]menaharia.com/create-blog/[/url]
[url=http://gamesmaker.ru/forum/common/offtopics/#replyform/]gamesmaker.ru/forum/common/offtopics/#replyform[/url]
[u][b] Добрый день![/b][/u]
Получить диплом ВУЗа
[url=http://sky-metaverse.com/read-blog/11387/]sky-metaverse.com/read-blog/11387[/url]
[url=http://domainrama.com/read-blog/1224/]domainrama.com/read-blog/1224[/url]
[url=http://veneraroleplay.listbb.ru/viewtopic.php?f=4&t=332/]veneraroleplay.listbb.ru/viewtopic.php?f=4&t=332[/url]
[url=http://mos.flybb.ru/viewtopic.php?f=2&t=2552/]mos.flybb.ru/viewtopic.php?f=2&t=2552[/url]
[url=http://kalininabad.flyboard.ru/viewtopic.php?f=28&t=2850/]kalininabad.flyboard.ru/viewtopic.php?f=28&t=2850[/url]
[u][b] Добрый день![/b][/u]
Диплом техникума купить официально с упрощенным обучением в Москве
[url=http://matthiasjakobbecker.com/купить-диплом-проверенные-способы//]matthiasjakobbecker.com/купить-диплом-проверенные-способы/[/url]
Окажем помощь!.
Скачать музыку https://vksaver.pro/ на сайте. Все новое, свежее, добавляемое каждый час. Хиты, ТОПы прослушивания, альбомы целиком, новинки. В mp3 на сайте, без регистрации можно скачать все что вы ищите, в одном месте. Самый большой выбор музыки в интернете.
Strategies and Tips
ivermectin buy online
На сайте http://oknaksa.by вы сможете проконсультироваться по таким вопросам, как: окна ПВХ, балконы, патио. На все конструкции даются гарантии до 20 лет. Все клиенты смогут воспользоваться бесплатным обслуживанием. А работа происходит по ГОСТу, СНИПу. Для того чтобы получить необходимый результат, на объект выезжают замерщики для того, чтобы определить размеры с точностью. Установка происходит в день, когда привезут окна. Перед вами огромное количество готовых проектов, которыми вы сможете воспользоваться прямо сейчас.
Всё, что нужно знать о покупке аттестата о среднем образовании без рисков
[url=http://girlscools.ru/ofitsialnyie-diplomyi-s-garantiey-podlinnosti/]girlscools.ru/ofitsialnyie-diplomyi-s-garantiey-podlinnosti[/url]
[url=http://umorforme.ru/diplom-pod-klyuch-kachestvenno-i-bezopasno/]umorforme.ru/diplom-pod-klyuch-kachestvenno-i-bezopasno[/url]
[url=http://famenest.com/read-blog/8977/]famenest.com/read-blog/8977[/url]
[url=http://amtest.mybb.ru/viewtopic.php?id=423#p1372/]amtest.mybb.ru/viewtopic.php?id=423#p1372[/url]
[url=http://hramada.listbb.ru/viewtopic.php?f=7&t=609/]hramada.listbb.ru/viewtopic.php?f=7&t=609[/url]
Используйте [url=https://maxikarta.ru/zerkalo-1win-rabochee-na-segodnya/]1вин рабочее зеркало[/url] для бесперебойной игры.
Пройдите [url=https://maxikarta.ru/kak-proiti-registraciyu-v-bykmekerskoi-kontore-1win/]1win регистрация[/url] и получите приветственные бонусы.
https://derbayerischelowe.info/
Several key developers and companies have played a significant role in the development and success of the
ivermectin purchase
[u][b] Здравствуйте![/b][/u]
Купить документ ВУЗа
[url=http://edpt200.mn.co/posts/61724610/]edpt200.mn.co/posts/61724610[/url]
[url=http://azw2p8stp.educationalimpactblog.com/50594599/Как-возможно-быстро-купить-аттестат-в-интернет-магазине/]azw2p8stp.educationalimpactblog.com/50594599/Как-возможно-быстро-купить-аттестат-в-интернет-магазине[/url]
[url=http://perfectohub.com/read-blog/7176/]perfectohub.com/read-blog/7176[/url]
[url=http://t98223u0.beget.tech/2024/07/07/faq-i-teh-podderzhka-pokupaem-diplom-v-internete.html/]t98223u0.beget.tech/2024/07/07/faq-i-teh-podderzhka-pokupaem-diplom-v-internete.html[/url]
[url=http://thereaderview.com/wall/blogs/275/Детальное-описание-покупки-документов-в-интернет-магазине/]thereaderview.com/wall/blogs/275/Детальное-описание-покупки-документов-в-интернет-магазине[/url]
[u][b] Добрый день![/b][/u]
Мы можем предложить документы техникумов
[url=http://exoltech.ps/blogs/post/59237/]exoltech.ps/blogs/post/59237[/url]
[url=http://twoplustwoequal.com/read-blog/38647/]twoplustwoequal.com/read-blog/38647[/url]
[url=http://poboltaem.foroactivo.com/post/]poboltaem.foroactivo.com/post[/url]
[url=http://hobby-svarka.ru/viewtopic.php?f=11&t=6305/]hobby-svarka.ru/viewtopic.php?f=11&t=6305[/url]
[url=http://odinzovo.rusff.me/viewtopic.php?id=4921#p8315/]odinzovo.rusff.me/viewtopic.php?id=4921#p8315[/url]
[u][b] Здравствуйте![/b][/u]
[b]Полезные советы по безопасной покупке диплома о высшем образовании[/b]
[url=http://foro.rune-nifelheim.com/general-ragnarok-m/diplomy-ot-veduschih-vuzov-strany//]foro.rune-nifelheim.com/general-ragnarok-m/diplomy-ot-veduschih-vuzov-strany/[/url]
Чудо Гриб препарат от паразитов https://chydogrib.ru и ВПЧ. Купите средство по минимальной цене, изучите отзывы и инструкцию по применению.
контекстная реклама под ключ https://razrabotka-sajtov-pod-klyuch.ru/
Brief of the jackpot, you can win up to $1 million for matching all 5 white balls (except in California).
my web-site; https://999reunite.co.uk/forum/profile/Shawn00B08
[u][b] Здравствуйте![/b][/u]
[b]Заказать документ[/b] о получении высшего образования вы сможете в нашей компании в столице.
[url=http://asxdiplomik.com/kupit-diplom-rostov-na-donu/]asxdiplomik.com/kupit-diplom-rostov-na-donu[/url]
[b]Успехов в учебе![/b]
https://derbayerischelowe.info/
Ищете надежные казино с лицензией? Telegram канал [url=https://t.me/s/topcasino_rus]рейтинг лучших мобильных казино[/url] представляет топ-5 лучших лицензированных казино. Эти платформы гарантируют безопасность, честную игру и быстрые выплаты. Более 10 казино предлагают 100% бонус к депозиту и мгновенный вывод на карты банков РФ.
Не упустите шанс выиграть реальные деньги в проверенных казино. Подписывайтесь на канал, чтобы быть в курсе самых выгодных предложений и наслаждаться безопасной игрой с реальными выигрышами!
Інтер Маямі представи офіціално перед своє фенове двете Сі нові зірки-Ліонел меси і Серхіо https://mediapoint.com.ua/ Бускетс.
[url=https://xn—–8kcaaomxdpelhyeeqjefp6c.xn--p1ai/%D1%83%D1%81%D0%BB%D1%83%D0%B3%D0%B8/%D1%8D%D0%BA%D1%81%D0%BA%D1%83%D1%80%D1%81%D0%B8%D0%B8_%D0%B8%D0%B7_%D0%B0%D0%BD%D0%B0%D0%BF%D1%8B/%D0%BA%D0%B8%D0%BF%D0%B0%D1%80%D0%B8%D1%81%D0%BE%D0%B2%D0%BE_%D0%BE%D0%B7%D0%B5%D1%80%D0%BE]Экскурсия Кипарисовое озеро[/url] – Экскурсия Кипарисовое озеро, Экскурсия Грязевой вулкан “Гефест” и Азовское море
[u][b] Добрый день![/b][/u]
Заказать документ университета.
[url=http://mylot.su/blogs/2323/]mylot.su/blogs/2323[/url]
[url=http://rkiyosaki.ru/discussion/9746/kupit-diplom-bystro-i-nadezhno//]rkiyosaki.ru/discussion/9746/kupit-diplom-bystro-i-nadezhno/[/url]
[url=http://easyinsurancehub.co.uk/forum/thread-57034.html/]easyinsurancehub.co.uk/forum/thread-57034.html[/url]
[url=http://talkrealty.ru/diplomyi-s-dostavkoy/]talkrealty.ru/diplomyi-s-dostavkoy[/url]
[url=http://aboutalltour.ru/nadezhnyiy-sposob-poluchit-diplom-za-korotkiy-srok//]aboutalltour.ru/nadezhnyiy-sposob-poluchit-diplom-za-korotkiy-srok/[/url]
[u][b] Добрый день![/b][/u]
[b]Мы изготавливаем дипломы[/b] любой профессии по приятным тарифам.
[url=http://phongthuygiaphat.com/купить-заполненный-диплом//]phongthuygiaphat.com/купить-заполненный-диплом/[/url]
and fair. These collaborations have helped elevate the Aviator Game to its current status as a beloved online
where to buy ivermectin
[u][b] Добрый день![/b][/u]
Приобрести диплом о высшем образовании:
[url=http://biyografiforum.10tl.net/newthread.php?fid=124/]biyografiforum.10tl.net/newthread.php?fid=124[/url]
[url=http://rem.4nmv.ru/forum/profile.php?action=show&member=9613/]rem.4nmv.ru/forum/profile.php?action=show&member=9613[/url]
[url=http://erotikfoto.ru/index.php?subaction=userinfo&user=yjuserune/]erotikfoto.ru/index.php?subaction=userinfo&user=yjuserune[/url]
[url=http://ashinova.ru/blog/ulegiseza.html/]ashinova.ru/blog/ulegiseza.html[/url]
[url=http://wp1065308.server-he.de/doku.php?id=diplomandoci/]wp1065308.server-he.de/doku.php?id=diplomandoci[/url]
На сайте https://gruz63.ru/gruzoperevozki/ посмотрите телефон компании, которая на профессиональном уровне оказывает услуги, связанные с грузоперевозками. Заказать работы смогут как частные компании, так и физические лица, крупные предприятия. Грузоперевозками пользуются во время офисного, дачного переезда, для того, чтобы доставить строительные материалы из магазина. В этой компании работают исключительно опытные, квалифицированные и компетентные грузчики, которые быстро и аккуратно справятся с работой. А у вас даже не останутся замечания.
Greetings to the romantics and casino lovers!!
At Glory Casino, I found everything I was looking for: high odds, a variety of games, and generous bonuses. The working mirror is always at hand, and withdrawals are without delays. I recommend everyone to try Glory Casino!
I’ve been playing at Glory Casino for several months and have never regretted it. Registration is simple, the bonuses are generous, and withdrawals are fast. The working mirror is always available. I recommend Glory Casino to all gambling enthusiasts!
Catch the site where everything is in the best shape! – [url=https://prpelizz.blogspot.com/2024/06/glory-casino-your-destination-for-fish.html]Glory Casino[/url]
Glory Casino download mirror for today
lucky get Glory Casino
Glory Casino promo code during registration
Glory Casino casino download on android for free
Glory Casino mirror for today
Good profits!